ZusammensetzungWirkstoffe
Ethinylestradiolum, Desogestrelum.
Hilfsstoffe
Tablettenkern:
All-racα-Tocopherolum, Magnesii stearas, Silica colloidalis anhydrica, Acidum stearicum, Povidonum K30, Solani amylum, Lactosum monohydricum (68 mg)
Tablettenüberzug:
Propylenglycolum, Macrogolum 6000, Hypromellosum (E 464)
Indikationen/AnwendungsmöglichkeitenHormonale Kontrazeption.
Bei der Entscheidung Desoren 30 zu verschreiben, sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frau, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von Desoren 30 mit jenem anderer kombinierter hormonaler Kontrazeptiva (CHC) verglichen werden (vgl. «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Dosierung/AnwendungCHC wie Desoren 30 sollten nur von einem Arzt, bzw. einer Ärztin, mit entsprechender Erfahrung verordnet werden, welche in der Lage sind, eine umfassende Aufklärung der Patientin über die Vor- und Nachteile sämtlicher verfügbarer Kontrazeptionsmethoden sowie neben einer allgemeinen auch eine gynäkologische Untersuchung durchzuführen.
Die Verordnung eines CHC sollte grundsätzlich unter Beachtung der jeweils aktuellen Richtlinien der Schweizer Gesellschaft für Gynäkologie und Geburtshilfe erfolgen.
Die Filmtabletten sind in der auf der Packung angegebenen Reihenfolge jeweils möglichst zur gleichen Tageszeit vorzugsweise mit Flüssigkeit einzunehmen. Es wird an 21 aufeinanderfolgenden Tagen täglich eine Tablette eingenommen. Darauf folgt jeweils eine 7-tägige Einnahmepause, bevor die nächste Packung angefangen wird. Während der Einnahmepause kommt es üblicherweise zu einer Entzugsblutung, die normalerweise 2–3 Tage nach der letzten Tabletten-Einnahme beginnt und noch andauern kann, wenn bereits die nächste Packung angefangen wird.
Beginn der Einnahme
Frauen, die im letzten Monat keine hormonalen Kontrazeptiva angewendet haben
Mit der Tabletten-Einnahme ist am 1. Tag des normalen Menstruationszyklus (also am 1. Tag der Regelblutung) zu beginnen. Ein Beginn ist auch vom 2.–5. Tag an möglich, wobei dann während der ersten 7 Tage der Tabletten-Einnahme im 1. Zyklus die zusätzliche Anwendung Barrieremethoden(mit Ausnahme der Methoden wie Knaus-Ogino oder Temperaturmessung) empfohlen wird.
Wechsel von einem kombinierten hormonalen Kontrazeptivum (kombiniertes orales Kontrazeptivum (COC), Vaginalring oder Transdermal-Pflaster)
Mit der Einnahme von Desoren 30 ist vorzugsweise am folgenden Tag nach Einnahme der letzten wirkstoffhaltigen Tablette des bisherigen COC, spätestens jedoch am Tag nach dem üblichen einnahmefreien Intervall bzw. der Plazebophase zu beginnen.
Falls ein Vaginalring oder Transdermal-Pflaster angewendet wurde, ist mit der Einnahme von Desoren 30 vorzugsweise am Tag der Entfernung, spätestens jedoch am Tag der nächsten fälligen Anwendung zu beginnen.
Wechsel von einem Gestagenmonopräparat (Minipille, Injektion, Implantat, gestagenabgebendes IUD)
Die Umstellung von der Minipille kann an jedem beliebigen Tag erfolgen, von einem Implantat bzw. IUD frühestens am Tag der Entfernung und von einem Injektionspräparat zum Zeitpunkt, an dem die nächste Injektion fällig wäre. In all diesen Fällen sind während der ersten 7 Tage der Tabletten-Einnahme zusätzlich barrierebildende Kontrazeptions-Methoden anzuwenden.
Nach einem Abort im 1. Trimenon
Mit der Einnahme von Desoren 30 kann sofort begonnen werden. Zusätzliche kontrazeptive Massnahmen sind dann nicht erforderlich.
Nach einem Abort im 2. Trimenon oder einer Geburt
Bei der Entscheidung, zu welchem Zeitpunkt nach einer Geburt bzw. nach einem Abort im 2. Trimenon (wieder) mit der Anwendung eines CHC wie Desoren 30 begonnen werden kann, ist zu berücksichtigen, dass postpartal das Risiko für venöse thromboembolische Ereignisse erhöht ist (während bis zu 12 Wochen; siehe «Warnhinweise und Vorsichtsmassnahmen»).
In jedem Fall sollte nach einer Geburt bzw. einem Abort im 2. Trimenon mit der Anwendung von Desoren 30 frühestens zwischen dem 21. und dem 28. Tag begonnen werden. Bei einem späteren Beginn wird an den ersten 7 Tagen der Anwendung die zusätzliche Anwendung barrierebildender Kontrazeptionsmethoden empfohlen. Hat in der Zwischenzeit bereits Geschlechtsverkehr stattgefunden, ist vor dem Beginn der Anwendung eine Schwangerschaft auszuschliessen oder die erste Monatsblutung abzuwarten.
Vorgehen bei vergessener Tabletteneinnahme
Wird innerhalb von 12 Stunden bemerkt, dass die Einnahme der Tablette zum üblichen Zeitpunkt vergessen wurde, soll die Tablette sofort eingenommen werden. Die folgenden Tabletten sind wieder zur gewohnten Tageszeit einzunehmen. Der kontrazeptive Schutz wird dann nicht beeinträchtigt.
Wird die Tabletten-Einnahme mehr als 12 Stunden über den üblichen Zeitpunkt hinaus vergessen, ist der Konzeptionsschutz möglicherweise reduziert. Für die versäumte Einnahme gelten die folgenden zwei Grundregeln:
1.Die Einnahme darf nicht länger als 7 Tage unterbrochen werden.
2.Eine regelmässige Einnahme über mindestens 7 Tage ist erforderlich, um wirkungsvoll die Hypothalamus-Hypophysen-Ovar-Achse zu unterdrücken.
Daraus ergibt sich in Abhängigkeit von der Einnahmewoche folgendes Vorgehen:
1. Einnahmewoche
Die vergessene Tablette soll sofort eingenommen werden, sobald die vergessene Einnahme bemerkt wird – auch dann, wenn dadurch an einem Tag 2 Tabletten einzunehmen sind. Die weiteren Tabletten sollen zur gewohnten Zeit eingenommen werden. Während der folgenden 7 Tage ist zusätzlich eine barrierebildende Kontrazeptions-Methode anzuwenden. Hat in den vorangegangen 7 Tagen Geschlechtsverkehr stattgefunden, muss die Möglichkeit einer Schwangerschaft berücksichtigt werden. Je mehr Tabletten vergessen wurden und je näher dies beim einnahmefreien Intervall liegt, desto grösser ist das Risiko einer Schwangerschaft.
2. Einnahmewoche
Die vergessene Tablette soll sofort eingenommen werden, sobald die vergessene Einnahme bemerkt wird – auch dann, wenn dadurch an einem Tag 2 Tabletten einzunehmen sind. Die weiteren Tabletten sollen zur gewohnten Zeit eingenommen werden. Vorausgesetzt, dass an den 7 vorangegangenen Tagen eine regelmässige Einnahme erfolgte, ist keine zusätzliche kontrazeptive Massnahme erforderlich. War dies nicht der Fall oder wurde mehr als 1 Tablette vergessen, sind während der nächsten 7 Tage zusätzlich barrierebildende Kontrazeptions-Methoden anzuwenden.
3. Einnahmewoche
Es besteht wegen des bevorstehenden einnahmefreien Intervalls ein erhöhtes Schwangerschaftsrisiko. Wird eine der beiden folgenden Einnahmemöglichkeiten angewendet, sind keine zusätzlichen kontrazeptiven Massnahmen erforderlich, sofern die Einnahme an den letzten 7 Tagen regelmässig erfolgte. Andernfalls sollte die erste der beiden Einnahmemöglichkeiten befolgt und während der nächsten 7 Tage zusätzlich eine barrierebildende Kontrazeptions-Methode angewendet werden.
a)Die vergessene Tablette soll sofort eingenommen werden, sobald die vergessene Einnahme bemerkt wird – auch dann, wenn dadurch an einem Tag 2 Tabletten einzunehmen sind. Die weiteren Tabletten sollen zur gewohnten Zeit eingenommen werden. Die Tabletten-Einnahme aus der nächsten Packung ist unmittelbar danach, d.h. ohne Einhaltung des einnahmefreien Intervalls, zu beginnen. Es ist unwahrscheinlich, dass vor Ende der 2. Packung eine Entzugsblutung auftritt, jedoch kann es gehäuft zu Schmier- bzw. Durchbruchblutungen kommen.
b)Die Einnahme von Tabletten aus der aktuellen Packung wird abgebrochen. Nach einem einnahmefreien Intervall von bis zu 7 Tagen (einschliesslich jener Tage, an denen die Einnahme vergessen wurde), soll die nächste Packung angefangen werden.
Sollte es im nächsten einnahmefreien Intervall zu keiner Entzugsblutung kommen, muss die Möglichkeit einer Schwangerschaft in Betracht gezogen werden.
Verhalten bei gastrointestinalen Störungen
Im Falle schwerer gastrointestinaler Störungen – unabhängig von deren Ursache (d.h. auch bei Arzneimittel-induzierter Diarrhoe etc.) - ist die Resorption möglicherweise unvollständig, und zusätzliche kontrazeptive Methoden sollten angewendet werden.
Bei Erbrechen innerhalb von 3–4 Stunden nach der Tabletten-Einnahme sind die Grundregeln der Rubrik «Vorgehen bei vergessener Tabletteneinnahme» zu beachten.
Damit das gewohnte Einnahmeschema beibehalten werden kann, muss die zusätzlich einzunehmende Tablette aus einer Reservepackung entnommen werden.
Verschieben der Menstruation
Hinausschieben der Menstruation (Verlängerung des Zyklus)
Die Einnahme ist ohne einnahmefreies Intervall aus der nächsten Packung fortzusetzen. Dabei kann die Menstruation so lange wie gewünscht (längstens bis zum Ende der zweiten Packung) hinausgezögert werden. Während dieser Zeit kann es zu Schmier- und Durchbruchblutungen kommen. Die regelmässige Einnahme von Desoren 30 wird dann nach der üblichen 7-tägigen Pause fortgesetzt.
Vorverlegen der Menstruation
Der Beginn der Menstruation kann auf einen anderen Wochentag verschoben werden, indem das einnahmefreie Intervall beliebig verkürzt wird. Je kürzer das Intervall ist, desto unwahrscheinlicher kommt es zu einer Entzugsblutung und desto häufiger treten während der Einnahme der nächsten Packung Schmier- und Durchbruchblutungen auf (ähnlich wie beim Hinausschieben der Menstruation).
Verhalten bei Blutungsunregelmässigkeiten
Bei allen CHC kann es, insbesondere in den ersten Monaten der Einnahme, zu unregelmässigen Blutungen (Schmier- bzw. Durchbruchblutungen) kommen. Daher ist eine diagnostische Abklärung unregelmässiger Blutungen erst nach einer Anpassungsphase von ca. 3 Zyklen sinnvoll.
Persistieren die Blutungsunregelmässigkeiten oder treten sie erstmals nach zuvor regelmässigen Zyklen auf, müssen auch nichthormonal bedingte Ursachen in Betracht gezogen werden. Demnach sind entsprechende diagnostische Massnahmen zum Ausschluss einer Schwangerschaft oder einer malignen Erkrankung, angezeigt.
Die Entzugsblutung kann während des einnahmefreien Intervalls ausbleiben. Falls das CHC entsprechend den Dosierungsanweisungen eingenommen wurde, ist eine Schwangerschaft unwahrscheinlich. Wurde das CHC allerdings vor der ersten ausgebliebenen Entzugsblutung nicht vorschriftsgemäss eingenommen oder sind zwei Entzugsblutungen ausgeblieben, muss vor der weiteren Einnahme eine Schwangerschaft ausgeschlossen werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Desoren 30 darf bei Frauen mit Leberinsuffizienz nicht angewendet werden.
Patienten mit Nierenfunktionsstörungen
Desoren 30 wurde bei Frauen mit Niereninsuffizienz nicht untersucht und es können keine Dosierungsempfehlungen gemacht werden.
Ältere Patienten
Bei Frauen nach der Menopause besteht keine Indikation.
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit wurde an Frauen ab einem Alter von 18 Jahren untersucht. Für Jugendliche wird, falls indiziert, die gleiche Dosierung wie bei Erwachsenen empfohlen.
Kontraindikationen·Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
·Venöse Thromboembolie – bestehende VTE (auch unter Therapie mit Antikoagulanzien) oder VTE in der Anamnese (z.B. tiefe Venenthrombose oder Lungenembolie)
·Vorliegen starker Risikofaktoren für venöse thromboembolische Ereignisse wie
§hereditäre oder erworbene Prädisposition für venöse thromboembolische Ereignisse, wie z.B. APC-Resistenz (einschliesslich Faktor-V-Leiden-Mutation), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel
·Gleichzeitiges Vorliegen mehrerer Risikofaktoren für venöse thromboembolische Ereignisse, wie sie in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben sind.
·Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
·bestehende oder vorausgegangene arterielle thromboembolische Ereignisse und deren Prodromi (z.B. Angina pectoris, Myokardinfarkt, transitorische ischämische Attacke (TIA), zerebrovaskulärer Insult)
·Vorliegen starker Risikofaktoren für arterielle thromboembolische Ereignisse wie
·Diabetes mellitus mit Gefässkomplikationen
·schwere arterielle Hypertonie
·schwere Dyslipoproteinämie
·Migräne mit fokalen neurologischen Symptomen (auch in der Anamnese)
·hereditäre oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z.B. Hyperhomocysteinämie oder Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupusantikoagulans)
·Gleichzeitiges Vorliegen mehrerer Risikofaktoren für arterielle thromboembolische Ereignisse, wie sie in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben sind.
·Bestehende oder vorausgegangene schwere Lebererkrankung, solange abnorme Leberfunktionsparameter bestehen.
·Gleichzeitige Anwendung einer der Wirkstoffkombinationen Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir, Glecaprevir/Pibrentasvir und Sofosbuvir/Velpatasvir/Voxilaprevir (Arzneimittel zur Therapie der Hepatitis C) (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»)
·Bestehende oder vorausgegangene benigne oder maligne Lebertumore.
·Bestehende oder vermutete maligne Erkrankungen der Genitalorgane oder der Mammae, wenn diese sexualhormonabhängig sind:
·ungeklärte vaginale Blutungen
·Bestehende oder vorausgegangene Pankreatitis in Verbindung, mit schwerer Hypertriglyceridämie
·Vermutete oder bestehende Schwangerschaft.
·Überempfindlichkeit gegenüber den Wirkstoffen oder einem der Hilfsstoffe von Desoren 30.
Warnhinweise und VorsichtsmassnahmenDie Anwendung eines CHC erhöht das Risiko für venöse Thromboembolien (VTE) und für arterielle Thromboembolien (ATE) im Vergleich zur Nichtanwendung. Warnhinweise und Vorsichtsmassnahmen, welche nachfolgend beschrieben werden, müssen vor jeder Verschreibung berücksichtigt werden (siehe «Risiko für venöse Thromboembolien [VTE]» und «Risiko für arterielle Thromboembolien [ATE]»). Es ist wichtig, die Patientin auf die Informationen zu venösen und arteriellen thromboembolischen Ereignissen hinzuweisen, insbesondere auf die möglichen Symptome von VTE und ATE und die bekannten vaskulären Risikofaktoren sowie darauf, was im Falle einer vermuteten Thrombose zu tun ist (siehe «Symptome einer VTE [tiefe Venenthrombose und Lungenembolie]» und «Symptome einer ATE»).
Der Nutzen einer Anwendung eines CHC wie Desoren 30 sollte gegen die nachfolgend aufgeführten Erkrankungen/Risiken unter Berücksichtigung des Schweregrades jedes einzelnen Faktors oder dem Aufeinandertreffen mehrerer Faktoren abgewogen und mit jeder Patientin besprochen werden, bevor man sich zur Anwendung von Desoren 30 entschliesst (siehe auch «Kontraindikationen»). Die Patientin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen.
Vor Beginn oder erneuter Anwendung eines CHC wie Desoren 30 soll eine sorgfältige Eigen- und Familienanamnese erhoben, sowie unter Beachtung der Kontraindikationen und Warnhinweise und Vorsichtsmassnahmen eine gründliche allgemeine und gynäkologische Untersuchung durchgeführt werden, um behandlungsbedürftige Erkrankungen sowie deren Risikofaktoren feststellen und eine Schwangerschaft ausschliessen zu können. Diese Untersuchungen schliessen im Allgemeinen Blutdruck, Mammae, Abdomen, Beckenorgane (inkl. Zervixzytologie) und relevante Laboruntersuchungen ein.
Während der Anwendung des CHC müssen diese Untersuchungen in regelmässigen Abständen wiederholt werden, wobei Art und Häufigkeit auf die individuelle Anwenderin abgestimmt werden und sich an den Richtlinien der Schweizer Gesellschaft für Gynäkologie und Geburtshilfe (SGGG) orientieren sollten. Bei diesen Kontrollen sollten die Kontraindikationen (z.B. eine transitorische ischämische Attacke) und Risikofaktoren (z.B. Familienanamnese venöser oder arterieller Thrombosen, siehe «Risikofaktoren für VTE» und «Risikofaktoren für ATE») erneut überprüft werden, da diese während der Anwendung eines CHC zum ersten Mal auftreten können.
Gründe zum sofortigen Absetzen
Die Anwenderin muss darüber informiert werden, dass sie bei Auftreten einer der oben genannten Kontraindikationen sowie bei Eintreten einer der nachfolgenden Situationen schnellstmöglich einen Arzt/eine Ärztin konsultieren muss, der/die dann über die weitere Anwendung des CHC entscheiden wird:
·Erstmaliges Auftreten oder Exazerbation migräneartiger Kopfschmerzen oder häufigeres Auftreten ungewohnt starker Kopfschmerzen.
·Plötzliche Seh-, Hör-, Sprech- oder sonstige Wahrnehmungsstörungen.
·Erste Anzeichen von thromboembolischen Ereignissen (siehe «Symptome einer VTE [tiefe Venenthrombose und Lungenembolie]» und «Symptome einer ATE»).
·Mindestens 4 Wochen vor geplanten Operationen und während einer Immobilisation, z.B. nach Unfall oder Operation.
·Klinisch relevanter Blutdruckanstieg (bei wiederholter Messung).
·Auftreten von Ikterus, Hepatitis, generalisiertem Pruritus.
·Starke Oberbauchschmerzen oder Lebervergrösserung.
·Schwere depressive Zustände.
·Schwangerschaft.
Risiko für venöse Thromboembolien (VTE)
Die Anwendung jedes CHC erhöht das Risiko für VTE im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie Desoren 30, können ein bis zu doppelt so hohes Risiko aufweisen.
Die Entscheidung das Arzneimittel anzuwenden sollte nur nach einem Gespräch mit der Patientin getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht:
·Das Risiko für VTE bei Anwendung von Desoren 30.
·Wie beeinflussen ihre vorbestehenden individuellen Risikofaktoren dieses Risiko?
·Stärkste Risikoerhöhung für VTE im allerersten Anwendungsjahr (insbesondere während der ersten 3 Monate).
·Die vorhandenen Daten deuten darauf hin, dass dieses erhöhte Risiko sowohl bei der erstmaligen Anwendung eines CHC als auch bei der erneuten Anwendung des gleichen oder eines anderen CHC besteht (nach einem mindestens 4-wöchigen oder länger dauernden anwendungsfreien Intervall).
·Desoren 30 ist ein Arzneimittel. Im Falle eines Unfalls oder eines operativen Eingriffs muss die Anwenderin die behandelnden Ärzte bzw. Ärztinnen darüber informieren, dass sie Desoren 30 anwendet.
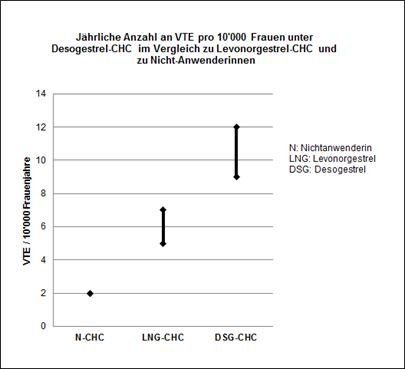
Ungefähr 2 von 10'000 Frauen, die kein CHC anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei der einzelnen Frau kann das Risiko jedoch in Abhängigkeit von ihren zugrundeliegenden Risikofaktoren bedeutend höher sein (siehe unten).
Aufgrund der vorliegenden epidemiologischen Daten wird geschätzt, dass im Verlauf eines Jahres 9-12 von 10'000 Frauen, die ein Desogestrel-haltiges CHC anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei 5-7 von 10'000 Frauen, die ein Levonorgestrel-haltiges CHC anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während einer Schwangerschaft oder in der postpartalen Phase.
VTE verlaufen in 1-2% der Fälle tödlich.
Äusserst selten wurde bei Anwenderinnen von CHC auch über venöse Thrombosen ausserhalb der Extremitäten berichtet, z.B. Sinusvenenthrombosen oder Thrombosen in hepatischen, mesenterialen, renalen oder retinalen Venen.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von CHC kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, vor allem wenn mehrere Risikofaktoren gleichzeitig vorliegen (siehe Tabelle). Insbesondere ist bei der Nutzen-Risiko-Abwägung zu berücksichtigen, dass das Risiko venöser thromboembolischer Ereignisse überadditiv erhöht sein kann, wenn eine Kombination von Risikofaktoren vorliegt. In diesem Fall muss das Gesamtrisiko für eine VTE in Betracht gezogen werden. Desoren 30 ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die sie insgesamt einem hohen Risiko für eine Venenthrombose aussetzen.
Tabelle: Risikofaktoren für VTE
|
Risikofaktor
|
Anmerkung
| |
Adipositas (Body-Mass-Index über 30 kg/m²)
|
Das Risiko nimmt mit steigendem BMI deutlich zu.
Besonders wichtig, wenn weitere Risikofaktoren vorliegen.
| |
Längere Immobilisierung, grössere chirurgische Eingriffe, jeder Eingriff an Beinen oder Hüfte, neurochirurgischer Eingriff oder schweres Trauma
|
In diesen Fällen ist es ratsam, die Anwendung der Tabletten zu unterbrechen (bei einer geplanten Operation mindestens vier Wochen vorher) und frühestens zwei Wochen nach vollständiger Mobilisierung wieder aufzunehmen. Ggf. ist eine andere Kontrazeptionsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern.
Eine medikamentöse Thromboseprophylaxe muss erwogen werden, wenn Desoren 30 nicht vorab abgesetzt wurde.
| |
Positive Familienanamnese (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z.B. jünger als 50 Jahre).
|
Bei Verdacht auf eine genetische Prädisposition ist die Patientin zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung von Desoren 30 getroffen wird.
Falls die Evaluation Hinweise auf eine Thrombophilie ergibt, ist die Anwendung von Desoren 30 kontraindiziert.
| |
Andere Erkrankungen, die mit einem erhöhten VTE-Risiko assoziiert sind
|
Systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, chronisch entzündliche Darmerkrankungen (Morbus Crohn oder Colitis ulcerosa), Sichelzellanämie, maligne Erkrankungen
| |
Zunehmendes Alter
|
Insbesondere älter als 35 Jahre
|
Hinweis: Eine vorübergehende Immobilisierung wie beispielsweise eine Flugreise von >4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Patientinnen mit weiteren Risikofaktoren.
Über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose besteht kein Konsens.
Es muss beachtet werden, dass das Risiko thromboembolischer Ereignisse in der postpartalen Phase erhöht ist. Es gibt Daten, die darauf hindeuten, dass das Thromboserisiko bis 12 Wochen nach der Entbindung erhöht sein kann.
Symptome einer VTE (tiefe Venenthrombose und Lungenembolie)
Der Patientin ist anzuraten, bei Auftreten eines oder mehrerer der folgenden Symptome unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie Desoren 30 anwendet.
·Symptome einer tiefen Beinvenenthrombose können sein
·unilaterale Schwellung in einem Bein oder entlang einer Vene im Bein;
·Spannungsgefühl oder Schmerzen in einem Bein, auch wenn sie nur beim Stehen oder Gehen spürbar sind;
·Überwärmung, Rötung oder Verfärbung der Haut am betroffenen Bein.
·Symptome einer Lungenembolie können sein
·plötzliche unerklärliche Kurzatmigkeit, schnelles Atmen oder Atemnot; Anstrengungsintoleranz;
·plötzliches Auftreten von Husten, eventuell mit blutigem Sputum;
·plötzlicher starker Schmerz im Brustkorb, welcher sich bei tiefer Atmung verstärken kann;
·starke Benommenheit, Schwindel, oder Angstgefühl;
·Tachykardie oder Arrhythmien.
Einige dieser Symptome (z.B. Kurzatmigkeit oder Husten) sind nicht spezifisch und können als häufige oder weniger schwere Ereignisse (z.B. Atemwegsinfektionen) missdeutet werden.
Risiko für arterielle Thromboembolien (ATE)
Epidemiologische Studien haben ausserdem die Anwendung von CHC mit einem erhöhten Risiko für arterielle thromboembolische Ereignisse (wie Myokardinfarkt, Schlaganfall oder transitorische ischämische Attacken) in Verbindung gebracht. Bevor die Entscheidung getroffen wird Desoren 30 zu verordnen, ist die Patientin über dieses Risiko sowie insbesondere auch darüber aufzuklären, wie eventuell vorbestehende individuelle Risikofaktoren dieses Risiko zusätzlich erhöhen können.
Äusserst selten wurde bei Anwenderinnen von CHC auch über Thrombosen in anderen Blutgefässen (wie z.B. hepatischen, mesenterialen, renalen oder retinalen Arterien) berichtet.
Risikofaktoren für ATE
Ein erhöhtes Risiko für einen zerebrovaskulären Insult oder andere arterielle thromboembolische Komplikationen bei Anwenderinnen von CHC besteht v.a. bei Frauen, die bereits Risikofaktoren für solche Erkrankungen aufweisen (siehe Tabelle). Insbesondere muss bei der Nutzen-Risiko-Abwägung beachtet werden, dass das Risiko für arterielle thromboembolische Ereignisse überadditiv erhöht sein kann, wenn eine Kombination von Risikofaktoren vorliegt. In diesem Fall muss das Gesamtrisiko für eine ATE betrachtet werden. Bei Patientinnen, die aufgrund eines schwerwiegenden Risikofaktors oder des Vorliegens mehrerer Risikofaktoren ein hohes Risiko für eine ATE aufweisen, ist Desoren 30 kontraindiziert.
Tabelle: Risikofaktoren für ATE
|
Risikofaktor
|
Anmerkung
| |
Zunehmendes Alter
|
Insbesondere älter als 35 Jahre
| |
Rauchen
|
Frauen ist anzuraten, nicht zu rauchen, wenn sie ein CHC wie Desoren 30 anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Kontrazeptionsmethode anzuwenden.
| |
Arterielle Hypertonie
|
| |
Diabetes mellitus
|
Bei Diabetikerinnen mit bereits bestehenden Gefässkomplikationen ist die Anwendung von CHC kontraindiziert.
| |
Dyslipoproteinämie
|
| |
Herzklappenerkrankungen
|
| |
Vorhofflimmern
|
| |
Adipositas (Body-Mass-Index über 30 kg/m²)
|
Das Risiko nimmt mit steigendem BMI deutlich zu.
Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren.
| |
Positive Familienanamnese (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d.h. jünger als 50 Jahre).
|
Bei Verdacht auf eine genetische Prädisposition ist die Patientin zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung von Desoren 30 getroffen wird.
Falls die Untersuchung Hinweise auf eine Thrombophilie ergibt, ist die Anwendung von Desoren 30 kontraindiziert.
| |
Migräne
|
Ein Anstieg der Häufigkeit oder des Schweregrads einer Migräne während der Anwendung von Desoren 30 kann ein Prodromalsymptom eines zerebrovaskulären Ereignisses darstellen und Grund für ein sofortiges Absetzen sein.
| |
Andere Erkrankungen, die mit einem erhöhten Risiko für ATE assoziiert sind
|
Hyperhomocysteinämie, systemischer Lupus erythematodes, Sichelzellanämie, maligne Erkrankungen.
|
Symptome einer ATE
Der Patientin ist anzuraten, beim Auftreten eines oder mehrerer der folgenden Symptome unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie Desoren 30 anwendet.
·Symptome eines zerebrovaskulären Insults können sein
·plötzliche Taubheit oder Kraftlosigkeit des Gesichtes, eines Armes oder Beines, vor allem einer Körperhälfte;
·plötzliche Verwirrtheit;
·undeutliche Aussprache oder Verständnisprobleme;
·plötzliche Sehstörungen in einem oder beiden Augen;
·plötzliche Gehstörungen;
·Schwindel;
·Gleichgewichts- oder Koordinationsstörungen;
·plötzliche schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
·Bewusstseinsverlust oder Ohnmacht mit oder ohne Krampfanfall.
·Symptome eines Myokardinfarktes können sein
·Schmerzen, Unwohlsein, Druckgefühl, Schweregefühl, Enge- oder Spannungsgefühl in der Brust, im Arm oder hinter dem Brustbein;
·Beschwerden, welche in Rücken, Kiefer, Hals, Arm oder Magen ausstrahlen;
·Völlegefühl, Magenbeschwerden oder Würgereiz;
·Schwitzen, Nausea, Erbrechen oder Schwindel;
·extremes Schwäche-, oder Angstgefühl oder Kurzatmigkeit;
·Tachykardie oder Arrhythmien.
·Andere Symptome eines vaskulären Verschlusses können sein
·Plötzlicher Schmerz, Schwellung oder leichte Cyanose einer Extremität;
·akutes Abdomen.
Verdacht auf hereditäre oder erworbene Prädisposition für thromboembolische Komplikationen
Bei Verdacht auf eine hereditäre oder erworbene Prädisposition für thromboembolische Komplikationen ist eine gerinnungs-physiologische Abklärung durch einen Spezialisten angezeigt, welcher ggf. eine Bestimmung bestimmter hämostatischer Parameter veranlassen wird.
Tumorerkrankungen
In einigen epidemiologischen Untersuchungen wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von CHC (>5 Jahre) berichtet. Es wird jedoch nach wie vor kontrovers diskutiert, in wie weit dieses Ergebnis durch andere Faktoren wie eine Infektion durch humane Papillomaviren (HPV) (stärkster Risikofaktor), die Frequenz der Teilnahme am Zervix-Screening oder das Sexualverhalten beeinflusst wird.
Eine Metaanalyse von 54 epidemiologischen Studien hat ergeben, dass das relative Risiko (RR) der Diagnosestellung eines Mammakarzinoms bei Frauen, die CHC anwenden, geringfügig erhöht (RR = 1,24) ist. Nach Absetzen der CHC sinkt das erhöhte Risiko kontinuierlich ab und ist nach 10 Jahren nicht mehr nachweisbar. Da Mammakarzinome vor dem 40. Lebensjahr selten sind, ist bei Frauen, die ein CHC anwenden oder bis vor kurzem angewendet haben, die zusätzlich diagnostizierte Anzahl an Mammakarzinomen im Verhältnis zum Mammakarzinom-Gesamtrisiko gering. Diese Studien liefern keine Hinweise auf eine Kausalität. Die beobachtete Risikoerhöhung kann sowohl auf eine bei Anwenderinnen von CHC frühzeitigere Erkennung als auch auf biologische Wirkungen von CHC oder auf beide Faktoren gemeinsam zurückzuführen sein. Mammakarzinome bei Frauen, die ein CHC angewendet haben, waren zum Zeitpunkt der Diagnosestellung tendenziell weniger weit fortgeschritten als bei Frauen, die nie ein CHC angewendet hatten.
In seltenen Fällen wurden unter Anwendung von CHC gutartige, noch seltener bösartige Lebertumoren beobachtet. In Einzelfällen führten diese Tumore zu lebensbedrohlichen intraabdominalen Blutungen. Wenn starke Oberbauchbeschwerden, eine Lebervergrösserung oder Hinweise auf eine intraabdominale Blutung auftreten, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen miteinbezogen werden.
Depressive Störungen
Depressionen bzw. depressive Verstimmungen sind als mögliche unerwünschte Wirkungen bei der Anwendung von Sexualhormonen, einschliesslich hormonaler Kontrazeptiva, bekannt (s. a. «Unerwünschte Wirkungen»). Solche Störungen können bereits kurz nach Beginn der Behandlung auftreten. Eine Depression kann schwerwiegend verlaufen und stellt einen Risikofaktor für Suizide bzw. suizidales Verhalten dar. Anwenderinnen hormonaler Kontrazeptiva sollen daher über mögliche Symptome depressiver Störungen informiert werden. Der Anwenderin soll dringend geraten werden, sich umgehend an einen Arzt/ eine Ärztin zu wenden, falls sie unter der Anwendung des Kontrazeptivums Stimmungsschwankungen oder andere Symptome einer Depression bemerkt. Anwenderinnen mit einer schweren Depression in der Anamnese sollen sorgfältig überwacht werden. Falls es unter der Anwendung von Desoren 30 erneut zu schweren depressiven Zuständen kommt, muss das Arzneimittel abgesetzt werden.
Sonstige Vorsichtsmassnahmen
Frauen, die ein hormonales Kontrazeptivum anwenden, sollen nicht gleichzeitig mit Johanniskrautpräparaten (Hypericum) behandelt werden, da die kontrazeptive Wirkung beeinträchtigt sein kann. Über Zwischenblutungen und Einzelfälle unerwünschter Schwangerschaften wurde berichtet (siehe auch «Interaktionen»).
Bei Frauen mit bestehender oder familiärer Hypertriglyzeridämie ist unter der Anwendung von CHC möglicherweise mit einem erhöhten Pankreatitis-Risiko zu rechnen.
Obwohl unter der Anwendung von CHC relativ häufig über einen geringfügigen Blutdruckanstieg berichtet wird, sind klinisch relevant erhöhte Blutdruckwerte selten. Kommt es unter der Anwendung eines CHC zu einer klinisch relevanten Blutdruckerhöhung (bei wiederholter Messung), sollte das CHC abgesetzt werden. Wo es angezeigt erscheint, kann die erneute Anwendung eines CHC erwogen werden, wenn sich die Blutdruckwerte (unter Behandlung) normalisiert haben.
Obwohl es unter der Anwendung von CHC zu einer Beeinflussung der peripheren Insulinresistenz und der Glukosetoleranz kommen kann, scheint eine Änderung des Therapieschemas bei Diabetikerinnen, die niedrigdosierte CHC (mit <0,05 mg EE) anwenden, nicht erforderlich. Dennoch sollten Diabetikerinnen – insbesondere während der ersten Monate der Anwendung von Desoren 30 – sorgfältig überwacht werden.
Akute oder chronische Störungen der Leberfunktion können das Absetzen des CHC erforderlich machen, bis sich die Leberfunktionswerte normalisiert haben. Beim Wiederauftreten eines cholestatischen Ikterus, der erstmalig während einer Schwangerschaft oder während einer früheren Anwendung von Sexualsteroidhormonen aufgetreten ist, müssen CHC abgesetzt werden.
Bei Patientinnen mit Hepatitis C, welche gleichzeitig ein Ethinylestradiol-haltiges CHC anwendeten, wurde unter Anwendung der Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir signifikant häufiger ein Anstieg der ALT (einschliesslich Fällen einer Erhöhung auf über das Fünffache, in Einzelfällen auf über das 20-Fache der Obergrenze des Normbereiches) beobachtet als bei Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden (siehe «Interaktionen»). Ähnliche ALT-Erhöhungen wurden auch unter Anti-HCV-Arzneimitteln beobachtet, die Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir enthielten. Desoren 30 muss daher vor Beginn einer Therapie mit diesen Wirkstoffkombinationen abgesetzt werden. Unter der Voraussetzung, dass Desoren 30 normale Leberwerte vorliegen, kann frühestens 2 Wochen, besser jedoch 4 Wochen nach dem Absetzen der Wirkstoffkombinationen Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir, Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir wieder mit der Einnahme von Desoren 30 begonnen werden. Hierbei ist allerdings zu beachten, dass bei einem Intervall von weniger als 4 Wochen aufgrund der enzyminduzierenden Eigenschaften von Ritonavir die Wirksamkeit des CHC noch beeinträchtigt sein kann und daher zusätzlich für 28 Tage eine Barrieremethode angewendet werden sollte (siehe unten unter «Interaktionen, Enzyminduktoren»).
Die folgenden Erkrankungen können sowohl während einer Schwangerschaft als auch während der Anwendung eines CHC auftreten oder ungünstig beeinflusst werden, doch lassen die verfügbaren Daten keine eindeutigen Schlüsse auf einen Kausalzusammenhang mit der Anwendung eines CHC zu: cholestatischer Ikterus und/oder Pruritus; Cholelithiasis; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Chorea minor; Herpes gestationis; Otosklerose-bedingter Hörverlust. Die Anwendung von CHC wurde ausserdem auch mit dem Auftreten von Morbus Crohn sowie Colitis ulcerosa assoziiert.
Bei Frauen mit hereditärem und/oder erworbenem Angioödem können exogene Östrogene die Symptome des Angioödems induzieren oder verschlimmern.
Bei prädisponierten Frauen kann die Anwendung von CHC gelegentlich ein Chloasma verursachen, das durch intensive Sonnenbestrahlung noch verstärkt wird. Frauen, die hierzu neigen, sollten sich deshalb keiner starken UV-Strahlung aussetzen.
Es soll darüber aufgeklärt werden, dass CHC keinen Schutz vor HIV-Infektionen (AIDS) und andere sexuell übertragbaren Krankheiten bieten.
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
InteraktionenAnmerkung: Die Fachinformationen von gleichzeitig angewendeten Arzneimitteln sollten zu Rate gezogen werden, um mögliche Interaktionen auszuschliessen.
Pharmakodynamische Interaktionen
Einfluss anderer Arzneimittel auf die Pharmakokinetik hormonaler Kontrazeptiva
Enzyminduktoren
Interaktionen zwischen hormonalen Kontrazeptiva und Arzneimitteln oder pflanzlichen Produkten, die mikrosomale Enzyme (insbesondere Cytochrom-P450 Enzyme) induzieren und dadurch eine erhöhte Clearance von Sexualhormonen verursachen, können zu einer Verminderung der kontrazeptiven Wirksamkeit sowie zu Durchbruchblutungen führen. Dies gilt z.B. für Barbiturate, Bosentan, Carbamazepin, Felbamat, Modafinil, Oxcarbazepin, Phenytoin, Primidon, Rifabutin, Rifampicin und Topiramat sowie für Arzneimittel, welche Johanniskraut (Hypericum perforatum) enthalten.
Eine Enzyminduktion kann bereits nach einigen Tagen der Behandlung auftreten. Die maximale Enzyminduktion wird im Allgemeinen nach 2 bis 3 Wochen beobachtet und kann nach dem Absetzen während mindestens 4 oder mehr Wochen andauern.
Frauen, welche kurzfristig mit einem der genannten Wirkstoffe behandelt werden, sollten dazu aufgefordert werden, zusätzlich zu Desoren 30 vorübergehend eine nicht-hormonale Kontrazeptionsmethode anzuwenden oder eine andere Art der Kontrazeption zu wählen. Die Barrieremethode sollte während der gleichzeitigen Anwendung der genannten Arzneimittel sowie für weitere 28 Tage nach deren Absetzen angewendet werden.
Wird die gleichzeitige Anwendung eines Enzyminduktors über das Ende der aktuellen Packung des CHC hinaus fortgesetzt, sollte sofort die nächste Packung des CHC begonnen werden, also ohne Einhaltung des gewohnten anwendungsfreien Intervalls. In diesem Fall ist eine Entzugsblutung nicht vor dem Ende der zweiten Packung zu erwarten. Kommt es während des anwendungsfreien Intervalls am Ende der zweiten Packung nicht zu einer Entzugsblutung, muss eine Schwangerschaft ausgeschlossen werden, bevor die Anwendung mit der nächsten Packung fortgesetzt wird.
Im Falle einer Langzeitbehandlung mit Arzneimitteln, welche zu einer Enzyminduktion in der Leber führen, sollten alternative Kontrazeptionsmethoden angewendet werden.
Darüber hinaus ist bekannt, dass verschiedene Inhibitoren der HIV/HCV-Protease (z.B. Nelfinavir, Boceprevir, Telaprevir) und der nicht-nukleosidischen Reverse-Transkriptase (z.B: Efavirenz [siehe unten], Nevirapin) sowie deren Kombinationen zu einer Erhöhung oder Erniedrigung der Plasmakonzentrationen von Östrogenen oder Gestagenen führen können. Der Nettoeffekt dieser Veränderungen kann in manchen Fällen klinisch relevant sein. Beispielsweise wurde in einer publizierten Studie der Einfluss einer Efavirenz-haltigen Therapie auf die Pharmakokinetik eines Etonogestrel-haltigen Implantates untersucht. Bei HIV-positiven Patientinnen unter der antiretroviralen Therapie war gegenüber Frauen ohne eine solche Komedikation die Cmax von Etonogestrel (dem aktiven Metaboliten von Desogestrel) um 54%, die AUC um 63% erniedrigt.
Insbesondere sind Proteaseinhibitoren wie Ritonavir oder Nelfinavir (einschliesslich deren Kombinationen) zwar als starke Inhibitoren von CYP3A4 bekannt, können jedoch bei gleichzeitiger Anwendung mit Steroidhormonen enzyminduzierende Eigenschaften aufweisen und dadurch die Plasmaspiegel von Östrogenen und Gestagenen reduzieren.
Enzyminhibitoren
Starke und moderate CYP3A4-Inhibitoren wie Azol-Antimykotika (z.B. Itraconazol, Voriconazol, Posaconazol, Fluconazol), Makrolid-Antibiotika (Clarithromycin, Erythromycin), Cobicistat, Diltiazem, Verapamil und Grapefruitsaft können die Plasmakonzentrationen von Östrogenen und/oder Gestagenen erhöhen und dadurch zum vermehrten Auftreten unerwünschter Wirkungen führen.
Andere Interaktionen
Interferenz mit dem enterohepatischen Kreislauf
Bei gleichzeitiger kurzdauernder Anwendung (bis zu 10 Tage) von Antibiotika, welche keine Interaktionen mit dem CYP3A4-Enzymsystem aufweisen, ist nicht mit pharmakokinetischen Interaktionen zu rechnen. Bei der Beratung der Patientin sollte jedoch berücksichtigt werden, dass unter Umständen die Grunderkrankung (z.B. Geschlechtskrankheiten), deretwegen das Antibiotikum eingesetzt wird, die zusätzliche Verwendung einer nicht-hormonalen Kontrazeptionsmethode nahelegen kann.
Über mögliche Interaktionen bei längerfristiger Komedikation mit Antibiotika (z.B. bei Osteomyelitis oder Borreliose) liegen keine ausreichenden Daten vor. Soll eine Schwangerschaft sicher ausgeschlossen werden, wird in solchen Fällen während der Antibiotikatherapie sowie in den ersten 7 Tagen nach deren Absetzen die zusätzliche Verwendung einer nicht-hormonalen Kontrazeptionsmethode empfohlen.
Sollte es unter der antibiotischen Therapie zu Durchfällen und/oder Erbrechen kommen, sind ausserdem die Angaben im Abschnitt, «Verhalten bei gastrointestinalen Störungen» in der Rubrik «Dosierung/Anwendung» zu beachten.
Einfluss hormonaler Kontrazeptiva auf die Pharmakokinetik anderer Arzneimittel
Hormonale Kontrazeptiva können – durch verschiedene Interaktionsmechanismen – auch die Pharmakokinetik einiger anderer Arzneimittel beeinflussen. Sie können die hepatischen mikrosomalen Enzyme (insbesondere Cytochrom-P450 Enzyme) hemmen oder die hepatische Konjugation, insbesondere die Glukuronidierung, induzieren. Entsprechend können die Plasma- und Gewebekonzentrationen anderer Arzneimittel entweder erhöht (z.B. Cyclosporin) oder erniedrigt (z.B. Lamotrigin, siehe unten) werden. Weiter kann auch die pharmakologische Wirkung ausgewählter Substanzen der folgenden Arzneimittelklassen beeinflusst werden: Analgetika, Antidepressiva, Antidiabetika, Antimalariamittel, einige Benzodiazepine, einige β-Blocker, Kortikosteroide, orale Antikoagulantien und Theophyllin. Nicht in allen Fällen sind die aus diesen Interaktionen resultierenden Veränderungen der Plasmaspiegel klinisch relevant.
Lamotrigin
Eine Interaktionsstudie mit dem Antiepileptikum Lamotrigin und einem kombinierten oralen Kontrazeptivum (30 µg Ethinylestradiol/150 µg Levonorgestrel) zeigte eine klinisch relevante Steigerung der Lamotrigin-Clearance mit einer entsprechenden signifikanten Abnahme der Lamotrigin-Plasmaspiegel, wenn diese Arzneimittel gleichzeitig verabreicht wurden. Eine derartige Senkung der Plasmakonzentrationen kann mit einer reduzierten Anfallskontrolle einhergehen. Es ist nicht bekannt, in wieweit diese Befunde auf andere kombinierte Kontrazeptiva mit anderer Gestagenkomponente und/oder anderer Östrogendosis übertragbar sind. Es ist jedoch davon auszugehen, dass diese Präparate ein vergleichbares Interaktionspotential aufweisen.
Beginnt eine Patientin, welche Lamotrigin einnimmt, neu mit der Anwendung von Desoren 30, kann daher eine Anpassung der Lamotrigindosis erforderlich sein, und die Lamotrigin-Konzentration sollte zu Beginn der Therapie engmaschig überwacht werden. Hierbei ist insbesondere auch zu beachten, dass es zu einem deutlichen Anstieg des Lamotriginspiegels (unter Umständen in den toxischen Bereich) kommen kann, wenn das hormonale Kontrazeptivum abgesetzt wird (sowie unter Umständen in den 7-tägigen Anwendungspausen).
Interaktionen mit unbekanntem Mechanismus
In klinischen Studien kam es bei gleichzeitiger Anwendung Ethinylestradiol-haltiger CHC zusammen mit der in der Therapie von HCV-Infektionen eingesetzten Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir gegenüber Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden, signifikant häufiger zu einem Anstieg der ALT (einschliesslich Fällen eines Anstiegs auf über das Fünffache, in Einzelfällen auf über das 20-Fache der oberen Grenze des Normbereiches [Upper Limit of Normal, ULN]). Ähnliche ALT-Erhöhungen wurden auch unter Anti-HCV-Arzneimitteln beobachtet, die Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir enthielten. Desoren 30 muss daher vor Beginn einer Therapie mit einer solchen antiviralen Kombination abgesetzt werden (siehe auch «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft, StillzeitSchwangerschaft
Die Einnahme von Desoren 30 ist während einer Schwangerschaft kontraindiziert. Vor Beginn der Anwendung des Arzneimittels ist eine Schwangerschaft auszuschliessen. Tritt unter der Anwendung von Desoren 30 eine Schwangerschaft ein oder wird eine solche vermutet, ist das Arzneimittel sofort abzusetzen und der Arzt oder die Ärztin zu konsultieren.
Es gibt Hinweise auf fötale Risiken, basierend auf tierexperimentellen Untersuchungen (siehe «Präklinische Daten»). Die meisten bis heute durchgeführten epidemiologischen Studien haben jedoch keine eindeutigen Hinweise auf eine embryotoxische oder teratogene Wirkung ergeben, wenn Kombinationen aus Östrogenen und Gestagenen versehentlich während der Schwangerschaft angewendet wurden.
Stillzeit
Das Arzneimittel sollte in der Stillzeit nicht angewendet werden, da die Milchproduktion reduziert und die Milchqualität verändert sein kann und geringe Wirkstoffkonzentrationen in der Milch gemessen werden können. Wenn möglich sollten bis zum vollständigen Abstillen des Kindes nichthormonale Kontrazeptionsmethoden angewendet werden.
Zum postpartalen Risiko thromboembolischer Ereignisse bei der Mutter siehe «Warnhinweise und Vorsichtsmassnahmen».
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Auswirkungen auf die Fahrtüchtigkeit und das Bedienen von Maschinen festgestellt.
Unerwünschte WirkungenDie schwerwiegendsten unerwünschten Wirkungen im Zusammenhang mit der Anwendung von CHC sind in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben (siehe oben). Schwerwiegende unerwünschte Wirkungen sind insbesondere arterielle und venöse Thromboembolien.
Nachfolgend sind die unerwünschten Wirkungen angegeben, welche unter der Anwendung von CHC beschrieben wurden. Die Häufigkeiten sind dabei definiert als «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Candidiasis, Vaginitis, Zervicitis.
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Selten: benigne hepatische Neoplasmen.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen.
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahme.
Gelegentlich: Flüssigkeitsretention, verminderte Glukosetoleranz.
Selten: Gewichtsabnahme.
Psychiatrische Erkrankungen
Häufig: depressive Verstimmung, Stimmungsveränderungen.
Gelegentlich: Abnahme der Libido.
Selten: Zunahme der Libido.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Gelegentlich: Migräne.
Augenerkrankungen
Selten: Beschwerden beim Tragen von Kontaktlinsen, Sehstörungen.
Erkrankungen des Ohrs und des Labyrinths
Selten: Hörstörungen.
Herz- und Gefässerkrankungen
Gelegentlich: Blutdruck-Erhöhung.
Selten: Venöse thromboembolische Ereignisse (z.B. tiefe Venenthrombose, Lungenembolie), arterielle thromboembolische Ereignisse (z.B. transitorische ischämische Attacke, Schlaganfall, Myokardinfarkt).
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Bauchschmerzen.
Gelegentlich: Erbrechen, Diarrhoe.
Leber- und Gallenerkrankungen
Selten: Cholelithiasis, cholestatischer Ikterus.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Rash, Urtikaria.
Selten: Hirsutismus, Erythema nodosum, Erythema multiforme.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Spannungsgefühl bzw. Schmerzen in der Brust.
Gelegentlich: Brustvergrösserung, Amenorrhoe, Zwischenblutungen.
Selten: Fluor vaginalis, Brustdrüsensekretion.
Bei Anwenderinnen von kombinierten oralen Kontrazeptiva wurde darüber hinaus über folgende unerwünschte Wirkungen berichtet: Mammakarzinom, fibrozystische Veränderungen der Brust, Zervixdysplasie, Myome des Uterus, Ovarialzysten, Lebertumoren, Chloasma, Akne, Alopezie, Verschlimmerung der Symptome eines hereditären oder erworbenen Angioödems, Erhöhung der Leberenzyme.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs liegen keine Meldungen über schwerwiegende Folgen bei Überdosierung vor.
Anzeichen und Symptome
Symptome einer Überdosierung sind: Übelkeit, Erbrechen und vaginale Blutungen. Letztere können nach versehentlicher Einnahme des Präparates auch bei Mädchen vor der Menarche auftreten.
Behandlung
Eine allfällige Behandlung hat symptomatisch zu erfolgen.
Eigenschaften/WirkungenATC-Code
G03AA09
Wirkungsmechanismus/Pharmakodynamik
Wie bei allen kombinierten hormonalen Kontrazeptiva (CHC) beruht die kontrazeptive Wirkung von Desoren 30 auf verschiedenen Faktoren, als deren wichtigste die Ovulationshemmung und die Veränderung des Zervixsekrets anzusehen sind. Darüber hinaus bietet das Endometrium infolge der morphologischen und enzymatischen Veränderungen ungünstige Verhältnisse für die Nidation. Ausserdem führen die durch das CHC induzierten hormonellen Veränderungen zu regelmässigeren Zyklen und einer geringeren Blutungsstärke.
Klinische Wirksamkeit
Keine Angaben.
PharmakokinetikAbsorption
Desogestrel (DSG)
DSG wird nach oraler Verabreichung rasch und vollständig resorbiert und in Etonogestrel (ENG, 3-Keto-Desogestrel), den biologisch aktiven Metaboliten umgewandelt. Maximale Plasmakonzentrationen von ENG werden ca. 1,5 h nach Verabreichung erreicht. Die Bioverfügbarkeit von ENG beträgt 62–81%.
Ethinylestradiol (EE)
EE wird nach oraler Gabe rasch und vollständig resorbiert. Maximale Serumkonzentrationen werden 1–2 h nach Verabreichung erreicht. Die absolute Bioverfügbarkeit beträgt infolge präsystemischer Metabolisierung (First-pass-Effekt) ca. 60%.
Distribution
DSG
ENG wird sowohl an Albumin als auch an Sexualhormon-bindendes Globulin (SHBG) gebunden. Nur 2–4% der Gesamtkonzentration im Serum sind freies Steroid, 40–70% sind spezifisch und mit hoher Affinität an SHBG gebunden. Die Ethinylestradiol-bedingte Zunahme der SHBG-Konzentration beeinflusst die relative Bindung an Serumproteine, was zu einem Anstieg der SHBG-Bindung und zu einer Abnahme der Albumin-Bindung und der freien Fraktion führt. Das (scheinbare) Verteilungsvolumen von ENG beträgt 1,5 l/kg.
EE
EE ist sehr stark, aber unspezifisch an Serumalbumin gebunden (ca. 98,5%) und verursacht eine Zunahme der Serumkonzentrationen von SHBG. Das Verteilungsvolumen beträgt ca. 5 l/kg.
Steady state Bedingungen
DSG
Die Pharmakokinetik von ENG wird durch die SHBG-Spiegel beeinflusst, die durch EE um das Dreifache erhöht werden. Bei täglicher Einnahme nehmen die Serumspiegel von ENG um etwa das 2–3-fache zu, wobei der Steady state in der zweiten Hälfte des Verabreichungszyklus erreicht wird.
EE
Entsprechend der variablen terminalen Halbwertszeit werden Steady-State-Serumspiegel von Ethinylestradiol nach etwa einer Woche erreicht.
Metabolismus
DSG
DSG wird schnell und vollständig in der intestinalen Mucosa und bei der ersten Leberpassage durch Hydroxylierung und Reduktion zum aktiven ENG metabolisiert. Es entstehen weitere, jedoch inaktive Metaboliten, welche mit Glukuronsäure und Sulfat konjugiert werden. Es gibt keine metabolischen Interaktionen aufgrund der gleichzeitigen Verabreichung von Ethinylestradiol (EE).
EE
EE wird präsystemisch sowohl in der Schleimhaut des Dünndarms als auch in der Leber metabolisiert. In der Dünndarmschleimhaut wird es konjugiert, in der Leber durch Phase-I-Metabolismus (Hauptmetaboliten: 2-Hydroxyethinylestradiol und 2-Methoxyethinyl-estradiol) und Konjugation abgebaut. Die Glucuronsäure- und Sulfatkonjugate von Ethinylestradiol und Phase-I-Metaboliten unterliegen einem enterohepatischen Kreislauf. Cytochrom 3A4 ist am Metabolismus in erheblichem Ausmass beteiligt.
Elimination
DSG
Die ENG-Serumspiegel nehmen zweiphasisch mit einer terminalen Halbwertszeit von ca. 30 h ab. Die Clearance beträgt 2 ml/min/kg. DSG wird in Form seiner Metaboliten mit dem Harn und der Galle in einem Verhältnis von ca. 6:4 ausgeschieden.
EE
Die EE-Serumspiegel nehmen zweiphasisch mit einer terminalen Halbwertszeit von ca. 24 h ab. Die totale Clearance beträgt ca. 5 ml/min/kg.
EE wird vollständig metabolisiert, seine Metaboliten werden mit dem Urin und der Galle im Verhältnis von 4:6 mit einer Halbwertszeit von ca. 24 h eliminiert.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Daten zur Pharmakokinetik bei Frauen mit Lebersuffizienz liegen nicht vor.
Nierenfunktionsstörungen
Daten zur Pharmakokinetik bei Frauen mit Niereninsuffizienz liegen nicht vor.
Präklinische DatenPräklinische Untersuchungen mit kombinierten oralen Kontrazeptiva zur Toxizität nach wiederholter Gabe, zur Genotoxizität und zum karzinogenen Potential ergaben bei vorschriftsgemässer Anwendung von CHC keine eindeutigen Hinweise auf besondere Gefahren für den Menschen. Jedoch sollte berücksichtigt werden, dass Sexualsteroide das Wachstum gewisser hormonabhängiger Gewebe und Tumore fördern können.
Reproduktionstoxizität
Bei Versuchstieren zeigte Ethinylestradiol bereits in relativ geringer Dosierung einen embryoletalen Effekt, welcher als Spezies-spezifisch erachtet wird; Missbildungen des Urogenitaltrakts und Feminisierung männlicher Feten wurden beobachtet. Gestagenartige Substanzen zeigten im Tierexperiment einen embryoletalen Effekt und, in hohen Dosen, eine virilisierende Wirkung auf weibliche Feten. Reproduktionstoxikologische Studien in Ratten, Mäusen und Kaninchen ergaben keine Hinweise auf eine teratogene Wirkung. Für Risiken beim Menschen siehe «Schwangerschaft/Stillzeit».
Sonstige HinweiseBeeinflussung diagnostischer Methoden
Kontrazeptive Steroide können die Ergebnisse gewisser Labortests beeinflussen, wie biochemische Parameter der Leber, Schilddrüse, Nebennieren- und Nierenfunktion, Plasmaspiegel von (Träger-) Proteinen und Lipid-/Lipoproteinfraktionen, Parameter des Kohlenhydrat-Stoffwechsels sowie der Blutgerinnung und Fibrinolyse. Diese Änderungen bewegen sich im Allgemeinen innerhalb des entsprechenden Normalbereichs.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 25°C lagern.
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer58268 (Swissmedic).
PackungenDesoren 30, 1× 21, 3× 21 und 6× 21 [B]
ZulassungsinhaberinGedeon Richter (Schweiz) AG, Genf.
Stand der InformationJuni 2022
|

