ZusammensetzungWirkstoffe
Telmisartanum.
Hilfsstoffe
Natrii hydroxidum, megluminum, povidonum K25, lactosum monohydricum, povidonum, crospovidonum, lactosum anhydricum, magnesii stearas.
1 Tablette 40 mg enthält 1,931 mg Natrium und 155,24 mg Lactose.
1 Tablette 80 mg enthält 3,863 mg Natrium und 310,48 mg Lactose.
Indikationen/AnwendungsmöglichkeitenBehandlung der leichten bis mittelschweren Hypertonie
Reduktion des Risikos von Myokardinfarkt und Schlaganfall bei Patienten mit erhöhtem kardiovaskulärem Risiko und/oder Diabetes mellitus von Typ 2.
Dosierung/AnwendungErwachsene
Behandlung der leichten bis mittelschweren Hypertonie
Die empfohlene Dosierung von Telmisartan Sandoz beträgt einmal täglich 40 mg immer zur gleichen Tageszeit, z.B. morgens. Bei ungenügender Wirksamkeit, d.h. die angestrebte Blutdrucksenkung wird nicht erreicht, kann die Dosis auf maximal 80 mg erhöht werden.
Bei einer Dosiserhöhung muss in Betracht gezogen werden, dass die maximale blutdrucksenkende Wirkung im Allgemeinen vier bis acht Wochen nach Behandlungsbeginn erreicht wird. Alternativ kann Telmisartan in Kombination mit Thiazid-Typ-Diuretika wie Hydrochlorothiazid oder Calcium-Kanal-Blockern wie Amlodipin angewendet werden, die nachweislich eine zusätzlich blutdrucksenkende Wirkung mit Telmisartan haben.
Reduktion des Risikos von Myokardinfarkt und Schlaganfall bei Patienten mit erhöhtem kardiovaskulärem Risiko und/oder Diabetes mellitus von Typ 2
Die empfohlene Dosis ist 80 mg einmal täglich. Es ist nicht bekannt, ob Dosierungen von unter 80 mg Telmisartan pro Tag zur Prävention von kardiovaskulärer Morbidität und Mortalität wirksam sind.
Es wird empfohlen, bei der Einleitung einer Telmisartan-Therapie zur Reduktion des Risikos von Myokardinfarkt und Schlaganfall bei Patienten mit erhöhtem kardiovaskulärem Risiko und/oder Diabetes mellitus von Typ 2 den Blutdruck zu überwachen; eventuell kann eine Anpassung von blutdrucksenkenden Arzneimitteln erforderlich sein.
Telmisartan Sandoz kann mit dem Essen oder nüchtern eingenommen werden.
Die Kombination von Telmisartan Sandoz mit folgenden anderen Antihypertensiva wurde untersucht und ist möglich: Hydrochlorothiazid, Amlodipin.
Falls der Patient vergessen hat, Telmisartan Sandoz einzunehmen, kann er die vergessene Dosis noch am gleichen Tag einnehmen. Ist dies nicht mehr möglich, nimmt er seine übliche Dosis am nächsten Tag (keine doppelte Dosis!).
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Für Patienten mit leicht bis mittelstark eingeschränkter Leberfunktion soll bei Behandlung der Hypertonie eine Tagesdosis von 40 mg nicht überschritten werden (siehe «Kontraindikationen»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit stark eingeschränkter Nierenfunktion oder Hämodialyse-Patienten liegen begrenzte Erfahrungen vor. Bei Patienten mit eingeschränkter Nierenfunktion ist keine Anpassung der Dosis notwendig.
Ältere Patienten
Eine Anpassung der Dosis ist nicht notwendig.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Telmisartan Sandoz bei Patienten unter 18 Jahren ist nicht geprüft worden.
Zurzeit vorliegende Daten werden in den Rubriken «klinische Wirksamkeit» und «Pharmakokinetik» beschrieben; eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Die Tabletten weisen eine Zierbruchrille auf. Diese ist nicht zur Dosisteilung geeignet.
Kontraindikationen·Zweites und drittes Schwangerschaftstrimenon (siehe «Schwangerschaft, Stillzeit»);
·Stillzeit (siehe «Schwangerschaft, Stillzeit»);
·starke Leberfunktionsstörungen, obstruktive Gallenwegserkrankungen, Cholestase;
·Überempfindlichkeit gegenüber dem Wirkstoff oder einem anderen Bestandteil von Telmisartan Sandoz;
·wie bei allen Angiotensin-II-Rezeptor-Blockern, wenn bei einer früheren Behandlung mit einem ACE-Hemmer oder Angiotensin-II-Rezeptor-Blocker ein angioneurotisches Ödem aufgetreten ist;
·Die gleichzeitige Anwendung von Telmisartan mit Aliskiren-haltigen Arzneimitteln ist bei Patienten mit Diabetes mellitus oder eingeschränkter Nierenfunktion (GFR < 60 ml/min/1,73 m2) kontraindiziert.
Warnhinweise und VorsichtsmassnahmenSchwangerschaft
Eine Behandlung mit Angiotensin-II-Rezeptor Blockern darf nicht während einer Schwangerschaft begonnen werden. Bei Patientinnen mit Schwangerschaftswunsch sollte eine Umstellung auf eine andere blutdrucksenkende Behandlung mit bewährtem Sicherheitsprofil für Schwangere erfolgen, es sei denn, eine Fortführung der Behandlung mit Angiotensin-II-Rezeptor-Blockern wird als unverzichtbar angesehen. Wird eine Schwangerschaft festgestellt, ist die Behandlung mit Angiotensin-II-Rezeptor-Blockern unverzüglich zu beenden und falls erforderlich eine andere Therapie einzuleiten.
Patienten mit Natriummangel und/oder Volumenmangel
Bei Patienten mit schwerem Natriummangel und/oder Volumenmangel (z.B. bei hochdosierter Diuretikatherapie, Durchfall und Erbrechen, salzarmer Diät) kann eine symptomatische Hypotonie nach Beginn der Behandlung mit Inhibitoren des Renin-Angiotensin-Systems auftreten. Ein Natrium- und/oder Volumendefizit sollte vor dem Beginn einer Behandlung mit Telmisartan Sandoz ausgeglichen werden. Wenn angebracht, sollte die diuretische Dosis zeitweilig reduziert werden.
Renovaskuläre Hypertonie
Patienten mit bilateraler Nierenarterienstenose oder Stenose der Nierenarterie bei Einzelniere, die mit Arzneimitteln, die das Renin-Angiotensin-Aldosteron-System beeinflussen, behandelt werden, haben ein erhöhtes Risiko einer schweren Hypotonie und Niereninsuffizienz.
Eingeschränkte Nierenfunktion und Nierentransplantation
Als Folge der Hemmung des Renin-Angiotensin-Aldosteron-Systems können Veränderungen der Nierenfunktion bei hierfür anfälligen Personen erwartet werden. Die periodische Kontrolle der Kalium- und Kreatinin-Serumspiegel wird empfohlen. Bisher liegen keine Erfahrungen bei der Behandlung von nierentransplantierten Patienten vor.
Telmisartan wird durch Hämofiltration nicht aus dem Blut eliminiert und ist nicht dialysierbar.
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
Es gibt Belege dafür, dass die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Blockern oder Aliskiren das Risiko für Hypotonie, Hyperkaliämie und eine Abnahme der Nierenfunktion (einschliesslich eines akuten Nierenversagens) erhöht. Eine duale Blockade des RAAS durch die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Blockern oder Aliskiren wird deshalb nicht empfohlen (siehe «Interaktionen»).
Wenn die Therapie mit einer dualen Blockade als absolut notwendig erachtet wird, sollte dies nur unter Aufsicht eines Spezialisten und unter Durchführung engmaschiger Kontrollen von Nierenfunktion, Elektrolytwerten und Blutdruck erfolgen.
ACE-Hemmer und Angiotensin-II-Rezeptor-Blocker sollten bei Patienten mit diabetischer Nephropathie nicht gleichzeitig angewendet werden.
Andere Zustände mit Stimulation des Renin-Angiotensin-Aldosteron-Systems
Bei Patienten, deren Gefässtonus und Nierenfunktion im Wesentlichen von der Aktivität des Renin-Angiotensin-Aldosteron-Systems abhängt (z.B. Patienten mit schwerer Herzinsuffizienz oder zugrunde liegender Nierenerkrankung einschliesslich Nierenarterienstenose), wurde eine Behandlung mit Arzneimitteln, die dieses System beeinflussen, mit akuter Hypotonie, Hyperazotämie, Oligurie oder in seltenen Fällen einem akuten Nierenversagen in Zusammenhang gebracht.
Primärer Aldosteronismus
Patienten mit primärem Aldosteronismus sprechen im Allgemeinen nicht auf Antihypertonika an, deren Wirkung auf der Hemmung des Renin-Angiotensin-Systems beruht. Daher wird die Anwendung von Telmisartan nicht empfohlen.
Aorten- und Mitralklappenstenose, obstruktive hypertrophe Kardiomyopathie
Wie bei anderen Vasodilatatoren ist bei Patienten mit Aorten- oder Mitralklappenstenose oder obstruktiver hypertropher Kardiomyopathie besondere Vorsicht angezeigt.
Hyperkaliämie
Während der Behandlung mit Arzneimitteln, die das Renin-Angiotensin-Aldosteron-System beeinflussen, kann eine Hyperkaliämie auftreten, insbesondere bei Patienten mit eingeschränkter Nierenfunktion und/oder Herzinsuffizienz. Eine adäquate Kontrolle des Serumkaliumspiegels wird bei Risikopatienten empfohlen.
Auf Erfahrung mit Arzneimitteln beruhend, die das Renin-Angiotensin-System beeinflussen, kann die gleichzeitige Verabreichung von kaliumsparenden Diuretika, Kaliumpräparaten, Kalium enthaltenden Salzersatzpräparaten, oder anderen Arzneimitteln, die eine Erhöhung des Kaliumspiegels verursachen können (Heparin, etc.), zu einem Anstieg des Serumkaliums führen und soll deswegen nur mit Vorsicht zusammen mit Telmisartan Sandoz erfolgen.
Eingeschränkte Leberfunktion
Telmisartan wird überwiegend über die Gallenflüssigkeit ausgeschieden. Bei Patienten mit obstruktiven Gallenfunktionsstörungen, Cholestase, oder schwerwiegender Leberinsuffizienz kann von einer reduzierten Clearance ausgegangen werden. Telmisartan Sandoz sollte bei diesen Patienten nicht angewendet werden (siehe «Kontraindikationen»). Bei leichter bis mittelschwerer Leberfunktionsstörung soll Telmisartan Sandoz nur mit Vorsicht angewendet werden.
Diabetes mellitus
Wie Post-hoc-Analysen von zwei Placebo-kontrollierten Telmisartan-Studien gezeigt haben, ist bei Patienten mit Diabetes mellitus, bei welchen in der Vorgeschichte weder eine koronare Herzkrankheit noch einen Myokardinfarkt bekannt ist und die keine Acetylsalicylsäure, keinen Beta-Blocker und keine Nitrate einnehmen, bei einer gleichzeitigen Behandlung mit Telmisartan das Risiko für fatale Myokardinfarkte und unerwartete kardiovaskuläre Todesfälle (Todesfälle, bei denen eine ischämische kardiovaskuläre Ursache vermutet aber nicht bestätigt wurde, die innerhalb 24 Stunden nach den ersten Symptomen auftraten und bei denen keine andere Ätiologie nachgewiesen wurde) erhöht (Hazard Ratio 3,25; 95%-Konfidenzintervall 1,38-7,65). Bei Patienten mit Diabetes mellitus kann die koronare Herzkrankheit asymptomatisch verlaufen und demzufolge nicht diagnostiziert sein. Daher sollten die Patienten mit Diabetes mellitus diesbezüglich diagnostisch untersucht und entsprechend behandelt werden, bevor eine Therapie mit Telmisartan Sandoz begonnen wird.
Ethnische Unterschiede
Wie bei Angiotensin-Converting-Enzym-Hemmern beobachtet, sind Angiotensin-Rezeptor-Blocker einschliesslich Telmisartan offensichtlich weniger wirksam bei Patienten mit dunkler Hautfarbe als bei Patienten ohne dunkle Hautfarbe. Dies beruht möglicherweise auf einer höheren Prävalenz niedriger Reninspiegel bei hypertensiven Patienten aus dieser Bevölkerungsgruppe.
Ischämische Herzkrankheit
Wie bei jedem blutdrucksenkenden Arzneimittel kann ein übermässiger Blutdruckabfall bei Patienten mit ischämischer Kardiopathie oder ischämischer kardiovaskulärer Erkrankung zu einem Myokardinfarkt oder Schlaganfall führen.
Lactose
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu «natriumfrei».
InteraktionenKeine klinisch relevante Interaktion wurde bei einer gleichzeitigen Anwendung von Telmisartan mit folgenden Substanzen festgestellt:
Hydrochlorothiazid, Glibenclamid, Ibuprofen, Paracetamol, Warfarin, Amlodipin und Simvastatin.
Andere Antihypertensiva
Telmisartan kann die blutdrucksenkende Wirkung von anderen Antihypertensiva verstärken.
Digoxin
Für Digoxin wurde ein 20%iger Anstieg (in einem Einzelfall ein 39%iger Anstieg) der niedrigsten mittleren Digoxinkonzentration im Plasma beobachtet, deshalb ist eine Überwachung der Digoxin-Plasmaspiegel zu erwägen.
Ramipril
In einer Studie führte die gleichzeitige Gabe von Telmisartan und Ramipril zu einem Anstieg um bis zum 2,5Fachen in der AUC0–24 und der Cmax von Ramipril und Ramiprilat. Die klinische Bedeutung dieser Beobachtung ist nicht bekannt, diese Kombination ist aus Sicherheitsgründen nur mit Vorsicht anzuwenden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Lithium
Ein reversibler Anstieg der Serumlithiumkonzentration und deren Toxizität wurde bei gleichzeitiger Verabreichung von Lithium und Angiotensin-Converting-Enzym-Hemmern berichtet. Einige Fälle wurden unter Angiotensin-II-Rezeptor-Blockern, einschliesslich Telmisartan, berichtet. Eine sorgfältige Kontrolle der Serumlithiumspiegel wird bei gleichzeitiger Anwendung empfohlen.
Arzneimittel, die den Kaliumspiegel erhöhen oder eine Hyperkaliämie auslösen können
Kaliumsparende Diuretika, Kaliumpräparate, Salzersatzpräparate oder andere Medikamente wie Heparin können den Kaliumspiegel erhöhen. Diese Wirkung kann durch Telmisartan, welches das Renin-Angiotensin-System beeinflusst, verstärkt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nichtsteroidale Antirheumatika (NSAR)
Die Behandlung mit nichtsteroidalen Antirheumatika (d.h. Acetylsalicylsäure in anti-inflammatorischen Dosierungen, COX-2-Hemmer und nicht-selektive NSAR) wurde mit dem Risiko einer akuten Niereninsuffizienz bei dehydrierten Patienten in Verbindung gebracht. Substanzen wie Telmisartan, welche das Renin-Angiotensin-System beeinflussen, können synergistische Wirkungen aufweisen. Patienten, die nichtsteroidale Antirheumatika und Telmisartan Sandoz erhalten, sollten ausreichend hydriert sein und die Nierenfunktion sollte zu Beginn der Kombinationstherapie untersucht werden.
Durch Hemmung der vasodilatierenden Prostaglandine wurde eine reduzierte Wirkung der blutdrucksenkenden Arzneimittel wie Telmisartan während einer Kombinationstherapie mit nichtsteroidalen Antirheumatika beobachtet.
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
Es gibt Belege dafür, dass die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Blockern oder Aliskiren das Risiko für Hypotonie, Hyperkaliämie und eine Abnahme der Nierenfunktion (einschliesslich eines akuten Nierenversagens) erhöht. Eine duale Blockade des RAAS durch die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Blockern oder Aliskiren wird deshalb nicht empfohlen.
Wenn die Therapie mit einer dualen Blockade als absolut notwendig erachtet wird, sollte dies nur unter Aufsicht eines Spezialisten und unter Durchführung engmaschiger Kontrollen von Nierenfunktion, Elektrolytwerten und Blutdruck erfolgen.
ACE-Hemmer und Angiotensin-II-Rezeptor-Blocker sollten bei Patienten mit diabetischer Nephropathie nicht gleichzeitig angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft, StillzeitSchwangerschaft
In präklinischen Studien mit Telmisartan gibt es keine Hinweise auf eine teratogene Wirkung. Sie haben jedoch eine Fetotoxizität ergeben.
Es liegen keine ausreichenden Angaben über die Anwendung von Telmisartan bei Schwangeren vor.
Es ist bekannt, dass Angiotensin-II-Rezeptor-Blocker im zweiten und dritten Schwangerschaftsdrittel für den menschlichen Fetus (Abnahme der Nierenfunktion, Oligohydramnion, Verzögerung der Schädelverknöcherung) und das Neugeborene (Nierenversagen, Hypotonie, Hyperkaliämie) toxisch sind.
Die Anwendung von Angiotensin-II-Rezeptor-Blockern im zweiten und dritten Schwangerschaftsdrittel ist kontraindiziert.
Die Anwendung von Angiotensin-II-Rezeptor-Blockern im ersten Schwangerschaftstrimesters wird nicht empfohlen und sollte nicht während der Schwangerschaft begonnen werden. Tritt eine Schwangerschaft ein, ist die Behandlung mit Angiotensin-II-Rezeptor-Blockern unverzüglich zu beenden und falls erforderlich, eine andere Therapie einzuleiten.
Sofern ein Fortsetzen der Behandlung mit Angiotensin-II-Rezeptor-Blockern nicht als zwingend notwendig erachtet wird, sollten Patientinnen mit Kinderwunsch auf eine andere antihypertensive Therapie mit bewährtem Sicherheitsprofil für Schwangere umgestellt werden.
Wenn ab dem zweiten Schwangerschaftsdrittel eine Exposition gegenüber Angiotensin-II-Rezeptor-Blockern erfolgt ist, wird empfohlen, eine Ultraschallkontrolle der Nierenfunktion und des Schädels durchzuführen.
Säuglinge, deren Mütter Angiotensin-II-Rezeptor-Blocker eingenommen haben, sollten engmaschig auf Hypotonie überwacht werden.
Stillzeit
Telmisartan ist in der Stillzeit kontraindiziert, da nicht bekannt ist, ob Telmisartan beim Menschen in die Muttermilch ausgeschieden wird. In Tierstudien wurde eine Ausscheidung in die Muttermilch festgestellt.
Fertilität
Es wurden keine Studien zur Fertilität beim Menschen durchgeführt.
In präklinischen Studien waren keine Auswirkungen von Telmisartan auf die männliche oder weibliche Fertilität zu beobachten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Es sollte jedoch berücksichtigt werden, dass bei einer antihypertensiven Therapie gelegentlich Schwindel oder Ohnmacht auftreten und daher das Lenken von Fahrzeugen und Bedienen von Maschinen beeinträchtigt sein kann.
Unerwünschte WirkungenDie Häufigkeit unerwünschter Wirkungen war nicht dosisbezogen und korrelierte nicht mit Geschlecht, Alter oder Rasse der Patienten.
In den kontrollierten klinischen Studien mit Patienten, die aufgrund einer Hypertonie behandelt wurden, war die Gesamtinzidenz der unerwünschten Ereignisse von Telmisartan vergleichbar mit Placebo.
Das Sicherheitsprofil von Telmisartan bei Patienten, die am ONTARGET-Studien-Programm mit mehr als 31'000 Patienten teilgenommen haben, entsprach demjenigen bei hypertonen Patienten.
Die unten angegebenen unerwünschten Arzneimittelwirkungen entstammen kontrollierten klinischen Prüfungen mit Patienten, die aufgrund einer Hypertonie behandelt wurden, und Post-Marketing-Berichten. In der Auflistung sind auch schwere unerwünschte Wirkungen und unerwünschte Wirkungen, die zu einem Therapieabbruch führten, berücksichtigt, die in drei klinischen Langzeitstudien gemeldet wurden. In diese Studien waren 21'642 Patienten eingeschlossen, die über bis zu sechs Jahre mit Telmisartan behandelt wurden.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
«sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000)
Bei unerwünschten Wirkungen, welche nicht in klinischen Studien sondern nach der Markteinführung spontan gemeldet wurden, ist die Häufigkeit nicht bekannt.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektion der oberen Atemwege, Harnwegsinfektion, Zystitis.
Selten: Septische Bilder, auch mit tödlichem Ausgang.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Anämie.
Selten: Thrombozytopenie, Eosinophilie.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeit, anaphylaktische Reaktion.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Hyperkaliämie.
Selten: Hypoglykämie (bei Diabetikern), Hyponatriämie.
Psychiatrische Erkrankungen
Gelegentlich: Schlaflosigkeit, Depression.
Selten: Angstgefühle.
Erkrankungen des Nervensystems
Gelegentlich: Synkope/Ohnmacht.
Augenerkrankungen
Selten: Sehstörungen.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Vertigo.
Herzerkrankungen
Gelegentlich: Hypotonie (einschliesslich orthostatischer Hypotonie), Bradykardie.
Selten: Tachykardie.
Gefässerkrankungen
Gelegentlich: Hypotonie (einschliesslich orthostatischer Hypotonie).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Abdominale Schmerzen, Diarrhoe, Dyspepsie, Blähungen, Erbrechen.
Selten: Mundtrockenheit, Magenbeschwerden.
Leber- und Gallenerkrankungen
Selten: abnorme Leberfunktion/ Lebererkrankung.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Hyperhidrosis, Juckreiz, Rash.
Selten: Ekzem, Erythem, Arzneimittelexanthem, Angioödem (mit tödlichem Ausgang), toxisches Hautexanthem, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Myalgie, Muskelkrämpfe (Wadenkrämpfe), Rückenschmerzen.
Selten: Arthralgien, Schmerzen in den Extremitäten (Schmerzen im Bein), Sehnenschmerz (Tendinitis-ähnliche Symptome).
Erkrankungen der Nieren und Harnwege
Gelegentlich: Nierenbeeinträchtigung einschliesslich eines akuten Nierenversagens.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Brustschmerzen, Asthenie (Schwäche).
Selten: Grippeähnliche Erkrankung.
Untersuchungen
Gelegentlich: Erhöhte Blutwerte von Kreatinin.
Selten: Erhöhte Blutwerte von Harnsäure, Leberenzymen oder Kreatinphosphokinase, reduzierte Hämoglobinwerte.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungZu Überdosierungen beim Menschen liegen begrenzte Erfahrungen vor.
Anzeichen und Symptome
Bei einer Telmisartan-Überdosierung waren die wichtigsten Ereignisse Hypotonie und Tachykardie; Bradykardie kam ebenfalls vor.
Therapie
Im Falle einer symptomatischen Hypotonie sollte eine unterstützende Behandlung durchgeführt werden. Telmisartan kann nicht durch Hämodialyse entfernt werden und ist nicht dialysierbar.
Eigenschaften/WirkungenATC-Code
C09CA07
Wirkungsmechanismus
Telmisartan ist ein oral wirksamer und spezifischer Angiotensin-II-Rezeptor-Blocker (Typ AT1). Telmisartan verdrängt Angiotensin-II mit hoher Affinität von seiner Bindungsstelle am AT1-Rezeptor-Subtyp, der für die bekannten Wirkungen von Angiotensin-II verantwortlich ist. Telmisartan zeigt am AT1-Rezeptor keine partielle Wirkung als Agonist. Es zeigt keine relevante Affinität zu anderen Rezeptoren. Es tritt keine Hemmung des humanen Plasmarenins oder eine Blockade von Ionenkanälen auf. Telmisartan inhibiert nicht das Angiotensin Converting Enzym (Kininase-II), das auch Bradykinin abbaut.
In klinischen Prüfungen war die Inzidenz von trockenem Husten bei Patienten, die mit Telmisartan behandelt wurden, wesentlich seltener als bei Patienten, die mit ACE-Inhibitoren behandelt wurden. Die Inzidenz von trockenem Husten bei Patienten, die Telmisartan erhielten, war vergleichbar mit der in der Placebogruppe.
Pharmakodynamik
Behandlung der leichten bis mittelschweren Hypertonie
Beim Menschen inhibiert eine Dosis von 80 mg Telmisartan fast vollständig den durch Angiotensin-II hervorgerufenen Blutdruckanstieg. Der inhibitorische Effekt wird über 24 Stunden aufrechterhalten und ist auch nach 48 Stunden noch messbar.
Nach der Initialgabe tritt die antihypertensive Wirkung allmählich innerhalb von 3 Stunden ein. Die maximale Blutdrucksenkung wird im Allgemeinen 4–8 Wochen nach Therapiebeginn erreicht und bei Langzeittherapie aufrechterhalten.
Wie durch Langzeit-Blutdruckmessungen festgestellt wurde, hält die antihypertensive Wirkung konstant über 24 Stunden an und schliesst auch die letzten 4 Stunden vor der nächsten Verabreichung ein. In placebo-kontrollierten klinischen Studien wird das durch Trough to Peak Ratios von einheitlich über 80% nach Gabe von 40 und 80 mg Telmisartan bestätigt.
Telmisartan senkt bei Patienten mit Hypertonie den systolischen und diastolischen Blutdruck, ohne die Pulsfrequenz zu beeinflussen. Nach Absetzen von Telmisartan kehrt der Blutdruck über einen Zeitraum von mehreren Tagen allmählich zu den Ausgangswerten zurück. Es gibt keine Anhaltspunkte für eine überschiessende Blutdruckreaktion nach Absetzen (Rebound).
In klinischen Studien bei Patienten mit Hypertonie und Linksherzhypertrophie konnte gezeigt werden, dass die Telmisartan-Behandlung mit einer statistisch signifikanten Minderung der linksventrikulären Masse und des linksventrikulären Massenindexes assoziiert ist.
Reduktion des Risikos von Myokardinfarkt und Schlaganfall bei Patienten mit erhöhtem kardiovaskulären Risiko und/oder Diabetes mellitus von Typ 2
Klinische Wirksamkeit
In der ONTARGET Studie, einer randomisierten, doppel-blinden, klinischen Vergleichs-Studie gegen den ACE-Hemmer Ramipril, erwies sich der Angiotensin-II-Rezeptor-Blocker Telmisartan zur Reduktion des primären kombinierten Endpunktes (kardiovaskuläre Mortalität, akuter Myokardinfarkt, Schlaganfall und Hospitalisation wegen Herzinsuffizienz) und mehreren vorab festgelegte sekundären Endpunkte als ebenso wirksam wie Ramipril bei gleichzeitig besserer Verträglichkeit und Therapiecompliance.
Für die in ONTARGET getestete Gesamtpatientenpopulation liess sich durch eine Kombination der beiden Medikamente keine weitere Abnahme der kardiovaskulären Ereignisse erreichen, jedoch verändert sich das Nebenwirkungsprofil ungünstig, weshalb die Anwendung einer Kombination aus Telmisartan und Ramipril in dieser Population nicht empfohlen wird.
In der Studie wurden weltweit 25'620 kardiovaskuläre Risikopatienten mit normalem oder gut eingestelltem Blutdruck über einen Beobachtungszeitraum von durchschnittlich 56 Monaten untersucht.
Während der Screeningphase und einer 28-tägigen «single blind run in phase» wurden ACE-Hemmer intolerante Patienten herausgefiltert und die verbleibenden Patienten anschliessend in einen der drei folgenden Behandlungsarme randomisiert:
·8576 Patienten erhielten Ramipril 10 mg
·8542 Patienten erhielten Telmisartan 80 mg
·8502 Patienten erhielten die Kombinationstherapie
Die untersuchte Population bestand zu 73% aus Männern, 83% der Patienten waren Hypertoniker. Ein Grossteil der Patienten hatte bereits vor Studienbeginn eine Therapie mit TC-Aggregationshemmern (80%), Statinen (62%), Betablockern (57%), Diuretika (28%), Calcium-Blockern (33%).
Die niedrige «lost to follow up» - Rate (0,19% = 48 aus 25'620 Patienten) zeigt die hohe Qualität der Studienergebnisse.
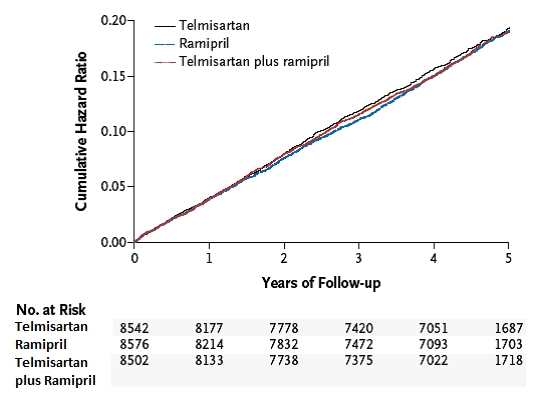
Die parallel laufende TRANSCEND Studie untersuchte die Risikoreduktion desselben primären kombinierten Endpunktes durch Telmisartan 80 mg versus Standardtherapie, welche während des Studienverlaufs angepasst werden durfte, an 5926 Risikopatienten, die sich lediglich durch eine ACE-Hemmer Intoleranz und einen hohen Frauenanteil von 43% von der ONTARGET Population unterschieden.
Die Analyse ergab, dass sich, trotz optimierter Standardtherapie, eine Risikoreduktion bezüglich der untersuchten Endpunkte von 8% durch den Einsatz von Telmisartan erzielen liess.
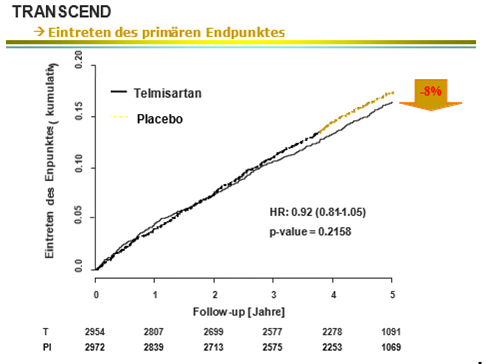
T. Telmisartan / Pl: Placebo
PharmakokinetikAbsorption
Telmisartan wird mit einem medianen tmax von 1 Stunde resorbiert. Die resorbierte Menge variiert inter- und intraindividuell. Nach einer Dosis von 80 mg werden Plasmaspitzen von 160 µg/ml bei Männern und 440 µg/ml bei Frauen erreicht (Cmax). Obwohl die Plasmakonzentrationen bei den Frauen 2–3-mal höher lagen als bei den Männern, wurde weder die Wirksamkeit noch die Sicherheit relevant beeinflusst. Die mittlere absolute Bioverfügbarkeit von Telmisartan beträgt nach 40 mg 42% und nach 160 mg 57% (95% Vertrauensintervall 32–57, resp. 51–65%).
Wird Telmisartan zusammen mit Nahrung eingenommen, so verringert sich die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC0–unendlich) von Telmisartan leicht zwischen etwa 6% (Dosis 40 mg) und etwa 19% (Dosis 160 mg). Drei Stunden nach Verabreichung sind die Plasmakonzentrationen ähnlich, unabhängig davon, ob Telmisartan nüchtern oder zusammen mit Nahrung eingenommen wurde.
Diese geringe Abnahme der AUC beeinflusst die therapeutische Wirksamkeit nicht.
Die maximale Plasmakonzentration (Cmax) und, weniger ausgeprägt, die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) steigen bei Dosierungen über 40 mg nicht proportional mit der Dosis an. Für eine klinisch relevante Kumulation von Telmisartan in einer Dosierung bis zu 160 mg/Tag gibt es keinen Hinweis.
Distribution
Telmisartan wird stark an Plasmaproteine, vor allem Albumin und saures Alpha-1-Glykoprotein gebunden (>99,5%). Das Verteilungsvolumen im steady state (Vdss) beträgt etwa 500 l.
Metabolismus
Telmisartan wird glucuronidiert. Für den Metaboliten ist keine pharmakologische Wirkung gezeigt worden.
Elimination
Telmisartan ist durch eine biexponentielle Abbaukinetik charakterisiert, mit einer terminalen Eliminationshalbwertszeit von >20 Stunden (t½ term.).
Telmisartan wird nach oraler (und intravenöser) Gabe fast ausschliesslich mit den Faeces ausgeschieden, vorwiegend als unveränderte Verbindung. Die kumulative Ausscheidung mit dem Harn beträgt weniger als 1% der Dosis. Verglichen mit der Leberdurchblutung (etwa 1500 ml/Min.) ist die Plasma-Clearance (Cltot) (etwa 1000 ml/Min.) hoch.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche
Die Pharmakokinetik von zwei Dosen Telmisartan wurde bei hypertensiven Patienten (n = 57) im Alter von 6 bis < 18 Jahren nach der Einnahme von Telmisartan 1 mg/kg oder 2 mg/kg über einen vierwöchigen Behandlungszeitraum als zweites Ziel untersucht. Zu den pharmakokinetischen Zielen gehörten die Bestimmung des Steady-state von Telmisartan bei Kindern und Jugendlichen sowie die Untersuchung altersbedingter Unterschiede. Obwohl die Studie für eine aussagekräftige Beurteilung der Pharmakokinetik von Kindern unter 12 Jahren zu klein war, stimmen die Ergebnisse im Allgemeinen mit den Ergebnissen bei Erwachsenen überein und bestätigen die Nichtlinearität von Telmisartan, insbesondere für Cmax.
Leberfunktionsstörungen
Pharmakokinetische Studien bei Patienten mit eingeschränkter Leberfunktion zeigten einen Anstieg der absoluten Bioverfügbarkeit bis nahezu 100% (Cmax + AUC erhöht), (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen»). Dagegen ist die Eliminationshalbwertszeit nahezu unverändert.
Nierenfunktionsstörungen
Bei Patienten mit dialysepflichtiger Niereninsuffizienz wurden geringere Plasmakonzentrationen beobachtet. Die Plasmaproteinbindung von Telmisartan bei niereninsuffizienten Patienten ist unverändert hoch und die Substanz kann nicht durch Hämodialyse entfernt werden.
Geschlecht
Es wurden unterschiedliche Plasmakonzentrationen beobachtet. Bei Frauen beträgt die Cmax etwa das Dreifache, die AUC etwa das Doppelte des entsprechenden Werts bei Männern; es wurde jedoch kein relevanter Einfluss dieses Unterschieds auf die Wirksamkeit festgestellt.
Ältere Patienten
Es bestehen keine Unterschiede in der Pharmakokinetik von Telmisartan zwischen jüngeren und älteren Patienten.
Präklinische DatenEs gibt keine Hinweise auf Mutagenität und relevante klastogene Aktivität in in-vitro Untersuchungen und keinen Hinweis auf Kanzerogenität an Ratten und Mäusen.
Es gibt keine klaren Hinweise eines teratogenen oder embryotoxischen Potenzials für Telmisartan. In toxischen Dosen deuten jedoch tierexperimentelle Untersuchungen auf ein gewisses Risikopotenzial von Telmisartan für die fötale Entwicklung (erhöhte Anzahl von Spätresorptionen in Kaninchen) und für die postnatale Entwicklung der Nachkommen hin: niedrigeres Körpergewicht, verzögertes Öffnen der Augen, höhere Mortalität.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, bei Raumtemperatur (15-25°C), vor Feuchtigkeit geschützt und ausser Reichweite von Kindern lagern.
Zulassungsnummer62466 (Swissmedic)
PackungenTelmisartan Sandoz 40 mg: Packungen zu 28 und 98 Tabletten (Zierbruchrille). [B]
Telmisartan Sandoz 80 mg: Packungen zu 28 und 98 Tabletten (Zierbruchrille). [B]
ZulassungsinhaberinSandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz
Stand der InformationJanuar 2023
|


