ZusammensetzungWirkstoffe
Dexlansoprazol.
Hilfsstoffe
Color: Indigotinum (E 132); excip. pro capsula.
Indikationen/AnwendungsmöglichkeitenDexilant ist indiziert bei Erwachsenen und Jugendlichen ab 12 Jahren:
·für die Heilung der erosiven Ösophagitis.
·zur Erhaltungstherapie der abgeheilten erosiven Ösophagitis und Linderung bei Magenbrennen.
·für die kurzzeitige Behandlung von Sodbrennen und saurem Aufstossen bei symptomatischer nicht-erosiver gastroösophagealer Refluxkrankheit (GORD).
Dosierung/AnwendungErwachsene und Jugendliche ab 12 Jahren
Heilung der erosiven Ösophagitis
Die empfohlene Dosis beträgt 60 mg einmal täglich über 4 Wochen. Bei Patienten, die innerhalb dieses Zeitraums nicht vollständig geheilt sind, kann die Behandlung mit der gleichen Dosis für weitere 4 Wochen fortgesetzt werden.
Erhaltungstherapie der abgeheilten erosiven Ösophagitis und Linderung bei Magenbrennen
Wird eine verlängerte Suppression der Säurebildung benötigt, beträgt die empfohlene Dosis 30 mg einmal täglich.
Therapiedauer:
·Erwachsene: bis zu 6 Monate
·Jugendliche ab 12 Jahren: bis zu 4 Monate
Behandlung der symptomatischen nicht-erosiven gastroösophagealen Refluxkrankheit (GORD)
Nach Ausschluss einer Ösophagitis beträgt die empfohlene Dosis 30 mg einmal täglich für bis zu 4 Wochen. Bei Persistenz der Symptome nach 4 Wochen sind weitere Untersuchungen angezeigt.
Art der Anwendung
Zur oralen Anwendung.
Die Kapseln mit veränderter Wirkstofffreisetzung sollten ganz und mit Flüssigkeit geschluckt werden. Sie können mit oder ohne Nahrung eingenommen werden (siehe «Pharmakokinetik»).
Die Kapseln können zur Verabreichung auch geöffnet und das Granulat mit einem Esslöffel Apfelmus vermengt werden. Nach Zubereitung der Mischung sollte das Arzneimittel umgehend verabreicht werden.
Das Granulat sollte nicht gekaut werden.
Spezielle Dosierungsanweisungen
Kinder unter 12 Jahren
Sicherheit und Wirksamkeit von Dexilant wurden bei Kindern unter 12 Jahren nicht untersucht. Eine Anwendung in dieser Altersgruppe wird daher nicht empfohlen.
Ältere Patienten
Sicherheit und Wirksamkeit unterschieden sich nicht in relevanter Weise zwischen älteren und jüngeren Patienten. Bei älteren Patienten ist keine Dosisanpassung notwendig (siehe «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung notwendig. Bei Patienten mit moderater Leberfunktionsstörung sollte eine tägliche Maximaldosis von 30 mg nicht überschritten werden. Bei Patienten mit schwerer Leberfunktionsstörung wurden keine Studien durchgeführt (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung notwendig (siehe «Pharmakokinetik»).
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenMaligne Erkrankungen von Magen und Ösophagus
Vor der Anwendung von Dexilant sollte ein möglicher maligner Magentumor ausgeschlossen werden, da Dexlansoprazol die Symptome verdecken und die Diagnose verzögern kann. Ebenso sollten vor Behandlung einer Refluxösophagitis maligne Erkrankungen des Ösophagus ausgeschlossen werden.
Gastrointestinale Infektionen
Eine verminderte Menge an Magensäure steigert im Magen die Keimzahl der physiologischerweise im Magen-Darm-Trakt vorhandenen Bakterien. Eine Behandlung mit Protonenpumpenhemmern (PPIs) kann dadurch zu einem leicht erhöhten Risiko für gastrointestinale Infektionen z.B. durch Salmonellen, Campylobacter und Clostridium difficile führen.
Hypomagnesiämie
Bei Patienten, die mit PPIs wie Dexlansoprazol für mindestens 3 Monate (in den meisten Fällen aber für 1 Jahr) behandelt wurden, gab es Berichte über eine schwere Hypomagnesiämie. Schwere Manifestationsformen einer Hypomagnesiämie wie Müdigkeit, Schwindel, Krämpfe, Tetanie, Delirium und ventrikuläre Arrhythmien können auftreten. Sie können schleichend beginnen und übersehen werden. Bei den meisten der betroffenen Patienten besserte sich die Hypomagnesiämie nach Absetzen des PPI und Zufuhr von Magnesium.
Bei Patienten mit voraussichtlicher längerer Behandlungsdauer oder bei Patienten, die PPIs gleichzeitig mit Arzneimitteln wie Digoxin oder Arzneimitteln, die Hypomagnesiämie verursachen können (z.B. Diuretika), einnehmen, sollte eine Überwachung der Magnesiumspiegel vor sowie regelmässig nach Behandlungsbeginn mit PPIs in Erwägung gezogen werden (siehe «Dosierung/Anwendung»).
Vitamin B12-Absorption
Die tägliche Behandlung mit säureunterdrückenden Arzneimitteln über einen längeren Zeitraum (mehrere Jahre) kann durch Hypo- oder Achlorhydrie eine Malabsorption von Cyanocobalamin (Vitamin B12) verursachen. Ein Cyanocobalamin-Mangel sollte in Betracht gezogen werden bei Patienten mit pathologischen Hypersekretionserkrankungen, die eine langfristige Behandlung erfordern, bei Personen mit vermindertem Körperspeicher oder mit Risikofaktoren für eine reduzierte Vitamin-B12-Resorption (wie ältere Menschen) während einer Langzeittherapie oder wenn relevante klinische Symptome beobachtet werden.
Knochenfrakturen
PPIs können, vor allem wenn sie in hohen Dosen und über einen langen Zeitraum (> 1 Jahr) angewendet werden, das Risiko für Hüft-, Handgelenks- und Wirbelsäulenfrakturen leicht erhöhen, insbesondere bei älteren Patienten oder bei Vorliegen anderer bekannter Risikofaktoren. Beobachtungsstudien deuten darauf hin, dass PPIs das allgemeine Risiko für Frakturen um 10-40% erhöhen können. Ein Teil dieses Anstiegs kann durch andere Risikofaktoren verursacht werden. Patienten mit Osteoporoserisiko sollen gemäss den aktuellen klinischen Richtlinien behandelt und ausreichend mit Calcium und Vitamin D versorgt werden.
Schwere kutane Arzneimittelreaktionen
Schwere kutane Arzneimittelreaktionen (SCAR) wie das Stevens-Johnson-Syndrom (SJS), toxische epidermale Nekrolyse (TEN), Arzneimittelexanthem mit Eosinophilie und systemischen Manifestationen (DRESS), akute generalisierte exanthematöse Pustulosis (AGEP) und Erythema multiforme wurden bei Patienten unter Behandlung mit Dexlansoprazol und anderen PPIs berichtet (siehe «Unerwünschte Wirkungen»). Dexlansoprazol ist bei den ersten Anzeichen oder Symptomen von schweren kutanen Arzneimitteleaktionen oder anderen Anzeichen von Hypersensitivität abzusetzen und weitere Untersuchungen sind in Betracht zu ziehen.
Subakuter kutaner Lupus erythematodes (SCLE)
PPIs sind in sehr seltenen Fällen mit dem Auftreten eines subakuten kutanen Lupus erythematodes (SCLE) assoziiert. Falls Läsionen, insbesondere an den der Sonne ausgesetzten Hautbereichen, auftreten, und falls dies von einer Arthralgie begleitet ist, sollte der Patient umgehend ärztliche Hilfe in Anspruch nehmen, und das medizinische Fachpersonal sollte erwägen, Dexilant abzusetzen. SCLE nach vorheriger Behandlung mit einem PPI kann das Risiko eines SCLE unter Einnahme anderer PPI's erhöhen.
Interstitielle Nephritis
Unter Anwendung von PPIs wurde über Fälle einer akuten interstitiellen Nephritis berichtet, welche vermutlich im Sinne einer Hypersensitivitätsreaktion zu interpretieren sind. Falls eine interstitielle Nephritis auftritt, sollte das Präparat abgesetzt werden.
Methotrexat
Wenn PPIs zusammen mit Methotrexat verabreichert werden, wurde bei einigen Patienten über eine Erhöhung der Methotrexat-Spiegel berichtet. Bei hohen Methotrexat-Dosen kann ein vorübergehender Unterbruch der Dexlansoprazol-Gabe in Betracht gezogen werden.
Langzeitbehandlung
Über eine Behandlungsdauer von mehr als einem Jahr liegen nur limitierte Daten vor. Daher sollte in einem solchen Fall eine sorgfältige Risiko-Nutzen-Analyse und eine regelmässige Überprüfung der Behandlung durchgeführt werden.
Leberfunktionsstörungen
Dexlansoprazol sollte bei Patienten mit moderater oder schwerer Leberfunktionsstörung mit Vorsicht angewendet werden (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
Einfluss auf labortechnische Untersuchungen
Während der Behandlung mit säurehemmenden Arzneimitteln steigen Serumgastrin und Chromogranin A (CgA) als Reaktion auf die verminderte Säuresekretion an. Der erhöhte CgA-Spiegel kann mit Untersuchungen bei neuroendokrinen Tumoren interferieren. In der Literatur wird erwähnt, dass eine Behandlung mit einem PPI 5 bis 14 Tage vor der CgA-Bestimmung, die im Rahmen einer Abklärung oder einer Verlaufskontrolle bei neuroendokrinen Tumoren durchgeführt wird, unterbrochen werden sollte, da sich die iatrogen erhöhten CgA-Spiegel innerhalb von 5 bis 14 Tagen – selten auch länger – normalisieren. Die Bestimmung sollte wiederholt werden, wenn die CgA-Spiegel nach diesem Intervall noch zu hoch sind.
Zuckerintoleranz
Da Dexilant Saccharose enthält, sollten Patienten mit seltenen erblichen Problemen von Fructoseintoleranz, Glucose-Galaktose-Malabsorption oder Sucrase-Isomaltase-Insuffizienz dieses Arzneimittel nicht einnehmen.
InteraktionenInteraktionsstudien wurden nur bei Erwachsenen durchgeführt.
Wirkung anderer Arzneimittel auf Dexlansoprazol
Es wurde eine Beteiligung von CYP2C19 und CYP3A4 am Metabolismus von Dexlansoprazol aufgezeigt.
CYP2C19-Inhibitoren
Hemmer von CYP2C19 (wie Fluvoxamin) würden die systemische Verfügbarkeit von Dexlansoprazol voraussichtlich erhöhen, daher sollte eine Dosisreduktion von Dexlansoprazol erwogen werden.
CYP2C19- und CYP3A4-Induktoren
Enzyminduktoren wie Rifampicin und Johanniskraut (Hypericum perforatum), die CYP2C19 und CYP3A4 beeinflussen, können die Plasmakonzentration von Dexlansoprazol verringern.
Andere
Sucralfat/Antazida
Sucralfat/Antazida können die Bioverfügbarkeit von Dexlansoprazol verringern. Daher sollte Dexlansoprazol mindestens 1 Stunde nach Einnahme dieser Arzneimittel eingenommen werden.
Wirkung von Dexlansoprazol auf andere Arzneimittel
Arzneimittel mit pH-abhängiger Resorption
Dexlansoprazol kann die Resorption von Arzneimitteln, bei denen der gastrische pH-Wert von wesentlicher Bedeutung für die Bioverfügbarkeit ist, beeinflussen. Dies gilt insbesondere für:
·HIV-Protease-Inhibitoren: Die gleichzeitige Einnahme von Dexlansoprazol und HIV-Proteasehemmern, deren Resorption von einem niedrigen pH-Wert im Magen abhängt, wie Atazanavir und Nelfinavir, wird nicht empfohlen, da dies ihre Bioverfügbarkeit deutlich verringert. In einer Studie führte die gleichzeitige Verabreichung von Lansoprazol mit Atazanavir bei gesunden Freiwilligen zu einer erheblichen Verringerung der Atazanavir-Verfügbarkeit. Gleiche Wirkungen würde man auch bei Dexlansoprazol erwarten.
·Azol-Antimykotika: Die Resorption von Itraconazol und Posaconazol aus dem Magen-Darm-Trakt wird durch das Vorhandensein von Magensäure gesteigert. Die Verabreichung von Dexlansoprazol kann zu subtherapeutischen Konzentrationen von Itraconazol und Posaconazol führen, und eine Kombination sollte vermieden werden.
·Erlotinib: Die Resorption von Erlotinib aus dem Gastrointestinaltrakt wird durch Magensäure verstärkt. Die Gabe von Dexlansoprazol kann daher zu subtherapeutischen Erlotinib-Konzentrationen führen, und die kombinierte Gabe mit Dexlansoprazol sollte vermieden werden.
·Digoxin: Die gleichzeitige Verabreichung von Dexlansoprazol kann zu einer erhöhten Resorption von Digoxin und damit zu erhöhten Digoxin-Plasmaspiegeln führen. Die Digoxin-Plasmaspiegel sollten daher zu Beginn und bei Beendigung der Dexlansoprazol-Behandlung überwacht und die Digoxin-Dosis, falls erforderlich, angepasst werden.
Arzneimittel, die durch P450 Enzyme metabolisiert werden
In-vitro-Studien zeigten, dass Dexlansoprazol die CYP Isoforme 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 2E1 oder 3A4 wahrscheinlich nicht hemmt. Daher werden keine klinisch relevanten Interaktionen mit Arzneimitteln, die durch diese CYP Enzyme metabolisiert werden, erwartet. Zusätzlich zeigten in-vivo-Studien, dass Dexlansoprazol keine Auswirkung auf die Pharmakokinetik von gleichzeitig verabreichten Einzeldosen von Phenytoin (CYP2C9 Substrat) oder Theophyllin (CYP1A2 Substrat) hatte. Die CYP1A2 Genotypen der Probanden wurden bei der Interaktionsstudie mit Theophyllin nicht bestimmt. Obwohl in-vitro-Studien aufzeigten, dass Dexlansoprazol das Potenzial hat, CYP2C19 zu hemmen, zeigte eine in-vivo-Interaktionsstudie bei hauptsächlich CYP2C19 extensiven und intermediären Metabolisierern, dass Dexlansoprazol die Pharmakokinetik von Diazepam (CYP2C19 Substrat) nicht beeinflusst.
Lansoprazol könnte die Plasmakonzentrationen von Arzneimitteln erhöhen, die über CYP3A4 metabolisiert werden. Vorsicht ist geboten, wenn Dexlansoprazol mit Wirkstoffen kombiniert wird, die über dieses Enzym metabolisiert werden und eine enge therapeutische Breite haben.
Tacrolimus
Die gleichzeitige Verabreichung von Dexlansoprazol kann, insbesondere bei Transplantatempfängern, die intermediäre bis schlechte Metabolisierer von CYP2C19 sind, die Plasmakonzentrationen von Tacrolimus (einem CYP3A- und P-Glycoprotein [P-gp]-Substrat) erhöhen. Eine Überwachung der Tacrolimus-Plasmakonzentrationen wird empfohlen, wenn eine gleichzeitige Behandlung mit Dexlansoprazol begonnen oder beendet wird.
Vitamin K Antagonisten
In einer Studie zeigte eine gleichzeitige Verabreichung von Dexlansoprazol und Warfarin keine signifikanten Unterschiede in der Pharmakokinetik von Warfarin oder der International Normalised Ratio (INR) im Vergleich zur Verabreichung von Warfarin mit Placebo. Trotzdem gab es Berichte über eine erhöhte INR und Prothrombinzeit bei Patienten, die gleichzeitig PPIs und Warfarin erhielten. Bei Patienten, die gleichzeitig mit PPI und Warfarin behandelt werden, könnte deshalb eine Überwachung hinsichtlich Erhöhungen des INR und der Prothrombinzeit angezeigt sein.
Für Acenocoumarol und Phenprocoumon stehen keine entsprechenden Daten zur Verfügung. Auch bei diesen Substanzen sollte beim Beginn oder beim Absetzen der Behandlung der INR kontrolliert werden.
Clopidogrel
In einer Studie führte die gleichzeitige Verabreichung von Dexlansoprazol (60 mg einmal täglich) und Clopidogrel (75 mg) bei gesunden Probanden zu einer Abnahme der Exposition gegenüber dem aktiven Metaboliten von Clopidrogel (ca. 9% Abnahme in der AUC und 27% Abnahme der Cmax). Die gleichzeitige Verabreichung von Dexlansoprazol hat keine klinische Wirkung auf die Pharmakodynamik von Clopidrogel. Bei Verabreichung einer zugelassenen Dosis von Dexlansoprazol ist keine Dosisanpassung von Clopidogrel notwendig.
Methotrexat
Fallberichte, publizierte Pharmakokinetik Studien und retrospektive Analysen deuten auf eine Erhöhung und Verlängerung der Serumspiegel von Methotrexat und/oder des Metaboliten Hydroxymethotrexat hin, bei gleichzeitiger Verabreichung von Methotrexat (vorwiegend bei hohen Dosen; man beachte die Fachinformation von Methotrexat) und PPIs. Es wurden jedoch keine formalen Interaktionsstudien mit hohen Dosen Methotrexat und PPIs durchgeführt.
Arzneimittel, die durch P-Glycoprotein transportiert werden
Lansoprazol hemmte in vitro das Transportprotein p-Glykoprotein (P-gp). Ein ähnlicher Effekt kann mit Dexlansoprazol erwartet werden. Die klinische Relevanz dieses Befundes ist nicht bekannt.
Weitere
Es wurden keine klinisch signifikanten Interaktionen von Dexlansoprazol mit nichtsteroidalen Antiphlogistika gezeigt, obwohl keine formellen Interaktionsstudien durchgeführt wurden.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine hinreichenden Daten zur Anwendung von Dexlansoprazol bei Schwangeren.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe «Präklinische Daten»).
Als Vorsichtsmassnahme soll Dexilant während der Schwangerschaft nicht angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Dexlansoprazol in die menschliche Muttermilch übertritt. Tierstudien zeigten eine Sekretion von Lansoprazol in die Milch.
Ein Risiko für den Säugling kann nicht ausgeschlossen werden. Daher ist auf das Stillen zu verzichten oder die Behandlung mit Dexilant zu unterbrechen.
Fertilität
In tierexperimentellen Studien zeigten sich nach der Gabe von Lansoprazol keine Hinweise auf eine Beeinträchtigung der Fertilität (siehe «Präklinische Daten»). Ähnliche Ergebnisse sind mit Dexlansoprazol zu erwarten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Aufgrund der möglichen unerwünschten Wirkungen (z.B. Kopfschmerzen, Sehstörungen und Vertigo) kann Dexilant die Fahrtüchtigkeit und das Bedienen von Maschinen beeinträchtigen.
Unerwünschte WirkungenDie Sicherheit von Dexlansoprazol wurde in klinischen Studien mit Dosen von 30, 60, oder 90 mg über eine Behandlungsdauer von bis zu 1 Jahr untersucht. In diesen Studien war die Gesamtinzidenz der unerwünschten Wirkungen unter Dexilant jener unter Placebo und Lansoprazol vergleichbar. Sie wurde durch Alter oder Geschlecht nicht in relevanter Weise beeinflusst.
In den klinischen Phase-III-Studien war die am häufigsten berichtete unerwünschte Wirkung Diarrhoe (ausgenommen infektiöse Diarrhoe). Das erste Einsetzen von Diarrhoe und abdominalen Schmerzen war unabhängig von der Expositionsdauer. Häufigste weitere unerwünschte Wirkungen in den klinischen Studien waren abdominale Schmerzen, Kopfschmerzen, Übelkeit, abdominales Unbehagen, Flatulenz und Obstipation.
Insgesamt brachen 2,4% der Patienten die Dexlansoprazol-Therapie aufgrund einer unerwünschten Wirkung vorzeitig ab. Häufigste unerwünschte Wirkungen (≥0,5%), die zu einem vorzeitigen Abbruch führten, waren dabei Diarrhoe und Bauchschmerzen.
Die unerwünschten Wirkungen, die in klinischen Studien und/oder während der Marktüberwachung unter Anwendung von Dexilant (30 mg, 60 mg oder 90 mg) berichtet wurden, sind nachstehend nach Systemorganklasse und Häufigkeit aufgelistet. Die Häufigkeiten sind dabei wie folgt definiert: sehr häufig (≥1/10); häufig (≥1/100 bis < 1/10); gelegentlich (≥1/1'000 bis < 1/100); selten (≥1/10'000 bis < 1/1'000); sehr selten (< 1/10'000); unbekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Infektionen
Selten: Candidiasis (des Gastrointestinaltraktes).
Erkrankungen des Blut- und Lymphsystems
Unbekannt: Autoimmune hämolytische Anämie (nach etwa 4-7 monatiger Behandlung mit 60mg Dexlansoprazol), idiopathische thrombozytopenische Purpura.
Erkrankungen des Immunsystems
Unbekannt: Überempfindlichkeit, anaphylaktische Reaktionen, anaphylaktischer Schock.
Stoffwechsel und Ernährungsstörungen
Gelegentlich: Appetitveränderungen
Unbekannt: Hyponatriämie, Hypomagnesiämie (siehe auch «Warnhinweise und Vorsichtsmassnahmen», eine schwere Hypomagnesiämie kann mit einer Hypokalzämie und/oder Hypokaliämie einhergehen).
Psychiatrische Erkrankungen
Gelegentlich: Schlaflosigkeit, Depression.
Selten: akustische Halluzinationen.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Gelegentlich: Benommenheit, veränderter Geschmackssinn.
Selten: Parästhesien, Konvulsionen.
Augenerkrankungen
Selten: Sehstörungen.
Unbekannt: Verschwommensehen.
Erkrankungen des Ohres und des Labyrinths
Selten: Vertigo.
Unbekannt: Taubheit.
Gefässerkrankungen
Gelegentlich: Hypertonie, Hitzewallungen.
Erkrankungen der Atemwege, des Brustraumes und Mediastinums
Gelegentlich: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhoe, abdominale Schmerzen, Übelkeit, abdominales Unbehagen, Flatulenz, Obstipation, Drüsenpolypen des Fundus (benigne).
Gelegentlich: Erbrechen, trockener Mund.
Leber- und Gallenerkrankungen
Gelegentlich: abnormale Leberfunktionstests.
Unbekannt: arzneimittelinduzierte Hepatitis.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Ausschlag, Pruritus, Urtikaria.
Sehr selten: Subakuter kutaner Lupus erythematodes.
Unbekannt: Stevens-Johnson-Syndrom (SJS), Lyell Syndrom, toxische epidermale Nekrolyse (TEN), Arzneimittelexanthem mit Eosinophilie und systemischen Manifestationen (DRESS), akute generalisierte exanthematöse Pustulosis (AGEP), Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Frakturen der Hüfte, des Handgelenkes oder der Wirbelsäule
Erkrankungen der Nieren und Harnwege
Unbekannt: tubulointerstitielle Nephritis (die zu Nierenversagen führen kann).
Allgemeine Erkrankungen
Gelegentlich: Asthenie.
Beschreibung ausgewählter unerwünschter Wirkungen
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen wurden häufiger bei Frauen berichtet (74%). Nach der Marktzulassung wurde selten über Fälle von Überempfindlichkeitsreaktionen und schweren Hautreaktionen wie toxisch epidermaler Nekrolyse (TEN), Stevens-Johnson-Syndroms (SJS), Arzneimittelexanthem mit Eosinophilie und systemischen Manifestationen (DRESS), akute generalisierte exanthematöse Pustulosis (AGEP) und Erythema multiforme berichtet. Auch schwere Fälle konnten meist durch Absetzen des Arzneimittels sowie eine Therapie mit Antihistaminika und/oder Steroiden beherrscht werden.
Sicherheit in der pädiatrischen Population
Das Sicherheitsprofil bei Jugendlichen ab dem Alter von 12 Jahren wurde in klinischen Studien an n=166 Patienten untersucht und war ähnlich jenem bei Erwachsenen. Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs gab keine Berichte über signifikante Überdosierungen von Dexilant.
Anzeichen und Symptome
Mehrfachdosen von Dexilant 120 mg und eine Einzeldosis von Dexilant 300 mg führten nicht zum Tod oder anderen schweren unerwünschten Wirkungen.
Im Zusammenhang mit Dosen von zweimal täglich 60 mg Dexilant wurde über unerwünschte Wirkungen wie Hypertonie, Hitzewallungen, Hämatome, oropharyngeale Schmerzen und Gewichtsverlust berichtet.
Behandlung
Im Falle einer vermuteten Überdosierung sollte der Patient überwacht werden. Dexlansoprazol wird durch eine Hämodialyse nicht signifikant eliminiert. Falls nötig werden eine Magenentleerung, Aktivkohle und eine symptomatische Therapie empfohlen.
Eigenschaften/WirkungenATC-Code
A02BC06
Wirkungsmechanismus
Dexlansoprazol ist das R-Enantiomer von Lansoprazol. Es ist ein gastrischer PPI. Es hemmt den terminalen Schritt der Magensäureproduktion durch Hemmen der Aktivität der H+/K+ ATPase der Parietalzellen im Magen. Die Hemmung ist dosisabhängig und reversibel, und die Wirkung betrifft sowohl die basale als auch die stimulierte Magensäuresekretion.
Dexlansoprazol wird in den Parietalzellen angereichert und in deren saurem Milieu aktiviert, worauf es mit der Sulfhydryl-Gruppe der H+/K+ATPase reagiert und so die Hemmung der Enzymaktivität verursacht.
Pharmakodynamik
Antisekretorische Aktivität
Die antisekretorische Aktivität von Dexlansoprazol wurde bei gesunden Probanden, die während 5 Tagen einmal täglich Dexlansoprazol 60 mg oder Lansoprazol 30 mg einnahmen, untersucht. Der durchschnittliche pH-Wert im Magen lag bei 4,55 für Dexlansoprazol und bei 4,13 für Lansoprazol. Unter Dexlansoprazol wurde der pH-Wert im Magen für 71% des Tages (17 Stunden), unter Lansoprazol für 60% (14 Stunden) über 4 gehalten.
Serum-Gastrin Wirkung
Die Wirkung von Dexlansoprazol auf die Serum-Gastrinkonzentrationen wurde bei Patienten in klinischen Studien von bis zu 12 Monate evaluiert. Die mittleren Nüchtern-Serum-Gastrinkonzentrationen erhöhten sich während der Behandlung mit Dexlansoprazol-Dosen von 30 mg und 60 mg gegenüber dem Ausgangswert. Bei Patienten, die während mehr als 6 Monaten behandelt wurden, erhöhten sich die mittleren Nüchtern-Serum-Gastrinspiegel während ungefähr der ersten 3 Behandlungsmonate und waren während der verbleibenden Behandlung stabil.
Die mittleren Serum-Gastrinspiegel gingen innerhalb eines Monats nach Therapieende auf Werte vor der Behandlung zurück.
Wirkung auf enterochromaffin-ähnliche Zellen (ECL)
Es gab keine Berichte über eine ECL-Zellen-Hyperplasie in Magenbiopsieproben von Patienten, die mit Dexilant 30 mg, 60 mg oder 90 mg während bis zu 12 Monaten behandelt wurden.
Wirkung auf die kardiale Repolarisation
In einer Placebo- und Moxifloxacin-kontrollierten Studie zur Untersuchung eines möglichen Potentials von Dexlansoprazol für eine Verlängerung des QT/QTc-Intervalls führten Dexilant-Dosen von 90 mg oder 300 mg nicht zu einer Verzögerung der kardialen Repolarisation.
Klinische Wirksamkeit
Heilung der erosiven Ösophagitis
Zwei multizentrische, doppelblinde, aktiv-kontrollierte, randomisierte, 8-wöchige Studien wurden bei Patienten mit endoskopisch bestätigter erosiver Ösophagitis durchgeführt. Der Schweregrad der Erkrankung vor der Behandlung gemäss Los Angeles Klassifikation war bei 71% der Patienten Grad A und B (leicht) und bei 29% der Patienten Grad C und D (moderat bis schwer). Die Patienten wurden zu einer der drei folgenden Behandlungsgruppen randomisiert: Dexilant 60 mg täglich, Dexilant 90 mg täglich oder Lansoprazol 30 mg täglich. Patienten, die H. pylori-positiv waren oder einen Barrett-Ösophagus hatten und/oder bei Studienbeginn bestimmte dysplastische Veränderungen aufwiesen, wurden von den Studien ausgeschlossen. Insgesamt waren 4092 Patienten im Alter zwischen 18 und 90 Jahren eingeschlossen.
Das Verhältnis der Patienten mit geheilter erosiver Ösophagitis nach 4 Wochen (sekundärer Endpunkt) oder 8 Wochen (primärer Endpunkt) wird unten in Tabelle 1 dargestellt. In beiden Studien wurde Nicht-Unterlegenheit von Dexlansoprazol gegenüber Lansoprazol gezeigt.
Tabelle 1 - Heilungsraten der erosiven Ösophagitis*: alle Grade
|
Studie
|
Anzahl Patienten
(n)
|
Behandlungsgruppe
(tägliche Einnahme)
|
Woche 4
% Heilung
|
Woche 8‡
% Heilung
|
95% CI für Unterschied in der Behandlung (Dexilant – Lansoprazol) Woche 8
| |
1
|
657
|
Dexilant 60 mg
|
69.7
|
86.9§
|
(-1.5, 6.1)
| |
648
|
Lansoprazol 30 mg
|
65.4
|
84.6
| |
2
|
639
|
Dexilant 60 mg
|
66.2
|
85.3§ **
|
(2.2, 10.5)
| |
656
|
Lansoprazol 30 mg
|
64.8
|
79.0
|
CI= Confidence Interval
* Basierend auf der Crude Rate Analyse. Patienten ohne endoskopisch dokumentiert abgeheilte erosive Ösophagitis und Patienten, welche die Studie vorzeitig beendeten wurden als «nicht geheilt» betrachtet.
‡ Primärer Wirksamkeitsendpunkt der Studie
§ Nicht Unterlegenheit zu Lansoprazol gezeigt
Statistisch signifikant vs Lansoprazol (p=0.004)
Dexilant 90 mg wurde ebenfalls untersucht, erbrachte jedoch keinen zusätzlichen klinischen Vorteil gegenüber Dexilant 60 mg.
Erhaltungstherapie der abgeheilten erosiven Ösophagitis
Eine multizentrische, doppelblinde, placebo-kontrollierte, randomisierte Studie wurde bei Patienten durchgeführt, die eine Studie zur erosiven Ösophagitis erfolgreich abgeschlossen hatten und eine endoskopisch bestätigte geheilte erosive Ösophagitis aufwiesen. Aufrechterhaltung der Heilung und Linderung der Symptome über einen 6monatigen Zeitraum wurden mit Dexilant 30 mg oder 60 mg einmal täglich im Vergleich zu Placebo evaluiert. Insgesamt waren 445 Patienten im Alter von 18 bis 85 Jahren eingeschlossen.
Basierend auf der Analyse nach der Crude-Rate-Methode zeigte Dexilant 30 mg in Monat 6 statistisch signifikant höhere Erhaltungsraten einer geheilten erosiven Ösophagitis als Placebo (Tabelle 2).
Tabelle 2 - Erhaltungsraten* einer geheilten erosiven Ösophagitis in Monat 6
|
Anzahl Patienten (n)
|
Behandlungsgruppe
(tägliche Einnahme)
|
Woche 8
% Heilung
| |
125
|
Dexilant 30 mg
|
66.4‡
| |
119
|
Placebo
|
14.3
|
* Basierend auf der Crude Rate Analyse. Patienten ohne endoskopisch dokumentiert abgeheilte erosive Ösophagitis und Patienten, welche die Studie vorzeitig beendeten wurden als «Rückfall» betrachtet.
‡ Statistische Signifikanz vs Placebo (p<0.00001)
Während der Behandlungsdauer der Studie erzielte Dexilant 30 mg eine statistisch signifikant höhere prozentuale Linderung bei Magenbrennen (Tabelle 3).
Tabelle 3 - Mediane Prozentangaben von Nächten und 24-Stunden Perioden ohne Magenbrennen in der Studie zur Erhaltungstherapie der abgeheilten erosiven Ösophagitis
|
Behandlungsgruppe
(Tägliche Einnahme)
|
Anzahl Patienten
(n)
|
Nächte ohne Magenbrennen*
(%)
|
Anzahl Patienten
(n)
|
24 Stunden-Magenbrennen-freien Perioden*
(%)
| |
Dexilant 30 mg
|
132
|
98.9†
|
132
|
96.1†
| |
Placebo
|
140
|
71.7
|
141
|
28.6
|
* Sekundärer Wirksamkeitsendpunkt der Studie
† Statistische Signifikanz vs Placebo (p<0.00001)
Dexilant 60 mg erbrachte keinen zusätzlichen klinischen Vorteil gegenüber Dexilant 30 mg.
Symptomatische nicht-erosive gastroösophageale Refluxkrankheit (GORD)
Die Wirksamkeit von Dexlansoprazol zur Behandlung der symptomatischen nicht-erosiven gastroösophagealen Refluxkrankheit (GORD) wurden in zwei randomisierten, doppelblinden, placebokontrollierten, multizentrischen Studien mit jeweils 4wöchiger Behandlungsdauer untersucht. Bei allen Patienten wurde vor Studienbeginn das Vorliegen einer erosiven Ösophagitis ausgeschlossen.
In die Hauptstudie wurden n=947 Patienten aufgenommen, die als Hauptsymptom seit mindestens 6 Monaten anhaltendes Sodbrennen angaben. Die Patienten erhielten einmal täglich Dexilant 30 mg, Dexilant 60 mg oder Placebo. Primärer Endpunkt war der prozentuale Anteil der Tage während der Behandlung, an denen Sodbrennen weder tagsüber noch nachts auftrat, beurteilt anhand eines elektronischen Tagebuchs. Dexilant 30 mg war Placebo signifikant überlegen, mit im Mittel 50,3% versus 25,0% Tagen ohne Sodbrennen (p<0.0001). Auch bezüglich des mittleren prozentualen Anteils der Nächte ohne Sodbrennen war Dexilant 30 mg Placebo signifikant überlegen (67,6% gegenüber 47,1%). Für Dexilant 60 mg wurde kein zusätzlicher klinischer Nutzen gegenüber Dexilant 30 mg beobachtet.
In die supportive Studie wurden n=305 Patienten mit nächtlichem Sodbrennen und damit einhergehenden Schlafstörungen aufgenommen; sie erhielten Dexilant 30 mg oder Placebo. Primärer Endpunkt war der prozentuale Anteil der Nächte ohne Sodbrennen über 4 Wochen, beurteilt anhand eines Tagebuchs. Mit im Mittel 60,1% versus 37,5% war der mittlere Prozentsatz der Nächte ohne Sodbrennen für Dexilant 30 mg signifikant höher als für Placebo (p<0.001).
Pädiatrische Population
Heilung der erosiven Ösophagitis, Erhaltungstherapie der abgeheilten erosiven Ösophagitis und Linderung bei Magenbrennen
In einer multizentrischen, 24-wöchigen Studie wurden 62 Jugendliche mit der Anamnese einer dokumentierten gastroösophagalen Refluxkrankheit über mindestens 3 Monate, die eine endoskopisch bestätigte erosive Ösophagitis aufwiesen, während 8 Wochen mit Dexilant 60 mg einmal täglich behandelt. Die Patienten waren zwischen 12 und 17 Jahre alt (Durchschnittsalter 15 Jahre), davon waren 61% männlich. Auf der Grundlage der Los Angeles Classification Grading Scale wiesen vor der Behandlung 96,8% der Patienten eine milde (Grad A und B) und 3,2% eine moderate bis schwere (Grad C und D) erosive Ösophagitis auf. Bei einer Behandlungsdauer bis zu 8 Wochen lag die Heilungsrate der erosiven Ösophagitis bei 87,9% und war der Heilungsrate bei Erwachsenen vergleichbar.
Nach der initialen 8wöchigen Behandlung wurden die Patienten mit endoskopisch bestätigt geheilter erosiver Ösophagitis randomisiert und für weitere 16 Wochen entweder mit Dexilant 30 mg oder Placebo einmal täglich behandelt. 82% der Patienten, die mit 30 mg Dexilant behandelt wurden, blieben während des viermonatigen Behandlungszeitraums endoskopisch bestätigt geheilt, im Vergleich zu 58% in der Placebogruppe.
Während der 16-wöchigen Erhaltungsphase betrug der mediane Prozentsatz der Sodbrennen-freien Zeit über 24 Stunden 86,6% bei Patienten, die Dexilant 30 mg erhielten, im Vergleich zu 68,1% unter Placebo.
Symptomatische nicht-erosive gastroösophageale Refluxkrankheit (GORD)
In einer offenen, unkontrollierten, multizentrischen Studie wurden 104 Jugendliche im Alter von 12-<18 Jahren (Durchschnittsalter: 15 Jahre) mit symptomatischer nicht-erosiver GORD mit Dexilant 30 mg einmal täglich für 4 Wochen behandelt. 70% der Patienten waren weiblich. Die Patienten hatten dokumentierte GORD-Symptome für mindestens 3 Monate vor dem Screening, dokumentiertes Sodbrennen an mindestens 3 von 7 Tagen während des Screenings und endoskopisch keine ösophagealen Erosionen. Der durchschnittliche Anteil an Tagen, an welchen unter der Therapie weder tagsüber noch nachts Sodbrennen auftrat, lag bei 47.1% und war damit jenem bei Erwachsenen vergleichbar.
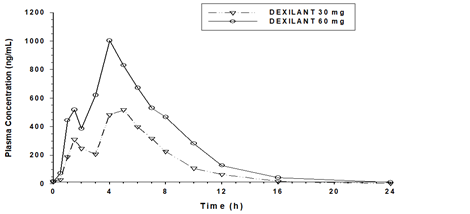
PharmakokinetikAufgrund der zweifach-retardierten Formulierung von Dexilant (dual delayed release Technologie) weist das Konzentrations-Zeit-Profil von Dexlansoprazol zwei unterschiedlichen Spitzen auf. Die erste Spitze tritt 1 bis 2 Stunden nach Verabreichung auf, gefolgt von einer zweiten Spitze innerhalb von 4 bis 5 Stunden (siehe Abbildung).
Abbildung 1: Durchschnittliche Plasmakonzentration von Dexlansoprazol – Zeitprofil nach oraler Gabe von 30 mg oder 60 mg Dexilant einmal täglich während 5 Tagen bei gesunden Probanden
Absorption
Nach oraler Verabreichung von Dexilant 30 mg oder 60 mg an gesunde Probanden erhöhten sich die mittleren Dexlansoprazol Cmax und AUC etwa dosisproportional. Die Spitzenplasmaspiegel traten innerhalb von 4 bis 6 Stunden auf.
Distribution
Die Plasmaproteinbindung von Dexlansoprazol reichte bei gesunden Probanden von 96,1% bis 98,8% und war im Bereich zwischen 0,01 und 20 µg/ml unabhängig von der Konzentration. Das scheinbare Verteilungsvolumen betrug bei symptomatischen GORD-Patienten nach mehrfachen Dosen 40,3 l.
Metabolismus
Dexlansoprazol wird in der Leber extensiv durch Oxidation, Reduktion und anschliessende Bildung von Sulfat-, Glucuronid- und Glutathion-Konjugaten zu inaktiven Metaboliten metabolisiert. Oxidative Metaboliten werden durch das Cytochrom P450 (CYP)-Enzymsystem gebildet, einschliesslich der Hydroxylierung hauptsächlich durch CYP2C19 und Oxidation zum Sulfon durch CYP3A4.
Bei langsamen Metabolisierern für CYP2C19 ist die systemische Exposition von Dexlansoprazol etwa vierfach höher als bei extensiven Metabolisierern. Unabhängig vom CYP2C19-Metabolisiererstatus ist Dexlansoprazol die bedeutendste im Plasma zirkulierende Komponente. Bei intermediären und extensiven CYP2C19-Metabolisierern sind die Hauptmetaboliten im Plasma 5-Hydroxy-Dexlansoprazol und sein Glucuronid-Konjugat, während bei langsamen CYP2C19-Metabolisierern Dexlansoprazol-Sulfon der Hauptmetabolit im Plasma ist.
Elimination
Nach oraler Gabe von Dexilant wurde im Urin kein unverändertes Dexlansoprazol nachgewiesen.
Nach Verabreichung von [14C]-Dexlansoprazol an gesunde männliche Probanden wurden etwa 50.7% der verabreichten Radioaktivität über den Urin und 47.6% über die Faeces ausgeschieden. Die scheinbare Clearance bei gesunden Probanden betrug nach einer Verabreichung von einmal täglich 30 oder 60 mg während 5 Tagen jeweils 11.4 bis 11.6 l/h.
Linearität/Nicht Linearität
Nach Verabreichung einzelner und mehrfacher täglicher Dexlansoprazol-Dosen von 30 bis 120 mg an gesunde Probanden erhöhten sich die mittleren Dexlansoprazol Cmax und AUC etwa dosisproportional über den gesamten Dosisbereich. Die Pharmakokinetik von Dexlansoprazol war sowohl dosis- als auch zeitunabhängig, mit einer geschätzten terminalen Eliminations-Halbwertzeit von etwa 1 bis 2 Stunden. Daher wurde bei Dexlansoprazol eine geringe oder keine Substanzakkumulation nach einmal täglichen Dosen an Dexlansoprazol beobachtet, was durch ähnliche Cmax und AUC nach einer einzelnen und mehreren Dosen einmal täglich im Steady-State gezeigt wurde.
Einfluss von Nahrung
In klinischen Studien zum Einfluss von Nahrung bei gesunden Probanden, die Dexilant erhielten, betrugen die Erhöhungen der Cmax unter verschiedenen Ernährungsbedingungen im Vergleich zu Nahrungskarenz zwischen 12% bis 55%, und die Erhöhungen der AUC zwischen 9% und 37%. Allerdings wurden keine relevanten Unterschiede hinsichtlich des intragastrischen pH-Werts beobachtet. In einer zusätzlichen Studie hatte die Verabreichung von 60 mg Dexilant vor Einnahme eines Frühstücks, Mittagessens oder Abendessens oder eines abendlichen Snacks keine Auswirkung auf die Dexlansoprazol-Exposition oder einen klinisch relevanten Effekt auf die intragastrische pH Kontrolle während 24 Stunden. Dexilant kann unabhängig von der Nahrungsaufnahme eingenommen werden.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche
Die Pharmakokinetik von Dexlansoprazol wurde bei 36 Patienten im Alter von 12 bis 17 Jahren mit symptomatischer gastroösophagaler Refluxkrankeheit in einer Studie untersucht. Die Patienten erhielten randomisiert Dexilant 30 mg oder Dexilant 60 mg einmal täglich während 7 Tagen. Die mittlere Cmax von Dexlansoprazol lag bei Jugendlichen bei 81 bis 105 % der mittleren Cmax bei Erwachsenen. Die mittlere AUC lag bei 78 bis 88 % des mittleren Erwachsenen-AUC-Werts, und die mittlere CL/F lag bei 112 bis 132 % des mittleren CF/L-Werts der Erwachsenen. Insgesamt war die Pharmakokinetik bei Patienten zwischen 12 und 17 Jahren ähnlich jener bei gesunden Erwachsenen.
Ältere Patienten
In einer Studie an gesunden männlichen und weiblichen Probanden, die eine einzelne orale Dosis Dexilant 60 mg erhielten, war die terminale Eliminations-Halbwertzeit von Dexlansoprazol bei älteren Probanden im Vergleich zu jüngeren Probanden statistisch signifikant länger (2,23 bzw. 1,5 Stunden). Zusätzlich zeigte Dexlansoprazol eine höhere systemische Exposition (AUC) bei älteren Probanden (34,5% höher) als bei jüngeren Probanden. Diese Unterschiede waren nicht klinisch relevant (siehe auch «Dosierung/Anwendung»).
Leberfunktionsstörungen
In einer Studie an Patienten mit moderater Leberfunktionsstörung, die eine orale Einzeldosis von Dexilant 60 mg erhielten, war die Plasmaexposition (AUC) von gebundenem und ungebundenem Dexlansoprazol in der Gruppe mit Leberfunktionsstörung etwa 2 Mal höher als bei Probanden mit normaler Leberfunktion (siehe «Dosierung/Anwendung»). Dieser Unterschied in der Exposition war nicht auf eine Differenz in der Proteinbindung zwischen den zwei Gruppen zurückzuführen. Bei Patienten mit schwerer Leberfunktionsstörung wurden keine Studien durchgeführt (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nierenfunktionsstörungen
Dexlansoprazol wird in der Leber extensiv zu inaktiven Metaboliten metabolisiert. Nach einer oralen Dexlansoprazol-Dosis wurde kein unveränderter Wirkstoff im Urin entdeckt. Daher ist keine Änderung der Pharmakokinetik von Dexlansoprazol bei Patienten mit Nierenfunktionsstörung zu erwarten, und es wurden keine Studien bei Probanden mit Nierenfunktionsstörung durchgeführt.
Geschlecht
In einer Studie an gesunden männlichen und weiblichen Probanden, die eine orale Einzeldosis von Dexilant 60 mg erhielten, hatten die weiblichen Probanden eine höhere (42.8%) systemische Exposition (AUC) als die männlichen Probanden.
Eine geschlechtsspezifische Dosisanpassung ist jedoch nicht notwendig.
Präklinische DatenPräklinische Daten zeigen keine besondere Gefahr für Menschen basierend auf konventionellen Studien zur Sicherheitspharmakologie, chronischen Toxizität, Genotoxizität, Reproduktionstoxizität und Entwicklung. Lansoprazol ist eine racemische Mischung von R- und S-Enantiomeren. Nach Verabreichung von Lansoprazol an Mensch und Tier ist die bedeutendste im Plasma zirkulierende Komponente Dexlansoprazol, das R-Enantiomer von Lansoprazol. Daher wurde das kanzerogene Potential von Dexlansoprazol aufgrund von bereits existierenden Studien mit Lansoprazol beurteilt.
Mutagenität
Lansoprazol war positiv im Ames-Test und im in-vitro humanen Lymphozyten-Chromosomenabberations-Test.
Lansoprazol war nicht genotoxisch im ex-vivo «Unscheduled DNA synthesis (UDS)»-Test an Ratten-Hepatozyten, im in vivo Mikronukleus-Test an der Maus oder dem Knochenmarkszellen-Chromosomenabberations-Test an der Ratte.
Dexlansoprazol war positiv im Ames-Test und im in vitro Chromosomenabberations-Test unter Verwendung von chinesischen Hamster-Lungenzellen. Dexlansoprazol war negativ im in vivo Mikronukleus-Test an der Maus.
Karzinogenität
In Karzinogenitäts-Studien an Ratten führte Lansoprazol zu einer dosisabhängigen ECL-Zell-Hyperplasie im Magen und zu ECL-Zell-Karzinoiden, verbunden mit einer Hypergastrinämie aufgrund der Hemmung der Säuresekretion. Zudem wurden eine intestinale Metaplasie sowie Leydig'sche Zell-Hyperplasie und benigne Leydig'sche Zell-Tumoren in den Hoden beobachtet. Nach 18-monatiger Behandlung wurde eine Retinaatrophie beobachtet. Bei Affen, Hunden und Mäusen wurde dies nicht beobachtet.
In Studien zur Karzinogenität an Mäusen entwickelten sich sowohl eine dosisabhängige ECL-Zell-Hyperplasie im Magen als auch Lebertumore und Adenome der Testis.
Die klinische Relevanz dieser Ergebnisse ist unbekannt.
Reproduktionstoxizität
In Reproduktionsstudien an trächtigen Ratten und Kaninchen wurden oral verabreichte Lansoprazol-Dosen (jeweils bezogen auf die Körperoberfläche) untersucht, welche dem 40-Fachen (Ratten) bzw. dem 16-Fachen (Kaninchen) der empfohlenen Lansoprazol-Dosis beim Menschen entsprachen. Diese Studien lieferten keine Hinweise auf eine Beeinträchtigung der Fertilität oder einen Effekt auf den Foeten.
Es wurde eine Toxizitätsstudie zur prä- und postnatalen Entwicklung durchgeführt, in der trächtige Ratten während der Organogenese bis zur Laktation oral Lansoprazol in einer Dosierung von bis zu 100 mg/kg/Tag erhielten. Bei der Dosis von 100 mg/kg/Tag (dem 1,8-Fachen der maximal beim Menschen empfohlenen Dexlansoprazol-Dosis von 60 mg, beruhend auf der Fläche unter der Konzentrations-Zeit-Kurve [AUC] von Dexlansoprazol) wurden bei den Muttertieren u.a. folgende Auswirkungen festgestellt: verlängerte Tragzeit, geringere Körpergewichtszunahme während der Trächtigkeit und verminderte Nahrungsaufnahme. Die Anzahl der Totgeburten war bei dieser Dosis erhöht, wobei es sich um eine Folge der maternalen Toxizität handeln könnte. Jungtiere, deren Mütter 100 mg/kg/Tag erhalten hatten, wiesen ein niedrigeres Körpergewicht und Femurgewicht sowie eine geringere Femurlänge und Scheitel-Steiss-Länge auf. Bei Dosen von 30 und 100 mg/kg/Tag war die Dicke der Wachstumsfuge verändert. Auswirkungen auf die Knochenparameter wurden als Folge der Körpergewichtszunahme betrachtet.
Jungtierstudien
Fünf durchgeführte Jungtierstudien mit Lansoprazol ergaben keine behandlungsbedingten Unterschiede zwischen Jungtieren und erwachsenen Tieren.
In einer weiteren 8-wöchigen Studie an juvenilen Ratten trat eine Verdickung der Herzklappe bei ungefähr dem 11-Fachen der erwarteten Lansoprazol-Exposition (AUC) beim Menschen (etwa dem 5-Fachen der erwarteten Dexlansoprazol-AUC beim Menschen) auf. Nach einer 4-wöchigen medikamentenfreien Erholungsphase erwiesen sich diese Befunde als reversibel oder zeigten zumindest einen Trend zur Reversibilität.
In einer anschliessenden Studie zur Anfälligkeit gegenüber Entwicklungsstörungen an Tieren, die das Arzneimittel ab Tag 14 nach der Geburt (entsprechend einem Alter von etwa 1 Jahr beim Menschen) erhielten, erwiesen sich juvenile Ratten in einem Alter von weniger als Tag 21 nach der Geburt (entsprechend einem Alter von etwa 2 Jahren beim Menschen) als anfälliger für die Entwicklung einer Verdickung der Herzklappe bei einer geringeren Exposition (etwa dem 4-Fachen der erwarteten Lansoprazol-AUC und dem 2-Fachen der erwarteten Dexlansoprazol-AUC beim Menschen).
Die Relevanz dieser Ergebnisse für Kinder unter 12 Jahren ist unbekannt. Für Patienten in einem Alter von 12 Jahren und älter sind die Ergebnisse dieser Studien nicht relevant.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» aufgedrucktem Datum verwendet werden.
Besondere Lagerungshinweise
Für Kinder unzugänglich aufbewahren. Nicht über 25 °C lagern.
Zulassungsnummer62993 (Swissmedic).
PackungenDexilant 30 mg: Packungen mit 14, 28 oder 98 Kapseln mit veränderter Wirkstofffreisetzung.
Dexilant 60 mg: Packungen mit 14, 28 oder 56 Kapseln mit veränderter Wirkstofffreisetzung.
ZulassungsinhaberinTakeda Pharma AG, 8152 Opfikon.
Stand der InformationDezember 2022
|

