ZusammensetzungWirkstoffe
Levonorgestrel
Hilfsstoffe
Polydimethylsiloxan-Elastomer, T-Körper: Polyethylen mit 20-24% Bariumsulfat, Kontrollfaden: Polypropylen, Ciaftalan-Kupfer.
Indikationen/Anwendungsmöglichkeiten·Intrauterine Kontrazeption
·Idiopathische Hypermenorrhoe
Dosierung/AnwendungLevosert sollte nur von Ärzten oder Ärztinnen eingelegt werden, die Erfahrung in der Einlage Levonorgestrel-haltiger Intrauterinsysteme (IUS) haben und/oder ausreichend in der Einlagetechnik instruiert wurden.
Detaillierte Hinweise zur Einlage des IUS befinden sich in der Packung.
Gestaltet sich die Einlage schwierig und/oder ist sie mit starken Schmerzen und/oder Blutungen verbunden, sollten, um eine Perforation auszuschliessen, direkt nach der Einlage eine ärztliche Untersuchung und eine Sonographie durchgeführt werden.
Levosert muss bei Frauen im fertilen Alter innerhalb von 7 Tagen nach Beginn der Menstruation eingesetzt werden. Das Auswechseln gegen ein neues Intrauterinsystem kann hingegen zu jedem Zeitpunkt während des Monatszyklus vorgenommen werden. Eine Postabortionem-Insertion (1. Trimenon) kann sofort vorgenommen werden. Bei Aborten im 2. Trimenon sowie post partum muss mit der Einlage bis zur kompletten Involution, d.h. mindestens 6 Wochen gewartet werden. Dauert die Involution wesentlich länger (wie dies z.B. nach einer Sectio caesarea möglich ist), sollte mit der Einlage bis 12 Wochen gewartet werden.
Levosert eignet sich nicht zur postkoitalen Kontrazeption.
Einlagedauer:
Nach sechsjähriger Einlagezeit sollte das IUS entfernt und durch ein Neues ersetzt werden.
Bei Anwenderinnen, bei welchen ein Levosert IUS eingelegt wurde, gemäss dessen Fachinformation nur eine Einlagedauer von 3 oder 4 Jahren zulässig ist, kann aufgrund der mittlerweile vorliegenden Daten das IUS ebenfalls für insgesamt bis zu 6 Jahre in situ belassen werden.
Entfernen von Levosert:
Levosert kann mit Hilfe einer Pinzette/Zange durch leichtes Ziehen an den Fäden entfernt werden. Nach der Entfernung kann sofort ein neues Levonorgestrel-haltiges Intrauterinsystem eingesetzt werden. Falls die Fäden nicht sichtbar sind und das Intrauterinsystem bei der Sonographie im Cavum uteri zu sehen ist, kann dieses mit Hilfe einer schmalen Zange entfernt werden. Eventuell muss der Zervixkanal hierzu dilatiert oder ein chirurgischer Eingriff vorgenommen werden.
Wird weiterhin eine Kontrazeption gewünscht, sollte, falls die Anwenderin regelmässige Blutungen hat, die Entfernung von Levosert innerhalb der ersten 7 Tage nach Beginn der Menstruation erfolgen. Bei Anwenderinnen ohne regelmässige Blutungen oder wenn Levosert zu einem anderen Zeitpunkt im Zyklus entfernt wird, besteht das Risiko einer Schwangerschaft, falls die Anwenderin in der Woche vor der Entfernung Geschlechtsverkehr hatte. Um einen Konzeptionsschutz zu gewährleisten, muss sofort nach der Entfernung ein neues Levonorgestrelhaltiges IUS eingelegt oder eine andere Kontrazeptionsmethode angewendet werden. Zur Frage des Anwendungsbeginns bei Umstellung auf ein anderes hormonales Kontrazeptivum siehe Fachinformation des jeweiligen Präparates.
Nach der Entfernung von Levosert sollte überprüft werden, ob das System intakt ist. Bei Entfernungen, die sich schwierig gestalteten, wurde vereinzelt berichtet, dass der Hormonzylinder sich über die horizontalen Arme verschoben hatte, so dass die Arme im Zylinder eingeschlossen waren. Diese Situation erfordert keine weiteren Massnahmen, solange die Vollständigkeit des Systems sichergestellt wurde. Die Köpfchen am Ende der horizontalen Arme verhindern normalerweise, dass der Zylinder sich komplett vom T-Körper löst.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von Levonorgestrel-haltigen IUS wurde überwiegend an Frauen ab einem Alter von 18 Jahren untersucht. Die Anwendung von Levosert ist bei Mädchen vor der Menarche nicht indiziert. Bei Jugendlichen wird, falls Arzt und Anwenderin sich für die Anwendung eines IUS entscheiden (siehe auch «Warnhinweise und Vorsichtsmassnahmen»), die gleiche Dosierung wie bei Erwachsenen empfohlen. Für die Kontrazeption bei Jugendlichen stehen Levonorgestrel-haltige IUS mit geringerer Grösse zur Verfügung (Wirkstoffgehalt 19.5 mg bzw. 13.5 mg).
Ältere Patienten
Levosert wurde bei Frauen >65 Jahre nicht untersucht. In dieser Altersgruppe besteht keine Indikation.
Patienten mit Nierenfunktionsstörungen
Levosert wurde bei Frauen mit eingeschränkter Nierenfunktion nicht untersucht. Es sind daher keine Dosierungsempfehlungen möglich.
Patienten mit Leberfunktionsstörungen
Levosert wurde bei Frauen mit eingeschränkter Leberfunktion nicht untersucht. Levosert darf bei akuten Lebererkrankungen oder Lebertumoren nicht angewendet werden (siehe «Kontraindikationen»).
Kontraindikationen• Angeborene oder erworbene Anomalien des Uterus (einschliesslich Endometriumpolypen) oder der Zervix;
• Akute entzündliche Erkrankungen des kleinen Beckens (Pelvic Inflammatory Disease, PID) oder rezidivierende PID in der Anamnese;
• Zervizitis;
• Infektionen des unteren Genitaltraktes;
• Postpartale-Endometritis;
• Septischer Abort in den vergangenen 3 Monaten;
• Gestagen-abhängige Tumoren;
• Nachweis oder Verdacht auf maligne Erkrankungen des Corpus oder der Zervix uteri (einschliesslich Zervixdysplasie);
• Nicht abgeklärte Vaginalblutungen;
• Akute Lebererkrankung und Lebertumore;
• Immunsuppressive Therapie sowie alle Bedingungen, die mit einer erhöhten Anfälligkeit auf Infektionen verbunden sind;
• Schwangerschaft;
• Überempfindlichkeit gegenüber Levonorgestrel oder einem der übrigen Bestandteile von Levosert.
Warnhinweise und VorsichtsmassnahmenVor der ersten Insertion von Levosert ist eine allgemeine und gynäkologische Untersuchung inklusive Palpation der Mammae durchzuführen. Eine Schwangerschaft sowie die übrigen Kontraindikationen sind auszuschliessen. Ein Zervixabstrich sollte durchgeführt werden, und eine Behandlung eventueller Infektionen des Genitaltraktes muss abgeschlossen sein. Da es in den ersten Monaten unter Anwendung von Levonorgestrel-haltigen IUS wie Levosert häufig zu Blutungsunregelmässigkeiten und Schmierblutungen kommen kann, sind vor der Einlage pathologische Veränderungen des Endometriums auszuschliessen.
Vor der Insertion ist die Anwenderin über Wirksamkeit, Risiken und Nebenwirkungen von Levosert aufzuklären, insbesondere über das seltene Risiko einer Uterusperforation (siehe unten) sowie über die Möglichkeit einer ektopischen Schwangerschaft im Falle eines Kontrazeptionsversagens. Die Risiken und Vorteile einer intrauterinen Kontrazeption sollten abgewogen und mit der Anwenderin besprochen werden.
Vor der Insertion von Levosert müssen Position des Uterus und Grösse des Cavum uteri bestimmt werden. Die korrekte Positionierung von Levosert im Fundus ist wichtig, um eine einheitliche Wirkung von Levonorgestrel auf das Endometrium zu bewirken, eine Ausstossung zu verhindern und die Wirksamkeit zu optimieren. Deshalb sollte die «Anleitung zum Einsetzen» genau befolgt werden. Da die Einlagetechnik für Levosert anders ist als für andere IUS, sollte diese sorgfältig geschult werden.
Bei der Einlage und Entfernung können Schmerzen und Blutungen auftreten. Die Insertion kann eine vasovagale Reaktion auslösen, z.B. Synkope oder bei Epileptikerinnen einen Anfall. Bei der Einlage empfehlen sich deshalb besondere Vorsicht und evtl. entsprechende Vorbereitungen für das Auftreten eines Krampfanfalls.
Menstruationsähnliche Schmerzen nach der Insertion sind normal. Die Anwenderin soll aufgefordert werden, sich bei starken Schmerzen sowie bei Schmerzen, die mehr als 3 Wochen nach der Insertion andauern, an ihren Arzt bzw. ihre Ärztin zu wenden.
Die Anwenderin sollte ein bis drei Monate nach Insertion und anschliessend jährlich sowie im Falle von Problemen erneut untersucht werden.
Die Anwenderin ist ferner anzuweisen, die Information für Patientinnen aufmerksam zu lesen, damit eine Selbstkontrolle und das rechtzeitige Aufsuchen des Arztes bzw. der Ärztin gewährleistet sind.
Gründe für das sofortige Entfernen von Levosert:
Bei Auftreten einer der oben genannten Kontraindikationen oder einer der folgenden Erkrankungen sollte Levosert entfernt werden:
• bestätigte oder vermutete geschlechtshormon-abhängige Neoplasien (insbesondere Brustkrebs),
• schwere arterielle thromboembolische Erkrankungen wie z.B. Schlaganfall oder Myokardinfarkt,
• tiefe Venenthrombose oder Lungenembolie,
• erstmaliges Auftreten oder Exacerbation migräneartiger oder häufigeres Auftreten ungewohnt starker Kopfschmerzen; fokale Migräne mit asymmetrischem Visusverlust,
• plötzliche Seh-, Hör-, Sprach- oder sonstige Wahrnehmungsstörungen sowie andere Symptome, die auf eine zerebrale Ischämie hindeuten können,
• Ikterus,
• stärkerer Blutdruckanstieg,
• schwere depressive Zustände.
Lagekontrolle
Die Aufklärung und Unterweisung der Anwenderin zur Kontrolle der Rückholfäden durch Selbstuntersuchung wird empfohlen. Die Rückholfäden können sich in den Uterus oder in den Zervixkanal zurückgezogen haben und bei der nächsten Menstruation wieder auftauchen. Wenn die Rückholfäden bei einer Kontrolluntersuchung nicht in der Vagina tastbar sind, sollte zunächst eine Schwangerschaft ausgeschlossen werden. Liegt keine Schwangerschaft vor, so lassen sich die Fäden meist durch vorsichtiges Sondieren des Zervixkanals mit einem geeigneten Instrument lokalisieren. Sind die Fäden nicht auffindbar, wurde das IUS möglicherweise ausgestossen oder hat die Uteruswand penetriert.
Wenn der Verdacht besteht, dass sich das System nicht in der richtigen Lage befindet, muss dies z.B. sonographisch kontrolliert werden. Falls dies nicht erfolgreich ist, kann eine Röntgenuntersuchung zur Lokalisierung erfolgen. Der Kunststoffkörper des IUS ist mit Bariumsulfat versetzt und gibt daher einen guten Kontrast.
Bei nicht korrekter Lage des IUS muss dieses entfernt und durch ein neues steriles IUS ersetzt werden.
Perforation:
Eine Perforation oder Penetration des Uterus oder der Zervix kann durch ein Levonorgestrel-haltige IUS wie Levosert verursacht werden. Sie kann sich durch Schmerzen und /oder Blutungen manifestieren, verläuft jedoch häufig auch asymptomatisch. Eine Perforation geschieht meist während der Einlage, wird allerdings möglicherweise erst Jahre später oder zum Zeitpunkt der geplanten Entfernung erkannt. Durch eine Perforation bzw. Penetration kann die Wirkung von Levosert reduziert sein. Wird eine vollständige oder partielle Perforation diagnostiziert, ist Levosert unverzüglich zu entfernen und geeignete Massnahmen sind einzuleiten, um Komplikationen auszuschliessen.
Eine grosse, prospektive Post-Marketing-Studie zeigte, dass das Risiko einer Uterusperforation insbesondere dann erhöht ist, wenn die Insertion postpartal oder während der Stillzeit erfolgt. Dabei fand sich eine Risikoerhöhung bis 36 Wochen nach einer Entbindung. Der Zeitabstand nach einer Entbindung und das Stillen stellten zwei unabhängige Risikofaktoren dar. Bei stillenden Frauen betrug die Inzidenz von Perforationen 5.3 pro 1000 Insertionen. Bei nicht-stillenden Frauen lag die Perforations-Inzidenz bis 36 Wochen postpartum bei 1.7 pro 1000 Insertionen. Diese Inzidenz war höher als bei Frauen, die weder stillten noch innerhalb der vorigen 36 Wochen entbunden hatten (0.7 pro 1000 Insertionen).
Insgesamt lag die Inzidenz von Uterusperforationen unter Levonorgestrel-haltigen IUSs in dieser Studie über einen Beobachtungszeitraum von 1 Jahr bei 1.4 pro 1000 Insertionen (95%-KI 1.1-1.8) und unter Kupfer-IUDs bei 1.1 pro 1000 Insertionen (95%-KI 0.7-1.6). Die überwiegende Mehrzahl der Perforationen wurde dabei bereits innerhalb der ersten drei Monate nach Insertion diagnostiziert.
Das Risiko für Perforationen kann bei Frauen mit retrovertierter Uteruslage erhöht sein.
Vor der Entscheidung, Levosert anzuwenden, muss die Anwenderin über das Risiko einer Uterusperforation aufgeklärt werden. Insbesondere sind Frauen während der Stillzeit bzw. bis 36 Wochen post partum darauf hinzuweisen, dass in dieser Zeit das Risiko für eine Perforation erhöht ist.
Ausstossung:
Schmerzen sowie das Auftreten von Blutungen resp. eine Zunahme der Menstruationsblutung können Hinweise auf eine partielle oder totale Ausstossung sein. Eine partielle oder vollständige Ausstossung kann von der Anwenderin unbemerkt auftreten und zu einer Verminderung oder zum Verlust des kontrazeptiven Schutzes führen.
Das Risiko einer Ausstossung ist erhöht bei einem BMI >25kg/m2 (und nimmt mit steigendem BMI weiter zu) sowie bei Menorrhagien in der Anamnese (einschliesslich Patientinnen, bei welchen das IUS zur Therapie einer idiopathischen Hypermenorrhoe eingesetzt wurde).
Die Anwenderin ist über die Anzeichen einer möglichen Ausstossung zu informieren und in der Kontrolle der Rückholfäden zu unterweisen (siehe auch «Lagekontrolle»). Falls die Fäden nicht tastbar sind, sollte sich die Anwenderin an eine Ärztin/einen Arzt wenden. Bis eine Ausstossung des IUS ausgeschlossen wurde, sollte im Falle von Geschlechtsverkehr zusätzlich eine Barrieremethode angewendet werden.
Anwenderinnen, die Tampons oder Menstruationstassen verwenden, sollten darauf hingewiesen werden, diese vorsichtig zu entfernen, um nicht unabsichtlich den Kontrollfaden zu ziehen oder anderweitig die Lage von Levosert zu verändern.
Falls es zu einer partiellen Ausstossung gekommen ist, ist Levosert zu entfernen. Nach Ausschluss einer Schwangerschaft kann ein neues System eingesetzt werden.
Unterleibsinfektionen:
Über Fälle von Unterleibsinfektionen wurde bei Anwendung aller Formen intrauteriner Kontrazeptiva berichtet. Unterleibsinfektionen können ernsthafte Folgen haben und die Fertilität beeinträchtigen sowie das Risiko ektopischer Schwangerschaften erhöhen. Risikofaktoren für Unterleibsinfektionen (z.B. Verkehr mit mehreren Sexualpartnern, sexuell übertragbare Infektionen, PIDs in der Anamnese) sind daher gründlich zu evaluieren.
Bei Anwenderinnen von Intrauterinsystemen aus Kupfer ist die Rate an Unterleibsinfektionen im ersten Monat nach der Insertion am höchsten und nimmt anschliessend langsam ab.
Falls bei der Anwenderin rezidivierende Endometritiden oder andere entzündliche Erkrankungen des kleinen Beckens auftreten oder falls eine akute Infektion schwer verläuft oder nicht innerhalb von weniger Tage auf eine entsprechende Behandlung anspricht, muss Levosert entfernt werden. Selbst bei nur geringfügigen Symptomen, die auf eine Infektion hinweisen, sind bakteriologische Untersuchungen angezeigt und eine Überwachung empfohlen.
Nach Insertion eines Intrauterinsystems wie Levosert können, wie auch bei anderen gynäkologischen oder chirurgischen Eingriffen, in sehr seltenen Fällen schwere Infektionen bis hin zur Sepsis (einschliesslich Sepsis mit Streptokokken der Gruppe A) auftreten.
Ektopische Schwangerschaft:
Wenn Frauen nach Insertion eines Levonorgestrel-haltigen IUS schwanger werden, ist das relative Risiko für eine ektopische Schwangerschaft erhöht. Frauen, die während der Verwendung von Levosert schwanger werden, sind deshalb im Hinblick auf eine ektopische Schwangerschaft zu untersuchen. Die Anwenderin ist auf die möglichen Symptome einer Extrauteringravidität (Auftreten heftiger Schmerzen im unteren Abdomen, insbesondere im Zusammenhang mit einem Ausbleiben der Menstruation bzw. beim Auftreten einer Blutung nach vorheriger Amenorrhoe) hinzuweisen und zu informieren, dass sie bei derartigen Symptomen umgehend einen Gynäkologen konsultieren sollten.
Dies gilt in besonderem Masse für Anwenderinnen mit einer ektopischen Schwangerschaft in der Anamnese sowie bei Patientinnen nach Eileiteroperationen oder entzündlichen Erkrankungen des kleinen Beckens. Diese Anwenderinnen sind auf ein erhöhtes Risiko und die Symptome einer Extrauteringravidität ausdrücklich hinzuweisen, und andere kontrazeptive Methoden sollten erwogen werden.
In den klinischen Studien liegt die Rate extrauteriner Schwangerschaften unter Levonorgestrel-haltigen IUS bei ca. 0.1% pro Jahr.
Levosert ist für junge nulligravide Frauen nicht die Methode der ersten Wahl. Vor der Insertion ist die Anwenderin über Wirksamkeit, Risiken und Nebenwirkungen von Levosert aufzuklären, insbesondere über das seltene Risiko einer Uterusperforation sowie über die Möglichkeit einer ektopischen Schwangerschaft im Falle eines Kontrazeptionsversagens.
Blutungsmuster:
Bei Frauen, die Levonorgestrel-haltige IUS anwenden, können unterschiedliche Arten von Menstruationsstörungen auftreten (häufigere, verlängerte, verkürzte oder verstärkte Blutungen, Zwischen- und Schmierblutungen, Oligomenorrhoe, Amenorrhoe, Dysmenorrhoe). Bei einigen Frauen im gebärfähigen Alter kann es im Prozess der Inaktivierung der Endometriumsproliferation während der ersten Monate nach der Insertion von Levosert zu einer Zunahme von Schmierblutungen kommen. Im weiteren Verlauf führt die Unterdrückung der Endometriumsproliferation zu einer Reduktion der Blutungsdauer und -menge. Im ersten Monat nach Insertion eines Levonorgestrel-haltigen IUS kommt es bei etwa einem Fünftel der Anwenderinnen zu einer verlängerten Blutungsdauer (mehr als 8 Tage). Bereits im dritten Zyklus weist jedoch nur noch eine geringe Zahl an Anwenderinnen eine verlängerte Blutungsdauer auf.
Bei Frauen im gebärfähigen Alter entwickelt sich über die Zeit eine Oligo- und/oder Amenorrhoe (bei 38% bzw. 16% der Frauen).
Falls 6 Wochen nach Insertion des IUS die Menstruation nicht eintritt, ist ein Schwangerschaftstest durchzuführen. Die Möglichkeit einer Schwangerschaft sollte ebenfalls berücksichtigt werden, wenn bei vorhandenen Menstruationszyklen die Menstruation nicht innerhalb von 6 Wochen nach der vorhergehenden eintritt. Ein wiederholter Schwangerschaftstest bei Vorliegen einer Amenorrhoe ist hingegen in der Regel nicht nötig, es sei denn, es liegen sonstige Anzeichen für eine Schwangerschaft vor.
Thromboembolische Ereignisse:
Epidemiologische Studien zeigen ein erhöhtes Risiko venöser und arterieller thromboembolischer Erkrankungen (wie z.B. tiefe Venenthrombose, Lungenembolie, Myokardinfarkt oder Apoplexie) bei der Anwendung kombinierter hormonaler Kontrazeptiva (CHC). Gemäss neuesten Daten ist hingegen das Risiko unter Gestagen-Monopräparaten (wie Levosert) vermutlich nicht erhöht. Trotzdem sollten bei Auftreten möglicher Symptome thromboembolischer Ereignisse entsprechende diagnostische und therapeutische Massnahmen eingeleitet werden.
Im Falle einer bestätigten Thrombose sollten die Entfernung von Levosert und geeignete alternative, nichthormonale Kontrazeptionsmethoden in Betracht gezogen werden.
Erste Anzeichen venöser thromboembolischer Ereignisse können sein:
starke Schmerzen oder Schwellung in einem Bein, ungewohnt stechende Schmerzen unklarer Ursache beim Atmen oder Husten, Kurzatmigkeit, Schmerz oder Engegefühl in der Brust.
Erste Anzeichen arterieller thromboembolischer Ereignisse können sein:
plötzliche starke Schmerzen in der Brust, eventuell mit Ausstrahlung in den linken Arm, plötzliche Atemnot, extremes Schwächegefühl, erstmaliges Auftreten einer Migräne oder jegliche ungewöhnliche, schwere und anhaltende Kopfschmerzen; plötzliche Taubheit oder Kraftlosigkeit des Gesichtes, eines Armes oder Beines, vor allem einer Körperhälfte; motorische Störungen, plötzlicher teilweiser oder vollständiger Visusverlust; Diplopie; unartikulierte Sprache oder Aphasie; Schwindel; Bewusstseinsverlust mit oder ohne fokale Krampfanfälle; deutlicher Blutdruckanstieg.
Bei der Nutzen-Risiko-Abwägung bezüglich vaskulärer Risiken sollte beachtet werden, dass durch angemessene Behandlung bestehender Erkrankungen das damit verbundene Thromboserisiko verringert werden kann und dass eine Schwangerschaft im Vergleich zur Anwendung von Levosert ein höheres Risiko birgt.
Mammakarzinom:
Das Risiko für Mammakarzinome steigt mit dem Alter. Während der Anwendung kombinierter hormonaler Kontrazeptiva (CHC) ist das Risiko der Diagnose eines Mammakarzinoms leicht erhöht. Nach Absetzen der CHC nimmt das erhöhte Risiko kontinuierlich innerhalb von 10 Jahren ab. Es hängt nicht von der Dauer der Anwendung ab, sondern vom Alter der Anwenderin. Für Gestagen-Monopräparate wie Levonorgestrel-haltige IUS ist die verfügbare Datenlage zu gering, um diesbezügliche Berechnungen zu erstellen. Es liegen widersprüchliche Befunde vor, ob auch solche Präparate das Risiko für ein Mammakarzinom erhöhen können. Die bisher vorliegenden Daten zur Anwendung Levonorgestrel-haltiger IUS bei Frauen im gebärfähigen Alter ergaben keine Hinweise für eine relevante Risikoerhöhung.
Lebererkrankungen:
In seltenen Fällen wurden nach Anwendung hormonaler Wirkstoffe, wie sie Levosert enthält, über gutartige, noch seltener über bösartige Lebertumore berichtet, die vereinzelt zu lebensgefährlichen intraabdominalen Blutungen geführt haben. Wenn starke Oberbauchschmerzen, eine Lebervergrösserung oder Anzeichen einer intraabdominalen Blutung auftreten, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
Bei Auftreten eines Ikterus sowie bei Lebervergrösserung mit Verdacht auf Entwicklung von Lebertumoren ist Levosert zu entfernen.
Funktionelle Ovarialzysten:
In den Fällen, in denen es nach Einlage von Levosert weiterhin zu einer Follikelreifung kommt, kann es gelegentlich zu einer verzögerten Follikelatresie und damit zu einer weiteren Grössenzunahme des entsprechenden Follikels kommen. Solche vergrösserten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden. Vergrösserte Follikel können bei etwa 7% der Anwenderinnen unter der Anwendung Levonorgestrel-haltiger IUS beobachtet werden. Diese Follikel sind meistens asymptomatisch, können aber auch Unterleibsschmerzen oder eine Dyspareunie verursachen. In den meisten Fällen sind solche vergrösserten Follikel klinisch nicht relevant und bilden sich im Lauf von 2 - 3 Monaten zurück. Sollte dies nicht der Fall sein, sind fortlaufende sonographische Kontrollen sowie gegebenenfalls auch andere diagnostische oder therapeutische Massnahmen zu empfehlen. In Einzelfällen kann eine chirurgische Intervention erforderlich sein.
Depressive Störungen
Depressionen bzw. depressive Verstimmungen sind als mögliche unerwünschte Wirkungen bei der Anwendung von Sexualhormonen, einschliesslich hormonaler Kontrazeptiva, bekannt (siehe auch «Unerwünschte Wirkungen»). Solche Störungen können bereits kurz nach Beginn der Behandlung auftreten. Eine Depression kann schwerwiegend verlaufen und stellt einen Risikofaktor für Suizide bzw. suizidales Verhalten dar. Anwenderinnen hormonaler Kontrazeptiva sollen daher über mögliche Symptome depressiver Störungen informiert werden. Der Anwenderin soll dringend geraten werden, sich umgehend an einen Arzt/eine Ärztin zu wenden, falls sie unter der Anwendung des Kontrazeptivums Stimmungsschwankungen oder andere Symptome einer Depression bemerkt.
Anwenderinnen mit einer schweren Depression in der Anamnese sollen sorgfältig überwacht werden. Falls es unter der Anwendung von Levosert erneut zu schweren depressiven Zuständen kommt, muss das Arzneimittel abgesetzt werden.
In folgenden Fällen ist eine besondere Überwachung der Anwenderin geboten.
• Herzklappenerkrankungen:
Eine Endokarditis Prophylaxe ist bei Einlage und Entfernung des IUS gemäss den aktuellen Richtlinien für die Endokarditis-Prophylaxe nicht notwendig. Bei Unklarheiten soll mit dem behandelnden Kardiologen Rücksprache genommen werden.
• Diabetes mellitus:
Levonorgestrel kann die Glukosetoleranz beeinträchtigen, daher sollte bei Diabetikerinnen der Blutzuckerspiegel überwacht werden. Im Allgemeinen ist jedoch keine Dosisanpassung von Antidiabetika erforderlich.
Es ist darauf hinzuweisen, dass Levosert keinen Schutz vor einer HIV-Infektion (AIDS) oder anderen sexuell übertragbaren Krankheiten bietet.
Die Anwenderin ist ferner anzuweisen, die Information für Patientinnen aufmerksam zu lesen, damit eine Selbstkontrolle und das rechtzeitige Aufsuchen des Arztes bzw. der Ärztin gewährleistet sind.
InteraktionenUm potentielle Interaktionen zu erkennen, sollte auch die Fachinformation der gleichzeitig verabreichten Arzneimittel konsultiert werden.
Enzyminduktoren
Interaktionen zwischen hormonalen Kontrazeptiva und Arzneimitteln, die mikrosomale Enzyme induzieren, können eine erhöhte Clearance der Sexualhormone verursachen. Dies gilt z.B. für Barbiturate, Carbamazepin, Felbamat, Oxcarbazepin, Phenytoin, Primidon, Rifampicin und Topiramat sowie für Arzneimittel, welche Johanniskraut (Hypericum perforatum) enthalten. Der Einfluss dieser Arzneimittel auf die Wirksamkeit von Levosert ist nicht bekannt, aufgrund der hauptsächlich lokalen Wirkung von Levosert jedoch vermutlich klinisch nicht relevant.
Substanzen mit enzyminduzierender und/oder –inhibierender Wirkung
Darüber hinaus ist bekannt, dass verschiedene Inhibitoren der HIV/HCV-Protease (z.B. Ritonavir, Nelfinavir, Boceprevir) und der Nichtnukleosidischen Reverse-Transkriptase (z.B. Efavirenz) zu einer Erniedrigung oder einer Erhöhung der Plasmakonzentrationen von Gestagenen führen können.
Enzyminhibitoren
Starke und moderate CYP3A4-Inhibitoren wie Azol-Antimykotika (z.B. Itraconazol, Voriconazol, Fluconazol), Makrolid-Antibiotika (z.B. Clarithromycin, Erythromycin), Cobicistat, Diltiazem, Verapamil und Grapefruitsaft können die Plasmaspiegel von Gestagenen erhöhen.
Schwangerschaft, StillzeitSchwangerschaft
Die Anwendung von Levosert ist während einer Schwangerschaft kontraindiziert. Vor Beginn der Anwendung ist eine Schwangerschaft auszuschliessen. Wenn bei eingesetztem IUS sechs Wochen nach der letzten Periode die Menstruation ausbleibt, muss eine Schwangerschaft ebenfalls ausgeschlossen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Im Falle einer Schwangerschaft unter der Anwendung von Levosert sollte das IUS entfernt werden. Die Entfernung von Levosert sowie eine Sondierung des Uterus können allerdings zu einem Spontanabort führen. Jeglicher Versuch einer Entfernung bedingt eine vorherige sonographische Lokalisierung des IUS. Ein hochliegendes intracavitäres System dürfte ein geringeres Risiko für einen Infekt oder Abort bedeuten, seine Entfernung jedoch mit grosser Wahrscheinlichkeit einen Abort induzieren. Eine ektopische Schwangerschaft ist auszuschliessen.
Wird die Schwangerschaft fortgesetzt und das IUS in situ belassen, besteht ein erhöhtes Risiko für Spontanaborte, Frühgeburten und septische Komplikationen. In einem solchen Fall muss die Anwenderin daher über dieses Risiko aufgeklärt und engmaschig sonographisch und infektiologisch überwacht werden. Sie ist ausserdem darauf hinzuweisen alle abnormen Symptome wie grippeähnliche Zustände, Fieber, Schmerzen, Abdominalkrämpfe, Dyspareunie, Blutungen oder Fluor vaginalis umgehend ihrem Arzt mitzuteilen, damit im Falle septischer Komplikationen eine sofortige Intervention gewährleistet ist.
Aufgrund der hohen kontrazeptiven Wirksamkeit liegen nur sehr beschränkte klinische Erfahrungen zu ausgetragenen Schwangerschaften unter Levonorgestrel-haltigen IUS vor. Die Anwenderin sollte jedoch darüber informiert werden, dass gemäss dem aktuellen Stand des Wissens keine Hinweise auf Geburtsdefekte vorliegen, die mit dem Gebrauch eines Levonorgestrel-haltigen IUS, das in situ belassen wurde, in Verbindung gebracht werden.
Aufgrund der lokalen Hormonexposition infolge der intrauterinen Levonorgestrel-Applikation ist eine Virilisierung des Foeten jedoch nicht auszuschliessen.
Stillzeit
Ca. 0.1% der Levonorgestreldosis werden vom Säugling während des Stillens aufgenommen. Da unter der Anwendung von Levonorgestrel-haltigen IUS wie Levosert nur geringe Levonorgestrel-Mengen systemisch verfügbar werden, sind jedoch keine schädigenden Auswirkungen auf den Säugling zu erwarten. Levonorgestrel-haltigen IUS wie Levosert scheinen keinen negativen Einfluss auf die Qualität und Quantität der Muttermilch zu haben. Levosert kann deshalb während der Stillzeit angewendet werden (siehe «Dosierung/Anwendung»).
Bei Insertion während der Stillzeit muss jedoch das in dieser Zeit (bzw. generell während der ersten Monate post partum) erhöhte Risiko für Uterusperforationen beachtet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs sind keine Auswirkungen auf die Fahrtüchtigkeit und das Bedienen von Maschinen festgestellt worden.
Unerwünschte WirkungenDie schwerwiegendsten unerwünschten Wirkungen im Zusammenhang mit der Anwendung hormonaler Kontrazeptiva sind in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben (siehe dort). Auch zu den möglichen Auswirkungen von Levosert auf das Blutungsverhalten wird auf die Rubrik «Warnhinweise und Vorsichtsmassnahmen» verwiesen.
Die häufigsten unerwünschten Wirkungen, welche unter Anwendung Levonorgestrel-haltiger IUS beobachtet wurden, waren Blutungsstörungen und benigne Ovarialzysten.
Nachfolgend sind die unerwünschten Wirkungen, welche in klinischen Studien und/oder während der Marktüberwachung unter Levonorgestrel-haltigen IUS beobachtet wurden, nach Organsystem und Häufigkeit aufgeführt. Die Häufigkeiten sind dabei definiert als:
sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000) und nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann daher nicht abgeschätzt werden).
Infektionen und parasitäre Erkrankungen
Sehr häufig: Vulvovaginitis (10.5%).
Häufig: Infektionen des oberen Genitaltrakts (z.B. Endometritis).
Gelegentlich: Pelvic inflammatory disease, Cervicitis.
Nicht bekannt: Sepsis (inklusive Sepsis durch Streptokokken der Gruppe A).
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen (wie Rash, Urtikaria und Angioödem).
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahme.
Psychiatrische Erkrankungen
Häufig: depressive Verstimmungen/Depression, verringerte Libido.
Gelegentlich: Stimmungsschwankungen.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (15%).
Häufig: Schwindel, Migräne.
Herzerkrankungen
Nicht bekannt: Blutdruckerhöhung.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Abdominalschmerzen (21 %).
Häufig: Übelkeit.
Gelegentlich: Blähungen.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Akne, Hirsutismus.
Gelegentlich: Pruritus, fettiges Haar, Alopezie, Ekzeme, Chloasma.
Selten: Hautausschlag, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Rückenschmerzen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Schmierblutungen (32%), abgeschwächte Menstruationsblutungen (23%), Amenorrhoe (18%), Fluor vaginalis (15%), verstärkte Menstruationsblutungen (12%), Oligomenorrhoe (10%).
Häufig: Unterbauchschmerzen, Dysmenorrhoe, Brustspannen/ Mastalgie, Ovarialzysten, Ausstossung des IUS (partiell oder komplett).
Selten: Uterusperforation (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Bei Frauen, die unter der Anwendung von Levosert schwanger werden, ist das Risiko für eine ektopische Schwangerschaft erhöht.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Ödeme.
Während Insertion und Entfernen wurden folgende unerwünschte Wirkungen beobachtet:
Schmerzen, Blutungen, vasovagale Reaktion mit Schwindel oder Synkope. Bei Epileptikerinnen kann es zu Krampfanfällen kommen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungNicht zutreffend.
Eigenschaften/WirkungenATC-Code
G02BA03
Wirkungsmechanismus
Das intrauterines Wirkstofffreisetzungssystem (IUS) Levosert besteht aus einem annähernd T-förmigen Polyethylenkörper mit einem Hormon-freisetzenden Zylinderreservoir. Dieses Reservoir umhüllt mantelartig den vertikalen Schenkel des IUS und enthält 52 mg Levonorgestrel, welches mittels einer regulierenden Membran aus Polydimethylsiloxan kontinuierlich abgegeben wird.
Das gestagenhaltige Zylinderreservoir ist 19 mm lang, die Gesamtlänge des IUS beträgt 32 mm.
Levonorgestrel ist ein Gestagen mit antiöstrogener Wirkung. Mittels des Intrauterinsystems Levosert wird es direkt in das Cavum uteri verabreicht. Diese Applikationsart erlaubt eine sehr niedrige tägliche Dosis, da das Hormon direkt am Zielorgan freigesetzt wird.
Der kontrazeptive und therapeutische Effekt von Levosert beruht auf der lokalen intrauterinen Wirkung des Levonorgestrels, indem:
• die Proliferation des Endometriums reversibel supprimiert wird,
• und es zu einer Zunahme der Viskosität des Zervixsekrets kommt mit der Folge einer Inhibition der Spermienpassage durch den Zervixkanal.
• Morphologische Veränderungen des Endometriums und eine geringe Fremdkörperreaktion des Endometriums scheinen ebenfalls vorzuliegen. Die Viskositätszunahme des Zervixschleims inhibiert die Spermienpassage durch den Zervixkanal. Das lokale Milieu des Uterus und der Tuben beeinträchtigt die Motilität der Spermien und ihre Funktion, so dass eine Befruchtung verhindert wird. Bei einigen Frauen lässt sich zusätzlich eine Anovulation bzw. eine beeinträchtigte Follikelreifung nachweisen.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Kontrazeptive Wirksamkeit
Levosert ist während sechs Jahren kontrazeptiv wirksam.
Die kontrazeptive Wirksamkeit von Levosert wurde in einer offenen klinischen Studie an n=1751 Frauen im gebärfähigen Alter untersucht. Der Pearl Index für Frauen von 16 bis 35 Jahren betrug im ersten Jahr 0.15 (95% CI: 0.02, 0.55) und lag nach 6 Jahren kumulativ bei 0.18 (95% CI: 0.08, 0.33).
Die Fertilität ist nach Entfernung von Levosert nicht beeinträchtigt; die Schwangerschaftsrate entspricht jener bei Frauen ohne Empfängnisschutz.
Blutungsverhalten
Das Blutungsmuster unter Levonorgestrel-haltigen IUS ist das Resultat der direkten Einwirkung des Levonorgestrels auf das Endometrium und gibt nicht den ovariellen Zyklus wieder. Klare Unterschiede bezüglich Follikelreifung, Ovulation und Steroidhormonproduktion sind nicht in Abhängigkeit von der Art der Menstruation festzustellen.
Bei einigen Frauen im gebärfähigen Alter kommt es nach der Einlage von Levosert im Prozess der Inaktivierung der Endometriumsproliferation in den ersten Monaten zu verlängerten Blutungen und einer Zunahme von Schmierblutungen. Die starke Unterdrückung der Endometriumsproliferation führt im weiteren Verlauf zu einer Reduktion der Blutungsdauer und -menge. Bei einigen Frauen kommt es zu einer Oligo- oder Amenorrhoe. Die Ovarialfunktion ist normal, und natürliche Estradiolspiegel werden aufrechterhalten, selbst wenn es zu einer Amenorrhoe kommt.
Idiopathische Hypermenorrhoe
Levosert kann auch zur Behandlung der idiopathischen Hypermenorrhoe therapeutisch eingesetzt werden. In der Behandlung der Hypermenorrhoe führt das IUS bereits nach 3 Monaten zu einer ausgeprägten Reduktion des menstruellen Blutverlustes. Bei einigen Frauen kommt es sogar zu einer Amenorrhoe. Die Verminderung des Blutverlustes führt zu einem Anstieg des Hämoglobingehaltes. Eine Hypermenorrhoe, die durch submuköse Myome verursacht wird, spricht weniger gut auf die Behandlung mit Levonorgestrel-haltigen IUS an. Wie orale Kontrazeptiva lindern Levonorgestrel-haltige IUS menstruelle Beschwerden.
PharmakokinetikDie in vivo-Freisetzungsrate von Levonorgestrel aus Levosert beträgt initial 20.1 µg/24 Std und sinkt dann auf 17.5 µg/24 Std während des ersten Jahres und 8.6 µg/24 Std während des sechsten Jahres.
- Durchschnitt über 6 Jahre: 13.8 µg/24 Std.
Absorption
Das aus dem IUS freigesetzte Levonorgestrel wird vom Endometrium absorbiert.
Eine Stunde nach Insertion des IUS ist Levonorgestrel im Plasma nachweisbar. Die maximale Plasmakonzentration wird innerhalb von zwei Wochen nach der Insertion erreicht. Aufgrund der mit der Zeit abnehmenden Abgaberate nehmen auch die Plasmakonzentrationen kontinuierlich ab.
Die Cmax wird etwa eine Woche nach der Insertion erreicht und lag bei normalgewichtigen Frauen bei 252 +/- 123 pg/ml. Danach nimmt die Plasmakonzentration ab und liegt nach 1 Jahr bei 168 ± 51 pg/ml und nach 6 Jahren noch bei 93 ± 45 pg/ml.
Die Plasmakonzentration im Steady-State sind damit deutlich niedriger als bei anderen etablierten Anwendungen von Levonorgestrel, die systemischen Wirkungen des Gestagens sind daher minimal.
Distribution
Levonorgestrel ist vor allem an SHBG (Sex hormon binding globulin), zu einem kleineren Teil an Albumin gebunden. Die relative Verteilung (frei, albumingebunden, SHBG-gebunden) hängt von der SHBG-Konzentration im Plasma ab. Nur 1-2% des Levonorgestrels liegen in Form freier Steroide vor. Während der Anwendung von Levosert sinkt die SHBG-Konzentration. In der Folge nimmt der Anteil des gebundenen Levonorgestrels ab, und der freie Anteil steigt.
Das Verteilungsvolumen beträgt 106 Liter.
Etwa 0.1% der mütterlichen Levonorgestrel-Exposition treten in die Muttermilch über.
Metabolismus
Levonorgestrel wird weitgehend in der Leber metabolisiert. Die Hauptmetaboliten im Serum sind unkonjugierte und konjugierte Formen des 3α, 5β-Tetrahydrolevonorgestrels. Basierend auf in vivo und in vitro Studien ist CYP3A4 das Hauptenzym im Stoffwechsel von Levonorgestrel. CYP2E1, CYP2C19 und CYP2C9 sind zu einem geringeren Ausmass am Stoffwechsel beteiligt.
Die Metaboliten von Levonorgestrel haben nur schwache oder gar keine pharmakologische Aktivität.
Elimination
Die metabolische Clearance von Levonorgestrel im Plasma beträgt ungefähr 1.0 ml/min/kg. Die Metaboliten werden mit Stuhl und Urin im Verhältnis 1:1 ausgeschieden. Die Eliminationshalbwertszeit beträgt ungefähr 20 Stunden. Unverändertes Levonorgestrel wird nur in Spuren ausgeschieden.
Kinetik spezieller Patientengruppen
Körpergewicht (KG)
BMI und SHBG-Konzentration beeinflussen die systemischen Levonorgestrel-Konzentrationen. Ein niedriger BMI und/oder hohe SHBG-Spiegel gehen mit erhöhten Levonorgestrel-Konzentrationen einher. Bei Frauen im gebärfähigen Alter mit einem niedrigen Körpergewicht (<55kg) bzw. BMI kann die durchschnittliche Levonorgestrelkonzentration um bis zu 50% höher liegen.
Leberfunktionsstörungen
Es liegen keine Daten zur Pharmakokinetik bei Patientinnen mit Leberinsuffizienz vor.
Nierenfunktionsstörungen
Es liegen keine Daten zur Pharmakokinetik bei Patientinnen mit Niereninsuffizienz vor.
Präklinische DatenPräklinische Untersuchungen mit Levonorgestrel zur Toxizität nach wiederholter Gabe, zur Genotoxizität und zum karzinogenen Potential ergaben keine eindeutigen Hinweise auf besondere Risiken für den Menschen.
Levonorgestrel ist ein Gestagen mit antiöstrogener Wirkung, dessen toxikologische Eigenschaften gut bekannt sind.
Levonorgestrel kann nach hohen parenteralen Dosierungen virilisierende Wirkungen an weiblichen Rattenfeten hervorrufen, wenn es während der sensiblen Phase der Entwicklung der Genitalorgane verabreicht wird. Jedoch wurden nach intrauteriner Verabreichung von Levonorgestrel an trächtige Kaninchen weder Teratogenität noch Anzeichen einer Virilisierung weiblicher Feten festgestellt. Darüber hinaus gibt es keine Anzeichen für Embryotoxizität oder Teratogenität aus reproduktionstoxikologischen Studien mit oraler Verabreichung von Levonorgestrel an Ratten oder Kaninchen.
Die Sicherheitsbeurteilung der Elastomerkomponenten des Hormonreservoirs, der Polyethylenmaterialien des Präparates und der Kombination des Elastomers mit Levonorgestrel wurde sowohl aufgrund der Bestimmung der genetischen Toxizität (Standard in vitro und in vivo Systeme) als auch aufgrund von Biokompatibilitätsuntersuchungen (an Ratten, Mäusen, Meerschweinchen, Kaninchen und in vitro Untersuchungen) vorgenommen. Dabei wurden keine Bioinkompatibilitäten festgestellt.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit „EXP“ bezeichneten Datum eingelegt werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) lagern.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Für die Einlage von Levosert ist die «Anleitung zum Einsetzen» in der Packung zu beachten.
Levosert ist in einem Blister steril verpackt. Der Blister sollte erst unmittelbar vor der Einlage geöffnet werden, danach sollten die üblichen Vorkehrungen getroffen werden, um eine aseptische Handhabung zu gewährleisten. Bei Beschädigung der sterilen Verpackung sollte das IUS nicht verwendet werden.
Das IUS befindet sich an der Spitze eines Inserters und ist nach der Entnahme aus der sterilen Packung im Wesentlichen frei von sichtbaren Verunreinigungen.
Jeder Anwenderin, der ein IUS eingelegt wurde, ist die Packungsbeilage «Information für Patientinnen» zum aufmerksamen Lesen mitzugeben.
Nicht verwendetes Material und Abfälle sollten in Übereinstimmung mit den lokalen Richtlinien entsorgt werden.
Zulassungsnummer65444 (Swissmedic)
PackungenLevosert 20 µg/24h: 1 Intrauterines Wirkstofffreisetzungssystem [B]
ZulassungsinhaberinGedeon Richter (Schweiz) AG, Genf
Stand der InformationAugust 2023
Anleitung für die Insertion
Levosert sollte nur von Ärzten / Ärztinnen eingelegt werden, die Erfahrung in der Einlage von Levonorgestrel-haltigen Intrauterinsystemen (IUS) haben und zuvor ausreichend von der Zulassungsinhaberin geschult wurden und die nachfolgenden Anweisungen vor der Insertion sorgfältig gelesen haben.
Levosert ist in einem Blister steril verpackt. Der Blister sollte erst unmittelbar vor der Insertion geöffnet und danach unter aseptischen Bedingungen gehandhabt werden. Das IUS darf nicht verwendet werden, falls die Verpackung beschädigt oder geöffnet ist. Bei Frauen im fertilen Alter wird Levosert innerhalb von 7 Tagen nach Beginn der Menstruation eingesetzt. Es kann in jeder Phase des Zyklus durch ein neues System ersetzt werden.
WICHTIG!
Wenn die Insertion schwierig ist und/oder bei oder nach der Insertion ungewöhnliche Schmerzen oder Blutungen auftreten, sind unverzüglich eine körperliche Untersuchung und eine Sonografie durchzuführen, um eine Perforation des Corpus uteri oder der Zervix auszuschliessen. Gegebenenfalls ist das System zu entfernen und durch ein neues steriles System zu ersetzen.
Bitte melden Sie jeden Fall einer Uterusperforation oder Schwierigkeiten bei der Insertion über das nationale Meldesystem.
1.Durch gynäkologische Palpation ist zunächst die Lage (Anteversion, Retroversion) und Grösse des Uterus zu bestimmen. Das Vorliegen einer Schwangerschaft oder anderer Kontraindikationen sind auszuschliessen.
2.Spekulum einführen. Vagina und Zervix mit einer geeigneten antiseptischen Lösung reinigen.
3.Im Falle einer Zervixstenose kann ein Zervixdilatator verwendet werden. Ein etwaiger Widerstand beim Einführen darf nicht durch Kraftanwendung überwunden werden.
4.Zervix mit einer Pozzi-Zange fassen und durch leichten Zug den Zervixkanal und das Cavum uteri strecken und gerade ausrichten.
5.Länge des Uterus durch Hysterometrie bestimmen. Falls die Uteruslänge <5,5 cm beträgt, ist der Vorgang abzubrechen.
|
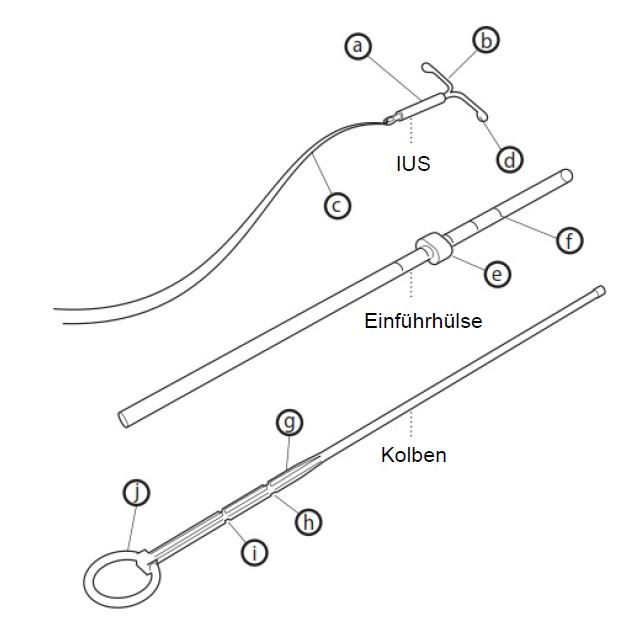
Beschreibung
|
| |
|
|
Levonorgestrel-haltiger Zylinder
|
|
| |
seitliche Arme
| |
Rückholfäden
| |
Endverdickungen
| |
Flansch
| |
Skala
| |
verdickte Markierung
| |
erste Einkerbung
| |
zweite Einkerbung
| |
Ring
|
Vorbereitungen für die Insertion
|
|
|
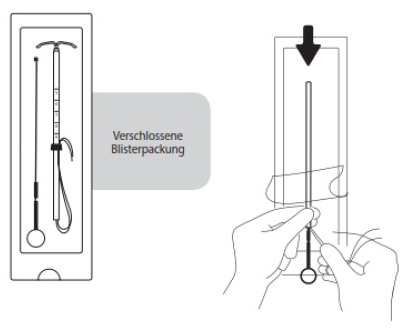
Kolben und IUS in die Hülse einführen
Die Blisterpackung vom unteren Rand her ein Stück weit (etwa 1/3) öffnen und den Kolben in die Einführhülse stecken. Die Rückholfäden aus dem Flansch herausführen. Durch Ziehen an den Fäden das IUS in die Hülse einführen. Die Arme des IUS müssen in einer horizontalen Ebene bleiben, parallel zur flachen Seite des Flansches.
| |
|
|
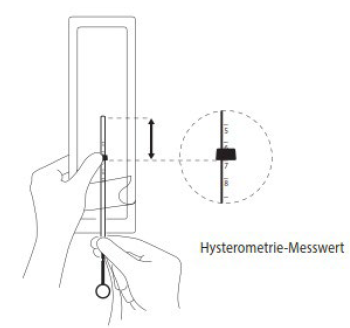
Das untere Ende des Flansches bis zur bestimmten Uteruslänge verschieben
Verschieben Sie den blauen Flansch so weit, dass sein unteres Ende den bei der Hysterometrie ermittelten Wert der Uteruslänge anzeigt. Die flachen Seiten des Flansches müssen immer parallel zu den Armen bleiben, damit sich die Arme im Cavum uteri korrekt öffnen können.
| |
|
|
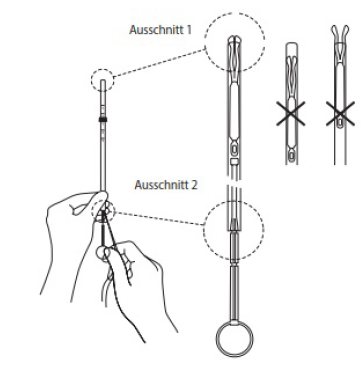
Position des IUS in der Einführhülse korrigieren
Kolben festhalten und Hülse unter Zug am Faden bewegen, um die Lage des IUS einzustellen. Die Endverdickungen der seitlichen Arme müssen (etwas über dem oberen Ende der Einführhülse) einander eng gegenüber stehen (siehe Ausschnitt 1), und das distale Ende der Hülse muss auf Höhe der ersten Einkerbung des Kolbens liegen (siehe Ausschnitt 2). Wenn die Hülse nicht an der ersten Einkerbung des Kolbens ausgerichtet ist, ist der Faden fester anzuspannen.
|
Durchführung der Insertion
|
|
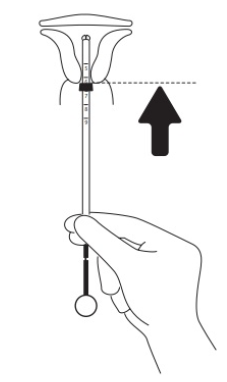
|
Das System in den Zervixkanal einführen, bis der blaue Flansch die Zervix berührt
Das ganze System aus der Blisterpackung nehmen, dabei den Kolben und die Hülse zusammen in der korrekt ausgerichteten Position festhalten. Das System in den Zervixkanal einführen, bis der blaue Flansch an die Zervix stösst.
| |
|
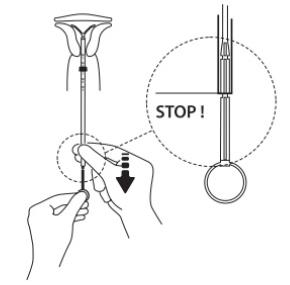
|
Arme des Intrauterinsystems freigeben
Kolben festhalten, den Faden loslassen und die Einführhülse zurückziehen, bis das untere Ende an der zweiten Einkerbung des Kolbens liegt.
| |
|
|
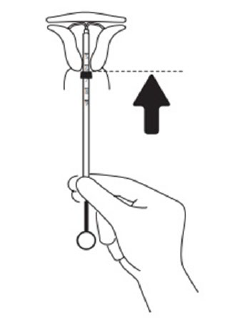
Positionierung des IUS im Fundus uteri
Um das IUS bis zum Fundus vorzuschieben, die Einführhülse zusammen mit dem Kolben einschieben, bis der blaue Flansch wieder mit der Zervix in Kontakt ist. Levosert liegt dann korrekt im Cavum uteri.
| |
|
|
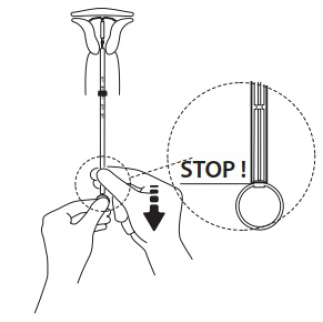
IUS aus der Hülse in das Cavum uteri freigeben
Ohne den Kolben zu bewegen die Einführhülse bis zum Ring des Kolbens zurückziehen. Ein leichter Widerstand ist an der Wölbung des Kolbens zu spüren. Ziehen Sie die Hülse dennoch bis zum Ring des Kolbens zurück. Levosert ist dann vollständig aus der Einführhülse freigegeben.
| |
|
|
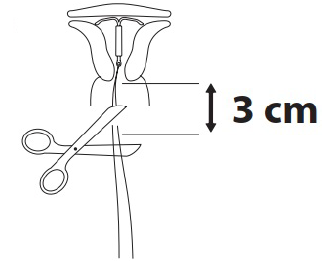
Inserter entfernen und die Fäden abschneiden
Zuerst den Kolben des Inserters, dann die Einführhülse herausziehen. Die Rückholfäden etwa 3 cm unterhalb der Zervix abschneiden.
|
Entfernen von Levosert
Levosert wird durch vorsichtiges Ziehen an den Rückholfäden mit einer Zange entfernt. Falls die Fäden nicht sichtbar sind und sich das IUS im Cavum uteri befindet, kann es mithilfe einer schmalen Zange oder einer Hakensonde entfernt werden. Dies kann eine Dilatation der Zervix erfordern.
Wenn eine Schwangerschaft nicht erwünscht ist, sollte bei Frauen im gebärfähigen Alter die Entfernung während der Menstruation erfolgen, sofern ein Menstruationszyklus zu bestehen scheint. Falls das System in der Mitte eines Zyklus entfernt wird und die Frau in der vorausgehenden Woche Geschlechtsverkehr hatte, besteht das Risiko einer Schwangerschaft, es sei denn, es wird unmittelbar nach der Entfernung ein neues System eingesetzt.
Nach der Entfernung von Levosert sollte das IUS auf seine Unversehrtheit überprüft werden.
Die Knöpfe an den horizontalen Armen verhindern in der Regel eine vollständige Loslösung des Zylinders vom T-Körper. Bei schwierigen Entfernungen wurde jedoch in Einzelfällen über ein Verschieben des Hormonzylinders über die horizontalen Arme berichtet, sodass diese im Zylinder verborgen waren. Sofern festgestellt wurde, dass das IUS vollständig ist, sind in diesem Fall keine weiteren Massnahmen erforderlich.
|