ZusammensetzungWirkstoffe
Dinoprostonum.
Hilfsstoffe
Hydrogel-Polymer
Macrogolum 8000 (E1521), 1,2,6-Hexantriolum, Dicyclohexylis methani-4,4'-diisocyanas, Ferri chloridum.
Rückholsystem
Polyesterum.
Indikationen/AnwendungsmöglichkeitenMedikamentöse Reifung der Zervix zur Geburtseinleitung am Termin (ab der vollendeten 37. Schwangerschaftswoche) mit Bishop Score 6 oder weniger, sofern die Geburtseinleitung indiziert ist und keine Kontraindikationen von Seiten des Kindes oder der Mutter vorliegen.
Dosierung/AnwendungPropess darf nur in Kliniken mit voll eingerichteten geburtshilflichen Abteilungen und intensiv-medizinischen Einrichtungen mit der Möglichkeit der kontinuierlichen Überwachung von Uterusaktivität und Fetus unter entsprechender fachärztlicher Aufsicht verwendet werden.
Nach Insertion des Vaginalinserts müssen Uterusaktivität und Zustand des Fetus sorgfältig und regelmässig überwacht werden.
Bei Geburtsbeginn muss das Vaginalinsert entfernt werden. Die Entfernung des Vaginalinserts geschieht durch leichten Zug an der Polyester-Schnur.
Propess muss spätestens 24 Stunden nach Insertion entfernt werden, unabhängig davon, ob eine Zervixreifung erreicht wurde. Falls nach Entfernen des Vaginalinserts eine Therapie mit Oxytocin eingeleitet wird, soll das Intervall mindestens 30 Minuten betragen. Von der Einlage eines zweiten Propess-Vaginalinserts wird abgeraten.
Art der Anwendung
Siehe «Sonstige Hinweise», Abschnitt «Hinweise für die Handhabung».
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Propess wurde bei Schwangeren unter 18 Jahren nicht untersucht.
Ältere Patientinnen
Bei Frauen nach der Menopause besitzt Propess keine Indikation.
Patientinnen mit Nierenfunktionsstörungen
Propess wurde bei Patientinnen mit Niereninsuffizienz nicht untersucht. Es können daher keine Dosierungsempfehlungen gemacht werden. Bei Patientinnen mit schwerer oder terminaler Niereninsuffizienz sollte Propess nicht angewendet werden, da Metabolismus und Elimination von Prostaglandinen beeinträchtigt sein können.
Patientinnen mit Leberfunktionsstörungen
Propess wurde bei Patientinnen mit Leberinsuffizienz nicht untersucht. Es können daher keine Dosierungsempfehlungen gemacht werden.
Kontraindikationen·Anzeichen von mütterlichen oder fetalen Komplikationen, insbesondere fetaler Distress und uterine Hyperstimulation;
·vorausgegangene grössere operative Eingriffe am Uterus wie z.B. Sectio caesarea oder Myomenukleation (siehe «Warnhinweise und Vorsichtsmassnahmen»);
·Zervixruptur oder grössere operative Eingriffe am Gebärmutterhals (d.h. andere als Biopsien und zervikale Abrasion) in der Anamnese;
·Verhältnisse, die einer natürlichen Entbindung entgegenstehen, wie z.B. Steisslage, Lage- und Stellungsanomalie, ausgeprägtes Kopf-Becken-Missverhältnis, vermutete oder bestätigte Notlage des Ungeborenen, schwierige oder traumatische Entbindungen in der Anamnese;
·Placenta praevia;
·Entzündungskrankheiten im Bereich des kleinen Beckens;
·ungeklärte uterine Blutungen während der aktuellen Schwangerschaft;
·Multiparae mit mehr als 3 vorangegangenen termingerechten Geburten;
·Mehrlingsschwangerschaften;
·Gabe von Oxytocin und/oder anderen weheninduzierenden Wirkstoffen (siehe «Interaktionen»);
·nach Einsetzen der Wehen;
·vor einer Amniotomie;
·bekannte oder vermutete Überempfindlichkeit gegenüber Prostaglandinen oder einem der Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenPropess darf nur in Kliniken mit spezialisierten geburtshilflichen Abteilungen mit Einrichtungen für die kontinuierliche Überwachung von Uterus und Fetus angewendet werden.
Vor der Anwendung von Propess muss die Eignung der Patientin, insbesondere in Bezug auf den Zustand der Zervix, sorgfältig abgeklärt werden. Nach Insertion des Vaginalinserts müssen Uterusaktivität und Zustand des Fetus durch qualifiziertes medizinisches Fachpersonal sorgfältig und kontinuierlich oder in kurzen, regelmässigen Abständen elektronisch überwacht werden. Die Dilatation des Zervixkanals muss regelmässig kontrolliert werden. Bei Anzeichen mütterlicher oder fetaler Komplikationen oder anderer unerwünschter Wirkungen muss die Behandlung durch Entfernen des Vaginalinserts aus der Vagina abgebrochen werden.
Propess darf bei Patientinnen mit Sectio caesarea oder anderen Uterusoperationen in der Anamnese aufgrund des Risikos einer Uterusruptur und damit verbundener Komplikationen nicht angewendet werden. Über Uterusrupturen im Zusammenhang mit der Anwendung von Propess wurde berichtet, insbesondere bei Patientinnen, bei denen das Arzneimittel trotz des Vorliegens von Kontraindikationen (siehe «Kontraindikationen») angewendet wurde.
Bei Patientinnen mit einer Uterushypertonie in der Anamnese darf Propess nur mit Vorsicht angewendet werden.
Bei Auftreten verstärkter oder verlängerter Uteruskontraktionen muss das Propess Vaginalinsert wegen der Gefahr einer Uterushypertonie oder Uterusruptur sofort entfernt werden.
CTG-Veränderungen und unspezifischer fetaler Distress wurden während und nach der Anwendung von intravaginalem Dinoproston beobachtet. Ferner trat eine erhöhte Uterusaktivität mit hypertonen Kontraktionen mit und ohne fetalen Distress auf. Da Prostaglandine eine Potenzierung der uterotonen Wirkung von wehenfördernden Arzneimitteln bewirken, steigt das Risiko einer Hyperstimulation, wenn Dinoproston vor einer Oxytocin-Gabe nicht abgesetzt wird.
Fälle von intrauterinem Fruchttod sowie Todesfälle bei Neugeborenen nach Geburtseinleitung mit Propess wurden nach der Marktzulassung beobachtet, insbesondere nach vorausgehenden schwerwiegenden Komplikationen wie z.B. einer Uterusruptur.
Die Erfahrungen über den Einsatz von Propess bei Patientinnen mit vorzeitigem Blasensprung sind beschränkt. Daher ist beim Einsatz von Propess bei diesen Patientinnen besondere Vorsicht geboten. Da die Wirkstofffreisetzung aus dem Insert durch die Amnionflüssigkeit erhöht werden kann (siehe „Pharmakokinetik“), sollten Uterusaktivität und Zustand des Fetus besonders sorgfältig überwacht werden.
Zur Anwendung von Propess bei Erkrankungen, welche die Funktion von Lunge, Leber oder Niere beeinträchtigen, liegen keine Daten vor. Da bei solchen Erkrankungen der Metabolismus von Prostaglandin E2 verändert sein kann, wird die Anwendung von Propess bei diesen Patientinnen nicht empfohlen.
Nach einer Geburtseinleitung wurde post partum ein erhöhtes Risiko einer disseminierten intravasalen Gerinnung (DIG) beschrieben. Als Risikofaktoren für das Auftreten einer DIG gelten dabei ein Alter ≥35 Jahren und ein Gestationsalter >40 Wochen sowie Komplikationen während der Schwangerschaft wie arterielle Hypertonie, Gestationsdiabetes oder Hypothyreose. Eine medikamentöse Weheninduktion kann das Risiko im Zusammenhang mit diesen Faktoren zusätzlich erhöhen. Bei Vorliegen solcher Risikofaktoren sollten Uterotonika wie Propess daher unter besonderer Vorsicht angewendet und post partum sorgfältig auf mögliche Anzeichen einer DIG (wie z.B. Fibrinolyse) geachtet werden.
Wie bei anderen Methoden zur Geburtseinleitung sollte der behandelnde Arzt berücksichtigen, dass die Anwendung von Dinoproston zu einer unbeabsichtigten Schädigung bzw. Ablösung der Plazenta und anschliessender Embolisierung von antigenem Gewebe führen kann. Als seltene Folge kann daraus ein anaphylaktisches Schwangerschaftssyndrom (Amnioninfusionssyndrom) resultieren.
Bei Infektionen der Vagina oder der Zervix sollen diese vor der Geburtseinleitung entsprechend behandelt werden.
Falls vor dem Blasensprung und vor dem erwarteten Beginn der Wehen eine Epiduralanästhesie vorgenommen wird, empfiehlt es sich, das Propess Vaginalinsert vorher zu entfernen.
In folgenden Situationen darf Propess nur mit Vorsicht angewendet werden: beeinträchtigte Herz-Kreislauf-Funktion, Asthma oder Glaukom.
Eine Wiederholung der Behandlung mit einer zweiten Dosis Propess wird nicht empfohlen, da dies nicht untersucht wurde.
Eine Therapie mit nichtsteroidalen Antiphlogistika (einschliesslich Acetylsalicylsäure) sollte vor Anwendung von Propess beendet werden, da diese zu einer Wirkungsabschwächung von Propess führen könnten (siehe «Interaktionen»).
InteraktionenEs wurden keine Interaktionsstudien mit Propess durchgeführt.
Prostaglandine können die uterotone Wirkung anderer Arzneimittel zur Weheninduktion potenzieren. Daher sollte Propess nicht gleichzeitig mit anderen Arzneimitteln zur Weheninduktion angewendet werden. Bei sequentieller Verabreichung von Oxytocin im Anschluss an eine Anwendung von Propess soll das Intervall mindestens 30 Minuten betragen, und Uterusaktivität und Zustand des Fetus müssen kontinuierlich überwacht werden.
Nichtsteroidale Antiphlogistika (NSAID's) vermindern die endogene Prostaglandinsynthese, was den pharmakodynamischen Effekt auf das Myometrium antagonisieren und zu einem verzögerten Wirkungseintritt von Dinoproston führen kann. Diese Arzneimittel sollten daher vor der Anwendung von Dinoproston abgesetzt werden.
Schwangerschaft, StillzeitSchwangerschaft
Propess wird ausschliesslich zur Zervixreifung bei Schwangeren am Termin bei bestehender Indikation für eine Geburtseinleitung angewendet.
Propess darf während der früheren Phasen der Schwangerschaft (d.h. vor Vollendung der 37. SSW) nicht angewendet werden.
Stillzeit
Studien zur Bestimmung von Dinoproston im Kolostrum oder in der Muttermilch nach Verabreichung von Propess liegen nicht vor. Dinoproston könnte in Kolostrum und Muttermilch übertreten. Jedoch ist angesichts der kurzen Halbwertszeit von Dinoproston und seines Hauptmetaboliten nicht mit einem negativen Einfluss auf das gestillte Kind zu rechnen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenIn kontrollierten, doppelblinden Studien an n=1116 Patientinnen waren die häufigsten gemeldeten unerwünschten Wirkungen unter Propess Veränderungen der fetalen Herzfrequenz (6.9%), abnorme Uteruskontraktionen (6.2%) und abnorme Wehentätigkeit mit Auswirkungen auf den Fetus (2.6%).
Nachfolgend sind die in klinischen Studien und während der Marktüberwachung unter der Anwendung von Propess im Geburtsverlauf beobachteten unerwünschten Wirkungen nach Organsystem und Häufigkeit angegeben.
Die Häufigkeiten sind dabei wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100 und <1/10), gelegentlich (≥1/1000 und <1/100), selten (≥1/10'000 und <1/1000), sehr selten (<1/10'000), unbekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Erkrankungen des Blutes und des Lymphsystems
Unbekannt: disseminierte intravasale Gerinnung.
Erkrankungen des Immunsystems
Unbekannt: Überempfindlichkeitsreaktionen (einschliesslich anaphylaktischer Reaktionen).
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerzen.
Herzerkrankungen
Häufig: Veränderungen der fetalen Herzfrequenz.
Gelegentlich: Hypotonie.
Erkrankungen des Gastrointestinaltrakts
Unbekannt: Bauchschmerzen, Übelkeit, Erbrechen, Diarrhoe.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Pruritus.
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Häufig: abnorme Wehentätigkeit (einschliesslich Fälle mit Beeinträchtigung des Fetus), Mekonium im Fruchtwasser.
Gelegentlich: postpartale Blutung, vorzeitige Plazentalösung, Geburtsstillstand, Chorioamnionitis, Uterusatonie.
Unbekannt: Uterusruptur, anaphylaktisches Schwangerschaftssyndrom, fetal distress, Totgeburt (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Brennen im Vulvovaginalbereich.
Unbekannt: Ödeme im Genitalbereich.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: fieberhafte Erkrankungen.
Die folgenden unerwünschten Wirkungen wurden beim Neugeborenen nach Anwendung von Propess im Geburtsverlauf beschrieben:
Erkrankungen des Nervensystems
In den klinischen Studien wurde unter der Anwendung von Propess ein Fall einer neonatalen Enzephalopathie beobachtet. Aufgrund der Art der Grunderkrankungen der Mutter sowie der multiplen mütterlichen Komedikationen prä- und perinatal ist die Beurteilung eines möglichen Kausalzusammenhanges mit Dinoproston nicht möglich.
Erkrankungen der Atemwege, des Brustraumes und Mediastinums
Gelegentlich: Respiratory Distress-Syndrom.
Leber- und Gallenerkrankungen
Gelegentlich: neonatale Hyperbilirubinämie.
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Gelegentlich: niedriger Apgar-Wert.
Unbekannt: neonataler Tod.
Es ist bekannt, dass Dinoproston den Ductus arteriosus Botalli während der Schwangerschaft offen hält. Nach Anwendung von Propess wurde jedoch während der Neonatalphase keine Zyanose beschrieben.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEine Überdosierung oder eine Überempfindlichkeit gegenüber PGE2 kann starke und zu häufige Uteruskontraktionen bis hin zu einem uterinen Hypertonus mit oder ohne fetal distress bewirken. In diesen Fällen sollte das Propess Vaginalinsert sofort entfernt und ggf. das fetal distress-Syndrom behandelt werden. Falls die Uterushyperstimulation durch Abbruch der Behandlung nicht abklingt, sollte eine Tokolyse (z.B. mit entsprechenden Beta-Sympathomimetika) durchgeführt werden.
Eigenschaften/WirkungenATC-Code
G02AD02
Wirkungsmechanismus
Das Propess Vaginalinsert besteht aus einem flachen, rechteckigen, nicht abbaubaren Polymer mit abgerundeten Ecken, in welchem der Wirkstoff eingebettet ist, und ist umgeben von einem Netz aus Polyester mit Schnur, welches die Entfernung des Vaginalinserts erleichtert.
Der Wirkstoff von Propess ist das dem natürlichen Prostaglandin E2 (PGE2) entsprechende Dinoproston.
Dinoproston bewirkt im Verlauf der Zervixreifung eine Vielzahl biochemischer und struktureller Veränderungen, welche insgesamt zu einer Verminderung des Widerstandes des unteren Uterinsegmentes führen. Dabei wird die Zervix weich und das Ostium dilatiert und erlaubt so die Passage des Fetus durch den Geburtskanal. Gleichzeitig wird das Enzym Kollagenase aktiviert.
Die kontinuierliche lokale Verabreichung von Dinoproston bewirkt eine Reifung der Zervix und rhythmische Uteruskontraktionen und führt so zur Geburtseinleitung.
Pharmakodynamik
Siehe «Wirkungsmechanismus».
Klinische Wirksamkeit
Siehe «Wirkungsmechanismus».
PharmakokinetikAbsorption
Aus der biologisch nicht abbaubaren Matrix des Vaginalinserts werden bei Patientinnen mit intakter Membran und einem vaginalen pH von 4 durchschnittlich ca. 0.3 mg/Stunde Dinoproston während 24 Stunden abgegeben. Bei Patientinnen mit vorzeitigem Blasensprung (und einem daraus resultierenden vaginalen pH von 6) ist die kumulative Dinoproston-Freisetzung aus der Matrix nach 3-12 Stunden im Allgemeinen um ca. 2 mg höher.
Das Reservoir von 10 mg dient dazu, eine konstante Wirkstofffreigabe aufrechtzuerhalten.
Distribution
Dinoproston wird zu 73% an Serumalbumin gebunden und rasch in die Gewebe verteilt.
Metabolismus
Dinoproston wird in Lungen, Nieren, Leber und Milz über verschiedene enzymatische Systeme metabolisiert. Bei einer Lungenpassage werden 90% metabolisiert. In Blut und Urin wurden mindestens 9 Metaboliten nachgewiesen. Der Hauptmetabolit, 11-alpha-Hydroxy-9,15-dioxoprost-5-en-Säure, weist 50% der therapeutischen Aktivität von Dinoproston auf.
Elimination
Die Halbwertszeit von Dinoproston im Blut beträgt 1-3 Minuten. Der grösste Teil der Dosis wird als Dicarbonsäuren und Lactone über die Nieren ausgeschieden.
Kinetik spezieller Patientengruppen
Daten zur Pharmakokinetik bei Patientinnen mit Leber- oder Niereninsuffizienz und bei jugendlichen Patientinnen liegen nicht vor.
Präklinische DatenAus Tierversuchen gibt es Anhaltspunkte, wonach Prostaglandine der Eund F-Gruppen in hohen Dosen die Knochenproliferation fördern. Eine ähnliche Wirkung wurde bei Neugeborenen, welche über längere Perioden Prostaglandinen ausgesetzt waren, beobachtet. Bei der kurzfristigen Anwendung von Propess zur Zervixreifung bei der Geburtseinleitung wurden keine entsprechenden Veränderungen festgestellt.
Die Hydrogel- und Polyesterbestandteile des Vaginalinserts sind inert. Die lokale Verträglichkeit ist gut.
Reproduktionstoxizität, Genotoxizität und Karzinogenität der Polymere wurden nicht untersucht, die Expositionszeit ist jedoch kurz und beträgt maximal 24 Stunden.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Propess muss tiefgekühlt unterhalb von -15°C gelagert werden.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Propess darf nur im Krankenhaus und von geschultem obstetrischem Personal eingesetzt werden. Das Vaginalinsert sollte erst kurz vor dem Einführen aus dem Tiefkühler genommen werden. Es muss vor der Anwendung nicht aufgetaut werden. Das Vaginalinsert muss bis unmittelbar vor der Anwendung in der verschlossenen Aluminium/Polyethylen-Folie gelagert werden. Auf einer Seite des Folienbeutels befindet sich eine Markierung zum Aufreissen der Verpackung. Öffnen Sie die Verpackung an der Markierung entlang der Oberseite des Beutels. Verwenden Sie dafür keine Schere oder andere scharfen Gegenstände, die das Vaginalinsert oder das Rückholband beschädigen könnten.
Das Vaginalinsert sollte niemals aus dem Rückholsystem entfernt werden.
Das Vaginalinsert wird hoch in die posteriore vaginale Fornix eingeführt (siehe Abbildung a). Um sicherzustellen, dass Propess in situ verbleibt, sollte es um 90° gedreht werden, damit es quer in der posterioren vaginalen Fornix der Vagina liegt (Abbildung b). Ggf. kann etwas wasserlösliches Gleitmittel verwendet werden, um das Einführen zu erleichtern.
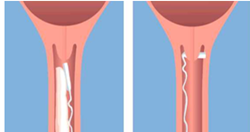
Abb. a Abb. b
Nachdem Propess eingeführt wurde, kann das Rückholband mit einer Schere soweit gekürzt werden, dass extravaginal einige Zentimeter übrig bleiben, um die Entfernung zu erleichtern. Das Ende des Bandes sollte nicht in die Vagina gebracht werden, da die Entfernung sonst schwierig sein könnte.
Nach dem Einführen sollte die Patientin 20 – 30 Minuten liegen, danach darf sie aufstehen. Es sollte darauf geachtet werden, dass Propess nicht versehentlich beim Gang zur Toilette oder bei den vaginalen Untersuchungen entfernt wird.
Entfernung: Propess wird durch leichtes Ziehen am Rückholband entfernt.
Nach dem Einführen quillt Propess auf und ist formbar. Nach der Entfernung ist darauf zu achten, dass das vollständige Produkt (Insert und Rückholband) aus der Vagina entfernt wurde.
Zulassungsnummer53915 (Swissmedic)
PackungenSpitalpackung mit 5 Vaginalinsert. (A)
ZulassungsinhaberinFerring AG, 6340 Baar
Stand der InformationNovember 2021
| 
