ZusammensetzungWirkstoffe
Toxinum botulinicum A*.
* aus Clostridium botulinum.
Hilfsstoffe
Albuminum humanum, 0,9 mg Natrii chloridum.
Eine Durchstechflasche enthält 0.35 mg Natrium.
Indikationen/AnwendungsmöglichkeitenVISTABEL ist indiziert für die vorübergehende Verbesserung des Aussehens, wenn die Ausprägung der folgenden Merkmale eine erhebliche psychologische Belastung für erwachsene Patienten darstellt:
·moderate bis starke vertikale Falten zwischen den Augenbrauen sichtbar bei maximalem Stirnrunzeln (Glabellafalten) und/oder
·moderate bis starke seitliche Kanthalfalten (Krähenfüsse) sichtbar bei maximalem Lächeln und/oder
·moderate bis starke Stirnfalten sichtbar bei maximalem Anheben der Augenbrauen
·moderates bis starkes sichtbares Platysma bei maximaler Kontraktion.
Dosierung/AnwendungÜbliche Dosierung
Siehe die speziellen Empfehlungen für jede unten beschriebene Indikation.
Botulinumtoxin-Einheiten sind nicht von einem Präparat auf andere übertragbar. Die in Allergan-Einheiten empfohlenen Dosierungen unterscheiden sich von denen anderer Botulinumtoxin-Präparate.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Ältere Patienten
Es liegen nur begrenzte klinische Daten aus Phase 3-Studien mit VISTABEL bei Patienten vor, die über 65 Jahre alt sind (siehe «Eigenschaften/Wirkungen»). Solange keine weiteren Studien in dieser Altersgruppe durchgeführt worden sind, wird die Anwendung von VISTABEL bei Patienten über 65 Jahren nicht empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von VISTABEL bei der Behandlung vertikaler Falten zwischen den Augenbrauen (sogenannte Glabellafalten), von Krähenfüssen, Stirnfalten oder bei maximaler Kontraktion sichtbarem Platysma bei Personen unter 18 Jahren wurden nicht untersucht. Der Einsatz von VISTABEL bei Personen unter 18 Jahren wird nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Art der Anwendung
VISTABEL darf nur von Ärzten mit geeigneter Qualifikation angewendet werden, die die entsprechende Erfahrung mit dieser Behandlung haben und über die erforderliche Ausstattung verfügen.
VISTABEL darf nur zur Behandlung eines einzelnen Patienten bei einer Sitzung verwendet werden.
Die optimale Dosis und die Anzahl der Injektionsstellen im jeweiligen Muskel können unter den Patienten variieren. Deshalb ist die Behandlung eines Patienten vom behandelnden Facharzt individuell zu gestalten.
Spezielle Vorsichtsmassnahmen sollen für die Zubereitung der Injektionslösung und die Anwendung sowie für die Inaktivierung und Entsorgung von nicht verwendeten Resten der Injektionslösung beachtet werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Sonstige Hinweise»).
Siehe Abschnitt «Sonstige Hinweise» für Anwendungshinweise, Verdünnungstabelle, Handhabung und Entsorgung der Durchstechflaschen.
Es sollte darauf geachtet werden sicherzustellen, dass VISTABEL nicht in ein Blutgefäss injiziert wird.
Die Sicherheit und Wirksamkeit einer häufigeren Anwendung von VISTABEL als alle 3 Monate wurden nicht untersucht. Daher sollten die Behandlungsintervalle 3 Monate nicht unterschreiten. Bei einer Behandlung von Erwachsenen mit VISTABEL und BOTOX für eine oder mehrere der zugelassenen Indikationen darf die maximale kumulative Dosis in einem Zeitraum von 3 Monaten 400 Einheiten generell nicht überschreiten.
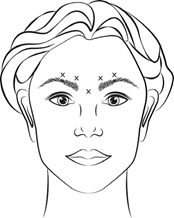
Applikationsanleitung für Glabellafalten:
Rekonstituiertes VISTABEL (100 Allergan-Einheiten/2,5 ml) wird mit einer sterilen 30-Gauge-Nadel injiziert. Es werden jeweils 0,1 ml (4 Allergan-Einheiten) in jede der 5 Injektionsstellen verabreicht (siehe Abbildung 1): 2 Injektionen in jeden M. corrugator und 1 Injektion in den M. procerus (Gesamtdosis 20 Allergan-Einheiten).
Vor und während der Injektion muss mit Daumen oder Zeigefinger fest unter den Augenhöhlenrand gedrückt werden, um eine Diffusion der Lösung in diesem Gebiet zu verhindern. Die Nadel muss während der Injektion superior und medial ausgerichtet bleiben. Um das Risiko einer Ptosis zu reduzieren, müssen Injektionen in der Nähe des M. levator palebrae superioris vermieden werden, insbesondere bei Patienten mit grösseren Brauendepressorkomplexen (Depressor supercilii). Injektionen in den M. corrugator dürfen nur im Mittelteil des Muskels mindestens 1 cm über dem Augenbrauenbogen erfolgen.
Abbildung 1:
Eine Verbesserung der Glabellafalten tritt im Allgemeinen innerhalb einer Woche nach der Behandlung ein. Die Wirkung hält 3 bis 4 Monate nach der Injektion an.
Sicherheit und Wirksamkeit einer häufigeren Anwendung sind bisher noch nicht untersucht worden, und die häufige Anwendung wird daher nicht empfohlen.
Sollte der behandelnde Arzt dies für angemessen halten, können Wiederholungsbehandlungen verabreicht werden, wenn die Wirkung der vorherigen Injektion nachgelassen hat.
Applikationsanleitung für Krähenfüsse:
Rekonstituiertes VISTABEL (100 Allergan-Einheiten/2,5 ml) wird mit einer sterilen 30-Gauge-Nadel injiziert. Es werden jeweils 0,1 ml (4 Allergan-Einheiten) in jede der 3 Injektionsstellen pro Seite (insgesamt 6 Injektionen) in den lateralen M. orbicularis oculi injiziert. Dies ergibt eine Gesamtdosis von 24 Allergan-Einheiten und ein Gesamtvolumen von 0,6 ml (12 Allergan-Einheiten pro Seite).
Bei der Verabreichung von Injektionen sollte die Nadelspitze schräg nach oben und vom Auge abgewandt gehalten werden. Die erste Injektion (A) sollte etwa 1,5 bis 2,0 cm temporal des lateralen Augenwinkels und unmittelbar temporal des Margo orbitalis erfolgen. Wenn sich die Falten in der Krähenfussregion oberhalb und unterhalb des lateralen Augenwinkels befinden, erfolgt die Injektion wie in Abbildung 2 dargestellt. Wenn sich die Falten in der Krähenfussregion jedoch vorwiegend unterhalb des lateralen Augenwinkels befinden, erfolgt die Injektion wie in Abbildung 3 dargestellt.
Abbildung 2: Abbildung 3:
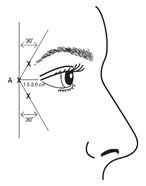
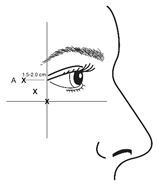
Bei der gleichzeitigen Behandlung mit Glabellafalten beträgt die Dosis 24 Allergan-Einheiten für Krähenfüsse und 20 Allergan-Einheiten für Glabellafalten (siehe Applikationsanleitung für Glabellafalten und Abbildung 1), sodass die Gesamtdosis 44 Allergan-Einheiten und das Gesamtvolumen 1,1 ml beträgt.
Eine Besserung des Schweregrades der Krähenfüsse erfolgte nach Beurteilung durch den Patienten innerhalb eines mittleren Zeitraums von 3 bis 4 Tagen nach der Behandlung. Die Wirkung liess sich bis zu 5 Monate nach der Injektion nachweisen.
Applikationsanleitung für Stirnfalten:
Rekonstituiertes VISTABEL (100 Allergan-Einheiten/2,5 ml) wird mit einer sterilen 30-Gauge-Nadel injiziert. 0,1 ml (4 Allergan-Einheiten) werden an jeder der fünf Injektionsstellen in den M. frontalis verabreicht, sodass eine Gesamtdosis von 20 Allergan-Einheiten mit einem Gesamtvolumen von 0,5 ml injiziert wird (siehe Abbildung 4).
Die Gesamtdosis für die Behandlung von Stirnfalten (20 Allergan-Einheiten) in Verbindung mit Glabellafalten (20 Allergan-Einheiten) beträgt 40 Allergan-Einheiten/1,0 ml.
Bei der Identifikation der geeigneten Injektionsstellen am M. frontalis ist das Gesamtverhältnis der Grösse der Patientenstirn zur Aktivitätsverteilung des M. frontalis zu beurteilen.
Die Stellen der folgenden horizontalen Injektionsreihen sollten durch leichtes Tasten an der Stirn im Ruhezustand und bei maximalem Anheben der Augenbrauen bestimmt werden:
·Oberer Rand der Frontalis-Aktivität: etwa 1 cm oberhalb der obersten Stirnfalte
·Untere Injektionsreihe: In der Mitte zwischen dem oberen Rand der Frontalis-Aktivität und der Augenbraue, aber mindestens 2 cm oberhalb der Augenbraue
·Obere Injektionsreihe: In der Mitte zwischen dem oberen Rand der Frontalis-Aktivität und der unteren Injektionsreihe
Die fünf Injektionen sollten am Schnittpunkt der horizontalen Injektionsreihen mit den folgenden vertikalen Referenzpunkten vorgenommen werden:
·In der unteren Injektionsreihe an der Mittellinie des Gesichts, und 0,5 - 1,5 cm medial der getasteten temporalen Fusionslinie (Crista temporalis); auf der anderen Seite wiederholen.
·In der oberen Injektionsreihe, in der Mitte zwischen den lateralen und medialen Stellen entlang der unteren Injektionsreihe; auf der anderen Seite wiederholen.
Abbildung 4:
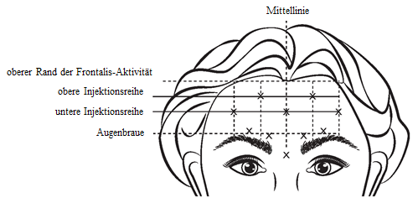
Eine Reduktion der Ausprägung der Stirnfalten bei maximal angehobenen Augenbrauen erfolgte innerhalb von einer Woche nach der Behandlung. Die Wirkung hält bis etwa 4 Monate nach der Injektion an.
Bei einer gleichzeitigen Behandlung mit Glabellafalten und Krähenfüssen beträgt die Gesamtdosis 64 Allergan-Einheiten, wobei 20 Allergan-Einheiten für Stirnfalten, 20 Allergan-Einheiten für Glabellafalten (siehe Anleitungen für die Anwendung bei Glabellafalten und Abbildung 1) sowie 24 Allergan-Einheiten für Krähenfüsse (siehe Anleitungen für die Anwendung bei Krähenfüssen sowie Abbildungen 2 und 3) verwendet werden.
Applikationsanleitung für sichtbares Platysma:
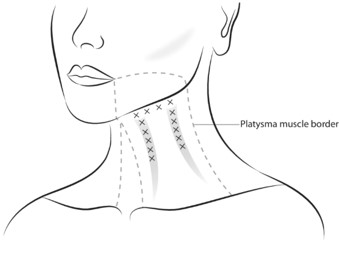
Mit einer sterilen Spritze und Nadel in geeigneter Grösse (empfohlene Nadelgrösse: 30-33 Gauge) sowie aseptischer Technik werden jeweils 2 Allergan-Einheiten/0,05 ml rekonstituiertes VISTABEL auf jeder Seite in jede der 4 Injektionsstellen im oberen Abschnitt des Platysmamuskels unter der Kieferlinie injiziert. Zusätzlich wird 1 Einheit/0,025 ml rekonstituiertes VISTABEL in jede der 5 Injektionsstellen entlang jedes senkrechten Halsmuskelbandes injiziert, in 1–2 Halsmuskelbänder pro Seite. Je nach Schweregrad des sichtbaren Platysmas kann die Gesamtdosis 26 Allergan-Einheiten (1 Band/Seite), 31 Allergan-Einheiten (1 Band auf einer Seite, 2 Bänder auf der anderen Seite) oder 36 Allergan-Einheiten (2 Bänder/Seite) betragen (siehe Tabelle 1 und Abbildungen 5 und 6 unten).
Bestimmen der Behandlungsstelle: Auf jeder Seite werden die 4 Injektionen an der Kieferlinie in den oberen Platysmamuskel etwa 1 bis 2 cm unterhalb und parallel zum unteren Mandibularrand ausgeführt. Die vordere Injektionsstelle liegt in einer Linie mit der oralen Kommissur, die hintere Injektionsstelle etwas vor dem Mandibularwinkel. Die restlichen 2 Injektionen werden in gleichem Abstand (etwa 1 bis 2 cm voneinander entfernt) zwischen den vorderen und hinteren Injektionspunkten vorgenommen (siehe Abbildungen 5 und 6).
Für jedes vertikale Halsmuskelband (1–2 pro Seite) werden 5 Injektionen vertikal in einem Abstand von etwa 1 bis 2 cm verteilt (siehe Abbildungen 5 und 6). Die am höchsten gelegene Injektionsstelle sollte etwa 1 bis 2 cm unterhalb der Kieferlinieninjektionen liegen.
Der Platysmamuskel ist eine dünne Muskelschicht direkt unter der Hautoberfläche. Daher müssen alle Injektionen in den Platysmamuskel oberflächlich und intramuskulär verabreicht werden, wobei die Nadel im rechten Winkel zur Hautoberfläche angesetzt wird. Bei Injektionen in die vertikalen Halsmuskelbänder ist jedes Band zu identifizieren, während der Patient das Platysma kontrahiert. Das Band vorsichtig zusammendrücken, um den Muskel während der Verabreichung von nahegelegenen anatomischen Strukturen zu isolieren (siehe Tabelle 1).
|
Abbildung 1: Injektionsstellen für sichtbares Platysma (2 Halsmuskelbänder)
|
|
Abbildung 2: Injektionsstellen für sichtbares Platysma (1 Halsmuskelband)
|

|
Um injektionsbedingte Komplikationen zu vermeiden, hat die Injektion mindestens 1 cm unter dem unteren Mandibularrand zu erfolgen. Nicht in tieferliegende Strukturen des Platysmamuskels injizieren, einschliesslich grosser Blutgefässe, insbesondere im vorderen Halsbereich.
Tabelle 1: Dosierung bei sichtbarem Platysma
|
Kieferlinieninjektion (unterhalb des unteren Mandibularrandes)
|
Injektion in die vertikalen Halsmuskelbänder
|
Gesamtdosis (Anzahl Injektionsstellen)
| |
2 Allergan-Einheiten/0,05 ml in jede der 4 Injektionsstellen auf jeder Seite (16 Einheiten an 8 Stellen)
|
1 Allergan-Einheit/0,025 ml in jede der 5 Injektionsstellen pro Muskelband
(1 bis 2 Bänder/Seite)
|
1 Band auf beiden Seiten
(10 Allergan-Einheiten an 10 Stellen)
|
26 Allergan-Einheiten
(18 Stellen)
| |
1 Band auf einer Seite und 2 Bänder auf der anderen Seite
(15 Allergan-Einheiten an 15 Stellen)
|
31 Allergan-Einheiten
(23 Stellen)
| |
2 Bänder auf beiden Seiten
(20 Allergan-Einheiten an 20 Stellen)
|
36 Allergan-Einheiten
(28 Stellen)
|
Allgemeine Informationen
Bei Versagen der Initialbehandlung, d.h. wenn auch einen Monat nach Injektion kein therapeutischer Effekt eingetreten ist, sind folgende Massnahmen durchzuführen:
·Analyse der Gründe für das Therapieversagen, z.B. falsche Muskeln, in die injiziert wurde, Injektionstechnik, Bildung von Toxin-neutralisierenden Antikörpern, unzureichende Dosierung;
·Überprüfung der Behandlung mit Botulinumtoxin Typ A als angemessene Therapieform.
Treten im Rahmen einer Initialbehandlung keine unerwünschten Wirkungen auf, kann eine Wiederholungsbehandlung eingeleitet werden, sofern mindestens ein 3-Monatsintervall zwischen beiden Behandlungen eingehalten wird.
Bei unzureichender Dosierung bei Glabellafalten und sofern im Rahmen der Initialbehandlung keine unerwünschten Wirkungen aufgetreten sind, kann eine Wiederholungsbehandlung vorgenommen werden, indem die Dosis auf eine Gesamtdosis von bis zu 40 bis 50 Allergan-Einheiten unter Berücksichtigung der Analyse des vorausgegangenen Therapieversagens angepasst wird.
KontraindikationenVISTABEL darf nicht angewendet werden:
·bei Personen mit bekannter Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
·bei allgemeinen Störungen der Muskelaktivität (z.B. Myasthenia gravis oder Eaton Lambert Syndrom).
·bei Infektion an der/den vorgesehenen Injektionsstelle(n).
Warnhinweise und VorsichtsmassnahmenBesondere Vorsicht ist bei der Aufbereitung des Produkts und der Verabreichung sowie bei der Inaktivierung und Beseitigung der restlichen nicht verwendeten Lösung (siehe «Dosierung/Anwendung» und «Sonstige Hinweise») erforderlich.
Bevor VISTABEL zum Einsatz kommt, sollten die Anatomie des Patienten und alle anatomischen Veränderungen infolge früherer chirurgischer Eingriffe bekannt sein. Injektionen in verletzliche anatomische Strukturen sind zu vermeiden.
Die empfohlenen Dosierungen und die Häufigkeit der Dosierung von VISTABEL sollten nicht überschritten werden.
Eine Überempfindlichkeitsreaktion kann sehr selten nach einer Injektion von Botulinumtoxin auftreten. Adrenalin oder andere Massnahmen gegen eine anaphylaktische Reaktion sollten deshalb bereitstehen.
Auch bei üblichen Dosen von Botulinumtoxin Typ A kann bei Patienten mit unerkannten neuromuskulären Erkrankungen ein erhöhtes Risiko für klinisch relevante systemische Wirkungen einschliesslich schwerer Dysphagie und respiratorischer Beeinträchtigung bestehen. In einigen dieser Fälle dauerte die Dysphagie mehrere Monate an und erforderte die Platzierung einer Magensonde (siehe «Kontraindikationen»).
Bei Patienten mit amyotropher Lateralsklerose oder peripheren neuromuskulären Dysfunktionen sollte VISTABEL ebenfalls nur mit Vorsicht angewendet werden.
Nebenwirkungen wurden sehr selten mit Botulinumtoxin berichtet, die sich möglicherweise auf die Ausbreitung des Toxins fern von der Injektionsstelle beziehen (siehe auch «Unerwünschte Wirkungen»). Die Symptome entsprechen dem Wirkmechanismus von Botulinumtoxin und wurden Stunden bis Wochen nach der Injektion gemeldet. Das Risiko von Nebenwirkungen ist wahrscheinlich am grössten bei Patienten mit Grunderkrankungen und Komorbiditäten, die eine entsprechende Veranlagung für diese Nebenwirkungen haben, darunter Kinder und Erwachsene, die aufgrund von Spastik und die mit hohen Dosen behandelt werden. Patienten unter therapeutischen Dosen können gesteigerte Muskelschwäche erleiden. Schluck- und Atembeschwerden sind schwerwiegend und können zum Tod führen. Eine VISTABEL Injektion ist bei Patienten mit Dysphagie und Aspiration in der Anamnese nicht empfohlen.
Patienten oder das Pflegepersonal sollten darauf hingewiesen werden, dass der ärztliche Notdienst sofort zu verständigen ist, wenn Schluck-, Sprech- bzw. Atemstörungen auftreten.
Zu hohe Dosen oder zu häufige Injektionen können das Risiko einer Antikörperbildung erhöhen. Antikörperbildung kann auch bei anderen Indikationen zu einem Therapieversagen mit Botulinumtoxin Typ A führen.
Wie mit jeder Injektion zu erwarten, wurden lokaler Schmerz, Entzündung, Parästhesie, Hypoästhesie, Empfindlichkeit, Schwellung/Ödem, Erythem, lokale Infektion, Blutung und/oder Quetschung mit der Injektion assoziiert. Schmerzen und/oder Angst, die in Verbindung mit der Nadel stehen, können zu vasovagalen Reaktionen führen, einschliesslich vorübergehender Hypotension und Synkope.
VISTABEL sollte nur mit Vorsicht bei Entzündung der vorgesehenen Injektionsstelle(n) oder bei ausgeprägter Schwäche oder Atrophie des zu injizierenden Muskels angewendet werden.
Vorsicht ist geboten, wenn VISTABEL bei Patienten mit entzündlichem Hautproblem an der Injektionsstelle, ausgeprägter Asymmetrie des Gesichts, Ptosis, extremer Schlaffhaut, tiefen Hautnarben, dicker talgiger Haut sowie Glabellafalten zur Anwendung kommt, die sich durch manuelles Auseinanderdehnen nicht deutlich glätten liessen. Diese Patienten wurden aus den Phase 3-Studien zur Sicherheit und Wirksamkeit ausgeschlossen.
Die gleichzeitige Verabreichung von Botulinumtoxin in der Platysma-Region und anderen Behandlungsregionen wurde nicht untersucht, und die damit verbundenen potenziellen Risiken von Nebenwirkungen sind unbekannt.
In klinischen Studien zur Wirksamkeit und Sicherheit zur Behandlung von Glabellafalten erhielten Patienten bis zu 3 Behandlungen und wurden über einen Zeitraum von 12 Monaten beobachtet. Am Ende dieser 12 Monate wurden in den auswertbaren Patientenproben keine neutralisierenden Antikörper gefunden.
Es sollte darauf geachtet werden sicherzustellen, dass VISTABEL nicht in ein Blutgefäss injiziert wird.
Die Anwendung von VISTABEL wird nicht empfohlen bei Patienten, die unter 18 Jahren bzw. über 65 Jahre alt sind.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit, d.h. es ist nahezu «natriumfrei»
InteraktionenTheoretisch kann die Wirkung von Botulinumtoxin bei gleichzeitiger Verabreichung von VISTABEL und Aminoglykosidantibiotika, Spectinomycin oder anderen Medikamenten, welche die neuromuskuläre Übertragung beeinträchtigen (wie z.B. Muskelrelaxantien), potenziert werden.
Die Wirkung einer gleichzeitigen Verabreichung oder einer Anwendung innerhalb mehrerer Monate von verschiedenen Botulinumneurotoxin Serotypen ist nicht bekannt. Eine ausgeprägte neuromuskuläre Schwäche kann sich noch verstärken, wenn ein anderes Botulinumtoxin verabreicht wird, bevor die Wirkungen eines zuvor injizierten Botulinumtoxins abgeklungen sind.
Spezielle Untersuchungen zu Wechselwirkungen mit anderen Arzneimitteln wurden nicht durchgeführt. Es wurde über keine weiteren klinisch relevanten Wechselwirkungen berichtet.
Schwangerschaft, StillzeitSchwangerschaft
Tierstudien haben unerwünschte Effekte auf den Fötus gezeigt (Reproduktionstoxikologie), und es existieren keine kontrollierten Humanstudien.
Inwieweit ein potentielles Risiko für den Menschen besteht, ist nicht bekannt. VISTABEL sollte daher während der Schwangerschaft und von Frauen in gebärfähigem Alter ohne Verhütung nicht angewendet werden.
Stillzeit
Es ist nicht bekannt, ob VISTABEL in die Milch übergeht. Die Anwendung von VISTABEL während der Stillzeit kann nicht empfohlen werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. VISTABEL kann jedoch eine Asthenie, Muskelschwäche, Schwindel und Sehstörungen hervorrufen, wodurch die Fähigkeit zur aktiven Teilnahme am Strassenverkehr und zum Bedienen von Maschinen beeinflusst werden könnte.
Unerwünschte WirkungenAllgemein
In kontrollierten klinischen Studien bei Glabellafalten wurden bei 23,5% der Patienten (Placebo: 19,2%) unerwünschte Wirkungen berichtet, die nach Meinung der Prüfärzte im Zusammenhang mit VISTABEL standen.
In den kontrollierten klinischen pivotalen Studien bei Krähenfüssen wurden derartige Ereignisse bei 7,6% (24 Allergan-Einheiten nur für Krähenfüsse) und 6,2% (44 Allergan-Einheiten: 24 Allergan-Einheiten für Krähenfüsse und gleichzeitige Gabe von 20 Allergan-Einheiten bei Glabellafalten) der Patienten im Vergleich zu 4,5% bei Placebo berichtet.
In Behandlungszyklus 1 der klinischen Studien zu Stirnfalten bei maximalem Anheben der Augenbrauen wurden bei 20,6% der mit 40 Allergan-Einheiten behandelten Patienten unerwünschte Wirkungen festgestellt (20 Allergan-Einheiten am M. frontalis, 20 Allergan-Einheiten am Glabellakomplex), die von den Prüfärzten als auf VISTABEL bezogen eingestuft wurden. Auch bei 14,3% der mit 64 Allergan-Einheiten behandelten Patienten (20 Allergan-Einheiten am M. frontalis, 20 Allergan-Einheiten am Glabellakomplex und 24 Allergan-Einheiten im Bereich der seitlichen Kanthalfalten) kam es zu unerwünschten Wirkungen, dies jeweils im Vergleich zu 8,9% der Patienten, die Placebo erhielten.
In Behandlungszyklus 1 der klinischen Studien bei sichtbarem Platysma bei maximaler Kontraktion wurden bei 4,7% der mit 26 Allergan-Einheiten, mit 31 Allergan-Einheiten oder mit 36 Allergan-Einheiten behandelten Patienten unerwünschte Wirkungen festgestellt, die von den Prüfärzten als auf VISTABEL bezogen eingestuft wurden, verglichen mit 5,0% der Patienten, die Placebo erhielten.
Unerwünschte Wirkungen können mit der Behandlung, mit der Injektionstechnik oder beidem zusammenhängen. Generell treten unerwünschte Wirkungen innerhalb der ersten Tage nach der Injektion auf und sind vorübergehend. Die meisten unerwünschten Wirkungen, die bisher berichtet wurden, waren leicht bis mittelschwer.
Lokale Muskelschwäche stellt eine erwartete pharmakologische Wirkung von Botulinumtoxin dar. Jedoch wurde über Schwäche von benachbarten Muskeln und/oder Muskeln fern von der Injektionsstelle berichtet.
Blepharoptosis, die durch die Injektionstechnik bedingt sein kann, hängt mit der pharmakologischen Wirkung von VISTABEL zusammen. Wie bei jeder Injektion können im Zusammenhang mit der Injektion Schmerzen, Brennen, Stechen, Ödeme und/oder Blutergüsse auftreten. Nach Injektionen mit Botulinumtoxin wurden auch Fieber und grippeähnliche Symptome berichtet.
Folgende unerwünschte Wirkungen wurden nach Behandlung mit VISTABEL beobachtet:
Die Häufigkeitsangaben sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10'000).
Glabellafalten
Folgende unerwünschte Wirkungen wurden in doppelblinden, Placebo-kontrollierten klinischen Studien nach der Injektion von 20 Allergan-Einheiten VISTABEL nur an den Glabellafalten berichtet:
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektion.
Psychiatrische Erkrankungen
Gelegentlich: Angst.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (13,3%).
Häufig: Parästhesie.
Gelegentlich: Schwindel.
Augenerkrankungen
Häufig: Augenlidptosis.
Gelegentlich: Augenschmerzen, Lidentzündungen (Blepharitis), Sehstörungen (einschliesslich verschwommenes Sehen).
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit.
Gelegentlich: trockener Mund.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Erytheme, Spannungsgefühl der Haut.
Gelegentlich: Ödeme (Gesicht, Augenlid, periorbital), Lichtempfindlichkeit, Juckreiz, trockene Haut.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: lokalisierte Muskelschwäche.
Gelegentlich: Muskelzuckungen, Mephisto-Zeichen (seitliche Erhöhung der Augenbrauen).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen im Gesicht, Ekchymose, Ödeme an der Injektionsstelle, Schmerzen oder Reizungen an der Injektionsstelle.
Gelegentlich: Grippesymptome, Asthenie, Fieber.
Krähenfüsse mit oder ohne Glabellafalten
Folgende unerwünschte Wirkungen wurden in doppelblinden, Placebo-kontrollierten klinischen Studien nach einer Injektion von VISTABEL bei Behandlung von Krähenfüssen mit oder ohne Einbezug von Glabellafalten berichtet:
Augenerkrankungen
Gelegentlich: Augenlidödem.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Hämatom an der Injektionsstelle*.
Gelegentlich: Blutungen an der Injektionsstelle*, Schmerzen an der Injektionsstelle*, Parästhesie an der Injektionsstelle*.
*verfahrensbedingte unerwünschte Wirkungen
Stirnfalten und Glabellafalten mit oder ohne Krähenfüsse
Folgende unerwünschte Wirkungen wurden in doppelblinden, Placebo-kontrollierten klinischen Studien nach einer Injektion von VISTABEL bei gleichzeitiger Behandlung von Stirnfalten und Glabellafalten mit oder ohne Einbezug von Krähenfüssen berichtet:
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Augenerkrankungen
Häufig: Augenlidptosis1
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautspannen, Brauenptosis2
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Mephisto-Zeichen (seitliche Erhöhung der Augenbrauen).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Blauer Fleck an der Injektionsstelle*, Hämatom an der Injektionsstelle*
Gelegentlich: Schmerzen an der Injektionsstelle*
1Die mediane Zeit bis zum Auftreten der Augenlidptosis nach der Behandlung betrug 9 Tage
2Die mediane Zeit bis zum Auftreten der Brauenptosis nach der Behandlung betrug 5 Tage
*mit dem Verfahren verbundene unerwünschte Wirkungen
Nach wiederholter Applikation wurden keine Veränderungen des gesamten Sicherheitsprofils beobachtet.
Sichtbares Platysma
Die Sicherheit von VISTABEL wurde in den doppelblinden, Placebo-kontrollierten klinischen Studien zur Verbesserung eines sichtbaren Platysmas untersucht. Es wurden keine unerwünschte Wirkungen von ≥1% der mit VISTABEL behandelten Studienteilnehmern gemeldet, die auch häufiger auftraten als bei den mit Placebo behandelten Studienteilnehmern
Die Sicherheit von bis zu 4 VISTABEL-Behandlungen bei sichtbarem Platysma wurde ebenfalls untersucht. Infrage kommende Studienteilnehmer, die in der doppelblinden, Placebo-kontrollierten Einführungsstudie mit VISTABEL oder Placebo behandelt wurden, erhielten im Rahmen der offenen Fortsetzungsstudie bis zu 3 weitere VISTABEL -Behandlungen. Die folgenden Nebenwirkungen wurden während der offenen Behandlungsphase des sichtbaren Platysmas berichtet:
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Dysphagie
Erkrankungen des Nervensystems
Gelegentlich: Fazialparese
Bei wiederholter Gabe von bis zu 4 VISTABEL-Behandlungen wurde keine Veränderung des allgemeinen Sicherheitsprofils beobachtet.
Die Sicherheit von VISTABEL-Behandlungen bei sichtbarem Platysma wurde auch bei einer höheren als der empfohlenen Dosis untersucht. Die folgenden unerwünschten Wirkungen wurden bei Studienteilnehmern beobachtet, die 52, 62, oder 72 Einheiten VISTABEL erhielten: Dyspnoe, Muskelschwäche, Muskelsteifheit, Muskelverspannungen, Muskelkrämpfe, Myalgie und Nackenschmerzen.
Zusätzliche Informationen
Schwere und/oder sofortige Überempfindlichkeitsreaktionen einschliesslich Anaphylaxie, Serumkrankheit, Urtikaria, Weichteilödem und Dyspnoe wurden selten berichtet. Einige dieser Reaktionen traten entweder nach der alleinigen Anwendung von Botulinumtoxin oder nach der kombinierten Anwendung von Botulinumtoxin mit anderen Präparaten auf, die mit ähnlichen Reaktionen einhergehen.
Neu oder wieder auftretende Anfälle wurden üblicherweise bei Patienten berichtet, die für solche Vorkommnisse empfänglich sind. Die genaue Beziehung dieser Vorfälle zur Injektion mit Botulinumtoxin wurde nicht ermittelt.
Unerwünschte Wirkungen wurden sehr selten mit Botulinumtoxin berichtet, die möglicherweise auf die Ausbreitung des Toxins fern von der Verabreichungsstelle zurückzuführen sind (z.B. Muskelschwäche, Dysphagie, Obstipation oder Aspirationspneumonie, was tödlich sein kann) (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Selten wurden unerwünschte Wirkungen berichtet, die das kardiovaskuläre System betrafen, wie Arrhythmie und Herzinfarkt, einige davon mit tödlichem Ausgang. Einige dieser Patienten wiesen Risikofaktoren, wie Herz-Kreislauf-Erkrankungen, auf. Der genaue Zusammenhang dieser Ereignisse mit der Botulinumtoxininjektion ist nicht festgestellt.
Die gleichzeitige Verabreichung von Botulinumtoxin in der Platysma-Region und anderen Behandlungsregionen wurde nicht untersucht, und die damit verbundenen potenziellen Risiken von Nebenwirkungen sind unbekannt.
Unerwünschte Wirkungen nach Markteinführung
Die folgenden unerwünschten Wirkungen oder medizinisch-relevanten unerwünschten Wirkungen wurden seit der Markteinführung des Arzneimittels für die Behandlung von Glabellafalten, Krähenfüssen und anderen klinischen Indikationen berichtet:
Erkrankungen des Immunsystems
Anaphylaxie, Angioödem, Serumkrankheit und Urtikaria.
Stoffwechsel und Ernährungsstörungen
Anorexie.
Erkrankungen des Nervensystems
Brachial-Plexopathie, Dysphonie, Dysarthrie, Gesichtsparese, Hypoästhesie, Muskelschwäche, Myasthenia gravis, periphere Neuropathie, Parästhesie, Radikulopathie, Synkope und Gesichtslähmung.
Augenerkrankungen
Engwinkelglaukom (wegen Behandlung von Blepharospasmus), Augenlidptosis, Strabismus, verschwommenes Sehen, Sehstörungen, Augentrockenheit und Lagophthalmus, Augenlidödem.
Erkrankungen des Ohrs und des Labyrinths
Hypoakusis, Tinnitus und Schwindel.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Aspirationspneumonie, Dyspnoe, Bronchospasmen, Atemdepression und respiratorische Insuffizienz.
Erkrankungen des Gastrointestinaltrakts
abdominale Schmerzen, Diarrhö, trockener Mund, Dysphagie, Übelkeit und Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Alopezie, Brauenptosis, Psoriasis-artige Dermatitis, Erythema multiforme, Hyperhidrose, Madarosis, Juckreiz und Exanthem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Muskelatrophie, Myalgie, gesteigerte Muskelspannung und lokalisierte Muskelzuckungen/unfreiwillige Muskelkontraktionen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Denervierung/Muskelatrophie, Unwohlsein und Pyrexie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungÜberdosierung von VISTABEL ist ein relativer Begriff und abhängig von Dosierung, Injektionsstelle und den zugrundeliegenden Gewebeeigenschaften. Es wurde über keine Fälle systemischer Intoxikation aufgrund versehentlicher Injektion von Botulinumtoxin Typ A-Lösungen berichtet. Exzessive Dosen können lokale oder von der Injektionsstelle entfernte, generalisierte und tiefe neuromuskuläre Paralyse auslösen. Keine Fälle von oraler Aufnahme von Botulinumtoxin Typ A sind bekannt.
Anzeichen und Symptome
Symptome einer Überdosierung treten nicht unmittelbar nach einer Injektion auf. Nach versehentlicher Injektion oder Ingestion muss der Patient mehrere Tage medizinisch auf Anzeichen und Symptome einer allgemeinen Muskelschwäche oder Muskellähmung überwacht werden.
Bei Auftreten von Anzeichen einer Intoxikation mit Botulinumtoxin Typ A (allgemeine Schwäche, Ptosis, Diplopie, Schluck- und Sprechstörungen oder Lähmung der Atemmuskulatur) ist eine Einweisung in die Klinik zu erwägen.
Eigenschaften/WirkungenATC-Code
M03AX01
Wirkungsmechanismus
Das Clostridium botulinum Toxin Typ A blockiert durch Spaltung von SNAP-25 die periphere Acetylcholin-Freisetzung an den präsynaptischen Nervenendigungen. SNAP-25 ist ein Protein, das wesentlich ist für die erfolgreiche Bindung und Freisetzung von Acetylcholin aus den Vesikeln, die sich in den Nervenendigungen befinden.
Nach der Injektion erfolgt initial eine hoch-affine Bindung des Toxins an spezifische zelluläre Oberflächenrezeptoren. Durch einen Rezeptor-vermittelten Endozytose-Prozess wird das Toxin durch die Plasmamembran transportiert und anschliessend im Cytosol freigesetzt. Dieser Prozess wird von einer progressiven Inhibition der Acetylcholin-Freisetzung begleitet. Klinische Befunde manifestieren sich innerhalb von 2-3 Tagen. Die maximale Wirkung ist 5-6 Wochen nach der Injektion zu beobachten.
Pharmakodynamik
Nach intramuskulärer Injektion erfolgt innerhalb von 12 Wochen die Wiederherstellung der Impulsübertragung durch neugebildete Nervenendigungen und deren Wiederverbindung mit den motorischen Endplatten.
Klinische Wirksamkeit
Glabellafalten
Zwei randomisierte, doppelblinde, Placebo-kontrollierte Multicenterstudien der Phase 3 mit Parallelgruppen, die identisch angelegt waren, untersuchten die Anwendung von VISTABEL zur vorübergehenden Verbesserung des Aussehens mässiger bis starker Glabellafalten. An den Studien nahmen gesunde Erwachsene (im Alter von 18 bis 75 Jahren) mit Glabellafalten teil, die bei maximalem Stirnrunzeln mindestens mässig ausgeprägt waren. Ausgeschlossen waren Patienten mit Infektion oder Hautproblemen an der Injektionsstelle, mit Fazialislähmung in der Anamnese, ausgeprägter Asymmetrie des Gesichts, Ptosis, extremer Schlaffhaut, tiefen Hautnarben, dicker talgiger Haut, mit Glabellafalten, die sich durch manuelles Auseinanderdehnen nicht deutlich glätten liessen, oder Patienten mit neuromuskulärem Leiden in der Anamnese oder mit anderen Störungen, welche die neuromuskuläre Funktion beeinträchtigen können. Die Patienten erhielten eine einmalige intramuskuläre Injektion mit entweder VISTABEL (n = 405, kombinierte Studien) oder Placebo (n = 132, kombinierte Studien). Das Injektionsvolumen betrug 0,1 ml pro Injektionsstelle, so dass sich in den Verumgruppen eine Dosis von 4 Allergan-Einheiten pro Injektionsstelle ergab. Die Patienten erhielten an fünf Stellen intramuskuläre Injektionen; eine in den M. procerus und zwei in jeden M. corrugator supercilii, so dass die Gruppen mit Verumbehandlung eine Gesamtdosis von 20 Allergan-Einheiten erhielten.
Die beiden primären Zielvariablen für die Wirksamkeit bestanden aus der Beurteilung des Schweregrads der Glabellafalte bei maximalem Stirnrunzeln 30 Tage nach Injektion durch den Arzt sowie aus der globalen Beurteilung der Veränderung des Aussehens der Glabellafalten 30 Tage nach Injektion durch die Patienten.
Für die Beurteilung durch den Arzt wurde in jedem Prüfzentrum ein Leitfaden mit Fotos überlassen, der bei der Klassifizierung des Schweregrades der Glabellafalten anhand einer 4-Punkte-Skala behilflich war (0 = keine Falten, 1 = leichte, 2 = mässige, 3 = schwere Falten). Als Behandlungserfolg wurde das Erreichen von Schweregrad 0 oder 1 definiert.
Für die globale Beurteilung der Veränderung im Aussehen der Glabellafalten mussten die Patienten folgende Frage beantworten: «Wie würden Sie die Veränderung des Aussehens Ihrer Glabellafalten im Vergleich zu dem Aussehen unmittelbar vor der letzten Injektion einstufen?». Die Beurteilungen durch die Patienten reichten von +4 (100%ige Besserung) bis -4 (sehr deutliche Verschlechterung, etwa 100% schlechter oder grösser). Als Behandlungserfolg wurde eine Einstufung von mindestens +2 (mässige Besserung, ca. 50%) festgelegt.
Das Durchschnittsalter betrug 46,0 Jahre; der Altersbereich reichte von 22 bis 78 Jahren. Von diesen waren 68,2% (366/537) 50 Jahre alt oder jünger, 31,8% (171/537) 51 Jahre alt oder älter und 6,0% 65 Jahre alt oder älter.
Die meisten Patienten waren weiblich, 81,9% (440/537) und 83,8% (450/537) waren kaukasischer Abstammung.
In klinischen Studien erhielten Patienten bis zu drei Injektionen über einen Zeitraum von 12 Monaten. Die erste doppelblinde Phase der Studie dauerte 16 Wochen. Nach Beendigung der doppelblinden Phase konnten die Patienten in eine offene Studie aufgenommen werden und erhielten Wiederholungsbehandlungen mit VISTABEL in im Prüfplan festgelegten Abständen von 4 Monaten.
30 Tage nach Injektion beurteilten die Ärzte die Behandlung bei 80% der 405 mit VISTABEL behandelten Patienten als Erfolg (keine oder nur leichte Falten bei maximalem Stirnrunzeln), verglichen mit 4% der mit Placebo behandelten Patienten. Zum selben Zeitpunkt schätzen 89% der mit VISTABEL behandelten Patienten die Besserung als mässig oder besser ein, verglichen mit 7% der mit Placebo behandelten Patienten.
120 Tage nach Injektion beurteilten die Ärzte die Behandlung bei 25% der mit VISTABEL behandelten Patienten als Erfolg (keine oder nur leichte Falten bei maximalem Stirnrunzeln), verglichen mit 1,6% der mit Placebo behandelten Patienten. Zum selben Zeitpunkt schätzten 39% der mit VISTABEL behandelten Patienten die Besserung als mässig oder besser ein, gegenüber 1% der mit Placebo behandelten Patienten.
Krähenfüsse
Es wurden 1362 Patienten nur mit mittelstarken bis starken Krähenfüssen bei maximalem Lächeln (n = 445, Studie 191622-098) oder auch mit mittelstarken bis starken Glabellafalten bei maximalem Stirnrunzeln (n = 917, Studie 191622-099) eingeschlossen.
VISTABEL-Injektionen haben im Vergleich mit Placebo die Ausprägung der Krähenfüsse bis zu 5 Monate lang zu allen Zeitpunkten signifikant reduziert (p < 0,001). Die Bestimmung erfolgte anhand des Anteils der Patienten, die in beiden pivotalen Studien eine Schweregradeinstufung der Krähenfüsse bei maximalem Lächeln von „Keine“ oder „Leicht“ bis Tag 150 (Studienende) in Studie 191622-098 und Tag 120 (Ende des ersten Behandlungszyklus) in Studie 191622-099 erreichten. In Tabelle 2 sind die Ergebnisse an Tag 30 (Zeitpunkt des primären Wirksamkeitsendpunkts) zusammengefasst.
In Studie 191622-104 (Extension von Studie 191622-099) wurden 101 Patienten, die zuvor für Placebo randomisiert waren, für die erste Behandlung mit einer Dosis von 44 Allergan-Einheiten eingeschlossen. Patienten, die mit VISTABEL behandelt wurden, profitierten im Vergleich mit Placebo beim primären Wirksamkeitsendpunkt an Tag 30 nach ihrer ersten Behandlung mit dem Wirkstoff signifikant. Die Ansprechrate war ähnlich hoch wie bei der Gruppe mit 44 Allergan-Einheiten an Tag 30 nach der ersten Behandlung in Studie 191622-099.
Tabelle 2: Tag 30 - Beurteilung der Krähenfüsse bei maximalem Lächeln durch den Arzt und durch den Patienten – Ansprechrate (% der Patienten, welche eine Schweregradeinstufung der Krähenfüsse von «Keine» oder «Leicht» beurteilten)
|
Klinische
Studie
|
Dosis
|
VISTABEL
|
Placebo
|
VISTABEL
|
Placebo
| |
Beurteilung durch den Arzt
|
Beurteilung durch den Patienten
| |
191622-098
|
24 Allergan-Einheiten
(Krähenfüsse)
|
66,7%*
(148/222)
|
6,7%
(15/223)
|
58,1%*
(129/222)
|
5,4%
(12/223)
| |
191622-099
|
24 Allergan-Einheiten (Krähenfüsse)
|
54,9%*
(168/306)
|
3,3%
(10/306)
|
45,8%*
(140/306)
|
3,3%
(10/306)
| |
|
44 Allergan-Einheiten
(24 Allergan-Einheiten (Krähenfüsse)
20 Allergan-Einheiten (Glabellafalten)
|
59,0%*
(180/305)
|
3,3%
(10/306)
|
48,5%*
(148/305)
|
3,3%
(10/306)
|
*p < 0,001 (VISTABEL im Vergleich zu Placebo)
In beiden pivotalen Studien war eine Besserung der Krähenfüsse nach Einschätzung der Teilnehmer gegenüber dem Ausgangsbefund an Tag 30 und an allen Zeitpunkten nach jedem Behandlungszyklus für VISTABEL (24 Allergan-Einheiten und 44 Allergan-Einheiten) im Vergleich zu Placebo statistisch signifikant (p < 0,001).
In einem Fragebogen zum Ergebnis der Faltenbehandlung (Facial Line Outcomes, FLO-11) war der Anteil der Patienten, bei denen nach eigener Einschätzung eine Besserung der psychischen Auswirkung der Krähenfüsse auf die Wahrnehmung von Alter, Attraktivität und Müdigkeit eingetreten ist, in beiden Kernstudien zum primären Zeitpunkt nach 30 Tagen für VISTABEL (24 Allergan-Einheiten und 44 Allergan-Einheiten) im Vergleich zu Placebo statistisch signifikant (p <0,001). Die statistische Signifikanz war auch zu jedem folgenden Zeitpunkt nachzuweisen.
In den pivotalen Studien waren 3,9% (53/1362) der Patienten älter als 65 Jahre. Die Ansprechrate auf die Behandlung mit VISTABEL (24 Allergan-Einheiten und 44 Allergan-Einheiten) betrug bei Patienten in dieser Altersgruppe nach Beurteilung durch den Prüfarzt 36% (an Tag 30).
Bei 916 Patienten (517 Patienten mit 24 Allergan-Einheiten und 399 Patienten mit 44 Allergan-Einheiten), die mit VISTABEL behandelt wurden, wurden Proben auf eine Antikörperbildung untersucht. Bei keinem Patienten traten neutralisierende Antikörper auf.
Stirnfalten
822 Patienten mit moderaten bis starken Stirnfalten und Glabellafalten, die bei maximaler Kontraktion entweder allein (N=254, Studie 191622-142) auftraten, oder mit moderaten bis starken Kanthalfalten bei maximalem Lächeln (N=568, Studie 191622-143) wurden in die Studie aufgenommen und in die Primärpopulationen zur Analyse aller primären Wirksamkeitsendpunkte einbezogen. Stirnfalten wurden in Verbindung mit Glabellafalten behandelt, um das Potenzial einer Brauenptosis zu minimieren.
Sowohl bei der Beurteilung durch den Prüfarzt als auch durch die Patienten war der Anteil der Patienten, die nach VISTABEL Injektionen bei maximalem Anheben der Augenbrauen keine oder nur leichte Stirnfalten hatten, höher als bei mit Placebo behandelten Patienten. Die Beurteilungen wurden an Tag 30 (Zeitpunkt des primären Wirksamkeitsendpunkts) durchgeführt (Tabelle 3).
Tabelle 3: Tag 30: Beurteilung der Stirnfalten und oberen Gesichtsfalten durch Prüfarzt und Patient bei maximaler Kontraktion und im Ruhezustand
|
Klinische Studie
|
Endpunkt
|
VISTABEL
|
Placebo
|
VISTABEL
|
Placebo
| |
Beurteilung
des Prüfarztes
|
Beurteilung des Patienten
| |
Studie 191622-142
40 Allergan-Einheiten
(20 Allergan-Einheiten für Stirnfalten + 20 Allergan-Einheiten für Glabellafalten)
|
Stirnfalten bei max. Kontraktiona
|
94,8%
(184/194)
|
1,7%
(1/60)
|
87,6%
(170/194)
|
0,0%
(0/60)
| |
p < 0,0005
|
p < 0,0005
| |
Stirnfalten im Ruhezustandb
|
86,2%
(162/188)
|
22,4 %
(13/58)
|
89,7%
(174/194)
|
10,2%
(6/59)
| |
p < 0,0001
|
p < 0,0001
| |
Studie 191622-143
40 Allergan-Einheiten
(20 Allergan-Einheiten für Stirnfalten + 20 Allergan-Einheiten für Glabellafalten)
|
Stirnfalten bei max. Kontraktiona
|
90,5%
(201/222)
|
2,7%
(3/111)
|
81,5%
(181/222)
|
3,6%
(4/111)
| |
p < 0,0005
|
p < 0,0005
| |
Stirnfalten im Ruhezustandb
|
84,1%
(185/220)
|
15,9 %
(17/107)
|
83,6%
(184/220)
|
17,4%
(19/109)
| |
p < 0,0001
|
p < 0,0001
| |
Studie 191622-143
64 Allergan-Einheiten
(20 Allergan-Einheiten für Stirnfalten + 20 Allergan-Einheiten für Glabellafalten + 24 Allergan-Einheiten für Krähenfüsse)
|
Stirnfalten bei max. Kontraktiona
|
93,6%
(220/235)
|
2,7 %
(3/111)
|
88,9%
(209/235)
|
3,6%
(4/111)
| |
p < 0,0005
|
p < 0,0005
| |
Obere Gesichtsfalten bei max. Kontraktionc
|
56,6%
(133/235)
|
0,9 %
(1/111)
|
nicht zutreffend
| |
p < 0,0001
|
a Anteil der Patienten, die bei maximalem Anheben der Augenbrauen keine oder eine geringfügige Ausprägung der Stirnfalten erreichten
b Anteil der Patienten mit einer Verbesserung von mindestens einem Grad bei der Ausprägung der Stirnfalten im Ruhezustand seit Baseline
c Anteil der Responder, definiert als einzelner Patient, der in jeder Region bei maximaler Kontraktion die Ausprägung «keine» oder «geringfügig» für Stirnfalten, Glabellafalten und Kanthalfalten erreichte
VISTABEL reduzierte im Vergleich zu Placebo bis zu 6 Monate lang signifikant die Ausprägung von Stirnfalten bei maximalem Anheben der Augenbrauen (p < 0,05). Der Anteil der Patienten, die in beiden pivotalen Studien Stirnfalten mit einer Ausprägung von «keine» oder «geringfügig» bei maximalem Anheben der Augenbrauen erreichten, betrug bis Tag 150 (Studie 191622-142) 21,6% unter VISTABEL im Vergleich zu 0% unter Placebo und bis Tag 180 (Studie 191622-143) 6,8% unter VISTABEL im Vergleich zu 0% unter Placebo.
Wenn alle drei Bereiche gleichzeitig behandelt wurden (Studie 191622-143), reduzierte VISTABEL die Ausprägung der Glabellafalten bis zu 6 Monate lang signifikant (5,5% unter VISTABEL im Vergleich zu 0% unter Placebo), der seitlichen Kanthalfalten bis zu 6 Monate lang (3,4% unter VISTABEL im Vergleich zu 0% unter Placebo) und der Stirnfalten bis zu 6 Monate lang (9,4% unter VISTABEL im Vergleich zu 0% unter Placebo).
Insgesamt erhielten 116 bzw. 150 Patienten während 1 Jahr 3 Behandlungszyklen mit VISTABEL 40 Allergan-Einheiten (20 für Stirnfalten, 20 für Glabellafalten) bzw. 64 Allergan-Einheiten (20 für Stirnfalten, 20 für Glabellafalten, 24 für Kanthalfalten). Die Ansprechrate für die Verbesserung der Stirnfalten war über alle Behandlungszyklen hinweg ähnlich.
In den pivotalen Studien waren 3,7% der Patienten älter als 65 Jahre. Die Ansprechraten in dieser mit VISTABEL behandelten Untergruppe waren denjenigen in der Gesamtpopulation ähnlich, aufgrund der geringen Patientenzahl wurde jedoch keine statistische Signifikanz erreicht.
Sichtbares Platysma
834 Patienten mit moderatem bis schwerem, bei maximaler Kontraktion sichtbarem Platysma wurden in die klinischen Studien eingeschlossen (N = 408, Studie M21-309; N = 426, Studie M21-310). 748 dieser Studienteilnehmer waren durch ihr sichtbares Platysma psychologisch beeinträchtigt.
Der primäre Wirksamkeitsendpunkt war die Beurteilung des sichtbaren Platysmas bei maximaler Kontraktion anhand der fünfstufigen Beurteilung durch Prüfärzte (Clinician Allergan Platysma Prominence Scale, C-APPS) und durch Studienteilnehmer (Participant Allergan Platysma Prominence Scale, P-APPS). Bei beiden Skalen sind die Grade: 1 = Minimal, 2 = Leicht, 3 = Moderat, 4 = Schwer, 5 = Extrem. Die Bewertungen mit C-APPS und P-APPS wurden unabhängig voneinander durchgeführt. Der primäre Zeitpunkt war der 14. Tag nach der ersten Behandlung.
Tabelle 4. Platysma Schweregrade und Beschreibungen (pro Seite)
|
Grad
|
Schweregrad Beschreibung pro Seite
| |
1
|
Minimal; keine sichtbaren vertikalen Halsstränge und kein Einfluss auf die Kieferliniendefinition
| |
2
|
Mild; sichtbare vertikale Halsstränge und kein Einfluss auf die Kieferliniendefinition
| |
3
|
Moderat; 1 sichtbarer, durchgehender vertikaler Halsstrang mit Einfluss auf Kieferliniendefinition
| |
4
|
Schwer; 2 sichtbare, durchgehende vertikale Halsstränge mit Einfluss auf die Kieferliniendefinition
| |
5
|
Extrem; 3 oder mehr sichtbare vertikale Halsstränge mit Einfluss auf die Kieferliniendefinition
|
Sowohl in der Studie M21-309 als auch in der Studie M21-310 waren die Verbesserungen des Schweregrads des bei maximaler Kontraktion sichtbaren Platysmas unter VISTABEL an Tag 14 (p < 0,0001) und an allen nachfolgenden Zeitpunkten bis Tag 120 (Ende der Studie) grösser als unter Placebo. Dies wurde anhand des Anteils der Studienteilnehmer gemessen, die auf der Grundlage der Beurteilungen von Prüfarzt und Studienteilnehmer eine Verbesserung von ≥2 Graden gegenüber Baseline erreichten (Tabelle 4).
Tabelle 5: Beurteilung des bei maximaler Kontraktion sichtbaren Platysmas durch Prüfarzt und Studienteilnehmer – Responderraten (% der Teilnehmer, die an Tag 14 eine Verbesserung von ≥2 Graden gegenüber Baseline erreichten)
|
Klinische Studie
|
VISTABEL
26, 31 oder 36 Allergan-Einheiten
|
Placebo
|
VISTABEL
26, 31 oder 36 Allergan-Einheiten
|
Placebo
| |
Beurteilung des Prüfarztes
|
Beurteilung des Studienteilnehmers
| |
M21-309
|
43,8 %*
(79/181)
|
3,9 %
(7/186)
|
45,6 %*
(83/181)
|
3,9 %
(7/186)
| |
M21-310
|
41,0 %*
(76/186)
|
2,2 %
(4/195)
|
40,8 %*
(76/186)
|
3,9 %
(8/195)
|
*p < 0,0001 (VISTABEL im Vergleich zu Placebo)
In der Studie M21-323, der offenen Fortsetzungsstudie zu Studie M21-309, erhielten insgesamt 292 Studienteilnehmer über einen Zeitraum von 1 Jahr bis zu 4 Behandlungen. 261 dieser Studienteilnehmer waren durch ihr sichtbares Platysma psychologisch beeinträchtigt. Die Ansprechraten für eine Verbesserung des sichtbaren Platysmas waren in allen Behandlungszyklen vergleichbar.
Anhand des Fragebogens zum Erscheinungsbild von Hals und unterer Gesichtspartie (Appearance of Neck and Lower Face Questionnaire, ANLFQ): Zufriedenheit (Nachbeobachtung) Punkt 5, gaben 63,6% (115/181) der Teilnehmer in Studie M21-309 und 61,2% (114/186) in Studie M21-310 an Tag 14 an, mit der VISTABEL -Behandlung «zufrieden» oder «sehr zufrieden» zu sein, verglichen mit den mit Placebo behandelten Studienteilnehmern (11,7% [22/186] bzw. 11,8% [23/195]) (p < 0,0001 in beiden Studien).
Sicherheit und Wirksamkeit bei älteren Patienten
In klinischen Studien mit VISTABEL war die Zahl der Patienten älter als 65 Jahre nicht ausreichend, um statistisch zu ermitteln, ob ältere Patienten anders auf die Behandlung ansprechen als jüngere. In den beiden identischen im Verhältnis 3:1 randomisierten, multizentrischen, doppelblinden, Placebo-kontrollierten Phase 3 Wirksamkeitsstudien (bei Glabellafalten) lagen die Ansprechraten für die beiden kombinierten primären Wirksamkeitsvariablen bei Patienten ≤50 Jahren höher als bei Patienten ≥65 Jahren.
Die auf einem kombinierten Datenset beruhende Analyse zeigte, dass bezüglich der Endpunkt-Beurteilung (am 30. Tag; in der Patientengruppe im Alter ≥65 Jahren) durch den Arzt bei 39% (9/23) der Patienten die Behandlung als Erfolg eingestuft wurde, verglichen mit 22% (2/9) in der Placebogruppe. Dieser Unterschied ist weder statistisch verschieden (p = 0,228), noch überschreitet er den im Voraus festgelegten 30%-Punkte Unterschied, der für die Definition «klinisch signifikant» erforderlich ist. Bei der Beurteilung durch den Arzt bestanden bei dieser Altersgruppe bei maximalem Stirnrunzeln keine statistisch signifikanten Unterschiede zwischen den Gruppen. Es bestand ein statistisch signifikanter Unterschied zugunsten von VISTABEL bei der globalen Beurteilung durch die Patienten zu allen Zeitpunkten (p = 0,036) ausser am 120. Tag (p = 0,214).
Bisher wurden zu wenig Patienten über 75 Jahre behandelt, um einen aussagekräftigen Vergleich zu ermöglichen.
PharmakokinetikAufgrund der Beschaffenheit von Botulinumtoxin Typ A wurden keine klassischen Resorptions-, Verteilungs-, Biotransformations- und Eliminationsuntersuchungen mit dem Wirkstoff durchgeführt.
Verteilungsstudien bei Ratten zeigen eine langsame Diffusion des radioaktiv markierten Botulinumtoxin Typ A im M. gastrocnemius, gefolgt von einer raschen systemischen Metabolisierung und Ausscheidung im Urin.
Die Halbwertszeit des markierten Materials betrug etwa 10 Stunden. An der Injektionsstelle wurde Radioaktivität an grosse Protein-Moleküle gebunden. Im Plasma erfolgte die Bindung an kleine Moleküle, was auf einen schnellen systemischen Metabolismus schliessen lässt. Innerhalb von 24 Stunden nach Applikation wurden 60% der Radioaktivität über den Urin ausgeschieden. Das Toxin wird vermutlich von Proteasen metabolisiert, und die Molekülkomponenten werden auf dem normalen Stoffwechselweg wiederverwertet.
Distribution
Verteilung des arzneilich wirksamen Bestandteils im Patienten:
Es wird angenommen, dass therapeutische VISTABEL-Dosen wenig systemisch verteilt werden. In klinischen Studien konnte mit Hilfe der Einzelfaser-EMG-Technik für Muskeln, die entfernt von der Injektionsstelle lagen, eine erhöhte elektrophysiologische neuromuskuläre Aktivität gezeigt werden. Gleichzeitige klinische Befunde oder Symptome wurden nicht beobachtet.
Präklinische DatenReproduktionstoxikologie
Trächtige Mäuse, Ratten und Kaninchen erhielten während der Organogenese intramuskuläre Injektionen von VISTABEL. Der NOAEL-Wert (No Observed Adverse Effect Level) in der Entwicklungsphase lag bei 4 bzw. 1 bzw. 0,125 Einheiten/kg Körpergewicht. Höhere Dosen führten zu verminderten fetalen Körpergewichten und/oder verzögerter Skelett-Ossifikation. Bei Kaninchen wurden Aborte beobachtet.
Weitere Daten (Lokale Toxizität, Phototoxizität, Immunotoxizität)
Zusätzlich zur Reproduktionstoxikologie wurden die folgenden präklinischen Studien zur Sicherheit von VISTABEL durchgeführt: akute Toxizität, chronische Toxizität, lokale Verträglichkeit, Mutagenität, Antigenität sowie Verträglichkeit mit menschlichem Blut. Für klinisch relevante Dosen konnte in diesen Studien kein spezielles Risiko für den Menschen nachgewiesen werden.
Dies wird auch bestätigt durch die langjährige Erfahrung mit diesem Arzneimittel in einer Vielzahl klinischer Indikationen, in denen ähnliche Dosen eingesetzt werden, wie zur Behandlung von Glabellafalten (Blepharospasmus, hemifazialer Spasmus und Strabismus) sowie in Indikationen, die höhere Dosen erfordern (Nackendystonie, Fokale Spastizitäten bei Erwachsenen nach Schlaganfall und bei Kindern mit Zerebralparese). Aus der Literatur ist für juvenile Affen bei intramuskulärer Applikation eine LD50 von 39 Einheiten/kg Körpergewicht bekannt.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Potenzstudien haben gezeigt, dass das Arzneimittel nach Rekonstitution bis zu 3 Tagen bei 2-8°C aufbewahrt werden kann. Da das Arzneimittel kein Konservierungsmittel enthält, ist die gebrauchsfertige Zubereitung aus mikrobiologischen Gründen unmittelbar nach Verdünnung zu verwenden, es sei denn, diese hat unter kontrollierten und validierten aseptischen Bedingungen stattgefunden. Das Arzneimittel sollte üblicherweise nicht länger als 24 Stunden bei 2-8°C gelagert werden.
Besondere Lagerungshinweise
Ungeöffnete Durchstechflaschen: Im Kühlschrank bei 2-8°C oder Gefrierschrank bei -5°C oder darunter lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Zubereitung der Injektionslösung
Das Rekonstituieren des Flascheninhalts und das Aufziehen der Spritze sind über plastikbeschichteten Papiertüchern durchzuführen, um evtl. Spritzer aufzufangen. Zur Herstellung einer gebrauchsfertigen Lösung von VISTABEL ist sterile physiologische Kochsalzlösung (0,9%ige Natriumchloridlösung zur Injektion) ohne Konservierungsmittel zu verwenden.
Die vorgeschriebene Menge Lösungsmittel (siehe Verdünnungstabelle unten) wird in eine Spritze geeigneter Grösse aufgezogen und das Lösungsmittel in die Flasche injiziert.
|
Zugesetztes Lösungsmittel:
|
Dosis (in Allergan-Einheiten pro 0,1 ml):
| |
2,5 ml
|
4,0 Allergan-Einheiten
|
Die Durchstechflasche darf nicht verwendet werden, wenn das Lösungsmittel nicht durch den Unterdruck eingezogen wird. VISTABEL vorsichtig durch Rotieren der Flasche mit der Kochsalzlösung mischen.
Das aufbereitete VISTABEL ist eine klare farblose bis leicht gelbliche Lösung, die frei von sichtbaren Teilchen ist. Die zubereitete Lösung sollte vor Anwendung auf Klarheit und Schwebeteilchen hin mit dem Auge überprüft werden.
Verbleibende Restmengen der Toxinlösung sind fachgerecht zu verwerfen.
Entsorgung der Toxinlösung
Zur sicheren Entsorgung sollten ungebrauchte Durchstechflaschen mit etwas Wasser aufbereitet und autoklaviert werden. Alle gebrauchten Durchstechflaschen, Spritzen, vergossenen Lösungsmittelreste, etc. sollten ebenfalls im Autoklav inaktiviert werden. Rückstände des Botulinumtoxins können auch mit verdünnter Hypochloritlösung 0,5% inaktiviert werden. Die Lösung sollte mindestens 5 Minuten einwirken.
Identifizierung des Arzneimittels
Wird ein authentisches VISTABEL-Produkt verwendet, werden horizontale Linien in Regenbogenfarben und der Name «abbvie» auf der Etikette sichtbar (Hologramm), und zwar beim Hin- und Herdrehen der Durchstechflasche in der Hand unter einer Schreibtischlampe oder Leuchtstoffröhre. Ist dies nicht der Fall und/oder ist die Perforation nicht intakt, soll das Produkt nicht verwendet werden, und AbbVie ist zu kontaktieren.
Zusätzlich können Aufkleber mit Chargennummer und Verfalldatum von der Etikette der VISTABEL-Durchstechflasche abgezogen und in die Patientenakte geklebt werden, um die Rückverfolgbarkeit der Charge zu erleichtern. Nach dem Abziehen des Aufklebers von der Etikette der Durchstechflasche wird «Verwendet/Utilisé» erscheinen.
Zulassungsnummer55955 (Swissmedic)
PackungenPackung mit 1 Durchstechflasche à 100 Allergan-Einheiten [A]
ZulassungsinhaberinAbbVie AG, 6330 Cham
Stand der InformationMai 2025
|






