Warnhinweise und VorsichtsmassnahmenDie Anwendung eines CHC erhöht das Risiko für venöse Thromboembolien (VTE) und für arterielle Thromboembolien (ATE) im Vergleich zur Nichtanwendung. Warnhinweise und Vorsichtsmassnahmen, welche nachfolgend beschrieben werden, müssen vor jeder Verschreibung berücksichtigt werden (siehe «Risiko für venöse Thromboembolien [VTE]» und «Risiko für arterielle Thromboembolien [ATE]»). Es ist wichtig, die Patientin auf die Informationen zu venösen und arteriellen thromboembolischen Ereignissen hinzuweisen, insbesondere auf die möglichen Symptome von VTE und ATE und die bekannten vaskulären Risikofaktoren sowie darauf, was im Falle einer vermuteten Thrombose zu tun ist (siehe «Symptome einer VTE [tiefe Venenthrombose und Lungenembolie]» und «Symptome einer ATE»).
Der Nutzen einer Anwendung eines CHC wie NuvaRing sollte gegen die nachfolgend aufgeführten Erkrankungen/Risiken – unter Berücksichtigung des Schweregrades jedes einzelnen oder dem Aufeinandertreffen mehrerer Faktoren – abgewogen und mit jeder Patientin besprochen werden, bevor man sich zur Anwendung von NuvaRing entschliesst (siehe auch «Kontraindikationen»). Die Patientin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen.
Vor Beginn oder Wiederaufnahme eines CHC wie NuvaRing soll eine sorgfältige Eigen- und Familienanamnese erhoben sowie unter Beachtung der Kontraindikationen und Warnhinweise und Vorsichtsmassnahmen eine gründliche allgemeine und gynäkologische Untersuchung durchgeführt werden, um behandlungsbedürftige Erkrankungen sowie deren Risikofaktoren feststellen und eine Schwangerschaft ausschliessen zu können. Diese Untersuchungen schliessen im Allgemeinen Blutdruck, Mammae, Abdomen, Beckenorgane (inkl. Zervixzytologie) und relevante Laboruntersuchungen ein.
Während der Anwendung des CHC müssen diese Untersuchungen in regelmässigen Abständen wiederholt werden, wobei Art und Häufigkeit auf die individuelle Anwenderin abgestimmt werden und sich an den Richtlinien der Schweizer Gesellschaft für Gynäkologie und Geburtshilfe (SGGG) orientieren sollten. Bei diesen Kontrollen sollten die Kontraindikationen (z.B. eine transitorische ischämische Attacke) und Risikofaktoren (z.B. Familienanamnese venöser oder arterieller Thrombosen, vgl. «Risikofaktoren für VTE» und «Risikofaktoren für ATE») erneut überprüft werden, da diese während der Anwendung eines CHC zum ersten Mal auftreten können.
Gründe zum sofortigen Absetzen
Die Anwenderin muss darüber informiert werden, dass sie bei Auftreten einer der oben genannten Kontraindikationen sowie bei Eintreten einer der nachfolgenden Situationen schnellstmöglich einen Arzt/eine Ärztin konsultieren muss, der/die dann über die weitere Anwendung des CHC entscheiden wird:
·erstmaliges Auftreten oder Exazerbation migräneartiger oder häufigeres Auftreten ungewohnt starker Kopfschmerzen.
·plötzliche Seh-, Hör-, Sprech- oder sonstige Wahrnehmungsstörungen.
·erste Anzeichen von thromboembolischen Ereignissen (vgl. Symptome einer VTE [tiefe Venenthrombose und Lungenembolie]» und «Symptome einer ATE»).
·mindestens 4 Wochen vor geplanten Operationen und während einer Immobilisation, z.B. nach Unfall oder Operation.
·klinisch relevanter Blutdruckanstieg (bei wiederholter Messung).
·Auftreten von Ikterus, Hepatitis, generalisiertem Pruritus.
·starke Oberbauchschmerzen oder Lebervergrösserung.
·schwere depressive Zustände.
·Schwangerschaft.
Risiko für venöse Thromboembolien (VTE)
Die Anwendung jedes CHC erhöht das Risiko für VTE im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie NuvaRing, können ein bis zu doppelt so hohes Risiko aufweisen.
Die Entscheidung, das Arzneimittel anzuwenden, sollte nur nach einem Gespräch mit der Patientin getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht:
·Das Risiko für VTE bei Anwendung von NuvaRing.
·Wie beeinflussen ihre vorbestehenden individuellen Risikofaktoren dieses Risiko?
·Stärkste Risikoerhöhung für VTE im allerersten Anwendungsjahr (insbesondere während der ersten 3 Monate).
·Die vorhandenen Daten deuten darauf hin, dass dieses erhöhte Risiko sowohl bei der erstmaligen Anwendung eines CHC als auch bei der erneuten Anwendung des gleichen oder eines anderen CHC besteht (nach einem mindestens 4-wöchigen oder länger dauernden anwendungsfreien Intervall).
·NuvaRing ist ein Arzneimittel. Im Falle eines Unfalls oder eines operativen Eingriffs muss die Anwenderin die behandelnden Ärzte bzw. Ärztinnen darüber informieren, dass sie NuvaRing anwendet.
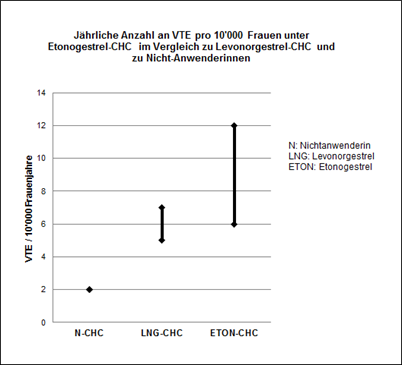
Ungefähr 2 von 10'000 Frauen, die kein CHC anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei der einzelnen Frau kann das Risiko jedoch in Abhängigkeit von ihren zugrundeliegenden Risikofaktoren bedeutend höher sein (siehe unten).
Aufgrund der vorliegenden epidemiologischen Daten wird geschätzt, dass im Verlauf eines Jahres 6-12 von 10'000 Frauen, die ein Etonogestrel-haltiges CHC anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei 5-7 von 10'000 Frauen, die ein Levonorgestrel-haltiges CHC anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während einer Schwangerschaft oder in der postpartalen Phase.
VTE verlaufen in 1-2% der Fälle tödlich.
Äusserst selten wurde bei Anwenderinnen von CHC auch über venöse Thrombosen ausserhalb der Extremitäten berichtet, z.B. Sinusvenenthrombosen oder Thrombosen in hepatischen, mesenterialen, renalen oder retinalen Venen.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von CHC kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, vor allem wenn mehrere Risikofaktoren gleichzeitig vorliegen (siehe Tabelle). Insbesondere ist bei der Nutzen-Risiko-Abwägung zu berücksichtigen, dass das Risiko venöser thromboembolischer Ereignisse überadditiv erhöht sein kann, wenn eine Kombination von Risikofaktoren vorliegt. In diesem Fall muss das Gesamtrisiko für eine VTE in Betracht gezogen werden. NuvaRing ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die sie insgesamt einem hohen Risiko für eine Venenthrombose aussetzen.
Tabelle: Risikofaktoren für VTE
|
Risikofaktor
|
Anmerkung
| |
Adipositas (Body-Mass-Index über 30 kg/m²)
|
Das Risiko nimmt mit steigendem BMI deutlich zu.
Besonders wichtig, wenn weitere Risikofaktoren vorliegen.
| |
Längere Immobilisierung, grössere chirurgische Eingriffe, jeder Eingriff an Beinen oder Hüfte, neurochirurgischer Eingriff oder schweres Trauma
|
In diesen Fällen ist es ratsam, die Anwendung des Vaginalrings zu unterbrechen (bei einer geplanten Operation mindestens vier Wochen vorher) und frühestens zwei Wochen nach vollständiger Mobilisierung wieder aufzunehmen. Ggf. ist eine andere Kontrazeptionsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern.
Eine medikamentöse Thromboseprophylaxe muss erwogen werden, wenn NuvaRing nicht vorab abgesetzt wurde.
| |
Positive Familienanamnese (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z.B. jünger als 50 Jahre).
|
Bei Verdacht auf eine genetische Prädisposition ist die Patientin zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung von NuvaRing getroffen wird.
Falls die Untersuchung Hinweise auf eine Thrombophilie ergibt, ist die Anwendung von NuvaRing kontraindiziert.
| |
Andere Erkrankungen, die mit einem erhöhten VTE-Risiko assoziiert sind
|
Systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, chronisch-entzündliche Darmerkrankungen (Morbus Crohn oder Colitis ulcerosa), Sichelzellanämie, maligne Erkrankungen
| |
Zunehmendes Alter
|
Insbesondere älter als 35 Jahre
|
Hinweis: Eine vorübergehende Immobilisierung wie beispielsweise eine Flugreise von >4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Patientinnen mit weiteren Risikofaktoren.
Über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose besteht kein Konsens.
Es muss beachtet werden, dass das Risiko thromboembolischer Ereignisse in der postpartalen Phase erhöht ist. Es gibt Daten, die darauf hindeuten, dass das Thromboserisiko bis 12 Wochen nach der Entbindung erhöht sein kann.
Symptome einer VTE (tiefe Venenthrombose und Lungenembolie)
Der Patientin ist anzuraten, bei Auftreten eines oder mehrerer der folgenden Symptome unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie NuvaRing anwendet.
·Symptome einer tiefen Beinvenenthrombose können sein
·unilaterale Schwellung in einem Bein oder entlang einer Vene im Bein;
·Spannungsgefühl oder Schmerzen in einem Bein, auch wenn sie nur beim Stehen oder Gehen spürbar sind;
·Überwärmung, Rötung oder Verfärbung der Haut am betroffenen Bein.
·Symptome einer Lungenembolie können sein
·plötzliche unerklärliche Kurzatmigkeit, schnelles Atmen oder Atemnot; Anstrengungsintoleranz;
·plötzliches Auftreten von Husten, eventuell mit blutigem Sputum;
·plötzlicher starker Schmerz im Brustkorb, welcher sich bei tiefer Atmung verstärken kann;
·starke Benommenheit, Schwindel, oder Angstgefühl;
·Tachykardie oder Arrhythmien.
Einige dieser Symptome (z.B. Kurzatmigkeit oder Husten) sind nicht spezifisch und können als häufige oder weniger schwere Ereignisse (z.B. Atemwegsinfektionen) missdeutet werden.
Risiko für arterielle Thromboembolien (ATE)
Epidemiologische Studien haben ausserdem die Anwendung von CHC mit einem erhöhten Risiko für arterielle thromboembolische Ereignisse (wie Myokardinfarkt, Schlaganfall oder transitorische ischämische Attacken) in Verbindung gebracht. Bevor die Entscheidung getroffen wird, NuvaRing zu verordnen, ist die Patientin über dieses Risiko sowie insbesondere auch darüber aufzuklären, wie eventuell vorbestehende individuelle Risikofaktoren dieses Risiko zusätzlich erhöhen können.
Äusserst selten wurde bei Anwenderinnen von CHC auch über Thrombosen in anderen Blutgefässen (wie z.B. hepatischen, mesenterialen, renalen oder retinalen Arterien) berichtet.
Risikofaktoren für ATE
Ein erhöhtes Risiko für einen zerebrovaskulären Insult oder andere arterielle thromboembolische Komplikationen bei Anwenderinnen von CHC besteht v.a. bei Frauen, die bereits Risikofaktoren für solche Erkrankungen aufweisen (siehe Tabelle). Insbesondere muss bei der Nutzen-Risiko-Abwägung beachtet werden, dass das Risiko für arterielle thromboembolische Ereignisse überadditiv erhöht sein kann, wenn eine Kombination von Risikofaktoren vorliegt. In diesem Fall muss das Gesamtrisiko für eine ATE betrachtet werden. Bei Patientinnen, die aufgrund eines schwerwiegenden oder des Vorliegens mehrerer Risikofaktoren ein hohes Risiko für eine ATE aufweisen, ist NuvaRing kontraindiziert.
Tabelle: Risikofaktoren für ATE
|
Risikofaktor
|
Anmerkung
| |
Zunehmendes Alter
|
Insbesondere älter als 35 Jahre
| |
Rauchen
|
Frauen ist anzuraten, nicht zu rauchen, wenn sie ein CHC wie NuvaRing anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Kontrazeptionsmethode anzuwenden.
| |
Arterielle Hypertonie
|
| |
Diabetes mellitus
|
Bei Diabetikerinnen mit bereits bestehenden Gefässkomplikationen ist die Anwendung von CHC kontraindiziert.
| |
Dyslipoproteinämie
|
| |
Herzklappenerkrankungen
|
| |
Vorhofflimmern
|
| |
Adipositas (Body-Mass-Index über 30 kg/m²)
|
Das Risiko nimmt mit steigendem BMI deutlich zu.
Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren.
| |
Positive Familienanamnese (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d.h. jünger als 50 Jahre).
|
Bei Verdacht auf eine genetische Prädisposition ist die Patientin zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung von NuvaRing getroffen wird.
Falls die Untersuchung Hinweise auf eine Thrombophilie ergibt, ist die Anwendung von NuvaRing kontraindiziert.
| |
Migräne
|
Ein Anstieg der Häufigkeit oder des Schweregrads einer Migräne während der Anwendung von NuvaRing kann ein Prodromalsymptom eines zerebrovaskulären Ereignisses darstellen und Grund für ein sofortiges Absetzen sein.
| |
Andere Erkrankungen, die mit einem erhöhten Risiko für ATE assoziiert sind
|
Hyperhomocysteinämie, systemischer Lupus erythematodes, Sichelzellanämie, maligne Erkrankungen.
|
Symptome einer ATE
Der Patientin ist anzuraten, beim Auftreten eines oder mehrerer der folgenden Symptome unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie NuvaRing anwendet.
·Symptome eines zerebrovaskulären Insults können sein
·plötzliche Taubheit oder Kraftlosigkeit des Gesichtes, eines Armes oder Beines, vor allem einer Körperhälfte;
·plötzliche Verwirrtheit;
·undeutliche Aussprache oder Verständnisprobleme;
·plötzliche Sehstörungen in einem oder beiden Augen;
·plötzliche Gehstörungen;
·Schwindel;
·Gleichgewichts- oder Koordinationsstörungen;
·plötzliche schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
·Bewusstseinsverlust oder Ohnmacht mit oder ohne Krampfanfall.
·Symptome eines Myokardinfarktes können sein
·Schmerzen, Unwohlsein, Druckgefühl, Schweregefühl, Enge- oder Spannungsgefühl in der Brust, im Arm oder hinter dem Brustbein;
·Beschwerden, welche in Rücken, Kiefer, Hals, Arm oder Magen ausstrahlen;
·Völlegefühl, Magenbeschwerden oder Würgereiz;
·Schwitzen, Nausea, Erbrechen oder Schwindel;
·extremes Schwäche- oder Angstgefühl oder Kurzatmigkeit;
·Tachykardie oder Arrhythmien.
·Andere Symptome eines vaskulären Verschlusses können sein
·plötzlicher Schmerz, Schwellung oder leichte Cyanose einer Extremität;
·akutes Abdomen.
Verdacht auf hereditäre oder erworbene Prädisposition für thromboembolische Komplikationen
Bei Verdacht auf eine hereditäre oder erworbene Prädisposition für thromboembolische Komplikationen ist eine gerinnungs-physiologische Abklärung durch einen Spezialisten angezeigt, welcher ggf. eine Bestimmung bestimmter hämostatischer Parameter veranlassen wird.
Tumorerkrankungen
In einigen epidemiologischen Untersuchungen wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von CHC (>5 Jahre) berichtet. Es wird jedoch nach wie vor kontrovers diskutiert, in wie weit dieses Ergebnis durch andere Faktoren wie eine Infektion durch humane Papillomaviren (HPV) (stärkster Risikofaktor), die Frequenz der Teilnahme am Zervix-Screening oder das Sexualverhalten beeinflusst wird.
Eine Metaanalyse von 54 epidemiologischen Studien hat ergeben, dass das relative Risiko (RR) der Diagnosestellung eines Mammakarzinoms bei Frauen, die CHC anwenden, geringfügig erhöht (RR=1,24) ist. Nach Absetzen der CHC sinkt das erhöhte Risiko kontinuierlich ab und ist nach 10 Jahren nicht mehr nachweisbar. Da Mammakarzinome vor dem 40. Lebensjahr selten sind, ist bei Frauen, die ein CHC anwenden oder bis vor kurzem angewendet haben, die zusätzlich diagnostizierte Anzahl an Mammakarzinomen im Verhältnis zum Mammakarzinom-Gesamtrisiko gering. Diese Studien liefern keine Hinweise auf eine Kausalität. Die beobachtete Risikoerhöhung kann sowohl auf eine bei Anwenderinnen von CHC frühzeitigere Erkennung als auch auf biologische Wirkungen von CHC oder auf beide Faktoren gemeinsam zurückzuführen sein. Mammakarzinome bei Frauen, die ein CHC angewendet haben, waren zum Zeitpunkt der Diagnosestellung tendenziell weniger weit fortgeschritten als bei Frauen, die nie ein CHC angewendet hatten.
In seltenen Fällen wurde unter Anwendung hormonaler Kontrazeptiva über gutartige, noch seltener über bösartige Lebertumore berichtet. In isolierten Fällen führten diese Tumore zu lebensbedrohlichen intraabdominalen Blutungen. Deshalb sollte ein Lebertumor in die differentialdiagnostischen Überlegungen miteinbezogen werden, wenn bei NuvaRing-Anwenderinnen starke Oberbauchbeschwerden, eine Lebervergrösserung oder Hinweise auf intraabdominale Blutungen auftreten.
Depressive Störungen
Depressionen bzw. depressive Verstimmungen sind als mögliche unerwünschte Wirkungen bei der Anwendung von Sexualhormonen, einschliesslich hormonaler Kontrazeptiva, bekannt (s. a. «Unerwünschte Wirkungen»). Solche Störungen können bereits kurz nach Beginn der Behandlung auftreten. Eine Depression kann schwerwiegend verlaufen und stellt einen Risikofaktor für Suizide bzw. suizidales Verhalten dar. Anwenderinnen hormonaler Kontrazeptiva sollen daher über mögliche Symptome depressiver Störungen informiert werden. Der Anwenderin soll dringend geraten werden, sich umgehend an einen Arzt zu wenden, falls sie unter der Anwendung des Kontrazeptivums Stimmungsschwankungen oder andere Symptome einer Depression bemerkt. Anwenderinnen mit einer schweren Depression in der Anamnese sollen sorgfältig überwacht werden. Falls es unter der Anwendung von NuvaRing erneut zu schweren depressiven Zuständen kommt, muss das Arzneimittel abgesetzt werden.
Lokalisierte Risiken
Unter Anwendung von NuvaRing kann es gelegentlich zu einer Vaginitis kommen. Es gibt keine Hinweise, dass die kontrazeptive Wirkung von NuvaRing durch die Behandlung einer Vaginitis beeinträchtigt werden kann oder dass NuvaRing die Wirkung einer Vaginitisbehandlung beeinflussen könnte.
Sehr selten wurde über Verwachsungen mit vaginalem Gewebe berichtet, was eine Entfernung des Vaginalringes durch einen Arzt bzw. eine Ärztin erforderte. In solchen Fällen kann eine Entfernung auch ohne Inzision des darüberliegenden vaginalen Gewebes möglich sein, indem der Vaginalring an einer Stelle durchtrennt wird. In diesem Fall muss darauf geachtet werden, dass der Vaginalring vollständig entfernt wird.
In sehr seltenen Fällen wurde NuvaRing irrtümlich in die Urethra eingesetzt und gelangte dabei möglicherweise in die Blase. Deshalb sollte bei Symptomen einer Zystitis eine unsachgemässe Positionierung in Betracht gezogen werden.
Unter den folgenden Umständen ist es möglich, dass eine Anwenderin entweder nicht in der Lage ist, den Vaginalring richtig einzusetzen, oder sie diesen verlieren könnte: Prolaps des Gebärmutterhalses, Zystozele und/oder Rectozele, starke bzw. chronische Obstipation.
Toxisches Schock Syndrom (TSS)
Fälle von TSS wurden bei NuvaRing-Anwenderinnen berichtet. TSS wurde mit der Verwendung von Tampons und gewissen barrierebildenden Kontrazeptiva in Verbindung gebracht, und in einigen Fällen benutzten die NuvaRing-Anwenderinnen ebenfalls Tampons. Ein kausaler Zusammenhang zwischen der Verwendung von NuvaRing und TSS konnte nicht hergestellt werden. Falls eine Patientin Symptome eines TSS aufweist, sollte diese Diagnose in Betracht gezogen und eine angemessene medizinische Untersuchung und Behandlung veranlasst werden.
Es soll darüber aufgeklärt werden, dass NuvaRing keinen Schutz vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten bietet.
Auswirkungen von Ethinylestradiol und Etonogestrel auf den männlichen Sexualpartner
Das Ausmass und die mögliche pharmakologische Auswirkung einer Ethinylestradiol- und Etonogestrel-Absorption durch den Penis auf den männlichen Partner wurde nicht untersucht.
Sonstige Vorsichtsmassnahmen
Über Hypersensitivitätsreaktionen wie Angioödem und anaphylaktische Reaktionen wurde während der Anwendung von NuvaRing berichtet. Exogene Östrogene können bei Frauen mit hereditärem und/oder erworbenem Angioödem die Symptome des Angioödems induzieren oder verschlimmern. Falls eine solche Reaktion vermutet wird, sollte NuvaRing abgesetzt und eine entsprechende Behandlung eingeleitet werden.
Frauen, die ein hormonales Kontrazeptivum anwenden, sollen nicht gleichzeitig mit Johanniskraut-Präparaten (Hypericum) behandelt werden, da die kontrazeptive Wirkung beeinträchtigt sein kann. Über Zwischenblutungen und Einzelfälle ungewollter Schwangerschaften bei gleichzeitiger Anwendung von oralen hormonalen Kontrazeptiva und Johanniskraut-Präparaten wurde berichtet (siehe auch «Interaktionen»).
Bei Frauen mit bestehender oder familiärer Hypertriglyzeridämie ist unter der Anwendung von CHC möglicherweise mit einem erhöhten Pankreatitis-Risiko zu rechnen.
Obwohl unter der Anwendung von CHC relativ häufig über einen geringfügigen Blutdruckanstieg berichtet wird, sind klinisch relevant erhöhte Blutdruckwerte selten. Kommt es unter der Anwendung eines CHC zu einer klinisch relevanten Blutdruckerhöhung (bei wiederholter Messung), sollte das CHC abgesetzt werden. Wo es angezeigt erscheint, kann die erneute Anwendung eines CHC erwogen werden, wenn sich die Blutdruckwerte (unter Behandlung) normalisiert haben.
Obwohl es unter der Anwendung von CHC zu einer Beeinflussung der peripheren Insulinresistenz und der Glukosetoleranz kommen kann, scheint eine Änderung des Therapieschemas bei Diabetikerinnen, die niedrigdosierte CHC (mit <0,050 mg Ethinylestradiol) anwenden, nicht erforderlich. Dennoch sollten Diabetikerinnen – insbesondere während der ersten Monate der Anwendung von NuvaRing – sorgfältig überwacht werden.
Akute oder chronische Störungen der Leberfunktion können das Absetzen des CHC erforderlich machen, bis sich die Leberfunktionswerte normalisiert haben. Beim Wiederauftreten eines cholestatischen Ikterus und/oder Pruritus, der erstmalig während einer Schwangerschaft oder während einer früheren Einnahme von Sexualsteroidhormonen aufgetreten ist, müssen CHC abgesetzt werden.
Bei Patientinnen mit Hepatitis C, welche gleichzeitig ein Ethinylestradiol-haltiges CHC anwendeten, wurde unter Anwendung der bei HCV-Infektionen eingesetzten Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir signifikant häufiger ein Anstieg der ALT (einschliesslich Fällen einer Erhöhung auf über das Fünffache, in Einzelfällen auf über das 20-Fache der Obergrenze des Normbereiches) beobachtet als bei Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden (siehe «Interaktionen»). Ähnliche ALT-Erhöhungen wurden auch unter Anti-HCV-Arzneimitteln beobachtet, die Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir enthielten. NuvaRing muss daher vor Beginn einer Therapie mit diesen Wirkstoffkombinationen abgesetzt werden. Unter der Voraussetzung, dass normale Leberwerte vorliegen, kann frühestens 2 Wochen, besser jedoch 4 Wochen nach dem Absetzen der Wirkstoffkombinationen Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir, Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir wieder mit der Anwendung von NuvaRing begonnen werden. Hierbei ist allerdings zu beachten, dass bei einem Intervall von weniger als 4 Wochen aufgrund der enzyminduzierenden Eigenschaften von Ritonavir die Wirksamkeit des CHC noch beeinträchtigt sein kann und daher zusätzlich für 28 Tage eine Barrieremethode angewendet werden sollte (siehe unten unter «Interaktionen, Enzyminduktoren»). Letzteres ist insbesondere dann relevant, wenn die Kombination Ombitasvir/Paritaprevir/Ritonavir zusammen mit dem potentiell teratogenen Wirkstoff Ribavirin angewendet wird.
Die folgenden Erkrankungen können sowohl während einer Schwangerschaft als auch während der Anwendung eines CHC auftreten oder ungünstig beeinflusst werden, doch lassen die verfügbaren Daten keine eindeutigen Schlüsse auf einen Kausalzusammenhang mit der Anwendung eines CHC zu: cholestatischer Ikterus und/oder Pruritus; Cholelithiasis; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Chorea minor; Herpes gestationis; Otosklerose-bedingter Hörverlust. Die Anwendung von CHC wurde ausserdem auch mit dem Auftreten von Morbus Crohn sowie Colitis ulcerosa assoziiert.
Bei prädisponierten Frauen kann die Anwendung von CHC gelegentlich ein Chloasma verursachen, das durch intensive Sonnenbestrahlung noch verstärkt wird. Frauen, die hierzu neigen, sollten sich deshalb keiner starken UV-Strahlung aussetzen.
|

