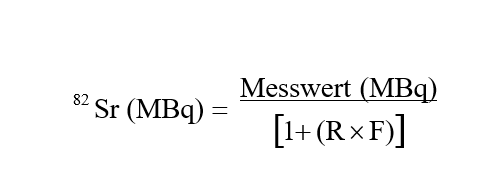ZusammensetzungWirkstoffe
Cardiogen-82 enthält durch einen Beschleuniger erzeugtes Strontium 82Sr, adsorbiert an einer mit einer Bleiabschirmung versehenen Zinn(IV)oxid-Säule. Es ermöglicht die Gewinnung von sterilen, apyrogenen Rubidiumchlorid-Injektionslösungen. Die chemische Formel von Rubidium-82 chlorid ist 82RbCl.
Die bei einer Elution entstehende Aktivität (in Megabecquerel) von 82Rb hängt von der Eluierbarkeit des Generators ab.
Hilfsstoffe
Cardiogen-82 enthält sterile 0,9%ige Natriumchloridlösung, was einem Natriumgehalt von 3,54 mg/ml entspricht, Chlorwasserstoff und Natriumhydroxid.
Indikationen/AnwendungsmöglichkeitenRadiodiagnostikum.
Cardiogen-82 ist ein geschlossenes System zur Herstellung einer 82Rb-Rubidiumchlorid- Injektionslösung zur intravenösen Verabreichung. Die Injektion von 82Rb-Rubidiumchlorid ist indiziert bei bildgebenden Verfahren durch Positronen-Emissions-Tomographie (PET) des Herzmuskels im Ruhezustand oder unter pharmakologischer Belastung, um die regionale Myokardperfusion bei Erwachsenen mit bekannter oder vermuteter Erkrankung der Herzkranzgefässe zu bewerten.
Cardiogen-82 (Rubidium-82-Generator) darf nur mit dem Cardiogen-82-Infusionssystem Modell 510 oder dem Cardiogen-82 Infusionssystem Modell 1701 verwendet werden, welche speziell für die Nutzung mit dem Cardiogen-82 Generator entworfen wurden. Die Cardiogen-82-Infusionssysteme Modell 510 bzw. Modell 1701 ermöglichen präzise Messungen und eine exakte Aktivitätsinjektion von 82Rb- Rubidiumchlorid, die bei einer Einmalverabreichung eine Aktivität von 2’220 MBq und bei einer Mehrfachverabreichung eine kumulative Aktivität von 4’440 MBq nicht überschreiten darf, bei einer maximalen Infusionsrate von 50 ml/min, einem Maximalvolumen pro Infusion von 100 ml und einem Gesamtvolumen, das unterhalb von 200 ml liegen muss.
Diese Einschränkungen für einen Durchgang im Ruhe- oder Belastungszustand spiegeln die Anwendungsbedingungen wider, unter denen die klinischen Tests durchgeführt wurden.
Anwendung in der Geriatrie
Laut berichteter klinischer Erfahrung konnten keine Unterschiede in der Verträglichkeit oder Wirksamkeit zwischen älteren und jüngeren Personen festgestellt werden.
Anwendung bei Patienten mit schwerer linksseitiger/globaler Herzdysfunktion
Bei Patienten mit klinisch signifikanter Verringerung der Herzfunktion (Herzschlagvolumen, LVEF), muss der Zeitraum zwischen der Infusion und der Bildgewinnung vergrössert werden (siehe „Dosierung/Anwendung“). Diese Patienten sind nach der Injektion klinisch zu überwachen (siehe „Warnhinweise und Vorsichtsmassnahmen“).
Dosierung/AnwendungAllgemeines
Die für den Erhalt einer geeigneten kardialen Visualisierung minimal erforderliche Aktivität Rubidium 82Rb verwenden: 21 MBq/kg. Eine schwache Aktivität setzt den Patienten weniger den Strahlungen aus und stimmt überein mit dem ALARA-Prinzip („As Low As Reasonably Achievable“).
Die meisten Verfahren erfordern nicht die maximal empfohlene Aktivität von Rubidium 82Rb. Die zu verwendende Aktivität ist sorgfältig individuell abzustimmen und muss beispielsweise folgende Faktoren berücksichtigen: Body-Mass-Index, Geräte (PET oder PET-CT, in 2D, 3D…) und anzuwendende Techniken (Erfassung in 2D, 3D,…) (siehe auch „Warnhinweise und Vorsichtsmassnahmen“).
Die Kalibrierung der Messung der Aktivität von Rubidium 82Rb im Eluat und die Bestimmung des Anteils von Strontium 82Sr und Strontium 85Sr nach dem Zerfall von 82Rb (Breakthrough-Test) sind zu Beginn jedes Tages durchzuführen, an dem der Generator verwendet wird. Die Elutionen für den Breakthrough-Test sowie für die Verabreichungen an die Patienten sind exakt in der gleichen Art und Weise (siehe Richtlinien unter „Sonstige Hinweise / Hinweise für die Handhabung“) durchzuführen.
Übliche Dosierung von Rubidium 82
Die aus Cardiogen-82 gewonnene 82Rb-Rubidiumchlorid-Injektionslösung ist nur für eine intravenöse Verabreichung mit Hilfe eines geeigneten Infusionssystems vorgesehen (siehe „Sonstige Hinweise / Hinweise für die Handhabung“).
Die übliche Dosis einer Injektion bei einem Erwachsenen (70 kg) beträgt 1’480 MBq, bzw. liegt im Bereich von 1’110 bis 2’220 MBq; eine Einmalverabreichung darf 2’220 MBq nicht überschreiten.
Eine einmalige Dosis bei einer Flussrate von 50 ml/min (Modell 510 oder Modell 1701) oder 20 ml/min (nur Modell 1701) mit Hilfe eines Katheters verabreichen, der in eine grosse periphere Vene gelegt ist. Dabei ein Gesamtvolumen von 100 ml nicht überschreiten. Niemals die Elutionsgeschwindigkeit von 50 ml/min überschreiten, da dies zu einem Entweichen (Breakthrough) von Strontium 82Sr führen würde.
Zwei einmalige Dosen werden folgendermassen für einen Durchgang im Ruhe- oder Belastungszustand verwendet:
Bei einer Perfusionsuntersuchung im Ruhezustand:
-Eine einmalige Dosis 82Rb-Rubidiumchloridlösung (im Ruhezustand) wie oben beschrieben verabreichen.
-Das bildgebende Verfahren 60-90 Sekunden nach Injektion der 82Rb- Rubidiumchloridlösung bei Patienten mit LVEF > 50 % starten. Wird eine längere Zirkulationszeit erwartet, kann der Start der Bildgewinnung verzögert werden: 90 bis 110 Sekunden, wenn die LVEF zwischen 30 und 50 % liegt, 110 bis 130 Sekunden, wenn die LVEF stark verringert ist (< 30 %) (z. B. bei einem Patienten mit schwerer linksventrikulärer Dysfunktion). Im Allgemeinen dauert die Bildgewinnung 5 Minuten.
Bei einer Perfusionsuntersuchung im Belastungszustand:
-Um ein Vorhandensein von Restaktivität der ersten Injektion Rubidium 82Rb zu vermeiden, mindestens 10 Minuten nach Abschluss der ersten Injektion Rubidium 82Rb abwarten, bevor der pharmakologische Stresstest begonnen wird.
-Durchführung des pharmakologischen Stresstests gemäss den in der Klinik geltenden Verfahren (Adenosin, Dobutamin, Dipyridamol...).
-Nach einem dreiminütigen Intervall nach Start des Stresstests eine einmalige Aktivität 82Rb- Rubidiumchloridlösung (Belastung) wie oben beschrieben injizieren.
-Das bildgebende Verfahren 60-90 Sekunden nach Injektion der 82Rb-Rubidiumchloridlösung im Stresszustand bei Patienten mit LVEF > 50 % starten. Wird eine längere Zirkulationszeit erwartet, kann der Start der Bildgewinnung verzögert werden: 90 bis 110 Sekunden, wenn die LVEF zwischen 30 und 50 % liegt, 110 bis 130 Sekunden, wenn die LVEF stark verringert ist (< 30 %) (z. B. bei einem Patienten mit schwerer linksventrikulärer Dysfunktion). Im Allgemeinen dauert die Bildgewinnung 5 Minuten.
STRAHLENEXPOSITION
Dosimetrie
Die in Tabelle 1 angegebenen Daten stammen aus der Veröffentlichung Nr. 128 der ICRP (International Commission for Radiologic Protection)1
TABELLE 1: Adsorbierte Strahlendosen für Rubidium 82 (82Rb)
|
Organ
|
Adsorbierte Dosis je verabreichte Aktivität (mGy/MBq)
| |
|
Erwachsener
|
15-Jähriger
|
10-Jähriger
|
5-Jähriger
|
1-Jähriger
| |
Nebennieren
|
2,4 x 10-3
|
3,6 x 10-3
|
5,1 x 10-3
|
7,0 x 10-3
|
1,0 x 10-2
| |
Knochenoberflächen
|
4,2 x 10-4
|
5,6 x 10-4
|
8,5 x 10-4
|
1,4 x 10-3
|
3,1 x 10-3
| |
Gehirn
|
1,4 x 10-4
|
1,4 x 10-4
|
1,6 x 10-4
|
1,9 x 10-4
|
2,8 x 10-4
| |
Brust
|
1,9 x 10-4
|
2,0 x 10-4
|
1,3 x 10-2
|
2,2 x 10-2
|
4,3 x 10-2
| |
Gallenblase
|
7,2 x 10-4
|
8,5 x 10-4
|
1,2 x 10-3
|
2,0 x 10-3
|
5,7 x 10-3
| |
Verdauungstrakt
|
|
|
|
|
| |
Magen
|
8,3 x 10-4
|
1,1 x 10-3
|
1,6 x 10-3
|
2,7 x 10-3
|
5,4 x 10-3
| |
Dünndarm
|
2,0 x 10-3
|
2,6 x 10-3
|
4,6 x 10-3
|
7,7 x 10-3
|
1,5 x 10-2
| |
Kolon
|
1,1 x 10-3
|
1,4 x 10-3
|
2,5 x 10-3
|
4,1 x 10-3
|
7,8 x 10-3
| |
Aufsteigendes Kolon
|
1,1 x 10-3
|
1,4 x 10-3
|
2,5 x 10-3
|
4,1 x 10-3
|
7,9 x 10-3
| |
Absteigendes Kolon
|
1,1 x 10-3
|
1,4 x 10-3
|
2,4 x 10-3
|
3,9 x 10-3
|
7,6 x 10-3
| |
Herz
|
4,0 x 10-3
|
5,2 x 10-3
|
8,2 x 10-3
|
1,3 x 10-2
|
2,4 x 10-2
| |
Nieren
|
9,3 x 10-3
|
1,1 x 10-2
|
1,6 x 10-2
|
2,4 x 10-2
|
4,3 x 10-2
| |
Leber
|
9,8 x 10-4
|
1,3 x 10-3
|
2,0 x 10-3
|
3,0 x 10-3
|
5,8 x 10-3
| |
Lunge
|
2,6 x 10-3
|
3,8 x 10-3
|
5,5 x 10-3
|
8,5 x 10-3
|
1,7 x 10-2
| |
Muskeln
|
2,3 x 10-4
|
3,6 x 10-4
|
7,2 x 10-4
|
2,2 x 10-3
|
4,3 x 10-3
| |
Speiseröhre
|
1,5 x 10-3
|
2,4 x 10-3
|
3,7 x 10-3
|
8,1 x 10-3
|
1,5 x 10-2
| |
Ovarien
|
5,0 x 10-4
|
4,9 x 10-4
|
1,2 x 10-3
|
2,0 x 10-3
|
4,4 x 10-3
| |
Bauchspeicheldrüse
|
2,6 x 10-3
|
3,7 x 10-3
|
7,6 x 10-3
|
9,7 x 10-3
|
2,1 x 10-2
| |
Rotes Knochenmark
|
3,8 x 10-4
|
4,6 x 10-4
|
7,8 x 10-4
|
1,5 x 10-3
|
3,8 x 10-3
| |
Haut
|
1,8 x 10-4
|
2,3 x 10-4
|
3,7 x 10-4
|
6,1 x 10-4
|
1,2 x 10-3
| |
Milz
|
1,8 x 10-4
|
3,9 x 10-4
|
2,4 x 10-3
|
2,8 x 10-3
|
3,8 x 10-3
| |
Testikel
|
2,6 x 10-4
|
3,3 x 10-4
|
5,0 x 10-4
|
7,9 x 10-4
|
1,5 x 10-3
| |
Thymus
|
1,5 x 10-3
|
2,4 x 10-3
|
3,7 x 10-3
|
8,1 x 10-3
|
1,5 x 10-2
| |
Schilddrüse
|
3,1 x 10-4
|
3,8 x 10-4
|
6,2 x 10-4
|
1,0 x 10-3
|
1,9 x 10-3
| |
Blasenwand
|
1,8 x 10-4
|
3,9 x 10-4
|
2,4 x 10-3
|
2,8 x 10-3
|
3,8 x 10-3
| |
Uterus
|
1,0 x 10-3
|
1,1 x 10-3
|
1,5 x 10-2
|
2,3 x 10-2
|
4,1 x 10-2
| |
Andere Gewebe
|
3,1 x 10-4
|
5,0 x 10-4
|
9,3 x 10-4
|
2,1 x 10-3
|
4,7 x 10-3
| |
Effektive Dosis je verabreichte Aktivitätseinheit (mSv/MBq)
|
1,1 x 10-3
|
1,4 x 10-3
|
3,0 x 10-3
|
4,9 x 10-3
|
8,5 x 10-3
|
1 Annals of the International Commission for Radiologic Protection, 2015; 44(2S). ICRP Veröffentlichung 128
Für Rubidium 82 (82Rb) beträgt die effektive Dosis, die sich aus der Verabreichung einer maximalen Aktivität von 2’220 MBq ergibt, 2,44 mSv.
Bei dieser Aktivität von 2’200 MBq werden an die folgenden kritischen Organe typischerweise die folgenden Strahlendosen abgegeben: Nieren: 20,65 mGy, Herz: 8,88 mGy, Lunge: 5,77 mGy und Bauchspeicheldrüse: 5,77 mGy.
Kontraindikationen-Schwangerschaft
-Kinder: Unschädlichkeit und Wirksamkeit des 82Rb-Rubidiumchlorid bei Kindern wurden nicht untersucht.
Warnhinweise und VorsichtsmassnahmenWarnhinweise
Besondere Vorsicht bei der Injektion ist aufgrund der vorübergehenden Erhöhung des Blutvolumens bei Patienten mit kongestiver Herzinsuffizienz geboten. Diese Patienten müssen nach der Verabreichung von 82Rb-Rubidiumchlorid mehrere Stunden überwacht werden, um jegliche verzögerte hämodynamische Instabilität zu entdecken.
Allgemeine Vorsichtsmassnahmen
Umgang mit dem Arzneimittel
Radiopharmaka dürfen ausschliesslich von qualifizierten Ärzten verwendet werden, die aufgrund ihrer Ausbildung und Erfahrung hinsichtlich der unbedenklichen Anwendung und Handhabung von Radionukliden von den zuständigen Behörden anerkannt werden.
Undurchlässige Handschuhe und einen wirksamen Schutz bei der Handhabung der 82Rb- Rubidiumchloridlösung tragen.
Sämtliche Schritte müssen unter streng aseptischen Bedingungen durchgeführt werden.
Der Generator darf nur mit 0,9%iger Natriumchloridlösung zu Injektionszwecken eluiert werden, die weder Verunreinigungen noch Zusatzstoffe aufweist. Tatsächlich können alle Fremdsubstanzen von NaCl, insbesondere zweiwertige Kationen, zu einem Entweichen (Breakthrough) von Strontium oder zu einem Eluat führen, das die Spezifikationen überschreitet, was mögliche unerwünschte Auswirkungen auf den Patienten haben kann.
Vor der Verabreichung ist eine visuelle Kontrolle auf Partikel oder Anzeichen von Entfärbung des Produkts vorzunehmen, wenn die Lösung und ihre Verpackung dies ermöglichen.
Das aus dem Generator stammende Eluat bei Verdacht auf Fremdstoffe nicht verabreichen.
Gefahren durch ionisierende Strahlungen
82Rb-Rubidiumchloridlösung trägt zu einer kumulierten Belastung durch ionisierende Strahlungen bei. Ist die Verabreichung der 82Rb-Rubidiumchloridlösung bei einer Frau im gebärfähigen Alter vorgesehen, ist eine Schwangerschaft vor der Injektion auszuschliessen.
Die geringstmögliche Aktivität beim bildgebenden Verfahren verwenden, um den Schutz des Patienten und der medizinischen Fachkräfte sicherzustellen (siehe auch „Dosierung/Anwendung“ und „Warnhinweise und Vorsichtsmassnahmen“).
Gefahren durch pharmakologische Belastung
Die pharmakologische Induktion einer Herzkreislaufbelastung kann mit schweren, unerwünschten Ereignissen wie Myokardinfarkt, Arrhythmie, Hypotonie, Bronchokonstriktion und zerebrovaskulären Ereignissen verbunden sein. Einen pharmakologischen Belastungstest je nach verordnetem pharmakologischem Belastungswirkstoff und nur, wenn Einrichtungen zur kardialen Reanimation sowie ein geübtes medizinisches Team zur Verfügung stehen, durchführen.
Störungen der Leber-/Nierenfunktion
Es ist nicht zu erwarten, dass eine verringerte Leber- oder Nierenfunktion die Clearance der 82Rb- Rubidiumchloridlösung verändert, da 82Rb in stabiles 82Kr mit einer Halbwertszeit von 75 Sekunden zerfällt und 82Kr durch die Lunge ausgeschieden wird.
Hinweise für die Patienten
-Der Patient muss seit mindestens 6 Stunden nüchtern sein.
-Bei Frauen im gebärfähigen Alter ist eine Schwangerschaft vor der Durchführung der Untersuchung auszuschliessen.
-Die 82Rb-Rubidiumchlorid-Injektionslösung enthält Natrium. Abhängig vom Injektionszeitpunkt kann die verabreichte Natriummenge in einigen Fällen höher als 1 mmol pro Dosis sein. Dies sollte bei Patienten, die eine strenge Natriumdiät einhalten müssen, berücksichtigt werden.
InteraktionenInteraktionen zwischen Cardiogen-82 und anderen Arzneimitteln wurden nicht untersucht.
In der Regel und in Abhängigkeit von der Indikation, eine Untersuchung der Myokardperfusion durchzuführen, wird empfohlen, die Einnahme von Digitalis oder Arzneimitteln auf Basis von Theophyllin innerhalb der 48 Stunden vor der Untersuchung zu vermeiden. Es wird ausserdem empfohlen, koffeinhaltige Getränke innerhalb der 12 Stunden vor der Untersuchung zu vermeiden, insbesondere bei Verwendung von Xanthinen (z. B. Dipyridamol) zur Erzeugung pharmakologischer Belastung.
Schwangerschaft, StillzeitSchwangerschaft
Das Arzneimittel ist bei schwangeren Frauen kontraindiziert (siehe „Kontraindikationen“).
Es wurde keine Studie mit Rubidium 82Rb bezüglich der Fortpflanzungsfähigkeit bei Tieren durchgeführt. Die Gefährlichkeit von Rubidium 82Rb für den Fötus bei Verabreichung an eine schwangere Frau ist nicht bekannt. Dennoch können alle Radiodiagnostika möglicherweise eine Beeinträchtigung des Fötus je nach Entwicklungsstadium verursachen.
Stillzeit
Die Ausscheidung von Rubidium 82Rb in die Muttermilch ist nicht bekannt. Aufgrund der kurzen Halbwertszeit von Rubidium 82Rb (75 Sekunden) ist es wenig wahrscheinlich, dass sich dieses Produkt in der Muttermilch wiederfindet. Da jedoch zahlreiche aktive Substanzen in der Milch ausgeschieden werden, sind bei der Verabreichung von Rubidium 82Rb an eine stillende Frau Vorsichtsmassnahmen zu treffen. Es ist ausreichend, eine Stillpause von einer Stunde nach der letzten Injektion von Rubidium 82Rb einzulegen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.
Der kardiovaskuläre Zustand des Patienten (in Relation zur Indikation der Untersuchung) und die eventuellen, unerwünschten Wirkungen sind zu berücksichtigen.
Unerwünschte WirkungenEine unbeabsichtigte Bestrahlung durch ionisierende Strahlung aufgrund einer Kontamination durch Strontium kann bei Patienten auftreten, die aus dem Generator Cardiogen-82 gewonnenes 82Rb-Rubidiumchlorid erhalten, wenn die Qualitätskontrolle am klinischen Einsatzort des Generators nicht korrekt durchgeführt wurde. Die Richtlinien bezüglich der Qualitätskontrolle am klinischen Einsatzort des Generators sind streng einzuhalten (siehe „Sonstige Hinweise / Hinweise für die Handhabung“).
Obwohl sehr selten, können allergische Reaktionen nach Verabreichung des Produkts auftreten.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAngesichts der Art des Produkts und seiner Anwendung ist eine klinisch signifikante Überdosierung von Rubidium 82Rb unwahrscheinlich. Um die Verabreichung einer hohen Menge Strontium 82Sr und 85Sr (Breakthrough) zu vermeiden, ist es angebracht, das Anwendungsverfahren streng einzuhalten und die maximale Elutionsgeschwindigkeit von 50 ml/min nicht zu überschreiten.
Eigenschaften/WirkungenATC-Code
V09GX04
Physikalische Eigenschaften
Rubidium 82Rb hat eine Halbwertszeit von 75 Sekunden1 und zerfällt unter Positronenemission sowie der damit verbundenen Emission von Gammastrahlen. Die infolge der Positronenemission ausgesandten Vernichtungsphotonen dienen zum Nachweis und zu Untersuchungen bei bildgebenden Verfahren und sind in Tabelle 2 aufgeführt.
Rubidium 82Rb zerfällt folgendermassen:
-95,5 % durch Positronenemission, die zu einer Vernichtungsstrahlung führt, das heisst zwei Gamma-Strahlungen von 511 keV;
-4,5 % durch Elektronenaufnahme, die im Wesentlichen zu einer Emission von Gamma- Strahlungen von 776,5 keV führt.
-Diese beiden Zerfallarten führen direkt zur Bildung von stabilem Krypton (82Kr)2.
TABELLE 2: Wichtigste Daten zur Strahlenemission
|
Strahlung
|
Durchschnittlicher Prozentsatz pro Zerfall
|
Durchschnittliche Energie (keV)
| |
Vernichtungsphotonen (2)
|
191,01
|
511 (pro Photon)
| |
Gamma-Strahlen
|
13-15
|
776,5
|
1 Table of Isotopes, 7th Edition, M. Letterer and V. Shirley
2 Judge, S et al. Applied radiation and isotopes (1987); vol 38, n°3: 185-90.
Aussendung von Strahlung nach aussen
Die Halbwertsdicke von Blei (Pb) beträgt 0,7 cm. Tabelle 3 zeigt eine Spannbreite von Werten der relativen Abschwächung der durch die Radionuklide ausgesandten Strahlungen. Diese Abschwächung ist das Resultat der Verwendung verschiedener Bleidicken. Bei Verwendung einer Dicke von 7,0 cm werden die ausgesandten Strahlungen beispielsweise um einen Faktor von etwa 1’000 geschwächt.
TABELLE 3: Abschwächung der Strahlungen durch Bleiabschirmung
|
Abschirmungsdicke (Pb, cm)
|
Abschwächungsfaktor
| |
0,7
|
0,5
| |
2,3
|
10-1
| |
4,7
|
10-2
| |
7,0
|
10-3
| |
9,3
|
10-4
|
Strontium 82Sr (Halbwertszeit von 25 Tagen (600 Stunden)) zerfällt zu Rubidium 82Rb. Um den physikalischen Zerfall von Strontium 82Sr zu korrigieren, werden die verbleibenden Teile zu ausgewählten Intervallen nach dem Kalibrationszeitpunkt in Tabelle 4 angegeben.
TABELLE 4: Tabelle zu radioaktivem Zerfall: Halbwertszeit von 82Sr = 25 Tage
|
Tage
|
Verbleibender Teil
|
Tage
|
Verbleibender Teil
|
Tage
|
Verbleibender Teil
| |
0*
|
1,000
|
15
|
0,660
|
30
|
0,435
| |
1
|
0,973
|
16
|
0,642
|
31
|
0,423
| |
2
|
0,946
|
17
|
0,624
|
32
|
0,412
| |
3
|
0,920
|
18
|
0,607
|
33
|
0,401
| |
4
|
0,895
|
19
|
0,591
|
34
|
0,390
| |
5
|
0,871
|
20
|
0,574
|
35
|
0,379
| |
6
|
0,847
|
21
|
0,559
|
36
|
0,369
| |
7
|
0,824
|
22
|
0,543
|
37
|
0,359
| |
8
|
0,801
|
23
|
0,529
|
38
|
0,349
| |
9
|
0,779
|
24
|
0,514
|
39
|
0,339
| |
10
|
0,758
|
25
|
0,500
|
40
|
0,330
| |
11
|
0,737
|
26
|
0,486
|
41
|
0,321
| |
12
|
0,717
|
27
|
0,473
|
42
|
0,312
| |
13
|
0,697
|
28
|
0,460
|
|
| |
14
|
0,678
|
29
|
0,448
|
|
|
* Kalibrationszeitpunkt
Um den physikalischen Zerfall von Rubidium 82Rb zu korrigieren, ist der verbleibende Teil der 82Rb-Rubidiumchlorid-Injektionslösung durch Intervalle von 15 Sekunden und bis zu 300 Sekunden nach dem Kalibrationszeitpunkt in Tabelle 5 angegeben.
TABELLE 5: Tabelle zu radioaktivem Zerfall: Halbwertszeit von 82Rb = 75 Sekunden
|
Sekunden
|
Verbleibender Teil
|
Sekunden
|
Verbleibender Teil
| |
0*
|
1,000
|
165
|
0,218
| |
15
|
0,871
|
180
|
0,190
| |
30
|
0,758
|
195
|
0,165
| |
45
|
0,660
|
210
|
0,144
| |
60
|
0,574
|
225
|
0,125
| |
75
|
0,500
|
240
|
0,109
| |
90
|
0,435
|
255
|
0,095
| |
105
|
0,379
|
270
|
0,083
| |
120
|
0,330
|
285
|
0,072
| |
135
|
0,287
|
300
|
0,063
| |
150
|
0,250
|
|
|
* Zeitraum nach Elution
Wirkungsmechanismus
Rubidium 82Rb ist ein Analog des Kalium-Ions (K+) in seinem biochemischen Verhalten und wird schnell aus dem Blutfluss durch den Myokard entfernt. Rb+ wirkt am Ionenaustausch der Kalium- Natrium Pumpe (Na+/K+) in den Zellmembranen mit. Die interzelluläre Aufnahme von 82Rb erfordert die Aufrechterhaltung des Ionengradienten durch die Zellmembran. Die Extraktion von 82Rb ist im gesunden Myokard erhöht und reflektiert eine intrazelluläre Retention, wohingegen der Tracer von nekrotischem oder infarziertem Gewebe nicht aufgenommen wird. Im Fall einer signifikanten stressbedingten Ischämie wird die Extraktion von Rubidium 82Rb im Bereich des Myokards, abhängig von stenotischen Gefässen, verringert und reflektiert den verringerten Blutfluss und die verringerte Koronarreserve.
Pharmakodynamik
In den Studien am Menschen wurde eine Herzmuskelaktivität innerhalb der ersten Minute nach der peripheren intravenösen Injektion von 82Rb belegt. Liegen Infarkt- oder Ischämiezonen im Myokard vor, können diese innerhalb der zwei bis sieben Minuten nach der Injektion als Bereiche mit geringer Fixierung visualisiert werden.
Bei Patienten mit einer Herzdysfunktion (LVEF < 50 %) ist die Zirkulationszeit verlängert und die myokardiale Extraktion von Rubidium 82Rb kann sich verzögern/verringern (siehe „Dosierung/Anwendung“).
Durch die systemische Zirkulation wird 82Rb beim ersten Durchgang im gesamten Körper verteilt. Folglich wird eine Aufnahme des Tracers auch in anderen Organen mit hohem Blutfluss festgestellt, wie den Nieren, der Leber, der Milz und der Lunge.
Klinische Wirksamkeit
2008 veröffentlichten Nandalur et al eine Metaanalyse zur diagnostischen Leistung von PET beim Nachweis von Erkrankungen der Koronararterie (CAD). Sie bewerteten, auf Grundlage der „Evidence Based Medicine“, die Verwendung von PET bei der Diagnostik von CAD. Dafür untersuchten sie Studien aus den Jahren 1977 bis 2007 unter Verwendung von MEDLINE und EMBASE. Diejenigen Studien wurden berücksichtigt, bei denen PET als diagnostischer Test zum Nachweis von CAD und die Koronarangiographie als Referenzmethode verwendet wurden (Stenose grösser als 50 % des Durchmessers). Die Analyse erfolgte pro Patient und pro Koronarbereich. Neunzehn Studien (1’442 Patienten) erfüllten die Aufnahmekriterien. Bei der Analyse pro Patient zeigte die PET eine Sensibilität von 0,92 (Vertrauensintervall (VI) von 95 %: 0,90-0,94) und eine Spezifität von 0,85 (VI: 0,79-0,90), mit einem positiven Wahrscheinlichkeitsverhältnis (LR+) von 6,2 (VI: 3,3-11,8) und einem negativen Wahrscheinlichkeitsverhältnis (LR-) von 0,11 (VI: 0,08-0,14). Bei der Analyse pro Koronarbereich (n=1.130) zeigte die PET eine Sensibilität von 0,81 (VI: 0,77-0,84) und eine Spezifität von 0,87 (VI: 0,84-0,90), mit einem LR+ von 5,9 (VI: 4,5-7,9) und einem LR- von 0,19 (VI: 0,09-0,38). Die PET wies ausgezeichnete Eigenschaften zur Diagnose von CAD auf, insbesondere bei der Analyse pro Patient. Nandalur et al. (2008) schlussfolgerten, dass die Leistungsfähigkeit der PET mit 82Rb höher schien als die, die in den Metaanalysen für Perfusionsbildgebung mit Tl-201 und Sestamibi berichtet wurde, oder als die der anatomischen Bildgebung mit CT-Angiographie oder Magnetresonanzangiographie. Diese Metaanalyse ist jedoch nur begrenzt aussagekräftig. Zunächst ist die Prävalenz der Erkrankung in dieser Studie hoch (77,4 %), vermutlich bedingt durch die Verzerrung von Auswahl/Überprüfung, die Patienten mit anormalen PET-Scans bei der Durchführung einer invasiven Angiographie begünstigt. Zudem ist die Qualität dieser oftmals vor dem Jahr 2000 durchgeführten Studien generell niedrig (Skala 1-10; durchschnittliche Beurteilung = 5,8; Standardabweichung = 1,7 und zahlreiche Studien enthalten keine vollständigen Angaben pro Patient und pro Koronarbereich.
PharmakokinetikAbsorption
keine Angaben
Distribution
keine Angaben
Metabolismus
keine Angaben
Elimination
Mit einer physikalischen Halbwertszeit von 75 Sekunden wird Rubidium 82Rb sehr schnell durch radioaktiven Zerfall in einen Spurenzustand von 82Kr (stabiles Gas) umgewandelt. Krypton 82Kr wird durch die Lunge passiv ausgestossen. Es ist nicht zu erwarten, dass die Ausscheidung durch Niere oder Leber eine zentrale Rolle bei der Beseitigung von 82Rb spielt, obwohl ein Teil der 82Rb-Dosis vor dem radioaktiven Zerfall im Urin ausgeschieden werden könnte.
Präklinische DatenBei toxikologischen Studien an Mäusen waren bei einer einmaligen intravenösen Injektion von Eluatproben Cardiogen-82 (maximale Dosis) keine Todesfälle zu beobachten (20 ml/kg bei einer Flussrate von 0,1 ml/5s).
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Bei einer Mehrfachverabreichung von 10 ml/kg/Tag über einen Zeitraum von 14 Tagen bei Mäusen und einer Mehrfachverabreichung von 3,0 ml/kg/Tag über einen Zeitraum von 14 Tagen bei Hunden wurde keine Toxizität festgestellt.
82Rb-Rubidiumchlorid ist nicht zur regelmässigen oder Dauerverabreichung bestimmt.
Mutagenität
Es wurden keine Langzeitstudien zur Bewertung des mutagenen Potentials durchgeführt.
Karzinogenität
Es wurden keine Langzeitstudien zur Bewertung des kanzerogenen Potentials durchgeführt.
Reproduktionstoxizität
Es wurden keine Langzeitstudien zur Beurteilung der Wirkung von Rubidium 82Rb auf die Fertilität bei Mann oder Frau durchgeführt.
Sonstige HinweiseInkompatibilitäten
Für die Elution von Rubidium 82Rb darf nur eine 0,9%ige Natriumchloridlösung zu Injektionszwecken verwendet werden, die weder Verunreinigungen noch Zusatzstoffe aufweist. Die Verwendung jeglicher anderen Lösung (insbesondere einer Kalzium enthaltenden Lösung, selbst in Spuren) oder von Zusatzstoffen ist absolut untersagt, da dies zu einem starken Entweichen des Mutternuklids Strontium 82Sr und/oder von Strontium 85Sr und zu einer Überschreitung der Spezifikationen für das Eluat führen könnte, die möglicherweise Auswirkungen auf den Patienten hat.
Haltbarkeit
Das Verfallsdatum ist auf dem Etikett des Generators angegeben.
Die Verwendung des Generators muss unterbrochen werden, wenn eine der folgenden Ablauffristen überschritten ist:
eine Verwendung von 42 Tagen nach Kalibration
ein Gesamtelutionsvolumen von 17 l wurde seit Beginn der Verwendung des Generators in die Säule gegeben
der Gehalt an 82Sr im Eluat liegt bei über 1x10-5 MBq/MBq 82Rb nach Elution.
der Gehalt an 85Sr im Eluat liegt bei über 1x10-4 MBq/MBq 82Rb nach Elution.
Aufgrund der kurzen Halbwertszeit von 82Rb verschwindet praktisch die gesamte Radioaktivität des Eluats innerhalb von 15 Minuten nach der Elution.
Besondere Lagerungshinweise
Der Generator muss bei einer Temperatur zwischen 20 und 25 °C gelagert werden.
Empfang, Transport, Besitz und Handhabung dieses Produkts unterliegen den geltenden Schweizer Strahlenschutz Regelungen über radioaktive Stoffe.
Hinweise für die Handhabung
Schulung der Anwender
Der Anwender muss durch den Vertreiber des Generators geschult werden und eine spezifische Dokumentation erhalten. Bei der Einführung des Produkts in einer nuklearmedizinischen Klinik ist das gesamte betroffene Personal unter Aufsicht des Unternehmens, das die Arzneimittelzulassung besitzt, und des technischen Leiters der Einrichtung zu schulen.
Cardiogen-82 (Rubidium-82-Generator) darf nur mit dem Cardiogen-82-Infusionssystem Modell 510 oder dem Cardiogen-82 Infusionssystem Modell 1701 verwendet werden, welche speziell für die Nutzung mit dem Cardiogen-82 Generator entworfen wurden (siehe „Darreichungsform“).
Die Herstellervorschriften müssen eingehalten und geeignete Massnahmen getroffen werden, um eine Kontamination durch Strontium oder zwischen den Patienten zu vermeiden.
Radionuklidreinheit/Breakthrough-Test
Zu Beginn jedes Tages, an dem der Generator verwendet wird, ist die Kontrolle der Radionuklidreinheit vor Verabreichung an den ersten Patienten zwingend folgendermassen durchzuführen:
Ein erstes Eluat von 50 ml wird unter Einhaltung der entsprechenden Sicherheitsvorschriften verworfen (möglicherweise wird dies automatisch vom Infusionssystem durchgeführt). Nach der Regeneration der Säule (10 min) wird die Qualitätskontrolle (Aktivität von Rubidium 82Rb und Breakthrough-Messung von Strontium 82Sr und 85Sr) sorgfältig und unter Beachtung der unten genannten Richtlinien durchgeführt. Die Testergebnisse sind aufzubewahren.
-Während der Vorbereitung und Handhabung undurchlässige Handschuhe tragen.
-Die gesamten Vorbereitungs- und Elutionsverfahren sind unter aseptischen Bedingungen durchzuführen.
-Zwischen den einzelnen Elutionen mindestens 10 Minuten verstreichen lassen, damit sich das 82Rb regeneriert.
-Ausschliesslich mithilfe einer 0,9%igen Natriumchloridlösung zu Injektionszwecken, die weder Verunreinigungen noch Zusatzstoffe aufweist, eluieren.
Qualitätskontrolle:
ANALYSE DES ANTEILS VON 82Rb UND MESSUNG DES GEHALTS AN 82Sr UND 85Sr
Berechnungsblatt
Es wird empfohlen, die vom Vertreiber in elektronischer Form (Excel-Datei) gelieferten Blätter zur Breakthrough- und Volumenberechnung gemäss der entsprechenden Anleitung zu verwenden. Die Daten sind gegen unbeabsichtigte Änderungen geschützt. Dennoch muss der Anwender bzw. die Anwenderin die im Folgenden beschriebenen Verfahren und Berechnungen im Detail verstanden haben und sich bei seiner bzw. ihrer Schulung versichert haben, dass die Ergebnisse des Tests an mehreren Versuchseluaten gültig sind, bevor er bzw. sie dieses Instrument im Arbeitsalltag einsetzt.
Verfallswerte
Die Verwendung des Generators muss beendet werden, wenn eine der folgenden Ablauffristen überschritten ist:
eine Verwendung von 42 Tagen nach Kalibration
ein Gesamtelutionsvolumen von 17 l wurde seit Beginn der Verwendung des Generators erreicht
der Gehalt an 82Sr im Eluat liegt bei über 1x10-5 MBq/MBq 82Rb nach Elution.
der Gehalt an 85Sr im Eluat liegt bei über 1x10-4 MBq/MBq 82Rb nach Elution.
Zusätzliche Tests
Bei jeder Veränderung des Eluenten NaCl 0,9 % (Anschluss eines neuen Fläschchens) ist ein zusätzlicher Breakthrough-Test durchzuführen.
Ein zusätzlicher Breakthrough-Test ist ebenfalls erforderlich, wenn eine der Alarmgrenzen überschritten wird:
-Ein Gesamtelutionsvolumen von 14 l wurde seit Beginn der Verwendung des Generators in die Säule gegeben;
der Gehalt an 82Sr liegt bei über 2x10-6 MBq/MBq 82Rb nach Elution;
der Gehalt an 85Sr liegt bei über 2x10-5 MBq/MBq 82Rb nach Elution;
Diese zusätzlichen Breakthrough-Tests müssen zu Zeitpunkten durchgeführt werden, die durch das Elutionsvolumen des Tages bestimmt werden. Sie haben stets nach 750 ml zu erfolgen.
-Wurden beispielsweise am klinischen Einsatzort des Generators weniger als 750 ml im Verlauf des Tages aus dem Generator eluiert, ist an diesem Tag kein zusätzlicher Test erforderlich.
-Werden am Tag darauf am klinischen Einsatzort des Generators 1’500 ml aus dem Generator eluiert, müssen dort an diesem Tag drei Tests durchgeführt werden: 1) der erforderliche Routinetest vor der Verabreichung an den ersten Patienten, 2) ein Test bei 750 ml Elution und 3) ein Test bei 1’500 ml Elution.
Sobald eine Alarmgrenze überschritten wird, sind zusätzliche Breakthrough-Tests während der gesamten Lebenszeit des Generators mit Intervallen von 750 ml Eluat gemäss den oben beschriebenen Modalitäten durchzuführen.
Verfahren und Berechnungen
Cardiogen-82 (Rubidium-82-Generator) darf nur mit dem Cardiogen-82-Infusionssystem Modell 510 oder dem Cardiogen-82 Infusionssystem Modell 1701 verwendet werden, welche speziell für die Nutzung mit dem Cardiogen-82 Generator entworfen wurden.
·Bei Verwendung des Cardiogen-82-Infusionssystems Modell 510 ist gemäss Abschnitt “Eluat-Testprotokoll für das Cardiogen-82-Infusionssystem Model 510” vorzugehen.
·Bei Verwendung des Cardiogen-82 Infusionssystems Modell 1701 ist gemäss Abschnitt “Eluat-Testprotokoll für das Cardiogen-82-Infusionssystem Modell 1701” vorzugehen.
Bei der Einrichtung und der intravenösen Infusion der Rubidium-Rb-82-Chlorid-Injektionsdosis(en) ist den Anweisungen in der Bedienungsanleitung des Cardiogen-82 Infusionssystems Modell 510 oder Modell 1701 zu folgen.
Eluat-Testprotokoll für das Cardiogen-82-Infusionssystem Modell 510
Die Bestimmung des Anteils von Rubidium 82Rb und des Gehalts an 82Sr und 85Sr erfolgt mithilfe eines Aktivimeters vom Typ Ionisationskammer.
Folgende Schritte (1 bis 11) sind durchzuführen.
Der Gehalt an 82Rb-Rubidiumchlorid der Injektionslösung wird wie folgt bestimmt:
1.Ein Aktivimeter für 82Rb gemäss Herstellerempfehlung einstellen oder die Einstellungen für 60Co verwenden und den erhaltenen Messwert durch 0,548 dividieren. Den vom Instrument angezeigten Wert in MBq (Megabecquerel) ablesen.
2.Den Generator aseptisch mithilfe von 50 ml 0,9%iger Natriumchloridlösung zu Injektionszwecken, die weder Verunreinigungen noch Zusatzstoffe aufweist, eluieren und das Eluat verwerfen (erste Elution).
3.Mindestens 10 Minuten warten, damit die Regeneration von 82Rb erfolgt. Anschliessend den Generator mithilfe von 50 ml 0,9%iger Natriumchloridlösung zu Injektionszwecken, die weder Verunreinigungen noch Zusatzstoffe aufweist, bei einer Flussrate von 50 ml/min eluieren und das Eluat in einem mit einem Verschluss versehenen Glasfläschchen (keine Plastikbehälter verwenden) auffangen. Die genaue Uhrzeit des Endes des Elutionsverfahrens (EOE) notieren.
4.Mithilfe des Aktivimeters die Aktivität von 82Rb (ARb(t)) bestimmen und die Uhrzeit (t) der Messung notieren. Den abgelesenen Wert nach Ende der Elution mithilfe des verbleibenden, 82Rb entsprechenden Teils (siehe Tabelle 5) korrigieren.
ARb(EOE) = ARb(t) / verbleibender Teil
Beispiel: Erfolgt die Messung 2,5 Minuten nach Ende der Elution, kann die durch den Zerfall bedingte Korrektur erfolgen, indem der durch das Aktivimeter angezeigte Wert durch 0,250 dividiert wird.
Um die Konzentration an 82Sr im Eluat zu messen, wie folgt vorgehen:
5.Wird mit der Probe gearbeitet, die für die Bestimmung der Aktivität von 82Rb verwendet wurde, muss diese mindestens eine Stunde lang ruhen, um den vollständigen Zerfall von 82Rb zu ermöglichen.
6.Die Aktivität der Probe (A decay) mithilfe eines Aktivimeters messen, der gemäss den Herstellerempfehlungen für 82Rb und/oder 82Sr eingestellt wurde. Alternativ: Die für 60Co empfohlenen Einstellungen verwenden und den erhaltenen Messwert durch 0,548 dividieren. Den durch das Instrument angezeigten Wert in MBq (Megabecquerel) ablesen.
7.Auf dem Etikett des Generators das 85Sr/82Sr-Verhältnis zum Kalibrationszeitpunkt ablesen. In Tabelle 6 den Korrekturfaktor des 85Sr/82Sr-Verhältnisses für den Verwendungstag nach Kalibration ablesen.
Das Verhältnis R mithilfe folgender Formel berechnen:
R= [85Sr] / [82Sr] zum Kalibrationszeitpunkt x Korrekturfaktor zum Messzeitpunkt
8.Korrekturfaktor (F) 0,478 anwenden, um den Beitrag von 85Sr auf den Messwert auszugleichen.
9.Den Gehalt an 82Sr in der Probe mithilfe folgender Gleichung berechnen:
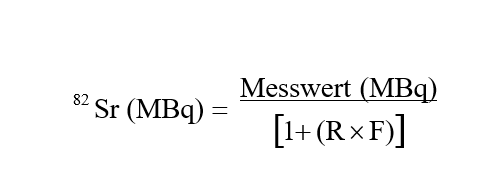
Beispiel:
Am Aktivimeter gemessener Wert (MBq) (= Messwert) = 2,96 x 10-2
Verhältnis 85Sr/82Sr am Kalibrationstag: 1,0172
Verwendungstag nach Kalibrationstag: 22
Korrekturfaktor bei 22 Tagen nach Tabelle 6: 1,46
R = 1,0172 x 1,46 = 1,48
Korrekturfaktor (F) = 0,478
82Sr (MBq) = 2,96 x 10-2 / [1+(1,48) x (0,478)]
82Sr (MBq) = 1,734 x 10-2
10.Den Gehalt an 82Sr durch Division der MBq 82Sr durch die MBq 82Rb nach Ende der Elution bestimmen.
Beispiel:
1,734 x10-2 MBq 82Sr
1’850 MBq 82Rb nach Elution
(1,734 x 10-2 MBq 82Sr)/ (1’850 MBq 82Rb) = 9,4 x 10-6 MBq/MBq 82Rb
In diesem Beispiel liegt der 82Sr-Gehalt über der Alarmgrenze von 2x10-6 MBq/MBq 82Rb. Folglich ist ein zusätzlicher Breakthrough-Test durchzuführen.
11.Den Gehalt an 85Sr durch Multiplikation des Ergebnisses aus Schritt 10 und dem Verhältnis (R) von 85Sr zu 82Sr bestimmen.
Beispiel:
9,4 x 10-6 x 1,48 = 1,4 x 10-5 MBq 85Sr/MBq 82Rb
In diesem Beispiel liegt der 85Sr-Gehalt unter der Alarmgrenze von 2x10-5 MBq/MBq 82Rb.
TABELLE 6: Verhältnis 85Sr/82Sr
|
Tage
|
Korrekturfaktor
|
Tage
|
Korrekturfaktor
| |
0*
|
1,00
|
22
|
1,46
| |
1
|
1,02
|
23
|
1,48
| |
2
|
1,03
|
24
|
1,51
| |
3
|
1,05
|
25
|
1,53
| |
4
|
1,07
|
26
|
1,56
| |
5
|
1,09
|
27
|
1,59
| |
6
|
1,11
|
28
|
1,61
| |
7
|
1,13
|
29
|
1,64
| |
8
|
1,15
|
30
|
1,67
| |
9
|
1,17
|
31
|
1,70
| |
10
|
1,19
|
32
|
1,73
| |
11
|
1,21
|
33
|
1,76
| |
12
|
1,23
|
34
|
1,79
| |
13
|
1,25
|
35
|
1,82
| |
14
|
1,27
|
36
|
1,85
| |
15
|
1,29
|
37
|
1,88
| |
16
|
1,31
|
38
|
1,91
| |
17
|
1,34
|
39
|
1,95
| |
18
|
1,36
|
40
|
1,98
| |
19
|
1,38
|
41
|
2,01
| |
20
|
1,41
|
42
|
2,05
| |
21
|
1,43
|
|
|
* Kalibrationstag
Eluat-Testprotokoll für das Cardiogen-82 Infusionssystem Modell 1701
Der 82Rb-Rubidiumchlorid-Gehalt der injizierbaren Lösung wird wie folgt bestimmt:
1.Ein Aktivimeter für 82Rb gemäss den Empfehlungen des Herstellers einstellen. Den Messwert des Geräts in Megabecquerel anzeigen lassen.
2.Den Anweisungen in der grafischen Benutzeroberfläche (GUI) für das Cardiogen-82-Infusionssystem Modell 1701 folgen, um den Generator mit einer 0,9%igen Natriumchloridlösung zu Injektionszwecken, die weder Verunreinigungen noch Zusatzstoffe aufweist, mit einer Geschwindigkeit von 50 ml/min zu eluieren. Das Eluat in den speziell für das Cardiogen-82-Infusionssystem Modell 1701 vorgesehenen mit einem Verschluss versehenen Durchstechflaschen auffangen (andere Durchstechflaschen aus Glas oder Kunststoff sind nicht geeignet). Den genauen Endzeitpunkt der Elution (EOE) notieren.
3.Mithilfe des externen Aktivimeters das Eluat genau 2:30, 3:45 oder 5:00 Minuten nach EOE testen.
4.Den Anweisungen in der GUI des Cardiogen-82-Infusionssystems Modell 1701 folgen und den 82Rb-Messwert des Aktivimeters sowie die Zeit seit EOE eingeben.
5.Die Software des Infusionssystems berechnet automatisch das Kalibrierverhältnis.
·Wenn das Verhältnis innerhalb von +/- 2 % (0,98 bis 1,02) liegt, kann das Infusionssystem den für die Elution verwendeten Kalibrierungsfaktor akzeptieren.
·Wenn das Verhältnis nicht innerhalb von +/- 2 % (0,98 bis 1,02) liegt, verlangt das System eine weitere Kalibrierungselution (Schritte 1 bis 4).
6.Die Schritte 1 bis 4 für eine Flussrate von 20 ml/min wiederholen.
Alle 14 Tage ist eine weitere Systemkalibrierung durchzuführen.
Um die Konzentration von 82Sr im Eluat zu messen, ist wie folgt vorzugehen:
Jeden Tag ist vor der Verabreichung der 82Rb-Rubidiumchlorid-Injektion der folgende Test durchzuführen, einschliesslich des obligatorischen Eluattests:
1.Die speziell für das Cardiogen-82-Infusionssystem Modell 1701 bestimmte mit einem Verschluss versehene Durchstechflasche (andere Durchstechflaschen aus Glas oder Kunststoff sind nicht geeignet) in die Sr-Detektor-Vertiefung des Cardiogen-82-Infusionssystems Modell 1701 stellen. Den Anweisungen auf der Benutzeroberfläche des Infusionssystems (GUI) zum Starten der täglichen Qualitätskontrolle folgen.
2.Das Infusionssystem führt automatisch die Hintergrundmessung des Sr-Detektors durch.
3.Das Infusionssystem führt automatisch die Säulenspülung des Generators durch.
4.Prüfung der Strontiumkonzentration und Dosiskonstanz:
a.Das Infusionssystem eluiert den Generator mit 50 ml 0,9%iger Natriumchloridlösung zu Injektionszwecken, die weder Verunreinigungen noch Zusatzstoffe aufweist, mit einer Geschwindigkeit von 50 ml/min in die mit einem Verschluss versehene Durchstechflasche (die speziell für die Verwendung mit dem Cardiogen-82-Infusionssystem Modell 1701 vorgesehen ist).
b.Der Sr-Detektor misst das 82Rb und Strontium in der 50-ml-Elution.
c.Die Software des Infusionssystems berechnet automatisch die 82Sr- und 85Sr-Konzentrationen am Tag der Messung (nach der Kalibrierung). Dazu werden das auf dem Etikett des Generators angegebene Verhältnis von 85Sr/82Sr am Tag der Kalibrierung sowie die Berechnung des vollständigen exponentiellen Zerfalls für beide unter Berücksichtigung des Alters des Generators verwendet.
d.Mithilfe der 82Rb- und Strontium-Messungen berechnet die Software des Infusionssystems automatisch MBq 82Sr/MBq 82Rb und MBq 85Sr/MBq 82Rb. Die GUI zeigt automatisch an, wenn die Ergebnisse die Alarm- oder Verfallsgrenzen überschreiten.
e.Die Software des Infusionssystems berechnet automatisch die Dosiskonstanz.
5.Konstanzprüfung des Sr-Detektors: Die GUI des Infusionssystems fordert den Benutzer auf, die Konstanzprüfung des Sr-Detektors durchzuführen.
a.Legen Sie die externe Konstanzquelle in die Detektor-Vertiefung des Infusionssystems.
b.Die Software des Infusionssystems berechnet auf Anweisung automatisch die Konstanz des Sr-Detektors gegenüber der externen Konstanzquelle.
Hinweis zur Entsorgung
Der Generator muss als radioaktives Material an den Hersteller zurückgegeben werden.
Zulassungsnummer62332 (Swissmedic)
PackungenCardiogen-82 (Rubidium-82-Generator) wird in Form von Strontium 82Sr geliefert, adsorbiert an einer mit einer Bleiabschirmung versehenen Zinn(IV)oxid-Säule, mit einer Aktivität von 3,3-5,6 GBq 82Sr zum Kalibrationszeitpunkt. Der Generator befindet sich in einem etikettierten Kunststoffbehälter, dessen Innenseite mit Blei beschichtet ist.
Die Richtlinien zur Bestimmung der Aktivität des durch den Generator erzeugten Eluats Rubidium 82Rb und des Strontium-Breakthrough sind unter „Sonstige Hinweise“/„Qualitätskontrolle“ beschrieben. Cardiogen-82 (Rubidium-82-Generator) darf nur mit dem Cardiogen-82-Infusionssystem Modell 510 oder dem Cardiogen-82 Infusionssystem Modell 1701 verwendet werden, welche speziell für die Nutzung mit dem Cardiogen-82 Generator entworfen wurden.
Funktionsprinzip
Mithilfe einer Spritzenpumpe wird die sterile 0,9%ige NaCl-Lösung durch den Generator geleitet. Das aus dem Generator gewonnene Eluat enthält das Rubidium82Rb. Erreicht die durch einen Positronendetektor gemessene Aktivität dieses Eluats einen ausreichenden Wert, lenkt das Ventil das Eluat über die Injektionsleitung zum Patienten. Der Wert der erwünschten Aktivität und damit auch der injizierten Dosis wird mithilfe eines elektronischen Systems vorgegeben.
Abgabekategorie A.
ZulassungsinhaberinBracco Suisse SA, Cadempino
Stand der InformationJuli 2023
|