ZusammensetzungWirkstoffe
Empagliflozin, Metforminhydrochlorid.
Hilfsstoffe
Jardiance Met 5 mg/500mg, Jardiance Met 5 mg/850mg, Jardiance Met 5 mg/1000mg:
-Tablettenkern: Maisstärke, Copovidon, Hochdisperses Siliciumdioxid, Magnesiumstearat
-Tablettenüberzug: Hypromellose 2910, Macrogol 400, Titandioxid (E171), Talkum, Eisenoxid gelb (E172)
Jardiance Met 12,5 mg/500mg, Jardiance Met 12,5 mg/850mg, Jardiance Met 12,5 mg/1000mg:
-Tablettenkern: Maisstärke, Copovidon, Hochdisperses Siliciumdioxid, Magnesiumstearat
-Tablettenüberzug: Hypromellose 2910, Macrogol 400, Titandioxid (E171), Talkum, Eisenoxid schwarz (E172), Eisenoxid rot (E172)
Darreichungsform und Wirkstoffmenge pro EinheitFilmtabletten zu
5 mg Empagliflozin und 500 mg Metforminhydrochlorid oder
5 mg Empagliflozin und 850 mg Metforminhydrochlorid oder
5 mg Empagliflozin und 1000 mg Metforminhydrochlorid.
12,5 mg Empagliflozin und 500 mg Metforminhydrochlorid oder
12,5 mg Empagliflozin und 850 mg Metforminhydrochlorid oder
12,5 mg Empagliflozin und 1000 mg Metforminhydrochlorid.
Indikationen/AnwendungsmöglichkeitenJardiance Met ist zusätzlich zu Diät und körperlicher Aktivität zur Behandlung des Typ 2 Diabetes mellitus bei Erwachsenen sowie Kindern und Jugendlichen ab einem Alter von 10 Jahren indiziert, wenn diese:
mit der maximal tolerierten bzw. empfohlenen Dosis Metformin, entweder als Monotherapie oder in Kombination mit weiteren blutzuckersenkenden Arzneimitteln (siehe Abschnitt "Klinische Wirksamkeit" ) keine adäquate Blutzuckerkontrolle erzielen;
bereits mit Empagliflozin und Metformin als separate Tabletten behandelt werden.
Prävention kardiovaskulärer Ereignisse bei erwachsenen Patienten mit Typ 2 Diabetes mellitus und bereits manifester kardiovaskulärer Erkrankung (siehe Abschnitt "Klinische Wirksamkeit" ).
Dosierung/AnwendungErwachsene:
Die empfohlene Dosis ist basierend auf der derzeitigen Therapie, der Wirksamkeit und der Verträglichkeit für den jeweiligen Patienten individuell festzulegen. Die empfohlenen Tageshöchstdosen von 25 mg Empagliflozin und 2000 mg Metformin dürfen jedoch nicht überschritten werden.
-Die Behandlung mit Empagliflozin zusätzlich zur bisherigen Therapie soll mit Jardiance Met 5 mg Empagliflozin zweimal täglich (Tagesdosis 10 mg) begonnen werden. Die Metformin-Dosis soll in etwa der Dosis unter der vorherigen Therapie entsprechen. Wird mit der Dosis Jardiance Met 5 mg Empagliflozin zweimal täglich keine zufriedenstellende glykämische Kontrolle erzielt, kann die Dosis bei Patienten, die eine höhere Dosis Empagliflozin gut vertragen, auf Jardiance Met 12.5 mg Empagliflozin zweimal täglich (Tagesdosis 25 mg) erhöht werden.
-Bei Patienten, die von separaten Empagliflozin und Metformin Tabletten auf Jardiance Met umgestellt werden, sollte die Tagesdosis von Empagliflozin und Metformin der bisherigen Dosis oder der therapeutisch geeigneten Dosis Metformin, die dieser am nächsten kommt, entsprechen.
Für die verschiedenen Metformin-Dosen ist Jardiance Met in Stärken von 5 mg Empagliflozin plus 500 mg, 850 mg oder 1000 mg Metforminhydrochlorid oder 12,5 mg Empagliflozin plus 500 mg, 850 mg oder 1000 mg Metforminhydrochlorid erhältlich.
Jardiance Met sollte zu einer Mahlzeit eingenommen werden, um gastrointestinale Nebenwirkungen im Zusammenhang mit Metformin zu reduzieren.
Kinder und Jugendliche:
Die empfohlene Anfangsdosis für Empagliflozin beträgt 5 mg zweimal täglich (Tagesdosis 10 mg). Diese kann bei guter Verträglichkeit auf 12,5 mg zweimal täglich (Tagesdosis 25 mg) erhöht werden, wenn eine bessere Blutzuckerkontrolle benötigt (siehe auch allgemeine Informationen unter "Patienten mit Nierenfunktionsstörungen" ). In der DINAMO Studie (siehe Abschnitt "Klinische Wirksamkeit" ) wurden die Tagesdosen von 10 mg und 25 mg Empagliflozin verabreicht.
Die maximale empfohlene Tagesdosis Jardiance Met beträgt 25 mg Empagliflozin und 2000 mg Metformin.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Es liegen nur sehr begrenzte Erfahrungen vor zur Verabreichung von Empagliflozin bei Patienten mit schwerer Leberfunktionsstörung oder mit deutlicher (mehr als dreifacher) Erhöhung der Transaminasen. Die Anwendung von Empagliflozin bei diesen Patienten wird nicht empfohlen.
Patienten mit Nierenfunktionsstörungen
Vor Beginn der Behandlung und danach mindestens einmal jährlich sollte die eGFR ermittelt werden. Bei Patienten mit erhöhtem Risiko einer weiteren Progression der Nierenfunktionsstörung und bei älteren Patienten sollte die Nierenfunktion häufiger, z.B. alle 3-6 Monate, kontrolliert werden.
Bevor die Einleitung einer Behandlung mit Metformin bei Patienten mit einer eGFR < 60 ml/min/1,73m2 erwogen wird, sollten Faktoren, die das Risiko einer Laktatazidose erhöhen können (siehe "Warnhinweise und Vorsichtsmassnahmen" ), überprüft werden.
Tabelle 1: Dosierung bei Patienten mit Nierenfunktionsstörung
eGFR ml/min/1,73m2 Metformin Empagliflozin
60 - 89 Eine Dosisreduktion kann in Abhängigkeit von Keine Dosisanpassung Die
der Abnahme der Nierenfunktion in Betracht maximale Tagesdosis bei
gezogen werden. Die maximale Tagesdosis bei Erwachsenen sowie Kindern
Erwachsenen beträgt 3000 mg* Die maximale und Jugendlichen beträgt 25
Tagesdosis bei Kindern und Jugendlichen beträgt mg.
2000 mg**
45 – 59** Die Anfangsdosis beträgt 500 mg oder 850 mg pro Keine Dosisanpassung
Tag. Die maximale Tagesdosis beträgt 1000 mg
aufgeteilt auf 2 Einzeldosen.
30 – 44** Die Anfangsdosis beträgt 500 mg oder 850 mg pro Empagliflozin wird nicht
Tag. Die maximale Tagesdosis beträgt 1000 mg empfohlen.
aufgeteilt auf 2 Einzeldosen.
< 30** Metformin ist kontraindiziert Empagliflozin wird nicht
empfohlen.
* Falls keine angemessene Stärke von Jardiance Met erhältlich ist, sollten statt der Fixdosiskombination die Einzelsubstanzen angewendet werden.
** Für Kinder mit einer eGFR <60 ml/min/1,73 m² und Kinder unter 10 Jahren liegen keine Daten vor.
Ältere Patienten
Da bei älteren Patienten die Nierenfunktion eingeschränkt sein kann, sollte die Dosis von Metformin vorsichtig unter Berücksichtigung der Nierenfunktionsparameter angepasst werden. Eine regelmässige Überprüfung der Nierenfunktion ist notwendig (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Kinder und Jugendliche
Daten zur Wirksamkeit und Sicherheit von Empagliflozin in Kombination mit Metformin liegen nur für die Altersgruppe von 10 - 17 Jahren (ausgenommen solche mit einer eGFR < 60 ml/min/1,73 m²) und ausschliesslich für die Indikation "Behandlung des Typ 2 Diabetes mellitus" vor. Jardiance Met ist nicht zur Behandlung von Kindern unter 10 Jahren zugelassen, für die keine Daten vorliegen. Die Anwendung von Jardiance Met bei Kindern und Jugendlichen mit einer eGFR < 60 ml/min/1,73 m² wird nicht empfohlen, da die Wirksamkeit und Sicherheit in diesen Patienten nicht untersucht wurden.
Kombinationstherapie mit Sulfonylharnstoff und/oder Insulin
Wenn Jardiance Met in Kombination mit einem Sulfonylharnstoff und/oder Insulin angewendet wird, könnte es erforderlich sein, die Sulfonylharnstoff- und/oder Insulindosis zu reduzieren, um das Hypoglykämierisiko zu senken (siehe Abschnitte "Interaktionen" und "Unerwünschte Wirkungen" )
Versäumte Dosis
Wenn die Einnahme einer Dosis versäumt wurde, sollte sie nachgeholt werden, sobald der Patient sich daran erinnert. Allerdings sollte keine doppelte Dosis zur selben Zeit eingenommen werden. In einem solchen Fall ist die versäumte Dosis auszulassen.
Vorübergehende Unterbrechung bei Operationen
Jardiance Met sollte wenn möglich mindestens 3 Tage vor grösseren Operationen oder Eingriffen, die mit längerem Fasten verbunden sind, abgesetzt werden. Die Einnahme von Jardiance Met kann wieder aufgenommen werden, wenn der Patient klinisch stabil ist und orale Nahrung zu sich nimmt (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Kontraindikationen-Überempfindlichkeit gegenüber den Wirkstoffen Empagliflozin und/oder Metformin oder einem der Hilfsstoffe gemäss Zusammensetzung
-Jede Art von akuter metabolischer Azidose (z.B. Laktatazidose oder diabetische Ketoazidose)
-Diabetisches Koma und Präkoma
-Schwere Niereninsuffizienz (eGFR <30ml/min/1,73m2 oder Kreatinin-Clearance <30ml/min)
-Akute Erkrankungen, die die Nierenfunktion beeinträchtigen können, wie Dehydratation (Diarrhöe, wiederholtes Erbrechen), schwere Infektionen, z.B. der Harnwege, hohes Fieber, schwere hypoxische Zustände (Schock, Septikämie), intravaskuläre Applikation jodhaltiger Kontrastmittel (siehe Abschnitt "Warnhinweise und Vorsichtsmassnahmen" )
-Krankheiten (speziell akute Erkrankungen oder die Verschlimmerung einer chronischen Erkrankung), welche eine Gewebshypoxie verursachen können, wie z.B. dekompensierte Herzinsuffizienz, respiratorische Insuffizienz, kürzlich zurückliegender Myokardinfarkt, Sepsis oder Schock. In diesen Situationen ist das Risiko für die Entwicklung einer Laktatazidose erhöht.
-Leberinsuffizienz
akute Alkoholintoxikation, Alkoholismus
Warnhinweise und VorsichtsmassnahmenJardiance Met sollte nicht bei Patienten mit Typ 1 Diabetes mellitus eingesetzt werden.
Diabetische Ketoazidose
Fälle von diabetischer Ketoazidose (DKA), einer schwerwiegenden, lebensbedrohlichen Stoffwechselstörung, die eine sofortige Hospitalisierung erfordert, wurden bei mit Empagliflozin behandelten Patienten berichtet, darunter auch tödlich verlaufende Fälle. Bei einigen der berichteten Fälle stellte sich die Krankheit atypisch mit nur mässig erhöhten Blutzuckerwerten unter 14 mmol/l (250 mg/dl) dar.
Das Risiko einer diabetischen Ketoazidose (DKA) muss im Falle von unspezifischen Symptomen wie Übelkeit, Erbrechen, Appetitlosigkeit, Bauchschmerzen, übermässigem Durst, Atemschwierigkeiten, Verwirrtheit, ungewöhnlicher Erschöpfung oder Müdigkeit bei mit Empagliflozin-behandelten Patienten mit Diabetes in Betracht gezogen werden.
Wenn diese Symptome auftreten, sollte bei diesen Patienten unabhängig vom Blutzuckerspiegel umgehend ein Test auf Ketonkörper durchgeführt werden. Bei Verdacht auf Ketoazidose sollte Jardiance Met abgesetzt, der Zustand des Patienten beurteilt und eine sofortige Behandlung eingeleitet werden. Die diabetische Ketoazidose kann bei einigen Patienten nach Absetzen von Jardiance Met länger andauern, d.h. sie kann länger andauern als aufgrund der Plasmahalbwertszeit von Empagliflozin zu erwarten ist. Es wurde eine prolongierte Glukosurie zusammen mit einer anhaltenden DKA beobachtet. Die Urin-Glukoseausscheidung hält bis zu 3 Tage nach dem Absetzen von Jardiance Met an; es gibt jedoch Post-Marketing-Berichte über DKA und Glukosurie, die länger als 6 Tage und teilweise bis zu 2 Wochen nach dem Absetzen von SGLT2-Hemmern andauern.
Ein höheres Risiko einer Ketoazidose während der Einnahme von Jardiance Met könnte für Patienten bestehen, die sich sehr kohlenhydratarm ernähren (da die Kombination die Produktion von Ketonkörpern weiter erhöhen könnte), für Patienten mit einer akuten Erkrankung, bei Pankreaserkrankungen, die auf einen Insulinmangel hinweisen (z.B. Typ 1 Diabetes mellitus, Pankreatitis oder Pankreasoperation in der Anamnese), bei Reduzierung der Insulindosis (einschliesslich Versagen der Insulinpumpe), bei Alkoholmissbrauch, bei starker Dehydratation und für Patienten, die bereits in der Vergangenheit eine Ketoazidose hatten. Jardiance Met sollte bei diesen Patienten mit Vorsicht angewendet werden. Vorsicht ist geboten bei der Reduzierung der Insulindosis [siehe "Dosierung/Anwendung" ]. In klinischen Situationen, die bekanntermassen für eine Ketoazidose prädisponieren (z.B. längeres Fasten aufgrund einer akuten Erkrankung, Eingriffen oder Operation) ist eine Überwachung auf Ketoazidose angezeigt und die Behandlung mit Jardiance Met sollte vorübergehend abgesetzt werden. In diesen Situationen ist ferner eine Überwachung der Ketonkörperkonzentration in Betracht zu ziehen, auch wenn die Behandlung mit Jardiance Met unterbrochen wurde. Die Behandlung mit Jardiance Met kann fortgesetzt werden, wenn der Patient klinisch stabil ist und orale Nahrung zu sich nimmt (siehe "Dosierung/Anwendung" ).
Laktatazidose
Laktatazidose ist eine sehr seltene, aber schwerwiegende metabolische Komplikation. Risikofaktoren sind unter anderem schlecht kontrollierter Diabetes, Ketose, längeres Fasten, exzessiver Alkoholkonsum, schwere Infektionen, Sepsis, Leberinsuffizienz und alle Situationen, die mit Hypoxie einhergehen, z.B. bei dekompensierter Herzinsuffizienz, kardiorespiratorischen Erkrankungen oder bei akutem Herzinfarkt. Vorsicht ist auch erforderlich bei der Kombination von Jardiance Met mit Arzneimitteln, die eine Laktatazidose verursachen können, wie z.B. Nukleosidische Reverse-Transkriptase-Inhibitoren.
Das Risiko einer Laktatazidose steigt mit dem Grad der renalen Dysfunktion und dem Alter des Patienten. Bei Behandlung mit Jardiance Met muss die renale Funktion regelmässig überprüft werden. Insbesondere bei älteren Patienten ist eine sorgfältige Überwachung erforderlich.
Eine Laktatazidose kann als Folge einer Metforminakkumulation auftreten. In den meisten der bisher bekannten Fälle von Laktatazidose unter Metformin litten die betroffenen Patienten an einem akuten Nierenversagen oder an einer akuten Verschlechterung der Nierenfunktion. Besondere Vorsicht ist daher in Situationen geboten, in denen sich die Nierenfunktion akut verschlechtern kann, wie z.B. bei Dehydratation (schwerer Durchfall, Fieber oder wiederholtes Erbrechen), Beginn einer Behandlung mit ACE-Hemmern und Angiotensin-II-Rezeptorantagonisten, Diuretika, insbesondere Schleifendiuretika oder nicht-steroidalen Antirheumatika einschliesslich selektiver Cyclooxygenase(COX)-2-Hemmer. Bei Verdacht auf eine Laktatazidose muss der Patient unverzüglich hospitalisiert werden. Am effektivsten werden sowohl Laktat als auch Metformin durch Hämodialyse eliminiert (vgl. "Überdosierung" ). Die Patienten sollten darauf hingewiesen werden, exzessiven Alkoholkonsum, akut oder chronisch, zu vermeiden, da Alkohol den Effekt von Metformin auf den Laktatmetabolismus potenziert.
Der Arzt muss den Patienten und/oder ihren Betreuern über das Risiko und die Symptome einer Laktatazidose informieren. Zudem sollten die Patienten angewiesen werden, Jardiance Met sofort bei diesen Verdachtssymptomen abzusetzen und unverzüglich ärztliche Hilfe zu suchen. Bis zur Klärung der Situation bleibt die Behandlung mit Jardiance Met unterbrochen. Bevor eine Wiederaufnahme der Behandlung mit Jardiance Met in Betracht gezogen wird, sollten das individuelle Nutzen-Risiko-Verhältnis sowie die renale Funktion abgeklärt werden.
Diagnose
Folgende unspezifische Symptome können ein Zeichen einer Laktatazidose sein: Muskelkrämpfe, gastrointestinale Störungen wie Bauchschmerzen und schwere Asthenie.
Laktatazidose ist durch azidotische Dyspnoe, Abdominalschmerzen, Hypothermie gefolgt von Koma charakterisiert. Anhand folgender Laborparameter kann die Symptomatik erkannt werden: erniedrigter Blut-pH-Wert (<7.35), erhöhte Plasmalaktatspiegel >5 mmol/l, vergrösserte Anionenlücke sowie ein erhöhtes Laktat/Pyruvat-Verhältnis.
Patienten mit bekannter oder vermuteter mitochondrialer Erkrankung
Bei Patienten mit bekannter mitochondrialer Erkrankung wie Mitochondrialer Enzephalomyopathie mit Laktatazidose und schlaganfallähnlichen Episoden (MELAS-Syndrom) und maternal vererbter Diabetes mit Hörverlust (MIDD) wird die Anwendung von Metformin nicht empfohlen, da das Risiko einer Exazerbation der Laktatazidose und neurologischer Komplikationen besteht, was zu einer Verschlechterung der Krankheit führen könnte.
Treten nach der Einnahme von Metformin Anzeichen und Symptome auf, die auf MELAS-Syndrom oder MIDD hindeuten, ist die Behandlung mit Jardiance Met unverzüglich abzusetzen und eine sofortige diagnostische Untersuchung einzuleiten.
Nekrotisierende Fasziitis des Perineums (Fournier-Gangrän)
Bei weiblichen und männlichen Patienten, die mit SGLT2-Hemmern – darunter auch Empagliflozin - behandelt wurden, wurden Fälle von nekrotisierender Fasziitis des Perineums, auch als "Fournier-Gangrän" bezeichnet, berichtet. Dabei handelt es sich um eine seltene, aber schwerwiegende und lebensbedrohliche nekrotisierende Infektion. Zu den schwerwiegenden Folgen zählten Krankenhausaufenthalte, mehrfache Operationen und Tod.
Patienten, die mit Jardiance Met behandelt werden und sich mit Schmerzen oder Druckempfindlichkeit, Erythemen, Schwellungen im Genital- oder Perinealbereich, Fieber oder Unwohlsein melden, sind auf nekrotisierende Fasziitis hin zu untersuchen. Wenn Verdacht auf nekrotisierende Fasziitis besteht, ist Jardiance Met abzusetzen und umgehend eine Behandlung (u.a. mit Breitspektrumantibiotika und ggf. chirurgischer Wundausschneidung) einzuleiten.
Nierenfunktion
Aufgrund des Wirkmechanismus ist die Wirksamkeit von Empagliflozin von der renalen Funktion abhängig.
Die eGFR sollte vor Beginn der Behandlung und danach in regelmässigen Abständen ermittelt werden (siehe "Spezielle Dosierungsanweisungen" ). Jardiance Met wird bei Patienten mit einer eGFR < 45 ml/min/1,73m2 nicht empfohlen und ist bei Patienten mit einer eGFR < 30 ml/min/1,73m2 kontraindiziert. Intensive Kontrollen sind bei jeder klinischen Situation indiziert, in der mit einer raschen Verschlechterung der Nierenfunktion zu rechnen ist.
Besondere Vorsicht ist in Fällen angezeigt, bei denen sich die Nierenfunktion durch zugrundeliegende prädisponierende Faktoren oder allfällig verwendete Begleitmedikation verschlechtern könnte (z.B. bei älteren Patienten, bei Dehydrierung, zu Beginn einer Therapie mit Diuretika, Antihypertensiva oder nicht-steroidalen Antirheumatika). In diesen Fällen wird ebenfalls empfohlen, die Nierenfunktion vor Behandlungsbeginn zu überprüfen und danach in regelmässigen Abständen. Gegebenenfalls ist ein vorübergehendes Absetzen von Jardiance Met zu erwägen.
Kardiale Funktion
Patienten mit Herzinsuffizienz haben ein höheres Risiko für Hypoxie und Niereninsuffizienz. In Patienten mit stabiler chronischer Herzinsuffizienz kann eine Therapie mit Jardiance Met erfolgen, wobei die kardiale und renale Funktion regelmässig überprüft werden sollen.
Bei Patienten mit akuter und dekompensierter Herzinsuffizienz ist Jardiance Met kontraindiziert (siehe Kontraindikationen).
Ältere Patienten
Bei älteren Patienten (≥75 Jahre) besteht möglicherweise ein erhöhtes Risiko für Volumenmangel. Daher sollte die Verschreibung von Jardiance Met in dieser Patientengruppe mit Vorsicht erfolgen (siehe "Unerwünschte Wirkungen" ).
Volumenmangel
Empagliflozin führt auf Grund der osmotischen Diurese zu einer leichten Absenkung des Blutdrucks (systolisch mehr als diastolisch) und kann eine orthostatische Hypotonie auslösen, was zu unerwünschten Wirkungen wie Schwindel, Synkopen oder Stürzen führen kann. Besondere Vorsicht ist geboten bei Patienten mit bekannter orthostatischer Hypotonie, Patienten unter antihypertensiver Therapie, älteren Patienten sowie Patienten mit bekannter kardiovaskulärer und/oder cerebrovaskulärer Erkrankung.
Erfahrungsgemäss kommt es zu einem Anstieg des Hämatokrits von rund 2%.
Bei Erkrankungen, die zu Flüssigkeitsverlust führen können (z.B. Magen-Darm-Erkrankungen), wird bei Patienten, welche Empagliflozin erhalten, eine sorgfältige Überwachung des Volumenstatus und der Elektrolyte empfohlen. Eine vorübergehende Unterbrechung der Behandlung mit Jardiance Met sollte erwogen werden, bis der Flüssigkeitsverlust korrigiert ist.
Harnwegsinfekte
Die Behandlung mit Empagliflozin erhöht das Risiko von Harnwegsinfekten. Betroffen sind häufig Patienten mit anamnestisch bekannten chronischen oder rezidivierenden Harnwegsinfekten und weiblichen Patienten. Nach Markteinführung wurden bei Patienten, die mit Empagliflozin behandelt wurden, Fälle von komplizierten Harnwegsinfektionen einschliesslich Pyelonephritis und Urosepsis berichtet. Der behandelnde Arzt sollte auf mögliche Anzeichen einer Harnwegsinfektion achten und sofort eine Behandlung einleiten. Bei Patienten mit komplizierten Harnwegsinfekten (z.B. Pyelonephritis oder Urosepsis) ist eine vorübergehende Unterbrechung der Behandlung zu erwägen.
Amputationen der unteren Gliedmassen
Eine erhöhte Anzahl von Amputationen der unteren Gliedmassen (in erster Linie von Zehen) sind in klinischen Langzeitstudien mit einem anderen SGLT-2-Inhibitor beobachtet worden. Ob es sich hierbei um einen Klasseneffekt handelt, ist nicht bekannt. Wie bei allen Diabetes-Patienten üblich, ist es wichtig, die Patienten hinsichtlich der regelmässigen präventiven Fusspflege zu beraten.
Anwendung von jodhaltigen Kontrastmitteln
Die intravaskuläre Applikation von iodhaltigen Kontrastmitteln für Röntgenuntersuchungen kann zu Nierenversagen führen. Dies kann zu Metforminakkumulation und Laktatazidose führen. Die Behandlung mit Jardiance Met muss im Vorfeld oder zum Zeitpunkt einer solchen Untersuchung unterbrochen werden und darf frühestens 48 Stunden danach und nur dann wieder aufgenommen werden, wenn die Nierenfunktion erneut kontrolliert wurde und sich als stabil erwiesen hat.
Chirurgische Eingriffe
Da Jardiance Met Metformin enthält, muss die Behandlung 48 Stunden vor einer geplanten Operation unter Vollnarkose, Spinal- oder Periduralanästhesie abgesetzt werden. Die Fortführung der Behandlung darf frühestens 48 Stunden nach dem Eingriff oder bei Wiederaufnahme der oralen Ernährung erfolgen, sofern die Nierenfunktion als ausreichend eingestuft wurde (eGFR ≥60 ml/min/1.73 m2).
Zerebrovaskuläre Ereignisse
In der Studie EMPA-REG OUTCOME war Empagliflozin (kombinierte Behandlungsgruppen mit Empagliflozin 10 mg und 25 mg) im Vergleich zur Plazebo-Gruppe mit einem nicht signifikanten Trend für ein höheres Risiko tödlicher/nicht tödlicher Schlaganfälle assoziiert: HR 1,18 (95%-KI 0,89; 1,56) (siehe "Klinische Wirksamkeit" ). Ein kausaler Zusammenhang zwischen Empagliflozin und Schlaganfall ist nicht erwiesen; allerdings ist bei Patienten mit hohem Risiko für zerebrovaskuläre Ereignisse Vorsicht geboten.
Vitamin B12
Metformin kann die Vitamin-B-12-Serumspiegel senken. Das Risiko für einen verminderten Vitamin B12-Spiegel ist erhöht mit zunehmender Metformin-Dosis, Behandlungsdauer und bei Patienten mit Risikofaktoren für einen Vitamin B12-Mangel. Es wird empfohlen, die Vitamin-B12-Serumspiegel in regelmässigen Abständen (z.B. jährlich) sowie bei Verdacht auf Vitamin-B12-Mangel (z.B. bei Anämie oder Neuropathie) zu kontrollieren.
Kinder und Jugendliche
Die pädiatrische DINAMO-Studie, in der Kinder und Jugendliche mit Typ 2 Diabetes mellitus einer Behandlung mit Empagliflozin plus Metformin unterzogen wurden (siehe Abschnitt "Klinische Wirksamkeit" ), weist auf ein vergleichbares Sicherheitsprofil von Kindern ab einem Alter von 10 Jahren, Jugendlichen und Erwachsenen mit Typ 2 Diabetes mellitus hin. Die für Erwachsene aufgeführten Warnhinweise und Vorsichtsmassnahmen gelten somit auch für die pädiatrische Population.In der DINAMO-Studie wurden nach 26 Behandlungswochen keine relevanten Unterschiede zwischen Placebo und Empagliflozin bezüglich Längenwachstums oder hinsichtlich der sexuellen Reifung verzeichnet. Gleichermassen zeigten kontrollierte klinischen Studien über 1 Jahr keine Wirkung von Metformin auf Wachstum oder Pubertät. Es liegen jedoch keine Daten hinsichtlich längerer Behandlungsdauer vor. Daher wird die sorgfältige Nachbeobachtung der auf Wachstumsparameter bei Kindern, insbesondere vor der Pubertät, empfohlen.
InteraktionenAllgemein
Die gleichzeitige Mehrfachgabe von Empagliflozin (50 mg einmal täglich) und Metforminhydrochlorid (1000 mg zweimal täglich) hatte bei gesunden Probanden keine relevanten Auswirkungen auf die Pharmakokinetik von Empagliflozin oder Metformin.
Studien zu pharmakokinetischen Wechselwirkungen mit Jardiance Met liegen nicht vor; jedoch wurden Studien mit den jeweiligen Einzelwirkstoffen (Empagliflozin und Metformin) durchgeführt.
Empagliflozin
Pharmakodynamische Interaktionen
Diuretika
Empagliflozin kann die diuretische Wirkung von Thiazid- und Schleifendiuretika verstärken und das Risiko für Dehydratation und Blutdruckabfall erhöhen.
Insulin und lnsulin-Sekretagoga
Insulin und lnsulin-Sekretagoga, wie z.B. Sulfonylharnstoffe, können das Risiko einer Hypoglykämie erhöhen. Bei Anwendung in Kombination mit Empagliflozin muss daher unter Umständen die Dosierung des Insulins oder lnsulin-Sekretagogums reduziert werden, um das Risiko einer Hypoglykämie zu senken.
Pharmakokinetische Interaktionen
Wirkungen anderer Arzneimittel auf Empagliflozin
In-vitro-Daten lassen darauf schliessen, dass die primäre Metabolisierung von Empagliflozin beim Menschen über eine Glucuronidierung durch die Uridin-5'-Diphospho-Glucuronosyltransferasen UGT1A3, UGT1A8, UGT1A9 und UGT2B7 erfolgt. Empagliflozin ist ein Substrat der Aufnahme-Transporter OAT3, OATP1B1 und OATP1B3 beim Menschen, jedoch nicht von OAT1 und OCT2. Empagliflozin ist ein Substrat für P-Glykoprotein (P-gp) und das Brustkrebsresistenzprotein (BCRP).
Die gleichzeitige Anwendung von Empagliflozin mit Probenecid, einem Inhibitor von UGT-Enzymen und OAT3, führte zu einem Anstieg der maximalen Plasmakonzentrationen (Cmax) von Empagliflozin um 26% und zu einer Zunahme der Fläche unter der Konzentrations-Zeit-Kurve (AUC) um 54%.
Diese Veränderungen wurden als klinisch nicht relevant eingestuft.
Die Wirkung einer Induktion von UGT auf Empagliflozin wurde nicht untersucht.
Eine Begleitmedikation mit bekannten Induktoren von UGT-Enzymen sollte vermieden werden, da das potenzielle Risiko einer verminderten Wirksamkeit besteht.
Eine Interaktionsstudie mit Gemfibrozil, einem in-vitro-lnhibitor von OAT3- und OATP1B1/1B3-Transportern, zeigte, dass sich die Cmax von Empagliflozin nach gleichzeitiger Anwendung um 15 % und die AUC um 59% erhöhte. Diese Veränderungen wurden als klinisch nicht relevant eingestuft.
Die Hemmung von OATP1B1/1B3-Transportern durch gleichzeitige Anwendung von Rifampicin führte zu einem Anstieg der Cmax von Empagliflozin um 75% und zu einem Anstieg der AUC von Empagliflozin um 35 %.
Diese Veränderungen wurden als klinisch nicht relevant eingestuft.
Die Exposition gegenüber Empagliflozin war mit oder ohne eine gleichzeitige Anwendung von Verapamil, einem P-gp-lnhibitor, ähnlich; dies zeigt, dass die Hemmung von P-gp keinen klinisch relevanten Effekt auf Empagliflozin hat.
Bei gesunden Probanden durchgeführte Interaktionsstudien lassen darauf schliessen, dass die Pharmakokinetik von Empagliflozin nicht durch die gleichzeitige Anwendung von Metformin, Glimepirid (Einzeldosis), Verapamil, Ramipril, Simvastatin, Torasemid und Hydrochlorothiazid beeinflusst wird.
Wirkungen von Empagliflozin auf andere Arzneimittel
Basierend auf in-vitro-Studien bewirkt Empagliflozin keine Hemmung, Inaktivierung oder Induktion von CYP450-Isoenzymen. UGT1A1 wird durch Empagliflozin nicht gehemmt.
Arzneimittelwechselwirkungen aufgrund einer Beteiligung der wichtigsten CYP450-Isoenzyme oder von UGT1A1 bei gleichzeitiger Anwendung von Empagliflozin und Substraten dieser Enzyme werden daher als unwahrscheinlich angesehen. Das Potenzial von Empagliflozin, UGT2B7 zu hemmen, wurde nicht untersucht.
ln therapeutischen Dosen bewirkt Empagliflozin keine Hemmung von P-gp. Basierend auf in-vitro-Studien gilt es als unwahrscheinlich, dass Empagliflozin Wechselwirkungen mit anderen P-gp-Substraten hervorruft. Die gleichzeitige Anwendung von Digoxin, einem P-gp-Substrat, mit Empagliflozin führte zu einer Erhöhung der AUC von Digoxin um 6% und zu einer Erhöhung der Cmax um 15 %. Patienten unter Digoxin sollten entsprechend beobachtet werden.
Empagliflozin hemmt in klinisch relevanten Plasmakonzentrationen in vitro keinen der Aufnahme-Transporter beim Menschen wie OAT3, OATP1B1 und OATP1B3. Daher werden Arzneimittelwechselwirkungen mit Substraten dieser Aufnahme-Transporter als unwahrscheinlich angesehen.
Bei gesunden Probanden durchgeführte Interaktionsstudien lassen darauf schliessen, dass Empagliflozin keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Metformin, Glimepirid, Simvastatin, Warfarin, Ramipril, Hydrochlorothiazid, Torasemid und oralen Kontrazeptiva hat.
Für Acenocoumarol und Phenprocoumon stehen keine Daten zur Verfügung.
SGLT2-Inhibitoren einschliesslich Empagliflozin können die renale Lithiumausscheidung erhöhen und den Lithiumspiegel im Blut senken. Die Serumkonzentration von Lithium sollte nach Beginn der Behandlung mit Empagliflozin und bei Dosisänderungen häufiger kontrolliert werden. Zur Überwachung der Serumkonzentration von Lithium ist der Patient an den Arzt, der das Lithium verschrieben hat, zu verweisen.
Metformin
Bei gleichzeitiger Verabreichung der im Folgenden aufgeführten Arzneimittel mit Metformin sowie beim Absetzen dieser Arzneimittel unter Therapie mit Metformin sollte der Blutzuckerspiegel engmaschig kontrolliert werden. Die Patienten sollten entsprechend informiert werden. Wenn notwendig, ist die Dosierung der antidiabetischen Behandlung während der Dauer der Begleitbehandlung anzupassen.
Interaktionen, welche die Wirkung von Metformin beeinflussen
Reduktion der blutzuckersenkenden Wirkung
Glukokortikoide (systemisch und lokal), β2-Sympathomimetica, Diuretika, Phenothiazine (z.B. Chlorpromazin), Schilddrüsenhormone, Östrogene, orale Kontrazeptiva, Hormonersatzpräparate, Phenytoin, Nicotinsäure, Calciumkanalblocker, Isoniazid und Tetracosactid können den Blutzucker erhöhen.
Verstärkung der blutzuckersenkenden Wirkung
Furosemid erhöht die Plasmakonzentration von Metformin (Cmax um 22%, AUC um 15%) ohne signifikante Veränderung der renalen Clearance.
Nifedipin erhöht die Plasmakonzentration von Metformin (Cmax um 20%, AUC um 9-20%) durch Erhöhung der Metformin-Absorption.
Cimetidin erhöht die Cmax von Metformin um 60% und die AUC um 40%. Die Eliminationshalbwertszeit von Metformin wird nicht beeinflusst. Andere Wirkstoffe (Amilorid, Digoxin, Morphin, Procainamid, Chinidin, Chinin, Ranitidin, Triamteren, Trimethoprim oder Vancomycin), welche über aktive renale tubuläre Sekretion eliminiert werden, können potentiell eine Interaktion mit Metformin aufweisen. Patienten, die solche Arzneimittel erhalten, sollten bei der Behandlung mit Metformin deshalb sorgfältig beobachtet werden.
ACE-Hemmer können den Blutzucker reduzieren.
Ebenso kann der Blutzucker durch Betarezeptorenblocker reduziert werden, wobei kardioselektive (β1-selektive) Betablocker solche Wechselwirkungen in sehr viel geringerem Mass zeigen als nicht-kardioselektive.
Die gleichzeitige Anwendung von MAO-Hemmern und oralen Antidiabetika kann die Glukosetoleranz verbessern und den hypoglykämischen Effekt verstärken.
Bei gleichzeitiger Anwendung mit Alkohol kann es zur Verstärkung der blutzuckersenkenden Wirkung von Metformin bis zum hypoglykämischen Koma kommen.
Verstärkung oder Reduktion der blutzuckersenkenden Wirkung von Metformin
H2-Antagonisten, Clonidin und Reserpin können die Wirkung von Metformin verstärken oder abschwächen. Störungen der Blutzuckerkontrolle (einschliesslich Hyper- oder Hypoglykämie) wurden bei gleichzeitiger Gabe von Chinolonen und Metformin beobachtet.
Interaktionen, welche die Nebenwirkungen von Metformin erhöhen
Diuretika: Infolge einer durch Diuretika (insbesondere Schleifendiuretika) bedingten Nierenfunktionsstörung kann eine Laktatazidose auftreten. Des Weiteren haben Diuretika einen blutzuckersteigernden Effekt.
Iodhaltige Kontrastmittel: Zu Wechselwirkungen mit iodhaltigen Röntgenkontrastmitteln und der Gefahr einer hierdurch ausgelösten Laktatazidose vgl. Rubrik "Warnhinweise und Vorsichtsmassnahmen" .
Eine gleichzeitige Anwendung von Metformin mit:
-Substraten/Inhibitoren der OCT1 wie z.B. Verapamil kann die Wirksamkeit von Metformin reduzieren.
-Induktoren der OCT1 wie z.B. Rifampicin können die gastrointestinale Absorption sowie die Wirksamkeit von Metformin erhöhen.
-Substraten/Inhibitoren der OCT2 wie Cimetidin, Dolutegravir, Crizotinib, Olaparib, Daclatasvir, Vandetanib kann die renale Elimination erniedrigen und so zu einer erhöhten Plasmakonzentration führen.
Daher ist bei gleichzeitiger Anwendung dieser Arzneimittel mit Metformin Vorsicht angeraten, insbesondere bei Patienten mit Nierenfunktionsstörung, da sich die Plasmakonzentration von Metformin erhöhen kann. Gegebenenfalls ist eine Dosisanpassung von Metformin in Erwägung zu ziehen, da Inhibitoren/Induktoren von OCT die Wirksamkeit von Metformin verändern können.
Alkohol: Unter Metformin besteht bei akuter Alkoholintoxikation, insbesondere bei vorherigem Fasten oder beim Vorliegen von Mangelernährung oder Leberinsuffizienz, ein erhöhtes Risiko für Laktatazidose. Die Einnahme von Alkohol und Alkohol enthaltenden Arzneimitteln sollte vermieden werden.
Interaktionen, welche die Wirkung anderer Substanzen beeinflussen
Metformin erniedrigt die Plasmakonzentration von Furosemid (Cmax um 33%, AUC um 12%), und die terminale Halbwertzeit wird um 32% reduziert, ohne Veränderung der renalen Clearance von Furosemid.
Die Wirkung von Phenprocoumon kann verringert werden, da seine Ausscheidung durch Metformin beschleunigt wird.
Interaktionsstudien mit Glibenclamid, Nifedipin, Ibuprofen oder Propranolol ergaben keine klinisch relevanten Effekte auf die pharmakokinetischen Parameter dieser Substanzen.
Weitere Interaktionen
Unter dem Einfluss von sympatholytisch wirkenden Substanzen (z.B. Betablocker, Clonidin, Guanethidin, Reserpin) kann die Wahrnehmung der Warnzeichen einer Hypoglykämie beeinträchtigt sein.
Interferenz mit 1,5-Anhydroglucitol(1,5-AG)-Assay
Die Überwachung der Glykämie mittels 1,5-AG-Assay ist nicht empfohlen, da bei Patienten, die SGLT2-Hemmer einnehmen, 1,5-AG-Messungen zur Bewertung der glykämischen Kontrolle unzuverlässig sind. Alternative Methoden zur Überwachung der Glykämie sollen benutzt werden.
Kinder und Jugendliche
Interaktionsstudien wurden ausschliesslich an Erwachsenen durchgeführt.
Schwangerschaft, StillzeitSchwangerschaft
Ungenügend kontrollierter Diabetes während der Schwangerschaft (gestationsbedingt oder vorbestehend) ist mit einem erhöhten Risiko für kongenitale Missbildungen und perinatale Mortalität verbunden.
Es liegen nur begrenzte Erfahrungen mit der Anwendung von Jardiance Met oder seinen einzelnen Bestandteilen bei Schwangeren vor.
Tierexperimentelle Studien mit Empagliflozin allein ergaben keine Hinweise auf eine Reproduktionstoxizität.
Tierexperimentelle Studien mit der Kombination Empagliflozin plus Metformin oder mit Metformin allein haben nur bei höher dosiertem Metformin teratogene Wirkungen gezeigt (siehe "Präklinische Daten" ).
Jardiance Met sollte während der Schwangerschaft nicht angewendet werden, ausser es ist klar notwendig.
Der Blutzuckerspiegel sollte durch Insulin so gut wie möglich auf normale Werte eingestellt werden, um das Risiko von Fehlbildungen und weiteren Komplikationen für das Kind zu reduzieren.
Stillzeit
Metformin wird in kleinen Mengen in die menschliche Muttermilch ausgeschieden. Es ist in der Stillzeit kontraindiziert.
Es ist nicht bekannt, ob Empagliflozin in die Muttermilch übergeht. Die zur Verfügung stehenden Daten aus tierexperimentellen Studien zeigten, dass Empagliflozin in die Milch übergeht. Tierstudien haben unerwünschte Wirkungen auf die postnatale Entwicklung gezeigt (siehe "Präklinische Daten" ).
Ein Risiko für das Neugeborene / Kind kann nicht ausgeschlossen werden. Die Metformin-haltige Kombination Jardiance Met ist in der Stillzeit kontraindiziert oder das Stillen soll während der Behandlung mit Jardiance Met unterbrochen werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien über die Wirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Patienten sollten jedoch auf das Risiko einer Hypoglykämie hingewiesen werden, wenn Jardiance Met als zusätzliche Therapie zu Insulin und/oder einem Sulfonylharnstoff verabreicht wird. Zudem sollten sie auf das erhöhte Risiko unerwünschter Wirkungen in Zusammenhang mit reduziertem intravaskulärem Volumen, wie z.B. Schwindel (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Unerwünschte Wirkungen" ) aufmerksam gemacht werden.
Unerwünschte WirkungenIn klinischen Studien zur Beurteilung der Sicherheit von Empagliflozin plus Metformin wurden insgesamt 12245 Patienten mit Typ 2 Diabetes mellitus behandelt, wobei 8199 Patienten Empagliflozin plus Metformin entweder allein oder in Kombination mit einem Sulfonylharnstoff, Pioglitazon, DPP4-Inhibitoren oder Insulin erhielten.
Das allgemeine Sicherheitsprofil von Empagliflozin plus Metformin bei Patienten, die an der EMPA-REG-OUTCOME-Studie teilnahmen, war den zuvor bekannten Sicherheitsprofilen der beiden Einzelsubstanzen vergleichbar.
An placebokontrollierten, doppelblinden Studien mit 18- bis 24wöchiger Behandlungsdauer nahmen 3456 Patienten teil, von denen 1271 Empagliflozin 10 mg plus Metformin und 1259 Empagliflozin 25 mg plus Metformin erhielten.
Die in klinischen Studien am häufigsten gemeldete unerwünschte Wirkung war Hypoglykämie, abhängig von der angewendeten Basistherapie in den jeweiligen Studien (siehe "Beschreibung spezieller Nebenwirkungen" ).
In klinische Studien mit Empagliflozin plus Metformin wurden im Vergleich zu den einzelnen Bestandteilen keine zusätzlichen unerwünschten Wirkungen festgestellt.
Bei den Nebenwirkungshäufigkeiten werden folgende Häufigkeitskategorien zugrunde gelegt: "sehr häufig" (≥1/10), "häufig" (<1/10, ≥1/100), "gelegentlich" (<1/100, ≥1/1000), "selten" (<1/1000, ≥1/10'000), "sehr selten" (<1/10'000).
Folgende unerwünschte Wirkungen wurden bei Patienten, die in placebokontrollierten, doppelblinden Studien mit einer Laufzeit von bis zu 24 Wochen mit Empagliflozin plus Metformin behandelt wurden, berichtet (klassifiziert nach Systemorganklassen und bevorzugten Begriffen gemäss MedDRA).
Infektionen und Infestationen
Häufig: Vaginaler Soor, Vulvovaginitis, Balanitis und andere Infektionen des Genitaltrakts1,2, Harnwegsinfekte1,2 (einschliesslich Pyelonephritis und Urosepsis)6.
Häufigkeit nicht bekannt: Nekrotisierende Fasziitis des Perineums (Fournier-Gangrän)2,6.
Stoffwechsel und Ernährungsstörungen
Sehr häufig: Hypoglykämie (bei Kombination mit einem Sulfonylharnstoff oder Insulin)1.
Häufig: Vitamin-B12-Abnahme/Mangel³.
Sehr selten: Laktatazidose3.
Nervensystem
Häufig: Geschmacksstörungen (Metallgeschmack) 3.
Funktionsstörungen der Gefässe
Gelegentlich: Volumenmangel1,2.
Gastrointestinale Störungen4
Sehr häufig: Gastrointestinale Störungen (5-15%) wie z.B. Übelkeit3, Erbrechen3, Diarrhöe3, Bauchschmerzen3, Appetitverlust3.
Häufig: Obstipation.
Leber und Galle
Sehr selten: abnorme Werte in Leberfunktionstests, z.B. erhöhte Transaminasen3 oder Hepatitis3 (nach Absetzen von Metformin reversibel).
Haut
Häufig: allergische Hautreaktionen (z.B. Erythem3, Hautausschlag6, Urtikaria3,6, Pruritus3,2).
In Einzelfällen: Angioödem2,6.
Funktionsstörungen der Nieren und Harnwege
Häufig: Vermehrtes Wasserlassen1,2.
Gelegentlich: Dysurie2.
Sehr selten: Tubulointerstitielle Nephritis.
Allgemeine Störungen
Häufig: Durst.
Untersuchungen
Häufig: Erhöhte Serumlipide5, Erhöhter Hämatokrit5.
Gelegentlich: Verringerte glomeruläre Filtrationsrate1, erhöhter Kreatininspiegel im Blut1.
1 Weitere Informationen siehe "Beschreibung spezieller Nebenwirkungen" .
2 Unerwünschte Wirkungen, die unter Empagliflozin als Monotherapie aufgetreten sind
3 Identifizierte unerwünschte Wirkungen auf Grundlage der EU-Fachinformation für Metformin
4 Gastrointestinale Symptome wie z.B. Übelkeit, Erbrechen, Diarrhoe, Bauchschmerzen und Appetitlosigkeit treten am häufigsten zu Behandlungsbeginn auf und klingen in den meisten Fällen spontan ab.
5 nähere Angaben siehe "Klinische Wirksamkeit"
6 aus den Erfahrungen seit der Marktzulassung
Im Rahmen der Überwachung nach Markteinführung wurden bei Patienten, die mit SGLT-2 Inhibitoren wie Empagliflozin behandelt wurden, Fälle von diabetischer Ketoazidose beobachtet (siehe "Warnhinweise und Vorsichtsmassnahmen" )
Beschreibung spezieller Nebenwirkungen
Die nachstehend angegebenen Häufigkeiten für unerwünschte Wirkungen werden ungeachtet des Kausalzusammenhangs angegeben.
Hypoglykämie
Die Häufigkeit der Hypoglykämie war von der Basistherapie in der jeweiligen Studie abhängig.
Leichte Hypoglykämie
Die Anzahl von Patienten mit leichter Hypoglykämie in den Gruppen mit Empagliflozin plus Metformin bzw. Placebo plus Metformin als Monotherapie oder als Zusatztherapie zu Pioglitazon war vergleichbar. Eine erhöhte Häufigkeit wurde beobachtet, wenn die Gabe als Zusatztherapie zu einem Sulfonylharnstoff (Empagliflozin plus Metformin 10 mg: 16.1%, Empagliflozin plus Metformin 25 mg: 11.5%, Placebo plus Metformin: 8.4%) erfolgte. Als Zusatztherapie zu Insulin (Empagliflozin plus Metformin 10 mg: 31.3%, Empagliflozin plus Metformin 25 mg: 36.2%, Placebo plus Metformin: 34.7%) fand sich kein erhöhtes Hypoglykämierisiko versus Placebo. Als Zusatztherapie zu Insulin plus einen Sulphonylharnstoff wurden Hypoglykämien bei 16.2% (Empagliflozin plus Metformin 10 mg), 32.8% (Empagliflozin plus Metformin 25 mg) und 13.2% (Placebo plus Metformin) berichtet.
Schwere Hypoglykämie (behandlungsbedürftige Hypoglykämie)
Die Anzahl von Patienten mit schweren hypoglykämischen Ereignissen in den Gruppen mit Empagliflozin plus Metformin bzw. Placebo plus Metformin war gering (<1%) und vergleichbar.
Vaginaler Soor, Vulvovaginitis, Balanitis und andere Infektionen des Genitaltrakts
Vaginaler Soor, Vulvovaginitis, Balanitis und andere Genitalinfektionen traten häufiger unter Empagliflozin 10 mg plus Metformin (4,0%) und Empagliflozin 25 mg plus Metformin (3,9%) auf als unter Placebo plus Metformin (1,3%); Patientinnen unter Empagliflozin plus Metformin waren im Vergleich zur Placebo-Gruppe häufiger betroffen, bei männlichen Patienten war der Unterschied in der Häufigkeit weniger ausgeprägt. Die Infektionen des Genitaltrakts waren von leichter und mittelschwerer Intensität, schwerwiegende Infektionen kamen nicht vor.
Fälle von Phimose/erworbener Phimose wurden in Verbindung mit Genitalinfektionen gemeldet.
Vermehrtes Wasserlassen
Wie angesichts des Wirkmechanismus zu erwarten, wurde vermehrtes Wasserlassen (umfasst die bevorzugten Bezeichnungen [PT]: Pollakisurie, Polyurie, Nykturie) häufiger bei Patienten unter Empagliflozin 10 mg plus Metformin (3,0%) und Empagliflozin 25 mg plus Metformin (2,9%) als unter Placebo plus Metformin (1,4%) beobachtet. Diese Nebenwirkung war zumeist leicht bis mittelschwer ausgeprägt. Die Häufigkeit von Meldungen über Nykturie war für Placebo und Empagliflozin (beide mit Metformin als Basistherapie) vergleichbar (<1%).
Volumenmangel
Insgesamt war die Häufigkeit eines Volumenmangels (einschliesslich der vorab definierten Erfassungsbegriffe [ambulant gemessene] Abnahme des Blutdrucks, Abnahme des systolischen Blutdrucks, Dehydratation, Hypotonie, Hypovolämie, orthostatische Hypotonie und Synkope) gering und mit Placebo vergleichbar (Empagliflozin 10 mg plus Metformin (0,6%), Empagliflozin 25 mg plus Metformin (0,3%) und Placebo plus Metformin (0,1%). Die Wirkung von Empagliflozin auf die Ausscheidung von Zucker im Urin ist mit osmotischer Diurese assoziiert, wodurch der Hydratationsstatus von Patienten ab 75 Jahren beeinträchtigt werden könnte.
Erhöhter Blutkreatininspiegel und verringerte glomeruläre Filtrationsrate
Die Gesamthäufigkeit der Patienten mit erhöhtem Blutkreatininspiegel und verringerter glomerulärer Filtrationsrate war bei Empagliflozin und Placebo als Zusatztherapie zu Metformin vergleichbar (Blutkreatinin erhöht: Empagliflozin 10 mg 0,5 %, Empagliflozin 25 mg 0,1 %, Placebo 0,4 %; glomeruläre Filtrationsrate verringert: Empagliflozin 10 mg 0,1 %, Empagliflozin 25 mg 0 %, Placebo 0,2 %).
In diesen placebokontrollierten, doppelblinden Studien über einen Zeitraum von bis zu 24 Wochen wurden vorübergehende anfängliche Kreatininerhöhungen (durchschnittliche Veränderung von Baseline bis Woche 12: Empagliflozin 10 mg 0,02 mg/dl, Empagliflozin 25 mg 0,02 mg/dl) sowie vorübergehende anfängliche Senkungen der geschätzten glomerulären Filtrationsrate (durchschnittliche Veränderung von Baseline bis Woche 12: Empagliflozin 10 mg -1,46 ml/min/1,73 m2, Empagliflozin 25 mg -2,05 ml/min/1,73 m2) beobachtet. Diese Veränderungen waren in den Langzeitstudien im Allgemeinen unter Dauergabe oder nach Absetzen der Medikation reversibel.
Kinder und Jugendliche
Im Rahmen der DINAMO-Studie erhielten 157 Kinder ab 10 Jahren mit Typ 2 Diabetes mellitus eine Behandlung, davon 52 Patienten Empagliflozin, 52 Patienten Linagliptin und 53 Patienten Placebo (siehe Abschnitt zu klinischen Studien). Über 90% der Studienteilnehmenden wurden zusätzlich mit Metformin behandelt.
Während der placebokontrollierten Phase war die häufigste unerwünschte Arzneimittelwirkung Hypoglykämie (Empagliflozin 10 mg und 25 mg, gepoolt: 23,1 %, Placebo: 9,4 %).
Keines dieser Ereignisse war schwerwiegend oder erforderte Hilfestellung.
Insgesamt war das Sicherheitsprofil bei Kindern vergleichbar mit dem Sicherheitsprofil bei erwachsenen Patienten mit Typ 2 Diabetes mellitus.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Im Rahmen kontrollierter klinischer Studien an gesunden Probanden wurden Einzeldosen von bis zu 800 mg Empagliflozin (entspricht dem 32-Fachen der höchsten empfohlenen Tagesdosis) verabreicht.
Hypoglykämie wurde unter Metforminhydrochlorid in Dosierungen von bis zu 85 g nicht beobachtet; jedoch trat unter diesen Umständen Laktatazidose auf. Hohe Überdosierung von Metforminhydrochlorid oder Begleitrisiken können zur Laktatazidose führen. Die Laktatazidose ist ein medizinischer Notfall und muss im Krankenhaus behandelt werden.
Behandlung
Bei einer Überdosierung sind geeignete unterstützende Massnahmen entsprechend dem klinischen Zustand des Patienten einzuleiten. Die wirksamste Methode zur Entfernung von Laktat und Metforminhydrochlorid ist die Hämodialyse. Zur Entfernung von Empagliflozin durch Hämodialyse liegen keine Daten vor.
Eigenschaften/WirkungenATC-Code
A10BD20
Pharmakotherapeutische Gruppe:
Kombinationen mit oralen Antidiabetika.
Wirkungsmechanismus / Pharmakodynamik
Empagliflozin ist ein reversibler, stark wirksamer und selektiver kompetitiver SGLT2-Inhibitor mit einer IC50 von 1,3 nM. Es zeigt eine 5000fach höhere Selektivität für SGLT2 gegenüber dem für die Glukose-Resorption im Darm verantwortlichen humanen SGLT1 (IC50: 6278 nM).
Weiter konnte keine hemmende Wirkung auf Glukosetransporter GLUTs gezeigt werden, welche für die Glukoseversorgung in verschiedenen Geweben verantwortlich sind.
SGLT-2 wird vorwiegend in der Niere exprimiert. Es ist als wichtigster Transporter für die Rückresorption der Glukose aus dem glomerulären Filtrat in den Blutkreislauf verantwortlich.
Empagliflozin reduziert insulinunabhängig die renale Glucose-Rückresorption. Die durch diesen Mechanismus über den Urin ausgeschiedene Menge an Glucose ist abhängig von der Blutzuckerkonzentration sowie der glomerulären Filtrationsrate.
Die erhöhte renale Glucoseausscheidung führt zu einer osmotischen Diurese und über diesen diuretischen Effekt zu einer Senkung des Blutdrucks (im Mittel rund 4-5 mmHg systolisch und 1-2 mmHg diastolisch) und zu einem Anstieg des Hämatokrits (rund 2-3%). Zudem wirkt Empagliflozin urikosurisch und reduziert so den Plasma-Harnsäurespiegel (rund 50µmol/L). Durch die renale Glucoseausscheidung ist das Risiko für urogenitale Infektionen insbesondere bei Frauen und älteren Menschen erhöht.
Die renale Glucose-Ausscheidung nach 10mg Empagliflozin beträgt ca. 64g pro Tag (entspricht rund 256 kcal). Nach 25 mg Empagliflozin beträgt die renale Glucose-Ausscheidung ca. 78g pro Tag (entspricht rund 312 kcal).
Bei T2DM-Patienten steigt die renale Ausscheidung von Zucker im Urin nach der ersten Dosis Empagliflozin an und bleibt über das gesamte 24stündige Dosierungsintervall auf dem gleichen Niveau.
Die erhöhte Ausscheidung von Zucker im Urin führte bei T2DM-Patienten zu einer Reduktion der Plasmaglukosespiegel.
Die blutzuckersenkende Wirkung von Empagliflozin ist unabhängig von der Betazellfunktion und dem Insulinweg.
Metformin ist ein Biguanid mit antihyperglykämischen Wirkungen, sowohl auf die basale als auch auf die postprandiale Hyperglykämie. Es stimuliert nicht die Insulinsekretion und verursacht daher keine Hypoglykämie. Metformin reduziert die basale Hyperinsulinämie und verringert in Kombination mit Insulin den Insulinbedarf. Metformin übt seine antihyperglykämische Wirkung über mehrere Mechanismen aus:
Metformin reduziert die hepatische Glukoseproduktion.
Metformin erleichtert die periphere Glukoseaufnahme und -verwertung, zum Teil durch Erhöhung der Insulinwirkung.
Metformin verändert den Glukoseumsatz im Darm: Die Aufnahme aus dem Blutkreislauf wird erhöht und die Absorption aus der Nahrung wird verringert. Zu den zusätzlichen Mechanismen, die dem Darm zugeschrieben werden, gehören eine erhöhte Freisetzung von Glucagon-like Peptide 1 (GLP-1) und eine Abnahme der Gallensäureresorption. Metformin verändert das Darmmikrobiom.
Metformin kann das Lipidprofil bei Personen mit Hyperlidämie verbessern.
In klinischen Studien war die Anwendung von Metformin entweder mit einem stabilen Körpergewicht oder einem moderaten Gewichtsverlust verbunden.
Metformin ist ein Aktivator der Adenosin-monophosphat-Protein-Kinase (AMPK) und erhöht die Transportkapazität aller Arten von Glukosetransportern in der Zellmembran (GLUTs).
Klinische Wirksamkeit
Insgesamt 10224 Patienten mit Typ 2 Diabetes mellitus wurden mindestens 24 Wochen lang in 9 doppelblinden, placebo- oder wirkstoffkontrollierten klinischen Studien behandelt; von diesem Patienten erhielten 2947 Empagliflozin 10 mg und 3703 Empagliflozin 25 mg als Zusatz zur Metformin-Therapie. Insgesamt 2978 dieser Patienten wurden mit Metformin plus Insulin behandelt, davon erhielten 988 Empagliflozin 10 mg und 990 Empagliflozin 25 mg als Zusatztherapie.
Die Behandlung mit Empagliflozin in Kombination mit Metformin mit oder ohne eine weitere Basistherapie (Sulfonylharnstoff, DPP-4-Inhibitoren und Insulin) bewirkte eine klinisch relevante Verbesserung der HbA1c- und Nüchternplasmaglukosewerte (NPG), des Körpergewichts sowie des systolischen und diastolischen Blutdrucks.
Bei Patienten ab 75 Jahren wurden unter Empagliflozin numerisch geringere Reduktionen des HbA1c-Werts beobachtet. Höhere HbA1c-Werte zu Baseline waren mit einer stärkeren Reduktion des HbA1c assoziiert.
Kombinationstherapie
Empagliflozin als Add-on-Therapie zu Metformin und Sulfonylharnstoff
Empagliflozin führte als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff im Vergleich zu Placebo zu einer statistisch signifikanten (p < 0,0001) Abnahme des HbA1c-Werts und des Körpergewichts (Tabelle 2). Zudem führte es im Vergleich zu Placebo zu einer klinischen bedeutsamen Abnahme der NPG sowie des systolischen und diastolischen Blutdrucks.
In der doppelblinden. Placebokontrollierten Verlängerungsperiode dieser Studien blieben die Reduktionen von HbA1c, Körpergewicht und Blutdruck bis Woche 52 bestehen.
Tabelle 2: Ergebnisse einer 24wöchigen (LOCF) Placebokontrollierten Studie mit Empagliflozin als Zusatz zu Metformin bzw. zu Metformin und einem Sulfonylharnstoff (Full Analysis Set)
Empagliflozinals Zusatz zu Placebo Empagliflozin10 mg Empagliflozin25 mg
Metformin
N 207 217 213
HbA1c (%)
Baseline (Mittelwert) 7,90 7,94 7,86
Veränderung gegenüber Baseline1 -0,13 -0,70 -0,77
Unterschied zu Placebo1(97,5% KI) -0,57* (-0,72, -0,64* (-0,79,
-0,42) -0,48)
N 184 199 191
Patienten (%), die HbA1c <7% 12,5 37,7 38,7
erreichen (HbA1c-Ausgangswert
≥7%)2
N 207 217 213
Körpergewicht (kg)
Baseline (Mittelwert) 79,73 81,59 82,21
Veränderung gegenüber Baseline1 -0,45 -2,08 -2,46
Unterschied zu Placebo1(97,5% KI) -1,63* (-2,17, -2,01* (-2,56,
-1,08) -1,46)
N 207 217 213
Patienten (%) mit einem 4,8 21,2 23,0
Gewichtsverlust von >5%
N 207 217 213
SBD (mmHg)2
Baseline (Mittelwert) 128,6 129,6 130,0
Veränderung gegenüber Baseline1 -0,4 -4,5 -5,2
Unterschied zu Placebo1(95% KI) -4,1* (-6,2, -2,1) -4.8* (-6.9, -2.7)
Empagliflozinals Zusatz Placebo Empagliflozin10 mg Empagliflozin25 mg
zu Metformin und einem
Sulfonylharnstoff
N 225 225 216
HbA1c (%)
Baseline (Mittelwert) 8,15 8,07 8,10
Veränderung gegenüber -0,17 -0,82 -0,77
Baseline1
Unterschied zu Placebo1( -0,64* (-0,79, -0,49) -0,59* (-0,74, -0,44)
97,5% KI)
N 216 209 202
Patienten (%), die 9,3 26,3 32,2
HbA1c <7% erreichen
(HbA1c-Ausgangswert
≥7%)2
N 224 225 215
NPG (mg/dl) [mmol/l]
Baseline (Mittelwert) 151,7 [8,42] 151,0 [8,38] 156,5 [8,68]
Veränderung gegenüber 5,5 [0,31] -23,3 [-1,29] -23,3 [-1,29]
Baseline1
Unterschied zu Placebo1( -28,8* (-34,3, -23,4) -28,8* (-34,3, -23,3)
95% KI) [-1,60 (-1,90, -1,30)] [-1,60 (-1,90, -1,29)]
N 225 225 216
Körpergewicht (kg)
Baseline (Mittelwert) 76,23 77,08 77,50
Veränderung gegenüber -0,39 -2,16 -2,39
Baseline1
Unterschied zu Placebo1( -1,76* (-2,25, -1,28) -1,99* (-2,48, -1,50)
97,5% KI)
N 225 225 216
Patienten (%) mit einem 5,8 27,6 23,6
Gewichtsverlust von >5%
N 225 225 216
SBD (mmHg)2
Baseline (Mittelwert) 128,8 128,7 129,3
Veränderung gegenüber -1,4 -4,1 -3,5
Baseline1
Unterschied zu Placebo1( -2,7 (-4,6, -0,8) -2,1 (-4,0, -0,2)
95% KI)
1 für Ausgangswert adjustierter Mittelwert
2 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Add-on-Therapie zu Insulin
Empagliflozin als Add-on-Therapie zu Basalinsulin
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu Basalinsulin mit oder ohne Metformin und/oder einem Sulfonylharnstoff wurde in einer doppelblinden, Placebokontrollierten Studie mit einer Dauer von 78 Wochen untersucht. In den ersten 18 Wochen wurde die Insulindosis stabil gehalten, in den folgenden 60 Wochen konnte die Dosis angepasst werden, um einen NPG-Wert < 110 mg/dl zu erreichen.
Bis zur Woche 18 führte Empagliflozin zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 3).
Nach 78 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme von NPG, des Körpergewichts und des Blutdrucks.
Tabelle 3: Ergebnisse einer Placebokontrollierten Studie mit Empagliflozin als Zusatz zu Basalinsulin mit oder ohne Metformin oder einem Sulfonylharnstoff (Full Analysis Set – Completer) nach 18 bzw. 78 Wochen (LOCF)
Placebo Empagliflozin10 mg Empagliflozin25 mg
N 125 132 117
HbA1c (%) in Woche 18
Baseline (Mittelwert) 8,10 8,26 8,34
Veränderung gegenüber Baseline1 -0,01 -0,57 -0,71
Unterschied zu Placebo1(97,5% KI) -0,56* (-0,78, -0,33) -0,70* (-0,93, -0,47)
N 112 127 110
HbA1c (%) in Woche 78
Baseline (Mittelwert) 8,09 8,27 8,29
Veränderung gegenüber Baseline1 -0,02 -0,48 -0,64
Unterschied zu Placebo1(97,5% KI) -0,46* (-0,73, -0,19) -0,62* (-0,90, -0,34)
N 112 127 110
Dosis Basalinsulin (IE/Tag) in Woche 78
Baseline (Mittelwert) 47,84 45,13 48,43
Veränderung gegenüber Baseline1 5,45 -1,21 -0,47
Unterschied zu Placebo1(97,5% KI) -6,66** (-11,56, -1,77) -5,92** (-11,00, -0,85)
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p < 0,01
Empagliflozin als Add-on-Therapie zu multiplen täglichen Insulininjektionen
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu mehrmals täglich verabreichtem Insulin mit oder ohne begleitende Metformin-Therapie wurde in einer doppelblinden, Placebokontrollierten Studie mit einer Dauer von 52 Wochen untersucht. In den ersten 18 Wochen und den letzten 12 Wochen wurde die Insulindosis stabil gehalten, zwischen Woche 19 und 40 jedoch angepasst, um präprandiale Glucosewerte < 100 mg/dl (5,5 mmol/l) und postprandiale Glucosewerte < 140 mg/dl (7,8 mmol/l) zu erreichen.
Bis zur Woche 18 führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 4).
Nach 52 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme der NPG und des Körpergewichts.
Tabelle 4: Ergebnisse zur Wirksamkeit in den Wochen 18 und 52 einer Placebokontrollierten Studie zu Empagliflozin als Add-on-Therapie zu mehreren täglichen Dosen Insulin mit oder ohne Metformin
Placebo Empagliflozin10 mg Empagliflozin25 mg
N 188 186 189
HbA1c (%) in Woche 18
Baseline (Mittel) 8,33 8,39 8,29
Veränderung gegenüber Baseline1 -0,50 -0,94 -1,02
Unterschied zu Placebo1 (97,5% KI) -0,44* (-0,61, -0,52* (-0,69,
-0,27) -0,35)
N 115 119 118
HbA1c (%) in Woche 522
Baseline (Mittel) 8,25 8,40 8,37
Veränderung gegenüber Baseline1 -0,81 -1,18 -1,27
Unterschied zu Placebo1 (97,5% KI) -0,38*** (-0,62, -0,46* (-0,70,
-0,13) -0,22)
N 113 118 118
Patienten (%), die HbA1c <7% mit 26,5 39,8 45,8
Baseline HbA1c ≥7% in Woche 52
erreichen
N 115 118 117
Insulindosis (IU/Tag) in Woche 522
Baseline (Mittel) 89,94 88,57 90,38
Veränderung gegenüber Baseline1 10,16 1,33 -1,06
Unterschied zu Placebo1 (97,5% KI) -8,83# (-15,69, -11,22** (-18,09,
-1,97) -4,36)
N 115 119 118
Körpergewicht (kg) in Woche 522
Baseline (Mittel) 96,34 96,47 95,37
Veränderung gegenüber Baseline1 0,44 -1,95 -2,04
Unterschied zu Placebo1 (97,5% KI) -2,39* (-3,54, -2,48* (-3,63,
-1,24) -1,33)
1 für Ausgangswert adjustierter Mittelwert
2 Woche 19-40: Treat-to-Target-Regime für Insulindosisanpassung, um vordefinierte Blutzucker-Zielwerte (präprandial <100 mg/dl (5,5 mmol/l), postprandial <140 mg/dl (7,8 mmol/l) zu erreichen
* p-Wert <0,0001
** p-Wert = 0,0003
*** p-Wert = 0,0005
# p-Wert = 0,0040
Empagliflozin zweimal täglich versus einmal täglich als Zusatz zu Metformin
Die Wirksamkeit und Sicherheit von Empagliflozin zweimal täglich versus einmal täglich (Tagesdosis von 10 mg und 25 mg) als Zusatzbehandlung bei Patienten, deren Blutzucker mit Metformin allein nicht ausreichend kontrolliert werden konnte, wurde in einer doppelblinden, placebokontrollierten 16wöchigen Studie beurteilt. Alle Behandlungen mit Empagliflozin bewirkten eine signifikante Reduktion des HbA1c ab Baseline (Gesamtmittelwert 7,8%) nach 16 Behandlungswochen im Vergleich zu Placebo. Bei zweimal täglicher Gabe von Empagliflozin wurden vergleichbaren Reduktionen des HbA1c wie bei Therapieregimes mit einmal täglicher Gabe erreicht, der Behandlungsunterschied bezüglich der HbA1c-Reduktion zwischen Baseline und Woche 16 betrug -0,02% (95% KI -0,16; 0,13) für Empagliflozin 5 mg zweimal täglich versus 10 mg einmal täglich und -0,11% (95% KI -0,26; 0,03) für Empagliflozin 12,5 mg zweimal täglich versus 25 mg einmal täglich.
Kardiovaskuläre Ergebnisse in Patienten mit manifester kardiovaskulärer Erkrankung
Die EMPA-REG Studie verglich das Risiko kardiovaskulärer Ereignisse in Patienten mit Typ 2 Diabetes mellitus und kardiovaskulärer Vorerkrankung unter Empagliflozin-Behandlung versus Placebo. In diese Studie wurden insgesamt 7020 Patienten mit koronarer Herzkrankheit (Ein- oder Mehrgefässerkrankung), Zustand nach Myokardinfarkt (MI), Zustand nach Schlaganfall und/oder peripherer arterieller Verschlusskrankheit eingeschlossen und für bis zu 4,5 Jahre (mediane Behandlungsdauer 3,1 Jahre) zusätzlich zur vorbestehenden Therapie entweder mit Empagliflozin 10 mg (n=2.345), Empagliflozin 25 mg (n=2.342) oder Plazebo (n=2.333) behandelt.
Die Population war zu 72,4 % kaukasisch, zu 21,6 % asiatisch und zu 5,1 % schwarz. Das Durchschnittsalter betrug 63 Jahre (9,3 % der Patienten ≥75 Jahre), 71,5 % der Patienten waren männlich. Zu Studienbeginn erhielten etwa 81 % der Patienten einen Hemmer des Renin-Angiotensin-Systems, 65 % Betablocker, 43 % Diuretika, 89 % Antikoagulantien und 81 % eine lipidsenkende Medikation. Etwa 74 % der Patienten nahmen bei Studienbeginn Metformin ein, 48 % wendeten Insulin an und 43 % erhielten einen Sulfonylharnstoff. In den ersten 12 Wochen erfolgte die Behandlung grundsätzlich ohne weitere Anpassungen. Ab diesem Zeitpunkt konnte die Behandlung (inklusive Hypertonie und Dyslipidämie) gemäss den aktuellen Therapierichtlinien angepasst werden.
Primärer Endpunkt (bestimmt für beide Empagliflozin-Arme zusammen) war die Zeit bis zum ersten Ereignis des kombinierten Endpunkts aus kardiovaskulären Todesfällen, nicht-tödlichen MI und nicht-tödlichen Schlaganfällen (3-point MACE [Major Adverse Cardiovascular Events]). Alle kardiovaskulären Todesfälle wurden durch ein verblindetes Expertengremium (CEC) als tödlicher MI, tödlicher Schlaganfall, Tod aufgrund von Herzinsuffizienz (durch Progression oder kardiogenen Schock), plötzlicher Tod oder andere tödliche kardiovaskuläre Ereignisse kategorisiert.
Subgruppen-Analysen für 3P-MACE und kardiovaskulärer Tod nach Antidiabetika zu Studienbeginn (einschliesslich Metformin und Insulin) zeigten Behandlungseffekte, welche mit jenen der Gesamtpopulation in Einklang standen, bei einer Punktschätzung für die Hazard Ratio der Gesamtpopulation innerhalb der Konfidenzintervalle der Subgruppen für jeden Endpunkt.
Reduktion des Risikos für kardiovaskuläre Todesfälle und Gesamtmortalität
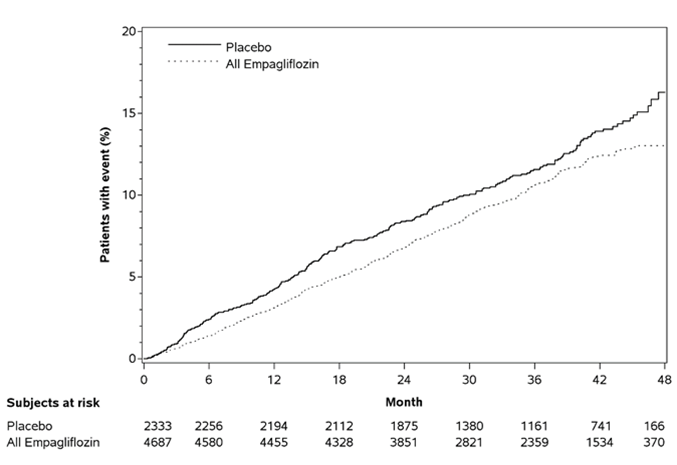
Empagliflozin war Plazebo hinsichtlich des primären Endpunkts überlegen (d.h. bewirkte eine Senkung des Risikos kardiovaskulärer Ereignisse). Dieser Effekt konnte nicht allein durch den Unterschied zwischen den Behandlungsgruppen in der glykämischen Kontrolle erklärt werden und beruhte weitgehend auf der ausgeprägten Senkung der Inzidenz kardiovaskulärer Todesfälle (Tabelle 5 und Abbildung 1). Ein präventiver Effekt wurde für alle Kategorien kardiovaskulärer Todesfälle beobachtet und war am deutlichsten für Tod aufgrund fortschreitender Herzinsuffizienz. Gleichzeitig wurde das Risiko nicht-tödlicher Myokardinfarkte nicht statistisch signifikant gesenkt. Empagliflozin hatte auch keinen präventiven Effekt für Schlaganfälle und bewirkte sogar einen numerischen Anstieg des Risikos (HR [95% Konfidenzintervall] für tödliche/nicht-tödliche Ereignisse: 1,18 [0,89, 1,56]). Ausserdem gab es keine Reduktion des primären Endpunkts in Patienten, welche ausschliesslich aufgrund einer zerebrovaskulären Vorgeschichte in die Studie eingeschlossen wurden. Die grösste Senkung der kardiovaskulären Mortalität wurde in Patienten mit 2 oder 3 Risikofaktoren beobachtet.
Resultierend hauptsächlich aus der Reduktion kardiovaskulärer Todesfälle (Empagliflozin bewirkte keine statistisch signifikante Reduktion der nicht-kardiovaskulären Mortalität) verbesserte sich unter Empagliflozin-Behandlung auch die Gesamtmortalität
Tabelle 5: Behandlungseffekt in Bezug auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Mortalität (Behandelte Population*)
Placebo Empagliflozin(10 und
25 mg, gepoolt)
N 2333 4687
Zeit bis zum ersten Eintreten eines kardiovaskulären 282 (12,1) 490 (10,5)
Todesfalls, nicht-tödlichen MI oder nicht-tödlichen
Schlaganfalls
Hazard Ratio vs. Plazebo (95,02%-KI)** 0,86 (0,74; 0,99)
p−Wert für Überlegenheit 0,0382
Kardiovaskuläre Todesfälle N (%) 137 (5,9) 172 (3,7)
Hazard Ratio vs. Plazebo (95%-KI) 0,62 (0,49; 0,77)
p-Wert <0,0001
Nicht-tödliche MI N (%) 121 (5,2) 213 (4,5)
Hazard Ratio vs. Plazebo (95%-KI) 0,87 (0,70; 1,09)
p−Wert 0,2189
Nicht-tödliche Schlaganfälle N (%) 60 (2,6) 150 (3,2)
Hazard Ratio vs. Plazebo (95%-KI) 1,24 (0,92; 1,67)
p−Wert 0,1638
Gesamtmortalität N (%) 194 (8,3) 269 (5,7)
Hazard Ratio vs. Plazebo (95%-KI) 0,68 (0,57; 0,82)
p-Wert <0,0001
Nicht-kardiovaskuläre Mortalität N (%) 57 (2,4) 97 (2,1)
Hazard Ratio vs. Plazebo (95%-KI) 0,84 (0,60; 1,16)
* d.h. Patienten, die mindestens eine Dosis der Studienmedikation erhalten hatten
** Da Daten der Studie in einer Interim-Analyse berücksichtigt wurden, gilt ein zweiseitiges 95,02-%-Konfidenzintervall, das einem p-Wert von kleiner 0,0498 für Signifikanz entspricht.
Abbildung 1: Zeit bis zum erstmaligen Auftreten eines Ereignisses des zusammengesetzten primären Endpunkts (kardiovaskulärer Tod/nicht-tödlicher MI/nicht-tödlicher Schlaganfall)
In einer randomisierten, plazebokontrollierten, wirkstoffkontrollierten Crossover-Studie an 30 gesunden Probanden wurde unter 25 mg bzw. 200 mg Empagliflozin kein Anstieg der QTc beobachtet.
Postprandialer Glukosewert (2-Stunden-Wert)
Die Behandlung mit Empagliflozin als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff führte nach 24 Wochen zu einer klinisch relevanten Abnahme des postprandialen 2-Stunden-Glukosewertes (Mahlzeittoleranztest) (Add-on-Therapie zu Metformin: Placebo +5,9 mg/dl [+0,33 mmol/l], Empagliflozin 10 mg: -46,0 mg/dl [-2,56 mmol/l]. Add-on-Therapie zu Metformin und einem Sulfonylharnstoff: Placebo -2,3 mg/dl [-0,13 mmol/l], Empagliflozin 10 mg: -35,7 mg/dl [1,98 mmol/l].
Patienten mit HbA1c-Ausgangswert ≥9%
In einer präspezifizierten Analyse von Patienten mit einem HbA1c-Ausgangswert ≥9,0%, führte die Behandlung mit Empagliflozin 10 mg als Zusatz zu Metformin zu einer statistisch signifikanten Reduktion des HbA1c in Woche 24 (korrigierte mittlere Veränderung gegenüber Baseline von -1,40% für Empagliflozin 10 mg und -0,44% für Placebo).
Körpergewicht
In einer präspezifizierten, gepoolten Analyse von 4 placebokontrollierten Studien führte die Behandlung mit Empagliflozin (68% aller Patienten erhielten Metformin als Basistherapie) nach 24 Woche zu einer Abnahme des Körpergewichts (-2,04 kg für Empagliflozin 10 mg und -0,24 kg für Placebo), die bis Woche 52 bestehen blieb (-1,96 kg für Empagliflozin 10 mg und -0,16 kg für Placebo).
Blutdruck
Die Wirksamkeit und Sicherheit von Empagliflozin wurde in einer 12-wöchigen doppelblinden, Placebokontrollierten Studie bei Patienten mit Typ 2 Diabetes mellitus und Bluthochdruck untersucht, die mit verschiedenen Antidiabetika und bis zu 2 Antihypertensiva behandelt wurden. Die Behandlung mit Empagliflozin einmal täglich führte zu einer statistisch signifikanten Verbesserung des HbA1c und des mit einem 24-Stunden-Monitoring gemessenen mittleren systolischen und diastolischen Blutdrucks (Tabelle 6). Die Behandlung mit Empagliflozin senkte den SBD und DBD im Sitzen.
Tabelle 6: Ergebnisse einer Placebokontrollierten Studie mit Empagliflozin an Patienten mit Typ 2 Diabetes mellitus und unkontrolliertem Blutdruck (Full Analysis Set) nach 12 Wochen (LOCF)
Placebo Empagliflozin10 mg Empagliflozin25 mg
N 271 276 276
HbA1c (%) in Woche 12
Baseline (Mittelwert) 7,90 7,87 7,92
Veränderung gegenüber Baseline1 0,03 -0,59 -0,62
Unterschied zu Placebo1(95% KI) -0,62* (-0,72, -0,52) -0,65* (-0,75, -0,55)
24-Stunden-SBD in Woche 12
Baseline (Mittelwert) 131,72 131,34 131,18
Veränderung gegenüber Baseline1 0,48 -2,95 -3,68
Unterschied zu Placebo1(95% KI) -3,44* (-4,78, -2,09) -4,16* (-5,50, -2,83)
24-Stunden-DBD in Woche 12
Baseline (Mittelwert) 75,16 75,13 74,64
Veränderung gegenüber Baseline1 0,32 -1,04 -1,40
Unterschied zu Placebo1(95% KI) -1,36** (-2,15, -0,56) -1,72* (-2,51, -0,93)
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p < 0,001
In einer präspezifizierten gepoolten Analyse von vier Placebokontrollierten Studien führte die Behandlung mit Empagliflozin in Woche 24 zu einer Senkung des systolischen Blutdrucks (Empagliflozin 10 mg: -3,9 mmHg) im Vergleich zu Placebo (-0,5 mmHg) und zu einer Senkung des diastolischen Blutdrucks (Empagliflozin 10 mg: -1,8 mmHg) im Vergleich zu Placebo (-0,5 mmHg); diese Verbesserungen blieben bis Woche 52 bestehen.
Laborparameter
Erhöhter Hämatokrit
In einer gepoolten Sicherheitsanalyse aller Studien mit Metformin als Basistherapie betrugen die mittleren Veränderungen des Hämatokrits gegenüber dem Ausgangswert 3,6% für Empagliflozin 10 mg und 4,0% für Empagliflozin 25 mg im Vergleich zu 0% für Plazebo. In der EMPA-REG-Outcome-Studie sanken die Hämatokritwerte nach einer Nachbeobachtungsphase von 30 Tagen nach Absetzen der Medikation auf die Ausgangswerte.
Erhöhte Serumlipide
In einer gepoolten Sicherheitsanalyse aller Studien mit Metformin als Basistherapie betrug der mittlere prozentuelle Anstieg gegenüber dem Ausgangswert für Empagliflozin 10 mg bzw. 25 mg im Vergleich zu Plazebo bei Gesamtcholesterin 5,0% bzw. 5,2% versus 3,7%; bei HDL-Cholesterin 4,6% bzw. 2,7% versus -0,5%; bei LDL-Cholesterin 9,1% bzw. 8,7% versus 7,8%; bei Triglyzeriden 5,4% bzw. 10,8% versus 12,1%.
Kinder und Jugendliche
Die klinische Wirksamkeit und Sicherheit von Empagliflozin 10 mg einmal täglich (mit einer möglichen Dosiserhöhung auf 25 mg einmal täglich) oder Linagliptin 5 mg einmal täglich wurde bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit Typ 2 Diabetes mellitus im Rahmen einer doppelblinden, randomisierten, placebokontrollierten Parallelgruppenstudie (DINAMO) über einen Zeitraum von 26 Wochen untersucht, mit einer doppelblinden sicherheitsbezogenen Verlängerungsphase der aktiven Behandlung zur Beurteilung der Sicherheit bis zu 52 Wochen.
Insgesamt 157 Patienten wurden entweder mit Empagliflozin (10 mg oder 25 mg; N = 52), Linagliptin (N = 52) oder Placebo (N = 53) behandelt. Zu den Hintergrundtherapien als Ergänzung zu diätetischen Massnahmen und körperlicher Aktivität gehörten Metformin allein (51 %), eine Kombination aus Metformin und Insulin (40,1 %), Insulin (3,2 %) oder aber es wurde keine Hintergrundtherapie verabreicht (5,7 %). Der mittlere HbA1c-Baselinewert lag bei 8,03 %. Die Studienpopulation umfasste 38,2 % männliche und 61,8 % weibliche Patienten bei einem Durchschnittsalter von 14,5 Jahren (Spanne: 10 bis 17 Jahre); 51,6 % waren mindestens 15 Jahre alt. Die Studienpopulation setzte sich ausserdem wie folgt zusammen: 49,7 % waren kaukasischer, 5,7 % asiatischer und 31,2 % afrikanischer/afroamerikanischer Herkunft. Der mittlere BMI betrug 36,04 kg/m², das mittlere Körpergewicht 99,92 kg. In die DINAMO-Studie wurden ausschliesslich Patienten mit einer eGFR ≥60 ml/min/1,73 m² aufgenommen.
Empagliflozin war Placebo hinsichtlich des primären Endpunkts – HbA1c-Reduktion nach 26 Wochen gegenüber Baseline – unabhängig von einer Rescue-Therapie oder einem Behandlungsabbruch, überlegen. Darüber hinaus führte die Behandlung mit Empagliflozin zu einer klinisch bedeutsamen FPG-Reduktion (Tabelle 7).
Tabelle 7: Ergebnisse einer 26-wöchigen, placebokontrollierten Studie zu Empagliflozin bei Kindern und Jugendlichen mit Typ 2 Diabetes mellitus (modifiziertes Intention-To-Treat-Set)
Placebo Empagliflozin (10 und 25 mg einmal täglich, gepoolt)
N 53 52
HbA1c (%)¹
Baseline (Mittelwert) 8,05 8,00
Veränderung gegenüber Baseline² 0,68 -0,17
Unterschied zu Placebo² (95%-KI) -0,84 (-1,50, -0,19)
p-Wert für Überlegenheit 0,0116
N 52 48
FPG (mg/dl) [mmol/l] 3,4
Baseline (Mittelwert) 158,6 [8,80] 154,4 [8,57]
Veränderung gegenüber Baseline² 15,7 [0,87] -19,5 [-1,08]
Unterschied zu Placebo² (95%-KI) -35,2 (-58,6, -11,7) [-1,95 (-3,25, -0,65)]
nominaler p-Wert 0,0035
¹ Mehrfachimputation mit 500 Iterationen für fehlende Daten
² Im Hinblick auf Baseline und Stratifizierung adjustierter Mittelwert
³ Last Observation Carried Forward (LOCF), einschliesslich Baseline-Werte
4 nicht im Hinblick auf statistische Signifikanz beurteilt; nicht Teil des sequenziellen Testverfahrens
PharmakokinetikJardiance Met
In Bioäquivalenzstudien mit gesunden Probanden erwiesen sich die Jardiance Met (Empagliflozin/Metforminhydrochlorid) 5 mg/500 mg, 5 mg/850 mg, 5 mg/1000 mg Kombinationstabletten als bioäquivalent zur Komedikation von Empagliflozin und Metformin als separate Tabletten in den entsprechenden Stärken.
Folgende Daten stammen aus Studien, die entweder mit Empagliflozin oder mit Metformin durchgeführt wurden.
Empagliflozin
Absorption
Die Pharmakokinetik von Empagliflozin wurde an gesunden Freiwilligen und T2DM-Patienten umfassend untersucht. Nach oraler Gabe wurde Empagliflozin schnell resorbiert, wobei die maximalen Plasmakonzentrationen (mediane tmax) 1,5 Stunden nach Einnahme der Dosis auftraten. Danach erfolgte eine biphasische Abnahme der Plasmakonzentrationen mit einer raschen Verteilungsphase und einer relativ langsamen terminalen Phase. Bei einmal täglicher (qd) Gabe von 10 mg Empagliflozin betrug die mittlere Plasma-AUC im Steady State 1870 nmol.h/l und die Cmax 259 nmol/l. Die systemische Exposition von Empagliflozin stieg im Bereich von 10mg-100mg dosisproportional an. Die Pharmakokinetik von Empagliflozin ist in Bezug auf die Zeit linear. Die Pharmakokinetik von Empagliflozin bei gesunden Probanden und Patienten mit Typ 2 Diabetes mellitus wies keine klinisch relevanten Unterschiede auf.
Die Pharmakokinetik von 5 mg Empagliflozin zweimal täglich und 10 mg Empagliflozin einmal täglich wurde bei gesunden Probanden verglichen. Die Gesamt-Exposition (AUCss) von Empagliflozin über 24 Stunden bei zweimal täglicher Gabe von 5 mg und einmal täglicher Gabe von 10 mg war vergleichbar. Wie erwartet, führte die zweimal tägliche Gabe von Empagliflozin 5 mg im Vergleich zur einmal täglichen Gabe von 10 mg Empagliflozin zu einer niedrigeren Cmax und höheren Talkonzentrationen (Cmin) von Empagliflozin im Plasma.
Die Gabe von 25 mg Empagliflozin nach Einnahme einer fett- und kalorienreichen Mahlzeit führte zu einer geringfügigen Abnahme der Bioverfügbarkeit; Die AUC nahm im Vergleich zum nüchternen Zustand um etwa 16% ab, die Cmax um etwa 37%. Der beobachtete Einfluss von Nahrung auf die Pharmakokinetik von Empagliflozin wurde als nicht klinisch relevant eingestuft und Empagliflozin kann mit oder ohne Nahrung eingenommen werden.
Distribution
Das scheinbare Verteilungsvolumen im Steady State wurde auf Grundlage einer populationspharmakokinetischen Analyse auf 73,8 l geschätzt. Nach oraler Verabreichung einer [14C]-Empagliflozin-Lösung an gesunde Probanden betrug die Erythrozytenpartitionierung etwa 36,8% und die Plasmaproteinbindung 86,2%.
Metabolismus
In einer Studie mit [14C]-markiertem Empagliflozin konnte der grösste Anteil der totalen Radioaktivität im Plasma unverändertem Empagliflozin zugeordnet werden.
Die häufigsten Metaboliten waren drei Glucuronidkonjugate (2-O-, 3-O- und 6-O-Glucuronid). Die systemische Exposition jedes Metaboliten betrug weniger als 10% der gesamten Radioaktivität im Plasma. Invitro-Studien deuten darauf hin, dass Empagliflozin beim Menschen primär über Glucuronidierung durch die Uridin-5'-diphosphat-Glucuronosyltransferasen UGT1A3, UGT1A8, UGT1A9 und UGT2B7 metabolisiert wird.
Elimination
Auf Grundlage der populationspharmakokinetischen Analyse wurde die apparente terminale Eliminationshalbwertszeit von Empagliflozin auf 12,4 Stunden geschätzt, die scheinbare orale Clearance betrug 10,6 l/h. Die Interindividualvariabilität der oralen Clearance von Empagliflozin betrug 39,1%. Bei einmal täglicher Dosierung von Empagliflozin wurden Steady-State-Plasmakonzentrationen mit der fünften Dosis erreicht. In Übereinstimmung mit der Halbwertszeit wurde im Steady State eine Akkumulation von bis zu 22% in Bezug auf die Plasma-AUC beobachtet. Nach oraler Verabreichung einer [14C]-Empagliflozin-Lösung an gesunde Probanden wurden etwa 41,2% der Radioaktivität in den Fäzes und 54,4% im Urin ausgeschieden. Der Hauptanteil der in den Fäzes wiedergefundenen wirkstoffbezogenen Radioaktivität (82,9%) und 43,5% der im Urin ausgeschiedenen Radioaktivität war unveränderte Muttersubstanz.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Bei Patienten mit leichter, mittelschwerer und schwerer Leberfunktionsstörung gemäss Child-Pugh-Klassifikation nahm die AUC von Empagliflozin im Vergleich zu Patienten mit normaler Leberfunktion um etwa 23%, 47% bzw. 75% und die Cmax um etwa 4%, 23% bzw. 48% zu. Auf Grundlage der pharmakokinetischen Daten ist für Patienten mit Leberfunktionsstörung keine Dosisanpassung erforderlich.
Nierenfunktionsstörungen
Bei Patienten mit leichter (eGFR: 60 - <90 ml/min/1,73 m2), mittelschwerer (eGFR: 30 - <60 ml/min/1,73 m2) und schwerer (eGFR: <30 ml/min/1,73 m2) Nierenfunktionsstörung und Patienten mit Nierenversagen/terminaler Niereninsuffizienz nahm die AUC von Empagliflozin im Vergleich zu Patienten mit normaler Nierenfunktion um etwa 18%, 20%, 66%, bzw. 48% zu. Die maximalen Plasmakonzentrationen von Empagliflozin waren bei Patienten mit mittelschwerer Nierenfunktionsstörung und Nierenversagen/terminaler Niereninsuffizienz und Patienten mit normaler Nierenfunktion vergleichbar. Die maximalen Plasmakonzentrationen von Empagliflozin waren bei Patienten mit leichter und schwerer Nierenfunktionsstörung im Vergleich zu Patienten mit normaler Nierenfunktion um annähernd 20% höher. In Übereinstimmung mit der Phase-I-Studie zeigte die populationspharmakokinetische Analyse, dass die Abnahme der eGFR mit einer Abnahme der scheinbaren oralen Clearance von Empagliflozin einherging und zu einem Anstieg der systemischen Exposition führte. Auf Grundlage der pharmakokinetischen Daten ist für Patienten mit Niereninsuffizienz keine Dosisanpassung erforderlich.
Body Mass Index (BMI)
Eine Dosisanpassung auf Grundlage des BMI ist nicht erforderlich. Auf Grundlage der populationspharmakokinetischen Analyse hat der Body Mass Index keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Empagliflozin.
Geschlecht
Eine geschlechtsspezifische Dosisanpassung ist nicht erforderlich. Auf Grundlage der populationspharmakokinetischen Analyse hat das Geschlecht keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Empagliflozin.
Ethnische Zugehörigkeit
Auf Grundlage der populationspharmakokinetischen Analyse wurde die AUC bei asiatischen Patienten mit einem BMI von 25 kg/m2 um 13,5% höher geschätzt als bei nichtasiatischen Patienten mit einem BMI von 25 kg/m2.
Ältere Patienten
Auf Grundlage der populationspharmakokinetischen Analyse hat das Alter keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Empagliflozin.
Kinder und Jugendliche
Die Pharmakokinetik und Pharmakodynamik einer Einzeldosis Empagliflozin 5 mg, 10 mg und 25 mg wurden bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit Typ 2 Diabetes mellitus untersucht. Die beobachtete Pharmakokinetik und das Pharmakokinetik-Pharmakodynamik-Verhältnis (Glukoseausscheidung im Urin) bei erwachsenen und pädiatrischen Patienten war nach Berücksichtigung signifikanter Kovariaten vergleichbar.
Die Pharmakokinetik und Pharmakodynamik (HbA1c-Veränderung gegenüber Baseline) von Empagliflozin 10 mg mit einer möglichen Dosiserhöhung auf 25 mg wurden bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit Typ 2 Diabetes mellitus untersucht. Die beobachtete Expositions-Wirkungs-Beziehung war bei Erwachsenen, Kindern und Jugendlichen im Allgemeinen vergleichbar. Die perorale Verabreichung von Empagliflozin führte zu einer Exposition innerhalb des bei erwachsenen Patienten beobachteten Bereichs. Die beobachteten geometrischen Mittelwerte für die Talkonzentration und die Konzentration 1,5 Stunden nach der Verabreichung im Steady-State betrugen 26,6 nmol/l bzw. 308 nmol/l unter Empagliflozin 10 mg einmal täglich und 67,0 nmol/l bzw. 525 nmol/l unter Empagliflozin 25 mg einmal täglich.
Metformin
Absorption
Nach oraler Anwendung von Metformin wird die Tmax nach 2,5 Stunden erreicht. Die absolute Bioverfügbarkeit einer 500 mg- oder 850 mg-Tablette Metforminhydrochlorid beträgt bei gesunden Probanden ca. 50-60%. Nach Einnahme einer oralen Dosis betrug die nichtresorbierte Fraktion, die in den Fäzes wiedergefunden wurde, 20-30%.
Nach oraler Einnahme einer Einzeldosis von 500-2500 mg wurde ein unterproportionaler Anstieg der Cmax beobachtet, was möglicherweise auf einem sättigbaren Mechanismus beruht. Bei Verwendung üblicher Metformin-Dosierungen werden im Plasma innerhalb von 24-48 Stunden steady-state-Spiegel erreicht. Diese sind i.d.R. geringer als 1 μg/ml. In kontrollierten klinischen Studien wurde festgestellt, dass Cmax, auch bei Verwendung von Maximaldosen, 4 μg/ml nicht übersteigt.
Nahrung verringert und verzögert die Absorption von Metformin. Bei Einnahme einer Dosis von 850 mg mit Nahrung wurde eine um 40% tiefere Cmax, eine um 25% verminderte AUC und eine um 35 Min. verlängerte Tmax beobachtet. Die klinische Relevanz dieser Veränderungen ist bislang noch unbekannt.
Distribution
Die Plasmaproteinbindung von Metformin ist vernachlässigbar. Metformin diffundiert zum Teil in die Erythrozyten. Die maximale Blutkonzentration ist geringer als die maximale Plasmakonzentration und wird ungefähr gleichzeitig erreicht. Die Erythrozyten repräsentieren wahrscheinlich ein sekundäres Verteilungskompartiment. Das durchschnittliche Verteilungsvolumen beträgt 63 l - 276 l.
Es ist nicht bekannt, ob Metformin die Plazentaschranke passiert und ob es in die Muttermilch gelangt.
Bei der Ratte gelangen geringe Mengen in die Muttermilch.
Metabolismus
Metformin wird beim Menschen nicht metabolisiert.
Elimination
Metformin wird unverändert im Urin ausgeschieden. Die renale Clearance beträgt >400 ml/min und ist somit etwa 3,5-fach höher als die Kreatinin-Clearance. Überwiegend wird es also durch aktive tubuläre Sekretion eliminiert. Die Plasmaeliminationshalbwertszeit nach oraler Verabreichung beträgt annähernd 6,5 Std. Gemessen im Vollblut beträgt die Halbwertzeit etwa 17,6 Stunden.
Bei normaler Nierenfunktion akkumuliert Metformin bei üblicher Dosierung (1500-2000 mg) nicht im Organismus.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nierenfunktion ist die renale Clearance proportional zur Kreatinin-Clearance oder GFR vermindert bzw. die Eliminationshalbwertszeit verlängert und es besteht ein Akkumulationsrisiko.
Präklinische DatenEmpagliflozin und Metformin
In einer 13wöchigen Kombinationsstudie mit Empagliflozin und Metformin an Ratten zur allgemeinen Toxizität wurde der NOAEL (No Observed Adverse Effect Level) bei 50/100 mg/kg/Tag Empagliflozin/Metformin auf Basis der Hypochlorämie beobachtet, d.h., nach Expositionen, die etwa dem 4-Fachen der klinischen Exposition für Empagliflozin und dem 2.1-Fachen der klinischen Exposition für Metformin auf Basis der AUC bei einer täglichen Dosis von 25 mg Empagliflozin bzw. 2000 mg Metformin entsprachen.
Reproduktionstoxizität
In einer embryofetalen Entwicklungsstudie an trächtigen Ratten [Wistar bzw. Crl:WI (Han)] wurden bei Expositionen, die etwa dem 14-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 25 mg Empagliflozin und dem 4-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 2000 mg Metformin entsprachen, keine teratogenen Wirkungen beobachtet, die auf die gleichzeitige Anwendung von Empagliflozin und Metformin zurückgeführt wurden. In einer Dosierung von 300/600 mg/kg/Tag Empagliflozin/Metformin in Kombination oder von 600 mg/kg/Tag Metformin allein, die dem 8-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 2000 mg Metformin entspricht, zeigte Metformin teratogene Wirkung.
Folgende Daten stammen aus Studien, die entweder mit Empagliflozin oder mit Metformin durchgeführt wurden.
Empagliflozin
In Studien zur allgemeinen Toxizität bei Nagern und Hunden wurden Anzeichen einer Toxizität nach Expositionen beobachtet, die zumindest dem 10-Fachen der klinischen Dosis von 25 mg entsprachen. Die Toxizität stimmte zumeist mit der sekundären pharmakologischen Wirkung in Zusammenhang mit der Ausscheidung von Zucker im Urin überein und umfasste Gewichts- und Körperfettverlust, erhöhte Nahrungsaufnahme, Diarrhoe, Dehydrierung, Abnahme der Serumglukose und Anstieg anderer Serum-Parameter, die auf einen verstärkten Proteinmetabolismus, Glukoneogenese und Elektrolytungleichgewicht hinweisen, Veränderungen des Urins (z.B. Polyurie und Glukosurie) und mikroskopische Veränderungen in der Niere (einschliesslich tubulärer Dilatation sowie Mineralisation der Tubuli und des Nierenbeckens).
Karzinogenität
Empagliflozin führte bei weiblichen Ratten bis zur höchsten Dosierung von 700 mg/kg/Tag (dies entspricht etwa dem 72-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 25 mg) zu keiner erhöhten Tumorinzidenz. Bei männlichen Ratten wurden bei einer Dosierung von 700 mg/kg/Tag (dies entspricht etwa dem 42-Fachen der klinischen Exposition bei einer Dosis von 25 mg) behandlungsbedingte gutartige proliferative Gefässläsionen (Hämangiome) der mesenterischen Lymphknoten festgestellt. Diese Tumore kommen bei Ratten häufig vor und sind für den Menschen wahrscheinlich nicht von Relevanz.
Empagliflozin führte bei weiblichen Mäusen bis zu einer Dosierung von 1000 mg/kg/Tag (dies entspricht etwa dem 62-Fachen der klinischen Exposition bei einer Dosis von 25 mg) zu keiner erhöhten Tumorinzidenz. Bei männlichen Mäusen, die Empagliflozin in einer Dosierung von 1000 mg/kg/Tag (dies entspricht etwa dem 45-Fachen der klinischen Exposition bei einer Dosis von 25 mg) erhielten, traten vermehrt Nierentumore auf. Der Wirkmechanismus, welcher der Entstehung dieser Tumoren zugrunde liegt, ist von der natürlichen Prädisposition der männlichen CD-1-Maus für Nierenerkrankungen sowie von einem Stoffwechselweg, welcher beim Menschen so nicht vorliegt, abhängig. Daher werden die bei männlichen CD-1-Mäusen beobachteten Nierentumore als für den Menschen wahrscheinlich nicht relevant eingestuft.
Genotoxizität
Empagliflozin ist nicht genotoxisch.
Reproduktionstoxizität
Während der Organogenese verabreichtes Empagliflozin war bei Ratten [Wistar bzw. Crl:WI (Han)] und Kaninchen in Dosen bis zu 300 mg/kg (dies entspricht etwa dem 48-Fachen bzw. dem 128-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 25 mg) nicht teratogen. Dosen von Empagliflozin, die bei der Ratte maternale Toxizität verursachten, führten nach Expositionen, die etwa dem 155-Fachen der klinischen Exposition bei einer Dosis von 25 mg entsprachen, auch zu Fehlbildungen (gekrümmte Extremitätenknochen). Dosen, die bei Kaninchen maternale Toxizität verursachten, führten bei einer Dosierung, die etwa dem 139-Fachen der klinischen Exposition bei einer Dosis von 25 mg entsprach, auch zu einem Anstieg der embryofetalen Letalität.
In prä- und postnatalen Toxizitätsstudien an Ratten wurde bei den Jungen bei einer maternalen Exposition, die etwa dem 4-Fachen der klinischen Exposition bei einer Dosis von 25 mg entsprach, eine reduzierte Gewichtszunahme beobachtet.
Bei einer Toxizitätsstudie mit Jungratten wurde in weiblichen und männlichen Tieren bei einer Gabe von Empagliflozin von Tag 21 bis Tag 90 nach der Geburt eine nichtschädliche minimale aber Dosis-abhängige und nicht reversible renale Mineralisierung der Tubuli ab einer Dosis von 10 mg/kg/Tag (entsprechend etwa dem 0.6-Fachen der klinischen Exposition bei einer Dosis von 25mg) beobachtet. Eine minimale bis leichte renal-tubuläre und pelvine Dilatation wurde nur bei 100 mg/kg/Tag beobachtet (entsprechend etwa dem 11fachen der klinischen Dosis von 25 mg), welche aber nach einer 13-wöchigen Regenerationsphase ohne Arzneimittelgabe nicht mehr feststellbar war.
Metformin
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität nach wiederholter Gabe, Genotoxizität (AmesTest, Genmutationstest, Chromosomenaberrationstest, Mikronucleustest) und Karzinogenität (bei Nagern in Dosierungen von bis zu 900 mg/kg/Tag (Ratte) bzw. 1'500 mg/kg/Tag (Maus)), lassen die präklinischen Daten keine besonderen Gefahren für die Anwendung am Menschen erkennen.
Reproduktionstoxizität
Metformin hat keinen Einfluss auf die Fertilität.
Allerdings war Metformin entweder in Kombination mit Empagliflozin bei einer Dosierung von 300/600 mg/kg/Tag Empagliflozin/Metformin oder allein ab einer Dosierung von 500 mg/kg/Tag bei Ratten [Wistar bzw. Crl:WI (Han)] teratogen (siehe oben "Empagliflozin und Metformin" ).
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit "EXP" bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Arzneimittel für Kinder unzugänglich aufbewahren.
Bei Raumtemperatur (15-25°C) lagern.
Zulassungsnummer65570 (Swissmedic)
PackungenFilmtabletten zu 5/500 mg: 60 und 180 [2x 90] (B)
Filmtabletten zu 5/850 mg: 60 und 180 [2x 90] (B)
Filmtabletten zu 5/1000 mg: 60 und 180 [2x 90] (B)
Filmtabletten zu 12.5/500 mg: 60 und 180 [2x 90] (B)
Filmtabletten zu 12.5/850 mg: 60 und 180 [2x 90] (B)
Filmtabletten zu 12.5/1000 mg: 60 und 180 [2x 90] (B)
ZulassungsinhaberinBoehringer Ingelheim (Schweiz) GmbH, Basel.
Stand der InformationDezember 2025
|

