| ||||||||||||||||
|
| Suchresultat - FI zu Lenalidomid Devatis, Hartkapseln |
| Fachinformation zu Lenalidomid Devatis, Hartkapseln: | Devatis AG |
Dosierung/AnwendungDie Behandlung muss von einem erfahrenen Hämatologen oder Onkologen begonnen und überwacht werden.
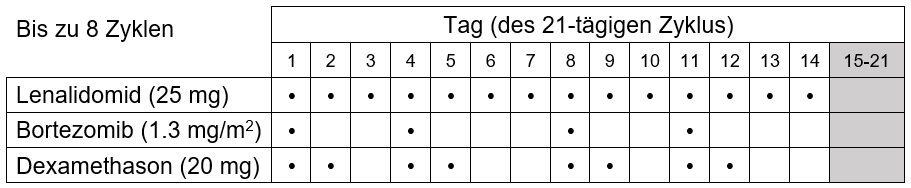
-Fortsetzung der Behandlung bei Patienten, die keine Stammzelltransplantation erhalten: Lenalidomid Devatis in Kombination mit Dexamethason bis zur Progression der Erkrankung Schritte zur Dosisreduktion
Lenalidomid
Initialdosis 25 mg
Dosisstufe -1 20 mg
Dosisstufe -2 15 mg
Dosisstufe -3 10 mg
Dosisstufe -4 5 mg
Dosisstufe -5 2,5 mg täglich oder 5 mg alle 48 h
Thrombozytopenie
Veränderung Thrombozytenzahl Empfohlene Vorgehensweise
Abfall auf <30 x 109/l Unterbrechung der Lenalidomid-Behandlung und wöchentliche
Überwachung des vollständigen Blutbildes
Wiederanstieg auf ≥50 x 109/l Fortsetzung von Lenalidomid auf der Dosisstufe -1
Bei jedem weiteren Abfall Unterbrechung der Lenalidomid-Behandlung Fortsetzung von
unter <30 x 109/l Wiederanstieg Lenalidomid auf der nächst niedrigeren Dosisstufe. Nicht unter
auf ≥50 x 109/l 2,5 mg einmal täglich dosieren.
Neutropenie Veränderung Neutrophilenzahl Empfohlene Vorgehensweise a Erster Abfall auf <0,5 x 109/l oder Unterbrechung der Lenalidomid-Behandlung und febrile Neutropenie (Fieber ≥38 °C; <1 x wöchentliche Überwachung des vollständigen Blutbildes 109/l) Wiederanstieg auf ≥1 x 109/l Fortsetzung von Lenalidomid auf der Dosisstufe -1 Bei jedem weiteren Abfall unter <0,5 x Unterbrechung der Lenalidomid-Behandlung Fortsetzung 109/l oder febrile Neutropenie von Lenalidomid auf der nächst niedrigeren Dosisstufe. Wiederanstieg auf ≥1 x 109/l Nicht unter 2,5 mg einmal täglich dosieren. a Wenn bei einer beliebigen Dosisstufe Neutropenie als einzige Toxizität auftritt, so wird nach Ermessen des Arztes, unter Beibehaltung der Dosisstufe von Lenalidomid, der Granulozytenkolonie stimulierende Faktor (G-CSF) gegeben. Schritte zur Dosisre
duktion
Initialdosis (10 mg) Falls Dosis erhöht (15 mg)a
Dosisstufe -1 5 mg einmal täglich, kontinuierlich 10 mg einmal täglich,
kontinuierlich
Dosisstufe -2 5 mg einmal täglich an Tagen 1-21 der 5 mg einmal täglich,
28-Tage-Zyklen kontinuierlich
Dosisstufe -3 Nicht zutreffend 5 mg einmal täglich an Tagen
1-21 der 28-Tage-Zyklen
An Tagen 1-21 der 28-Tage-Zyklen nicht
unter 5 mg einmal täglich dosieren
a Nach drei 28-Tage-Zyklen kontinuierlicher Erhaltungstherapie mit Lenalidomid Devatis kann die Dosis bei Verträglichkeit auf 15 mg oral einmal täglich erhöht werden. Thrombozytopenie
Veränderung Thrombozytenzahl Empfohlene Vorgehensweise
Abfall auf <30 x 109/l Unterbrechung der Lenalidomid-Behandlung und wöchentliche
Überwachung des vollständigen Blutbildes
Wiederanstieg auf ≥30 x 109/l Fortsetzung von Lenalidomid auf der Dosisstufe -1
Bei jedem weiteren Abfall Unterbrechung der Lenalidomid-Behandlung
unter <30 x 109/l
Wiederanstieg auf ≥30 x Fortsetzung von Lenalidomid auf der nächst niedrigeren Dosisstufe
109l/l
Neutropenie
Veränderung Neutrophilenzahl Empfohlene Vorgehensweisea
Abfall auf <0,5 x 109/l Unterbrechung der Lenalidomid-Behandlung und wöchentliche
Überwachung des vollständigen Blutbildes
Wiederanstieg auf ≥0,5 x 109/l Fortsetzung von Lenalidomid auf der Dosisstufe -1
Bei jedem weiteren Abfall Unterbrechung der Lenalidomid-Behandlung
unter <0,5 x 109/l
Wiederanstieg auf ≥0,5 x 109/l Fortsetzung von Lenalidomid auf der nächst niedrigeren Dosisstufe
a Wenn bei einer beliebigen Dosisstufe Neutropenie als einzige Toxizität auftritt, so wird nach Ermessen des Arztes, unter Beibehaltung der Dosisstufe von Lenalidomid, der Granulozytenkolonie stimulierende Faktor (G-CSF) gegeben. Schritte zur Dosisreduktion
Lenalidomid Dexamethason
Initialdosis 25 mg 40 mg
Dosisstufe -1 20 mg 20 mg
Dosisstufe -2 15 mg 12 mg
Dosisstufe -3 10 mg 8 mg
Dosisstufe -4 5 mg 4 mg
Dosisstufe -5 2,5 mg täglich oder 5 mg alle 48 h Nicht zutreffend
Thrombozytopenie
Veränderung Thromboz Empfohlene Vorgehensweise
ytenzahl
Abfall auf <25 x Unterbrechung der Lenalidomid-Behandlung für den Rest des Zyklusa
109/l
Wiederanstieg auf Fortsetzung von Lenalidomid mit einer 5 mg niedrigeren Dosis als die vorige
≥50 x 109/l Dosis. Nach einer Dosis von 5 mg Fortsetzung von Lenalidomid mit einer Dosis
von 2,5 mg täglich oder 5 mg alle 48 Stunden. Keine Dosis darf unter 2,5 mg
täglich oder 5 mg alle 48 Stunden liegen.
ª Bei Auftreten einer dosislimitierenden Toxizität (DLT) an > Tag 15 eines Zyklus wird die Lenalidomid-Behandlung mindestens für den Rest des jeweiligen 28-Tage-Zyklus unterbrochen. Neutropenie
Veränderung Neutrophilenzahl Empfohlene Vorgehensweisea
Erster Abfall auf <0,5 x 109/l oder febrile Unterbrechung der Lenalidomid-Behandlung
Neutropenie (Fieber ≥38 °C; <1 x 109/l) Wiederanstieg Fortsetzung von Lenalidomid mit der
auf ≥1 x 109/l bei Neutropenie als einzige beobachtete Initialdosis einmal täglich
Toxizität
Wiederanstieg auf ≥0,5 x 109/l bei Beobachtung anderer Fortsetzung von Lenalidomid auf der
dosisabhängiger hämatologischer Toxizitäten ausser Dosisstufe -1 einmal täglich
Neutropenie
Bei jedem weiteren Abfall unter <0,5 x 109/l Unterbrechung der Lenalidomid-Behandlung
Wiederanstieg auf ≥0,5 x 109/l Fortsetzung von Lenalidomid auf der
nächst niedrigeren Dosisstufe einmal
täglich.
a Wenn bei einer beliebigen Dosisstufe Neutropenie als einzige Toxizität auftritt, so wird nach Ermessen des Arztes, unter Beibehaltung der Dosisstufe von Lenalidomid, der Granulozytenkolonie stimulierende Faktor (G-CSF) gegeben. Schritte zur Dosisreduktion
Lenalidomid Melphalan Prednison
Initialdosis 10 mg 0,18 mg/kg 2 mg/kg
Dosisstufe -1 7,5 mg täglich oder 15 mg alle 48 h 0,14 mg/kg 1 mg/kg
Dosisstufe -2 5 mg 0,10 mg/kg 0,5 mg/kg
Dosisstufe -3 2,5 mg täglich oder 5 mg alle 48 h Nicht zutreffend 0,25 mg/kg
Thrombozytopenie Veränderung Thrombozytenzahl Empfohlene Vorgehensweise Erster Abfall auf <25 x 109/l Unterbrechung der Lenalidomid-Behandlung Fortsetzung von Wiederanstieg auf ≥25 x 109/l Lenalidomid und Melphalan auf der Dosisstufe -1 Bei jedem weiteren Abfall unter Unterbrechung der Lenalidomid-Behandlung Fortsetzung von 30 x 109/l Wiederanstieg auf Lenalidomid auf der nächst niedrigeren Dosisstufe (Dosisstufe -2 ≥30 x 109/l oder -3) einmal täglich. Neutropenie
Veränderung Neutrophilenzahl Empfohlene Vorgehensweisea
Erster Abfall auf <0,5 x 109/l Wiederanstieg Unterbrechung der Lenalidomid-Behandlung
auf ≥0,5 x 109/l bei Neutropenie als einzige Fortsetzung von Lenalidomid mit der Initialdosis
beobachtete Toxizität einmal täglich
Wiederanstieg auf ≥0,5 x 109/l bei Beobachtung Fortsetzung von Lenalidomid auf der Dosisstufe -1
anderer dosisabhängiger hämatologischer einmal täglich
Toxizitäten ausser Neutropenie
Bei jedem weiteren Abfall unter <0,5 x 109/l Unterbrechung der Lenalidomid-Behandlung
Wiederanstieg auf ≥0,5 x 109/l Fortsetzung von Lenalidomid auf der nächst
niedrigeren Dosisstufe einmal täglich.
a Wenn bei einer beliebigen Dosisstufe Neutropenie als einzige Toxizität auftritt, so wird nach Ermessen des Arztes, unter Beibehaltung der Dosisstufe von Lenalidomid, der Granulozytenkolonie stimulierende Faktor (G-CSF) gegeben. Schritte zur Dosisredukti
on
Lenalidomid
Initialdosisa 20 mg einmal täglich an den Tagen 1-21 alle 28 Tage
Dosisstufe -1 15 mg einmal täglich an den Tagen 1-21 alle 28 Tage
Dosisstufe -2 10 mg einmal täglich an den Tagen 1-21 alle 28 Tage
Dosisstufe -3 5 mg einmal täglich an den Tagen 1-21 alle 28 Tage
Dosisstufe -4 b 2,5 mg einmal täglich an den Tagen 1-21 alle 28 Tage oder 5 mg alle 48
Stunden
a Für Initialdosis bei Patienten mit Nierenfunktionsstörungen siehe Abschnitt unten. Thrombozytopenie
Veränderung Thromboz Empfohlene Vorgehensweise
ytenzahl
Erster Abfall auf Lenalidomid-Behandlung unterbrechen und vollständiges Blutbild wöchentlich
<50 x 109/l Wiederan bestimmen Wiederaufnahme von Lenalidomid auf Dosisstufe -1 Tag 1-21 des
stieg auf ≥50 x 28-tägigen Zyklus.)
109/l
Bei jedem weiteren Lenalidomid-Behandlung unterbrechen und vollständiges Blutbild wöchentlich
Abfall <50 x 109/l kontrollieren. Wiederaufnahme von Lenalidomid auf der nächst niedrigeren
Wiederanstieg auf Dosisstufe (Dosisstufe -2 oder -3 einmal täglich). Nicht niedriger als
≥50 x 109/l Dosisstufe -3 dosieren. Wenn die Initialdosis 10 mga war, nicht niedriger als
Dosisstufe -4 dosieren.
a siehe Abschnitt "Patienten mit Nierenfunktionsstörungen" Neutropenie
Veränderung Neutrophilenzahl Empfohlene Vorgehensweisea
Erster Abfall auf <1,0 x 109/l für Unterbrechung der Lenalidomid-Behandlung und Kontrolle des
mindestens 7 Tage ODER Abfall auf vollständigen Blutbildes mindestens alle 7 Tage
<1,0 x 109/l in Verbindung mit Fieber
≥38,5 °C) ODER Abfall auf <0,5 x 109/l
Wiederanstieg auf ≥1,0 x 109/l Wiederaufnahme von Lenalidomid auf der nächst niedrigeren
Dosisstufe (Dosisstufe -1)
Bei jedem weiteren Abfall auf unter Unterbrechung der Lenalidomid-Behandlung und Erstellen
1,0 x 109/l für mindestens 7 Tage eines vollständigen Blutbildes mindestens alle 7 Tage
oder einem Abfall auf <1,0 x 109/l Wiederaufnahme von Lenalidomid auf der nächst niedrigeren
verbunden mit Fieber (Körpertemperatur Dosisstufe (Dosisstufe -2 oder -3). Nicht niedriger als
≥38,5 °C) oder Abfall auf <0,5 x Dosisstufe -3 dosieren. Wenn die Initialdosis 10 mgb war,
109/l Wiederanstieg auf ≥0,5 x 109/l nicht niedriger als Dosisstufe -4 dosieren.
ª Wenn bei einer beliebigen Dosisstufe Neutropenie als einzige Toxizität auftritt, so wird nach Ermessen des Arztes, unter Beibehaltung der Dosisstufe von Lenalidomid, der Granulozytenkolonie stimulierende Faktor (G-CSF) gegeben. Nierenfunktion (ClCr) Dosisanpassung
Initiale Dosis 25 mg Initiale Dosis 20 mg Initiale Dosis 10 mg
Normale Nierenfunktion 25 mg täglich 20 mg täglich 10 mg täglich
/Milde Niereninsuffizi
enz (ClCr ≥60 ml/min)
Mässige Niereninsuffiz 10 mga täglich 10 mgc täglich 5 mg täglich
ienz (30≤ ClCr<60
ml/min)
Schwere Niereninsuffiz 7,5 mg täglich oder 15 Keine Daten verfügba 2,5 mg täglich oder 5 mg
ienz (ClCr <30 mgb alle 48 Stunden r alle 48 Stunden
ml/min, keine Dialyse
nötig)
Niereninsuffizienz im 5 mg täglich; An Keine Daten verfügba 2,5 mg täglich oder 5 mg
Endstadium (ClCr <30 Dialysetagen ist die r dreimal wöchentlich; An
ml/min, Dialyse nötig) Dosis nach der Dialyse zu Dialysetagen ist die
verabreichen Dosis nach der Dialyse zu
verabreichen
a Die Dosis kann nach 2 Zyklen auf 15 mg täglich gesteigert werden, falls der Patient nicht auf die Behandlung anspricht und das Medikament verträgt. | |
| ||||||||||||
|
|