ZusammensetzungWirkstoffe
Difelikefalin (als Difelikefalin-Acetat).
Hilfsstoffe
Essigsäure (zur pH-Einstellung), Natriumacetat-Trihydrat (zur pH-Einstellung), Natriumchlorid, Wasser für Injektionszwecke. Enthält insgesamt ca. 3.3 mg Natrium pro ml.
Indikationen/AnwendungsmöglichkeitenKapruvia ist zur Behandlung von mittelschwerem bis schwerem Pruritus im Zusammenhang mit chronischen Nierenerkrankungen bei erwachsenen Patienten unter Hämodialyse indiziert.
Dosierung/AnwendungÜbliche Dosierung
Die empfohlene Dosis von Difelikefalin beträgt 0,5 Mikrogramm/kg Trockenkörpergewicht (d. h. das Zielgewicht nach der Dialyse) und ist dreimal pro Woche durch intravenöse Bolusinjektion zu verabreichen. Das benötigte Gesamtdosisvolumen (ml) aus der Durchstechflasche ist wie folgt zu berechnen: 0,01 x Trockenkörpergewicht (kg) gemäss ärztlicher Verordnung, gerundet auf das nächstgelegene Zehntel (0,1 ml). Bei Patienten mit einem Trockengewicht von 195 kg oder mehr beträgt die empfohlene Dosis 100 Mikrogramm (2 ml). Die empfohlenen Dosen sind in der folgenden Tabelle aufgeführt:
|
Gewichtsbereich
(Trockenkörpergewicht in kg)
|
Dosis*
(ml)
| |
40 - 44
|
0.4
| |
45 - 54
|
0.5
| |
55 - 64
|
0.6
| |
65 - 74
|
0.7
| |
75 - 84
|
0.8
| |
85 - 94
|
0.9
| |
95 - 104
|
1.0
| |
105 - 114
|
1.1
| |
115 - 124
|
1.2
| |
125 - 134
|
1.3
| |
135 - 144
|
1.4
| |
145 - 154
|
1.5
| |
155 - 164
|
1.6
| |
165 - 174
|
1.7
| |
175 - 184
|
1.8
| |
185 - 194
|
1.9
| |
> 195
|
2.0
|
* Wenn eine Dosis von über 1 ml erforderlich ist, dann ist mehr als 1 Durchstechflasche zu verwenden.
Ausgelassene Dosen
Wenn eine regulär geplante Hämodialysebehandlung ausgelassen wurde, sollte Kapruvia bei der nächsten Hämodialysebehandlung in der üblichen Dosis verabreicht werden.
Zusätzliche Behandlung
Wenn eine 4. Hämodialysebehandlung in der gleichen Woche durchgeführt wird, sollte Kapruvia nach der Hämodialyse entsprechend der empfohlenen Dosis verabreicht werden. Es sollten nicht mehr als 4 Dosen pro Woche verabreicht werden, auch wenn die Anzahl der Hämodialysebehandlungen in einer Woche 4 übersteigt. Es ist unwahrscheinlich, dass eine 4. Dosis Kapruvia zu einer sicherheitsbedenklichen Akkumulation von Difelikefalin führt, da der Grossteil des verbleibenden Difelikefalins aus der vorherigen Behandlung durch die Hämodialyse ausgeschieden wird. Die Sicherheit und Wirksamkeit einer 4. Dosis ist jedoch aufgrund unzureichender Daten nicht vollständig erwiesen.
Patienten mit unvollständiger Hämodialysebehandlung
Bei Hämodialysebehandlungen, die weniger als eine Stunde dauern, sollte die Verabreichung von Difelikefalin bis zur nächsten Hämodialysebehandlung ausgesetzt werden.
Nach der Verabreichung von Difelikefalin bei Hämodialysepatienten wird vor der nächsten Hämodialysebehandlung bis zu 70 % aus dem Körper eliminiert. Verbleibende Difelikefalin-Plasmakonzentrationen zum Zeitpunkt der nächsten Hämodialyse werden innerhalb von einer Stunde Hämodialyse um ungefähr 40-50 % reduziert.
Ältere Personen
Die Dosierungsempfehlungen für ältere Patienten sind die gleichen wie für erwachsene Patienten.
Patienten mit Leberfunktionsstörung
Bei Patienten mit leichter und mässiger Leberfunktionsstörung ist keine Dosisanpassung erforderlich (siehe Abschnitt «Pharmakokinetik»). Die Anwendung von Difelikefalin bei Patienten mit schwerer Leberfunktionsstörung wurde bisher nicht untersucht und die Anwendung bei dieser Patientenpopulation wird daher nicht empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Kapruvia bei Kindern und Jugendlichen im Alter von 0 – 17 Jahren sind bisher noch nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Kapruvia sollte nicht verdünnt und nicht mit anderen Arzneimitteln gemischt werden.
Kapruvia wird 3-mal wöchentlich durch intravenöse Bolusinjektion über den venösen Zugang des Dialysekreislaufs am Ende der Hämodialysebehandlung während oder nach der Rückführung verabreicht.
Bei Verabreichung nach Rückführung sollten nach der Injektion von Kapruvia mindestens 10 ml Natriumchloridlösung zu 9 mg/ml (0,9%) als Rückführungsvolumen verabreicht werden. Wenn die Dosis während der Rückführung verabreicht wird, ist keine zusätzliche Natriumchloridlösung zu 9 mg/ml (0,9%) zum Spülen der Leitung erforderlich.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der anderen Inhaltsstoffe (siehe „Zusammensetzung“).
Warnhinweise und VorsichtsmassnahmenHyperkaliämie
Hyperkaliämie tritt häufig bei Patienten mit chronischer Nierenerkrankung unter Hämodialyse auf. In den placebokontrollierten klinischen Studien wurde bei den mit Difelikefalin behandelten Patienten (4,7 %; 20/424 Patienten) im Vergleich zu Placebo (3,5 %; 15/424 Patienten) eine zahlenmässig höhere Inzidenz unerwünschter Ereignisse von Hyperkaliämie berichtet. Es wurde kein kausaler Zusammenhang festgestellt. Eine regelmässige Überwachung der Kaliumwerte wird empfohlen.
Herzinsuffizienz und Vorhofflimmern
Difelikefalin wurde bei Patienten mit Herzinsuffizienz der New York Heart Association-Klasse IV nicht untersucht. In den Schlüsselstudien wurde bei den mit Difelikefalin behandelten Patienten im Vergleich zu Placebo ein geringfügiges numerisches Ungleichgewicht bei Ereignissen von Herzinsuffizienz und Vorhofflimmern beobachtet, insbesondere bei Patienten mit Vorhofflimmern in der Krankengeschichte, die ihre Vorhofflimmern-Behandlung abbrachen oder aussetzten. Es wurde kein kausaler Zusammenhang festgestellt.
Patienten mit einer Störung der Blut-Hirn-Schranke
Difelikefalin ist ein Kappa-Opioidrezeptor-Agonist mit eingeschränktem Zugang zum Zentralnervensystem (ZNS). Die Integrität der Blut-Hirn-Schranke (BHS) ist wichtig, um die Aufnahme von Difelikefalin in das ZNS zu minimieren (siehe "Eigenschaften/Wirkungen"). Bei Patienten mit klinisch bedeutsamen Störungen der BHS (z. B. primäre bösartige Hirntumoren, ZNS-Metastasen oder andere entzündliche Erkrankungen, aktive Multiple Sklerose, fortgeschrittene Alzheimer-Erkrankung) kann ein Risiko für den Eintritt von Difelikefalin in das ZNS bestehen. Kapruvia sollte solchen Patienten mit Vorsicht verordnet werden, unter Berücksichtigung ihres individuellen Nutzen-Risiko-Verhältnisses und unter Beobachtung hinsichtlich möglicher Auswirkungen auf das ZNS.
Schwindelgefühl und Somnolenz
Bei mit Difelikefalin behandelten Patienten sind Schwindelgefühl und Somnolenz aufgetreten. Diese Symptome können im Laufe der Zeit bei fortgesetzter Behandlung nachlassen (siehe "Unerwünschte Wirkungen"). Die gleichzeitige Anwendung von sedierenden Antihistaminika, Opioid-Analgetika oder anderen ZNS-Depressiva kann die Wahrscheinlichkeit dieser Nebenwirkungen erhöhen und sollte während der Behandlung mit Difelikefalin mit Vorsicht erfolgen (siehe "Interaktionen").
Im Vergleich zu Placebo war die Inzidenz von Somnolenz höher bei mit Difelikefalin behandelten Patienten ab 65 Jahren (7,0 %) als bei mit Difelikefalin behandelten Patienten unter 65 Jahren (2,8 %).
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Durchstechflasche, d. h. es ist nahezu „natriumfrei“.
InteraktionenEs wurden keine klinischen Studien zu Wechselwirkungen durchgeführt.
Difelikefalin ist weder ein Substrat von CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6 oder CYP3A4 noch ein Inhibitor von CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 oder CYP3A4/5 und birgt ein minimales bis kein Potenzial zur Induktion von humanem CYP1A2, CYP2B6 oder CYP3A. Es ist auch kein Inhibitor von glucuronidierenden Enzymen (UGT1A3, UGT1A9 oder UGT2B7).
Darüber hinaus ist Difelikefalin kein Inhibitor von BCRP, BSEP, LAT1, MATE1, MATE2-K, MRP2, OAT1, OAT3, OATP1A2, OATP1B1, OATP1B3, OCT1, OCT2, OCT3, P-Glykoprotein, PEPT1 oder PEPT2 und kein Substrat von ASBT, BCRP, BSEP, LAT1, MATE1, MATE2-K, MRP2, OAT1, OAT2, OAT3, OATP1A2, OATP1B1, OATP1B3, OATP2B1, OCT1, OCT2, OCT3, OCTN1, OCTN2, OSTαβ, P-Glykoprotein, PEPT1 oder PEPT2.
Demnach sind Wechselwirkungen von Difelikefalin mit anderen Arzneimitteln unwahrscheinlich.
Die gleichzeitige Anwendung von Arzneimittel wie etwa sedierenden Antihistaminika, Opioid-Analgetika oder anderen ZNS-Depressiva (z. B. Clonidin, Ondansetron, Gabapentin, Pregabalin, Zolpidem, Alprazolam, Sertralin, Trazodon) kann die Wahrscheinlichkeit von Schwindelgefühl und Somnolenz erhöhen (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Unerwünschte Wirkungen").
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine oder nur begrenzte Daten über die Anwendung von Difelikefalin bei schwangeren Frauen vor. Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Wirkungen in Bezug auf eine Reproduktionstoxizität schliessen (siehe “Präklinische Daten“).
Vorsichtshalber sollte Kapruvia nicht während der Schwangerschaft angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Difelikefalin in die Muttermilch übergeht. Tierexperimentelle Studien weisen auf einen Übertritt von Difelikefalin in die Muttermilch hin. Ein Risiko für Neugeborene/Säuglinge kann nicht ausgeschlossen werden.
Es ist unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Therapie für die Mutter zu entscheiden, ob auf die Therapie verzichtet, das Stillen unterbrochen, oder die Therapie mit Kapruvia abgebrochen werden soll.
Fertilität
Es liegen keine Daten zur Wirkung von Kapruvia auf die Fertilität beim Menschen vor. In Studien mit Difelikefalin an Ratten wurde keine Beeinträchtigung der Paarungsfähigkeit oder Fertilität festgestellt (siehe “Präklinische Daten“).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenKapruvia hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Bei Patienten, die Difelikefalin erhalten, wurde von Somnolenz und/oder Schwindelgefühl berichtet (siehe "Unerwünschte Wirkungen"). Patienten sollten hinsichtlich des Führens eines Fahrzeugs oder des Bedienens von Maschinen zur Vorsicht geraten werden, bis die Auswirkung von Difelikefalin auf die Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen bekannt ist. Somnolenz trat innerhalb der ersten 3 Behandlungswochen auf und klang bei fortgesetzter Behandlung tendenziell ab. Schwindelgefühl trat innerhalb der ersten 9 Behandlungswochen auf und war im Allgemeinen vorübergehend.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
In placebokontrollierten und unkontrollierten klinischen Studien der Phase 3 trat bei ungefähr 6,6 % der Patienten während der Behandlung mit Difelikefalin mindestens eine Nebenwirkung auf. Die häufigsten Nebenwirkungen waren Somnolenz (1,1 %), Schwindelgefühl (0,9 %), Parästhesie (einschliesslich Hypästhesie, oraler Parästhesie und oraler Hypästhesie) (1,1 %), Kopfschmerzen (0,6 %), Übelkeit (0,7 %), Erbrechen (0,7 %), Durchfall (0,2 %) und Veränderungen des Gemütszustands (einschliesslich Verwirrtheitszustand) (0,3 %). Die meisten Vorfälle waren leicht oder mittelschwer, hatten keine schädlichen Folgen und klangen während des weiteren Verlaufs der Behandlung ab. Kein Ereignis war schwerwiegend, und die Inzidenz von Ereignissen, die zu einem Behandlungsabbruch führten, betrug ≤ 0,5 % für jede der oben aufgeführten Nebenwirkungen.
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
„sehr häufig“ (≥1/10)
„häufig“ (≥1/100, <1/10),
„gelegentlich“ (≥1/1‘000, <1/100)
„selten“ (≥1/10‘000, <1/1‘000)
„sehr selten“ (<1/10‘000)
Nebenwirkungen, die bei der Anwendung von Kapruvia in klinischen Studien bei der Zieldosis von 0,5 Mikrogramm/kg in diesen Patienten (n = 1’306) berichtet wurden, sind in der Tabelle 1 aufgeführt.
Innerhalb jeder Häufigkeitskategorie sind die Nebenwirkungen nach abnehmender Schwere aufgeführt.
Tabelle 1: Nebenwirkungen, die in Zusammenhang mit der Behandlung mit Kapruvia bei Hämodialyse-Patienten stehen
|
MedDRA-Systemorganklasse
|
Häufig
|
Gelegentlich
| |
Erkrankungen des Nervensystems
|
Somnolenz
Parästhesie
|
Schwindel; Kopfschmerzen
| |
Erkrankungen des Gastrointestinaltrakts
|
|
Erbrechen, Übelkeit; Diarrhö
| |
Psychiatrische Erkrankungen
|
|
Veränderungen des Gemütszustandes1
|
1 Veränderungen des Gemütszustandes umfassten die von MedDRA bevorzugten Begriffe «Verwirrtheitszustand» und «Veränderungen des Gemütszustandes».
Beschreibung ausgewählter Nebenwirkungen
Somnolenz
Über Somnolenz als behandlungsbedingtes unerwünschtes Ereignis wurde bei 2,2 % der Studienteilnehmer berichtet, die für Difelikefalin randomisiert wurden. Die überwiegende Mehrzahl dieser Ereignisse war leicht oder mittelschwer. Bei 0,3 % der Patienten führte Somnolenz zum Abbruch der Behandlung mit Difelikefalin. Über Somnolenz wurde bei < 0,1 % der mit Difelikefalin behandelten Patienten als schwerwiegendes unerwünschtes Ereignis berichtet. Bei 1,1 % der Patienten wurde berichtet, dass die Somnolenz in einem kausalen Zusammenhang mit der Difelikefalin-Behandlung stand. Die Somnolenz trat innerhalb der ersten 3 Behandlungswochen auf und klang bei fortgesetzter Behandlung tendenziell ab.
Die Wahrscheinlichkeit von Somnolenz kann zunehmen, wenn Difelikefalin gleichzeitig mit anderen Arzneimitteln angewendet wird (siehe “Warnhinweise und Vorsichtsmassnahmen”).
Schwindelgefühl
Über Schwindelgefühl als behandlungsbedingtes unerwünschtes Ereignis wurde bei 7,9 % der Patienten berichtet, die für Difelikefalin randomisiert wurden. Die überwiegende Mehrzahl dieser Ereignisse war leicht oder mittelschwer. Bei 0,5 % der Patienten führte das Schwindelgefühl zum Abbruch der Behandlung mit Difelikefalin. Über Schwindelgefühl als schwerwiegendes unerwünschtes Ereignis wurde bei 0,5 % der mit Difelikefalin behandelten Patienten berichtet. Bei 0,9 % der Patienten wurde berichtet, dass das Schwindelgefühl in einem kausalen Zusammenhang mit der Difelikefalin-Behandlung stand. Das Schwindelgefühl trat innerhalb der ersten 9 Behandlungswochen auf und war im Allgemeinen vorübergehend.
Die Wahrscheinlichkeit von Schwindelgefühl kann zunehmen, wenn Difelikefalin gleichzeitig mit anderen Arzneimitteln angewendet wird (siehe “Warnhinweise und Vorsichtsmassnahmen”).
Veränderung des Gemütszustands
Über eine Veränderung des Gemütszustands (einschliesslich eines Verwirrtheitszustands) als behandlungsbedingtes unerwünschtes Ereignis wurde bei 4,4 % der Patienten berichtet, die für Difelikefalin randomisiert wurden.
Die Mehrzahl dieser Ereignisse war leicht oder mittelschwer. Bei weniger als 0,2 % der Patienten führten Veränderungen des Gemütszustands zum Abbruch der Behandlung mit Difelikefalin.
Über Veränderungen des Gemütszustands wurden bei 2,2 % der mit Difelikefalin behandelten Patienten als schwerwiegendes unerwünschtes Ereignis berichtet. Bei 0,3 % der Patienten wurde berichtet, dass Veränderungen des Gemütszustands in einem kausalen Zusammenhang mit der Difelikefalin-Behandlung standen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIn klinischen Studien wurden Einzeldosen von Difelikefalin bis zum 12-fachen und Mehrfachdosen von Difelikefalin bis zum 5-fachen der klinischen Dosis von 0,5 Mikrogramm/kg an Hämodialyse-Patienten verabreicht. Es wurde eine dosisabhängige Zunahme von Nebenwirkungen, einschliesslich Schwindel, Somnolenz, Veränderungen des Gemütszustandes, Parästhesie, Ermüdung, Bluthochdruck und Erbrechen, beobachtet.
Im Falle einer Überdosierung ist je nach klinischem Zustand des Patienten die entsprechende medizinische Versorgung sicherzustellen. Eine 4-stündige Hämodialyse unter Verwendung eines Hochflussdialysators entfernte Difelikefalin zu etwa 70-80 % aus dem Plasma und Difelikefalin war am Ende von zwei Dialysezyklen nicht mehr im Plasma nachweisbar.
Eigenschaften/WirkungenATC-Code
ATC-Code: V03AX04
Wirkungsmechanismus
Difelikefalin ist ein selektiver Kappa-Opioidrezeptor-Agonist mit geringer ZNS-Gängigkeit.
Opioidrezeptoren sind dafür bekannt, dass sie Juckreizsignale und den Entzündungsprozess modulieren, wobei eine Aktivierung der Kappa-Opioidrezeptoren den Juckreiz reduziert und immunmodulatorische Effekte auslöst.
Pharmakodynamik
Das Expositions-Wirkungs-Verhältnis von Difelikefalin und der zeitliche Verlauf des pharmakodynamischen Ansprechens sind nicht bekannt.
Einfluss auf das Elektrokardiogramm
Bei einer Dosierung mit dem 6fachen der empfohlenen Dosis kommt es unter Difelikefalin zu keiner klinisch signifikanten Verlängerung des QTc-Intervalls.
Klinische Wirksamkeit
Placebo-Kontrollierte Studien
In zwei zulassungsrelevanten klinischen Phase III-Studien mit ähnlichem doppelblinden, randomisierten, Placebokontrollierten Design (KALM 1 und KALM 2) erhielten chronisch nierenkranke Hämodialyse-Patienten mit mittelschwerem bis schwerem Pruritus 12 Wochen lang entweder das Placebo oder 0,5 Mikrogramm/kg Difelikefalin intravenös 3-mal wöchentlich nach der Hämodialyse. Bei Patienten, bei denen in einer Woche eine zusätzliche Dialyse durchgeführt wurde, waren maximal 4 Dosen erlaubt. An diesem doppelblinden Behandlungsabschnitt schloss sich eine 52-wöchige offene Verlängerungsstudie mit ausschliesslich aktiver Behandlung an. Der primäre Endpunkt in beiden Studien war der Prozentsatz der Patienten, die nach 12 Wochen eine Reduktion um mindestens 3 Punkte auf der Worst Itching Numerical Rating Scale (Die WI-NRS-Werte liegen zwischen 0 und 10, wobei höhere Werte für eine stärkere Intensität des Juckreizes stehen) gegenüber dem Ausgangswert erreichten. Die wichtigsten sekundären Endpunkte, die in beiden Studien übereinstimmten, waren der Prozentsatz der Patienten mit einer Verbesserung des WI-NRS um mindestens 4 Punkten nach 12 Wochen und die Veränderungen des Juckreizschweregrads und der juckreizbezogenen Lebensqualität (QoL), gemessen anhand des Gesamt-Skindex-10 und des 5-D-Pruritus-Werts. Die wichtigsten Einschlusskriterien waren chronische Nierenerkrankung mit dreimal wöchentlicher Hämodialyse seit mindestens 3 Monaten, mittelschwerer bis schwerer Juckreiz (WI-NRS-Baseline >4) und adäquate Hämodialyse. Die wichtigsten Ausschlusskriterien waren Juckreiz anderer Ursache als eine chronische Nierenerkrankung oder damit verbundener Komplikationen, Juckreiz an den Handinnenflächen und Juckreiz ausschliesslich während der Hämodialysesitzungen.
In die kombinierten Studien wurden 851 Patienten aufgenommen. Das Durchschnittsalter betrug 59 Jahre, 33.1% waren 65 Jahre oder älter, 60% der Patienten waren männlich. Die Krankheitsmerkmale zu Beginn der Studie, wie z. B. die Anwendung von Arzneimitteln zur Linderung von Pruritus, die Zeit seit der Diagnose der chronischen Nierenerkrankung und die Dauer des Pruritus, waren in den Armen mit aktiver Behandlung und dem Placebo vergleichbar. Die mittlere WI-NRS-Baseline lag sowohl in den Difelikefalin, als auch in den Placebo-Armen bei 7,18; die mittlere WI-NRS-Baseline lag bei 7,13 (Bereich 4,2 bis 10) in der Difelikefalin-Gruppe und bei 7,13 (Bereich 4,1 bis 10) in der Placebo-Gruppe. Insgesamt hatten 38% der Patienten zuvor Arzneimittel zur Behandlung von Pruritus angewendet. In allen Studien verbesserte Difelikefalin signifikant den Schweregrad des Juckreizes und die juckreizbezogene Lebensqualität über 12 Wochen, wie aus der Tabelle 2 hervorgeht.
Tabelle 2: Zusammenfassung der primären und wichtigsten sekundären Ergebnisse der KALM-1 und KALM-2 und der gepoolten Datenbank nach Woche 12
|
Endpunkt am
Ende von Woche 12
|
KALM-1 (n = 378)
|
KALM-2 (n = 473)
| |
Difelikefalin
(n = 189)
|
Placebo
(n = 189)
|
Difelikefalin
(n = 237)
|
Placebo
(n = 236)
| |
Primärer Endpunkt
|
|
|
|
| |
WI-NRS
|
|
|
|
| |
Patienten mit einer Verbesserung um ≥ 3 Punkte (%)
|
51,0%
(p < 0,001)
|
27,6%
|
54,0%
(p = 0,02)
|
42,2%
| |
Sekundärer Endpunkt
|
|
|
|
| |
WI-NRS
Patienten mit einer Verbesserung um ≥ 4 Punkte (%)
|
38,9%
(p < 0,001)
|
18,0%
|
41,2%
(p = 0,01)
|
28,4%
| |
Skindex-10
Veränderung ab Baseline
[Punkte]
|
-17,2
(p < 0,001)
|
-12,0
|
-16,6
(p = 0,171)
|
-14,8
| |
5-D-Pruritus
Veränderung ab Baseline
[Punkte]
|
-5,0
(p < 0,001)
|
-3,7
|
-4,9
(p = 0,002)
|
-3,8
|
Abbildung 1 zeigt den mittleren Prozentsatz von KALM-1 und KALM-2 mit einer ≥ 3-Punkte-Verbesserung gegenüber dem Ausgangswert im WI-NRS-Score nach Studienwoche. Basierend auf Odds Ratios wurden statistisch signifikante Verbesserungen zugunsten der Difelikefalin-Gruppe in Woche 3 in KALM-1 und in Woche 2 in KALM-2 beobachtet, die sich in beiden Studien in jeder folgenden Woche bis Woche 12 fortsetzen.
Abbildung 1: Prozentsatz der Patienten mit ≥ 3-Punkte-Verbesserung in Bezug auf den WI-NRS-Score nach Woche in KALM-1 und KALM-2 (ITT-Population)
KALM-1
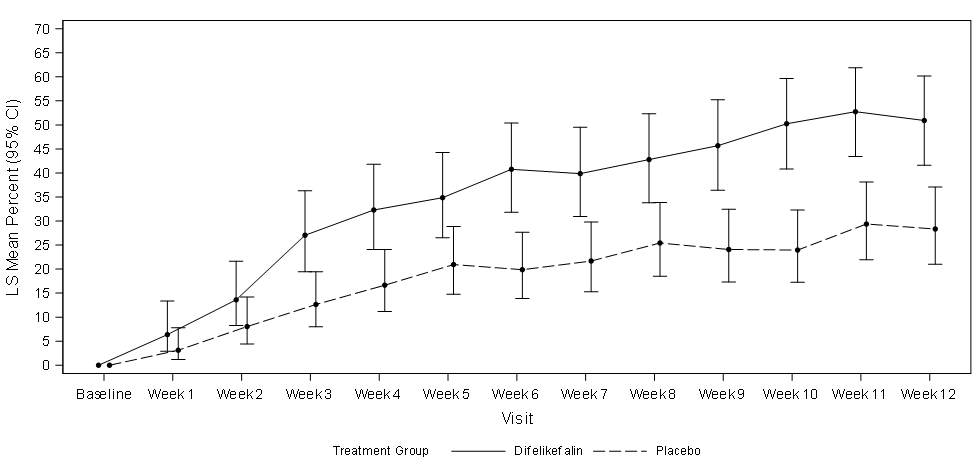
CI = confidence interval (Konfidenzintervall); ITT = intent to treat; LS = least squares (Methode der kleinsten Quadrate, MKQ); WI-NRS = Worst Itching-Numerical Rating Scale (Numerische Rating-Skala des schlimmsten Juckreizes)
KALM-2
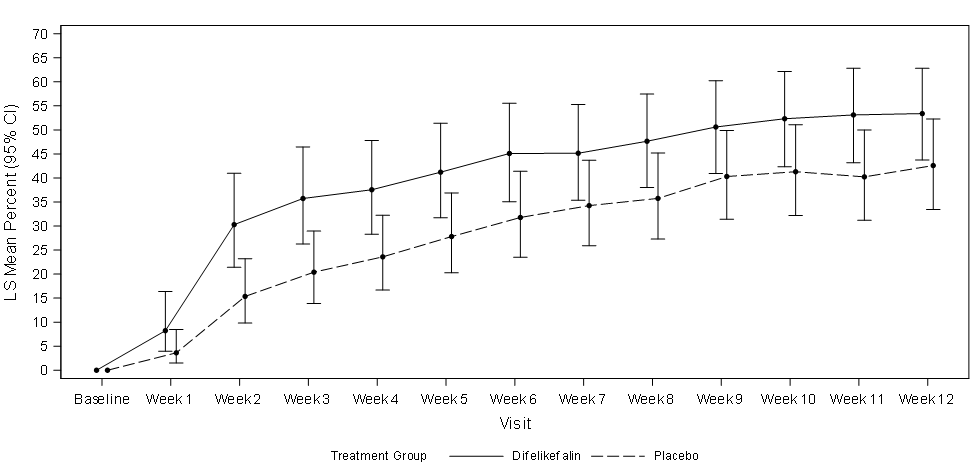
CI = confidence interval (Konfidenzintervall); ITT = intent to treat; LS = least squares (Methode der kleinsten Quadrate, MKQ); WI-NRS = Worst Itching-Numerical Rating Scale (Numerische Rating-Skala des schlimmsten Juckreizes)
Offene Verlängerungsstudien
Bei Patienten, die am Ende des doppelblinden Behandlungszeitraums von Placebo auf Difelikefalin wechselten, wurde nach einem Behandlungszeitraum von 4 Wochen eine Verbesserung auf der 5-D-Pruritus-Skala beobachtet, mit ähnlichem LS-Mittelwert (SE) der Veränderung ab Baseline wie bei Patienten, die ab Studienbeginn Difelikefalin erhielten: -6,0 (0,22) vs. -5,7 (0,23). Die Verbesserung auf der 5-D-Pruritus-Skala wurde in beiden Behandlungsgruppen über den 52wöchigen Behandlungszeitraum aufrechterhalten.
PharmakokinetikDie pharmakokinetischen Eigenschaften von intravenös verabreichtem Difelikefalin wurden an 319 gesunden Teilnehmern und 115 Patienten mit chronischer Nierenerkrankung, davon 91 unter Hämodialyse, untersucht. Das pharmakokinetische Profil bei Patienten mit leichter Nierenfunktionsstörung war vergleichbar mit dem von gesunden Teilnehmern. Bei Patienten mit schwerer Niereninsuffizienz war die Gesamtkörper-Clearance von Difelikefalin jedoch reduziert und die Plasmakonzentrationen blieben relativ konstant, bis der Wirkstoff während der Dialyse eliminiert wurde.
Absorption
Nicht zutreffend.
Distribution
Die Plasmaproteinbindung von Difelikefalin ist gering bis mässig. Sie liegt zwischen 24 und 32% und bleibt von Nierenfunktionsstörungen unbeeinträchtigt. Das mittlere Distributionsvolumen im Steady-State lag zwischen 145 und 189 ml/kg bei gesunden Teilnehmern und zwischen 214 und 301 ml/kg bei Hämodialyse-Patienten mit mittelschwerem bis schwerem Pruritus.
Metabolismus
Difelikefalin ist kein Substrat von CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6 oder CYP3A4.
Elimination
Bei gesunden Teilnehmern ist der primäre Eliminationsweg für Difelikefalin über die Niere, wobei etwa 81% der Dosis mit dem Urin im Vergleich zu 11% mit dem Stuhl ausgeschieden werden. Die mittlere Gesamt-Clearance bewegte sich zwischen 54 und 71 ml/h/kg und die mittlere Halbwertszeit zwischen 2 und 3 Stunden. Im Gegensatz dazu erfolgte die Elimination bei niereninsuffizienten Hämodialyse-Patienten überwiegend über den Stuhl, in dem im Durchschnitt ca. 59% der Dosis nachgewiesen wurden; ca. 19% wurden im Dialysat zurückgewonnen und ca. 11% wurden im Urin gefunden. Im Vergleich zu Teilnehmern mit normaler Nierenfunktion verringerte sich die mittlere Gesamt-Clearance und erhöhte sich die Halbwertszeit um das 10-Fache mit Werten von 5,3 bis 7,5 ml/h/kg bzw. 23 bis 31 Stunden. Nach Verabreichung von radioaktiv markiertem Wirkstoff machte die Muttersubstanz >99% der zirkulierenden Radioaktivität aus. Durch die Hämodialyse verringert sich die Difelikefalin-Konzentration um 70 bis 80%. Nach 2 Dialysezyklen war kein Difelikefalin mehr im Plasma nachweisbar.
Linearität/Nicht Linearität
Bei Hämodialyse-Patienten mit chronischer Nierenerkrankung ist die Pharmakokinetik von Difelikefalin im intravenösen Einzeldosisbereich von 1 bis 3 Mikrogramm/kg (das 2- bis 6fache der empfohlenen Dosierung) und im Mehrfachdosisbereich von 0,5 bis 2,5 Mikrogramm/kg (das 1- bis 5fache der empfohlenen Dosierung) linear und dosisproportional. Der Steady-State wurde nach der zweiten verabreichten Dosis erreicht, und das mittlere Akkumulationsverhältnis lag bei bis zu 1,6.
Kinetik spezieller Patientengruppen
Derzeit gibt es keine Hinweise darauf, dass Faktoren wie Alter (25 bis 80 Jahre), Geschlecht, ethnische Zugehörigkeit oder leichte bis mittelschwere Leberfunktionsstörungen einen Einfluss auf die Pharmakokinetik von Difelikefalin haben.
Zusammenhang zwischen Pharmakokinetik und Pharmakodynamik
In der Zielgruppe der Hämodialyse-Patienten mit Niereninsuffizienz wurde keine offensichtliche Dosis-Wirkungs-Beziehung für die juckreizstillende Wirksamkeit beobachtet. Bei Personen mit intakter Nierenfunktion ist das Risiko einer Aquarese dosisabhängig.
Präklinische DatenNichtklinische Daten zeigen auf der Grundlage konventioneller Studien zur Sicherheitspharmakologie, zur Toxizität bei wiederholter Verabreichung, zur Genotoxizität, zum kanzerogenen Potenzial sowie zum Missbrauchs- und Abhängigkeitspotenzial keine besondere Gefahr für den Menschen.
Reproduktions- und Entwicklungstoxizität
Bei Ratten wurden die männliche und weibliche Fertilität, die frühe embryonale sowie die prä- und postnatale Entwicklung bei Expositionen, die mindestens 775-fach über der humanen AUC lagen, nicht beeinträchtigt. Beim Kaninchen war die pränatale Entwicklung trotz deutlicher maternaler Toxizität beim 30-fachen der humanen AUC ebenfalls nicht beeinträchtigt.
Bei Ratten passiert Difelikefalin die Plazenta und tritt in die Muttermilch über.
Sonstige HinweiseInkompatibilitäten
In Abwesenheit von Kompatibilitätsstudien darf Kapruvia nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei 15-30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Kapruvia Injektionslösung in der Durchstechflasche ist gebrauchsfertig. Kapruvia darf nicht mit anderen Arzneimitteln gemischt oder verdünnt werden.
Die sterile Injektionslösung in der Durchstechflasche enthält keine Konservierungsmittel und ist nur für eine einmalige Injektion bei einem Patienten bestimmt. Es dürfen nur Lösungen injiziert werden, die klar, farblos und frei von sichtbaren Partikeln sind.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
PackungenPackungsgrössen von 3 Durchstechflaschen (zurzeit nicht im Handel) und 12 Durchstechflaschen mit je 1 ml Injektionslösung. (B).
ZulassungsinhaberinVifor Fresenius Medical Care Renal Pharma Ltd., St. Gallen
Stand der InformationMai 2024
|


