Sonstige HinweiseAlle Angaben in dieser Rubrik beziehen sich ausschliesslich auf Comirnaty 30 Mikrogramm/Dosis gebrauchsfertige Injektionsdispersion für Personen ab 12 Jahren (Durchstechflasche mit GRAUER Kunststoffkappe).
Für Angaben zu Comirnaty 10 Mikrogramm/Dosis Konzentrat zur Herstellung einer Injektionsdispersion für Kinder im Alter von 5 bis <12 Jahren (Durchstechflasche mit ORANGER Kunststoffkappe), Comirnaty 30 Mikrogramm/Dosis Konzentrat zur Herstellung einer Injektionsdispersion für Personen ab 12 Jahren (Durchstechflasche mit VIOLETTER Kunststoffkappe), Comirnaty Original/Omicron BA.1 15/15 Mikrogramm pro Dosis gebrauchsfertige Injektionsdispersion für Personen ab 18 Jahren (Durchstechflasche mit GRAUER Kunststoffkappe) oder Comirnaty Original/Omicron BA.4-5 15/15 Mikrogramm pro Dosis gebrauchsfertige Injektionsdispersion für Personen ab 12 Jahren (Durchstechflasche mit GRAUER Kunststoffkappe) beachten Sie bitte die jeweiligen separaten Fachinformationen!
Inkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit der ungeöffneten Durchstechflasche: 2 Jahre bei Lagerung bei -90 °C bis -60 °C.
Der Impfstoff wird tiefgekühlt bei -90 °C bis -60 °C erhalten und kann nach Erhalt entweder bei -90 °C bis -60 °C oder 2 °C bis 8 °C gelagert werden.
Nach dem Herausnehmen aus der Tiefkühllagerung kann die ungeöffnete Durchstechflasche für einen einmaligen Zeitraum von bis zu 10 Wochen bei 2 °C bis 8 °C gelagert werden. Dabei darf das aufgedruckte Verfallsdatum («EXP») nicht überschritten werden.
Beim Transfer des Produkts in eine Lagerung bei 2 °C bis 8 °C muss das aktualisierte Verfallsdatum auf der Packung vermerkt werden und der Impfstoff sollte bis zum aktualisierten Verfallsdatum verwendet oder verworfen werden. Das ursprüngliche Verfallsdatum ist durchzustreichen.
Der aufgetaute Impfstoff (ungeöffnete Durchstechflaschen) kann innerhalb der Haltbarkeitsfrist von 10 Wochen bei 2-8°C für eine eventuell nötige lokale Umverteilung transportiert werden. Stellen Sie in diesem Fall beim Empfang sicher, dass das Verfallsdatum auf der Packung aktualisiert und das ursprüngliche Verfallsdatum durchgestrichen worden ist, um das Verfallsdatum in Kühllagerung widerzuspiegeln.
Wird der Impfstoff tiefgekühlt bei -90 °C bis -60 °C gelagert, kann er bei 2 °C bis 8 °C oder bei Raumtemperatur (bis zu 30 °C) aufgetaut werden.
Der Impfstoff kann bis zu 24 Stunden lang bei Temperaturen zwischen 8 °C und 30 °C gelagert werden, einschliesslich jeglicher Zeiten nach erster Punktion (Siehe «Haltbarkeit nach Anbruch»).
Nach dem Auftauen darf der Impfstoff nicht erneut eingefroren werden.
Handhabung von Temperaturabweichungen nach Entnahme aus dem Gefrierschrank
Stabilitätsdaten zeigen, dass die ungeöffnete Durchstechflasche bei Lagerung bei Temperaturen von -2 °C bis 2 °C (innerhalb des 10-wöchigen Zeitraums der Lagerung zwischen 2 °C und 8 °C) bis zu 10 Wochen stabil ist.
Siehe Stabilitätsangaben unter «Haltbarkeit nach Anbruch» zur Begrenzung der Lagerung von Durchstechflaschen zwischen 8 °C und 30 °C.
Diese Angaben dienen nur als Orientierungshilfe für das medizinische Fachpersonal im Falle einer versehentlichen Temperaturabweichung.
Haltbarkeit nach Anbruch
Das Produkt enthält keine Konservierungsmittel. Aus mikrobiologischen Gründen sollte das Produkt nach der ersten Punktion sofort, aber spätestens innerhalb von maximal 6 Stunden verwendet werden, es sei denn, die Methode des Anbruchs der Durchstechflaschen und der Entnahme erfolgt unter strikt aseptischen Bedingungen.
Die chemische und physikalische Gebrauchsstabilität ist für einen Zeitraum von 12 Stunden bei 8 °C bis 30 °C belegt und schliesst eine Transportdauer von bis zu 6 Stunden ein.
Erfolgt die Anwendung nicht sofort, liegen die Aufbewahrungszeiten und -bedingungen für die Verwendung in der Verantwortung des Anwenders.
Besondere Lagerungshinweise
Tiefgekühlt bei -90 °C bis -60 °C lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Während der Lagerung ist die Exposition gegenüber Raumlicht so gering wie möglich zu halten, die Exposition gegenüber direktem Sonnenlicht und ultraviolettem Licht ist zu vermeiden.
Aufgetaute Durchstechflaschen können bei Raumlicht gehandhabt werden.
Für Angaben zu den Aufbewahrungsbedingungen nach Auftauen und erstem Anbruch des Arzneimittels, siehe oben unter «Haltbarkeit» und «Haltbarkeit nach Anbruch».
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung - Comirnaty 30 Mikrogramm/Dosis gebrauchsfertige Injektionsdispersion für Personen ab 12 Jahren (GRAUE Kappe)
Comirnaty 30 Mikrogramm/Dosis gebrauchsfertige Injektionsdispersion ist von einer medizinischen Fachperson unter Verwendung aseptischer Techniken vorzubereiten, um die Sterilität der Dispersion sicherzustellen.
|
ANWEISUNGEN ANWENDBAR FÜR EINZELDOSIS- UND MEHRFACHDOSIS-DURCHSTECHFLASCHEN
| |
ÜBERPRÜFUNG DER DURCHSTECHFLASCHE – COMIRNATY 30 MIKROGRAMM/DOSIS GEBRAUCHSFERTIGE INJEKTIONSDISPERSION FÜR PERSONEN AB 12 JAHREN (GRAUE KAPPE)
| |
|
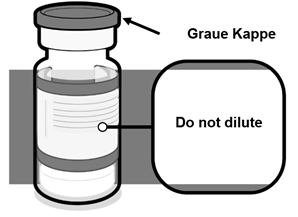
30 mcg
|
·Stellen Sie sicher, dass die Durchstechflasche mit einer grauen Kunststoffkappe versehen ist, das Etikett einen grauen Rand hat und der Name des Produktes «Comirnaty 30 micrograms/dose dispersion for injection» lautet.
·Prüfen Sie, ob die Durchstechflasche eine Einzeldosis- oder Mehrfachdosis-Durchstechflasche ist, und befolgen Sie die entsprechenden unten aufgeführten Hinweise für die Handhabung.
·Wenn die Durchstechflasche eine graue Kunststoffkappe, das Etikett einen grauen Rand hat und der Name des Produkts anders lautet, oder wenn die Durchstechflasche eine orange oder violette Kunststoffkappe hat, beachten Sie bitte die separate Fachinformation für die jeweilige Formulierung.
| |
HANDHABUNG VOR DEM GEBRAUCH – COMIRNATY 30 MIKROGRAMM/DOSIS GEBRAUCHSFERTIGE INJEKTIONSDISPERSION FÜR PERSONEN AB 12 JAHREN (GRAUE KAPPE)
| |
|
|
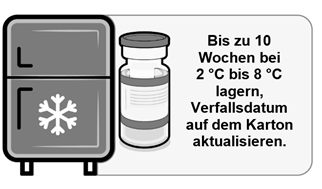
·Wird die Einzeldosis- oder Mehrfachdosis-Durchstechflasche tiefgekühlt gelagert, muss sie vor dem Gebrauch aufgetaut werden. Gefrorene Durchstechflaschen sollten zum Auftauen in eine Umgebung von 2 °C bis 8 °C gebracht werden. Stellen Sie sicher, dass die Durchstechflaschen vor dem Gebrauch vollständig aufgetaut sind.
·Einzeldosis-Durchstechflaschen: Das Auftauen einer Packung mit 10 Einzeldosis-Durchstechflaschen kann 2 Stunden dauern.
·Mehrfachdosis-Durchstechflaschen: Das Auftauen einer Packung mit 10 Mehrfachdosis-Durchstechflaschen kann 6 Stunden dauern.
·Beim Transfer des Produkts in eine Lagerung bei 2 °C bis 8 °C muss das aktualisierte Verfallsdatum auf der Packung vermerkt werden.
·Ungeöffnete Durchstechflaschen können bis zu 10 Wochen bei 2 °C bis 8 °C gelagert werden. Dabei darf das aufgedruckte Verfallsdatum («EXP») nicht überschritten werden.
·Alternativ können einzelne gefrorene Durchstechflaschen zur sofortigen Verwendung auch 30 Minuten lang bei Temperaturen bis zu 30 °C aufgetaut werden.
| |
|
|
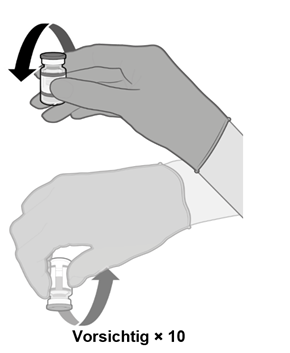
·Mischen Sie die Durchstechflaschen vor der Anwendung durch 10-maliges vorsichtiges Umdrehen. Nicht schütteln.
·Vor dem Mischen kann die aufgetaute Dispersion weisse bis gebrochen weisse, undurchsichtige, amorphe Partikel enthalten.
·Nach dem Mischen sollte der Impfstoff eine weisse bis gebrochen weisse Dispersion ohne sichtbare Partikel sein. Verwenden Sie den Impfstoff nicht, wenn Partikel oder Verfärbungen vorhanden sind.
| |
ZUBEREITUNG VON INDIVIDUELLEN 0.3 ML DOSEN VON COMIRNATY 30 MIKROGRAMM/DOSIS GEBRAUCHSFERTIGE INJEKTIONSDISPERSION FÜR PERSONEN AB 12 JAHREN (GRAUE KAPPE)
| |
|
|
Einzeldosis-Durchstechflaschen
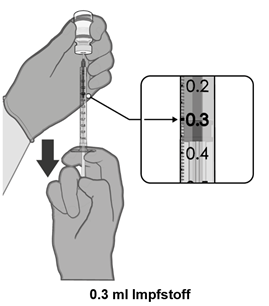
·Entnehmen Sie eine Einzeldosis von 0.3 ml des Impfstoffs.
·Entsorgen Sie die Durchstechflasche mit dem überschüssigen Volumen.
Mehrfachdosis-Durchstechflaschen
·Mehrfachdosis-Durchstechflaschen enthalten 6 Dosen von je 0.3 ml.
·Reinigen Sie den Stopfen der Durchstechflasche unter aseptischen Bedingungen mit einem antiseptischen Einmaltupfer.
·Entnehmen Sie 0.3 ml Comirnaty 30 Mikrogramm/Dosis gebrauchsfertige Injektionsdispersion für Personen ab 12 Jahren (GRAUE Kappe).
Es sollten Spritzen und/oder Nadeln mit geringem Totvolumen verwendet werden, um 6 Dosen aus einer Durchstechflasche zu entnehmen. Die Kombination aus Spritze und Nadel sollte ein Totvolumen von nicht mehr als 35 Mikrolitern haben.
Wenn Standardspritzen und -nadeln verwendet werden, reicht das Volumen möglicherweise nicht aus, um eine sechste Dosis aus einer einzelnen Durchstechflasche zu entnehmen.
·Jede Dosis muss 0.3 ml des Impfstoffs enthalten.
·Wenn die in der Durchstechflasche verbleibende Impfstoffmenge nicht für eine volle Dosis von 0.3 ml ausreicht, entsorgen Sie die Durchstechflasche mit dem überschüssigen Volumen.
·Entsorgen Sie nicht verwendeten Impfstoff spätestens 6 Stunden nach der ersten Punktion der Durchstechflasche, respektive spätestens nach 12 Stunden, falls die Entnahme unter strikt aseptischen Bedingungen erfolgte. Notieren Sie das entsprechende Datum und die Uhrzeit des Anbruchs auf der Durchstechflasche.
|
Entsorgung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
| 



