Zusammensetzung
Wirkstoffe
Etonogestrel, Ethinylestradiol.
Hilfsstoffe
Ethylen-Vinylacetat-Copolymer, Magnesiumstearat.
Indikationen/Anwendungsmöglichkeiten
Hormonale Kontrazeption zur vaginalen Anwendung.
Bei der Entscheidung NuvaRing zu verschreiben sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frau, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von NuvaRing mit jenem anderer kombinierter hormonaler Kontrazeptiva (CHC) verglichen werden (vgl. «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Dosierung/Anwendung
CHC wie NuvaRing sollten nur von einem Arzt bzw. einer Ärztin mit entsprechender Erfahrung verordnet werden, welche in der Lage sind, eine umfassende Aufklärung der Patientin über die Vor- und Nachteile sämtlicher verfügbarer Kontrazeptionsmethoden sowie neben einer allgemeinen auch eine gynäkologische Untersuchung durchzuführen.
Die Verordnung eines CHC sollte grundsätzlich unter Beachtung der jeweils aktuellen Richtlinien der Schweizer Gesellschaft für Gynäkologie und Geburtshilfe erfolgen.
Anwendung von NuvaRing
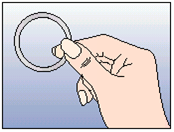
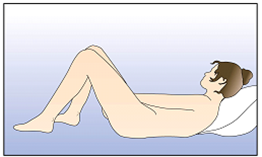
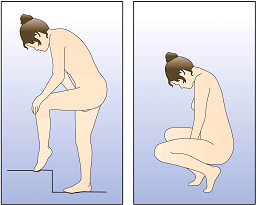
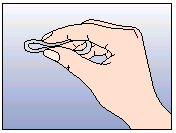
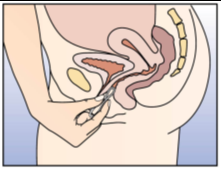
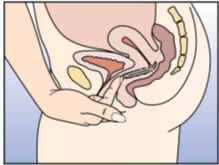
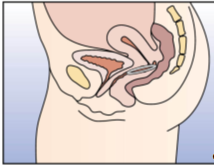
NuvaRing kann von der Frau selbst in die Vagina eingesetzt werden. Der Arzt sollte die Frau über das Einsetzen und Entfernen des Vaginalrings entsprechend beraten. Zum Einsetzen sollte die Haltung gewählt werden, die der Frau am bequemsten erscheint, z.B. Stehen mit einem angehobenen Bein, Hockstellung oder Liegen. NuvaRing sollte zusammengedrückt und soweit in die Vagina geschoben werden, bis er bequem sitzt. Die genaue Lage von NuvaRing in der Vagina spielt keine Rolle für die kontrazeptive Wirkung (siehe Abbildungen 1-4).
Wenn NuvaRing eingesetzt worden ist, verbleibt er für die folgenden drei Wochen in der Vagina. Die Frau kann jederzeit prüfen, ob sich der NuvaRing tatsächlich in der Vagina befindet. Es ist empfehlenswert, den Sitz des Vaginalrings regelmässig zu überprüfen, z.B. nach Sport oder Schwimmen sowie eventuell vor und nach dem Geschlechtsverkehr.
Wird NuvaRing versehentlich ausgestossen (z.B. beim Herausziehen eines Tampons) siehe Anweisungen unter «Vaginalring zeitweilig ausserhalb der Vagina (Ausstossen des Vaginalrings)».
Drei Wochen später ist NuvaRing am gleichen Wochentag zu entfernen und eine 1-wöchige Anwendungspause einzuhalten, bevor wieder ein neuer Vaginalring eingesetzt wird. (Wenn NuvaRing z.B. an einem Mittwoch um 22 Uhr eingesetzt wird, sollte der Vaginalring drei Wochen später am Mittwoch gegen 22 Uhr wieder herausgenommen werden. Am folgenden Mittwoch setzt man einen neuen Vaginalring ein.)
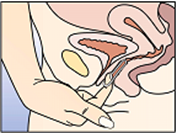
Die Entfernung von NuvaRing aus der Vagina erfolgt entweder durch Einhaken des Zeigefingers unter den vorderen Rand oder durch Festhalten des Randes zwischen Zeige- und Mittelfinger und Herausziehen (s. Abbildung 5). Der gebrauchte Vaginalring soll in den wiederverschliessbaren Beutel zurückgesteckt und entsorgt werden (nicht in die Toilette spülen). Er darf für Kinder und Haustiere nicht zugänglich sein.
Während der Anwendungspause kommt es üblicherweise zu einer Entzugsblutung, die normalerweise 2-3 Tage nach dem Entfernen von NuvaRing einsetzt und noch andauern kann, wenn bereits der neue Vaginalring eingesetzt wird.
|
|
Nehmen Sie NuvaRing aus dem Beutel. |
|
|
Wählen Sie eine bequeme Haltung, um den Vaginalring einzusetzen. | ||
|
|
Drücken Sie den Vaginalring zusammen. | |||||
|
|
|
|
|
|
| |
|
Abbildung 4A: Setzen Sie den Vaginalring mit einer Hand in die Vagina ein; spreizen Sie, falls das erforderlich ist, die Schamlippen mit der anderen Hand auseinander. |
Abbildung 4B: Schieben Sie den Vaginalring so weit in die Vagina hinein, bis er bequem sitzt. |
Abbildung 4C: Der Vaginalring verbleibt dort für drei Wochen. | ||||
|
|
|
Abbildung 5: NuvaRing kann entweder durch Einhaken des Zeigefingers unter den vorderen Rand des Vaginalringes oder durch Festhalten des Randes zwischen Zeige- und Mittelfinger herausgezogen werden. | ||||
Beginn der Anwendung
Frauen, die im letzten Zyklus kein hormonales Kontrazeptivum verwendet haben
NuvaRing sollte am 1. Tag des natürlichen Zyklus (d.h. am ersten Tag der Monatsblutung) eingesetzt werden. NuvaRing kann auch an den Tagen 2-5 eingesetzt werden. Es wird dann allerdings empfohlen, während der ersten sieben Tage der NuvaRing Anwendung zusätzlich ein barrierebildendes Kontrazeptivum (z.B. Kondom für den Mann) zu benutzen.
Wechsel von einem kombinierten hormonalen Kontrazeptivum (CHC)
Die Frau sollte NuvaRing spätestens an dem Tag einsetzen, der auf die übliche Einnahmepause bzw. die Einnahme der Placebotabletten oder des pflasterfreien Intervalls ihres früheren CHC folgt.
Wechsel von einem Gestagen-Mono-Kontrazeptivum (Minipille, Implantat, Injektion oder Gestagen abgebendes Intrauterinsystem)
Der Wechsel von der Minipille zu NuvaRing kann an jedem beliebigen Tag (ohne Einhaltung einer Pause) erfolgen. Die Umstellung von einem Implantat oder einem Intrauterinsystem (IUS) sollte an dem Tag erfolgen, an welchem dieses entfernt wird, die Umstellung von einem Injektionspräparat zu dem Zeitpunkt, an dem die nächste Injektion fällig ist. In all diesen Fällen ist während der ersten sieben Tage zusätzlich ein barrierebildendes Kontrazeptivum zu verwenden.
Nach Abort im ersten Trimester
Die Frau kann den Vaginalring sofort einsetzen. Dabei braucht sie keine weiteren kontrazeptiven Massnahmen zu ergreifen. Ist keine sofortige Anwendung erwünscht, sollte sich die Anwenderin an die Hinweise halten, die unter «Frauen, die im letzten Zyklus kein hormonales Kontrazeptivum verwendet haben» gegeben werden. Es ist ihr zu raten, in der Zwischenzeit ein barrierebildendes Kontrazeptivum anzuwenden.
Nach Geburt oder Abort im zweiten Trimester
Bei der Entscheidung, zu welchem Zeitpunkt nach einer Geburt bzw. nach einem Abort im 2. Trimenon (wieder) mit der Anwendung eines CHC wie NuvaRing begonnen werden kann, ist zu berücksichtigen, dass postpartal das Risiko für venöse thromboembolische Ereignisse erhöht ist (während bis zu 12 Wochen; siehe «Warnhinweise und Vorsichtsmassnahmen»).
In jedem Fall sollte nach einer Geburt bzw. einem Abort im 2. Trimenon mit der Anwendung von NuvaRing frühestens zwischen dem 21. und dem 28. Tag begonnen werden. Bei einem späteren Beginn wird an den ersten 7 Tagen der Anwendung die zusätzliche Anwendung nicht-hormonaler Kontrazeptionsmethoden empfohlen. Hat bereits Geschlechtsverkehr stattgefunden, sollte vor Beginn der NuvaRing Anwendung eine Schwangerschaft ausgeschlossen oder die erste natürliche Menstruation abgewartet werden.
Für stillende Mütter (siehe «Schwangerschaft, Stillzeit»).
Abweichungen von der empfohlenen Anwendungsweise
Kontrazeptive Wirkung und Zykluskontrolle können kompromittiert werden, wenn die Frau von der empfohlenen Anwendungsweise abweicht. Damit die kontrazeptive Wirkung nicht verloren geht, können im Falle einer Abweichung folgende Ratschläge erteilt werden:
Verlängertes NuvaRing-freies Intervall
Sobald die vergessene Applikation bemerkt wird, sollte die Frau einen neuen Vaginalring einsetzen. Ausserdem ist während der nächsten 7 Tage zusätzlich ein barrierebildendes Kontrazeptivum zu verwenden. Falls in der Zeit ohne Vaginalring bereits Geschlechtsverkehr stattgefunden hat, ist die Möglichkeit einer Schwangerschaft zu berücksichtigen. Je länger die Zeit ohne Vaginalring andauert, umso höher ist das Risiko einer Schwangerschaft.
Vergessene Entfernung des NuvaRings nach der dritten Woche
Obschon es nicht der üblichen Dosierungsempfehlung entspricht, ist die kontrazeptive Wirkung noch ausreichend, solange NuvaRing bis zu max. 4 Wochen in der Vagina belassen wurde. Die Frau sollte das übliche ringfreie Intervall von einer Woche einhalten und anschliessend einen neuen Vaginalring einsetzen. Wenn NuvaRing für länger als 4 Wochen nicht entfernt wurde, kann die kontrazeptive Wirkung eingeschränkt sein. Deshalb sollte vor dem Einsetzen eines neuen NuvaRings eine Schwangerschaft ausgeschlossen werden.
Vaginalring zeitweilig ausserhalb der Vagina (Ausstossen des Vaginalrings)
NuvaRing sollte während 3 Wochen ununterbrochen in der Vagina verbleiben. Wurde der Vaginalring versehentlich ausgestossen, kann er mit kaltem oder lauwarmem (nicht mit heissem!) Wasser abgespült werden. Anschliessend muss er dann sofort wieder eingesetzt werden. Im Einzelnen ist wie folgt vorzugehen:
Vaginalring während weniger als 3 Stunden ausserhalb der Vagina
Befand sich der Vaginalring während weniger als 3 Stunden ausserhalb der Vagina, mindert dies die kontrazeptive Wirkung nicht. Die Anwenderin sollte den Vaginalring so schnell wie möglich (jedoch spätestens 3 Stunden nach der Ausstossung) wieder einsetzen.
Vaginalring während mehr als 3 Stunden oder für einen unbekannten Zeitraum ausserhalb der Vagina
Das weitere Vorgehen ist abhängig vom Zeitpunkt innerhalb des Zyklus, zu welchem sich der Vaginalring ausserhalb der Vagina befand:
Während der 1. oder 2. Anwendungswoche:
Befand sich NuvaRing während mehr als 3 Stunden ausserhalb der Vagina, kann die kontrazeptive Wirkung reduziert sein. Sobald die Frau es bemerkt, sollte sie den Vaginalring erneut einsetzen. Zusätzlich ist ein barrierebildendes Kontrazeptivum zu benutzen, bis NuvaRing durchgehend über 7 Tage angewendet wurde. Je länger NuvaRing sich ausserhalb der Vagina befunden hat und je näher das planmässige ringfreie Intervall liegt, umso grösser ist die Gefahr einer Schwangerschaft.
Während der 3. Anwendungswoche:
Falls sich der Vaginalring in der dritten Anwendungswoche während mehr als 3 Stunden ausserhalb der Vagina befand, kann die kontrazeptive Wirkung herabgesetzt sein. Die Frau sollte diesen Vaginalring verwerfen und eine der beiden folgenden Möglichkeiten wählen:
1.Sofortiges Einsetzen eines neuen Vaginalrings.Durch Einsetzen eines neuen Vaginalrings beginnt die nächste dreiwöchige Periode. Es wird voraussichtlich zu keiner Entzugsblutung kommen. Allerdings kann es zu Durchbruch- oder Schmierblutungen kommen.
2.Entzugsblutung abwarten und den neuen Vaginalring nicht später als 7 Tage nach der Entfernung oder dem Ausstossen (7 x 24 Stunden) einsetzen. Diese Möglichkeit sollte nur angewendet werden, wenn der Vaginalring vor dem Ausstossen bzw. der Entfernung während den vorhergehenden 7 Tagen kontinuierlich benutzt wurde.
Insbesondere wenn nicht bekannt ist, für welchen Zeitraum sich der Vaginalring ausserhalb der Vagina befand, sollte die Möglichkeit einer Schwangerschaft in Betracht gezogen und vor dem Einsetzen eines neuen Vaginalringes ein Schwangerschaftstest durchgeführt werden.
Gebrochene Vaginalringe
In seltenen Fällen wurde über einen Bruch des Vaginalringes während der Anwendung berichtet, was mit vaginalen Verletzungen einhergehen kann. Es wird empfohlen, den gebrochenen Vaginalring sobald als möglich herauszunehmen und einen neuen einzusetzen. Während der nächsten sieben Tage soll zusätzlich ein barrierebildendes Kontrazeptivum (z.B. Kondom für den Mann) benutzt werden. Die Möglichkeit einer Schwangerschaft muss in Betracht gezogen und der Arzt aufgesucht werden.
Ist die Anwenderin von der empfohlenen Anwendungsweise abgewichen und hat sich danach während des folgenden ringfreien Intervalls keine Entzugsblutung eingestellt, sollte vor dem Einsetzen eines neuen NuvaRing eine Schwangerschaft ausgeschlossen werden.
Verschieben der Menstruation
Hinausschieben der Menstruation (Verlängerung des Zyklus)
Wenn in ausserordentlichen Situationen die Periode hinausgezögert werden muss, sollte die Frau sofort einen neuen Vaginalring einsetzen, ohne das übliche ringfreie Intervall einzuhalten. Der nächste Vaginalring kann wieder bis zu maximal 3 Wochen benutzt werden. Danach wird die Anwendung von NuvaRing nach dem üblichen einwöchigen ringfreien Intervall wie gewöhnlich fortgesetzt. Während der verlängerten Anwendung des Vaginalringes kann es zu Durchbruch- oder Schmierblutungen kommen.
Vorverlegen der Menstruation
Um die Periode auf einen anderen als den bisher gewohnten Wochentag zu verschieben, kann die ringfreie Anwendungspause beliebig verkürzt werden. Je kürzer der ringfreie Zeitraum ist, umso grösser ist das Risiko, dass sich keine Entzugsblutung einstellt und während der Benutzung des nächsten Vaginalringes Durchbruch- bzw. Schmierblutungen auftreten.
Blutungsunregelmässigkeiten
Bei Verwendung von NuvaRing können, insbesondere in den ersten Monaten der Anwendung, unregelmässige Blutungen (Durchbruch- oder Schmierblutungen) auftreten. Persistieren die Blutungsunregelmässigkeiten oder kommt es bei korrekter Anwendung zu Blutungsunregelmässigkeiten nach zuvor regelmässigen Zyklen, sollten nichthormonal bedingte Ursachen in Betracht gezogen werden. Es sollte eine Untersuchung zum Ausschluss von malignen Erkrankungen oder einer Schwangerschaft erfolgen. Dies kann eine Kürettage einschliessen.
Bei einigen Frauen kann die Entzugsblutung während der Anwendungspause ausbleiben. Wurde NuvaRing korrekt angewendet, ist es unwahrscheinlich, dass eine Schwangerschaft vorliegt. Wurde jedoch NuvaRing vor der ersten ausgebliebenen Entzugsblutung nicht korrekt angewendet oder sind bereits zwei Entzugsblutungen ausgeblieben, muss vor einer weiteren Anwendung eine Schwangerschaft ausgeschlossen werden.
Spezielle Dosierungsanweisungen
Patientinnen mit Leberfunktionsstörungen
NuvaRing darf bei Frauen mit Leberinsuffizienz nicht angewendet werden.
Patientinnen mit Nierenfunktionsstörungen
NuvaRing wurde bei Frauen mit Niereninsuffizienz nicht untersucht, und es können keine Dosierungsempfehlungen gemacht werden.
Ältere Patientinnen
Nach der Menopause besteht keine Indikation für NuvaRing.
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von NuvaRing wurden an Frauen im Alter von 18 bis 40 Jahren untersucht. Für Jugendliche wird, falls indiziert, die gleiche Dosierung wie bei Erwachsenen empfohlen.
Kontraindikationen
·Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
·venöse Thromboembolie – bestehende VTE (auch unter Therapie mit Antikoagulanzien) oder VTE in der Anamnese (z.B. tiefe Venenthrombose oder Lungenembolie);
·Vorliegen starker Risikofaktoren für venöse thromboembolische Ereignisse wie
·hereditäre oder erworbene Prädisposition für venöse thromboembolische Ereignisse, wie z.B. APC-Resistenz (einschliesslich Faktor-V-Leiden-Mutation), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel;
·gleichzeitiges Vorliegen mehrerer Risikofaktoren für venöse thromboembolische Ereignisse, wie sie in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben sind;
·Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
·bestehende oder vorausgegangene arterielle thromboembolische Ereignisse und deren Prodromi (z.B. Angina pectoris, Myokardinfarkt, transitorische ischämische Attacke (TIA), zerebrovaskulärer Insult);
·Vorliegen starker Risikofaktoren für arterielle thromboembolische Ereignisse wie
·Diabetes mellitus mit Gefässkomplikationen;
·schwere arterielle Hypertonie;
·schwere Dyslipoproteinämie;
·Migräne mit fokalen neurologischen Symptomen (auch in der Anamnese);
·hereditäre oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z.B. Hyperhomocysteinämie oder Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupusantikoagulans);
·gleichzeitiges Vorliegen mehrerer Risikofaktoren für arterielle thromboembolische Ereignisse, wie sie in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben sind;
·bestehende oder vorausgegangene schwere Lebererkrankung, solange abnorme Leberfunktionsparameter bestehen;
·gleichzeitige Anwendung einer der Wirkstoffkombinationen Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir, Glecaprevir/Pibrentasvir und Sofosbuvir/Velpatasvir/Voxilaprevir (Arzneimittel zur Therapie der Hepatitis C) (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»);
·bestehende oder vorausgegangene benigne oder maligne Lebertumore;
·bestehende oder vermutete maligne oder prämaligne Erkrankungen der Genitalorgane oder der Mammae, wenn diese sexualhormonabhängig sind;
·ungeklärte vaginale Blutungen;
·bestehende oder vorausgegangene Pankreatitis in Verbindung mit schwerer Hypertriglyceridämie;
·Überempfindlichkeit gegen die Wirkstoffe oder einen der Hilfsstoffe von NuvaRing.
Warnhinweise und Vorsichtsmassnahmen
Die Anwendung eines CHC erhöht das Risiko für venöse Thromboembolien (VTE) und für arterielle Thromboembolien (ATE) im Vergleich zur Nichtanwendung. Warnhinweise und Vorsichtsmassnahmen, welche nachfolgend beschrieben werden, müssen vor jeder Verschreibung berücksichtigt werden (siehe «Risiko für venöse Thromboembolien [VTE]» und «Risiko für arterielle Thromboembolien [ATE]»). Es ist wichtig, die Patientin auf die Informationen zu venösen und arteriellen thromboembolischen Ereignissen hinzuweisen, insbesondere auf die möglichen Symptome von VTE und ATE und die bekannten vaskulären Risikofaktoren sowie darauf, was im Falle einer vermuteten Thrombose zu tun ist (siehe «Symptome einer VTE [tiefe Venenthrombose und Lungenembolie]» und «Symptome einer ATE»).
Der Nutzen einer Anwendung eines CHC wie NuvaRing sollte gegen die nachfolgend aufgeführten Erkrankungen/Risiken – unter Berücksichtigung des Schweregrades jedes einzelnen oder dem Aufeinandertreffen mehrerer Faktoren – abgewogen und mit jeder Patientin besprochen werden, bevor man sich zur Anwendung von NuvaRing entschliesst (siehe auch «Kontraindikationen»). Die Patientin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen.
Vor Beginn oder Wiederaufnahme eines CHC wie NuvaRing soll eine sorgfältige Eigen- und Familienanamnese erhoben sowie unter Beachtung der Kontraindikationen und Warnhinweise und Vorsichtsmassnahmen eine gründliche allgemeine und gynäkologische Untersuchung durchgeführt werden, um behandlungsbedürftige Erkrankungen sowie deren Risikofaktoren feststellen und eine Schwangerschaft ausschliessen zu können. Diese Untersuchungen schliessen im Allgemeinen Blutdruck, Mammae, Abdomen, Beckenorgane (inkl. Zervixzytologie) und relevante Laboruntersuchungen ein.
Während der Anwendung des CHC müssen diese Untersuchungen in regelmässigen Abständen wiederholt werden, wobei Art und Häufigkeit auf die individuelle Anwenderin abgestimmt werden und sich an den Richtlinien der Schweizer Gesellschaft für Gynäkologie und Geburtshilfe (SGGG) orientieren sollten. Bei diesen Kontrollen sollten die Kontraindikationen (z.B. eine transitorische ischämische Attacke) und Risikofaktoren (z.B. Familienanamnese venöser oder arterieller Thrombosen, vgl. «Risikofaktoren für VTE» und «Risikofaktoren für ATE») erneut überprüft werden, da diese während der Anwendung eines CHC zum ersten Mal auftreten können.
Gründe zum sofortigen Absetzen
Die Anwenderin muss darüber informiert werden, dass sie bei Auftreten einer der oben genannten Kontraindikationen sowie bei Eintreten einer der nachfolgenden Situationen schnellstmöglich einen Arzt/eine Ärztin konsultieren muss, der/die dann über die weitere Anwendung des CHC entscheiden wird:
·erstmaliges Auftreten oder Exazerbation migräneartiger oder häufigeres Auftreten ungewohnt starker Kopfschmerzen.
·plötzliche Seh-, Hör-, Sprech- oder sonstige Wahrnehmungsstörungen.
·erste Anzeichen von thromboembolischen Ereignissen (vgl. Symptome einer VTE [tiefe Venenthrombose und Lungenembolie]» und «Symptome einer ATE»).
·mindestens 4 Wochen vor geplanten Operationen und während einer Immobilisation, z.B. nach Unfall oder Operation.
·klinisch relevanter Blutdruckanstieg (bei wiederholter Messung).
·Auftreten von Ikterus, Hepatitis, generalisiertem Pruritus.
·starke Oberbauchschmerzen oder Lebervergrösserung.
·schwere depressive Zustände.
·Schwangerschaft.
Risiko für venöse Thromboembolien (VTE)
Die Anwendung jedes CHC erhöht das Risiko für VTE im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie NuvaRing, können ein bis zu doppelt so hohes Risiko aufweisen.
Die Entscheidung, das Arzneimittel anzuwenden, sollte nur nach einem Gespräch mit der Patientin getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht:
·Das Risiko für VTE bei Anwendung von NuvaRing.
·Wie beeinflussen ihre vorbestehenden individuellen Risikofaktoren dieses Risiko?
·Stärkste Risikoerhöhung für VTE im allerersten Anwendungsjahr (insbesondere während der ersten 3 Monate).
·Die vorhandenen Daten deuten darauf hin, dass dieses erhöhte Risiko sowohl bei der erstmaligen Anwendung eines CHC als auch bei der erneuten Anwendung des gleichen oder eines anderen CHC besteht (nach einem mindestens 4-wöchigen oder länger dauernden anwendungsfreien Intervall).
·NuvaRing ist ein Arzneimittel. Im Falle eines Unfalls oder eines operativen Eingriffs muss die Anwenderin die behandelnden Ärzte bzw. Ärztinnen darüber informieren, dass sie NuvaRing anwendet.
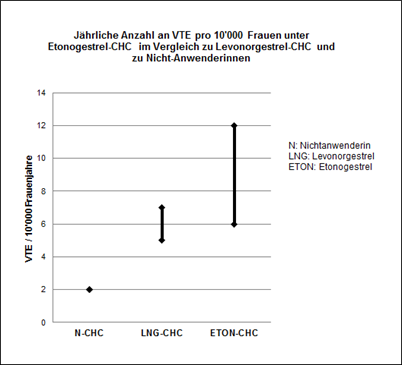
Ungefähr 2 von 10'000 Frauen, die kein CHC anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei der einzelnen Frau kann das Risiko jedoch in Abhängigkeit von ihren zugrundeliegenden Risikofaktoren bedeutend höher sein (siehe unten).
Aufgrund der vorliegenden epidemiologischen Daten wird geschätzt, dass im Verlauf eines Jahres 6-12 von 10'000 Frauen, die ein Etonogestrel-haltiges CHC anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei 5-7 von 10'000 Frauen, die ein Levonorgestrel-haltiges CHC anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während einer Schwangerschaft oder in der postpartalen Phase.
VTE verlaufen in 1-2% der Fälle tödlich.
Äusserst selten wurde bei Anwenderinnen von CHC auch über venöse Thrombosen ausserhalb der Extremitäten berichtet, z.B. Sinusvenenthrombosen oder Thrombosen in hepatischen, mesenterialen, renalen oder retinalen Venen.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von CHC kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, vor allem wenn mehrere Risikofaktoren gleichzeitig vorliegen (siehe Tabelle). Insbesondere ist bei der Nutzen-Risiko-Abwägung zu berücksichtigen, dass das Risiko venöser thromboembolischer Ereignisse überadditiv erhöht sein kann, wenn eine Kombination von Risikofaktoren vorliegt. In diesem Fall muss das Gesamtrisiko für eine VTE in Betracht gezogen werden. NuvaRing ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die sie insgesamt einem hohen Risiko für eine Venenthrombose aussetzen.
Tabelle: Risikofaktoren für VTE
|
Risikofaktor |
Anmerkung |
|
Adipositas (Body-Mass-Index über 30 kg/m²) |
Das Risiko nimmt mit steigendem BMI deutlich zu. |
|
Längere Immobilisierung, grössere chirurgische Eingriffe, jeder Eingriff an Beinen oder Hüfte, neurochirurgischer Eingriff oder schweres Trauma |
In diesen Fällen ist es ratsam, die Anwendung des Vaginalrings zu unterbrechen (bei einer geplanten Operation mindestens vier Wochen vorher) und frühestens zwei Wochen nach vollständiger Mobilisierung wieder aufzunehmen. Ggf. ist eine andere Kontrazeptionsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern. |
|
Positive Familienanamnese (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z.B. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Patientin zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung von NuvaRing getroffen wird. |
|
Andere Erkrankungen, die mit einem erhöhten VTE-Risiko assoziiert sind |
Systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, chronisch-entzündliche Darmerkrankungen (Morbus Crohn oder Colitis ulcerosa), Sichelzellanämie, maligne Erkrankungen |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
Hinweis: Eine vorübergehende Immobilisierung wie beispielsweise eine Flugreise von >4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Patientinnen mit weiteren Risikofaktoren.
Über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose besteht kein Konsens.
Es muss beachtet werden, dass das Risiko thromboembolischer Ereignisse in der postpartalen Phase erhöht ist. Es gibt Daten, die darauf hindeuten, dass das Thromboserisiko bis 12 Wochen nach der Entbindung erhöht sein kann.
Symptome einer VTE (tiefe Venenthrombose und Lungenembolie)
Der Patientin ist anzuraten, bei Auftreten eines oder mehrerer der folgenden Symptome unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie NuvaRing anwendet.
·Symptome einer tiefen Beinvenenthrombose können sein
·unilaterale Schwellung in einem Bein oder entlang einer Vene im Bein;
·Spannungsgefühl oder Schmerzen in einem Bein, auch wenn sie nur beim Stehen oder Gehen spürbar sind;
·Überwärmung, Rötung oder Verfärbung der Haut am betroffenen Bein.
·Symptome einer Lungenembolie können sein
·plötzliche unerklärliche Kurzatmigkeit, schnelles Atmen oder Atemnot; Anstrengungsintoleranz;
·plötzliches Auftreten von Husten, eventuell mit blutigem Sputum;
·plötzlicher starker Schmerz im Brustkorb, welcher sich bei tiefer Atmung verstärken kann;
·starke Benommenheit, Schwindel, oder Angstgefühl;
·Tachykardie oder Arrhythmien.
Einige dieser Symptome (z.B. Kurzatmigkeit oder Husten) sind nicht spezifisch und können als häufige oder weniger schwere Ereignisse (z.B. Atemwegsinfektionen) missdeutet werden.
Risiko für arterielle Thromboembolien (ATE)
Epidemiologische Studien haben ausserdem die Anwendung von CHC mit einem erhöhten Risiko für arterielle thromboembolische Ereignisse (wie Myokardinfarkt, Schlaganfall oder transitorische ischämische Attacken) in Verbindung gebracht. Bevor die Entscheidung getroffen wird, NuvaRing zu verordnen, ist die Patientin über dieses Risiko sowie insbesondere auch darüber aufzuklären, wie eventuell vorbestehende individuelle Risikofaktoren dieses Risiko zusätzlich erhöhen können.
Äusserst selten wurde bei Anwenderinnen von CHC auch über Thrombosen in anderen Blutgefässen (wie z.B. hepatischen, mesenterialen, renalen oder retinalen Arterien) berichtet.
Risikofaktoren für ATE
Ein erhöhtes Risiko für einen zerebrovaskulären Insult oder andere arterielle thromboembolische Komplikationen bei Anwenderinnen von CHC besteht v.a. bei Frauen, die bereits Risikofaktoren für solche Erkrankungen aufweisen (siehe Tabelle). Insbesondere muss bei der Nutzen-Risiko-Abwägung beachtet werden, dass das Risiko für arterielle thromboembolische Ereignisse überadditiv erhöht sein kann, wenn eine Kombination von Risikofaktoren vorliegt. In diesem Fall muss das Gesamtrisiko für eine ATE betrachtet werden. Bei Patientinnen, die aufgrund eines schwerwiegenden oder des Vorliegens mehrerer Risikofaktoren ein hohes Risiko für eine ATE aufweisen, ist NuvaRing kontraindiziert.
Tabelle: Risikofaktoren für ATE
|
Risikofaktor |
Anmerkung |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
|
Rauchen |
Frauen ist anzuraten, nicht zu rauchen, wenn sie ein CHC wie NuvaRing anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Kontrazeptionsmethode anzuwenden. |
|
Arterielle Hypertonie |
|
|
Diabetes mellitus |
Bei Diabetikerinnen mit bereits bestehenden Gefässkomplikationen ist die Anwendung von CHC kontraindiziert. |
|
Dyslipoproteinämie |
|
|
Herzklappenerkrankungen |
|
|
Vorhofflimmern |
|
|
Adipositas (Body-Mass-Index über 30 kg/m²) |
Das Risiko nimmt mit steigendem BMI deutlich zu. |
|
Positive Familienanamnese (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d.h. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Patientin zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung von NuvaRing getroffen wird. |
|
Migräne |
Ein Anstieg der Häufigkeit oder des Schweregrads einer Migräne während der Anwendung von NuvaRing kann ein Prodromalsymptom eines zerebrovaskulären Ereignisses darstellen und Grund für ein sofortiges Absetzen sein. |
|
Andere Erkrankungen, die mit einem erhöhten Risiko für ATE assoziiert sind |
Hyperhomocysteinämie, systemischer Lupus erythematodes, Sichelzellanämie, maligne Erkrankungen. |
Symptome einer ATE
Der Patientin ist anzuraten, beim Auftreten eines oder mehrerer der folgenden Symptome unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie NuvaRing anwendet.
·Symptome eines zerebrovaskulären Insults können sein
·plötzliche Taubheit oder Kraftlosigkeit des Gesichtes, eines Armes oder Beines, vor allem einer Körperhälfte;
·plötzliche Verwirrtheit;
·undeutliche Aussprache oder Verständnisprobleme;
·plötzliche Sehstörungen in einem oder beiden Augen;
·plötzliche Gehstörungen;
·Schwindel;
·Gleichgewichts- oder Koordinationsstörungen;
·plötzliche schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
·Bewusstseinsverlust oder Ohnmacht mit oder ohne Krampfanfall.
·Symptome eines Myokardinfarktes können sein
·Schmerzen, Unwohlsein, Druckgefühl, Schweregefühl, Enge- oder Spannungsgefühl in der Brust, im Arm oder hinter dem Brustbein;
·Beschwerden, welche in Rücken, Kiefer, Hals, Arm oder Magen ausstrahlen;
·Völlegefühl, Magenbeschwerden oder Würgereiz;
·Schwitzen, Nausea, Erbrechen oder Schwindel;
·extremes Schwäche- oder Angstgefühl oder Kurzatmigkeit;
·Tachykardie oder Arrhythmien.
·Andere Symptome eines vaskulären Verschlusses können sein
·plötzlicher Schmerz, Schwellung oder leichte Cyanose einer Extremität;
·akutes Abdomen.
Verdacht auf hereditäre oder erworbene Prädisposition für thromboembolische Komplikationen
Bei Verdacht auf eine hereditäre oder erworbene Prädisposition für thromboembolische Komplikationen ist eine gerinnungs-physiologische Abklärung durch einen Spezialisten angezeigt, welcher ggf. eine Bestimmung bestimmter hämostatischer Parameter veranlassen wird.
Tumorerkrankungen
In einigen epidemiologischen Untersuchungen wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von CHC (>5 Jahre) berichtet. Es wird jedoch nach wie vor kontrovers diskutiert, in wie weit dieses Ergebnis durch andere Faktoren wie eine Infektion durch humane Papillomaviren (HPV) (stärkster Risikofaktor), die Frequenz der Teilnahme am Zervix-Screening oder das Sexualverhalten beeinflusst wird.
Eine Metaanalyse von 54 epidemiologischen Studien hat ergeben, dass das relative Risiko (RR) der Diagnosestellung eines Mammakarzinoms bei Frauen, die CHC anwenden, geringfügig erhöht (RR=1,24) ist. Nach Absetzen der CHC sinkt das erhöhte Risiko kontinuierlich ab und ist nach 10 Jahren nicht mehr nachweisbar. Da Mammakarzinome vor dem 40. Lebensjahr selten sind, ist bei Frauen, die ein CHC anwenden oder bis vor kurzem angewendet haben, die zusätzlich diagnostizierte Anzahl an Mammakarzinomen im Verhältnis zum Mammakarzinom-Gesamtrisiko gering. Diese Studien liefern keine Hinweise auf eine Kausalität. Die beobachtete Risikoerhöhung kann sowohl auf eine bei Anwenderinnen von CHC frühzeitigere Erkennung als auch auf biologische Wirkungen von CHC oder auf beide Faktoren gemeinsam zurückzuführen sein. Mammakarzinome bei Frauen, die ein CHC angewendet haben, waren zum Zeitpunkt der Diagnosestellung tendenziell weniger weit fortgeschritten als bei Frauen, die nie ein CHC angewendet hatten.
In seltenen Fällen wurde unter Anwendung hormonaler Kontrazeptiva über gutartige, noch seltener über bösartige Lebertumore berichtet. In isolierten Fällen führten diese Tumore zu lebensbedrohlichen intraabdominalen Blutungen. Deshalb sollte ein Lebertumor in die differentialdiagnostischen Überlegungen miteinbezogen werden, wenn bei NuvaRing-Anwenderinnen starke Oberbauchbeschwerden, eine Lebervergrösserung oder Hinweise auf intraabdominale Blutungen auftreten.
Depressive Störungen
Depressionen bzw. depressive Verstimmungen sind als mögliche unerwünschte Wirkungen bei der Anwendung von Sexualhormonen, einschliesslich hormonaler Kontrazeptiva, bekannt (s. a. «Unerwünschte Wirkungen»). Solche Störungen können bereits kurz nach Beginn der Behandlung auftreten. Eine Depression kann schwerwiegend verlaufen und stellt einen Risikofaktor für Suizide bzw. suizidales Verhalten dar. Anwenderinnen hormonaler Kontrazeptiva sollen daher über mögliche Symptome depressiver Störungen informiert werden. Der Anwenderin soll dringend geraten werden, sich umgehend an einen Arzt zu wenden, falls sie unter der Anwendung des Kontrazeptivums Stimmungsschwankungen oder andere Symptome einer Depression bemerkt. Anwenderinnen mit einer schweren Depression in der Anamnese sollen sorgfältig überwacht werden. Falls es unter der Anwendung von NuvaRing erneut zu schweren depressiven Zuständen kommt, muss das Arzneimittel abgesetzt werden.
Lokalisierte Risiken
Unter Anwendung von NuvaRing kann es gelegentlich zu einer Vaginitis kommen. Es gibt keine Hinweise, dass die kontrazeptive Wirkung von NuvaRing durch die Behandlung einer Vaginitis beeinträchtigt werden kann oder dass NuvaRing die Wirkung einer Vaginitisbehandlung beeinflussen könnte.
Sehr selten wurde über Verwachsungen mit vaginalem Gewebe berichtet, was eine Entfernung des Vaginalringes durch einen Arzt bzw. eine Ärztin erforderte. In solchen Fällen kann eine Entfernung auch ohne Inzision des darüberliegenden vaginalen Gewebes möglich sein, indem der Vaginalring an einer Stelle durchtrennt wird. In diesem Fall muss darauf geachtet werden, dass der Vaginalring vollständig entfernt wird.
In sehr seltenen Fällen wurde NuvaRing irrtümlich in die Urethra eingesetzt und gelangte dabei möglicherweise in die Blase. Deshalb sollte bei Symptomen einer Zystitis eine unsachgemässe Positionierung in Betracht gezogen werden.
Unter den folgenden Umständen ist es möglich, dass eine Anwenderin entweder nicht in der Lage ist, den Vaginalring richtig einzusetzen, oder sie diesen verlieren könnte: Prolaps des Gebärmutterhalses, Zystozele und/oder Rectozele, starke bzw. chronische Obstipation.
Toxisches Schock Syndrom (TSS)
Fälle von TSS wurden bei NuvaRing-Anwenderinnen berichtet. TSS wurde mit der Verwendung von Tampons und gewissen barrierebildenden Kontrazeptiva in Verbindung gebracht, und in einigen Fällen benutzten die NuvaRing-Anwenderinnen ebenfalls Tampons. Ein kausaler Zusammenhang zwischen der Verwendung von NuvaRing und TSS konnte nicht hergestellt werden. Falls eine Patientin Symptome eines TSS aufweist, sollte diese Diagnose in Betracht gezogen und eine angemessene medizinische Untersuchung und Behandlung veranlasst werden.
Es soll darüber aufgeklärt werden, dass NuvaRing keinen Schutz vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten bietet.
Auswirkungen von Ethinylestradiol und Etonogestrel auf den männlichen Sexualpartner
Das Ausmass und die mögliche pharmakologische Auswirkung einer Ethinylestradiol- und Etonogestrel-Absorption durch den Penis auf den männlichen Partner wurde nicht untersucht.
Sonstige Vorsichtsmassnahmen
Über Hypersensitivitätsreaktionen wie Angioödem und anaphylaktische Reaktionen wurde während der Anwendung von NuvaRing berichtet. Exogene Östrogene können bei Frauen mit hereditärem und/oder erworbenem Angioödem die Symptome des Angioödems induzieren oder verschlimmern. Falls eine solche Reaktion vermutet wird, sollte NuvaRing abgesetzt und eine entsprechende Behandlung eingeleitet werden.
Frauen, die ein hormonales Kontrazeptivum anwenden, sollen nicht gleichzeitig mit Johanniskraut-Präparaten (Hypericum) behandelt werden, da die kontrazeptive Wirkung beeinträchtigt sein kann. Über Zwischenblutungen und Einzelfälle ungewollter Schwangerschaften bei gleichzeitiger Anwendung von oralen hormonalen Kontrazeptiva und Johanniskraut-Präparaten wurde berichtet (siehe auch «Interaktionen»).
Bei Frauen mit bestehender oder familiärer Hypertriglyzeridämie ist unter der Anwendung von CHC möglicherweise mit einem erhöhten Pankreatitis-Risiko zu rechnen.
Obwohl unter der Anwendung von CHC relativ häufig über einen geringfügigen Blutdruckanstieg berichtet wird, sind klinisch relevant erhöhte Blutdruckwerte selten. Kommt es unter der Anwendung eines CHC zu einer klinisch relevanten Blutdruckerhöhung (bei wiederholter Messung), sollte das CHC abgesetzt werden. Wo es angezeigt erscheint, kann die erneute Anwendung eines CHC erwogen werden, wenn sich die Blutdruckwerte (unter Behandlung) normalisiert haben.
Obwohl es unter der Anwendung von CHC zu einer Beeinflussung der peripheren Insulinresistenz und der Glukosetoleranz kommen kann, scheint eine Änderung des Therapieschemas bei Diabetikerinnen, die niedrigdosierte CHC (mit <0,050 mg Ethinylestradiol) anwenden, nicht erforderlich. Dennoch sollten Diabetikerinnen – insbesondere während der ersten Monate der Anwendung von NuvaRing – sorgfältig überwacht werden.
Akute oder chronische Störungen der Leberfunktion können das Absetzen des CHC erforderlich machen, bis sich die Leberfunktionswerte normalisiert haben. Beim Wiederauftreten eines cholestatischen Ikterus und/oder Pruritus, der erstmalig während einer Schwangerschaft oder während einer früheren Einnahme von Sexualsteroidhormonen aufgetreten ist, müssen CHC abgesetzt werden.
Bei Patientinnen mit Hepatitis C, welche gleichzeitig ein Ethinylestradiol-haltiges CHC anwendeten, wurde unter Anwendung der bei HCV-Infektionen eingesetzten Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir signifikant häufiger ein Anstieg der ALT (einschliesslich Fällen einer Erhöhung auf über das Fünffache, in Einzelfällen auf über das 20-Fache der Obergrenze des Normbereiches) beobachtet als bei Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden (siehe «Interaktionen»). Ähnliche ALT-Erhöhungen wurden auch unter Anti-HCV-Arzneimitteln beobachtet, die Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir enthielten. NuvaRing muss daher vor Beginn einer Therapie mit diesen Wirkstoffkombinationen abgesetzt werden. Unter der Voraussetzung, dass normale Leberwerte vorliegen, kann frühestens 2 Wochen, besser jedoch 4 Wochen nach dem Absetzen der Wirkstoffkombinationen Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir, Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir wieder mit der Anwendung von NuvaRing begonnen werden. Hierbei ist allerdings zu beachten, dass bei einem Intervall von weniger als 4 Wochen aufgrund der enzyminduzierenden Eigenschaften von Ritonavir die Wirksamkeit des CHC noch beeinträchtigt sein kann und daher zusätzlich für 28 Tage eine Barrieremethode angewendet werden sollte (siehe unten unter «Interaktionen, Enzyminduktoren»). Letzteres ist insbesondere dann relevant, wenn die Kombination Ombitasvir/Paritaprevir/Ritonavir zusammen mit dem potentiell teratogenen Wirkstoff Ribavirin angewendet wird.
Die folgenden Erkrankungen können sowohl während einer Schwangerschaft als auch während der Anwendung eines CHC auftreten oder ungünstig beeinflusst werden, doch lassen die verfügbaren Daten keine eindeutigen Schlüsse auf einen Kausalzusammenhang mit der Anwendung eines CHC zu: cholestatischer Ikterus und/oder Pruritus; Cholelithiasis; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Chorea minor; Herpes gestationis; Otosklerose-bedingter Hörverlust. Die Anwendung von CHC wurde ausserdem auch mit dem Auftreten von Morbus Crohn sowie Colitis ulcerosa assoziiert.
Bei prädisponierten Frauen kann die Anwendung von CHC gelegentlich ein Chloasma verursachen, das durch intensive Sonnenbestrahlung noch verstärkt wird. Frauen, die hierzu neigen, sollten sich deshalb keiner starken UV-Strahlung aussetzen.
Interaktionen
Hinweis: NuvaRing sollte nicht zusammen mit einem Diaphragma, einer Portiokappe oder einem Kondom für die Frau benutzt werden.
Anmerkung: Die Fachinformationen von gleichzeitig angewendeten Arzneimitteln sollten zu Rate gezogen werden, um mögliche Interaktionen auszuschliessen.
Einfluss anderer Arzneimittel auf die Pharmakokinetik hormonaler Kontrazeptiva
• Enzyminduktoren
Interaktionen zwischen hormonalen Kontrazeptiva und Arzneimitteln, die mikrosomale Enzyme (insbesondere Cytochrom-P450 Enzyme) induzieren und dadurch eine erhöhte Clearance von Sexualhormonen verursachen, können zu einer Verminderung der kontrazeptiven Wirksamkeit sowie zu Durchbruchblutungen führen. Dies gilt z.B. für Barbiturate, Bosentan, Carbamazepin, Felbamat, Modafinil, Oxcarbazepin, Phenytoin, Primidon, Rifabutin, Rifampicin und Topiramat sowie für Arzneimittel, welche Johanniskraut (Hypericum perforatum) enthalten.
Eine Enzyminduktion kann bereits nach einigen Tagen der Behandlung auftreten. Die maximale Enzyminduktion wird im Allgemeinen nach 2-3 Wochen beobachtet und kann nach dem Absetzen während mindestens 4 oder mehr Wochen andauern.
Frauen, welche kurzfristig mit einem der genannten Arzneimittel behandelt werden, sollten dazu aufgefordert werden, zusätzlich zu NuvaRing vorübergehend eine nicht-hormonale Kontrazeptionsmethode anzuwenden oder eine andere Art der Kontrazeption zu wählen. Die Barrieremethode sollte während der gleichzeitigen Anwendung der genannten Arzneimittel sowie für weitere 28 Tage nach deren Absetzen angewendet werden.
Wird die gleichzeitige Anwendung eines Enzyminduktors über den dreiwöchigen Ringzyklus hinaus fortgesetzt, sollte der nächste Vaginalring sofort eingesetzt werden, also ohne Einhaltung des gewohnten ringfreien Intervalls.
Im Falle einer Langzeitbehandlung mit Arzneimitteln, welche zu einer Enzyminduktion in der Leber führen, sollten alternative Kontrazeptionsmethoden angewendet werden.
Darüber hinaus ist bekannt, dass verschiedene Inhibitoren der HIV/HCV-Protease (z.B. Nelfinavir, Boceprevir, Telaprevir) und der nichtnukleosidischen Reverse-Transkriptase (z.B. Efavirenz [siehe unten], Nevirapin) sowie deren Kombinationen zu einer Erniedrigung oder einer Erhöhung der Plasmakonzentrationen von Östrogenen oder Gestagenen führen können. Diese Veränderungen können in manchen Fällen klinisch relevant sein. Beispielsweise wurde in einer publizierten Studie der Einfluss einer Efavirenz-haltigen Therapie auf die Pharmakokinetik eines Etonogestrel-haltigen subkutanen Implantates untersucht. Bei HIV-positiven Patientinnen unter der antiretroviralen Therapie war gegenüber Frauen ohne eine solche Komedikation die Cmax von Etonogestrel um 54%, die AUC um 63% erniedrigt.
lnsbesondere sind Proteaseinhibitoren wie Ritonavir oder Nelfinavir (einschliesslich deren Kombinationen) zwar als starke Inhibitoren von CYP3A4 bekannt, können jedoch bei gleichzeitiger Anwendung mit Steroidhormonen enzyminduzierende Eigenschaften aufweisen und dadurch die Plasmaspiegel von Östrogenen und Gestagenen reduzieren.
• Enzyminhibitoren
Starke und moderate CYP3A4-Inhibitoren wie Azol-Antimykotika (z.B. Itraconazol, Voriconazol, Posaconazol, Fluconazol), Makrolid-Antibiotika (Clarithromycin, Erythromycin), Cobicistat, Diltiazem, Verapamil und Grapefruitsaft können die Plasmaspiegel von Östrogenen und/oder Gestagenen erhöhen und dadurch zum vermehrten Auftreten unerwünschter Wirkungen führen.
Interferenz mit dem enterohepatischen Kreislauf
Bei gleichzeitiger kurzdauernder Anwendung (bis zu 10 Tage) von Antibiotika, welche keine Interaktionen mit dem CYP3A4-Enzymsystem aufweisen, ist nicht mit pharmakokinetischen Interaktionen zu rechnen. Bei der Beratung der Patientin sollte jedoch berücksichtigt werden, dass unter Umständen die Grunderkrankung (z.B. Geschlechtskrankheiten), derentwegen das Antibiotikum eingesetzt wird, die zusätzliche Verwendung einer nicht-hormonalen Kontrazeptionsmethode nahelegen kann.
Über mögliche Interaktionen bei längerfristiger Komedikation mit Antibiotika (z.B. bei Osteomyelitis oder Borreliose) liegen keine ausreichenden Daten vor. Soll eine Schwangerschaft sicher ausgeschlossen werden, wird in solchen Fällen während der Antibiotikatherapie sowie in den ersten 7 Tagen nach deren Absetzen die zusätzliche Verwendung einer nicht-hormonalen Kontrazeptionsmethode empfohlen.
Einfluss hormonaler Kontrazeptiva auf die Pharmakokinetik anderer Arzneimittel
Hormonale Kontrazeptiva können – durch verschiedene lnteraktionsmechanismen – auch die Pharmakokinetik einiger anderer Arzneimittel beeinflussen. Sie können die hepatischen mikrosomalen Enzyme hemmen oder die hepatische Konjugation, insbesondere die Glukuronidierung, induzieren. Entsprechend können die Plasma- und Gewebekonzentrationen andere Arzneimittel entweder erhöht (z.B. Cyclosporin) oder erniedrigt (z.B. Lamotrigin, siehe unten) werden. Weiter kann auch die pharmakologische Wirkung ausgewählter Substanzen der folgenden Arzneimittelklassen beeinflusst werden: Analgetika, Antidepressiva, Antidiabetika, Antimalariamittel, einige Benzodiazepine, einige β-Blocker, Kortikosteroide, orale Antikoagulantien und Theophyllin. Nicht in allen Fällen sind die aus diesen Interaktionen resultierenden Veränderungen der Plasmaspiegel klinisch relevant.
Lamotrigin
Eine lnteraktionsstudie mit dem Antiepileptikum Lamotrigin und einem kombinierten oralen Kontrazeptivum (30 µg Ethinylestradiol/150 µg Levonorgestrel) zeigte eine klinisch relevante Steigerung der Lamotrigin-Clearance mit einer entsprechenden signifikanten Abnahme der Lamotrigin-Plasmaspiegel, wenn diese Arzneimittel gleichzeitig verabreicht wurden. Eine derartige Senkung der Plasmakonzentrationen kann mit einer reduzierten Anfallskontrolle einhergehen. Es ist nicht bekannt, in wieweit diese Befunde auf andere kombinierte Kontrazeptiva mit anderer Gestagenkomponente und/oder anderer Östrogendosis oder anderem Applikationsweg übertragbar sind. Es ist jedoch davon auszugehen, dass diese Präparate ein vergleichbares lnteraktionspotential aufweisen.
Beginnt eine Patientin, welche Lamotrigin einnimmt, neu mit der Anwendung von NuvaRing, kann daher eine Anpassung der Lamotrigindosis erforderlich sein, und die Lamotrigin-Konzentration sollte zu Beginn der Therapie engmaschig überwacht werden. Hierbei ist insbesondere auch zu beachten, dass es zu einem deutlichen Anstieg des Lamotriginspiegels (unter Umständen in den toxischen Bereich) kommen kann, wenn das hormonale Kontrazeptivum abgesetzt wird (sowie unter Umständen in der 7-tägigen Anwendungspausen).
Interaktionen mit unbekanntem Mechanismus
In klinischen Studien kam es bei gleichzeitiger Anwendung Ethinylestradiol-haltiger CHC zusammen mit der in der Therapie von HCV-Infektionen eingesetzten Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir gegenüber Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden, signifikant häufiger zu einem Anstieg der ALT (einschliesslich Fällen eines Anstiegs auf über das Fünffache, in Einzelfällen auf über das 20-Fache der oberen Grenze des Normbereiches [Upper Limit of Normal, ULN]). Ähnliche ALT-Erhöhungen wurden auch unter Anti-HCV-Arzneimitteln beobachtet, die Glecaprevir/Pibrentasvir oder Sofosbuvir/Velpatasvir/Voxilaprevir enthielten. NuvaRing muss daher vor Beginn einer Therapie mit einer solchen antiviralen Kombination abgesetzt werden (siehe auch «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Lokale Interaktionen
Aufgrund pharmakokinetischer Daten scheint es unwahrscheinlich, dass vaginal verabreichte Antimykotika und spermizide Mittel eine Auswirkung auf die Wirksamkeit und Sicherheit von NuvaRing haben können. Es gibt jedoch Berichte über Vaginalringbrüche bei gleichzeitiger Anwendung von intravaginalen Arzneimitteln (z.B. Antimykotika) oder Gleitmitteln (siehe auch «Dosierung/Anwendung», Gebrochene Vaginalringe).
Anwendung zusammen mit anderen vaginalen Kontrazeptionsmethoden
NuvaRing kann die korrekte Platzierung und Position von gewissen Barrieremethoden für die Frau, wie Diaphragma, Portiokappe oder Kondom für die Frau, beeinträchtigen. Diese Methoden sollten nicht als Zweitmethode zusammen mit NuvaRing verwendet werden.
Gleichzeitige Verwendung von Tampons
Pharmakokinetische Daten zeigen, dass die Anwendung von Tampons keinen Einfluss auf die systemische Absorption der freigesetzten Hormone hat. In seltenen Fällen kann NuvaRing beim Herausziehen eines Tampons versehentlich ausgestossen werden (s. Kapitel «Dosierung/Anwendung» unter «Vaginalring zeitweilig ausserhalb der Vagina (Ausstossen des Vaginalrings)»).
Schwangerschaft, Stillzeit
Schwangerschaft
Die Anwendung von NuvaRing ist während einer Schwangerschaft nicht indiziert. Vor Beginn der Anwendung des Arzneimittels ist eine Schwangerschaft auszuschliessen. Tritt unter der Anwendung eine Schwangerschaft ein oder wird eine solche vermutet, ist der NuvaRing sofort zu entfernen und der Arzt oder die Ärztin zu konsultieren.
Es gibt Hinweise auf fetale Risiken, basierend auf tierexperimentellen Untersuchungen (siehe «Präklinische Daten»). Die meisten bis heute durchgeführten epidemiologischen Studien haben jedoch keine eindeutigen Hinweise auf eine embryotoxische oder teratogene Wirkung ergeben, wenn Kombinationen aus Östrogenen und Gestagenen versehentlich während der Schwangerschaft angewendet wurden.
Stillzeit
Das Arzneimittel sollte nicht in der Stillzeit angewendet werden, da die Milchproduktion reduziert und die Milchqualität verändert sein kann und geringe Wirkstoffkonzentrationen in der Milch gemessen werden können. Wenn möglich sollten bis zum vollständigen Abstillen des Kindes nichthormonale Kontrazeptionsmethoden angewendet werden.
Zum postpartalen Risiko thromboembolischer Ereignisse bei der Mutter siehe «Warnhinweise und Vorsichtsmassnahmen».
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Aufgrund des pharmakodynamischen Profils sollte NuvaRing keinen Einfluss auf die Fahrtüchtigkeit und das Bedienen von Maschinen haben.
Unerwünschte Wirkungen
Die schwerwiegendsten unerwünschten Wirkungen im Zusammenhang mit der Anwendung von CHC sind in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben (siehe dort). Schwerwiegende unerwünschte Wirkungen sind insbesondere arterielle und venöse Thromboembolien.
Die häufigsten unerwünschten Wirkungen, über die in den klinischen Studien unter der Anwendung von NuvaRing berichtet wurde, waren Kopfschmerzen, Vaginitis und Fluor vaginalis (jeweils bei 5-6% der Anwenderinnen). Nachfolgend sind die unerwünschten Wirkungen nach Organsystem und Häufigkeit angegeben, welche in den klinischen Studien sowie während der Marktüberwachung unter der Anwendung von NuvaRing beobachtet wurden. Die Häufigkeiten sind dabei wie folgt definiert:
häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000) und unbekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann anhand der verfügbaren Daten nicht abgeschätzt werden).
Infektionen und parasitäre Erkrankungen
Häufig: Vaginale Candidiasis, vulvovaginale Pilzinfektion.
Gelegentlich: Zervizitis, Harnwegsinfektion, Pilzinfektion, vaginale Infektion (z.B. bakterielle Vaginitis).
Erkrankungen des Immunsystems
Selten: Hypersensitivitätsreaktionen (einschliesslich Angioödem und anaphylaktischer Reaktion).
Stoffwechsel und Ernährungsstörungen
Häufig: Gewichtszunahme.
Gelegentlich: Gesteigerter Appetit.
Psychiatrische Erkrankungen
Häufig: Depression, verringerte Libido.
Gelegentlich: Ängstlichkeit, Stimmungsveränderungen, Stimmungsschwankungen.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Migräne.
Gelegentlich: Schwindel, Hypoästhesien.
Augenerkrankungen
Gelegentlich: Sehstörungen.
Gefässerkrankungen
Gelegentlich: Hitzewallung, Hypertonie.
Selten: Venöse thromboembolische Ereignisse (z.B. tiefe Venenthrombose, Lungenembolie), arterielle thromboembolische Ereignisse (z.B. transitorische ischämische Attacke, Schlaganfall, Myokardinfarkt).
Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominalschmerzen, Übelkeit.
Gelegentlich: Erbrechen, aufgetriebenes Abdomen, Diarrhoe, Obstipation.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Akne.
Gelegentlich: Hautausschlag, Alopezie, Ekzem, Pruritus, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Rückenschmerzen, Muskelkrämpfe, Schmerzen in den Extremitäten.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Dysurie, Harndrang, Pollakisurie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Unterleibsschmerzen, Empfindlichkeit der Brust, Dysmenorrhoe, Fluor vaginalis, genitaler Pruritus.
Gelegentlich: Brustbeschwerden, Menorrhagie, Metrorrhagie, Amenorrhoe, vulvovaginale Beschwerden (wie vulvovaginale Trockenheit, brennendes Gefühl in der Vagina, Vaginalschmerzen, Foetor vaginalis), Gebärmutterkrämpfe, Brusthypertrophie, prämenstruelles Syndrom, fibrozystische Veränderungen der Brust, Dyspareunie, koitale Blutung, Ektropium der Zervix, Zervixpolypen.
Selten: Galaktorrhoe, Funktionsstörungen des Penis (inklusive lokaler Reaktionen am Penis) beim Partner.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Fremdkörpergefühl, Ausstossung des Vaginalrings.
Gelegentlich: Unwohlsein, Asthenie, Reizbarkeit, Vaginalring-bedingte Komplikationen (z.B. Schwierigkeiten beim Einführen und/oder Entfernen), gebrochener Vaginalring, Ödeme.
Unbekannt: Vaginale Verletzungen in Zusammenhang mit einem gebrochenen Vaginalring.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es liegen keine Meldungen über schwerwiegende Folgen bei Überdosierung hormonaler Kontrazeptiva vor. Mögliche Symptome einer Überdosierung sind: Übelkeit, Erbrechen und vaginale Blutungen. Letztere können nach versehentlicher Einnahme des Präparates auch bei Mädchen vor der Menarche auftreten. Ein Antidot ist nicht bekannt; die Behandlung hat symptomatisch zu erfolgen.
Eigenschaften/Wirkungen
ATC-Code
G02BB01
Wirkungsmechanismus/Pharmakodynamik
NuvaRing ist ein hormonales Kontrazeptivum zur vaginalen Anwendung mit den Wirkstoffen Etonogestrel und Ethinylestradiol. Etonogestrel (ENG, 3-Keto-Desogestrel) ist der biologisch aktive Metabolit von Desogestrel, einem von 19-Nortestosteron abgeleiteten Gestagen, das mit hoher Affinität an die Gestagenrezeptoren in den Zielorganen bindet. Ethinylestradiol (EE) ist ein Östrogen, das häufig in Kontrazeptiva verwendet wird.
Wie bei allen kombinierten hormonalen Kontrazeptiva (CHC) beruht die kontrazeptive Wirkung von NuvaRing auf verschiedenen Faktoren, als deren wichtigste die Ovulationshemmung und die Veränderung des Zervixsekrets anzusehen sind. Darüber hinaus bietet das Endometrium infolge der morphologischen und enzymatischen Veränderungen ungünstige Verhältnisse für die Nidation. Ausserdem führen die durch das CHC induzierten hormonellen Veränderungen zu regelmässigeren Zyklen und einer geringeren Blutungsstärke.
Klinische Wirksamkeit
Weltweit wurden klinische Studien bei Frauen im Alter von 18 bis 40 Jahren durchgeführt. In diesen Studien betrug der durchschnittliche Pearl-Index (PI), wenn sowohl Anwendungs- als auch Methodenfehler berücksichtigt wurden, 0,96 (95% CI: 0,64-1,39). Unter Berücksichtigung ausschliesslich von Methodenfehlern lag der PI bei 0,64 (95% CI: 0,35-1,07). Damit war der Pearl Index von NuvaRing jenem oraler kombinierter Kontrazeptiva vergleichbar.
Blutungsmuster
Eine grosse Vergleichsstudie mit oralen 150/30 μg Levonorgestrel/Ethinylestradiol Kontrazeptiva (n=512 vs n=518) zur Evaluation der Blutungseigenschaften während 13 Zyklen zeigte eine geringe Inzidenz von Schmier- oder Durchbruchblutungen (2,0-6,4%) bei der Anwendung von NuvaRing. Zudem traten die vaginalen Blutungen bei den meisten Probandinnen ausschliesslich während des ringfreien Intervalls auf (58,8-72,8%).
Auswirkungen auf die Knochendichte
Der Einfluss von NuvaRing auf die Knochendichte (n=76) wurde über zwei Jahre mit jenem einer nicht- hormonhaltigen Spirale (n=31) verglichen. Es wurden keine unerwünschten Wirkungen auf die Knochendichte beobachtet.
Pharmakokinetik
Absorption
Etonogestrel (ENG)
Das von NuvaRing freigesetzte ENG wird rasch von der Vaginalmukosa absorbiert. Maximale Serumkonzentrationen von ca. 1700 pg/ml ENG werden etwa eine Woche nach dem Einsetzen erreicht. Die Serumspiegel zeigen leichte Fluktuationen und sinken langsam auf 1600 pg/ml nach 1 Woche, 1500 pg/ml nach 2 Wochen und 1400 pg/ml nach drei Wochen. Die absolute Bioverfügbarkeit von ENG beläuft sich auf ungefähr 100% und ist somit höher als nach oraler Applikation von Desogestrel.
Bei einer kleinen Anzahl von Anwenderinnen (n=8) von NuvaRing oder einem kombinierten oralen Kontrazeptivum mit 0,15 mg Desogestrel und 0,02 mg Ethinylestradiol wurden zervikale und intrauterine Etonogestrel-Konzentrationen bestimmt. Die Konzentrationen waren unter beiden Präparaten vergleichbar.
Ethinylestradiol (EE)
Das von NuvaRing freigesetzte EE wird rasch von der Vaginalmukosa absorbiert. Maximale Serumspiegel von etwa 35 pg/ml wurden drei Tage nach dem Einsetzen erreicht. Nach 1 Woche waren die Spiegel auf 19 pg/ml abgefallen, zum Zeitpunkt der Vaginalringentfernung nach 3 Wochen, lagen sie noch bei etwa 18 pg/ml. Die AUC über einen Monat wurde mit 10,9 ng×h/ml bestimmt.
Die absolute Bioverfügbarkeit beträgt etwa 56% und ist mit jener nach oraler Verabreichung von EE vergleichbar.
Bei einer kleinen Anzahl von Anwenderinnen (n=8) von NuvaRing oder einem kombinierten oralen Kontrazeptivum mit 0,150 mg Desogestrel und 0,020 mg Ethinylestradiol wurden zervikale und intrauterine Ethinylestradiol-Konzentrationen bestimmt. Die gefundenen Konzentrationen waren vergleichbar.
Distribution
ENG
ENG wird sowohl an Serumalbumin als auch an Sexualhormon-bindendes Globulin (SHBG) gebunden. Nur 2-4% der Gesamtkonzentration im Serum sind freies Steroid, 40-70% sind spezifisch und mit hoher Affinität an SHBG gebunden. Der Ethinylestradiol-bedingte Anstieg der SHBG-Konzentration beeinflusst die relative Bindung an Serumproteine, was zu einer Zunahme der SHBG-Bindung und zu einer Abnahme der Albumin-Bindung und der freien Fraktion führt. Das scheinbare Verteilungsvolumen von ENG beträgt 2,3 l/kg.
EE
EE ist sehr stark, aber unspezifisch an Serumalbumin gebunden (ca. 98,5%) und verursacht einen Anstieg der Serumkonzentration von SHBG. Das scheinbare Verteilungsvolumen beträgt ca. 15 l/kg.
Metabolismus
ENG
Etonogestrel wird in der Leber über CYP3A4 hydroxyliert sowie reduziert und zu Sulfaten und Glukuroniden konjugiert. Die Metaboliten sind inaktiv. Es wurden keine metabolischen Interaktionen aufgrund der gleichzeitigen Verabreichung von Ethinylestradiol (EE) gefunden.
EE
EE wird primär durch aromatische Hydroxylierung metabolisiert, wobei eine breite Palette von hydroxylierten und methylierten Metaboliten gebildet wird. Diese treten in Form von freien Metaboliten sowie als Sulfat- und Glucuronidkonjugate in Erscheinung. Cytochrom 3A4 ist am Metabolismus in erheblichem Mass beteiligt.
Elimination
ENG
Die ENG-Serumspiegel nehmen biphasisch mit einer terminalen Halbwertszeit von ca. 29 Stunden ab. Die scheinbare Plasmaclearance beträgt etwa 3,5 l/h. Die Ausscheidung von ENG und dessen Metaboliten erfolgt über den Urin und die Faezes in einem Verhältnis von etwa 1,7:1. Die Halbwertszeit der Metaboliten-Ausscheidung beträgt ca. 6 Tage.
EE
EE-Serumspiegel nehmen biphasisch mit einer terminalen mittleren Halbwertszeit (starke individuelle Schwankungen) von etwa 34 Stunden ab. Die scheinbare Clearance beträgt etwa 35 l/h. Ethinylestradiol wird vollständig metabolisiert und nicht unverändert ausgeschieden; die Metaboliten werden in einem Verhältnis von 1,3:1 über Nieren und Galle ausgeschieden. Die Halbwertszeit der Metaboliten beträgt etwa 1,5 Tage. Die Konjugate unterliegen einem enterohepatischen Kreislauf.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Es wurden keine Studien zu den Auswirkungen einer Leberinsuffizienz auf die Pharmakokinetik von NuvaRing durchgeführt. Es ist jedoch bekannt, dass Steroidhormone bei Patienten mit eingeschränkter Leberfunktion verlangsamt metabolisiert werden.
Nierenfunktionsstörungen
Es wurden keine Studien zu eventuellen Auswirkungen einer Niereninsuffizienz auf die Pharmakokinetik von NuvaRing durchgeführt.
Kinder und Jugendliche
Die Pharmakokinetik von NuvaRing wurde ausschliesslich bei Erwachsenen untersucht.
Präklinische Daten
Präklinische Untersuchungen mit kombinierten oralen Kontrazeptiva zur Toxizität nach wiederholter Gabe, zur Genotoxizität und zum karzinogenen Potential sowie reproduktionstoxikologische Studien ergaben keine eindeutigen Hinweise auf besondere Risiken für den Menschen.
Bei Versuchstieren zeigte Ethinylestradiol bereits in relativ geringer Dosierung einen embryoletalen Effekt; Missbildungen des Urogenitaltrakts und Feminisierung männlicher Feten wurden beobachtet. Gestagenartige Substanzen zeigen im Tierexperiment einen embryoletalen Effekt und, in hohen Dosen, eine virilisierende Wirkung auf weibliche Feten. Reproduktionstoxikologische Studien in Ratten, Mäusen und Kaninchen ergaben keine Hinweise auf eine teratogene Wirkung. Für Risiken beim Menschen siehe Rubrik «Schwangerschaft, Stillzeit».
Sonstige Hinweise
Beeinflussung diagnostischer Methoden
Kontrazeptive Steroide können die Ergebnisse gewisser Labortests beeinflussen, wie biochemische Parameter der Leber, Schilddrüse, Nebennieren- und Nierenfunktion, Plasmaspiegel von (Träger-) Proteinen und Lipid/Lipoproteinfraktionen, Parameter des Kohlenhydrat-Stoffwechsels sowie der Blutgerinnung und Fibrinolyse. Diese Änderungen bewegen sich im Allgemeinen innerhalb des entsprechenden Normalbereichs.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Zum Zeitpunkt der Abgabe: Der Arzt oder Apotheker vermerkt das Verkaufsdatum auf der Schachtel. NuvaRing sollte 4 Monate nach dem Verkaufsdatum bzw. nach dem angegebenen Verfalldatum (je nachdem, welcher Fall zuerst eintritt) nicht mehr verwendet werden.
Bei der Anwenderin: Innerhalb von 4 Monaten ab Abgabedatum bzw. vor Ablauf des Verfalldatums verwenden.
Besondere Lagerungshinweise
In der Originalverpackung aufbewahren.
Vor der Abgabe an die Anwenderin: Lagerung im Kühlschrank (2-8 °C).
Bei der Anwenderin: Lagerung bei 2-30 °C in der Originalverpackung vor Licht geschützt.
Ausser Reichweite von Kinder aufbewahren.
Hinweise für die Handhabung
Nach der Entfernung sollte der NuvaRing im wiederverschliessbaren Sachet mit dem üblichen Haushaltsabfall entsorgt werden, um einen versehentlichen Personenkontakt zu vermeiden. NuvaRing sollte nicht in der Toilette entsorgt werden.
Zulassungsnummer
56038 (Swissmedic).
Packungen
NuvaRing ist in einem wiederverschliessbaren und wasserdichten Beutel verpackt.
Packung mit 1 Vaginalring [B]
Packung mit 3 Vaginalringen [B]
Zulassungsinhaberin
Organon GmbH, Luzern
Stand der Information
Juli 2024
OG8342A-NuvaRing-072024-HMV4+removal-contraindication-pregnancy-RCN100002628-CH+RCN100004172-CH