Zusammensetzung
Wirkstoffe
Masernvirus (Stamm Schwarz) (lebend, attenuiert), Mumpsvirus (Stamm RIT 4385) (lebend, attenuiert), Rötelnvirus (Stamm Wistar RA 27/3) (lebend, attenuiert), Varizellenvirus (Stamm OKA) (lebend, attenuiert).
Hilfsstoffe
Pulver: Aminosäuren (enthält 583 µg Phenylalanin), Lactose, Mannitol (E 421), Sorbitol (E 420) 14 mg.
Lösungsmittel: Wasser für Injektionszwecke.
Rückstände aus dem Herstellungsprozess
Neomycinsulfat.
Indikationen/Anwendungsmöglichkeiten
Priorix-Tetra ist indiziert zur aktiven Immunisierung von Personen ab 12 Monaten gegen Masern, Mumps, Röteln und Varizellen (Windpocken).
Priorix-Tetra kann unter besonderen Umständen ab einem Alter von 9 Monaten verabreicht werden (z.B. in Übereinstimmung mit nationalen Impfempfehlungen, in epidemischen Situationen oder bei Reisen in eine Region mit hoher Masern-Prävalenz). Es ist dann jedoch zu berücksichtigen, dass Säuglinge im ersten Lebensjahr wegen möglichen Interferenzen mit den mütterlichen Antikörpern möglicherweise nicht genügend auf die Bestandteile des Impfstoffes ansprechen. Eine zweite Dosis Priorix-Tetra sollte bei diesen Kindern 3 Monate nach der ersten Dosis verabreicht werden (siehe «Eigenschaften/Wirkungen»).
Priorix-Tetra sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/Anwendung
Übliche Dosierung
Die Immunisierung besteht aus zwei Dosen Priorix-Tetra. Vorzugsweise sollte ein Mindestabstand von 6 Wochen zwischen den beiden Dosen eingehalten werden. Auf keinen Fall sollte der Abstand jedoch weniger als 4 Wochen betragen.
Alternativ kann eine Einzeldosis Priorix-Tetra nach der Immunisierung mit einer Dosis eines anderen Masern-Mumps-Röteln oder Masern-Mumps-Röteln-Varizellen-Impfstoffes verabreicht werden. Dabei ist zu beachten, dass Personen, die zuvor nicht gegen Varizellen geimpft worden sind, eine Dosis eines monovalenten Varizellen-Impfstoffes vorzugsweise 6 bis 12 Wochen nach der Impfung mit Priorix-Tetra verabreicht werden sollte, um den Schutz vor einer Varizellen-Durchbruchserkrankung zu erhöhen (siehe «Eigenschaften/Wirkungen»).
Art der Anwendung
Der Impfstoff ist bevorzugt subkutan oder intramuskulär in die Deltoid-Region des Oberarms oder in den anterolateralen Bereich des Oberschenkels zu injizieren.
Bei Personen mit Blutungsstörungen (z.B. Thrombozytopenie oder Gerinnungsstörungen) muss der Impfstoff subkutan verabreicht werden.
Hinweise zur Rekonstitution des Impfstoffes vor der Anwendung, siehe «Sonstige Hinweise».
Kontraindikationen
Wie bei allen anderen Impfstoffen sollte auch bei Priorix-Tetra die Impfung im Falle einer akuten und mit hohem Fieber einhergehenden Erkrankung auf einen späteren Zeitpunkt verschoben werden. Leichte Infekte stellen im Allgemeinen keine Kontraindikation für die Impfung dar.
Priorix-Tetra ist kontraindiziert bei bekannter Überempfindlichkeit gegenüber einem der Bestandteile des Impfstoffes oder Neomycin, oder bei Personen, die bei früheren Masern-, Mumps-, Röteln- und/oder Varizellen-Impfungen Zeichen einer Überempfindlichkeit zeigten. Eine Neomycin-Kontaktdermatitis in der Anamnese stellt keine Kontraindikation dar. Zu Hühnereiweissallergie siehe «Warnhinweise und Vorsichtsmassnahmen».
Priorix-Tetra ist bei schwangeren Frauen kontraindiziert. Ausserdem muss eine Schwangerschaft über einen Zeitraum von 3 Monaten nach der Impfung vermieden werden (siehe «Schwangerschaft/Stillzeit»).
Personen mit beeinträchtigter Immunfunktion sollten nicht mit Priorix-Tetra geimpft werden. Das trifft auch für Personen mit angeborenen oder erworbenen Immundefekten zu.
Warnhinweise und Vorsichtsmassnahmen
Priorix-Tetra darf unter keinen Umständen intravasal oder intradermal verabreicht werden.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie bei allen injizierbaren Impfstoffen sollte für den Fall einer anaphylaktischen Reaktion nach der Impfung immer angemessene medizinische Behandlungs- und Überwachungsmöglichkeiten verfügbar sein.
Alkohol oder andere Desinfektionsmittel müssen vollständig von der Hautoberfläche verdunstet sein, bevor der Impfstoff injiziert wird, da diese Mittel die attenuierten Viren im Impfstoff inaktivieren können.
Die Impfung von Kindern im Alter von 9-11 Monaten führt möglicherweise zu keiner ausreichenden Immunantwort auf die Bestandteile des Impfstoffes, da noch maternale Antikörper vorhanden sein können. Falls die Impfung von Säuglingen unter 12 Monaten wegen einer epidemiologischen Situation erforderlich ist, sollte eine 2. Dosis des MMRV-Impfstoffes drei Monate nach der ersten Dosis verabreicht werden (siehe «Eigenschaften/Wirkungen»).
Fieberkrämpfe
Während eines Zeitraums von 5 bis 12 Tagen nach Verabreichung der ersten Dosis Priorix-Tetra wurde ein erhöhtes Risiko für Fieber und Fieberkrämpfe im Vergleich zur gleichzeitigen Verabreichung von Masern, Mumps, Röteln (MMR)- und Varizellen-Impfstoffen beobachtet (siehe «Unerwünschte Wirkungen» und «Eigenschaften/Wirkungen»).
Eine Impfung von Kindern mit Krampfanfällen, einschliesslich Fieberkrämpfen, in der Eigen- oder Familienanamnese sollte mit Vorsicht erwogen werden. Für diese Kinder sollte für die erste Dosis alternativ eine getrennte Impfung mit MMR- und Varizellen-Impfstoffen in Betracht gezogen werden (siehe «Dosierung/Anwendung»). Auf alle Fälle sollten die Kinder während des Risikozeitraums auf Fieber und Fieberkrämpfe überwacht werden.
Im Allgemeinen werden nach Verabreichung der ersten Dosis eines Masern-Impfstoffes hohe Fieberraten beobachtet.
Die Masern- und Mumpskomponente des Impfstoffes werden in Kulturen embryonaler Hühnerzellen gezüchtet und können daher Spuren von Hühnereiweiss enthalten. Bei Personen mit anaphylaktischen, anaphylaktoiden oder anderen Reaktionen vom Soforttyp (z.B. generalisierte Urtikaria, Schwellung des Mundes und Rachens, Atembeschwerden, Hypotonie oder Schock) nach Verzehr von Hühnereiweiss ist das Risiko für eine Überempfindlichkeitsreaktion vom Soforttyp nach der Impfung erhöht, obwohl diese Reaktionen nur sehr selten beobachtet wurden. Personen, die schon einmal eine Überempfindlichkeitsreaktion vom Soforttyp nach dem Verzehr von Hühnereiweiss gezeigt haben, sollten mit äusserster Vorsicht geimpft werden. Für den Fall einer anaphylaktischen Reaktion sollten geeignete Behandlungsmassnahmen zur Verfügung stehen.
Die Anwendung von Salicylaten während einer natürlichen Windpockenerkrankung wird mit dem Auftreten eines Reye-Syndroms in Zusammenhang gebracht. Daher sollte die Anwendung von Salicylaten bis zu 6 Wochen nach Impfung mit Priorix-Tetra unterbleiben.
Übertragung
Eine Übertragung von Masern-, Mumps- oder Rötelnviren vom Impfling auf empfängliche Kontaktpersonen ist bisher nicht beschrieben worden, obwohl bekannt ist, dass eine Ausscheidung des Rötelnvirus über das Rachensekret etwa 7 bis 28 Tage nach der Impfung auftritt, mit einer maximalen Ausscheidung um den 11. Tag. Es wurde gezeigt, dass es bei geimpften Personen, die einen Hautausschlag entwickeln, in sehr seltenen Fällen zu einer Übertragung des OKA-Varizellen-Impfvirus auf seronegative Kontaktpersonen kommt. Es wurde auch gezeigt, dass es bei geimpften Personen, die keinen Hautausschlag entwickeln, in Einzelfällen zu einer Übertragung des OKA-Varizellen-Impfvirus auf seronegative Kontaktpersonen kommt. Geimpfte Personen, bei denen es zu einem windpockenähnlichen Ausschlag gekommen ist, sollten solange den Kontakt zu empfänglichen schwangeren Frauen und zu empfänglichen Personen mit einem hohen Risiko für eine schwere Windpockenerkrankung (wie Patienten mit angeborenen und erworbenen Immundefekten) vermeiden, bis der Ausschlag vollständig abgeklungen ist.
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Thrombozytopenie
Es wurde über Fälle einer Verschlimmerung und das Wiederauftreten einer Thrombozytopenie nach einer Impfung mit Masern-, Mumps- und Röteln-Lebendimpfstoffen bei Personen berichtet, bei denen bereits nach der ersten Dosis eine Thrombozytopenie aufgetreten war. In diesen Fällen wird eine erneute Impfung mit Priorix-Tetra nicht empfohlen. Die zweite Impfdosis zur Immunisierung gegen Varizellen soll, falls als notwendig erachtet, mit einem Mono-Varizellen-Impfstoff durchgeführt werden.
Die Anwendung von Priorix-Tetra bei Personen mit einer asymptomatischen HIV-Infektion wurde nicht untersucht.
Sehr wenige Berichte liegen vor über disseminierte Varizellenerkrankungen mit Beteiligung innerer Organe nach Impfung mit dem OKA-Varizellen-Impfstamm; diese betrafen insbesondere, aber nicht nur, immungeschwächte Personen. In Einzelfällen wurden auch fatale Verläufe trotz Therapie mit Aciclovir berichtet.
Enzephalitis
Nach Markteinführung von Masern-, Mumps-, Röteln-, Varizellen-Impfstoffen (lebend, abgeschwächt), einschliesslich Priorix-Tetra, wurden Fälle von Enzephalitis berichtet. Fatale Verläufe wurden beobachtet, insbesondere bei immungeschwächten Personen (siehe «Kontraindikationen»). Geimpfte bzw. Eltern/Erziehungsberechtigte sollen angewiesen werden, umgehend ärztliche Hilfe in Anspruch zu nehmen, wenn nach der Impfung Symptome auftreten, die auf eine Enzephalitis hindeuten, z.B. Bewusstseinsverlust oder -minderung, Krampfanfälle oder Ataxie, insbesondere in Verbindung mit Fieber und Kopfschmerzen.
Hilfsstoffe
Das Arzneimittel enthält 14 mg Sorbitol pro Impfdosis. Patienten mit einer seltenen hereditären Fructoseintoleranz sollte der Impfstoff nicht verabreicht werden.
Dieses Arzneimittel enthält 583 Mikrogramm Phenylalanin pro Impfdosis. Phenylalanin kann schädlich sein für Patienten mit Phenylketonurie.
Interaktionen
Priorix-Tetra kann gleichzeitig, aber an verschiedenen Injektionsstellen, mit jedem der folgenden monovalenten oder kombinierten Impfstoffe, einschliesslich hexavalenten Impfstoffe (DTPa-IPV-Hib-HBV), verabreicht werden: Diphterie-Tetanus-azelluläre Pertussis (DTPa), Haemophilus influenza-Typ b (Hib), Polio inaktiviert (IPV), Hepatitis B (HBV).
Für den gleichzeitigen Gebrauch von Priorix-Tetra mit anderen Impfstoffen liegen keine Daten vor.
Ein eventuell erforderlicher Tuberkulintest muss entweder vor oder gleichzeitig mit der Impfung vorgenommen werden, da kombinierte Masern-Mumps-Röteln-Lebendimpfstoffe die Tuberkulinempfindlichkeit der Haut zeitweise herabsetzen können. Da diese verminderte Reaktion bis zu maximal 6 Wochen anhalten kann, sollte zur Vermeidung falsch negativer Ergebnisse ein Tuberkulintest nicht innerhalb dieses Zeitraumes nach der Impfung durchgeführt werden.
Bei Personen, die humane Immunoglobuline oder eine Bluttransfusion erhalten haben, sollte eine Impfung mit Priorix-Tetra frühestens nach 3 Monaten vorgenommen werden, da die Möglichkeit eines Impfversagens durch passiv erworbene Antikörper gegen Masern, Mumps, Röteln und/oder Varizellen besteht.
Die Anwendung von Acetylsalicylsäure (ASS) während einer natürlichen Windpockenerkrankung wird mit dem Auftreten eines Reye-Syndroms in Zusammenhang gebracht. Daher sollte die Verwendung von ASS bis zu 6 Wochen nach Impfung mit Priorix-Tetra unterbleiben.
Kann Priorix-Tetra nicht gleichzeitig mit anderen attenuierten Lebendimpfstoffen verabreicht werden, sollte ein Zeitabstand von mindestens einem Monat zwischen den Impfungen eingehalten werden.
Schwangerschaft, Stillzeit
Schwangerschaft
Die Impfung mit Priorix-Tetra ist bei schwangeren Frauen kontraindiziert. Ausserdem muss eine Schwangerschaft über einen Zeitraum von 3 Monaten nach der Impfung vermieden werden.
Tierexperimentelle Studien zur Reproduktionstoxizität wurden nicht durchgeführt.
Stillzeit
Es liegen keine ausreichenden Daten zur Anwendung von Priorix-Tetra während der Stillzeit vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Studien zu den Auswirkungen von Priorix-Tetra auf die Fahrtüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen wurden nicht durchgeführt. Ein Teil der im Kapitel «Unerwünschte Wirkungen» beschriebenen Nebenwirkungen kann einen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen haben. Siehe «Unerwünschte Wirkungen».
Unerwünschte Wirkungen
Daten aus klinischen Studien
Das folgende Sicherheitsprofil basiert auf Daten von mehr als 6'700 Dosen, die an Kinder im Alter von 9 bis 27 Monaten verabreicht wurden. Die Ereignisse wurden bis zu 42 Tage nach der Impfung im Rahmen klinischer Studien aktiv erfasst.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1'000, <1/100), «selten» (≥1/10'000, <1/1'000), «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektionen der oberen Atemwege.
Selten: Mittelohrentzündung.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Lymphadenopathie.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Appetitlosigkeit.
Psychiatrische Erkrankungen
Häufig: Reizbarkeit.
Gelegentlich: Schreien, Nervosität, Schlaflosigkeit.
Erkrankungen des Nervensystems
Selten: Fieberkrämpfe* (siehe auch unter «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Schnupfen.
Selten: Husten, Bronchitis.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Vergrösserung der Ohrspeicheldrüse, Durchfall, Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerzen an der Injektionsstelle (10,1%), Rötung an der Injektionsstelle (23,2%), Fieber (rektal ≥ 38°C - ≤ 39,5°C; axillar/oral ≥ 37,5°C - ≤ 39°C) (35,8%)**.
Häufig: Schwellung an der Injektionsstelle, Fieber (rektal > 39,5°C; axillar/oral > 39,0°C)**.
Gelegentlich: Lethargie, Unwohlsein, Mattigkeit.
* In einer retrospektiven Datenbank-Analyse wurde das Risiko für Fieberkrämpfe nach Verabreichung der ersten Dosis Priorix-Tetra im Vergleich zur Impfung mit einem MMR-Impfstoff oder der gleichzeitigen Verabreichung eines MMR- und eines Varizellen-Impfstoffes in unterschiedliche Gliedmassen bei Kindern im Alter von 9 bis 30 Monaten untersucht.
In der Studie wurden 82'656 Kinder mit einem MMRV- und 149'259 Kinder mit einem MMR-Impfstoff geimpft. Bei 39'203 Kindern erfolgte eine gleichzeitige Verabreichung von MMR- und Varizellen-Impfstoffen.
Abhängig von der Falldefinition, die für die Bestimmung von Fieberkrämpfen im Zeitraum mit dem höchsten Risiko (5 bis 12 Tage nach der ersten Dosis) verwendet wurde, betrug die Inzidenz von Fieberkrämpfen 2,18 (95% KI: 1,38; 3,45) oder 6,19 (95% KI: 4,71; 8,13) pro 10'000 Kinder für die MMRV-Gruppe bzw. 0,49 (95% KI: 0,19; 1,25) oder 2,55 (95% KI: 1,67; 3,89) pro 10'000 Kinder für die entsprechenden Kontrollkohorten.
Diese Daten lassen darauf schliessen, dass pro 5'882 oder 2'747 mit Priorix-Tetra geimpften Kindern ein zusätzlicher Fall eines Fieberkrampfes auftritt, verglichen mit entsprechenden Kontrollkohorten, die einen MMR-Impfstoff oder gleichzeitig einen MMR- und einen Varizellen-Impfstoff erhalten hatten (zusätzliches Risiko 1,70 (95% KI: -1,86; 3,46) bzw. 3,64 (95% KI: -6,11; 8,30) pro 10'000 Kinder) (siehe «Eigenschaften/Wirkungen»).
** Nach der Verabreichung der ersten Dosis des kombinierten MMR-Varizellen-Impfstoffes wurden, verglichen mit einer gleichzeitigen Verabreichung an verschiedenen Injektionsstellen einer MMR- und einer Varizellen-Impfung, höhere Inzidenzen von Fieber (ungefähr 1,5-fach) beobachtet.
Klinische Studien mit Priorix-Tetra an Personen > 6 Jahre wurden nicht durchgeführt. Das Sicherheitsprofil von Priorix-Tetra bei Personen > 6 Jahre wird aus den zum MMR-Impfstoff (Priorix) sowie zum monovalenten Oka-Varizellenimpfstoff (Varilrix) von GlaxoSmithKline vorliegenden Daten abgeleitet. Die Häufigkeiten unerwünschter Wirkungen wie Fieber, Hautausschlag, Schmerzen an der Injektionsstelle, Schwellung an der Injektionsstelle und Rötung an der Injektionsstelle bei Personen > 6 Jahre, die Priorix oder Varilrix erhielten, waren vergleichbar mit denjenigen bei Kindern < 6 Jahren, die Priorix-Tetra erhielten.
Unerwünschte Wirkungen aus der Postmarketingphase
Nach der Markteinführung wurde über folgende zusätzliche Reaktionen mit einer Masern-Mumps-Röteln- und Varizellen-Impfung berichtet:
Infektionen und parasitäre Erkrankungen
Selten: Meningitis, Herpes zoster, Masern-ähnliches Syndrom, Mumps-ähnliches Syndrom (einschliesslich Orchitis, Epididymitis und Parotitis).
Erkrankungen des Blutes und des Lymphsystems
Selten: Thrombozytopenie, thrombozytopenische Purpura.
Erkrankungen des Immunsystems
Selten: Allergische Reaktionen, einschliesslich anaphylaktischer und anaphylaktoider Reaktionen.
Erkrankungen des Nervensystems
Selten: Enzephalitis (siehe «Warnhinweise und Vorsichtsmassnahmen»), Schlaganfall (in Einzelfällen mit Impfvirusnachweis im betroffenen Gefäss), Zerebellitis, Zerebellitis-ähnliche Symptome (einschliesslich vorübergehende Gangstörung und vorübergehende Ataxie), Guillain-Barré-Syndrom, transverse Myelitis, periphere Neuritis.
Gefässerkrankungen
Selten: Vaskulitis (einschliesslich Purpura Schönlein-Henoch und Kawasaki-Syndrom).
Erkrankungen der Haut und des Unterhautgewebes
Selten: Erythema exsudativum multiforme, Varizellen-ähnlicher Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Arthralgie, Arthritis.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Fälle einer Überdosierung sind nicht bekannt.
Eigenschaften/Wirkungen
ATC-Code
J07BD54
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Wirksamkeit und Effektivität
Die Wirksamkeit der Oka-Varizellenimpfstoffe von GlaxoSmithKline (1 Dosis Varilrix bzw. 2 Dosen tetravalenter Masern-Mumps-Röteln-Varizellenimpfstoff Priorix-Tetra im Abstand von 42 Tagen) wurde in der grossen, in mehreren Ländern durchgeführten, verumkontrollierten klinischen Studie OKA-H-179 (Follow-up OKAH-182 EXT 179:Y4-Y6-Y8-Y10) im Vergleich zu 2 Dosen Masern-Mumps-Röteln-Impfstoff ohne Varizellenkomponente im Abstand von 42 Tagen untersucht. Dabei wurden verschiedene Wirksamkeitskriterien zur Diagnose einer manifesten Varizelleninfektion verwendet. In der Phase A (Impfung im Alter von 12-24 Monaten) nahmen 5803 Kinder teil. In den Langzeit Follow-up Phase B wurden 4580 Kinder eingeschlossen. 3298 Kinder (56,8%) schlossen die Studie OKAH-182 EXT 179:Y4-Y6-Y8-Y10 vollständig über 10 Jahre ab. Es gab für Phase B der Studie keine statistische Hypothese sondern nur deskriptive Beschreibungen. Die primäre Diagnose beruhte auf der Meldung einer Varizella artigen Erkrankung durch die Eltern, welche im Falle einer geplanten Bestätigung durch den Investigator mittels PCR weiter untersucht wurde. Telefonische Kontakte fanden alle 6 Monate statt. Es fand zuerst eine Beurteilung der aufgetretenen klinisch vermuteten Varizelleninfektionen durch den Prüfarzt statt. Vermutete Varizellenfälle wurden dann durch ein Expertenpanel weiter beurteilt. Ausserdem wurde ein direkter Virusnachweis durch PCR (Polymerasekettenreaktion) durchgeführt und es fand eine anamnestische Abklärung einer möglichen Windpockenexposition statt.
Bei der ersten Analyse (bestätigte Varizellenfälle) war ein definitiver Virusnachweis in der PCR und/oder eine sichere Exposition gegenüber Varizellen Bedingung für die Beurteilung des Impferfolgs gegen Varizellenerkrankungen aller Schweregrade und gegen mässiggradige bis schwere Varizellenerkrankungen. In einer zweiten, weniger strengen Analyse (klinische Varizellenfälle) wurden für die Beurteilung des Impferfolgs alle bestätigten Varizellenfälle aber auch alle Varizellenfälle, die vom Expertenpanel identifiziert wurden, unabhängig von einer Bestätigung durch PCR oder Expositionsanamnese, berücksichtigt.
Die Wirksamkeit des Impfstoffs im Hinblick auf die Prävention bestätigter Varizellenfälle aller Schweregrade sowie mässiger bis schwerer bestätigter Varizellenfälle wurde nach einem Hauptbeobachtungszeitraum von 2 Jahren mit geimpften 5803 Kindern (mediane Dauer: 3,2 Jahre) belegt. In den Langzeit-Nachbeobachtungsphasen von 6 Jahren (mediane Dauer: 6,4 Jahre) und 10 Jahren (mediane Dauer: 9,8 Jahre, 3298 Kinder mit vollständiger Teilnahme in allen 3 Armen) derselben Studie OKAH-182 EXT 179:Y4-Y6-Y8-Y10 wurde eine anhaltende Wirksamkeit beobachtet. Die Ergebnisse sind in der nachfolgenden Tabelle dargestellt.
|
Gruppe |
Zeitpunkt |
Wirksamkeit gegen bestätigte Varizellenerkrankungen aller Schweregrade |
Wirksamkeit gegen mässiggradige bis schwere bestätigte Varizellenerkrankungen |
|
Priorix-Tetra |
Jahr 2 |
94,9% |
99,5% |
|
Jahr 6(1) |
95,0% |
99,0% | |
|
Jahr 10(1) |
95,4% |
99,1% | |
|
Monovalenter Oka-Varizellenimpfstoff |
Jahr 2 |
65,4% |
90,7% |
|
Jahr 6(1) |
67,0% |
90,3% | |
|
Jahr 10(1) |
67,2% |
89,5% |
N=Anzahl Probanden, die in die Studie eingeschlossen und geimpft wurden. Der Follow-up über 10 Jahre wurde bei insgesamt 3298 Kindern in allen 3 Armen zusammen (Priorix-Tetra, Varilrix, Priorix) durchgeführt.
(1) Deskriptive Analyse
In der nachfolgenden Tabelle sind die Wirksamkeitsdaten, bezogen auf klinische Varizellenfälle aller Schweregrade sowie auf mässige bis schwere klinische Varizellenfälle nach einem Hauptbeobachtungszeitraum von 2 Jahren sowie nach den Nachbeobachtungsphasen von 6 Jahren und 10 Jahren dargestellt.
|
Gruppe |
Zeitpunkt |
Wirksamkeit gegen klinische Varizellenerkrankungen aller Schweregrade |
Wirksamkeit gegen mässiggradige bis schwere klinische Varizellenerkrankungen |
|
Priorix-Tetra |
Jahr 2 |
92,5% |
99,3% |
|
Jahr 6(1) |
93,4% |
98,7% | |
|
Jahr 10(1) |
93,6% |
98,5% | |
|
Monovalenter Oka-Varizellenimpfstoff |
Jahr 2 |
64,6% |
90,2% |
|
Jahr 6(1) |
66,2% |
89,8% | |
|
Jahr 10(1) |
66,3% |
89,0% |
N=Anzahl Probanden, die in jede Gruppe eingeschlossen wurden. Der Follow-up über 10 Jahre wurde bei insgesamt 3298 Kindern in allen 3 Armen zusammen (Priorix-Tetra, Varilrix, Priorix) durchgeführt.
(1) Deskriptive Analyse
Die Daten deuten darauf hin, dass die Verabreichung von zwei Dosen Priorix-Tetra im Vergleich zu einer Dosis zu einer höheren Wirksamkeit und einer Abnahme der Varizellen-Durchbruchserkrankungen führt. Der signifikante Anstieg (26,3-fach) der Varizellen-Antikörper nach der zweiten Dosis weist auf einen Boostereffekt hin. Auch für die anderen Impfstoff-Komponenten wurden erhöhte Antikörperspiegel nach Verabreichung von zwei Dosen beobachtet; der Anstieg reicht von 1,5-fach für Masern-Antikörper bis 3,3-fach für Mumps-Antikörper (im Neutralisationstest).
In einer Durchbruchsituation in Kindertagesstätten in Deutschland betrug die Effektivität von zwei Dosen Priorix-Tetra 91% (95% KI: 65;98) gegen alle Erkrankungen und 94% (95% KI: 54;99) gegen mässiggradige Erkrankungen.
Ein eingeschränkter Schutz gegen Masern bzw. Varizellen kann erzielt werden, wenn innerhalb von 72 Stunden nach einer natürlichen Exposition geimpft wird.
Immunantwort
Mit einer oder zwei Dosen Priorix-Tetra, die bei ca. 2'000 zuvor ungeimpften Kindern im Alter von 11 bis 23 Monaten verabreicht wurden, wurden die folgenden Serokonversionsraten (SC) und GMCs/GMTs (Geometric Mean antibody Concentrations/Titres) erzielt (die Dosen wurden im Abstand von 6 Wochen verabreicht):
|
Antikörper-Test |
Nach der 1. Dosis |
Nach der 2. Dosis | ||
|
|
SC |
GMC/GMT |
SC |
GMC/GMT |
|
Masern |
96,4% |
3'184,5 |
99,1% |
4'828,6 |
|
Mumps |
|
|
|
|
|
ELISA (231 E./mL) |
91,3% |
976,7 |
98,8% |
1'564,4 |
|
Neutralisation (1:28) |
95,4% |
147,0 |
99,4% |
478,4 |
|
Rubella |
99,7% |
62,2 |
99,9% |
119,7 |
|
Varicella |
97,2% |
97,5 |
99,8% |
2'587,8 |
ELISA: Enzyme Linked Immunosorbent Assay
IFA: Immunofluorescence Assay
Die beobachteten Serokonversionsraten und GMCs/GMTs waren ähnlich wie nach der Impfung mit einem monovalenten Varizellen- und dem kombinierten Masern-Mumps-Röteln-Impfstoff.
Entsprechende Untersuchungen zur CMI (cell mediated immunity) nach der Impfung mit Priorix-Tetra (MMRV) im Vergleich zur Impfung mit Masern-Mumps-Röteln Impfstoff (Priorix) + Einzeldosis Varizellen Impfstoff (V) mit mindestens 4-wöchigem Abstand liegen keine vor.
In eine klinische Studie in Asien (Singapur) wurden 300 gesunde Kinder im Alter von 9 bis 10 Monaten zum Zeitpunkt der ersten Impfstoffdosis eingeschlossen. Von diesen erhielten 153 Kinder zwei Dosen Priorix-Tetra im Abstand von drei Monaten und 147 Kinder erhielten Priorix und Varilrix. Die Serokonversionsraten und GMCs/GMTs waren denen nach getrennter Verabreichung eines Varizellen- und Masern-Mumps-Röteln-Impfstoffes von GlaxoSmithKline ähnlich. Die Serokonversionsraten nach der ersten Dosis Priorix-Tetra waren für alle Antigene, ausser Masern, mit denen, die in anderen klinischen Studien bei Kindern im Alter von 12 bis 24 Monaten beobachtet wurden, vergleichbar. Die Serokonversionsrate für Masern bei Kindern im Alter von 9 bis 10 Monaten nach einer Dosis Priorix-Tetra betrug 93,3% (95% KI: 87,6; 96,9). Die Immunantwort von Kindern kann im ersten Lebensjahr wegen einer möglichen Interferenz mit maternalen Antikörpern nicht ausreichend sein. Daher sollte eine zweite Dosis Priorix-Tetra drei Monate nach der ersten Dosis verabreicht werden.
Klinische Studien zur Beurteilung der Immunogenität von Priorix-Tetra bei Personen > 6 Jahre wurden nicht durchgeführt. Die Immunogenität von Priorix-Tetra bei Personen > 6 Jahre wird aus den für Priorix und Varilrix vorliegenden Daten abgeleitet.
Eine Vergleichsstudie mit 328 Kindern (Durchschnittsalter 12 Monate), denen Priorix-Tetra entweder i.m. oder s.c. verabreicht wurde, zeigte, dass beide Verabreichungswege eine ähnliche Immunogenität und ähnliche Sicherheitsprofile haben. Daten zur intramuskulären Injektion von Priorix-Tetra bei Jugendlichen und Erwachsenen liegen nicht vor.
Persistenz der Immunantwort gegen Masern, Mumps und Röteln
Die nachfolgende Tabelle zeigt für Kinder zwischen 12 und 22 Monaten, die in einer klinischen Studie zwei Impfdosen Priorix-Tetra (N = 2'489) erhielten, die Seropositivitätsraten für Antikörper gegen Masern, Mumps und Röteln nach Beobachtungszeiträumen von 2, 6 und 10 Jahren, bezogen auf Kinder, deren Antikörperkonzentrationen mindestens dem festgelegten Schwellenwert entsprachen:
|
Zeitpunkt |
Antikörper | ||
|
Masern |
Mumps |
Röteln | |
|
Jahr 2 |
99,1% |
90,5% |
100% |
|
Jahr 6 |
99,0% |
90,5% |
99,8% |
|
Jahr 10 |
98,5% |
90,0% |
97,7% |
ELISA: Enzyme Linked Immuno Sorbent Assay
Anwendungsbeobachtung nach der Markteinführung (Sicherheitsstudie)
Das Risiko von Fieberkrämpfen nach der ersten Impfdosis von Priorix-Tetra bei Kindern zwischen 9 und 30 Monaten wurde im Rahmen einer retrospektiven Datenbank-Analyse untersucht (siehe «Unerwünschte Wirkungen»).
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
Pharmakokinetik
Eine Untersuchung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische Daten
Toxizitätsstudien bei Tieren nach wiederholter Gabe ergaben keinerlei Hinweise auf lokale oder systemische Toxizität des Impfstoffes.
Sonstige Hinweise
Inkompatibilitäten
Priorix-Tetra darf nicht mit anderen Arzneimitteln gemischt werden, da keine Daten zur Kompatibilität vorliegen.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Nach dem Auflösen wird eine umgehende Verwendung empfohlen. Jedoch wurde gezeigt, dass der Impfstoff nach dem Auflösen bei 2°C bis 8°C für 8 Stunden stabil ist.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Kühlkettenpflichtig. Nicht einfrieren!
Hinweise für die Handhabung
Aufgrund geringfügig abweichender pH-Werte kann die Farbe des gelösten Impfstoffes von klar pfirsichfarben bis fuchsienrosa variieren. Nach der Rekonstitution können durchsichtige, produktbezogene Partikel enthalten sein. Dies ist normal und beeinträchtigt die Wirksamkeit des Impfstoffs nicht. Der rekonstituierte (gelöste) Impfstoff ist vor der Verabreichung visuell zu überprüfen. Falls der Impfstoff eine andere Färbung aufweist oder andere Partikel als beschrieben enthält, darf der Impfstoff nicht verabreicht werden.
Hinweise für die Rekonstitution des Impfstoffes mit dem in der Fertigspritze befindlichen Lösungsmittel
Priorix-Tetra wird rekonstituiert, indem der gesamte Inhalt der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Für das Befestigen der Nadel an der Spritze folgen Sie der nachstehenden Anleitung. Allerdings kann sich die mit Priorix-Tetra mitgelieferte Spritze leicht von der abgebildeten Spritze unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Nadel ohne zu schrauben angebracht werden.
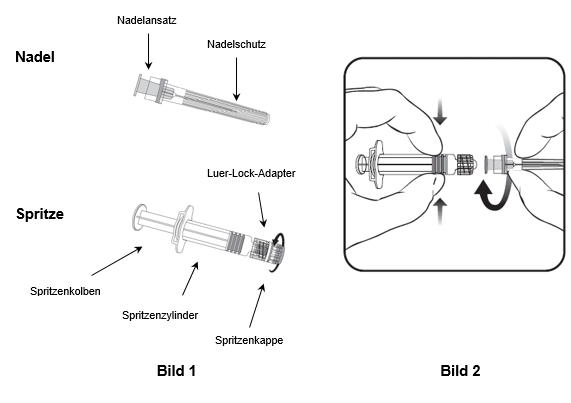
Halten Sie die Spritze immer am Spritzenzylinder fest. Die Spritze nicht am Spritzenkolben oder Luer-Lock-Adapter (LLA) festhalten.
1. Halten Sie die Spritze am Spritzenzylinder fest und drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab (wie in Bild 1 gezeigt).
2. Um die Nadel an der Spritze anzubringen, führen Sie den Nadelansatz vorsichtig in den LLA und drehen Sie die Nadel im Uhrzeigersinn, bis sie fest sitzt (wie in Bild 2 gezeigt). Achten Sie beim Anbringen darauf, dass sich die Nadel in der Achse der Spritze befindet (wie im Bild 2 gezeigt). Andernfalls könnte sich der LLA verbiegen und undicht werden. Falls sich während des Anbringens der Nadel der LLA löst, ist eine neue Impfstoffdosis (neue Spritze und Durchstechflasche) zu verwenden.
3. Entfernen Sie den Nadelschutz, der gelegentlich fest sitzen kann.
4. Fügen Sie das Lösungsmittel dem Pulver zu. Schütteln Sie danach die Mischung gründlich, bis sich das Pulver vollständig im Lösungsmittel gelöst hat. Nach der Rekonstitution sollte der Impfstoff sofort verabreicht werden.
5. Ziehen Sie den gesamten Inhalt der Durchstechflasche in die Spritze auf.
6. Zur Verabreichung des Impfstoffs soll eine neue Nadel verwendet werden. Drehen Sie die Nadel von der Spritze ab und bringen Sie eine Injektionsnadel an, indem Sie Schritt 2 wiederholen.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer
58158 (Swissmedic)
Packungen
Durchstechflasche mit 1 Dosis des lyophilisierten Impfstoffs und Fertigspritze mit Lösungsmittel (Nadeln separat) [B].
Zulassungsinhaberin
GlaxoSmithKline AG, 6340 Baar
Stand der Information
Oktober 2025