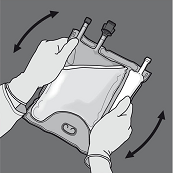
Zusammensetzung
Wirkstoffe
Alanin, Arginin, Asparaginsäure, Cystein, Glutaminsäure, Glycin, Histidin, Isoleucin, Leucin, Lysin, Methionin, Ornithin, Phenylalanin, Prolin, Serin, Taurin, Threonin, Tryptophan, Tyrosin, Valin, Natriumchlorid, Kaliumacetat, Calciumchlorid, Magnesiumacetat, Natriumglycerophosphat, Glucose, Olivenöl, Sojaöl
Hilfsstoffe
L-Apfelsäure, Salzsäure, Eilecithin für Injektionszwecke, Glycerol, Natriumoleat, Natriumhydroxid, Wasser für Injektionszwecke
Darreichungsform und Wirkstoffmenge pro Einheit
Numeta Ped sind Emulsionen zur Infusion.
Aussehen vor dem Mischen: Die Lösungen in den Aminosäuren- und Glucosekammern sind klar und farblos bis hellgelb. Die Fettemulsion ist homogen und milchig-weiss.
Numeta Ped besteht aus einem Dreikammer-Beutel. Eine Kammer enthält die Fettemulsion, eine Kammer die pädiatrische Aminosäurelösung mit Elektrolyten und die dritte Kammer die Glucoselösung.
Beutelgrösse 50% Glucose- lösung 5,9% Aminosäure- 12,5 % Fettemulsion
lösung mit Elektrol
yten
Numeta Ped G16% E 500 ml 155 ml 221 ml 124 ml
Numeta Ped G19% E 1000 ml 383 ml 392 ml 225 ml
Nach dem Mischen der Inhalte von zwei Kammern (Aminosäuren und Glucose, Verwendung als Zweikammer-Beutel mit 376 ml Numeta Ped G16%E- oder 775 ml Numeta Ped G19%E- Lösung) oder drei Kammern (Aminosäuren, Glucose und Lipide, Verwendung als Dreikammer-Beutel mit 500 ml Numeta Ped G16%E- oder 1000 ml Numeta Ped G19%E- Emulsion) erhält man folgende Zusammensetzung:
Numeta Ped G16%E Numeta Ped G16%E Numeta Ped G19%E Numeta Ped G19%E
als 2-Kammerbeutel(3 als 3-Kammerbeutel(5 als 2-Kammerbeutel(7 als 3-Kammerbeutel(1
76 ml) 00 ml) 75 ml) 000 ml)
Alanin 1,03 g 1,03 g 1,83 g 1,83 g
Arginin 1,08 g 1,08 g 1,92 g 1,92 g
Asparaginsäure 0,77 g 0,77 g 1,37 g 1,37 g
Cystein 0,24 g 0,24 g 0,43 g 0,43 g
Glutaminsäure 1,29 g 1,29 g 2,29 g 2,29 g
Glycin 0,51 g 0,51 g 0,91 g 0,91 g
Histidin 0,49 g 0,49 g 0,87 g 0,87 g
Isoleucin 0,86 g 0,86 g 1,53 g 1,53 g
Leucin 1,29 g 1,29 g 2,29 g 2,29 g
Lysin-Monohydrat 1,59 g(1,42 g) 1,59 g(1,42 g) 2,82 g(2,51 g) 2,82 g(2,51 g)
(entspricht Lysin)
Methionin 0,31 g 0,31 g 0,55 g 0,55 g
Ornithin HCl (entspr 0,41 g(0,32 g) 0,41 g(0,32 g) 0,73 g(0,57 g) 0,73 g(0,57 g)
icht Ornithin)
Phenylalanin 0,54 g 0,54 g 0,96 g 0,96 g
Prolin 0,39 g 0,39 g 0,69 g 0,69 g
Serin 0,51 g 0,51 g 0,91 g 0,91 g
Taurin 0,08 g 0,08 g 0,14 g 0,14 g
Threonin 0,48 g 0,48 g 0,85 g 0,85 g
Tryptophan 0,26 g 0,26 g 0,46 g 0,46 g
Tyrosin 0,10 g 0,10 g 0,18 g 0,18 g
Valin 0,98 g 0,98 g 1,74 g 1,74 g
Natriumchlorid 0,30 g 0,30 g 1,79 g 1,79 g
Kaliumacetat 1,12 g 1,12 g 3,14 g 3,14 g
Calciumchlorid 0,46 g 0,46 g 0,56 g 0,56 g
Dihydrat
Magnesiumacetat 0,33 g 0,33 g 0,55 g 0,55 g
Tetrahydrat
Natriumglycerophosph 0,98 g 0,98 g 2,21 g 2,21 g
at hydratisiert
Glucose Monohydrat 85,25 g(77,50 g) 85,25 g(77,50 g) 210,65 g(191,50 g) 210,65 g(191,50 g)
(entspricht wasserfr
eier Glucose)
Olivenöl (ca. 80%) - 15,5 g - 28,1 g
+ Sojaöl (ca. 20%)
Ei-Lecithin - 0,93 g - 1,69 g
Glycerol - 1,75 g - 3,17 g
Natriumoleat - 0,02 g - 0,04 g
Apfelsäure, Salzsäur ad pH ad pH ad pH ad pH
e, Natriumhydroxid
q.s.
Wasser für Injektion ad 376 ml ad 500 ml ad 775 ml ad 1000 ml
szwecke q.s.
Die rekonstituierte Lösung/Emulsion enthält folgende Zusammensetzung:
Zusammensetzung
Numeta Ped G16%E Numeta Ped G16%E Numeta Ped G19%E Numeta Ped G19%E
als 2-Kammerbeutel als 3-Kammerbeutel als 2-Kammerbeutel als 3-Kammerbeutel
Pro Volumeneinheit 376 100 500 100 775 100 1000 100
(ml)
Stickstoff (g) 2,0 0,52 2,0 0,39 3,5 0,45 3,5 0,35
Aminosäuren (g) 13,0 3,5 13,0 2,6 23,0 3,0 23,0 2,3
Glucose (g) 77,5 20,6 77,5 15,5 192 24,7 192 19,2
Lipide (g) 0 0 15,5 3,1 0 0 28,1 2,8
Energie:
Gesamtkalorien 362 96 517 103 858 111 1139 114
(kcal)
Nichteiweiss-Kalorie 310 82 465 93 766 99 1047 105
n (kcal)
Glucosekalorien 310 82 310 62 766 99 766 77
(kcal)
Fettkalorien (kcal) 0 0 155 31 0 0 281 28
a
Nichteiweiss-Kalorie 158 158 237 237 220 220 301 301
n/Stickstoff
(kcal/g N)
Fettkalorien (% n.a. n.a. 33 33 n.a. n.a. 27 27
Nichteiweiss-Kalorie
n)
Fettkalorien (% n.a. n.a. 30 30 n.a. n.a. 25 25
Gesamtkalorien)
Elektrolyte
Natrium (mmol) 11,6 3,1 12,0 2,4 45,1 5,8 45,8 4,6
Kalium (mmol) 11,4 3,0 11,4 2,3 32,0 4,1 32,0 3,2
Magnesium (mmol) 1,6 0,41 1,6 0,31 2,6 0,33 2,6 0,26
Calcium (mmol) 3,1 0,82 3,1 0,62 3,8 0,50 3,8 0,38
Phosphatb (mmol) 3,2 0,85 4,4 0,87 7,2 0,93 9,4 0,93
Acetat (mmol) 14,5 3,9 14,5 2,9 37,1 4,8 37,1 3,71
Malat (mmol) 4,3 1,1 4,3 0,86 8,8 1,1 8,8 0,88
Chlorid (mmol) 13,8 3,7 13,8 2,8 42,6 5,5 42,6 4,3
pH (ca.) 5,5 5,5 5,5 5,5 5,5 5,5 5,5 5,5
Osmolarität (mOsmol/ 1585 1585 1230 1230 1835 1835 1460 1460
l)
a Einschliesslich der Kalorien aus Eilecithin
b Einschliesslich Phosphat aus der Eilecithin-Komponente der Lipidemulsion
Indikationen/Anwendungsmöglichkeiten
Numeta Ped G16%E ist angezeigt für die parenterale Ernährung bei Neugeborenen und Kindern bis zu zwei Jahren, wenn eine orale oder enterale Ernährung nicht möglich, unzureichend oder kontraindiziert ist.
Numeta Ped G19%E ist angezeigt für die parenterale Ernährung bei Kindern über zwei Jahren und Heranwachsende (16-18 Jahre), wenn eine orale oder enterale Ernährung nicht möglich, unzureichend oder kontraindiziert ist.
Dosierung/Anwendung
Die Dosierung hängt von Energiebedarf, Gewicht, Alter, klinischem Zustand und der Fähigkeit des Patienten ab, die Bestandteile von Numeta Ped zu metabolisieren, sowie von der zusätzlichen oralen/enteralen Energie-/oder Proteinzufuhr. Die Elektrolyt- und Makronährstoffzusammensetzung hängt von der Anzahl der miteinander vermischten Kammern ab (siehe Rubrik „Galenische Form und Wirkstoffmenge pro Einheit“).
Falls die Verabreichung von Lipiden unerwünscht ist, kann nur die Trenn-Naht zwischen der Kammer mit Aminosäuren/Elektrolyten und Glucose geöffnet werden, so dass die Trenn-Naht zwischen Aminosäuren- und Lipid-Kammer verschlossen bleibt. Der Inhalt des Beutels kann anschliessend mit oder ohne Lipide infundiert werden.
Die maximal empfohlene Infusionsrate pro Stunde und das maximal empfohlene Volumen pro Tag hängen von den Bestandteilen ab. Sobald bei einem der genannten Inhaltsstoffe die maximale Dosis erreicht wird, ist damit die maximale Tagesdosis des gesamten Produkts erreicht. Folgende Richtlinien gelten für die maximal empfohlene Infusionsrate pro Stunde und das maximal empfohlene Volumen pro Tag:
Numeta Ped G16%E Numeta Ped G19%E
Verwendung als Verwendung als Verwendung als Verwendung als
2-Kammerbeutel (376 3-Kammerbeutel (500 2-Kammerbeutel 3-Kammerbeutel
ml) ml) (775 ml) (1000 ml)
Maximale Infusionsra 5,8 5,5 4,7 4,6
te in ml/kg/Stunde
Dies entspricht:
Aminosäure in 0,20a 0,14 0,14a 0,11
g/kg/Stunde
Glucose in g/kg/Stun 1,2 0,85 1,17 0,89
de
Lipide in g/kg/Stund 0 0,17a 0 0,13a
e
Maximale Menge in 72,3 96,2 64,8 83,6
ml/kg/Tag
Dies entspricht:
Aminosäure in 2,5a 2,5a 1,9 1,9
g/kg/Tag
Glucose in g/kg/Tag 14,9 14,9 16,0a 16,0a
Lipide in g/kg/Tag 0 3,0 0 2,3
a Limitierender Parameter gemäss ESPEN-ESPGHAN-Richtlinien
Aufgrund der fixen Zusammensetzung des Mehrkammerbeutels können nicht alle Nährstoffbedürfnisse des Patienten gleichzeitig erfüllt werden. Es können klinische Situationen vorkommen, in denen Patienten andere Mengen an Nährstoffen benötigen, als diejenige aus der fixen Zusammensetzung des Mehrkammerbeutels. In dieser Situation muss die Auswirkung jeder Volumen-(Dosis)-anpassung und die daraus resultierende Folge auf die Dosierung der übrigen Nährstoffkomponenten von Numeta Ped berücksichtigt werden.
Die maximale Tagesdosis ist in jedem Fall einzuhalten.
Anwendung
Bei Zusätzen muss die endgültige Osmolarität der Mischung vor der Verabreichung bestimmt werden. Die erhaltene Mischung muss je nach endgültiger Osmolarität über eine periphere oder zentrale Vene verabreicht werden. Falls die zu verabreichende endgültige Mischung hyperton ist, kann es bei der Verabreichung in eine periphere Vene zur Reizung der Vene kommen.
Numeta Ped G16%E:
Wegen seiner hohen Osmolarität darf Numeta Ped G16%E unverdünnt nur durch eine zentrale Vene verabreicht werden. Numeta Ped G16%E kann jedoch ausreichend mit Wasser für Injektionszwecke verdünnt werden, um die Osmolarität zu senken und die Infusion periphervenös zu verabreichen.
Die folgende Tabelle gibt an, inwiefern die Verdünnung die Osmolarität der Lösungen beeinflusst. Beispiele für die Osmolarität von Mischlösungen bei Verwendung als 2-Kammerbeutel und 3-Kammerbeutel nach Zusatz von Wasser für Injektionszwecke:
Numeta Ped G16%E Aminosäuren und Glucose Aminosäuren, Glucose und Lipide
(Verwendung als 2-Kammerbeutel) (Verwendung als 3-Kammerbeutel)
Ausgangsvolumen im 376 500
Beutel (ml)
Ausgangsosmolarität 1585 1230
(mOsm/l ca.)
Volumen des hinzugefügt 376 500
en Wassers (ml)
Endvolumen nach Zusatz 752 1000
(ml)
Osmolarität nach 792.5 615
Zusatz (mOsm/l ca.)
Art der Anwendung
Bei der Verabreichung an Neugeborene und Kinder unter 2 Jahren sollte die Lösung (in Beuteln und Systemen zur Verabreichung) bis zum Abschluss der Verabreichung vor Lichtexposition geschützt werden (siehe Rubriken "Warnhinweise und Vorsichtsmassnahmen" , "Sonstige Hinweise" ).
Numeta Ped G19%E:
Wegen seiner hohen Osmolarität darf Numeta Ped G19%E unverdünnt nur durch eine zentrale Vene verabreicht werden.
Die Flussrate während der ersten Stunde der Infusion schrittweise erhöhen. Die Infusionsrate unter Berücksichtigung der verordneten Dosis, des täglich aufgenommenen Volumens und der Infusionsdauer anpassen (siehe Rubrik "Überdosierung" ).
Derselbe Beutel darf jedoch maximal 24 Stunden am Infusionsständer hängen bzw. infundiert werden. Zyklische Infusionen müssen sich nach der metabolischen Toleranz des Patienten richten.
Die parenterale Ernährung kann so lange fortgesetzt werden, wie es der klinische Zustand des Patienten erfordert.
Dieses Produkt enthält Elektrolyte und kann durch handelsübliche Vitaminpräparate nach Ermessen des behandelnden Arztes und den klinischen Bedürfnissen des Patienten ergänzt werden (siehe Rubrik "Sonstige Hinweise" ).
Kontraindikationen
Allgemeine Gegenanzeigen einer intravenösen Infusion von Numeta Ped bei Verwendung als Zweikammerbeutel sind:
-Überempfindlichkeit gegenüber einem der Inhaltsstoffe, oder der sonstigen Bestandteile des Beutels.
-Angeborene Störungen des Aminosäurestoffwechsels
-Pathologisch erhöhte Natrium-, Kalium-, Magnesium-, Calcium- und/oder Phosphor-Konzentrationen im Plasma
-Wie bei anderen calciumhaltigen Infusionslösungen ist eine gleichzeitige Verabreichung von Ceftriaxon und Numeta Ped bei Neugeborenen (≤ 28 Tage alt) kontraindiziert, auch wenn unterschiedliche Infusionsschläuche verwendet werden, und sie sollten nicht innerhalb von 48 Stunden nacheinander verabreicht werden (Risiko einer Ausfällung von fatalen Ceftriaxon-Calcium-Salzen im Blutkreislauf des Neugeborenen) (siehe Rubriken "Warnhinweise und Vorsichtsmassnahmen" , "Interaktionen" und "Sonstige Hinweise" ).
-Schwere Hyperglykämie
Der Zusatz von Lipiden (Applikation von Numeta Ped bei Verwendung als intravenöse Emulsion im Dreikammerbeutel) ist ausserdem in folgenden klinischen Situationen kontraindiziert:
-Überempfindlichkeit gegenüber Ei-, Soja-, Erdnussproteinen oder einem der Inhaltsstoffe oder Bestandteile des Beutels
-Schwere Hyperlipidämie oder schwere Störungen des Fettstoffwechsels, gekennzeichnet durch Hypertriglyceridämie
Warnhinweise und Vorsichtsmassnahmen
Beim Auftreten von Anzeichen einer Störung oder Symptome einer allergischen Reaktion (wie z.B. Fieber, Schwitzen, Schüttelfrost, Kopfschmerzen, Hautausschläge oder Dyspnoe) die Infusion unverzüglich abbrechen.
Lösungen, welche Glucose enthalten, sollten bei Patienten mit bekannter Allergie gegen Mais oder Maisprodukte mit Vorsicht angewendet werden.
Bei über 28 Tage alten Patienten (einschliesslich Erwachsenen), darf Ceftriaxon nicht gleichzeitig mit calciumhaltigen Lösungen zur intravenösen Verabreichung, einschliesslich Numeta Ped, durch dasselbe Infusionsset verabreicht werden (z.B. über den Y-Connector).
Soll dasselbe Infusionsset für eine sequentielle Verabreichung eingesetzt werden, muss dieses zwischen den Infusionen gründlich mit einer kompatiblen Lösung gespült werden.
Es wurden pulmonalvaskuläre Ausfällungen beobachtet, die Lungengefässembolien und Atemnot bei Patienten verursachen, welche parenteral ernährt wurden. Einige Fälle hatten einen tödlichen Verlauf.
Übermässige Zugabe von Calcium und Phosphat erhöht das Risiko für die Bildung von Calciumphosphatausfällungen. Über Ausfällungen wurde auch in Abwesenheit von Phosphatsalzen in der Lösung berichtet. Über Ausfällungen distal des In-line Filters und über vermutete Bildung von Ausfällungen im Blut wurde ebenfalls berichtet.
Zusätzlich zur Kontrolle der Lösung, sollte auch das Infusionsset und der Katheter periodisch bezüglich Ausfällungen untersucht werden.
Falls Anzeichen von Atemnot auftreten, sollte die Infusion gestoppt und eine medizinische Bewertung eingeleitet werden.
Vor dem Zusetzen von Arzneimitteln die Kompatibilität überprüfen, da es durch Ausfällungen oder Destabilisierung der Fettemulsion zu einem Gefässverschluss kommen kann (siehe Rubriken "Sonstige Hinweise" , "Inkompatibilitäten" und "Hinweise zur Handhabung" ).
Bei Verwendung von Venenkathetern zur Verabreichung parenteraler Arzneimittel, bei schlecht gewarteten Kathetern oder bei kontaminierten Lösungen kann es zu Infektionen und Sepsis kommen. Immunsuppression und andere Faktoren wie Hyperglykämie, Mangelernährung und/oder deren Grunderkrankung können infektiöse Komplikationen fördern. Durch sorgfältige Überwachung der Laborwerte und Symptome des Patienten wie Fieber/Schüttelfrost, Leukozytose, technische Komplikationen mit dem Gefässzugang und Hyperglykämie können Infektionen frühzeitig erkannt werden. Durch eine streng aseptische Arbeitsweise beim Legen und bei der Handhabung des Katheters sowie bei der Zubereitung der Ernährungsformel kann das Risiko septischer Komplikationen reduziert werden.
Über Fettüberladungssyndrom wurde bei anderen Präparaten zur parenteralen Ernährung berichtet. Die reduzierte oder limitierte Fähigkeit die Lipide in Numeta Ped zu metabolisieren, kann zu einem Fettüberladungssyndrom, verursacht durch eine Überdosierung, führen. Die Symptome von diesem Syndrom können auch auftreten, wenn das Produkt gemäss Anweisungen angewandt wird (siehe auch Rubrik "Unerwünschte Wirkungen" ).
Die Überwachung des Kaliumspiegels und anderen Elektrolyten wird bei der gleichzeitigen Anwendung von Numeta Ped mit Medikamenten, die den Kaliumspiegel erhöhen können, empfohlen (Siehe Rubrik "Interaktionen" für weitere Details).
Eine Zufuhr normaler Nahrungsmengen kann bei stark unterernährten Patienten zum Refeeding-Syndrom führen, das durch intrazelluläre Verschiebung von Kalium, Phosphor und Magnesium gekennzeichnet ist, während beim Patienten ein anaboler Effekt eintritt. Darüber hinaus kann es zu Thiamin-Defizit und Flüssigkeitsretention kommen.
Die parenterale Ernährung möglichst langsam und vorsichtig einleiten und dabei Flüssigkeitshaushalt, Elektrolyte, Spurenelemente und Vitamine engmaschig überwachen.
Nach der Markteinführung wurde über schwerwiegende unerwünschte Wirkungen einschliesslich akutes Lungenversagen, metabolische Azidose und Tod bei Neugeborenen und Säuglingen nach schneller Infusion von intravenösen Lipidemulsionen berichtet. Zudem wurde Hypertriglyceridämie beobachtet.
Wenn Zusätze verwendet werden, vor der Verabreichung über eine periphere Vene die Osmolarität der Mischlösung bestimmen, um eine Venenreizung zu vermeiden oder Gewebeschäden im Falle einer Extravasation der Lösung. Die periphere Verabreichung von Numeta Ped führte zu einer Extravasation, die zu einer Weichteilverletzung und Hautnekrose führte.
Während der gesamten Therapie den Wasser- und Elektrolythaushalt, die Serumosmolarität, die Triglyceridkonzentration im Serum, den Säure-Basen-Haushalt, den Blutzuckerspiegel, die Leber- und Nierenfunktion, das Blutbild einschliesslich Thrombozyten und Gerinnungsparameter überwachen.
Bei instabilen Zuständen (z. B. Zustand nach schwerem Trauma, nicht eingestellter Diabetes mellitus, akute Phase eines Kreislaufschocks, akuter Myokardinfarkt, schwere metabolische Azidose, schwere Sepsis und hyperosmolares Koma) die Verabreichung von Numeta Ped unbedingt überwachen und an die klinischen Bedürfnisse des Patienten anpassen.
Für Früh- und Neugeborene < 28 Wochen liegen nur begrenzt Daten aus kontrollierten Studien zu Numeta Ped vor.
Herz-Kreislauf-System
Bei Patienten mit Lungenödem oder Herzinsuffizienz nur mit Vorsicht anwenden. Den Flüssigkeitshaushalt unbedingt genau überwachen.
Niere
Bei Patienten mit Niereninsuffizienz nur mit Vorsicht anwenden. Den Elektrolyt- und Flüssigkeitsstatus einschliesslich Magnesium (siehe Hypermagnesiämie) bei diesen Patienten engmaschig überwachen.
Schwere Störungen des Wasser- und Elektrolythaushalts, schwere Flüssigkeitsüberladung und schwere Stoffwechselstörungen unbedingt vor Beginn der Infusion beheben (siehe "Kontraindikationen" ).
Leber/Gastrointestinaltrakt
Bei Patienten mit schwerer Leberinsuffizienz, einschliesslich Cholestase oder Anstieg der Leberenzyme nur mit Vorsicht anwenden. Die Leberwerte müssen sorgfältig kontrolliert werden.
Endokrines System und Stoffwechsel
Stoffwechselkomplikationen können eintreten, wenn die Nährstoffaufnahme nicht an den Bedarf des Patienten angepasst wird oder die Stoffwechselkapazität eines bestimmten Nahrungsbestandteils nicht exakt ermittelt wurde.
Durch inadäquate oder übermässige Nährstoffzufuhr oder Verabreichung einer Mischlösung, die nur unzureichend auf die Bedürfnisse eines bestimmten Patienten abgestimmt wurde, kann es zu negativen Auswirkungen auf den Stoffwechsel kommen.
Die Konzentrationen der Triglyceride im Serum und die Lipid-Clearance des Patienten müssen regelmässig überprüft werden. Bei Verdacht auf eine Fettstoffwechselstörung wird empfohlen, die Triglycerid-Konzentrationen im Serum zu überwachen, sofern dies klinisch erforderlich ist.
Im Falle einer Hyperglykämie muss die Infusionsrate von Numeta Ped angepasst und/oder Insulin verabreicht werden (siehe Rubrik "Überdosierung" ).
Hämatologie
Bei Patienten mit schweren Blutgerinnungsstörungen nur mit Vorsicht anwenden. Das Blutbild und die Gerinnungsparameter unbedingt sorgfältig überwachen.
Hypermagnesiämie bei Numeta Ped G16%E
Numeta Ped G16%E führt bei Verabreichung der maximalen Dosis zu einer Magnesium-Aufnahme von 0,3 mmol/kg/Tag (siehe "Dosierung/ Anwendung" ). Es besteht die Möglichkeit der Entwicklung einer Hypermagnesiämie. Zeichen einer Hypermagnesiämie sind allgemeine Schwäche, Hyporeflexie, Übelkeit, Erbrechen, Hypokalzämie, Ateminsuffizienz, Hypotonie und Arrhythmien. Da die Zeichen einer Hypermagnesiämie eventuell nicht erkannt werden, wird zu Behandlungsbeginn und in angemessenen Abständen entsprechend der klinischen Routine und den Anfordernissen des einzelnen Patienten zur Überwachung der Magnesiumspiegel geraten. Dies ist besonders wichtig bei Patienten mit erhöhtem Risiko für die Entwicklung einer Hypermagnesiämie, einschliesslich Patienten mit beeinträchtigter Nierenfunktion, Patienten, die andere Arzneimittel einnehmen, aufgrund derer sie dem Risiko für die Entwicklung einer Hypermagnesiämie unterliegen, oder Patienten, die Magnesium aus anderen Quellen erhalten, einschliesslich Neugeborene, deren Mütter ante partum Magnesium erhielten.
Wenn die Magnesiumspiegel im Serum erhöht sind (oberhalb der Normalwerte des Referenzbereichs), sollte die Infusion von Numeta Ped G16%E entsprechend dessen, was als klinisch angemessen und sicher erachtet wird, beendet oder die Infusionsrate reduziert werden.
Besondere Warnhinweise und Vorsichtsmassnahmen für die Anwendung von Numeta Ped G16%E
Die Lichtexposition von Lösungen für die intravenöse parenterale Ernährung kann insbesondere nach Zugabe von Spurenelementen und/oder Vitaminen aufgrund der Bildung von Peroxiden und anderen Abbauprodukten negative Auswirkungen auf den Behandlungserfolg bei Neugeborenen haben. Bei der Verabreichung an Neugeborene und Kinder unter 2 Jahren sollte Numeta Ped G16%E bis zum Abschluss der Verabreichung vor Umgebungslicht geschützt werden (siehe Rubriken "Dosierung/Anwendung" , "Sonstige Hinweise" ).
Interaktionen
Es wurden keine pharmakodynamischen Interaktionsstudien mit Numeta Ped durchgeführt.
Numeta Ped darf aufgrund des Risikos einer Pseudoagglutination nicht gleichzeitig mit Blut durch dasselbe Infusionsset verabreicht werden.
Wie bei anderen calciumhaltigen Infusionslösungen ist eine gleichzeitige Verabreichung von Ceftriaxon und Numeta Ped bei Neugeborenen (≤ 28 Tage alt) kontraindiziert, auch wenn unterschiedliche Infusionsschläuche verwendet werden, und sie sollten nicht innerhalb von 48 Stunden nacheinander verabreicht werden (Risiko einer Ausfällung von fatalen Ceftriaxon-Calcium-Salzen im Blutkreislauf des Neugeborenen).
Bei über 28 Tage alten Patienten (einschliesslich Erwachsenen), darf Ceftriaxon nicht gleichzeitig mit calciumhaltigen Lösungen zur intravenösen Verabreichung, einschliesslich Numeta Ped, durch dasselbe Infusionsset verabreicht werden.
Soll dasselbe Infusionsset für eine sequentielle Verabreichung eingesetzt werden, muss dieses zwischen den Infusionen gründlich mit einer kompatiblen Lösung gespült werden.
Oliven- und Sojaöl haben einen natürlichen Gehalt an Vitamin K1, das der blutgerinnungshemmenden Wirkung von Cumarin-Derivaten, einschliesslich Warfarin, entgegenwirken kann.
Wegen des Kaliumgehalts von Numeta Ped ist bei Patienten, die gleichzeitig mit kaliumsparenden Diuretika (Amilorid, Spironolacton, Triamteren) oder mit ACE-Inhibitoren, Angiotensin-II-Rezeptor-Antagonisten, oder den Immunsuppressiva Tacrolimus und Cyclosporin behandelt werden, aufgrund des Hyperkaliämie-Risikos besondere Vorsicht geboten.
Die in dieser Emulsion enthaltenen Lipide können die Ergebnisse bestimmter Labortests verfälschen (z. B. Bestimmung von Bilirubin, Lactatdehydrogenase, Sauerstoffsättigung, Hämoglobinkonzentration), wenn die Blutproben vor Elimination der Lipide aus dem Serum entnommen werden. Ohne weitere Fettzufuhr beträgt die Eliminationszeit der Lipide üblicherweise 5 bis 6 Stunden (siehe auch "Sonstige Hinweise" , "Inkompatibilitäten" ).
Schwangerschaft, Stillzeit
Nicht zutreffend.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nicht zutreffend.
Unerwünschte Wirkungen
Die Sicherheit der Verabreichung von Numeta Ped wurde in einer Phase III Studie beurteilt. Einhundertneunundfünfzig (159) pädiatrische Patienten wurden in die Studie eingeschlossen und erhielten Numeta Ped.
Folgende Nebenwirkungen konnten während klinischen Studien und nach der Markteinführung beobachtet werden:
Die Häufigkeit ist wie folgt definiert: Sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10’000), Einzelfälle.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hypophosphatämie*, Hyperglykämie*, Hyperkalzämie*, Hypertriglyceridämie*, Hyponatriämie*
Gelegentlich: Hyperlipidämie
* Während der Infusion entnommene Blutproben (nicht in nüchternem Zustand).
Leber- und Gallenerkrankungen
Gelegentlich: Cholestase
Erkrankungen der Haut und des Unterhautzellgewebes
Einzelfälle: Hautnekrosen und Weichteilverletzung (Für Numeta Ped G16%E bei peripherer Verabreichung mit unzureichender Verdünnung, siehe unter „Warnhinweise und Vorsichtsmassnahmen“).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Einzelfälle: Extravasation (Für Numeta Ped G16%E bei peripherer Verabreichung mit unzureichender Verdünnung, siehe unter „Warnhinweise und Vorsichtsmassnahmen“).
Andere Klasseneffekte
Die folgenden unerwünschten Wirkungen wurden mit anderen Präparaten zur parenteralen Ernährung berichtet:
Bei Neugeborenen und Säuglingen kann es bei schneller Infusion von intravenösen Lipidemulsionen zu einer Verschlechterung des klinischen Zustands kommen (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Fettüberladungssyndrom
Über Fettüberladungssyndrom wurde mit ähnlichen Produkten berichtet. Dies kann durch eine unangemessene Verabreichung (z.B. Überdosierung und/oder höhere Infusionsgeschwindigkeit als empfohlen, siehe Rubrik "Überdosierung" ) verursacht werden. Die Anzeichen und Symptome von diesem Syndrom können jedoch auch auftreten, wenn das Präparat gemäss den Anweisungen verabreicht wird. Die reduzierte oder limitierte Fähigkeit die in Numeta Ped enthaltenen Lipide zu metabolisieren, begleitet mit einer verlängerten Plasma Clearance, kann zu einem „Fettüberladungssyndrom“ führen.
Dieses Syndrom geht mit einer plötzlichen Verschlechterung des klinischen Zustandes des Patienten einher und ist gekennzeichnet durch Hyperlipidämie, Fieber, Fettinfiltration der Leber, Hepatomegalie, verschlechternde Leberfunktion, Anämie, Leukopenie, Thrombozytopenie, Gerinnungsstörungen und Manifestationen des Zentralnervensystems (Koma). Diese Symptome bilden sich normalerweise wieder zurück wenn die Infusion der Lipidemulsion gestoppt wurde.
Über Lungengefässpräzipitate (Lungengefässembolien und Atemnot) wurde mit ähnlichen Produkten berichtet (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei nicht bestimmungsgemässer Anwendung (Überdosierung und/oder höherer Infusionsrate als empfohlen) kann es zu Übelkeit, Erbrechen, Schüttelfrost, Störungen des Elektrolythaushalts und Anzeichen von Hypervolämie oder Azidose kommen, möglicherweise mit tödlichen Folgen. Bei Neugeborenen und Säuglingen wurde eine Überdosierung und/oder schnelle Infusion von intravenösen Fettemulsionen mit schwerwiegenden unerwünschten Ereignissen wie metabolischer Azidose und Atemnot in Verbindung gebracht. In diesen Fällen muss die Infusion sofort abgebrochen werden. Falls medizinisch angemessen, kann eine weitere Intervention erforderlich sein.
Wenn die Infusionsrate von Glucose die Clearance-Rate übersteigt, kann dies zu Hyperglykämie, Glucosurie oder hyperosmolarem Syndrom führen.
Eine verminderte oder limitierte Lipid-Clearance kann zu einem Fettüberladungs-Syndrom führen. Die Symptome dieses Krankheitsbildes sind nach Abbruch der Infusion der Lipidemulsion in der Regel reversibel (siehe Rubrik "Unerwünschte Wirkungen" ).
Es gibt kein spezifisches Gegenmittel bei einer Überdosierung. Verfahren im Notfall sollten allgemeine, unterstützende Massnahmen umfassen, unter besonderer Berücksichtigung der Atemwege und des Herz-Kreislauf-Systems. In schwerwiegenden Fällen kann eine Hämodialyse, Hämofiltration oder Hämodiafiltration erforderlich sein.
Eigenschaften/Wirkungen
ATC-Code
B05BA10
Der Gehalt von Numeta Ped an Stickstoff (20 L-Aminosäuren, einschliesslich 8 essentieller Aminosäuren) und Energie (Glucose und Triglyceride) dient der Auftrechterhaltung eines angemessenen Stickstoff-Energiehaushalts. Stickstoff und Energie sind erforderlich, damit alle Körperzellen normal funktionieren. Zudem spielen sie eine wichtige Rolle für die Proteinsynthese, das Wachstum, die Wundheilung, die Immunfunktion, die Muskelfunktion und viele andere Zellaktivitäten.
Diese Formulierung enthält darüber hinaus Elektrolyte.
Das Aminosäuren-Profil ist wie folgt:
-Essentielle Aminosäuren / Gesamt-Aminosäuren: 47,5 %
-Verzweigtkettige Aminosäuren / Gesamt-Aminosäuren: 24,0 %
Die Fettemulsion in Numeta Ped ist eine Zusammensetzung aus raffiniertem Olivenöl und raffiniertem Sojaöl (Verhältnis ca. 80/20). Die ungefähre relative Verteilung der Fettsäuren ist wie folgt:
-15 % gesättigte Fettsäuren
-65 % einfach ungesättigte Fettsäuren
-20 % mehrfach ungesättigte Fettsäuren
Das Verhältnis Phospholipide/Triglyceride beträgt 0,06. Der mässige Gehalt an essentiellen Fettsäuren (EFS) verbessert den Status ihrer höheren Derivate und gleicht zudem einen EFS-Mangel aus.
Olivenöl enthält grössere Mengen Alpha-Tocopherol. Bei mässiger Aufnahme von mehrfach ungesättigten Fettsäuren verbessert dies den Vitamin-E-Status und trägt wesentlich dazu bei, das Risiko der Lipid-Peroxidierung herabzusetzen.
Die Kohlenhydratquelle ist Glucose. Glucose ist eine primäre Energiequelle für den Körper.
Wirkungsmechanismus
Keine Angaben
Pharmakodynamik
Keine Angaben
Klinische Wirksamkeit
Keine Angaben
Pharmakokinetik
Die Verteilung, die Metabolisierung und die Ausscheidung der Inhaltsstoffe der Emulsion zur Infusion (Aminosäuren, Elektrolyte, Glucose, Lipide) erfolgt auf gleiche Weise wie bei der jeweils einzelnen Infusion dieser Substanzen. Das Produkt wird intravenös verabreicht. Dadurch ist es zu 100 % bioverfügbar, und die Bestandteile werden in alle Körperzellen verteilt und metabolisiert.
Absorption
Keine Angaben
Distribution
Keine Angaben
Metabolismus
Keine Angaben
Elimination
Keine Angaben
Präklinische Daten
In präklinischen Studien wurde die Sicherheit und Verträglichkeit der Bestandteile des Dreikammer-Beutels bestätigt.
Andere Studien zu karzinogenem Potenzial, Reproduktions- und Entwicklungstoxizität und genotoxischem Potenzial wurden nicht an Numeta Ped durchgeführt, da eine intravenöse Verabreichung im Rahmen von Langzeitstudien nicht durchführbar ist und es sich bei den Bestandteilen um natürlich vorkommende Stoffwechselprodukte handelt. Orale Ernährungsstudien mit vergleichbaren Nährstoffen ergaben keine Hinweise auf Karzinogenität, Fertilitätsbeeinträchtigungen oder Embryotoxiztät aufgrund des Aminosäuren-Gehalts.
In präklinischen Studien zur Toxizität der in Numeta Ped enthaltenen Fettemulsion zeigten sich die typischen Veränderungen, die bei hoher Aufnahme von Fettemulsion auftreten: Fettinfiltration der Leber, Thrombozytopenie und Erhöhung der Cholesterin-Konzentration.
Bei hoher Dosierung von Fettemulsionen auf Olivenöl-Basis konnten eine geringere Lipid-Peroxidation und ein verbesserter Vitamin-E-Status nachgewiesen werden als bei Fettemulsionen auf Sojaöl-Basis.
Bei einer In-vitro-Studie an humanen Zellen und einer In-vivo-Studie an Ratten zeigte der Vergleich mit auf Sojaöl basierenden Fettemulsionen, dass auf Olivenöl basierende Fettemulsionen die Lymphozyten-Proliferation, die Expression von Zellaktivierungsmarkern und die Freisetzung von IL-2 aufrechterhalten. Die klinische Relevanz dieser Ergebnisse ist nicht bekannt.
Sonstige Hinweise
Inkompatibilitäten
Andere Arzneimittel oder Substanzen erst dann den drei Beutelkammern oder der gebrauchsfertig gemischten Lösung/Emulsion zusetzen, wenn die Kompatibilität und die Stabilität der resultierenden Gesamtlösung (vor allem die Stabilität der Fettemulsion bzw. die Bildung von Ausfällungen) geprüft wurde (siehe Rubrik "Hinweise für die Handhabung" ).
Wie bei allen Mischlösungen zur parenteralen Ernährung muss das Verhältnis Calcium: Phosphat berücksichtigt werden. Übermässige Calcium- und Phosphatzufuhr – insbesondere in Form von Mineralsalzen – kann zu Calciumphosphat-Ausfällungen führen.
Aufgrund des Risikos von Präzipitat-Bildung, sollte Numeta Ped nicht mit Ampicillin, Fosphenytoin oder Furosemid vermischt oder über dasselbe Infusionsset verabreicht werden.
Wie bei anderen calciumhaltigen Infusionslösungen ist die gleichzeitige Behandlung mit Ceftriaxon und Numeta Ped bei Neugeborenen (≤ 28 Tage alt) kontraindiziert. Nicht durch separate Infusionssets oder sequentiell verabreichen wegen des Risikos für eine tödliche Ceftriaxon-Calciumsalz Ausfällung im Blut des Neugeborenen (siehe Rubriken "Kontraindikationen" und "Interaktionen" ).
Numeta Ped darf nicht gleichzeitig mit Blut über denselben Infusionsschlauch verabreicht werden (siehe Rubrik "Interaktionen" ).
Numeta Ped enthält Calcium-Ionen, welche ein zusätzliches Gerinnungsrisiko in Citrat antikoaguliertem/konserviertem Blut oder Komponenten aufweisen.
Haltbarkeit
Numeta Ped darf in der Schutzhülle nur bis zu dem auf dem Beutel mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit nach dem Mischen
Das Produkt sollte nach dem Öffnen der Trenn-Nähte zwischen den zwei oder drei Kammern sofort verwenden werden. Es wurde jedoch nachgewiesen, dass gebrauchsfertige Mischungen über einen Zeitraum von 7 Tagen zwischen 2°C und 8°C stabil sind und anschliessend noch 48 Stunden bei 30°C gelagert werden können.
Haltbarkeit nach der Zugabe von Zusätzen (Elektrolyten, Spurenelemente, Vitamine, Wasser)
Für spezifische Zusätze wurde nachgewiesen, dass diese über einen Zeitraum von 7 Tagen zwischen 2°C und 8°C stabil sind und anschliessend noch 48 Stunden bei 30°C gelagert werden können.
Besondere Lagerungshinweise
Nicht einfrieren. In der Schutzhülle, nicht über 25°C sowie ausserhalb der Reichweite von Kindern aufbewahren.
Numeta Ped G16%E
Bei der Verabreichung an Neugeborene und Kinder unter 2 Jahren sollte die Lösung (in Beuteln und Systemen zur Verabreichung) bis zum Abschluss der Verabreichung vor Lichtexposition geschützt werden.
Hinweise für die Handhabung
Nur zum einmaligen Gebrauch.
Alle Komponenten sind frei von Latex.
Um Kontakt mit Luft zu vermeiden, ist der Beutel in einer sauerstoffdichten Schutzhülle verpackt, in dem sich ein Sauerstoffabsorber und ggf. ein Sauerstoff-Indikator befindet.
Nach Öffnen der Trenn-Nähte zwischen den Kammern den Inhalt sofort anwenden und nicht für eine spätere Infusion aufbewahren.
Die Beutel eignen sich nicht für den Anschluss in Serie, da die Gefahr einer Luftembolie durch Lufteinschlüsse im ersten Beutel besteht.
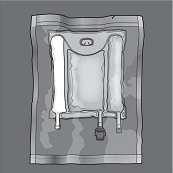
Die Unversehrtheit des Beutels und der Trenn-Nähte überprüfen. Nur verwenden, wenn der Beutel unbeschädigt ist, die Trenn-Nähte intakt sind (also der Inhalt der drei Beutelkammern noch nicht vermischt ist), die Aminosäuren- und die Glucoselösung klar, farblos bis hellgelb und frei von sichtbaren Partikeln sind, und die Fettemulsion homogen und milchig ist.
Numeta Ped G16%E
Bei der Verabreichung an Neugeborene und Kinder unter 2 Jahren bis zum Abschluss der Verabreichung vor Lichteinwirkung schützen. Die Exposition von Numeta Ped G16%E gegenüber dem Umgebungslicht erzeugt, insbesondere nach Zugabe von Spurenelementen und/oder Vitaminen, Peroxide und andere Abbauprodukte, was durch Schutz vor Lichtexposition reduziert werden kann.
Vor dem Öffnen der Schutzhülle die Farbe des Sauerstoffindikators überprüfen. Die Farbe des Indikators mit der Farbe vergleichen, die auf dem Etikett des Indikators neben dem OK-Symbol abgedruckt ist. Das Produkt nicht verwenden, wenn sich die Farbe des Sauerstoffindikators von der Referenzfarbe neben dem OK-Symbol unterscheidet.
Öffnen: Die Schutzhülle entfernen. Schutzhülle und den Beutel mit Sauerstoffadsorber/ Sauerstoffindikator entsorgen.
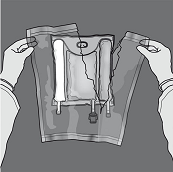
Mischen: Sicherstellen, dass das Produkt Raumtemperatur hat, wenn die Trenn-Nähte geöffnet werden. Den Beutel auf eine flache, saubere Fläche legen. Nicht verwenden, wenn die Trenn-Nähte während des Transports versehentlich gerissen sind und sich die Beutelinhalte vermischt haben.
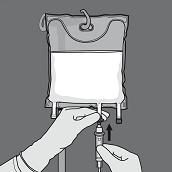
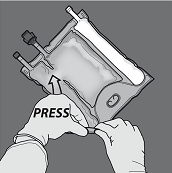
Aktivierung als 3-Kammer-Beutel (Öffnen der zwei Trenn-Nähte)
Den Beutel vom Ende mit der Aufhängung zusammenrollen.
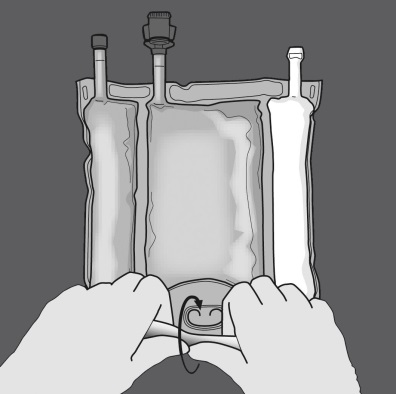
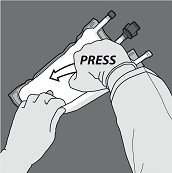
Druck ausüben, um die Trenn-Nähte zu öffnen.
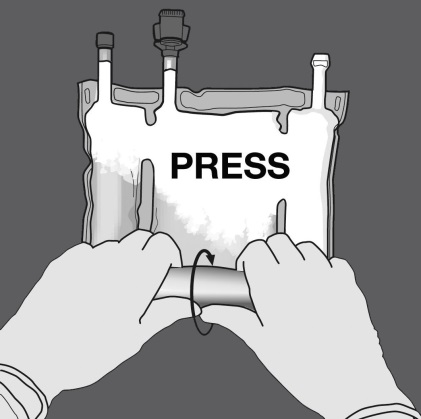
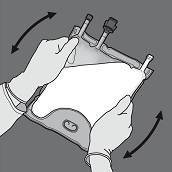
Anschliessend den Beutel in die entgegengesetzte Richtung und in Richtung der Aufhängung rollen bis die Trenn-Naht vollständig offen ist. Auf dieselbe Weise Vorgehen, um die zweite Trenn-Naht vollständig zu öffnen.
Den Beutel mindestens dreimal umdrehen, um die Kammerinhalte gründlich durchzumischen. Die Lösung sieht nach dem Mischen homogen und milchig-weiss aus.
Die Schutzkappe vom Ausfluss-Stutzen entfernen und das Infusionsset einführen.
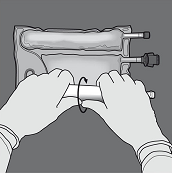
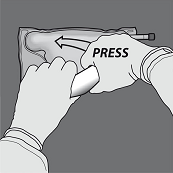
Aktivierung als 2-Kammer-Beutel (Öffnen der Trenn-Nähte zwischen der Aminosäuren- und Glucose-Kammer):
Um nur die Trenn-Naht zwischen Aminosäuren- und Glucose-Kammer zu öffnen, den Beutel von der Ecke der Aufhängung zwischen den Aminosäuren- und Glucose-Kammern her zusammenrollen und Druck ausüben, um die Trenn-Naht zwischen Glucose- und Aminosäuren-Kammer zu öffnen.
Den Beutel so ausrichten, dass die Kammer mit der Fettemulsion zum Anwender zeigt und beim Zusammenrollen des Beutels die Kammer mit der Fettemulsion mit der Hand abdecken.
Den Beutel mit einer Hand nach unten drücken und in Richtung der Anschlüsse zusammenrollen.
Dann den Beutel in die andere Richtung zur Aufhängung hin aufrollen und mit der anderen Hand so lang drücken, bis die Trenn-Naht zwischen Aminosäuren- und Glucose-Lösung vollständig geöffnet ist.
Den Beutel mindestens dreimal umdrehen, um die Kammerinhalte gründlich durchzumischen. Die Mischlösung sollte klar und farblos bis hellgelb sein.
Die Schutzkappe vom Ausfluss-Stutzen abnehmen und das Infusionsset einführen.
Zugabe von Zusätzen
Das Fassungsvermögen des Beutels erlaubt den Zusatz von Elektrolyten, Spurenelementen, Vitaminen und Wasser für Injektionszwecke. Eventuelle Zusätze (einschliesslich Vitamine) zur gebrauchsfertigen Mischung (nach dem Öffnen der Trenn-Nähte und dem Mischen der Beutelinhalte) hinzufügen. Vitamine können der Glucose-Kammer auch vor dem Mischen der gebrauchsfertigen Lösung (vor dem Öffnen der Trenn-Nähte und dem Mischen der Lösungen mit der Emulsion) zugesetzt werden.
Beim Hinzufügen von Zusätzen die bereits im Beutel enthaltene Menge an Elektrolyten berücksichtigen, um diese auf die klinischen Bedürfnisse des Patienten abzustimmen.
Die folgenden Kompatibilitätstabellen zeigen mögliche Zugaben von handelsüblichen Spurenelement-Formulierungen (Angegeben als TE1, TE2, und TE4), Vitamine (Vitaminlyophilisat, angegeben als V1 und V2) und Elektrolyte in definierten Mengen. Bei der Bestimmung des Elektrolytbedarfs für die Zugabe zum Zweikammer- oder Dreikammerbeutel sollten die bereits in der ursprünglichen Beutelformulierung enthaltenen Mengen berücksichtigt werden.
Kompatibilität mit Spurenelementen (TE1, TE2) und Vitaminen (V1, V2)
Numeta Ped G16%E
Tabelle 1: Kompatibilität eines 3 in 1 (aktivierter 3-Kammerbeutel) mit und ohne Verdünnung mit Wasser
Pro Dreikammerbeutel
(500 ml)
Mischlösung ohne Mit Verdünnung
Verdünnung
Zusätze Bereits enthalten Max. zusätzlich Total Bereits enthalten Max. zusätzlich Total
hinzugefügt hinzugefügt
Natrium (mmol) 12.0 4.0 16.0 12.0 0.0 12.0
Kalium (mmol) 11.4 6.2 17.6 11.4 0.0 11.4
Magnesium (mmol) 1.6 0.0 1.6 1.6 0.0 1.6
Calcium (mmol) 3.1 2.1 5.2 3.1 0.0 3.1
Phosphat* (mmol) 4.4 2.0 6.4 4.4 0.0 4.4
Spurenelemente & - 5 ml TE1 + ½ Ampulle 5 ml TE1 + ½ Ampulle - 5 ml TE1 + ½ Ampulle 5 ml TE1 + ½ Ampulle
Vitamine (mmol)a V1 + 5 ml V2 V1 + 5 ml V2 V1 + 5 ml V2 V1 + 5 ml V2
Oder 5 ml TE2 + Oder 5 ml TE2 + ½ Oder 5 ml TE2 + ½ Oder 5 ml TE2 + ½
½ Ampulle V1 + 5 ml Ampulle V1 + 5 ml V2 Ampulle V1 + 5 ml V2 Ampulle V1 + 5 ml V2
V2
Wasser für Injektion - - - - 350 ml 350 ml
szwecke q.s.
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
Tabelle 2: Kompatibilität eines 2 in 1 (aktivierter 2-Kammerbeutel) mit und ohne Verdünnung mit Wasser
Pro Zweikammerbeutel
(376 ml)
Mischlösung ohne Mit Verdünnung
Verdünnung
Zusätze Bereits enthalten Max. zusätzlich Total Bereits enthalten Max. zusätzlich Total
hinzugefügt hinzugefügt
Natrium (mmol) 11.6 26.0 37.6 11.6 0.0 11.6
Kalium (mmol) 11.4 26.2 37.6 11.4 0.0 11.4
Magnesium (mmol) 1.6 3.6 5.2 1.6 0.0 1.6
Calcium (mmol) 3.1 8.2 11.3 3.1 0.0 3.1
Phosphat* (mmol) 3.2 8.1 11.3 3.2 0.0 3.2
Spurenelemente & - 5 ml TE1 + ½ Ampulle 5 ml TE1 + ½ Ampulle - 5 ml TE1 + ½ Ampulle 5 ml TE1 + ½ Ampulle
Vitamine (mmol)a V1 Oder 5 ml V1 Oder 5 ml V1 Oder 5 ml V1 Oder 5 ml
TE2 + ½ Ampulle V1 TE2 + ½ Ampulle V1 TE2 + ½ Ampulle V1 TE2 + ½ Ampulle V1
Wasser für Injektion - - - - 450 ml 450 ml
szwecke q.s.
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
Numeta Ped G19%E
Tabelle 3: Kompatibilität eines 3 in 1 (aktivierter 3-Kammerbeutel)
Pro Dreikammerbeutel
(1000 ml)
Zusätze Bereits enthalten Max. zusätzlich hinzugefügt Total
Natrium (mmol) 45.8 0.0 45.8
Kalium (mmol) 32.0 0.0 32.0
Magnesium (mmol) 2.6 0.0 2.6
Calcium (mmol) 3.8 6.4 10.2
Phosphat (mmol)* 9.4 0.0 9.4
Spurenelemente & - 15 ml TE1 + 1 Ampulle V1 + 15 ml TE1 + 1 Ampulle V1 +
Vitaminea 10ml V2 Oder 15 ml 10 ml V2 Oder 15 ml
TE2 + 1 Ampulle V1 + 10 ml TE2 + 1 Ampulle V1 + 10 ml
V2 V2
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
Tabelle 4: Kompatibilität eines 2 in 1 (aktivierter 2-Kammerbeutel)
Pro Zweikammerbeutel
(775 ml)
Zusätze Bereits enthalten Max. zusätzlich hinzugefügt Total
Natrium (mmol) 45.1 32.0 77.1
Kalium (mmol) 32.0 45.6 77.6
Magnesium (mmol) 2.6 5.2 7.8
Calcium (mmol) 3.8 19.4 23.2
Phosphat (mmol)* 7.2 16.0 23.2
Spurenelemente & - 10 ml TE1 + 1 Ampulle V1 10 ml TE1 + 1 Ampulle V1
Vitaminea Oder 15 ml TE2 + 1 Oder 15 ml TE2 + 1
Ampulle V1 Ampulle V1
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
Kompatibilität mit Spurenelement (TE4) und Vitamine(V1 und V2)
Numeta Ped G16%E
Tabelle 5: Kompatibilität eines 3 in 1 (aktivierter 3-Kammerbeutel) mit und ohne Verdünnung mit Wasser
Pro Dreikammerbeutel
(500 ml)
Mischlösung ohne Mit Verdünnung
Verdünnung
Zusätze Bereits enthalten Max. zusätzlich Total Bereits enthalten Max. zusätzlich Total
hinzugefügt hinzugefügt
Natrium (mmol) 12.0 25.6 37.6 12.0 25.6 37.6
Kalium (mmol) 11.4 26.2 37.6 11.4 26.2 37.6
Magnesium (mmol) 1.6 3.6 5.2 1.6 3.6 5.2
Calcium (mmol) 3.1 16.4 19.5 3.1 8.2 11.3
Phosphat* (mmol) 4.4 6.9 11.3 4.4 6.9 11.3
Spuren-elemente & - 10 ml TE4 + 1 10 ml TE4 + 1 - 5 ml TE4 + ½ Ampulle 5 ml TE4 + ½ Ampulle
Vitamine (mmol) a Ampulle V1 + 30 ml Ampulle V1 + 30 ml V1 + 5 ml V2 b V1 + 5 ml V2 b
V2b V2 b
Wasser für Injektion - - - - 350 ml 350 ml
s-zwecke q.s.
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
b Numeta Ped G16%E: Es können bis 3.8 mg Zink und bis 10 μg Selen hinzugefügt werden ohne Kompatibilitätsänderung
der Mischlösung.
Tabelle 6: Kompatibilität eines 2 in 1 (aktivierter 2-Kammerbeutel) mit und ohne Verdünnung mit Wasser
Pro Zweikammerbeutel
(376 ml)
Mischlösung ohne Mit Verdünnung
Verdünnung
Zusätze Bereits enthalten Max. zusätzlich Total Bereits enthalten Max. zusätzlich Total
hinzugefügt hinzugefügt
Natrium (mmol) 11.6 26.0 37.6 11.6 0.0 11.6
Kalium (mmol) 11.4 26.2 37.6 11.4 0.0 11.4
Magnesium (mmol) 1.6 3.6 5.2 1.6 0.0 1.6
Calcium (mmol) 3.1 8.2 11.3 3.1 0.0 3.1
Phosphat * (mmol) 3.2 8.1 11.3 3.2 0.0 3.2
Spuren-elemente & - 5 ml TE4 + ½ 5 ml TE4 + ½ - 5 ml TE4 + ½ 5 ml TE4 + ½ Ampulle
Vitamine (mmol) a Ampulle V1b Ampulle V1 b Ampulle V1 b V1 b
Wasser für Injektion - - - - 450 ml 450 ml
szwecke q.s.
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
b Numeta Ped G16%E: Es können bis 3.8 mg Zink und bis 10 μg Selen hinzugefügt werden ohne Kompatibilitätsänderung
der Mischlösung.
Numeta Ped G19%E
Tabelle 7: Kompatibilität eines 3 in 1 (aktivierter 3-Kammerbeutel) mit und ohne Verdünnung mit Wasser
Pro Dreikammerbeutel
(1000 ml)
Mischlösung ohne Mit Verdünnung
Verdünnung
Zusätze Bereits enthalten Max. zusätzlich Total Bereits enthalten Max. zusätzlich Total
hinzugefügt hinzugefügt
Natrium (mmol) 45.8 105 150.8 45.8 105 150.8
Kalium (mmol) 32 118 150 32 118 150
Magnesium (mmol) 2.6 7.8 10.4 2.6 7.8 10.4
Calcium (mmol) 3.8 20.5 24.3 3.8 20.5 24.3
Phosphat * (mmol) 9.4 14.6 24 9.4 14.6 24
Spurenelemente & - 34 ml TE4 + 3.4 34 ml TE4 + 3.4 - 34 ml TE4 + 3.4 34 ml TE4 + 3.4
Vitamine (mmol) a Ampullen V1 + 38 ml Ampullen V1 + 38 ml Ampullen V1 + 38 ml Ampullen V1 + 38 ml
V2c V2 c V2 c V2 c
Wasser für Injektion - - - - 1450 ml 1450 ml
s-zwecke q.s.
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
c Numeta Ped G19%E: Es können bis 13.79 mg Zink und bis 34.5 μg Selen hinzugefügt werden ohne
Kompatibilitätsänderung der Mischlösung
Tabelle 8: Kompatibilität eines 2 in 1 (aktivierter 2-Kammerbeutel)
Pro Zweikammerbeutel (775
ml)
Mischlösung ohne
Verdünnung
Zusätze Bereits enthalten Max. zusätzlich Total
hinzugefügt
Natrium (mmol) 45.1 32.0 77.1
Kalium (mmol) 32.0 45.6 77.6
Magnesium (mmol) 2.6 5.2 7.8
Calcium (mmol) 3.8 19.4 23.2
Phosphat * (mmol) 7.2 16.0 23.2
Spurenelemente & Vitamine - 10ml TE4 + 1 Ampulle 10 ml TE4 + 1
(mmol) a V1 Ampulle V1
Wasser für Injektions-zwecke - - -
q.s.
* Organisches Phosphat
a Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt
Die Zusammensetzung von Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt:
Zusammensetzung der handelsüblichen Spurenelement-Präparate
Zusammensetzung pro TE1 (10 ml) TE2 (10 ml) TE4 (10 ml)
Fläschchen
Eisen - 8,9 µmol oder 0,5 -
mg
Zink 38.2 µmol oder 2.5 mg 15,3 µmol oder 1 mg 15.3 µmol oder 1 mg
Selen 0.253 µmol oder 0.02 0,6 µmol oder 0,05 0.253 µmol oder 0.02
mg mg mg
Kupfer 3.15 µmol oder 0.2 mg 4,7 µmol oder 0,3 3.15 µmol oder 0.2 mg
mg
Iod 0.0788 µmol oder 0.01 0,4 µmol oder 0,05 0.079 µmol oder 0.01
mg mg mg
Fluor 30 µmol oder 0.57 mg 26,3 µmol oder 0,5 -
mg
Molybdän - 0,5 µmol oder 0,05 -
mg
Mangan 0.182 µmol oder 0.01 1,8 µmol oder 0,1 0.091 µmol oder 0.005
mg mg mg
Kobalt - 2,5 µmol oder 0,15 -
mg
Chrom - 0,4 µmol oder 0,02 -
mg
Zusammensetzung der handelsüblichen Vitaminpräparate
Zusammensetzung pro Fläschchen Fläschchen V1 Fläschchen V2 Vitamin B1 2,5 mg - Vitamin B2 3,6 mg - Nicotinamid 40 mg - Vitamin B6 4,0 mg - Pantothensäure 15,0 mg - Biotin 60 µg - Folsäure 400 µg - Vitamin B12 5,0 µg - Vitamin C 100 mg - Vitamin A - 2300 I.E. Vitamin D - 400 I.E. Vitamin E - 7 I.E. Vitamin K - 200 µg
Wenn Zusätze gemacht werden, muss vor der Verabreichung über eine periphere Vene die Osmolarität der Mischlösung bestimmt werden. Zusätze müssen unter aseptischen Bedingungen von qualifiziertem Personal hinzugefügt werden.
In jedem Fall ist darauf zu achten, dass eine vollständige Mischung des Zusatzes mit der Lösung gewährleistet ist.
Eine Lagerung solcher Lösungen muss vermieden werden (siehe auch “Haltbarkeit“).
Auf die Kompatibilität muss auch geachtet werden, wenn mehrere Infusionen durch das gleiche Infusionsbesteck wie Numeta Ped verabreicht werden.
Hinzufügen von Zusätzen:
Aseptische Bedingungen sicherstellen.
Den Zuspritzanschluss des Beutels vorbereiten.
Den Anschluss durchstechen und die Zusätze über eine Injektionsnadel oder ein Rekonstitutions-Gerät injizieren.
Den Beutelinhalt mit den Zusätzen mischen.
Zusätze die Spurenelemente und Vitamine enthalten sollten vor Licht geschützt werden, wenn sie vor der Verabreichung vermischt werden.
Vorbereitung der Infusion:
Aseptische Bedingungen sicherstellen.
Den Beutel aufhängen.
Die Kunststoff-Schutzabdeckung vom Verabreichungsanschluss entfernen.
Den Dorn des Infusionssets fest in den Verabreichungsanschluss einführen.
Verabreichung der Infusion:
Nur zum einmaligen Gebrauch.
Das Arzneimittel erst verabreichen, wenn die Trenn-Nähte zwischen den zwei oder drei Kammern geöffnet sind und der Inhalt der zwei oder drei Kammern gemischt wurde.
Sicherstellen, dass die gebrauchsfertige Emulsion zur Infusion (Verwendung als Dreikammer-Beutel) keine Anzeichen von Phasentrennung bzw. die gebrauchsfertige Infusionslösung (Verwendung als Zweikammer-Beutel) keine Partikel aufweist.
Nach dem Öffnen des Beutels dessen Inhalt unverzüglich verwenden. Angebrochene Beutel unter keinen Umständen für eine spätere Infusion aufbewahren.
Angebrochene Beutel nicht wieder anschliessen.
Nicht mehrere Beutel miteinander verbinden, da sonst die Gefahr einer Luftembolie durch Lufteinschlüsse im ersten Beutel besteht.
Nicht verwendetes Arzneimittel, Abfallmaterial und sonstiges Material sachgerecht entsorgen und nicht wiederverwenden.
Zulassungsnummer
61‘425 (Swissmedic)
Packungen
Numeta Ped ist in folgenden Packungsgrössen erhältlich:
Numeta Ped G16%E: 6 x 500 ml (B)
Numeta Ped G19%E: 6 x 1000 ml (B)
Zulassungsinhaberin
Baxter AG, 8152 Opfikon
Stand der Information
März 2024