ZusammensetzungWirkstoffe
Triptorelin als Triptorelin-Embonat.
Hilfsstoffe
Poly(lactid-co-glycolid), Mannitol, Carmellose-Natrium*, Polysorbat 80.
Lösungsmittel: Wasser für Injektionszwecke.
*Die Menge an Natrium, die durch Carmellose-Natrium zugeführt wird, entspricht 2,2 mg pro Dosis.
Indikationen/AnwendungsmöglichkeitenHormonabhängiges Prostatakarzinom im fortgeschrittenen Stadium.
Lokalisiertes hormonabhängiges Prostatakarzinom mit hohem Risiko oder lokal fortgeschrittenes Prostatakarzinom, das in Kombination mit einer Strahlentherapie behandelt wird (siehe «Klinische Wirksamkeit»).
Endometriose.
Herunterregulation im Rahmen der assistierten Reproduktion.
Adjuvante Behandlung in Kombination mit Tamoxifen oder einem Aromatasehemmer von Mammakarzinom, der Hormonrezeptoren (Östrogen und/oder Progesteron) exprimiert, in einem frühen Stadium bei Frauen mit hohem Rezidivrisiko, die nach einer Chemotherapie als prämenopausal bestätigt wurden (siehe «Kontraindikationen, Warnhinweise und Vorsichtsmassnahmen», «Unerwünschte Wirkungen und Pharmakodynamik»).
Dosierung/AnwendungPamorelin LA 3,75 mg darf nur von Ärzten oder medizinischem Fachpersonal angewendet werden.
Art der Anwendung
Pamorelin LA 3,75 mg ist intramuskulär zu injizieren oder subkutan (nur bei Männern mit Prostatakrebspatienten).
Da es sich bei Pamorelin LA 3,75 mg um eine Suspension von Mikrogranula handelt, ist eine intravasale Injektion unbedingt zu vermeiden. Die Injektionsstelle sollte in regelmässigen Abständen gewechselt werden.
Für die Herstellung der gebrauchsfertigen Injektionssuspension siehe «Sonstige Hinweise», Rubrik «Art der Herstellung».
Übliche Dosierung
Prostatakarzinom
Die übliche Dosierung ist eine intramuskuläre oder subkutane Injektion von Pamorelin LA 3,75 mg jeden Monat (alle 4 Wochen) unter ärztlicher Aufsicht.
Die Wirksamkeit der Behandlung kann durch die Bestimmung der Serumspiegel von Testosteron und prostataspezifischem Antigen (PSA) sowie durch subjektive Beurteilung (Verbesserung der Symptome wie Miktionsbeschwerden, Krebsschmerzen usw.) überprüft werden. Das Testosteron kann unmittelbar vor oder nach der Injektion bestimmt werden.
Endometriose
Die übliche Dosierung ist eine intramuskuläre Injektion von Pamorelin LA 3,75 mg jeden Monat (alle 4 Wochen) unter ärztlicher Aufsicht.
Während der Behandlung ist eine Besserung der Symptome (z.B. Dysmenorrhoe, Dyspareunie, Tenesmen, Beckenschmerzen) zu erwarten. Bei Bedarf kann sich die therapeutische Überwachung auf die üblichen biologischen Konstanten (E2, Progesteron) stützen.
Dauer der Behandlung
Bei Endometriose beträgt die übliche Behandlungsdauer 4–6 Monate, was 4–6 Injektionen von Pamorelin LA 3,75 mg entspricht.
Assistierte Reproduktion
Die übliche Dosierung ist eine intramuskuläre Injektion von Pamorelin LA 3,75 mg jeden Monat (alle 4 Wochen) unter ärztlicher Aufsicht.
Für die Anwendung von Pamorelin LA 3,75 mg werden verschiedene Protokolle vorgeschlagen:
Herunterregulation im Rahmen der assistierten Reproduktion (IVF, GIFT) oder Induktion der Follikelreifung bei nicht assistierten Behandlungsmethoden usw.
·Beim «langen Protokoll» bewirkt eine einmalige Injektion von Pamorelin LA 3,75 mg eine umfassende Suppression der Hypophyse (Herunterregulation), bevor die Stimulation mit exogenen Gonadotropinen eingeleitet wird. Der Grad der hypophysären Suppression wird am zirkulierenden Östrogenspiegel gemessen. Die Stimulation mit exogenen Gonadotropinen wird erst eingeleitet, wenn der E2-Spiegel < 50 pg/ml beträgt.Das «lange Protokoll» wird auch ausserhalb der assistierten Reproduktion angewandt. Die Dosierung von Gonadotropinen, die zur Induktion einer Follikelreifung verabreicht werden, muss angepasst werden, da das Ziel der Behandlung eine monofollikuläre Reifung ist.
·Beim «kurzen Protokoll» wird die Stimulation mit exogenen Gonadotropinen gleichzeitig mit der einmaligen Injektion von Pamorelin LA 3,75 mg oder sehr kurz danach eingeleitet. In diesem Fall potenziert die Wirkung der GnRH-Agonisten in den ersten Tagen der Stimulation diejenige der exogenen Gonadotropine («flare-up»). Das «kurze Protokoll» darf nicht ausserhalb der assistierten Reproduktion angewendet werden.
Der Grad der hypophysären Suppression (im «langen Protokoll») kann durch die Bestimmung des E2-Spiegels beurteilt werden. Im Rahmen der assistierten Reproduktion sind regelmässige Labor- und endokrinologische Untersuchungen mit Ultraschallkontrollen erforderlich. Im Fall einer übermässigen ovariellen Stimulation ist die Gabe von Gonadotropinen zu reduzieren oder zu unterbrechen.
Mammakarzinom:
Eine intramuskuläre Injektion, die alle 4 Wochen in Kombination mit Tamoxifen oder einem Aromatasehemmer wiederholt wird.
Die Behandlung mit Triptorelin sollte nach Abschluss der Chemotherapie eingeleitet werden, sobald der prämenopausale Status bestätigt wurde (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Behandlung mit Triptorelin sollte mindestens 6 bis 8 Wochen vor Beginn der Behandlung mit einem Aromatasehemmer eingeleitet werden. Vor Beginn der Behandlung mit einem Aromatasehemmer sind mindestens zwei Triptorelin-Injektionen (mit einem Abstand von vier Wochen zwischen den Injektionen) durchzuführen.
Während der Behandlung mit einem Aromatasehemmer darf die Behandlung mit Triptorelin nicht unterbrochen werden, um einen Rebound-Anstieg der zirkulierenden Östrogene bei nicht-menopausalen Frauen zu vermeiden.
Die empfohlene Dauer der adjuvanten Behandlung in Kombination mit anderen Hormontherapien kann bis zu 5 Jahre betragen.
Spezielle Dosierungsanweisungen
Pädiatrische Population
Die Sicherheit und Wirksamkeit von Pamorelin LA 3,75 mg bei Kindern und Jugendlichen wurden nicht untersucht. Das Arzneimittel ist für die Anwendung in der pädiatrischen Population nicht zugelassen.
Ältere Patienten
Eine altersabhängige Anpassung der Dosis ist nicht erforderlich.
Patienten mit beeinträchtigter Nierenfunktion
Bei Patienten mit beeinträchtigter Nierenfunktion ist keine Anpassung der Dosierung erforderlich.
Patienten mit beeinträchtigter Leberfunktion
Bei Patienten mit beeinträchtigter Leberfunktion ist keine Anpassung der Dosierung erforderlich.
KontraindikationenAllgemeine Kontraindikationen
Überempfindlichkeit gegen Triptorelin, andere GnRH-Analoga oder einen der Hilfsstoffe in der Zusammensetzung.
Schwangerschaft und Stillzeit (siehe «Schwangerschaft, Stillzeit»).
Prostatakarzinom
Pamorelin LA 3,75 mg darf nicht angewendet werden, wenn es Hinweise gibt, dass der Tumor nicht hormonabhängig ist, oder nach einer chirurgischen Kastration.
Pamorelin LA 3,75 mg ist bei Patienten mit einer Rückenmarkskompression durch Metastasen eines Prostatakarzinoms kontraindiziert.
Endometriose/assistierte Reproduktion
Vaginale Blutungen unbekannter Ursache
Warnhinweise und VorsichtsmassnahmenAllgemeine Warnhinweise
Überempfindlichkeitsreaktionen:
Kurz nach der Injektion von Pamorelin LA 3,75 mg wurden einige seltene allergische Reaktionen beobachtet. Es wurden seltene Fälle von anaphylaktischem Schock und angioneurotischem Ödem nach der Gabe von Triptorelin beschrieben.
Hypophysenapoplexie:
Bei Patienten unter Behandlung mit GnRH-Agonisten wurden seltene Fälle von Hypophysenapoplexie beschrieben (klinisches Syndrom als Folge eines Hypophyseninfarkts). Die meisten Fälle traten innerhalb von zwei Wochen auf, einige innerhalb einer Stunde nach der ersten Injektion. Eine Hypophysenapoplexie äusserte sich durch plötzliche Kopfschmerzen, Erbrechen, Sehstörungen, Lähmung der Augenmuskeln, veränderten Geisteszustand und mitunter durch kardiovaskulären Kollaps.
Sofortige medizinische Massnahmen sind unerlässlich.
Daher sollte bei einem bekannten Hypophysenadenom kein GnRH-Agonist verabreicht werden.
Stimmungsschwankungen/Depression:
Stimmungsschwankungen bis hin zu Depressionen (einige davon schwer) wurden unter der Behandlung mit Triptorelin berichtet. Seltene Fälle von Suizidgedanken oder Suizidversuchen wurden auch unter der Behandlung mit anderen GnRH-Analoga berichtet. Patienten mit Depression (auch in der Anamnese) sind daher während der Behandlung mit Pamorelin LA 3,75 mg engmaschig zu überwachen. Die Patienten sind auf das Risiko des Auftretens solcher Symptome (und auf die Möglichkeit der Verschlimmerung einer vorbestehenden Depression) hinzuweisen.
Krampfanfälle
Unter der Behandlung mit GnRH-Analoga wurde über das Auftreten von Krampfanfällen berichtet, insbesondere bei Frauen und Kindern. Einige dieser Patienten wiesen Risikofaktoren für Krampfanfälle auf (wie Epilepsie in der Vorgeschichte, intrakranielle Tumore oder gleichzeitige Behandlung mit Arzneimitteln, von denen bekannt ist, dass sie mit einem Risiko für Reaktionen in Form von Krampfanfällen einhergehen). Es wurden aber auch Fälle von Krampfanfällen bei Patienten gemeldet, die keine derartigen Risikofaktoren aufwiesen.
Patienten unter Antikoagulation:
Bei Patienten unter Antikoagulation ist besondere Vorsicht geboten, da das Risiko eines Hämatoms an der Injektionsstelle besteht.
Weitere Vorsichtsmassnahmen
Parästhesien und schwere Migräne sind selten. In schweren oder rezidivierenden Fällen ist die Behandlung zu unterbrechen.
Bei Patienten, die mit GnRH-Analoga behandelt wurden, wurde ein Anstieg der Lymphozytenzahl beschrieben.
Warnhinweise im Zusammenhang mit der Behandlung von Prostatakarzinom
Symptome und Komplikationen von Prostatakarzinom: Wie andere GnRH-Agonisten bewirkt auch Triptorelin einen vorübergehenden Anstieg des zirkulierenden Testosteronspiegels innerhalb der ersten Woche nach der ersten Injektion der Depotform des Wirkstoffs. Dies ist auch möglich, wenn der Abstand zwischen zwei Injektionen > 1 Monat beträgt. Im Gegensatz zum Abfall des Testosteronspiegels nach einer Orchiektomie kann es bei einem geringen Prozentsatz der Patienten (< 5 %) zu einem anfänglichen Anstieg des zirkulierenden Testosteronspiegels und dadurch bedingt zu einer vorübergehenden Verschlechterung der Anzeichen und Symptome eines Prostatakarzinoms kommen. Dies äussert sich meist in einer Verstärkung der Krebsschmerzen, hauptsächlich durch eine Neuropathie, Hämaturie und Knochenschmerzen, die durch eine symptomatische Behandlung unter Kontrolle gebracht werden können. In Einzelfällen kann es zu einer Verschlimmerung der Symptome kommen, entweder zu einer Obstruktion des Harnleiters oder des Blasensphinkters oder zu einer Rückenmarkskompression durch Metastasen, was mit Lähmungen mit oder ohne tödlichen Verlauf einhergehen kann.
Wenn eine Rückenmarkskompression oder Nierenversagen auftritt, ist eine Standardbehandlung dieser Komplikationen einzuleiten und allenfalls eine notfallmässige Orchiektomie in Betracht zu ziehen. Eine gewissenhafte Kontrolle ist daher in den ersten Behandlungswochen unerlässlich, besonders bei Patienten mit Wirbelsäulenmetastasen und/oder Harnwegsobstruktion.
In der Anfangsphase der Behandlung sollte die gleichzeitige Gabe eines Antiandrogens in Betracht gezogen werden, um den anfänglichen Anstieg des Serumtestosteronspiegels zu kompensieren und einer Verschlechterung der klinischen Symptomatik vorzubeugen.
Osteoporose/Knochendichte:
Die Gabe von synthetischen GnRH-Analoga bei der Behandlung des Prostatakarzinoms kann zu Knochenschwund bis hin zur Osteoporose führen und somit das Risiko von Knochenbrüchen erhöhen. Die Folge kann eine falsche Diagnose von Knochenmetastasen sein. Besondere Vorsicht ist bei Patienten geboten, die zusätzliche Risikofaktoren für Osteoporose aufweisen (wie chronischer Alkoholabusus, Rauchen, Unterernährung, positive Familienanamnese für Osteoporose oder Langzeitbehandlung mit Arzneimitteln, welche die Knochendichte reduzieren, wie Kortikosteroide oder Antiepileptika).
Diabetesrisiko/kardiovaskuläres Risiko:
Epidemiologische Studien zeigten metabolische Veränderungen (z.B. beeinträchtigte Glukosetoleranz, Fettleber) und ein erhöhtes Risiko für Diabetes mellitus und/oder kardiovaskuläre Erkrankungen bei Männern, die mit GnRH-Agonisten behandelt wurden. Daher sollten Patienten mit Hypertonie, Hyperlipidämie oder kardiovaskulären Erkrankungen während der Behandlung mit Triptorelin auf dieses Risiko hin überwacht werden.
Wirkung auf das QT/QTc-Intervall:
Langfristiger Androgenentzug kann das QT-Intervall verlängern. Daher sind Patienten mit QT-Verlängerung, Elektrolytstörungen oder Herzinsuffizienz zu überwachen. Die gleichzeitige Anwendung von Triptorelin mit Arzneimitteln, die bekanntermassen das QT-Intervall verlängern oder Torsade de Pointes auslösen können, wie Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder der Klasse III (z.B. Amiodaron, Sotalol), ist mit Vorsicht zu erwägen.
Anämie Risiko:
Aufgrund des Androgenentzugs kann die Behandlung mit GnRH-Analoga das Risiko einer Anämie erhöhen. Dieses Risiko sollte bei behandelten Patienten beurteilt und entsprechend überwacht werden.
Warnhinweise im Zusammenhang mit der Behandlung von Endometriose
Die Ätiologie möglicher vaginaler Blutungen muss vor der Behandlung mit Triptorelin abgeklärt werden.
Bevor eine Behandlung einer Endometriose mit Pamorelin LA 3,75 mg begonnen wird, ist eine mögliche Schwangerschaft auszuschliessen. Während der Behandlung und nach deren Ende sollten bis zur Normalisierung der Menstruationszyklen nicht-hormonelle Verhütungsmethoden angewendet werden. Pamorelin LA 3,75 mg führt normalerweise zu einer Amenorrhoe; wenn diese anhält, sollten die Patientinnen ihren Arzt darüber informieren.
Nach der Menopause ist eine medikamentöse Behandlung der Endometriose nur in seltenen Ausnahmefällen angezeigt (z.B. bei östrogenproduzierenden Tumoren, die eine Reaktivierung der Endometriose bewirken, und wenn eine chirurgische Behandlung kontraindiziert ist).
Bei Patientinnen, die wegen Endometriose mit GnRH-Analoga behandelt werden, hat sich gezeigt, dass eine zusätzliche Hormonersatztherapie (ein Östrogen und ein Gestagen) die Abnahme der Knochendichte und die vasomotorischen Symptome verringert.
Die Anwendung von GnRH-Agonisten wird bei Patientinnen unter 18 Jahren nicht empfohlen. Besondere Vorsicht ist bei Jugendlichen und jungen Frauen (insbesondere unter 16 Jahren) geboten, da sie möglicherweise noch nicht ihre maximale Knochenmineraldichte erreicht haben.
Es liegen keine Daten vor über die klinischen Auswirkungen einer Therapie, die länger als 6 Monate dauert. Wenn eine längere Anwendungsdauer geplant ist, sollte die Knochenmineraldichte vor Beginn der Behandlung gemessen und nötigenfalls während der Behandlung in regelmässigen Abständen kontrolliert werden. Zur Vermeidung einer behandlungsbedingten Verringerung der Knochendichte wird eine ausreichende Zufuhr von Kalzium und Vitamin D (über die Nahrung) empfohlen. Gegebenenfalls ist den Patientinnen zu raten, ihren Lebensstil zu ändern, z.B. durch regelmässige körperliche Übungen, die zu einer Belastung des Skeletts führen, das Rauchen aufzugeben und Alkohol nur mässig zu konsumieren.
Warnhinweise im Zusammenhang mit der assistierten Reproduktion
Das Risiko einer ovariellen Hyperstimulation kann nicht ausgeschlossen werden, auch nicht bei einer vorgängigen Behandlung mit Triptorelin. Bei den ersten Anzeichen einer Überstimulation ist äusserste Vorsicht (klinische und sonographisch Überwachung) geboten, insbesondere wenn sie unter exogenen Gonadotropinen während oder am Ende der Lutealphase induziert wurde.
Klinische und paraklinische Anzeichen einer auch nur mässigen Überstimulation sind Hypovolämie, Tachykardie, Hypotonie, Oligurie, Dehydratation, Aszites, Pleuraerguss sowie Störungen der Nierenfunktion und der Blutgerinnung, die je nach Schweregrad eine Hospitalisierung erforderlich machen können.
Bei einer mit exogenen Gonadotropinen induzierten Stimulation (im Rahmen der assistierten Reproduktion) ist das Risiko einer Zwillings- oder ektopischen Schwangerschaft erhöht. Daher ist eine Ultraschallüberwachung der Schwangerschaft in den ersten vier Wochen erforderlich.
Warnhinweise im Zusammenhang mit Mammakarzinom
Die Behandlung prämenopausaler Frauen mit Hormonrezeptor-exprimierendem Mammakarzinom im Frühstadium mit Triptorelin in Kombination mit Tamoxifen oder einem Aromatasehemmer muss einer sorgfältigen individuellen Risiko-Nutzen-Bewertung unterzogen werden.
Bei prämenopausalen Mammakarzinom-Patientinnen darf die Behandlung mit einem Aromatasehemmer erst eingeleitet werden, wenn durch die Behandlung mit Triptorelin eine ausreichende Suppression der ovariellen Funktion erreicht wurde (siehe auch «Dosierung/Anwendung»). Dazu muss die Behandlung mit Triptorelin mindestens 6 bis 8 Wochen vor Beginn einer Behandlung mit einem Aromatasehemmer erfolgen und die Triptorelin-Injektionen sind wie vorgesehen alle 4 Wochen und ohne Unterbrechung während der Behandlung mit einem Aromatasehemmer durchzuführen.
Patientinnen, welche die Behandlung mit Triptorelin abgebrochen haben, müssen auch die Aromatasehemmer innerhalb eines Monats nach der letzten Gabe von Triptorelin absetzen (28-Tage-Formulierung).
Eine Chemotherapie kann eine vorübergehende Amenorrhoe oder den bleibenden Verlust der ovariellen Funktion induzieren, der mit einer zytotoxischen Schädigung des gonadalen Gewebes zusammenhängt. Dennoch kann es bei Patientinnen, die zum Zeitpunkt der Diagnose prämenopausal sind oder während der Chemotherapie eine Amenorrhoe aufweisen, manchmal weiterhin zu einer ovariellen Östrogenproduktion kommen. Unabhängig von möglichen Menstruationen sollte nach der Chemotherapie und vor Beginn der Behandlung mit Triptorelin sichergestellt werden, dass die Konzentrationen von Estradiol und FSH (follikelstimulierendes Hormon) innerhalb der Referenzbereiche für prämenopausale Frauen liegen, um eine unnötige Behandlung mit Triptorelin im Falle einer Chemotherapie-induzierten Menopause zu vermeiden.
Gemäss den aktuellen Empfehlungen der klinischen Richtlinien ist es nach Beginn der Behandlung mit Triptorelin wichtig, eine ausreichende Suppression der ovariellen Funktion (d.h. eine durch GnRH-Analogon induzierte Menopause) durch regelmässige Kontrolle der zirkulierenden Estradiol- und FSH-Spiegel zu bestätigen, wenn eine Behandlung mit einem Aromatasehemmer für diese Untergruppe von Patientinnen in Betracht gezogen wird.
Daher muss die Suppression der ovariellen Funktion vor Beginn der Behandlung mit einem Aromatasehemmer durch niedrige Blutspiegel von FSH und Östradiol bestätigt werden, und die Messungen sind während der Dauer der Kombination von Triptorelin mit einem Aromatasehemmer alle drei Monate zu wiederholen.
Dadurch soll ein durch den Aromatasehemmer induzierter Rebound-Effekt mit Anstieg des zirkulierenden Östrogenspiegels mit Auswirkungen auf das Mammakarzinom vermieden werden. Es ist zu beachten, dass die zirkulierenden FSH-Spiegel als Reaktion auf die Suppression der ovariellen Funktion infolge der Hemmung der gonadotropen Funktion durch das GnRH-Analogon (induzierte Menopause) erniedrigt sind, im Gegensatz zur natürlichen Menopause, bei der die FSH-Spiegel erhöht sind.
Hypertonie wurde sehr häufig als besonders überwachungsbedürftige unerwünschte Wirkung bei der Kombination von Triptorelin mit Exemestan oder Tamoxifen berichtet (siehe «Unerwünschte Wirkungen»). Prämenopausale Frauen mit Mammakarzinom, die Triptorelin in Kombination mit Exemestan oder Tamoxifen erhalten, sollten regelmässig hinsichtlich kardiovaskulärer Risikofaktoren und des Blutdrucks überwacht werden.
Hyperglykämie und Diabetes wurden häufig als besonders überwachungsbedürftige unerwünschte Wirkungen bei der Kombination von Triptorelin mit Exemestan oder Tamoxifen berichtet (siehe «Unerwünschte Wirkungen»). Prämenopausale Frauen mit Mammakarzinom, die Triptorelin in Kombination mit Exemestan oder Tamoxifen erhalten, sind regelmässig auf Risikofaktoren für Diabetes zu überwachen, d.h. mit regelmässiger Bestimmung des Blutzuckerspiegels. Gegebenenfalls ist eine antidiabetische Behandlung gemäss den nationalen Empfehlungen einzuleiten.
Die Sicherheit von Triptorelin bei prämenopausalen Frauen mit Mammakarzinom mit positivem Hormonrezeptor-Status wurde in zwei Studien untersucht: SOFT und TEXT (siehe «Eigenschaften/Wirkungen»). In allen Behandlungsgruppen dieser Studien trat bei etwa 50 % der mit Triptorelin in Kombination mit Tamoxifen oder Exemestan behandelten Patientinnen eine Depression auf, aber weniger als 5 % der Patientinnen wiesen eine schwere Depression (Grad 3–4) auf. Die Patientinnen sind entsprechend zu informieren und bei Auftreten von Symptomen adäquat zu behandeln. Patientinnen, die an einer Depression leiden, oder solche mit bekannter Depression in der Vorgeschichte, sind während der Behandlung sorgfältig zu überwachen.
Das Risiko für muskuloskelettale Beschwerden (einschliesslich Gelenk- oder Muskelschmerzen), wenn Triptorelin in Kombination mit einem Aromatasehemmer oder Tamoxifen angewendet wird, beträgt etwa 89 % bzw. 76 %.
Ausserdem ist die Arzneimittelfachinformation für Exemestan und Tamoxifen hinsichtlich der relevanten Sicherheitshinweise zu beachten, wenn diese Arzneimittel in Kombination mit Triptorelin angewendet werden.
Pharmazeutische Hilfsstoffe von besonderem Interesse
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Dosis, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakodynamische Interaktionen
Wenn Triptorelin zusammen mit Arzneimitteln angewendet wird, welche die hypophysäre Sezernierung von Gonadotropinen beeinflussen, ist besondere Vorsicht geboten, und es wird empfohlen, den Hormonstatus der Patienten zu überwachen.
Pharmakokinetische Interaktionen
Die Wahrscheinlichkeit einer Beteiligung von Cytochrom-P450(CYP)-Enzymen am Stoffwechsel und an der Elimination von Triptorelin ist gering. Darüber hinaus haben In-vitro-Daten gezeigt, dass Triptorelin weder ein CYP-Inhibitor oder -Induktor noch ein Substrat oder Inhibitor von P-Glykoprotein (P-gp) ist. Daher sind pharmakokinetische Interaktionen mit Triptorelin unwahrscheinlich.
Schwangerschaft, StillzeitSchwangerschaft
Eine Schwangerschaft muss vor der Verschreibung von Pamorelin LA 3,75 mg ausgeschlossen werden (siehe «Kontraindikationen»).
Es sind keine klinischen Studien bei schwangeren Frauen durchgeführt worden. Triptorelin ist während der Schwangerschaft kontraindiziert, da die Anwendung von GnRH-Agonisten mit einem theoretischen Risiko von Fehlgeburt oder fetalen Anomalien verbunden ist.
Frauen im gebärfähigen Alter
Bis zum Wiederauftreten der Menstruation müssen nicht-hormonelle Verhütungsmethoden angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Triptorelin in die Muttermilch übergeht oder die Produktion von Muttermilch beeinflussen kann. Triptorelin ist während der Stillzeit kontraindiziert.
Fertilität
Die männliche Fertilität kann durch eine Behandlung mit Triptorelin beeinträchtigt werden. Daher sollten Männer vor Beginn der Behandlung mit Pamorelin LA 3,75 mg die Kryokonservierung ihres Spermas in Erwägung ziehen. Tierversuche haben negative Auswirkungen auf die Fortpflanzungsparameter gezeigt (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.
Verschiedene Nebenwirkungen wie Apathie, Krampfanfälle und Sehstörungen können jedoch die Reflexe abschwächen und die Fähigkeit zum Führen eines Kraftfahrzeugs und zum Bedienen von Werkzeugen oder Maschinen beeinträchtigten.
Unerwünschte WirkungenAllgemein
Kurz nach der Injektion von Pamorelin LA 3,75 mg wurden einige seltene allergische Reaktionen festgestellt, die sich unter der üblichen Behandlung zurückbildeten.
Die häufigsten Nebenwirkungen, die unter der Behandlung mit Triptorelin beobachtet wurden, waren auf seine erwarteten physiologischen Effekte zurückzuführen: anfänglicher Anstieg des Testosteronspiegels, gefolgt von einer fast vollständigen Suppression des Testosterons.
Prostatakarzinom
Aufgrund des vorübergehenden Anstiegs des Testosteronspiegels kann es 7 bis 10 Tage nach der ersten Injektion zu einer Verstärkung der Krebsschmerzen kommen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Diese Schmerzen gehen gewöhnlich zurück, sobald das Karzinom auf die Behandlung anspricht. Es kann eine vorübergehende Behandlung mit einem Antiandrogen in Betracht gezogen werden.
Die am häufigsten beobachteten Wirkungen waren Hitzewallungen (70 %), Knochenschmerzen (26 %) und eine Atrophie der Genitalien (12 %).
Die folgenden unerwünschten Wirkungen wurden in klinischen Studien oder im Rahmen der Pharmakovigilanz berichtet. Entsprechend ihrer Häufigkeit werden die folgenden unerwünschten Wirkungen wie folgt klassifiziert: sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1000, < 1/100); selten (≥1/10'000, < 1/1000); sehr selten (< 1/10'000), nicht bekannt (beruht hauptsächlich auf spontanen Meldungen aus der Marktüberwachung, die genaue Häufigkeit kann nicht angegeben werden).
Infektionen und parasitäre Erkrankungen
Häufig: Harnwegsinfektionen.
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Häufig: vorübergehender Tumor-Flare.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Thrombozytose.
Selten: Lymphadenopathie.
Nicht bekannt: Anämie.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Endokrine Erkrankungen
Während der Post-Marketing-Phase wurden seltene Fälle von Hypophysenapoplexie beschrieben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Stoffwechsel- und Ernährungsstörungen
Häufig: Anstieg der alkalischen Phosphatase, Hyperurikämie.
Gelegentlich: Hyperglykämie, Anstieg des Harnstoff-Stickstoffs, Diabetes, Anstieg des nicht aus Proteinen stammenden Stickstoffgehalts im Blut (Azotämie), Gewichtszunahme.
Psychiatrische Erkrankungen
Häufig: Stimmungsschwankungen, verminderte Libido, Depression.
Gelegentlich: Nervosität, Amnesie, Euphorie.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindelanfälle, Schlaflosigkeit.
Gelegentlich: Parästhesie, Schläfrigkeit, Synkope.
Selten: Migräne, Dysgeusie, Rückenmarkskompression, Hypästhesie.
Nicht bekannt: Krampfanfälle.
Während der Post-Marketing-Phase wurden seltene Fälle von Hypophysenapoplexie beschrieben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Augenerkrankungen
Häufig: Augenschmerzen, Bindehautentzündung.
Selten: Sehstörungen, Stauungspapille, Gesichtsfeldstörungen.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Tinnitus.
Herzerkrankungen
Selten: myokardiale Ischämie.
Nicht bekannt: verlängertes QT-Intervall.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (70 %).
Häufig: Hypertonie.
Gelegentlich: Hypotonie, tiefe Venenthrombose, Lungenembolie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten, Dyspnoe, Pharyngitis.
Gelegentlich: Rhinitis.
Erkrankungen des Gastrointestinaltrakts
Häufig: Bauchschmerzen, Übelkeit, Obstipation, Durchfall, Dyspepsie.
Gelegentlich: Erbrechen, Tenesmus, gastroösophagealer Reflux.
Leber und Gallenerkrankungen
Häufig: Störung der Leberfunktion.
Gelegentlich: cholestatische Hepatitis.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Exanthem.
Gelegentlich: vermehrtes Schwitzen, Alopezie, analer Juckreiz, Ekzem, bullöser Hautausschlag.
Selten: Urtikaria, Photosensibilisierungsreaktionen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Knochenschmerzen (26 %).
Häufig: Rückenschmerzen, Schmerzen in den Beinen, Arthralgie, Myalgie, Muskelkrämpfe in den unteren Gliedmassen.
Gelegentlich: Arthrose, Muskelschwäche.
Selten: pathologische Frakturen.
Erkrankungen der Nieren und Harnwege
Häufig: Dysurie, Harnverhalt.
Gelegentlich: Pollakisurie, Nykturie, Funktionsstörungen der Harnröhre, Harninkontinenz, Nierenschmerzen, Hämaturie, Nierenfunktionsstörung.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Volumenabnahme der Genitalien (12 %).
Häufig: Impotenz, Gynäkomastie, Brustdrüsenschmerzen.
Gelegentlich: Prostatabeschwerden, Hodenbeschwerden, Entzündung der Brustdrüse.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen, Müdigkeit, Brustkorbschmerzen, Asthenie, (idiopathische) Ödeme, Schmerzen an der Injektionsstelle.
Gelegentlich: Unwohlsein, Verschlimmerung postoperativer Probleme, Entzündungen und andere Reaktionen an der Injektionsstelle.
Selten: perineale Schmerzen.
Prämenopausale Frauen
Aufgrund des vorübergehenden Anstiegs des Östrogens in den ersten zehn Tagen der Behandlung kann es zu einer Intensivierung subjektiver Beschwerden kommen. Diese Beschwerden klingen ab, wenn die Östrogen- und Progesteronspiegel auf ein Niveau gesenkt werden, das demjenigen einer Kastration entspricht.
Die häufigsten Nebenwirkungen, die bei der Behandlung mit Triptorelin über einen Zeitraum von bis zu 5 Jahren in Kombination mit Tamoxifen oder einem Aromatasehemmer in den Studien TEXT und SOFT beobachtet wurden, waren Hitzewallungen, Muskel-Skelett-Beschwerden, Müdigkeit, Schlaflosigkeit, Hyperhidrose, vulvovaginale Trockenheit und Depression.
Die Häufigkeiten der Nebenwirkungen, die mit Triptorelin in Kombination mit Tamoxifen (n = 2325) oder Exemestan (n = 2318) beobachtet wurden, sind im Folgenden dargestellt.
Entsprechend ihrer Häufigkeit werden unerwünschte Wirkungen wie folgt klassifiziert: sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1000, < 1/100); selten (≥1/10'000, < 1/1000); sehr selten (< 1/10'000), nicht bekannt (beruht hauptsächlich auf spontanen Meldungen aus der Postmarketing-Beobachtung, die genaue Häufigkeit kann nicht angegeben werden).
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeitsreaktionen.
Sehr selten: allergische Reaktionen.
Endokrine Erkrankungen
Während der Post-Marketing-Phase wurden seltene Fälle von Hypophysenapoplexie beschrieben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Stoffwechsel- und Ernährungsstörungen
Häufig: Diabetes (Glukoseintoleranz), Hyperglykämie (adjuvante Behandlung von Mammakarzinom).
Psychiatrische Erkrankungen
Sehr häufig: Schlaflosigkeit (58 %), Depression (50 % bei der adjuvanten Behandlung von Mammakarzinom), Verlust der Libido (18–45 %), Gemütsstörungen (15 %).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (17 %).
Gelegentlich: Zerebrale Ischämie, Blutungen im zentralen Nervensystem.
Selten: Migräne, Parästhesie.
Nicht bekannt: Krampfanfälle.
Herzerkrankungen
Gelegentlich: myokardiale Ischämie.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (fast 100 %), Hypertonie (22–23 %).
Häufig: Embolie, andere vasomotorische Störungen.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit.
Leber- und Gallenerkrankungen
Nicht bekannt: Leberfunktionsstörung.
Erkrankungen der Haut und des Unterhautgewebes
Nicht bekannt: Exanthem (einschliesslich bullösen Hautausschlags).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Muskuloskelettale Beschwerden (82 %), Osteoporose (32 %).
Häufig: Fraktur.
Eine Endometriosebehandlung, die länger als 6 Monate dauert, sollte vermieden werden, da der dadurch langfristig verursachte Östradiolabfall die Knochendichte verringert (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Nieren und Harnwege
Sehr häufig: Harninkontinenz (15 %).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Spotting (Schmierblutung, 56 %), vulvo-vaginale Trockenheit (25–50 %), Dyspareunie (30 %).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Müdigkeit (62 %), Schwitzen.
Häufig: Reaktionen an der Injektionsstelle.
Nicht bekannt: Reaktionen an der Injektionsstelle (Rötung, Entzündung und Schmerzen).
Beschreibung spezifischer unerwünschter Wirkungen
Osteoporose wurde bei der Anwendung von Triptorelin in Kombination mit Exemestan häufiger berichtet als bei der Anwendung in Kombination mit Tamoxifen (39 % vs. 25 %) (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Auch Muskel-Skelett-Erkrankungen und Frakturen wurden bei der Kombination mit Exemestan häufiger berichtet als bei der Kombination mit Tamoxifen (Muskel-Skelett-Erkrankungen: 89 % vs. 76 %; Frakturen: 7 % vs. 5 %)
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie pharmakologischen Eigenschaften von Triptorelin machen eine versehentliche oder absichtliche Überdosierung unwahrscheinlich. Tierversuche zeigen, dass auch bei höheren Dosen von Triptorelin keine anderen als die erwarteten therapeutischen Auswirkungen auf die Konzentration der Sexualhormone und das Fortpflanzungssystem auftreten.
Behandlung
Eine mögliche Überdosierung ist symptomatisch zu behandeln.
Eigenschaften/WirkungenATC-Code
L02AE04
Wirkungsmechanismus
Durch den Ersatz der Aminosäure Glycin durch D-Tryptophan an Position 6 von Gonadorelin entsteht ein Agonist, dessen biologische Aktivität stärker ist als die des natürlichen Hormons Gonadotropin-Releasing-Hormon (GnRH). Diese erhöhte Wirkung kann auf eine verstärkte Affinität für die Hypophysenrezeptoren und eine langsamere Inaktivierung im Zielgewebe zurückgeführt werden.
Pharmakodynamik
Bei der einmaligen und intermittierenden Gabe von GnRH wird die Freisetzung von LH und FSH aus der Hypophyse stimuliert. Bei einer kontinuierlichen Dosierung hingegen, wie sie bei der verzögerten Freisetzung nach der Injektion von Pamorelin LA 3,75 mg erfolgt, kann ein «paradoxer» Effekt beobachtet werden: Die Plasmaspiegel von LH, FSH, Testosteron und Östrogen/Progesteron sinken nach einem vorübergehenden Anstieg zu Beginn der Behandlung innerhalb von etwa 2 Wochen auf Kastrationsniveau ab.
Bei gesunden prämenopausalen Frauen betrug die Zeit bis zur Suppression von Östradiol ca. 4,2 Tage (geometrischer Mittelwert) und die Dauer der Suppression von Östradiol ca. 26,7 Tage (geometrischer Mittelwert). Trotz einer hohen individuellen Variabilität wurde insgesamt 5 Tage nach der i. m. Injektion von Pamorelin LA 3,75 mg die Suppression von Östradiol während etwa 30 Tagen beobachtet.
In der Reproduktionsmedizin führt die selektive Hypophysensuppression, die zuvor mit Triptorelin bei der Behandlung eines unfruchtbaren Paares erreicht wurde, zu einem besseren Erfolg der Ovarialstimulation unter exogenen Gonadotropinen.
Bei der Stimulation mit Gonadotropinen kommt es aufgrund des raschen Anstiegs der Estradiolkonzentration im Plasma häufiger zu einem frühen LH-Peak mit Luteinisierung des unreifen Follikels, und der Therapiezyklus muss dann abgebrochen werden. Dies betrifft etwa 30 % der nicht vorbehandelten Patientinnen im Rahmen eines IVF-Programms und 30–50 % der Zyklen beim polyzystischen Ovarialsyndrom. Die vorgängige Behandlung mit Triptorelin führt zu einer vollständigen hypophysären Suppression (Herunterregulation) mit Blockierung der LH-Freisetzung. Die ovarielle Stimulation wird ausschliesslich durch Gabe exogener Gonadotropine gesteuert. Dies führt zu einer Verbesserung der Follikelreifung, der Eizellenaktivität und Anzahl der Schwangerschaften sowie zu einer geringeren Inzidenz des Hyperstimulationssyndroms und weniger Behandlungsabbrüchen.
Die Derivate Triptorelin-Embonat und -Acetat sind in Bezug auf Pharmakodynamik und Toxizität gleichwertig und austauschbar.
Klinische Wirksamkeit
Prostatakarzinom
In einer randomisierten klinischen Studie der Phase III (EORTC 22961) mit 970 Patienten mit lokal fortgeschrittenem Prostatakarzinom (hauptsächlich T2c-T4, mit Patienten im Stadium T1c bis T2b mit Befall der regionären Lymphknoten), die mit Strahlentherapie behandelt wurden, erhielten 483 Patienten eine kurze (6 Monate) kombinierte Androgen-Suppression und 487 Patienten eine lange (3 Jahre) kombinierte Androgen-Suppression. Insgesamt betrug die Gesamtmortalität nach 5 Jahren 19 % in der Gruppe «kurze Hormontherapie» und 15 % in der Gruppe «lange Hormontherapie», was einem relativen Risiko von 1,42 entspricht. Die spezifisch auf das Prostatakarzinom zurückzuführende 5-Jahres-Mortalität betrug 4,78 % in der Gruppe «kurze Hormontherapie» und 3,2 % in der Gruppe «lange Hormontherapie», was einem relativen Risiko von 1,71 entspricht.
Endometriose
Das Therapiekonzept bei Endometriose mit Pamorelin LA 3,75 mg besteht in einer zeitlich begrenzten und reversiblen Hemmung der Freisetzung hypophysärer Gonadotropine. Dadurch sinkt der Östrogen- und Progesteronspiegel auf ein Niveau, das dem einer Kastration entspricht. Die Folge ist eine Verbesserung der Symptome wie Dysmenorrhoe, Tenesmen, Dysurie, Dyspareunie, Unterleibs- und Sakralschmerzen sowie die Resorption ektopischer Endometriose-Herde.
Mammakarzinom
In klinischen Studien mit prämenopausalen Frauen mit Hormonrezeptor-positivem Mammakarzinom im Frühstadium wurde Triptorelin eingesetzt, um die ovarielle Sekretion von Östradiol, der Hauptquelle für Östrogen, zu unterdrücken. Basierend auf Studien bei gesunden Frauen und bei Frauen mit Endometriose wird der Effekt von Triptorelin 3 bis 4 Wochen nach der ersten Gabe erreicht.
Zwei Phase-III-Studien (SOFT und TEXT) untersuchten den Nutzen einer fünfjährigen Suppression der ovariellen Funktion in Kombination mit Tamoxifen (T) oder einem Aromatase-Hemmer (Exemestan - E) bei prämenopausalen Frauen mit Hormonrezeptor-positivem Mammakarzinom im Frühstadium.
Triptorelin war die Hauptbehandlung zur Erreichung einer ovariellen Suppression (91,0 % der randomisierten Patientinnen in der SOFT-Studie und 100 % in der TEXT-Studie). Bei den übrigen 9 % der Frauen in der SOFT-Studie erfolgte eine bilaterale Ovariektomie oder eine bilaterale Bestrahlung der Ovarien.
Die SOFT-Studie umfasste n = 2023 Patientinnen nach Brustoperation, die nach Abschluss der adjuvanten oder neoadjuvanten Chemotherapie prämenopausal blieben, sowie prämenopausale Frauen, die keine Chemotherapie erhalten hatten und bei denen adjuvantes T (Tamoxifen) allein als adäquate Behandlung angesehen wurde. Die Patientinnen wurden randomisiert, um E + ovarielle Suppression, T + ovarielle Suppression oder T allein zu erhalten. In der TEXT-Studie wurden Frauen nach Brustoperation aufgenommen und randomisiert einer Behandlung mit T + ovarielle Suppression oder E + ovarielle Suppression zugeteilt; die Patientinnen, welche eine Chemotherapie erhielten, begannen diese nach der Randomisierung gleichzeitig mit dem GnRH-Analogon. Die Wirksamkeit beider Studien wurde anhand des primären Endpunkts krankheitsfreies Überleben (DFS) nach 5 Jahren und sekundärer Endpunkte einschliesslich brustkrebsfreies Intervall (BCFI), rezidivfreies Intervall (DRFI) und Gesamtüberleben (OS) beurteilt.
Die SOFT-Studie war zur Beantwortung der Frage nach dem Mehrwert der ovariellen Suppression in Kombination mit Tamoxifen als adjuvante Behandlung bei prämenopausalen Frauen mit Hormonrezeptor-positivem Mammakarzinom im Frühstadium ausgelegt.
Ergebnisse der SOFT-Studie:
Diese Analyse der Frage nach der ovariellen Suppression verglich das DFS (krankheitsfreies Überleben) von Patientinnen, die nach dem Zufallsprinzip T + ovarielle Suppression oder nur T zugeteilt wurden. Bei einer medianen Nachbeobachtung von 67 Monaten (5,6 Jahre) wurden bei 14,7 % der Patientinnen in der Intent-to-treat-Population (ITT) Fälle von DFS berichtet.
Insgesamt hatten 53,3 % der Patientinnen eine vorgängige Chemotherapie erhalten (d.h. Patientinnen, die tendenziell ein hohes Risiko für ein Mammakarzinom-Rezidiv hatten). Der absolute Unterschied nach fünf Jahren war bei den Patientinnen, die zuvor eine Chemotherapie erhalten hatten, signifikanter: DFS 80,7 % (T + ovarielle Suppression) gegenüber 77,1 % (nur T) (Tabelle 1).
Tabelle 1: Frage nach der ovariellen Suppression: Wirksamkeitsergebnisse nach 67 Monaten bei Patientinnen, die zuvor eine Chemotherapie erhalten hatten (ITT-Population)
|
Wirksamkeitsparameter
|
Nur T
(n = 542)
|
T+ovarielle Suppression
(n = 542)
|
Nur T vs. T+ovarielle Suppression
Hazard Ratio
(95 %-KI)
| |
|
Ereignisse:
|
Häufigkeit ohne Ereignis ( %)
|
Ereignisse:
|
Häufigkeit ohne Ereignis ( %)
|
| |
DFS[a]
|
122
|
77,1
|
107
|
80,7
|
0,82 (0,64 bis 1,07)
| |
BCFI
|
116
|
78,0
|
97
|
82,5
|
0,78 (0,60 bis 1,02)
| |
DRFI
|
90
|
83,6
|
82
|
84,8
|
0,87 (0,64 bis 1,17)
| |
OS[b]
|
57
|
90,9
|
39
|
94,5
|
0,64 (0,42 bis 0,96)
|
BCFI = Mammakarzinom-freies Intervall, KI = Konfidenzintervall, DFS= krankheitsfreies Überleben, DRFI = rezidivfreies Intervall, ITT = Intent-to-Treat, SFO = ovarielle Suppression, OS = Gesamtüberleben, T = Tamoxifen
a Krankheitsfreies Überleben ist definiert als die Zeit bis zum ersten Auftreten eines lokalen Rezidivs oder Fernrezidivs, eines kontralateralen Mammakarzinoms oder Tod jeglicher Ätiologie.
b Unreife Daten zum Gesamtüberleben nach 67 Monaten.
Kombinierte Ergebnisse der SOFT- und TEXT-Studien
Die TEXT-Studie war zur Bewertung der Rolle von Aromatase-Hemmern (AIs) (Exemestan) in der adjuvanten Therapie prämenopausaler Frauen mit Hormonrezeptor-positivem Mammakarzinom im Frühstadium ausgelegt, die mit ovarieller Suppression behandelt werden.
Die Analyse der AI-Frage kombinierte die TEXT- und SOFT-Studien und verglich das DFS von nach dem Zufallsprinzip zugewiesenen Patientinnen mit E + ovarieller Suppression vs. solchen mit T + ovarieller Suppression. In die Analyse wurden insgesamt 4690 Patientinnen einbezogen.
Nach einer medianen Nachbeobachtung von 68 Monaten (5,7 Jahre) wurden DFS-Ereignisse bei (11,0 %) der Patientinnen in der ITT-Population berichtet. Insgesamt verbesserte sich das geschätzte DFS nach 5 Jahren um 91,1 % (95 %-KI 89,7 % bis 92,3 %) bei Patientinnen mit E + ovarieller Suppression gegenüber 87,3 % (95 %-KI 85,7 % bis 88,7 %) bei Patientinnen mit T + ovarieller Suppression (HR 0,717; 95 %-KI 0,602 bis 0,855; p = 0,0002). Tabelle 2 zeigt die Wirksamkeitsergebnisse für Patientinnen in der AI-Analyse, die eine vorgängige Chemotherapie erhalten hatten.
Tabelle 2: Frage nach der AI: Wirksamkeitsergebnisse nach 68 Monaten bei Patientinnen, die zuvor eine Chemotherapie erhalten hatten (ITT-Population)
|
Wirksamkeitsparameter
|
E+ovarielle Suppression
(n = 544)
|
T+ovarielle Suppression
(n = 543)
|
Hazard Ratio
E+ovarielle Suppression vs. T+ovarielle Suppression
(95 %-KI)
| |
|
Ereignisse:
|
Häufigkeit ohne Ereignis ( %)
|
Ereignisse:
|
Häufigkeit ohne Ereignis ( %)
|
| |
DFS[a]
|
81
|
84,3
|
98
|
80,6
|
0,838 (0,625 bis 1,125)
| |
BCFI
|
72
|
86,1
|
90
|
82,2
|
0,818 (0,600 bis 1,116)
| |
DRFI
|
61
|
88,0
|
77
|
84,6
|
0,808 (0,577 bis 1,131)
| |
OS[b]
|
46
|
91,8
|
35
|
94,1
|
1,387 (0,894 bis 2,154)
|
AI = Aromatase-Inhibitor; BCFI = Mammakarzinomfreies Intervall, KI = Konfidenzintervall, DFS = krankheitsfreies Überleben, E = Exemestan, DRFI = rezidivfreies Intervall, ITT = Intent-to-treat, SFO = ovarielle Suppression, OS = Gesamtüberleben, T = Tamoxifen
a Krankheitsfreies Überleben ist definiert als die Zeit bis zum ersten Auftreten eines lokalen Rezidivs oder Fernrezidivs, eines kontralateralen Mammakarzinoms oder Tod jeglicher Ätiologie.
b Unreife Daten zum Gesamtüberleben nach 68 Monaten.
Eine aktualisierte Analyse nach einer medianen Nachbeobachtung von 8 Jahren bestätigte die Ergebnisse der 5-Jahres-Analyse.
PharmakokinetikAbsorption
Maximale Plasmakonzentrationen von etwa 30 ng/l wurden bei gesunden erwachsenen männlichen Probanden 1–3 Stunden nach der intramuskulären Injektion von Pamorelin LA 3,75 mg erreicht. Die Konzentrationen sinken schnell und stabilisieren sich bei Plasmaspiegeln von etwa 0,1 ng/l, die mindestens einen Monat lang aufrechterhalten werden. Etwa 80 % des Wirkstoffs werden in diesem vierwöchigen Intervall freigesetzt. Es gibt keinen Hinweis auf eine Akkumulation des Wirkstoffs nach wiederholter Gabe.
Bei gesunden prämenopausalen Frauen wurden nach einer intramuskulären Injektion von Pamorelin LA 3,75 mg maximale Triptorelin-Konzentrationen ca. 2 Stunden nach der Injektion beobachtet, mit einem geometrischen Mittelwert von Cmax = 18,5 ng/ml.
Distribution
Nach intravenöser Bolusgabe entspricht die Distribution von Triptorelin einem 3-Kompartiment-Modell mit Halbwertszeiten von 6 Minuten, 45 Minuten und 3 Stunden. Das Distributionsvolumen entspricht ungefähr 30 Litern im Steady-State. In klinisch relevanten Konzentrationen wird Triptorelin nicht an Plasmaproteine gebunden.
Metabolismus
Beim Menschen wurden keine Metaboliten von Triptorelin gefunden. Die pharmakokinetischen Daten beim Menschen zeigen aber, dass die durch Gewebezerstörung entstehenden C-terminalen Fragmente entweder vollständig im Gewebe zerstört oder schnell und endgültig im Plasma zerstört oder über die Nieren ausgeschieden werden. Eine Beteiligung der CYP450-Enzyme am Metabolismus ist unwahrscheinlich.
Elimination
Triptorelin wird über die Leber und Nieren ausgeschieden. Nach i. v. Injektion von 0,5 mg Triptorelin wurden 42 % dieser Dosis als nicht metabolisiertes Triptorelin im Urin ausgeschieden.
Die Gesamt-Clearance von Triptorelin liegt bei etwa 200 ml/min und die terminale Halbwertszeit bei 2,8 Stunden.
Kinetik spezieller Patientengruppen
Ältere Patienten
Der Einfluss des Alters auf die Pharmakokinetik von Triptorelin wurde nicht systematisch untersucht. Pharmakokinetische Daten, die an jungen männlichen Freiwilligen im Alter von 20 bis 22 Jahren mit einer supraphysiologischen Kreatinin-Clearance (ca. 150 ml/min) erhoben wurden, deuten jedoch darauf hin, dass Triptorelin bei jungen Menschen doppelt so schnell eliminiert wird. Dies ist darauf zurückzuführen, dass die Kreatinin-Clearance mit zunehmendem Alter abnimmt.
Beeinträchtigte Nierenfunktion
Bei einer beeinträchtigten Nierenfunktion nimmt die Clearance von Triptorelin proportional zur Kreatinin-Clearance ab. Die Halbwertszeit betrug 6,7 Stunden bei Patienten mit mässig beeinträchtigter Nierenfunktion (durchschnittliche Kreatinin-Clearance 40 ml/min) und 7,8 Stunden bei Patienten mit stark beeinträchtigter Nierenfunktion.
Beeinträchtigte Leberfunktion
Bei Patienten mit beeinträchtigter Leberfunktion war die AUC (Fläche unter Kurve) von Triptorelin etwa 3,7-mal so hoch wie bei gesunden Probanden und die Halbwertszeit von Triptorelin betrug 7,65 Stunden. Der Anteil an nicht-metabolisiertem Triptorelin, der im Urin ausgeschieden wurde, war bei diesen Patienten auf 62 % erhöht.
Präklinische DatenDie akute Toxizität von Triptorelin ist sehr gering. Die beobachteten Effekte sind im Wesentlichen auf eine Verstärkung der pharmakologischen Wirkung von Triptorelin zurückzuführen.
Nach subkutaner Injektion von 10 µg/kg bei Ratten an Tag 6 bis 15 der Trächtigkeit (im Vergleich zur klinischen Dosis von 3,75 mg alle 4 Wochen beim Menschen) hatte Triptorelin keine embryotoxischen, teratogenen oder fetotoxischen Auswirkungen. Bei 100 µg/kg wurde hingegen eine geringere Gewichtszunahme der Muttertiere sowie eine Zunahme der Resorptionen beobachtet.
Toxizität bei wiederholter Gabe
Es wurden keine Fertilitätsstudien bei männlichen Ratten durchgeführt. In Studien zur chronischen Toxizität mit klinischen Dosierungen verursachte Triptorelin makro- und mikroskopische Veränderungen in Fortpflanzungsorganen von Ratten und Hunden, die auf die Suppression der Gonadenfunktion aufgrund der pharmakologischen Aktivität dieses Wirkstoffs zurückgeführt wurden. Diese Veränderungen bildeten sich in der Erholungsphase teilweise zurück.
Mutagenität
Triptorelin ist nicht mutagen, weder in vitro noch in vivo.
Kanzerogenität
Eine 23-monatige Kanzerogenesestudie bei Ratten zeigte, dass bei jeder Dosierungsstufe fast 100 % benigner Hypophysentumore zum vorzeitigen Tod führten. Diese erhöhte Inzidenz benigner Hypophysentumore bei Ratten ist eine häufige Folge der Behandlung mit GnRH-Agonisten. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Triptorelin wurde Mäusen in Dosen von bis zu 6000 µg/kg verabreicht und zeigte nach 18 Monaten Behandlung keine onkogene Wirkung.
Reproduktionstoxizität
Bei einer 8-mal höheren Dosis als für Menschen empfohlen (bezogen auf die Körperoberfläche) wurde in Tierversuchen bei Ratten eine Toxizität für die Organogenese nachgewiesen (maternale und embryonale Toxizität). Bei jungen Ratten, die in utero hohen Dosen von Triptorelin ausgesetzt waren, gab es vereinzelte Fälle von Hydroureter.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Triptorelin in therapeutischen Dosen führt zur Suppression der Hypophysen-Gonaden-Achse. Die normale Funktion wird in der Regel nach Absetzen der Behandlung wiederhergestellt. Die Ergebnisse diagnostischer Hypophysen-Gonaden-Funktionstests während der Behandlung oder 4 bis 12 Wochen nach Absetzen der GnRH-Agonisten können daher irreführend sein.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Aus mikrobiologischen Gründen sollte die Suspension unmittelbar nach der Rekonstitution injiziert werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern.
Nicht einfrieren.
In der Originalverpackung aufbewahren.
Behälter fest verschlossen halten.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Herstellung der Suspension zur Injektion sollte unmittelbar vor der Injektion erfolgen.
Es ist die bebilderte Anleitung am Ende des Dokuments zu beachten.
Zulassungsnummer52815 (Swissmedic)
PackungenPamorelin LA 3,75 mg ist in zwei Darreichungsformen erhältlich:
·1 Durchstechflasche mit 3,75 mg Triptorelin als Pulver
·1 Fertigspritze mit 2 ml Lösungsmittel
·1 Durchstechflaschenadapter und 2 Nadeln (1 Nadel für die intramuskuläre und 1 Nadel für die subkutane Verabreichung) (A)
oder
·1 Durchstechflasche mit 3,75 mg Triptorelin als Pulver
·1 Ampulle mit 2 ml Lösungsmittel
·1 Spritze und 3 Nadeln (1 Nadel für die Rekonstitution, 1 Nadel für die intramuskuläre und 1 Nadel für die subkutane Verabreichung) (A)
ZulassungsinhaberinDebiopharm Research & Manufacturing SA, 1920 Martigny
Stand der InformationMai 2025
02-010628/12
Anleitung zur Herstellung einer Suspension
Allgemeine Anweisungen und Empfehlungen
Das Produkt ist eine Suspension von Mikropartikeln:
·Das Produkt ist eine Suspension von Mikropartikeln, die in der Verdünnung sedimentieren können. Das Produkt sollte homogen, dickflüssig und milchig aussehen. Wenn das Produkt in der Flasche sedimentiert, schütteln Sie sie erneut.
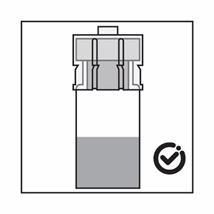
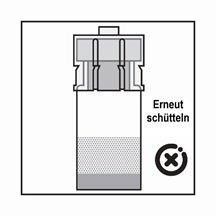
·Wenn sich die Partikel in der Spritze absetzen, führt dies zu einer Blockierung der Nadel bei der Verabreichung. Es ist sehr wichtig, das Produkt innerhalb von 2 Minuten nach der Rekonstitution in der Durchstechflasche zu injizieren.
·Wenn das Produkt in der Spritze sedimentiert, ziehen Sie etwas Luft in die Spritze auf, schütteln Sie die Flasche erneut und drücken Sie die Luft heraus (ohne die Nadel mit der Flüssigkeit zu aspirieren), bevor Sie das Produkt verabreichen.
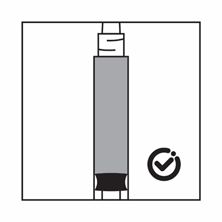
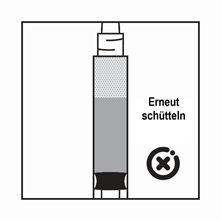
Anweisungen zur Herstellung der Suspension von Pamorelin LA 3,75 mg in der Darreichungsform mit vorgefüllter Lösungsmittelspritze
|
1
|
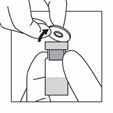
Die Durchstechflasche mit dem Pulver entnehmen.
Den Plastikdeckel der Durchstechflasche entfernen.
|
|
| |
2
|
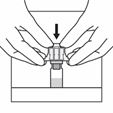
Die Schutzfolie vom Adaptersystem entfernen. Entfernen Sie den Flaschenadapter nicht aus dem Blister. Die Durchstechflasche auf eine flache, harte Oberfläche stellen. Den Adapter auf dem Verschluss der Durchstechflasche zentrieren und hineindrücken, bis ein Klicken zu hören ist. Den Blister entfernen und entsorgen.
|
|
|
| |
3
|
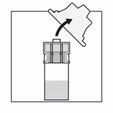
Nehmen Sie die Spritze auf, halten Sie sie am (drehbaren) Kunststoff-Konnektor zwischen Zeigefinger und Daumen einer Hand fest und schrauben Sie mit der anderen Hand die Kappe ab.
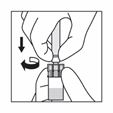
Halten Sie die Spritze immer noch am drehbaren Konnektor fest und befestigen Sie sie vertikal am Adapter, indem Sie eine halbe Drehung im Uhrzeigersinn machen (nur, bis ein Widerstand zu spüren ist). Achtung: Ein zu festes Anziehen kann zu einer Unterbrechung der Verbindung und zu Undichtigkeiten führen.
|
|
|
| |
4
|
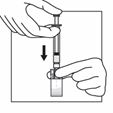
Halten Sie die Durchstechflasche am Adapter mit einer Hand fest, drücken Sie mit der anderen Hand den Kolben der Spritze und injizieren Sie langsam den gesamten Inhalt der Spritze in die Durchstechflasche.
In diesem Schritt den Patienten für die Injektion vorbereiten. Die folgenden Schritte sollten ohne Unterbrechung durchgeführt werden.
|
|
| |
5
|
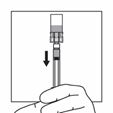
Halten Sie das gesamte System (Spritze, Adapter und Flasche) fest in der Hand und schütteln Sie es dann 30 Sekunden lang kräftig auf und ab.
Überprüfen Sie das Aussehen der Suspension, indem Sie durch den Boden des Fläschchens schauen. Die Suspension sollte homogen, dick und milchig aussehen. Schütteln Sie das System erneut, wenn sich eine Sedimentation zeigt.
Wenn während des Schüttelns ein Teil der Suspension in der Spritze aufsteigt, drücken Sie mit dem Kolben die Suspension wieder in die Flasche. Schütteln Sie das System erneut, bevor Sie zum nächsten Schritt übergehen.
Das Produkt sollte ab jetzt innerhalb von 2 Minuten injiziert werden.
|
|
| |
6
|
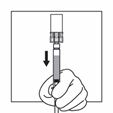
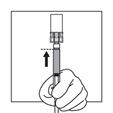
Drehen Sie das System, so dass die Flasche oben und die Spritze unten ist. Ziehen Sie vorsichtig an der Kolbenstange, um den gesamten Inhalt der Flasche in die Spritze aufzuziehen.
|
|
|
| |
7
|
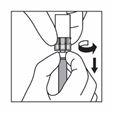
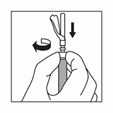
Wenn der gesamte Inhalt in die Spritze aufgezogen ist, entfernen Sie Luftblasen aus der Spritze in die Durchstechflasche. Stoppen Sie, bevor die Suspension die Basis des Spritzenkopfes erreicht.
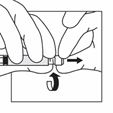
Trennen Sie die Spritze vom Adapter, indem Sie die Spritze mit einer Hand festhalten und mit der anderen Hand den Adapter gegen den Uhrzeigersinn drehen.
Halten Sie die Spritze am Drehverschluss fest und befestigen Sie die lange Nadel für die intramuskuläre Injektion oder die kurze Nadel für die subkutane Injektion.
Vergewissern Sie sich vor der Injektion, dass das Produkt homogen, dickflüssig, milchig und frei von Sedimentation ist. Falls es zu einer Sedimentation kommt, schütteln Sie die Spritze vor der Injektion noch einmal.
|
|
|
|
| |
8
|
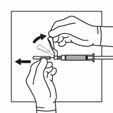
Schieben Sie die Sicherheitshülle hinter die Nadel und in Richtung des Spritzenkörpers. Die Sicherheitshülle verbleibt in der Position.
Entfernen Sie den transparenten Nadelschutz.
Die Nadel nicht mit der Suspension aspirieren.
Die Spritze mit der Suspension ist nun bereit für die Injektion. Die Suspension sollte sofort verabreicht werden (weniger als 2 Minuten nach der Rekonstitution), um eine übermäßige Verdickung der Suspension zu vermeiden.
|
|

|
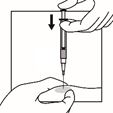
| |
9
|
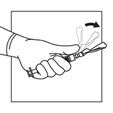
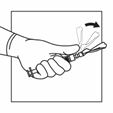
Injizieren Sie die Suspension relativ schnell und ohne Unterbrechung intramuskulär. Achten Sie darauf, dass die gesamte Menge innerhalb von 10 Sekunden ohne Unterbrechung injiziert wird.
Die Injektionsstelle muss regelmässig gewechselt werden.
Verwenden Sie die kürzere Nadel für die subkutane Verabreichung (nur für erwachsene Männer). Injizieren Sie die Suspension relativ schnell und ohne Unterbrechung.
Aktivieren Sie das Sicherheitssystem der Injektionsnadel, indem Sie Ihren Daumen oder Zeigefinger auf dem strukturierten Bereich der Sicherheitshülle zentrieren und ihn nach vorne auf die Nadel drücken, bis Sie hören oder fühlen, dass er einrastet. Führen Sie den Vorgang mit einer Hand durch und aktivieren Sie den Sicherheits-Mechanismus weit weg von sich und anderen.
|
Intramuskulär
|
Subkutan
|
|
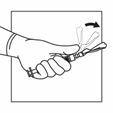
|
Die Nadeln in einem dafür vorgesehenen Behälter entsorgen.
Nur zur einmaligen Verwendung. Jede nicht verwendete Suspension muss entsorgt werden.
Anleitungen zur Herstellung der Suspension von Pamorelin LA 3,75 mg in der Darreichungsform mit Lösungsmittelampulle
|
1. Vorbereitung der Injektion
2 Nadeln sind im Set enthalten:
·Die Rekonstitutionsnadel ohne Sicherheitssystem
·Die Injektionsnadel mit Sicherheitssystem
·Die Lösung, die sich eventuell im oberen Teil der Ampulle befindet, wird in den Hauptbehälter der Lösungsmittelampulle geklopft.
·Die Nadel ohne Sicherheitssystem auf die Spritze drehen (den Nadelschutz noch nicht entfernen!).
·Die Lösungsmittelampulle aufbrechen (Punkt gegen sich).
| |
·Den Nadelschutz der Rekonstitutionsnadel entfernen und das gesamte Lösungsmittel in die Spritze aufziehen (Abb. A).
·Die Spritze mit dem Lösungsmittel beiseite legen.
·Die Durchstechflasche mit dem Pulver entnehmen.
·Den Plastikdeckel der Durchstechflasche entfernen.
|
|
| |
·Die Spritze mit dem Lösungsmittel wieder aufnehmen, die Nadel in den Gummistopfen des Fläschchens einstechen und das Lösungsmittel langsam injizieren, sodass es weitgehend an der Flaschenwand herunterläuft (Abb. B).
·In diesem Schritt den Patienten für die Injektion vorbereiten. Die folgenden Schritte sollten ohne Unterbrechung durchgeführt werden.
|
|
| |
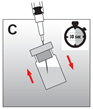
·Die Nadel oberhalb des Flüssigkeitsspiegels zurückziehen und die Durchstechflasche 30 Sekunden lang kräftig schütteln. Die Suspension sollte milchig und homogen aussehen (Abb. C). Überprüfen, dass kein Pulver in der Flasche verbleibt, und wenn nötig, die Suspension fortsetzen, bis das Pulver vollständig verschwunden ist.
Achtung: Die Mischung darf nicht durch mehrmaliges Aufziehen und Entleeren der Spritze erfolgen!
·Das Produkt sollte nun innerhalb von 2 Minuten injiziert werden.
|
|
| |
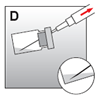
·Die gesamte Injektionssuspension in die Spritze aufziehen (Abb. D).
|
|
| |
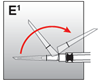
·Die Rekonstitutionsnadel entfernen. Die lange intramuskuläre Nadel oder die kurze subkutane Nadel mit Sicherheitssystem fest auf die Spritze drehen (bis zum Anschlag). Nur die farbige Hülle fassen.
·Die Sicherheitshülle hinter die Nadel und in Richtung des Spritzenkörpers bewegen (Abb. E1). Die Sicherheitshülle bleibt in der Position, in die sie gebracht wurde.
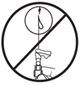
·Den Schutz der Injektionsnadel entfernen.
·Dann sofort die gesamte Spritze verabreichen.
·Die Nadel nicht mit der Suspension anstechen (Abb. E2)
|
|
E2
|
| |
2. Injektion
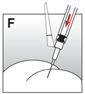
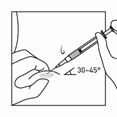
·Die Suspension für Injektionszwecke relativ schnell und ohne Unterbrechung intramuskulär injizieren (Abb. F).
·Verwenden Sie die kürzere Injektionsnadel für die subkutane Verabreichung (nur für erwachsene Männer). Injizieren Sie die Suspension relativ schnell und ohne Unterbrechung.
|
Intramuskulär
|
Subkutan
|
| |
3. Nach der Verabreichung
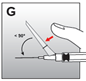
·Das Sicherheitssystem der Injektionsnadel nach einer der folgenden Methoden aktivieren:
·Mit einer Hand auf die Sicherung nach vorne drücken, um die Nadel zu bedecken und die Sicherung zu schliessen (Abb. G). Immer den Zeigefinger oder Daumen hinter der Nadelspitze halten.
Oder
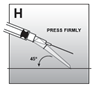
·Die Sicherung mit der nach unten gerichteten Seite auf eine flache Oberfläche, z.B. den Tisch, drücken, um die Nadel zu bedecken und die Sicherung zu schliessen (Abb. H).
·Die Sicherung der Injektionsnadel ist geschlossen, sobald die Nadelspitze vollständig bedeckt ist (Abb. I).
Sicherstellen, dass dies durch hörbare, spürbare und/oder optische Zeichen geschieht.
·Die Nadeln in einem dafür vorgesehenen Behälter entsorgen.
·Nur zur einmaligen Verwendung. Jede nicht verwendete Suspension muss entsorgt werden.
|
|
Oder
|
|
|
|
































