ZusammensetzungWirkstoffe
Urapidilum.
Hilfsstoffe
1 Ampulle Urapidil Stragen i.v. 25 mg enthält:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad solutionem pro 5 ml.
*Hilfsstoffe von besonderem Interesse: 500 mg Propylenglycolum und 2,18 mg Natrium.
1 Ampulle Urapidil Stragen i.v. 50 mg enthält:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad. solutionem pro 10 ml.
*Hilfsstoffe von besonderem Interesse: 1000 mg Propylenglycolum und 4.36 mg Natrium.
Darreichungsform und Wirkstoffmenge pro EinheitInjektionslösung i.v:
1 Ampulle Urapidil Stragen i.v. 25 mg enthält:
Wirkstoff: Urapidilum 25 mg.
1 Ampulle Urapidil Stragen i.v. 50 mg enthält:
Wirkstoff: Urapidilum 50 mg.
Indikationen/AnwendungsmöglichkeitenBluthochdruck.
Hypertensive Notfälle (z.B. krisenhafter Blutdruckanstieg), schwere bzw. schwerste Formen der Hochdruckkrankheit, therapieresistenter Hochdruck. Die Behandlung des krisenhaften Blutdruckanstiegs bei Vorliegen eines Phäochromozytoms ist möglich. Blutdrucksenkung bei Hochdruckpatienten während und/oder nach Operationen. Blutdrucksenkung bei krisenhaftem Blutdruckanstieg von Normotonikern während und/oder nach Operationen.
Dosierung/AnwendungErwachsene
Übliche Dosierung
Urapidil Stragen i.v. wird intravenös als Injektion oder Infusion am liegenden Patienten verabreicht.
Sowohl ein- oder mehrmalige Injektion als auch intravenöse Langzeitinfusion sind möglich. Injektionen lassen sich mit anschliessender Langzeitinfusion kombinieren. Überlappend mit der parenteralen Akuttherapie ist der Übergang auf eine Dauertherapie mit oral zu verabreichenden Blutdrucksenkern möglich.
Hypertensive Notfälle, schwere und schwerste Formen der Hypertonie sowie therapieresistente Hypertonie
Als Injektion werden 10-50 mg Urapidil Stragen i.v. intravenös injiziert. Innerhalb von 5 Minuten ist eine blutdrucksenkende Wirkung zu erwarten. Abhängig vom Blutdruckverhalten kann die Injektion von Urapidil Stragen i.v. wiederholt werden.
Für eine intravenöse Dauertropfinfusion verdünnt man 250 mg Urapidil Stragen i.v. (5 Ampullen Urapidil Stragen i.v. 50 mg oder 10 Ampullen Urapidil Stragen i.v. 25 mg) in 500 ml einer kompatiblen Infusionslösung, z.B. physiologische Kochsalzlösung, 5- oder 10%ige Glukoselösung, 5%ige Lävuloselösung oder Dextran-40-Lösung mit 0,9% Natriumchlorid. Die kompatible Höchstmenge beträgt 4 mg Urapidil Stragen i.v. pro ml Infusionslösung. Wegen physikalisch-chemischer Inkompatibilitäten sollte Urapidil Stragen i.v. nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden: aufgrund der sauren Eigenschaften der Injektionslösung kann es zu einer Trübung oder Ausflockung kommen.
Bei Verwendung eines Perfusors zur Gabe der Erhaltungsdosis werden 20 ml Urapidil Stragen i.v.-Injektionslösung (= 100 mg Urapidil Stragen i.v.) in einer Perfusorspritze aufgezogen und bis zu einem Volumen von 50 ml mit einer kompatiblen Infusionslösung (siehe oben) verdünnt.
Für die Anfangsdosis kommt eine Infusionsgeschwindigkeit von bis 2 mg/min in Frage. Die Erhaltungsdosis (im Mittel 9 mg/h) und die Dauer der Infusion (nicht länger als 48 Stunden) sind dem Blutdruck anzupassen.
Das Ausmass der Blutdrucksenkung wird von der in den ersten 15 Minuten infundierten Dosis bestimmt. Nachfolgend kann der eingestellte Blutdruck mit wesentlich kleineren Dosen aufrechterhalten werden.
Kontrollierte Blutdrucksenkung bei Hochdruckpatienten während und/oder nach Operationen
Dosierungsschema:
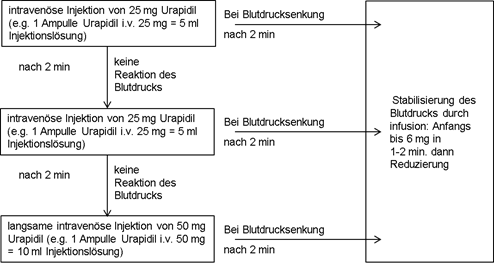
Zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus kommen kontinuierliche Infusion per Perfusor oder Dauertropfinfusion zur Anwendung.
Spezielle Dosierungsanweisungen
Wird Urapidil Stragen i.v. nicht als erstes blutdrucksenkendes Medikament gegeben, so kann es nach intravenöser Verabreichung zu einem ausgeprägten Blutdruckabfall mit Bradykardie und/oder Herzstillstand kommen. Daher ist ausreichend lange auf den Wirkungseintritt des/der zuvor gegebenen blutdrucksenkenden Mittel(s) zu warten. Die Dosierung von Urapidil Stragen i.v. ist entsprechend niedriger zu wählen.
Ältere Patienten
Bei älteren Patienten müssen blutdrucksenkende Mittel mit entsprechender Vorsicht und zu Beginn in kleineren Dosen verabreicht werden, da bei diesen Patienten die Empfindlichkeit gegenüber derartigen Präparaten oftmals verändert ist.
Nieren- und Leberfunktionsstörungen
Bei Patienten mit leichter bis mittlerer Nieren- und/oder Leberfunktionsstörung kann eine mässige Dosisverringerung von Urapidil Stragen i.v. erforderlich sein.
Kinder und Jugendliche
Die für dieses Präparat in Frage kommenden Indikationen sind in der Pädiatrie ausserordentlich selten. Die Anwendung und Sicherheit von Urapidil Stragen i.v. Injektionslösung bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Therapiedauer
Nicht länger als 48 Stunden.
KontraindikationenUrapidil Stragen i.v. soll nicht angewendet werden bei Aortenisthmusstenose, arteriovenösem Shunt, ausgenommen: hämodynamisch nicht wirksamer Dialyse-Shunt, sowie bei Überempfindlichkeit gegenüber einem der Inhaltsstoffe.
Warnhinweise und VorsichtsmassnahmenWurden vor Urapidil Stragen i.v. bereits andere blutdrucksenkende Substanzen angewendet, so ist besondere Vorsicht hinsichtlich Dosierung und Wartezeit geboten (siehe auch "Dosierung/Anwendung" ).
Zu rascher Blutdruckabfall kann zu Bradykardie oder Herzstillstand führen.
Besondere Vorsicht bei der Anwendung von Urapidil Stragen i.v., ist erforderlich bei:
-Herzinsuffizienz, deren Ursache in einer mechanischen Funktionsbehinderung liegt (z.B. Aortenklappen- oder Mitralklappenstenose), bei Lungenembolie oder bei durch Perikarderkrankungen bedingter Einschränkung der Herzaktion;
-Kindern und Jugendlichen, da keine Untersuchungen hierzu vorliegen;
-Patienten mit Leberfunktionsstörungen;
-Patienten mit mässiger bis schwerer Nierenfunktionsstörung;
älteren Patienten;
-Patienten, die gleichzeitig Cimetidin erhalten (vgl. Rubrik "Interaktionen" ).
Überempfindlichkeit/Urtikaria/Angioödem
Bei mit Urapidil behandelten Patienten sind Urtikaria und Angioödeme des Gesichts, der Lippen, Zunge, Glottis und/oder des Larynx beobachtet worden (siehe auch "Unerwünschte Wirkungen" ). Urapidil Stragen i.v. sollte in diesen Fällen sofort abgesetzt und der Patient sorgfältig überwacht werden, bis die Schwellung verschwunden ist. Sogar Patienten, bei denen die Schwellungen nur die Zunge involviert, ohne Atemnot, benötigen unter Umständen eine verlängerte Beobachtung, da die Behandlung mit Antihistaminika und Kortikosteroiden ungenügend sein kann.
Bei Patienten, bei denen Zunge, Glottis oder Larynx betroffen sind, ist es möglich, dass die Atemwege blockiert werden. Sind Zunge, Larynx und Glottis betroffen, so sollten sofort adäquate therapeutische Massnahmen ergriffen werden, welche die subkutane Injektion einer Lösung von Adrenalin 1:1000 (0,3 ml bis 0,5 ml) und/oder Massnahmen zur Sicherstellung eines offenen Atemwegs einschliessen können. Der Patient sollte medizinisch streng überwacht werden.
Hilfsstoffe von besonderem Interesse:
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Ampulle, d.h. es ist nahezu "natriumfrei" .
Das in diesem Arzneimittel enthaltene Propylenglycol kann die gleichen Wirkungen haben wie der Genuss von Alkohol und kann die Wahrscheinlichkeit für das Auftreten von Nebenwirkungen erhöhen.
Unter hohen Dosen oder bei längerer Anwendung von Propylenglycol wurde über verschiedene unerwünschte Ereignisse berichtet, wie: Hyperosmolalität, Lactatacidose, Nierenfunktionsstörung (akute Tubulusnekrose), akutes Nierenversagen, Kardiotoxizität (Arrhythmie,Hypotonie), Erkrankungen des Zentralnervensystems (Depression, Koma, Krampfanfälle), Atemdepression, Dyspnoe, Leberfunktionsstörung, hämolytische Reaktionen (intravaskuläre Hämolyse) und Hämoglobinurie, Multiorganversagen. Daher können Dosen über 500 mg/kg/Tag bei Kindern über 5 Jahren angewendet werden, müssen jedoch im Einzelfall bewertet werden. Unerwünschte Wirkungen sind normalerweise nach Absetzen von Propylenglycol reversibel; in schwereren Fällen kann eine Hämodialyse erforderlich sein. Eine medizinische Überwachung ist erforderlich. Wenden sie dieses Arzneimittel nicht bei Kindern unter 5 Jahren an. Wenden Sie dieses Arzneimittel nur auf Empfehlung eines Arztes an. Ihr Arzt führt möglicherwiese zusätzliche Untersuchungen durch, während Sie dieses Arzneimittel einnehmen.
InteraktionenPharmakokinetische und Pharmakodynamische Interaktionen
Urapidil verändert weder die Aktivität noch die individuelle Reaktionsweise des Plasmarenins.
Wirkung anderer Arzneimittel auf Urapidil Stragen i.v.
Alpha-Rezeptorenblocker, Vasodilatatoren und andere Arzneimittel zur Behandlung der Hochdruckkrankheit (auch Diuretika), Zustände mit Volumenmangel (Durchfall, Erbrechen) oder Alkoholgenuss können die blutdrucksenkende Wirkung von Urapidil verstärken. Bei gleichzeitiger Gabe von Cimetidin ist mit einer Erhöhung der Urapidil-Serumspiegelmaxima zu rechnen.
Sonstige Interaktionen
Wechselwirkungen mit gleichzeitig verabreichten Narkose-, Herz- und Beruhigungsmitteln sowie gerinnungshemmenden, harnsäuresenkenden, blutzucker- und blutfettsenkenden Mitteln sind bislang nicht beschrieben.
Enzymatische Inhibitoren
Wegen mangelnder klinischer Erfahrung wird die Kombination mit ACE-Hemmern nicht empfohlen.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt nur begrenzte Daten zur Anwendung bei Schwangeren.
Urapidil ist bei Tieren nicht teratogen, tierexperimentelle Studien haben jedoch eine Reproduktionstoxizität, bei Dosierungen gezeigt, die als ausreichend über der maximalen menschlichen Dosis liegend angesehen werden (siehe "Präklinische Daten" ). Urapidil wird während der Schwangerschaft nicht empfohlen, es sei denn, der potenzielle Nutzen für die Mutter überwiegt das potenzielle Risiko für den Fötus. Urapidil wird nicht bei Frauen im gebärfähigen Alter empfohlen, die keine wirksame Verhütung anwenden.
Stillzeit
Es ist nicht bekannt, ob Urapidil in die menschliche Muttermilch ausgeschieden wird, daher sollten Mütter während der Behandlung mit Urapidil nicht stillen.
Fertilität
Es wurden keine klinischen Studien über die Auswirkungen auf die männliche und weibliche Fruchtbarkeit durchgeführt. Tierversuche haben gezeigt, dass Urapidil die Fruchtbarkeit beeinflusst (siehe "Präklinische Daten" ), aber die Relevanz für den Menschen ist nicht bekannt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDurch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Strassenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Masse bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenhang mit Alkohol. Urapidil Stragen i.v. hat einen geringen Einfluss auf die Fahrtüchtigkeit oder das Bedienen von Maschinen.
Unerwünschte WirkungenIm Folgenden sind die unerwünschten Wirkungen aufgelistet, die nach Anwendung von Urapidil auftreten können. Die Häufigkeiten sind folgendermassen definiert: sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich: ≥1/1000 bis <1/100; selten: ≥1/10 000 bis <1/1000; sehr selten: <1/10 000.
Erkrankungen des Nervensystems
Häufig: Schwindel*, Kopfschmerzen*.
Sehr selten: Unruhe*.
Herzerkrankungen
Gelegentlich: Herzklopfen*, Tachykardie*, Bradykardie*, Druckgefühl hinter dem Brustbein*, Atemnot*, unregelmässige Herzschlagfolge*.
Sehr selten: kollapsähnliche Zustände (Orthostasen).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten: verstopfte Nase.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit*.
Gelegentlich: Erbrechen*.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Schweissausbruch*.
Selten: Allergische Erscheinungen (Juckreiz, Hautrötung, Exantheme).
Einzelfälle: Angioödem und Urtikaria.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Priapismus.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Müdigkeit*.
*) Diese unerwünschten Wirkungen sind in der Regel auf eine zu rasche Blutdrucksenkung durch Urapidil zurückzuführen. Erfahrungsgemäss verschwinden diese Nebenwirkungen jedoch innerhalb von Minuten, auch während Langzeitinfusion, so dass eine Unterbrechung der Behandlung nicht erforderlich ist.
Eine Natriumretention wurde bislang unter Urapidiltherapie nicht beobachtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
seitens des Kreislaufs: Schwindel, Orthostasesyndrom und Kollaps
seitens des Zentralnervensystems: Müdigkeit und verminderte Reaktionsfähigkeit.
Therapie bei Überdosierung
Eine übermässige Blutdrucksenkung kann durch Hochlagern der Beine und Volumensubstitution gebessert werden. Falls diese Massnahmen nicht ausreichen, können gefässverengende Präparate langsam und unter Blutdruckkontrolle i.v. injiziert werden. In seltenen Fällen ist die Gabe von Adrenalin in der üblichen Verdünnung und Dosis (100-1000 μg) notwendig.
Eigenschaften/WirkungenATC-Code
C02CA06
Wirkungsmechanismus
Der blutdrucksenkende Effekt von Urapidil beruht auf einer gleichzeitigen Beeinflussung zentraler und peripherer Funktionen des sympathischen Nervensystems. Urapidil hemmt bevorzugt periphere postsynaptische α1-adrenerge Rezeptoren, mindert die Neurotransmission an den peripheren sympathischen Nervenendigungen und bewirkt zentral eine Abnahme des Sympathikotonus.
Eine beabsichtigte oder versehentliche Unterbrechung der Urapidil-Therapie hat keine abrupte Blutdrucksteigerung zur Folge.
Belastungsbedingte Blutdruckspitzen bei Hochdruckkranken werden durch Urapidil gedämpft.
Die Herzfrequenz bleibt weitgehend konstant.
Das Herzzeitvolumen wird nicht verändert; ein infolge erhöhter Nachlast vermindertes Herzzeitvolumen kann ansteigen.
Nach Injektion von Urapidil tritt kein initialer Blutdruckanstieg auf.
Eine Normalisierung des Lungenkapillardruckes wurde beobachtet.
Unter Urapidil bleibt die physiologische Blutdruckregulation erhalten. Daher ist eine Senkung des Blutdrucks in hypotone Bereiche nicht zu befürchten.
Urapidil zeichnet sich durch eine grosse therapeutische Breite aus. Seine Wirkung ist gut steuerbar.
Nach den bisherigen Erkenntnissen liegen keinerlei Hinweise auf einen Ausschluss von Patienten mit verminderter Herzmuskelleistung und eingeschränkter Atemfunktion vor.
Pharmakodynamik
Siehe auch "Wirkungsmechanismus" .
Klinische Wirksamkeit
Klinische Langzeitstudien haben die Eignung von Urapidil als Monotherapeutikum für die Langzeitbehandlung des Bluthochdrucks erwiesen. Nach intravenöser Applikation erfolgt die Reduktion sowohl systolischer als auch diastolischer Blutdruckwerte schnell, aber nicht drastisch. Nach Absetzen der intravenösen Therapie steigt der Blutdruck langsam innerhalb von 2-3 Std. wieder an. Das ist besonders vorteilhaft in der postoperativen Phase nach intraoperativer Blutdrucksenkung von Hochdruckpatienten.
PharmakokinetikAbsorption
Nach intravenöser Gabe wird eine Eliminationshalbwertszeit für Urapidil aus dem Serum von im Mittel 2,5 Std. gemessen. Das Verteilungsvolumen errechnet sich zu 0,59 l/kg, ein mittlerer Clearance-Wert wird zu 0,17 l/Std./kg bestimmt.
Distribution
Siehe auch "Absorption" .
Metabolismus
Im Urin des Menschen findet man ausser der Muttersubstanz (10-15%) den biologisch inaktiven Hauptmetaboliten M1 (= 6-{3-[4-(2-Methoxy-4-hydroxyphenyl)-piperazin-1-yl]-propyl-amino}-1,3 dimethyluracil) zu ca. 30% der verabreichten Dosis, daneben noch geringe Mengen der Metaboliten M2 und M3.
Elimination
Die Ausscheidung von Urapidil erfolgt zu etwa 76% über die Niere, zu ca. 20% über den Stuhl. Die Plasmaeiweissbindung von Urapidil (Humanserum) beträgt in vitro 94%.
Präklinische DatenSicherheitspharmakologie
Präklinische Daten zeigen keine besondere Gefährdung des Menschen aufgrund der durchgeführten Studien zur Sicherheitspharmakologie.
Toxizität bei wiederholter Verabreichung
Wiederholte intravenöse Verabreichungen an Tieren zeigten keine Letalität bis zur höchsten getesteten Dosis (bei der Ratte 300 mg/kg über 7 Tage und 40 mg/kg für 4 Wochen; beim Hund 75 mg/kg über 7 Tage und 50 mg/kg über 4 Wochen). Befunde wie Sedierung, verminderte Motorik, Dyspnoe, erhöhte Herzfrequenz, Blutdruckabfall und muskuläre Hypertonie waren bei den Ratten innerhalb weniger Stunden nach der Verabreichung reversibel und bei Hunden innerhalb 24 Stunden.
Studien zur chronischen Toxizität in denen bei Ratten Dosen von bis zu 266 mg/kg und bei Hunden Dosen von 64 mg/kg über einen Zeitraum von 12 Monaten oral verabreicht wurden, zeigten Befunde wie Sedierung, Verlängerung des Östrogenzyklus, Hypersalivation und Zittern in hohen Dosen.
Mutagenes und tumorerzeugendes Potential
Urapidil zeigte in Untersuchungen an Bakterien (AMES-Test, Host Mediated Assay), an Humanlymphozyten und im Knochenmark-Metaphasetest an der Maus keine mutagenen Eigenschaften. Ein Test auf DNS-Reparatur an Rattenhepatozyten verlief ebenfalls negativ.
Aus Kanzerogenitätsuntersuchungen an Mäusen und Ratten über 18 und 24 Monate haben sich keine für den Menschen relevanten Hinweise auf ein tumorerzeugendes Potential ergeben.
In speziellen Untersuchungen an Ratten und Mäusen zeigte sich, dass Urapidil den Prolaktinspiegel erhöht. Beim Nager führt ein erhöhter Prolaktinspiegel zur Stimulation des Wachstums von Mammagewebe. Aufgrund der Kenntnisse über den Wirkungsmechanismus ist diese Wirkung für den Menschen bei therapeutischer Dosierung nicht zu erwarten und konnte in klinischen Studien nicht nachgewiesen werden.
Reproduktionstoxizität
Urapidil war bei Mäusen, Ratten und Kaninchen nicht teratogen. Darüber hinaus hatte Urapidil keinen Einfluss auf laktierende Ratten oder auf die Nachkommen während der Laktation und später nach der Entwöhnung, gemessen an Überleben, Verhalten, Aussehen, Körpergewicht und Anzeichen der Reifung. Urapidil hat das Potenzial, die Fruchtbarkeit von Männchen und Weibchen zu verringern und embryonal-fötale Sterblichkeit zu induzieren. Eine Verlängerung des Östruszyklus bei weiblichen Ratten und Mäusen wurde in Reproduktionsstudien und Studien zur chronischen Toxizität beobachtet, aber die Relevanz für den Menschen ist nicht bekannt.
Sonstige HinweiseInkompatibilitäten
Urapidil Stragen i.v. soll nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden, da es aufgrund der sauren Eigenschaften der Injektionslösung zur Trübung oder Ausflockung kommen kann.
Haltbarkeit
Das Präparat darf nur bis zu dem auf dem Behälter mit "EXP" bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern und ausser Reichweite von Kindern aufbewahren.
Stabilität nach der Öffnung
Nach der Verdünnung darf die zu injizierende oder zu infundierende Zubereitung nicht aufbewahrt werden. Chemische und physikalische in-use Stabilität wurde für 50 Stunden bei 15-25°C gezeigt.. Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Verdünnung verwendet werden. Falls dies nicht möglich ist, liegen Aufbrauchsfristen und Lagerbedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Std. bei 2 - 8°C betragen, ausser wenn die Verdünnung unter kontrollierten und validierten aseptischen Bedingungen erfolgte.
Weitere Informationen: vgl. Rubrik "Dosierung/Anwendung" .
Zulassungsnummer66012 (Swissmedic).
Packungen5 Ampullen Urapidil Stragen i.v. 25 mg/5 ml Injektionslösung: [B]
5 Ampullen Urapidil Stragen i.v. 50 mg/10 ml Injektionslösung: [B]
ZulassungsinhaberinStragen Pharma SA, 1228 Plan-les-Ouates.
Stand der InformationOktober 2021
| 
