Zusammensetzung
Wirkstoffe
Acidum penteticum (DTPA).
Hilfsstoffe
Stannosi(II) chloridum dihydricum, Acidum gentisicum, Calcii chloridum dihydricum, Acidum hydrochloridum concentratum, Natrii hydroxidum.
Das Lyophilisat des Produktes enthält 4.72 mg Natrium pro Durchstechfläschchen. Nach der Rekonstitution mit 10 ml Natriumpertechnetat-Lösung enthält das Produkt 4.01 mg/ml Natrium.
Reaktionsmechanismus
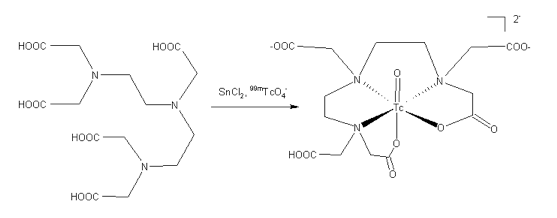
DTPA 99mTc - DTPA
Spezifikationen des markierten Präparates
Sterile, endotoxinfreie, klare bis leicht opaleszente, farblose, wässrige Lösung zur intravenösen Anwendung oder – mit Hilfe eines geeigneten Verneblers – zur Inhalation,
pH: 4,0 - 5,0;
Markierungsausbeute: ≥ 95%.
Darreichungsform und Wirkstoffmenge pro Einheit
Markierungsbesteck zur Herstellung von 99mTechnetium-markiertem DTPA (99mTc-Pentetsäure).
Ein Fläschchen enthält 20,8 mg Pentetsäure (DTPA).
Indikationen/Anwendungsmöglichkeiten
TechneScan DTPA ist ein Radiodiagnostikum, das nach Rekonstitution mit Natriumpertechnetat [99mTc] indiziert ist für die:
-Nierenszintigraphie
-Hirnszintigraphie
-Lungen-Ventilationsszintigraphie nach Herstellung eines zur Inhalation geeigneten Aerosols.
Dosierung/Anwendung
99mTc-DTPA wird als einmalige, intravenöse Injektion oder durch Inhalation mittels eines Aerosolgenerators verabreicht. Mit dem markierten Inhalt eines Fläschchens TechneScan DTPA können mehrere Patienten untersucht werden. Falls besondere Bedingungen es erfordern, kann der gesamte, mit einer geeigneten Aktivität markierte, Inhalt eines Fläschchens auch einem einzelnen Patienten verabreicht werden.
Das Präparat darf dem Patienten nicht unmarkiert verabreicht werden.
Dosierung bei Erwachsenen
-Nierenszintigraphie: 40 - 400 MBq
-Hirnszintigraphie: 200 - 750 MBq
-Lungen-Ventilationsszintigraphie: 50 - 100 MBq in der Lunge deponiert, 500 - 1000 MBq im Aerosolgenerator, abhängig vom Gerät.
Dosierung bei Jugendlichen und Kindern:
Nierenzintigraphie:
Eine Anwendung bei Kindern und Jugendlichen muss sorgfältig überdacht werden und von der klinischen Notwendigkeit sowie dem Risiko-Nutzen-Verhältnis in dieser Patientengruppe abhängig gemacht werden. Die intravenös zu verabreichenden Aktivitäten bei Kindern und Jugendlichen können gemäß den Empfehlungen der „Paediatric Dosage Card“ der EANM (European Association of Nuclear Medicine) von 2016 berechnet werden. Dafür sind die Formeln für die jeweilige Indikation und der relevante Korrekturfaktor für das Körpergewicht des jungen Patienten zu wählen.
Verabreichung von (99mTc)Technetiumpentetat bei eingeschränkter Nierenfunktion:
Verabreichte Aktivität [MBq] = Baseline-Aktivität [MBq] x Multiplikator (bei einer Baseline-Aktivität von 14,0)
Tabelle 1
Körpergewicht Multiplikator Körpergewicht Multiplikator Körpergewicht Multiplikator 3 kg 1 22 kg 5,29 42 kg 9,14 4 kg 1,14 24 kg 5,71 44 kg 9,57 6 kg 1,71 26 kg 6,14 46 kg 10,00 8 kg 2,14 28 kg 6,43 48 kg 10,29 10 kg 2,71 30 kg 6,86 50 kg 10,71 12 kg 3,14 32 kg 7,29 52-54 kg 11,29 14 kg 3,57 34 kg 7,72 56-58 kg 12,00 16 kg 4,00 36 kg 8,00 60-62 kg 12,71 18 kg 4,43 38 kg 8,43 64-66 kg 13,43 20 kg 4,86 40 kg 8,86 68 kg 14,00
Verabreichung von (99mTc)Technetiumpentetat bei normaler Nierenfunktion:
Verabreichte Aktivität [MBq] = Baseline-Aktivität [MBq] x Multiplikator (bei einer Baseline-Aktivität von 34,0)
Tabelle 2
Körpergewicht Multiplikator Körpergewicht Multiplikator Körpergewicht Multiplikator 3 kg 1 22 kg 3,06 42 kg 4,41 4 kg 1,12 24 kg 3,18 44 kg 4,53 6 kg 1,47 26 kg 3,35 46 kg 4,65 8 kg 1,71 28 kg 3,47 48 kg 4,77 10 kg 1,94 30 kg 3,65 50 kg 4,88 12 kg 2,18 32 kg 3,77 52-54 kg 5,00 14 kg 2,35 34 kg 3,88 56-58 kg 5,24 16 kg 2,53 36 kg 4,00 60-62 kg 5,47 18 kg 2,71 38 kg 4,18 64-66 kg 5,65 20 kg 2,88 40 kg 4,29 68 kg 5,77
Bei Kindern bis zum Alter von 1 Jahr ist eine Mindestdosis von 20 MBq erforderlich, um mit 99mTc- DTPA Bilder von ausreichender Qualität zu erhalten.
Lungenzintigraphie:
-Lungen-Ventilationsszintigraphie: 10 MBq in der Lunge deponiert, 500 - 1000 MBq im Aerosolgenerator.
Bilderfassung
-Nierenperfusion: Die Untersuchung erfolgt durch dynamische Bildgebung innerhalb der ersten Minute nach der Injektion. Der optimale Zeitpunkt für die statische Bildgebung ist 1 Stunde nach der Injektion. Bei einer Captopril (ACE-Hemmer)-Renografie wird das Captopril intravenös vor Verabreichung des (99mTc)Technetiumpentetat gegeben. Die Aufnahmen zur Funktion der einzelnen Nieren erfolgen durch dynamische Bildgebung nach der Injektion. Wenn eine oder beide Nieren sich innerhalb der ersten 20 Minuten nicht ausreichend entleert haben, erfolgt eine Furosemid-Belastung. Die dynamische Bildgebung sollte weitere 15 Minuten nach Gabe des Diuretikums fortgesetzt werden. Statische Aufnahmen können 1 Stunde nach der Injektion erfolgen.
-Hirnzintigraphie: Die Untersuchung sollte sofort nach der Injektion mit dynamischen Akquisitionen begonnen werden. Statische Bilder werden 1 Stunde und bei Bedarf mehrere Stunden nach der Injektion aufgenommen.
-Lungen-Ventilationsszintigraphie: Bilder der Lunge werden innerhalb von 180 Minuten aufgenommen. Für die Lungen-Ventilationsszintigraphie ist ein Aerosolgenerator erforderlich, wobei je nach Gerätetyp (jeweilige Gebrauchsanleitung konsultieren) zu dosieren ist.
Wiederholung der Untersuchung
Die Untersuchung mit TechneScan DTPA sollte frühestens 48 Stunden (8 Halbwertszeiten von 99mTc) nach der ersten Verabreichung des Präparates in Erwägung gezogen werden.
Spezielle Dosierungsanweisung
Bei beeinträchtigter Nierenfunktion kann sich die Strahlenbelastung erhöhen, dies sollte bei der Dosierung in Betracht gezogen werden.
Strahlenexposition
(99mTc)Technetium wird mittels eines (99Mo/99mTc)-Generators hergestellt und zerfällt unter Emission von Gammastrahlung mit einer Energie von 140 keV und einer Halbwertszeit von 6,01 Stunden zu (99Tc)Technetium, das aufgrund seiner langen Halbwertzeit von 2,13 x 105 Jahren quasi als stabil angesehen werden kann.
Die in der Tabelle aufgeführten Daten stammen aus ICRP 128 und wurden unter folgenden Annahmen berechnet:
-Intravenöse Injektion von (99mTc)Technetiumpentetat führt zu einer initialen Verteilung in der extrazellulären Flüssigkeit. Nach dieser initialen Verteilung wird die Substanz ausschließlich über die Nieren ausgeschieden. Bei normaler Nierenfunktion lässt sich die Gesamtkörperretention als biexponentielle Funktion mit Halbwertszeiten für die Komponenten von 100 Minuten (0,99) und 7 Tagen (0,01) beschreiben. Der über die Nieren ausgeschiedene Anteil beträgt 1,0 (1,0). Die renale Durchflusszeit beträgt 5 Minuten. Bei eingeschränkter Nierenfunktion wird angenommen, dass die Retentionshalbwertzeit der Hauptkomponente 1000 Minuten beträgt und die renale Durchflusszeit sich auf 20 Minuten erhöht.
Nach ICRP Veröffentlichung Nr. 128 werden die folgenden geschätzten absorbierten Dosen für Patienten mit normaler Nierenfunktion angegeben:
Geschätzte absorbierte Dosis pro Einheit verabreichter Aktivität (mGy/MBq)
Organ Erwachsener 15 Jahre 10 Jahre 5 Jahre 1 Jahr Nebennieren 0,0014 0,0018 0,0027 0,004 0,0072 Knochenoberflächen 0,0024 0,0029 0,0043 0,0061 0,010 Hirn 0,00086 0,0011 0,0017 0,0028 0,0049 Brust 0,00072 0,00092 0,0013 0,0022 0,0041 Gallenblase 0,0015 0,0021 0,0038 0,005 0,0061 Magen-Darm-Trakt Magenwand 0,0013 0,0017 0,0028 0,0040 0,0068 Dünndarmwand 0,0025 0,0031 0,0049 0,0070 0,010 Dickdarmwand 0,0031 0,0039 0,0060 0,0081 0,011 Obere Dickdarmwand 0,0021 0,0028 0,0043 0,0065 0,0092 Untere Dickdarmwand 0,0043 0,0054 0,0082 0,010 0,013 Herzwand 0,0012 0,0015 0,0022 0,0033 0,0059 Nieren 0,0044 0,0053 0,0075 0,011 0,018 Leber 0,0012 0,0016 0,0025 0,0038 0,0064 Lungen 0,001 0,0013 0,002 0,003 0,0055 Muskelgewebe 0,0016 0,002 0,003 0,0043 0,0068 Speiseröhre 0,001 0,0013 0,0019 0,003 0,0054 Ovarien 0,0042 0,0053 0,0077 0,01 0,013 Pankreas 0,0014 0,0018 0,0028 0,0043 0,0074 Blutbildendes Knochenmark 0,0015 0,0018 0,0027 0,0037 0,0057 Haut 0,00087 0,001 0,0017 0,0026 0,0044 Milz 0,0013 0,0016 0,0026 0,0039 0,0068 Hoden 0,0029 0,004 0,0068 0,0094 0,013 Thymus 0,001 0,0013 0,0019 0,0030 0,0054 Schilddrüse 0,001 0,0013 0,0021 0,0033 0,006 Harnblasenwand 0,062 0,078 0,11 0,15 0,17 Uterus 0,0079 0,0096 0,015 0,018 0,022 Sonstige Organe 0,0017 0,0021 0,0030 0,0042 0,0066 Effektive Dosis (mSv/MBq) 0,0049 0,0063 0,0094 0,012 0,016
Die effektive Strahlendosis beträgt bei Verabreichung der empfohlenen Höchstaktivität von 740 MBq für Erwachsene mit einem Körpergewicht von 70 kg etwa 3,6 mSv.
Bei einer verabreichten Aktivität von 740 MBq beträgt die typische Strahlenbelastung des Zielorgans (Nieren) 3,3 mGy und die typische Strahlenbelastung des kritischen Organs (Blasenwand) 46 mGy.
Folgende Werte gelten nach ICRP 128 für Patienten mit eingeschränkter Nierenfunktion:
Geschätzte absorbierte Dosis pro Einheit verabreichter Aktivität (mGy/MBq)
Organ Erwachsener 15 Jahre 10 Jahre 5 Jahre 1 Jahr Nebennieren 0,0041 0,0051 0,0076 0,011 0,021 Knochenoberflächen 0,006 0,0071 0,011 0,015 0,028 Hirn 0,0028 0,0035 0,0057 0,0091 0,016 Brust 0,0023 0,003 0,0042 0,0068 0,013 Gallenblase 0,0042 0,0057 0,0092 0,013 0,016 Magen-Darm-Trakt Magenwand 0,0038 0,005 0,0079 0,011 0,019 Dünndarmwand 0,0045 0,0056 0,0085 0,013 0,022 Dickdarmwand 0,0045 0,0058 0,0087 0,013 0,022 Obere Dickdarmwand 0,0043 0,0056 0,0081 0,013 0,021 Untere Dickdarmwand 0,0049 0,0061 0,0095 0,013 0,023 Herzwand 0,0037 0,0047 0,007 0,01 0,018 Nieren 0,0077 0,0092 0,013 0,019 0,032 Leber 0,0037 0,0046 0,0071 0,011 0,019 Lungen 0,0033 0,0042 0,0062 0,0095 0,017 Muskelgewebe 0,0032 0,004 0,0061 0,0091 0,017 Speiseröhre 0,0033 0,0042 0,0062 0,0096 0,017 Ovarien 0,005 0,0062 0,0092 0,014 0,023 Pankreas 0,0043 0,0053 0,008 0,012 0,021 Blutbildendes Knochenmark 0,0034 0,0042 0,0064 0,0093 0,016 Haut 0,0022 0,0026 0,0042 0,0067 0,012 Milz 0,0038 0,0047 0,0073 0,011 0,019 Hoden 0,0035 0,0045 0,0069 0,01 0,018 Thymus 0,0033 0,0042 0,0062 0,0096 0,017 Schilddrüse 0,0034 0,0042 0,0067 0,011 0,019 Harnblasenwand 0,021 0,027 0,039 0,05 0,066 Uterus 0,0061 0,0074 0,011 0,016 0,025 Sonstige Organe 0,0033 0,0041 0,0063 0,0097 0,017 Effektive Dosis (mSv/MBq) 0,0046 0,0058 0,0087 0,013 0,021
Die physikalische Halbwertzeit von (99mTc) beträgt 6,01 Stunden.
Die Harnblasenwand trägt bis zu 57 % der effektiven Dosis bei.
Die unten aufgeführten Daten stammen aus ICRP 53 und werden unter folgenden Annahmen berechnet:
-Inhalation von Technetium (99mTc) Pentetat:
Das Einatmen von Aerosolen, die aus Partikeln mit einem Durchmesser von weniger als 2-3 Mikrometern bestehen, führt zu Ablagerungen hauptsächlich in den Lungenbläschen.
Partikel werden schnell über den Blutkreislauf aus der Lunge entfernt. Die biologische Halbwertszeit von Technetium (99mTc)pentetat in der Lunge beträgt bei normalen Nichtrauchern 60-80 Minuten; Sie ist bei Rauchern und bei den meisten Patienten mit Lungenerkrankungen verkürzt. Im Folgenden wird ein Wert von 60 min übernommen. Die Substanz, die ins Blut gelangt, wird nach dem Modell für intravenös verabreichtes Technetium (99mTc)-Pentetat eliminiert.
Bei Verabreichung von 99mTc-DTPA als Aerosol gelten nach ICRP 53 folgende Werte:
Geschätzte absorbierte Dosis pro Einheit verabreichter Aktivität (mGy/MBq)
Organ Erwachsener 15 Jahre 10 Jahre 5 Jahre 1 Jahr
Nebennieren 0.0021 0.0029 0.0044 0.0067 0.012
Blasenwand 0.047 0.058 0.084 0.12 0.23
Knochenoberfläche 0.0019 0.0024 0.0035 0.0053 0.0098
Brust 0.0019 0.0019 0.0033 0.0048 0.0078
Magen-Darm-Trakt
Magenwand 0.0017 0.0022 0.0035 0.0051 0.0089
Dünndarmwand 0.0021 0.0026 0.0041 0.0063 0.011
Obere Dickdarmwand 0.0019 0.0024 0.0038 0.0061 0.01
Untere Dickdarmwand 0.0032 0.0042 0.0063 0.0088 0.015
Nieren 0.0041 0.0051 0.0072 0.011 0.019
Leber 0.0019 0.0025 0.0037 0.0055 0.0097
Lunge 0.017 0.026 0.036 0.054 0.1
Ovarien 0.0033 0.0041 0.0061 0.0089 0.015
Pankreas 0.0021 0.0026 0.004 0.0061 0.011
Blutbildendes Knochenmark 0.0027 0.0034 0.0047 0.0062 0.0096
Milz 0.0019 0.0024 0.0036 0.0056 0.0099
Hoden 0.0021 0.0031 0.0052 0.0079 0.015
Schilddrüse 0.00099 0.0017 0.0027 0.0044 0.0078
Uterus 0.0059 0.0072 0.011 0.016 0.027
Sontige Organe 0.0018 0.0022 0.0032 0.0049 0.0086
Effektive Dosis (mSv/MSq)
0.007 0.0091 0.013 0.02 0.036
Kontraindikationen
Nachgewiesene Überempfindlichkeit gegenüber nicht markiertem DTPA, 99mTc-DTPA oder einem anderen Inhaltsstoff des Präparates.
-Schwangerschaft.
-Während des Stillens.
-Intrathekale Anwendung.
Warnhinweise und Vorsichtsmassnahmen
Mögliche Überempfindlichkeits- oder anaphylaktische Reaktionen
Treten Überempfindlichkeits- bzw. anaphylaktische Reaktionen auf, muss die Anwendung des Arzneimittels unterbrochen und bei Bedarf eine intravenöse Behandlung eingeleitet werden. Um im Notfall unverzüglich reagieren zu können, müssen geeignete Arzneimittel und Notfallinstrumente (z. B. Trachealtubus, Beatmungsgerät) bereitstehen.
Individuelle Nutzen-Risiko-Abwägung
Für jeden Patienten muss die Strahlenbelastung durch den möglichen Nutzen gerechtfertigt sein. Die verabreichte Aktivität soll in jedem Fall so niedrig wie möglich sein, um das erwünschte diagnostische Resultat zu erhalten.
Nieren-/Leberfunktionsstörungen
Die zu verabreichende Aktivität muss sorgfältig überdacht werden, da bei dieser Patientengruppe eine erhöhte Strahlenexposition möglich ist.
Kinder und Jugendliche
Informationen über Einsatz bei den Kindern und Jugendlichen siehe Abschnitt „Dosierung/Anwendung“.
Die Indikation muss besonders streng gestellt werden, da die effektive Dosis pro MBq höher ist als bei Erwachsenen (siehe „Strahlenexposition“).
Vorbereitung des Patienten
Vor der Untersuchung ist auf ausreichende Hydration des Patienten zu achten. Um die Strahlenexposition möglichst niedrig zu halten, müssen die Patienten aufgefordert werden, während der ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren.
Besondere Warnhinweise
Die Technescan DTPA-Injektionslösung darf nicht in den subarachnoidalen Raum injiziert werden und ist nicht für die Szintigrafie des Flusses der Rückenmarksflüssigkeit geeignet.
Abhängig von der Zeit, zu der Sie die Injektion verabreichen, kann der Natriumgehalt, der dem Patienten verabreicht wird, in einigen Fällen über 1 mmol liegen. Dies sollte bei Patienten mit natriumarmer Diät berücksichtigt werden.
Interaktionen
Nierenzintigraphie
In einige Fällen wird während pharmakologischer Tests die einmalige Gabe eines Diuretikums oder eines ACE-Hemmers genutzt, um eine Differenzialdiagnose von nephrologischen und urologischen Störungen zu ermöglichen.
-ACE-Hemmer verringern die Durchblutung der Niere.
-Diclofenac, Furosemid und andere Diuretika wie Hydrochlorothiazid können die Nierensekretion und damit die Clearance des (99mTc)Technetiumpentetats beeinflussen.
-Nephrotoxische Arzneimittel wie Aminoglykoside, Cisplatin und verabreichte Kontrastmittel können die renale Ausscheidung verringern und dadurch die (99mTc)Technetiumpentetat-Clearance beeinflussen.
Hirnszintigraphie
Psychotrope Arzneimittel erhöhen die Blutzufuhr im Gebiet der A. carotis externa. Dies kann zu schneller Aufnahme von 99mTc-DTPA im Nasopharynx führen.
Zur Sicherstellung der bestmöglichen Aussagekraft der Szintigramme sollten diese oder andere Substanzen weder während einer Untersuchung mit TechneScan DTPA noch im kürzeren zeitlichen Abstand verabreicht werden, es sei denn, das Untersuchungsziel erfordere ein solches Vorgehen. In jedem Fall muss bei der Auswertung der Szintigramme die Medikation des Patienten zum Zeitpunkt der Untersuchung berücksichtigt werden.
Schwangerschaft, Stillzeit
Frauen im gebärfähigen Alter
Falls beabsichtigt ist, bei einer Frau im gebärfähigen Alter ein radioaktives Arzneimittel anzuwenden, muss unbedingt festgestellt werden, ob eine Schwangerschaft vorliegt. Solange nicht das Gegenteil nachgewiesen wurde, muss grundsätzlich von einer Schwangerschaft ausgegangen werden, wenn eine Regelblutung ausgeblieben ist. Im Zweifelsfall (Ausbleiben der Regelblutung, sehr unregelmäßige Periode etc.) sind der Patientin alternative Untersuchungsmethoden, bei denen keine ionisierenden Strahlen angewandt werden, anzubieten (sofern solche Methoden verfügbar sind).
Schwangerschaft
Untersuchungen mit Radionukliden an Schwangeren führen auch zur Bestrahlung des Fötus. Daher dürfen während der Schwangerschaft nur wesentliche Untersuchungen durchgeführt werden, bei denen der erwartete Nutzen das Risiko für Mutter und Fötus bei weitem überwiegt.
Stillzeit
Vor Anwendung eines Radiopharmakons in der Stillzeit sollte erwogen werden, ob die Anwendung des Radionuklids bis nach dem Abstillen verschoben werden kann; bei der Wahl des am besten geeigneten Radiopharmakons sollte dabei auch die Ausscheidung von Radioaktivität in die Muttermilch berücksichtigt werden. Wird die Anwendung als erforderlich angesehen, muss das Stillen für mindestens 12 Stunden unterbrochen und die in dieser Zeit abgepumpte Milch verworfen werden.
Fertilität
Es wurden keine Studien zur Fertilität durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
(99mTc)Technetiumpentetat hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Unerwünschte Wirkungen
Die in der folgenden Tabelle aufgeführten Nebenwirkungen sind nach Systemorganklassen zusammengefasst. Ihre Häufigkeit ist nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Systemorganklasse Symptom Häufigkeit Erkrankungen des Nervensystems Schwindelgefühl Nicht bekannt Erkrankungen der Atemwege, des Brustraums und Mediastinums Dyspnoe Nicht bekannt Erkrankungen der Haut und des Unterhautzellgewebes Urtikaria, Pruritus Nicht bekannt Gefäßerkrankungen Hypotonie, Flush Nicht bekannt
Ionisierende Strahlen können Krebs und Erbgutveränderungen erzeugen. Da die effektive Dosis 3,6 mSv beträgt, wenn die maximal empfohlene Aktivität von 740 MBq verabreicht wird, sind diese Effekte mit geringer Wahrscheinlichkeit zu erwarten.
In seltenen Fällen, insbesondere bei Patienten mit Aspirinallergie, wurden anaphylaktische Reaktionen beobachtet auf Grund des in TechneScan DTPA enthaltenen Konservierungsmittels Gentisinsäure (Dihydroxybenzoesäure). Solche Reaktionen können mit Antihistaminika oder parenteral verabreichten Steroiden zum Abklingen gebracht werden.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei vorschriftsmässiger Anwendung ist nicht mit einer Überdosierung zu rechnen. Im Falle einer unbeabsichtigten Überdosierung von 99mTc-DTPA geht die damit verbundene erhöhte Strahlenbelastung wegen der kurzen Halbwertszeit von 99mTc (6,02 Stunden) rasch zurück. Die Elimination sollte, wenn möglich, durch forcierte Diurese und häufiges Leeren der Blase beschleunigt werden.
Eigenschaften/Wirkungen
ATC-Code
V09CA01
Wirkungsmechanismus
-Wie Inulin zirkuliert auch (99mTc)Technetiumpentetat im Blutkreislauf mit vernachlässigbarer Bindung an Plasmaproteine. Es wird durch die glomeruläre Membran gefiltert und erfährt keine tubuläre Sekretion oder Reabsorption. Es überschreitet nicht die normale Blut-Hirn-Schranke (BHS).
-Technetium(99mTc)pentetat wird aus einer wässrigen Lösung mit einer Partikelgröße von 1,2-2 Mikrometern aerosolisiert. Nach der Inhalation werden Aerosoltröpfchen in Abhängigkeit von ihren aerodynamischen Eigenschaften, insbesondere ihrem mittleren aerodynamischen Durchmesser, in den Atemwegen und Alveolen verteilt und abgelagert.
Pharmakodynamik
Von 99mTc-DTPA sind in den für die Szintigraphie empfohlenen Aktivitäten und den dabei verabreichten Substanzmengen keine pharmakodynamischen Wirkungen zu erwarten.
Klinische Wirksamkeit
Die für diagnostische Untersuchungen wichtigen Eigenschaften von 99mTc-DTPA beruhen auf seiner verzögerten Ausscheidung bei Nierenfunktionsstörungen, seiner Anreicherung in intrakraniellen Läsionen und – nach inhalativer Verabreichung – seinem Verteilungsmuster in der Lunge.
Pharmakokinetik
Nach intravenöser Injektion verteilt sich 99mTc- DTPA rasch im extrazellulären Flüssigkeitsraum und wird schnell durch glomeruläre Filtration aus dem Körper ausgeschieden.
Das Chelat wird kaum oder nur wenig durch das Nieren-Parenchym gebunden. Serumproteine binden 99mTc-DTPA bei einer einmaligen Injektion bis zu ca. 4% und bei Dauerinfusion bis zu ca. 10%. Obwohl das Chelat nützliche Hinweise über die glomeruläre Filtrationsrate gibt, führt dieser plasmagebundene Anteil zu niedrigeren glomerulären Filtrationswerten als beispielsweise auf Grund der Inulin-Clearance zu erwarten ist.
Da 99mTc-DTPA durch glomeruläre Filtration ausgeschieden wird, stellen die Szintigramme in den ersten Minuten nach Injektion das Gefässystem der Nieren dar. Später durchgeführte Aufnahmen zeigen die Aktivität im Urin sowohl der Sammelkanälchen als auch des Nierenbeckens.
99mTc-DTPA reichert sich in intrakranialen Läsionen jedoch nicht im Plexus choroidei an.
Nach Inhalation diffundiert 99mTc-DTPA rasch mit einer biologischen Halbwertszeit von etwa 60 Minuten über die alveolären Membranen ins Blut, wo es sich weiter wie oben beschrieben nach i.v. Injektion verhält und rasch über die Nieren ausgeschieden wird.
Absorption
Siehe "Pharmakokinetik" .
Distribution
Siehe "Pharmakokinetik" .
Metabolismus
Keine Angaben
Elimination
Siehe "Pharmakokinetik" .
Kinetik spezieller Patientengruppen
Bei Nierenerkrankungen kann sich die Plasmaclearance von 99mTc-DTPA verlängern. Bei intrakraniellen Läsionen mit erhöhter Neovaskularisation oder veränderter Permeabilität der Blut-Hirn-Schranke ist die Anreicherung von 99mTc-DTPA erhöht.
Bei Ventilationsstörungen werden minder- oder unbelüftete Lungenpartien als aktivitätsverminderte oder –freie Zonen dargestellt.
Präklinische Daten
Tierversuche mit unmarkierter Pentetsäure (DTPA) zeigten bei Dosen zwischen 5 - 50 mg/kg i.v. keine Zeichen akuter Toxizität. Auch die Autopsiebefunde 14 Tage nach mehrfacher Applikation waren negativ. Die maximale Patientendosis liegt bei 20,8 mg Pentetsäure (0,30 mg/kg) und damit um mindestens 2 Grössenordnungen unter den in den präklinischen Studien verwendeten Dosen. Daten zum mutagenen, karzinogenen und reproduktionstoxischen Potential von 99mTc-DTPA sind bisher nicht verfügbar, die potentiellen Gefahren der ionisierenden Strahlung sind jedoch bekannt.
Das Präparat ist nicht für eine häufig wiederholte oder regelmässige Verwendung bestimmt.
Sonstige Hinweise
Inkompatibilitäten
Es sind keine Inkompatibilitäten bekannt. Es wird dennoch empfohlen, 99mTc-DTPA nicht gleichzeitig mit anderen Medikamenten zu verabreichen.
Beeinflussung diagnostischer Methoden
Keine Angaben.
Haltbarkeit
Haltbarkeit des unmarkierten TechneScan DTPA
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit des markierten Präparates
Das markierte Präparat ist haltbar bis 8 Stunden nach Markierung im Originalfläschchen – danach ist die Präparation nicht mehr verwendbar.
Besondere Lagerungshinweise
Lagerung des unmarkierten TechneScan DTPA
Das unmarkierte TechneScan DTPA muss lichtgeschützt nicht über 25 °C gelagert werden.
Lagerung des markierten Präparates
Das markierte Präparat ist in einem Bleibehälter geeigneter Stärke nicht über 25 °C zu lagern. Nicht einfrieren.
Hinweise für die Handhabung
Der Inhalt eines Fläschchens TechneScan DTPA wird mit Natrium-[99mTc]-Pertechnetat zu 99mTc-markiertem Diethylentriaminpentaacetet (99mTc-DTPA), dem eigentlichen diagnostischen Agens rekonstituiert. Die Markierung muss von fachkundigem Personal unter streng aseptischen Bedingungen, Ausschluss von Luft und Beachtung der Strahlenschutzvorschriften (Arbeiten im Bleibehälter bzw. hinter einer Bleiwand) durchgeführt werden.
Markierung
1.Die flip-off Verschlusskappe des Fläschchens TechneScan DTPA entfernen, den Gummistopfen mit Alkohol desinfizieren und das Fläschchen in einen Bleibehälter stellen.
2.Entsprechend der vorgesehenen Anzahl Untersuchungen in das Fläschchen mit einer sterilen, strahlengeschützten Spritze 110 MBq - 10 GBq Natrium-[99mTc]-Pertechnetat in einem Volumen von 2 - 10 ml ohne Luftblase und ohne Verwendung einer Belüftungskanüle hinzufügen. Anschliessend mit derselben Spritze durch Zurückziehen des gleichen Gasvolumens den Überdruck im Fläschchen ausgleichen.
3.Das im Bleibehälter befindliche Fläschchen mit einem Bleideckel zudecken und durch mehrmaliges Kippen oder durch leichtes Schwenken auf einer Rollvorrichtung die Trockensubstanz vollständig in Lösung bringen.
4.Das Fläschchen noch 15 - 30 Minuten bei Raumtemperatur stehen lassen. Nach dieser Reaktionszeit ist die Markierung abgeschlossen und die Lösung zur i.v. Applikation oder – mit Hilfe eines geeigneten Verneblers – zur Verabreichung als Aerosol geeignet.
5.Die Radioaktivität des markierten Präparates in einem geeigneten Aktivimeter messen. Gesamtaktivität, Volumen, Konzentration, Messzeit und Datum auf dem beigelegten Warn-/Protokolletikett vermerken und damit das Präparat kennzeichnen.
Das markierte Produkt muss innerhalb von 8 Stunden verwendet werden. Bis dahin kann es – unter Beachtung der Strahlenschutzvorschriften – unter 25 °C aufbewahrt werden. Nicht einfrieren.
Vor der Verabreichung muss die Markierungsausbeute bestimmt werden.
Anmerkungen zur Markierung
Zur Markierung dürfen nur 99mTc-Pertechnetat-Eluate aus Generatoren verwendet werden, die in der Schweiz registriert und zum Vertrieb zugelassen sind. Die Qualität der Eluate muss den Anforderungen der gültigen Ph. Eur. entsprechen, die Eluate müssen insbesondere frei von Oxidantien sein, und sie sollten weniger als 5ppm Aluminium enthalten. Zur Sicherstellung der erforderlichen Markierungsausbeute von mindestens 95% sollten Eluate nicht später als 6 Stunden nach Elution verwendet werden.
Bei zu hoher Aktivität der 99mTc-DTPA-Lösung kann diese mit physiologischer Natriumchloridlösung verdünnt werden. Diese muss steril und endotoxinfrei sein, sie darf keine Bakteriostatika oder Konservierungsmittel enthalten, und sie sollte aus Glasbehältern (Glasampullen), nicht aus Plastikbehältnissen entnommen werden.
Qualitätskontrolle
Die Markierungsausbeute sowie die radiochemische Reinheit werden radiochromatographisch bestimmt. Es werden dazu zwei Dünnschichtchromatographien (A und B) durchgeführt. Die erste Chromatographie dient zum Nachweis der Verunreinigung durch freies Pertechnetat, die zweite zum Nachweis der Verunreinigung durch reduziertes, hydrolysiertes Technetium.
Aus den beiden Chromatographien kann die Summe der Verunreinigungen ermittelt werden und die Markierungsausbeute und die radiochemische Reinheit des markierten Präparates bestimmt werden.
A: Nachweis des freien Pertechnetats (99mTcO4¯) mittels Dünnschichtchromatographie:
Benötigtes Material
Chromatographiekammer
Silicagel auf Glasfiber – Gelman ITLC-SG
Methylethylketon
1 ml Spritze mit Kanüle
Durchführung der Chromatographie
Laufrichtung: aufsteigend Laufzeit: etwa 5 min
Freies Pertechnetat (99mTcO4