Zusammensetzung
Wirkstoffe
Atorvastatin als Atorvastatin-Calcium-Trihydrat, Perindopril Arginin, Amlodipin als Amlodipinbesilat.
Hilfsstoffe
Triveram 10 mg / 5 mg / 5 mg
Tablettenkern: Calciumcarbonat (E170), Lactose Monohydrat 27.46 mg), Hydroxypropylcellulose (E463), Carboxymethylstärke-Natrium (entspricht einer Natriummenge zwischen 0,25 und 0,38 mg), mikrokristalline Cellulose (E460), Maltodextrin, Magnesiumstearat (E470b).
Filmüberzug: Glycerin (E422), Hypromellose, Macrogol 6000, Magnesiumstearat (E470b), Titandioxid (E171), Eisenoxid gelb (E172).
Triveram 20 mg / 5 mg / 5 mg
Tablettenkern: Calciumcarbonat (E170), Lactose Monohydrat 54,92 mg), Hydroxypropylcellulose (E463), Carboxymethylstärke-Natrium (entspricht einer Natriummenge zwischen 0,5 und 0,75 mg), mikrokristalline Cellulose (E460), Maltodextrin, Magnesiumstearat (E470b).
Filmüberzug: Glycerin (E422), Hypromellose, Macrogol 6000, Magnesiumstearat (E470b), Titandioxid (E171), Eisenoxid gelb (E172).
Triveram 20 mg / 10 mg / 5 mg
Tablettenkern: Calciumcarbonat (E170), Lactose Monohydrat 54,92 mg), Hydroxypropylcellulose (E463), Carboxymethylstärke-Natrium (entspricht einer Natriummenge zwischen 0,5 und 0,75 mg), mikrokristalline Cellulose (E460), Maltodextrin, Magnesiumstearat (E470b).
Filmüberzug: Glycerin (E422), Hypromellose, Macrogol 6000, Magnesiumstearat (E470b), Titandioxid (E171), Eisenoxid gelb (E172).
Triveram 20 mg / 10 mg / 10 mg
Tablettenkern: Calciumcarbonat (E170), Lactose Monohydrat 54,92 mg), Hydroxypropylcellulose (E463), Carboxymethylstärke-Natrium (entspricht einer Natriummenge zwischen 0,5 und 0,75 mg), mikrokristalline Cellulose (E460), Maltodextrin, Magnesiumstearat (E470b).
Filmüberzug: Glycerin (E422), Hypromellose, Macrogol 6000, Magnesiumstearat (E470b), Titandioxid (E171), Eisenoxid gelb (E172).
Triveram 40 mg / 10 mg / 10 mg
Tablettenkern: Calciumcarbonat (E170), Lactose Monohydrat 109,84 mg), Hydroxypropylcellulose (E463), Carboxymethylstärke-Natrium (entspricht einer Natriummenge zwischen 0,5 und 0,75 mg), mikrokristalline Cellulose (E460), Maltodextrin, Magnesiumstearat (E470b).
Filmüberzug: Glycerin (E422), Hypromellose, Macrogol 6000, Magnesiumstearat (E470b), Titandioxid (E171), Eisenoxid gelb (E172).
Darreichungsform und Wirkstoffmenge pro Einheit
Filmtablette zu 10 mg/5 mg/5 mg:
10 mg Atorvastatin (als 10,82 mg Atorvastatin-Calcium-Trihydrat), 5 mg Perindopril Arginin (entsprechend 3,395 mg Perindopril) und 5 mg Amlodipin (als 6,935 mg Amlodipinbesilat). Gelbe, runde Filmtablette von 7 mm Durchmesser, mit einem Krümmungsradius von 25 mm, mit der Prägung "

" auf einer Seite und "

" auf der anderen Seite.
Filmtablette zu 20 mg/5 mg/5 mg:
20 mg Atorvastatin (als 21,64 mg Atorvastatin-Calcium-Trihydrat), 5 mg Perindopril Arginin (entsprechend 3,395 mg Perindopril) und 5 mg Amlodipin (als 6,935 mg Amlodipinbesilat). Gelbe, runde Filmtablette von 8,8 mm Durchmesser, mit einem Krümmungsradius von 32 mm, mit der Prägung "
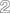
" auf einer Seite und "

" auf der anderen Seite.
Filmtablette zu 20 mg/10 mg/5 mg:
20 mg Atorvastatin (als 21,64 mg Atorvastatin-Calcium-Trihydrat), 10 mg Perindopril Arginin (entsprechend 6,790 mg Perindopril) und 5 mg Amlodipin (als 6,935 mg Amlodipinbesilat). Gelbe, quadratische Filmtablette von 9 mm Seitenlänge, mit einem Krümmungsradius von 16 mm, mit der Prägung "

" auf einer Seite und "

" auf der anderen Seite.
Filmtablette zu 20 mg/10 mg/10 mg:
20 mg Atorvastatin (als 21,64 mg Atorvastatin-Calcium-Trihydrat), 10 mg Perindopril Arginin (entsprechend 6,790 mg Perindopril) und 10 mg Amlodipin (als 13,870 mg Amlodipinbesilat). Gelbe, oblonge Filmtablette mit einer Länge von 12,7 mm und einer Breite von 6,35 mm, mit der Prägung "
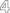
" auf einer Seite und "

" auf der anderen Seite.
Filmtablette zu 40 mg/10 mg/10 mg:
40 mg Atorvastatin (als 43,28 mg Atorvastatin-Calcium-Trihydrat), 10 mg Perindopril Arginin (entsprechend 6,790 mg Perindopril) und 10 mg Amlodipin (als 13,870 mg Amlodipinbesilat). Gelbe, oblonge Filmtablette mit einem Gesamtgewicht von 600 mg, einer Länge von 16 mm und einer Breite von 8 mm, mit der Prägung "

" auf einer Seite und "

" auf der anderen Seite.
Indikationen/Anwendungsmöglichkeiten
Triveram ist indiziert zur Behandlung der essentiellen arteriellen Hypertonie und/oder der stabilen koronaren Herzkrankheit, die mit einer primären Hypercholesterinämie oder einer gemischten Hyperlipidämie assoziiert sind, als Substitutionstherapie bei erwachsenen Patienten, die mit gleichzeitig eingenommenem Perindopril, Amlodipin und Atorvastatin in gleichen Dosierungen als eigenständige Produkte bereits korrekt eingestellt sind.
Dosierung/Anwendung
Übliche Dosierung
Die übliche Dosierung ist eine Tablette täglich, vorzugsweise am Morgen vor einer Mahlzeit. Die Tablette soll zusammen mit Wasser ganz geschluckt und nicht zerkaut werden.
Die Fixkombination ist nicht zur Initialbehandlung geeignet.
Wenn eine Dosisänderung notwendig ist, sollte die Dosisanpassung mit jeder einzeln eingenommenen Komponente durchgeführt werden.
Kombinationstherapie:
Bei Patienten, die Tipranavir, Ritonavir oder Ciclosporin gleichzeitig mit Triveram einnehmen, darf die Dosis von Atorvastatin in Triveram 10 mg/Tag nicht überschreiten (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Interaktionen" ).
Bei Patienten, die gleichzeitig mit der Behandlung mit Triveram auch antivirale Medikamente gegen Hepatitis C mit Elbasvir/Grazoprevir oder Letermovir zur Prophylaxe einer Cytomegalovirus-Infektion nehmen, darf die Dosis von Atorvastatin in Triveram 20 mg/Tag nicht überschreiten (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Interaktionen" ).
Die Anwendung von Triveram wird nicht empfohlen bei Patienten, die Letermovir in Kombination mit Ciclosporin erhalten.
Patienten mit Leberfunktionsstörungen (siehe "Kontraindikationen" , "Warnhinweise und Vorsichtsmassnahmen" und "Pharmakokinetik" )
Bei Patienten, die an einer Leberinsuffizienz leiden, muss Triveram mit Vorsicht angewendet werden. Im Falle einer aktiven Lebererkrankung ist die Behandlung mit Triveram kontraindiziert.
Patienten mit Nierenfunktionsstörungen
Patienten mit Niereninsuffizienz (siehe "Kontraindikationen" und "Warnhinweise und Vorsichtsmassnahmen" ):
Bei schwerer Niereninsuffizienz (Kreatinin-Clearance unter 30 ml/min) ist die Behandlung mit Triveram kontraindiziert.
Triveram kann bei Patienten mit einer Kreatinin-Clearance ≥60 ml/min angewendet werden, wird aber nicht empfohlen bei Patienten mit einer Kreatinin-Clearance zwischen 30 und 60 ml/min. Bei diesen Patienten wird eine individuelle Dosisanpassung mit den Einzelkomponenten empfohlen.
Ältere Patienten (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Pharmakokinetik" )
Ältere Patienten können entsprechend ihrer Nierenfunktion mit Triveram behandelt werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Triveram bei Kindern und Jugendlichen ist nicht erwiesen. Es liegen keine Daten vor. Von der Anwendung bei Kindern und Jugendlichen wird deshalb abgeraten.
Kontraindikationen
-Überempfindlichkeit gegen die Wirkstoffe oder andere ACE-Hemmer, gegen Dihydropyridin-Derivate, Statine oder einen der unter "Zusammensetzung" genannten Hilfsstoffe.
-Schwere Niereninsuffizienz (Kreatinin-Clearance unter 30 ml/min).
-Aktive Lebererkrankung oder dauerhafte unklare Erhöhung von Serum-Transaminasen auf mehr als das 3-Fache des oberen Normalwertes.
-Während Schwangerschaft und Stillzeit und bei Frauen im gebärfähigen Alter, die keine wirksame Methode zur Empfängnisverhütung anwenden (siehe "Schwangerschaft/Stillzeit" ).
-Gleichzeitige Anwendung von antiviralen Medikamenten gegen Hepatitis C, Glecaprevir/Pibrentasvir.
-Schwere Hypotonie.
-Schock (einschliesslich kardiogener Schock).
-Obstruktion des linksventrikulären Ausflusstrakts (zum Beispiel hochgradige Aortenstenose).
-Hämodynamisch instabile Herzinsuffizienz nach einem akuten Myokardinfarkt.
-Angioödem (Quincke-Ödem) in der Anamnese im Zusammenhang mit der Gabe eines ACE-Hemmers.
-Hereditäres oder idiopathisches Angioödem.
-Gleichzeitige Anwendung von Aliskiren-haltigen Arzneimitteln bei Patienten, die an Diabetes mellitus oder Niereninsuffizienz (GFR < 60 ml/min/1,73 m2) leiden (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Interaktionen" ).
-Die gleichzeitige Anwendung von ACE-Hemmern - darunter Triveram - und Neprilysin-Inhibitoren (z.B. die Kombination Sacubitril/Valsartan oder Racecadotril) ist wegen eines erhöhten Risikos für Angioödem kontraindiziert (siehe "Warnhinweise und Vorsichtsmassnahmen" und "Interaktionen" ). Eine Behandlung mit Perindopril sollte nicht innerhalb von 36 Stunden nach der letzten Dosis von Sacubitril/Valsartan begonnen werden.
-Behandlung mittels extrakorporellem Kreislauf, der einen Kontakt des Blutes mit negativ geladenen Oberflächen mit sich bringt (siehe "Interaktionen" ).
-Beidseitige relevante Stenose der Nierenarterie oder Stenose der Nierenarterie einer einzigen funktionsfähigen Niere (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Warnhinweise und Vorsichtsmassnahmen
Die speziellen Warnhinweise und Vorsichtsmassnahmen bei der Anwendung im Zusammenhang mit Atorvastatin, Perindopril und Amlodipin gelten auch für Triveram.
Leberinsuffizienz
Aufgrund des in Triveram enthaltenen Atorvastatins müssen regelmässig Leberfunktionstests vorgenommen werden. Leberfunktionstests müssen durchgeführt werden, falls Anzeichen oder Symptome auftreten, die auf eine Leberfunktionsstörung hindeuten. Patienten, bei denen ein Anstieg der Transaminasen-Werte auftritt, müssen bis zum Verschwinden dieser Abweichung(en) überwacht werden. Falls eine Erhöhung der Transaminasen-Werte auf mehr als das 3-Fache des oberen Normalwertes (>3x ULN, Upper Limit of Normal) fortdauert, empfiehlt sich eine Reduktion der Atorvastatin-Dosis unter Verwendung der Einzelkomponenten oder das Absetzen von Atorvastatin (siehe "Unerwünschte Wirkungen" ).
Selten wurden ACE-Hemmer mit einem Syndrom in Zusammenhang gebracht, das mit cholestatischem Ikterus beginnt und zu fulminanter nekrotisierender Hepatitis und (manchmal) zum Tod führen kann. Der Mechanismus dieses Syndroms ist nicht bekannt. Patienten, die unter Einnahme von Triveram einen Ikterus oder eine deutliche Erhöhung der Leberenzym-Werte entwickeln, müssen die Triveram-Behandlung abbrechen und eine geeignete medizinische Überwachung erhalten (siehe "Unerwünschte Wirkungen" ).
Die Halbwertszeit von Amlodipin ist bei Patienten mit Leberfunktionsstörungen verlängert und die AUC-Werte (Fläche unter der Konzentrations-Zeit-Kurve) sind höher; Dosisempfehlungen liegen nicht vor. Eine strikte Überwachung kann erforderlich sein bei Patienten, die mit Triveram behandelt werden und an schwerer Leberinsuffizienz leiden.
In Anbetracht der Wirkungen von Atorvastatin, Amlodipin und Perindopril ist Triveram kontraindiziert bei Patienten mit aktiver Lebererkrankung oder mit dauerhafter unklarer Erhöhung der Serum-Transaminasen-Werte auf mehr als das 3-Fache des oberen Normalwerts. Triveram muss mit Vorsicht angewendet werden bei Patienten, die an einer Leberinsuffizienz leiden und bei jenen, die beträchtliche Mengen Alkohol konsumieren und/oder eine Lebererkrankung in der Anamnese aufweisen. Wenn eine Dosisänderung notwendig ist, muss die Dosisanpassung mit den Einzelkomponenten durchgeführt werden.
Einfluss auf die Skelettmuskulatur
Wie andere HMG-CoA-Reduktase-Hemmer kann Atorvastatin in seltenen Fällen Auswirkungen auf die Skelettmuskulatur haben und Myalgien, Myositiden oder Myopathien hervorrufen. Daraus kann sich eine Rhabdomyolyse entwickeln, eine möglicherweise lebensbedrohliche Erkrankung, die charakterisiert ist durch eine deutliche Erhöhung der Creatinphosphokinase (CPK)-Spiegel (>10x ULN), eine Myoglobinämie und eine Myoglobinurie, die zu Niereninsuffizienz führen kann.
Kreatinkinase-Bestimmung:
Der Creatinphosphokinase (CPK)-Spiegel sollte nicht nach schweren körperlichen Anstrengungen oder bei Vorliegen anderer möglicher Ursachen eines CPK-Anstieges gemessen werden, da in diesen Fällen die Interpretation der Messwerte verfälscht werden könnte. Falls die CPK-Werte anfänglich wesentlich erhöht sind (>5x ULN), müssen zur Bestätigung der Resultate innerhalb von 5 bis 7 Tagen erneute Messungen durchgeführt werden.
Vor Behandlungsbeginn:
Atorvastatin muss mit Vorsicht verschrieben werden bei Patienten, bei denen prädisponierende Faktoren für eine Rhabdomyolyse vorliegen.
Vor dem Beginn einer Behandlung mit einem Statin muss in folgenden Situationen der CPK-Spiegel gemessen werden:
-Niereninsuffizienz;
-Hypothyreose;
erbliche Muskelerkrankungen in der Eigen- oder Familienanamnese;
muskulär-toxische Komplikationen im Zusammenhang mit der Gabe eines Statins oder Fibrates in der Anamnese;
-Lebererkrankungen in der Anamnese und/oder übermässiger Alkoholkonsum;
bei älteren Patienten (>70 Jahre). Bei diesen sollte die Notwendigkeit einer solchen Messung erwogen werden, wenn weitere prädisponierende Faktoren für eine Rhabdomyolyse vorliegen.
-Situationen, in denen eine Erhöhung der Plasmakonzentration vorkommen kann, aufgrund von Interaktionen (siehe "Interaktionen" ) und aufgrund der Anwendung in speziellen Populationen einschliesslich genetischer Polymorphismen (siehe "Pharmakokinetik" ).
In solchen Situationen werden eine regelmässige Nutzen-Risiko-Neubewertung der Behandlung sowie eine regelmässige klinische Überwachung empfohlen. Wenn der Ausgangswert des CPK-Spiegels bedeutend (>5x ULN) erhöht ist, darf die Behandlung nicht begonnen werden.
Während der Behandlung:
-Die Patienten müssen angewiesen werden, muskuläre Schmerzen, Krämpfe oder Schwächen unverzüglich zu melden, besonders wenn diese von Unwohlsein oder Fieber begleitet sind.
-Wenn solche Symptome auftreten, während ein Patient unter Behandlung mit Triveram steht, muss der CPK-Spiegel gemessen werden. Wenn dieser signifikant erhöht ist (>5x ULN), muss die Behandlung abgebrochen werden.
-Wenn die muskulären Symptome schwer sind und zu täglichen Beschwerden führen, muss der Abbruch der Behandlung erwogen werden, auch wenn der CPK-Wert gleich oder geringer ist als das 5-Fache der ULN.
-Wenn die Symptome verschwinden und sich der CPK-Spiegel normalisiert, kann die Wiederaufnahme von Atorvastatin oder die Einführung eines anderen Statins in der niedrigsten Dosierung und unter engmaschiger Überwachung erwogen werden.
-Triveram muss sofort abgesetzt werden, wenn klinisch bedeutsam erhöhte CPK-Werte (>10x ULN) festgestellt werden oder eine Rhabdomyolyse diagnostiziert oder vermutet wird.
Gleichzeitige Anwendung von anderen Arzneimitteln
Aufgrund des enthaltenen Atorvastatins ist das Risiko einer Rhabdomyolyse erhöht, wenn Triveram gleichzeitig mit bestimmten Arzneimitteln verabreicht wird, die die Plasmakonzentration von Atorvastatin erhöhen können, wie starke Inhibitoren von CYP3A4 oder von Transportproteinen (z.B. Ciclosporin, Telithromycin, Clarithromycin, Delavirdin, Stiripentol, Ketoconazol, Voriconazol, Itraconazol, Posaconazol, Letermovir und HIV-Protease-Inhibitoren, einschliesslich Ritonavir, Lopinavir, Atazanavir, Indinavir, Darunavir, Tipranavir/Ritonavir usw.). Das Risiko einer Myopathie kann ebenfalls erhöht sein bei gleichzeitiger Anwendung von Gemfibrozil oder anderen Fibrinsäure-Derivaten, antiviralen Medikamenten gegen Hepatitis C (Elbasvir/Grazoprevir, Ledipasvir/Sofosbuvir), Erythromycin, Niacin oder Ezetimib. Mögliche Arzneimittelinteraktionen sollten vor und während der Behandlung mit antiviralen Medikamenten, die bei der Behandlung von Hepatitis C (HCV) eingesetzt werden, in Betracht gezogen werden und können zu einem Absetzen oder einer Dosisreduktion von Atorvastatin führen (siehe Abschnitt "Interaktionen" ). Soweit möglich sind anstelle dieser Arzneimittel andere Behandlungsmöglichkeiten (die keine Interferenz verursachen) in Betracht zu ziehen.
Während oder nach der Behandlung mit bestimmten Statinen wurde über sehr seltene Fälle von autoimmun-vermittelter nekrotisierender Myopathie (immune-mediated necrotizing myopathy, IMNM) berichtet. Eine IMNM ist klinisch charakterisiert durch eine persistierende proximale Muskelschwäche und eine Erhöhung der Serum-Kreatinkinase-Werte, die trotz Absetzen des Statins persistieren, positive anti-HMG-CoA-Reduktase-Antikörper und Besserung durch Gabe von Immunsuppressiva.
Wenn gleichzeitig die Verabreichung dieser Arzneimittel und von Triveram notwendig ist, sind Nutzen und Risiken der Begleitbehandlung sorgfältig abzuwägen. Für Patienten, die Arzneimittel erhalten, die die Plasmakonzentration von Atorvastatin erhöhen, gilt eine niedrigere maximal empfohlene Dosis von Atorvastatin, und deshalb muss eine Dosisreduktion mit den Einzelkomponenten in Betracht gezogen werden. Ausserdem sollte im Falle von starken CYP3A4-Inhibitoren eine niedrigere Initialdosis von Atorvastatin in Erwägung gezogen werden, und es wird eine geeignete klinische Überwachung dieser Patienten empfohlen (siehe "Interaktionen" ).
Bei gleichzeitiger Verabreichung von HMG-CoA-Reduktasehemmern (z.B. Atorvastatin) und Daptomycin kann das Risiko einer Myopathie und/oder Rhabdomyolyse erhöht sein (siehe "Interaktionen" ). Es sollte in Erwägung gezogen werden, Triveram bei Patienten, welche mit Daptomycin behandelt werden, vorübergehend abzusetzen, es sei denn, der Nutzen der gleichzeitigen Anwendung überwiegt das Risiko. Wenn eine gleichzeitige Verabreichung unvermeidbar ist, sollten die CK-Werte zwei bis drei Mal wöchentlich bestimmt werden, und die Patienten sollten engmaschig auf jegliche Anzeichen oder Symptome hin überwacht werden, die auf eine Myopathie hindeuten könnten.
HMG-CoA-Reduktasehemmer (Statine) einschliesslich Triveram dürfen nicht mit systemischen Fusidinsäurepräparaten kombiniert werden.
Es wurden Fälle von Rhabdomyolyse (darunter einige Todesfälle) bei Patienten mitgeteilt, die systemische Fusidinsäurepräparate in Kombination mit Statinen erhalten hatten (siehe "Interaktionen" ).
Während jeglicher unverzichtbaren systemischen Behandlung mit Fusidinsäure ist die Einnahme von Triveram zu unterbrechen. Die Patienten sind anzuweisen, sofort ärztlichen Rat zu suchen, wenn sie Zeichen der Schwäche, Muskelschmerzen oder -empfindlichkeit bemerken.
Die Behandlung mit Statinen kann 7 Tage nach der letzten Einnahme von Fusidinsäure wieder aufgenommen werden.
Ausnahmsweise, wenn eine kontinuierliche systemische Behandlung mit Fusidinsäure erforderlich ist, darf die Kombination von Triveram mit Fusidinsäure nur nach Prüfung des einzelnen Falls und unter engmaschiger ärztlicher Kontrolle erfolgen.
Myasthenia gravis, okuläre Myasthenie
In einigen Fällen wurde berichtet, dass Statine eine Myasthenia gravis oder okuläre Myasthenie auslösen oder verschlimmern, falls bereits bestehend (siehe "Unerwünschte Wirkungen" ). Triveram sollte bei einer Verschlimmerung der Symptome abgesetzt werden. Es wurde über Rezidive berichtet, wenn dasselbe Statin oder ein anderes Statin (erneut) gegeben wurde.
Interstitielle Lungenerkrankung
Bei einigen Statinen wurde über Ausnahmefälle von interstitiellen Lungenerkrankungen berichtet, insbesondere bei Langzeitbehandlung (siehe "Unerwünschte Wirkungen" ). Charakteristische Symptome sind Dyspnoe, unproduktiver Husten und Verschlechterung des Allgemeinzustands (Müdigkeit, Gewichtsverlust und Fieber). Falls bei einem Patienten der Verdacht auf eine interstitielle Lungenerkrankung besteht, muss die Behandlung mit Triveram abgebrochen werden.
Diabetes mellitus
Es gibt Hinweise darauf, dass Statine als Substanzklasse den Blutzuckerspiegel erhöhen und bei manchen Patienten, die ein hohes Risiko für die zukünftige Entwicklung eines Diabetes mellitus haben, eine Hyperglykämie hervorrufen können, deren Ausmass eine formelle Diabetesbehandlung erforderlich macht. Dieses Risiko wird jedoch aufgewogen durch die Statin-bedingte Reduktion des vaskulären Risikos und stellt deshalb keinen Grund für einen Abbruch der Behandlung mit Triveram dar. Im Falle einer Behandlung mit Triveram müssen Risikopatienten (Nüchternblutzucker 5,6-6,9 mmol/l, BMI >30 kg/m², erhöhte Triglyceridwerte, arterielle Hypertonie) sowohl klinisch als auch in Bezug auf die Laborwerte überwacht werden, wie dies den nationalen Richtlinien entspricht.
Bei Diabetikern, die mit oralen Antidiabetika oder Insulin behandelt werden, muss der Blutzuckerspiegel während des ersten Monats einer Behandlung mit Arzneimitteln wie Triveram, die einen ACE-Hemmer enthalten, engmaschig kontrolliert werden (siehe "Interaktionen" ).
Patienten mit Herzinsuffizienz
Triveram muss bei Patienten mit Herzinsuffizienz mit Vorsicht angewendet werden. In einer placebokontrollierten Langzeitstudie an Patienten mit schwerer Herzinsuffizienz (der NYHA-Klassen III und IV) war die Inzidenz von Lungenödemen in der mit Amlodipin behandelten Gruppe höher als in der Placebogruppe (siehe "Eigenschaften/Wirkungen" ).
Arzneimittel, die Calciumantagonisten enthalten, darunter auch Amlodipin, müssen bei Patienten mit kongestiver Herzinsuffizienz mit Vorsicht eingesetzt werden, da sie das Risiko von späteren kardiovaskulären Ereignissen und das Mortalitätsrisiko erhöhen können.
Patienten mit hypertensiver Krise
Die Sicherheit in der Anwendung und die Wirksamkeit von Amlodipin bei einer hypertensiven Krise wurden nicht untersucht.
Hypotonie
Die Anwendung des ACE-Hemmers kann einen plötzlichen Abfall des Blutdrucks bewirken, insbesondere bei Patienten mit starker Stimulierung des Renin-Angiotensin-Aldosteron Systems (RAAS). Dies kann vor allem der Fall sein bei Patienten mit renovaskulärer Hypertonie oder anderen Formen sekundärer Hypertonie, bei Patienten mit Hypovolämie, Herz- oder Leberinsuffizienz, sowie bei solchen, die im Rahmen einer medikamentösen Unterstützungsbehandlung insbesondere Diuretika oder Vasodilatatoren einnehmen.
Patienten mit einem erhöhten Risiko für eine symptomatische Hypotonie sind zu Beginn der Therapie und bei Dosisanpassungen engmaschig zu überwachen (siehe "Unerwünschte Wirkungen" ). Ähnliches gilt für Patienten mit ischämischen Herzerkrankungen oder zerebrovaskulären Erkrankungen, bei denen ein starker Blutdruckabfall einen Myokardinfarkt oder einen Schlaganfall auslösen kann.
Aorta- und Mitralklappenstenose/hypertrophe Kardiomyopathie
Wie andere Arzneimittel, die ACE-Hemmer enthalten, wie zum Beispiel Perindopril, ist Triveram bei Patienten mit Mitralklappenstenose oder nicht schwerwiegender Aortenstenose mit Vorsicht anzuwenden. Der Gebrauch von Triveram ist kontraindiziert bei Patienten, bei denen eine Ausflussbehinderung aus dem linken Ventrikel besteht (siehe "Kontraindikationen" ).
Nierentransplantation
Es liegen keine Daten zur Anwendung von Perindopril bei Patienten kurz nach einer Nierentransplantation vor.
Renovaskuläre Hypertonie
Die adäquate Behandlung der renovaskulären Hypertonie besteht in der Revaskularisierung. Bei Patienten mit beidseitiger Stenose der Nierenarterie oder Stenose der Nierenarterie einer einzigen funktionsfähigen Niere besteht bei Behandlung mit einem ACE-Hemmer ein erhöhtes Risiko für Hypotonie und Niereninsuffizienz (siehe "Kontraindikationen" ). Die Behandlung mit Diuretika kann zu diesem Risiko beitragen. Ein Verlust der Nierenfunktion kann selbst bei Patienten mit einseitiger Stenose der Nierenarterie mit geringfügigen Veränderungen des Serumkreatinins vorkommen.
Niereninsuffizienz
Triveram kann angewendet werden bei Patienten, die eine Kreatinin-Clearance ≥60 ml/min aufweisen, ist jedoch nicht geeignet bei Werten <60 ml/min (mittlere bis schwere Niereninsuffizienz). Bei diesen Patienten wird eine individuelle Dosisanpassung mit den Einzelkomponenten empfohlen. Zur gängigen ärztlichen Praxis gehört bei Patienten mit Niereninsuffizienz eine routinemässige Kontrolle der Kreatinin- und Kaliumspiegel. Bei schwerer Niereninsuffizienz (Kreatinin-Clearance unter 30 ml/min) ist die Behandlung mit Triveram kontraindiziert (siehe "Kontraindikationen" ).
Die sekundäre, durch die Behandlungseinleitung mit ACE-Hemmern wie beispielsweise Perindopril verursachte Hypotonie kann eine beeinträchtigte Nierenfunktion weiter verschlechtern. Unter solchen Umständen wurden Fälle von akuter, für gewöhnlich reversibler Niereninsuffizienz beschrieben.
Bei gewissen Patienten mit bilateraler Nierenarterienstenose oder Stenose der Arterie, die eine Einzelniere versorgt, wurde unter Behandlung mit ACE-Hemmern eine Erhöhung der Harnstoff- und Kreatinin-Blutspiegel beobachtet, die für gewöhnlich nach Behandlungsende reversibel war. Ein solches Risiko besteht vor allem bei Patienten mit Niereninsuffizienz. Bei gleichzeitigem Vorliegen einer renovaskulären Hypertonie besteht ein erhöhtes Risiko für schwere Hypotonie und Niereninsuffizienz. Bei diesen Patienten muss die Behandlung unter engmaschiger medizinischer Überwachung in niedriger, progressiv ansteigender Dosierung eingeleitet werden. Die Behandlung mit Diuretika stellt einen zusätzlichen Risikofaktor dar; sie muss abgesetzt werden, und während der ersten Behandlungswochen muss die Nierenfunktion überwacht werden.
Bei gewissen Patienten mit Bluthochdruck ohne renovaskuläre Erkrankungen in der Anamnese wurden, in der Regel geringfügige und vorübergehende, Erhöhungen der Harnstoff- und Kreatinin-Blutspiegel beobachtet, besonders wenn Perindopril zusammen mit einem Diuretikum verabreicht wurde. Dies tritt eher bei Patienten mit vorbestehender Niereninsuffizienz auf. Eine Dosisreduktion und/oder das Absetzen des Diuretikums und/oder von Triveram können erforderlich sein.
Amlodipin kann bei Patienten mit Niereninsuffizienz in normalen Dosierungen verabreicht werden. Unterschiede in den Amlodipin-Plasmakonzentrationen korrelieren nicht mit dem Grad der Niereninsuffizienz. Amlodipin ist nicht dialysierbar.
Die Wirkung der Kombination Triveram bei Niereninsuffizienz wurde nicht geprüft. Die Dosis von Triveram muss den Dosen der verschiedenen Einzelkomponenten bei separater Einnahme entsprechen.
Hämodialyse-Patienten
Anaphylaktoide Reaktionen wurden bei Patienten beschrieben, welche eine Dialyse mit High-Flux Membranen erhielten und begleitend mit einem ACE Hemmer behandelt wurden. Bei diesen Patienten sollte ein anderer Membrantyp oder ein Antihypertensivum aus einer anderen Klasse verwendet werden.
Überempfindlichkeit, Angioödem
Selten wurde bei Patienten unter der Behandlung mit ACE-Hemmern, einschliesslich Perindopril, ein Angioödem des Gesichts, der Gliedmassen, der Lippen, der Schleimhäute, der Zunge, der Glottis und/oder des Larynx beschrieben (siehe "Unerwünschte Wirkungen" ). Dies kann zu jeder Zeit im Laufe der Behandlung auftreten. Triveram muss dann unverzüglich abgesetzt werden und eine geeignete Überwachung eingeleitet und bis zum vollständigen Verschwinden der Symptome beibehalten werden. Wenn das Ödem auf Gesicht und Lippen beschränkt war, verschwanden die Beschwerden im Allgemeinen ohne Behandlung, jedoch haben sich Antihistaminika zur Linderung der Symptome als nützlich erwiesen.
Angioödeme in Verbindung mit laryngealen Ödemen können tödlich verlaufen. Wenn Zunge, Glottis oder Larynx betroffen sind, was eine Obstruktion der Atemwege zur Folge haben kann, muss unverzüglich eine Notfallbehandlung durchgeführt werden. Diese kann in der Verabreichung von Adrenalin und/oder dem Offenhalten der Atemwege bestehen. Der Patient muss bis zum vollständigen Verschwinden der Symptome unter strenger medizinischer Überwachung bleiben.
Patienten mit Angioödemen in der Anamnese, die unabhängig von einer Behandlung mit ACE-Hemmern auftraten, können unter Behandlung mit Triveram einem erhöhten Risiko für Angioödeme ausgesetzt sein (siehe "Kontraindikationen" ).
Über seltene Fälle von intestinalem Angioödem bei mit ACE-Hemmern behandelten Patienten wurde berichtet. Diese Patienten zeigten abdominale Schmerzen (mit oder ohne Übelkeit oder Erbrechen); in manchen Fällen ging kein faziales Angioödem voraus und der C-1 Esterasespiegel war normal. Die Diagnose wurde mittels abdominaler CT-Untersuchung, Ultraschall oder während eines chirurgischen Eingriffs gestellt. Die Symptome verschwanden nach Absetzen des ACE-Hemmers. Ein intestinales Angioödem sollte bei mit Triveram behandelten Patienten, die abdominale Schmerzen zeigen, in die Differentialdiagnose miteinbezogen werden.
Gleichzeitige Behandlung mit mTOR-Inhibitoren (z.B. Sirolimus, Everolimus, Temsirolimus): Die Patienten mit gleichzeitiger Behandlung mit mTOR-Inhibitoren können einem erhöhten Risiko für Angioödem ausgesetzt werden (z.B. Schwellung der Atemwege oder der Zunge mit oder ohne Atembeschwerden) (siehe "Interaktionen" ).
Gleichzeitige Anwendung von Gliptinen (z.B. Linagliptin, Saxagliptin, Sitagliptin, Vildagliptin):
Bei Patienten, die gleichzeitig mit Gliptinen behandelt werden, kann ein erhöhtes Risiko für Angioödeme (z.B. Schwellungen der Atemwege oder der Zunge, mit oder ohne Atembeschwerden) bestehen (siehe "Wechselwirkungen" ).
Die gleichzeitige Anwendung von Inhibitoren des Neprilysins (neutrale Endopeptidase, NEP) kann auch das Risiko für ein Angioödem erhöhen (siehe "Kontraindikationen" und "Interaktionen" ).
ACE-Hemmer – darunter Triveram – dürfen nicht gleichzeitig mit NEP-Inhibitoren angewendet werden (z.B. die Kombination Sacubitril/Valsartan oder Racecadotril), denn das Angioödem-Risiko kann bei Patienten erhöht sein, die gleichzeitig mit der Kombination Sacubitril/Valsartan oder Racecadotril behandelt werden.
Zwischen dem Beginn einer Behandlung mit Triveram und der Einnahme der letzten Dosis von Sacubitril/Valsartan muss ein Intervall von mindestens 36 Stunden eingehalten werden.
Zwischen dem Beginn einer Behandlung mit Sacubitril/Valsartan und der Einnahme der letzten Dosis von Triveram muss ein Intervall von mindestens 36 Stunden eingehalten werden (siehe "Kontraindikationen" und "Interaktionen" ).
Anaphylaktoide Reaktionen während der Low-Density-Lipoprotein-Apherese (LDL-Apherese)
In seltenen Fällen erlitten Patienten, welche ACE-Hemmer erhielten, während einer LDL-Apherese mit Adsorption an Dextransulfat lebensbedrohliche anaphylaktoide Reaktionen. Diese Reaktionen können durch vorübergehendes Absetzen der ACE-Hemmertherapie vor jeder Apherese vermieden werden. Triveram sollte deshalb vor jeder LDL-Apherese vorübergehend abgesetzt werden.
Anaphylaktoide Reaktionen während der Desensibilisierung
Fälle von anaphylaktoiden Reaktionen bei der Verabreichung eines ACE-Hemmers wie Triveram während einer Desensibilisierungsbehandlung (zum Beispiel Hymenopterengift) wurden gemeldet. Diese Reaktionen konnten durch das vorübergehende Absetzen des ACE-Hemmers bei diesen Patienten vermieden werden, aber bei versehentlicher Wiederaufnahme der Behandlung traten sie erneut auf.
Neutropenie/Agranulozytose/Thrombozytopenie/Anämie
Bei Patienten, die ACE-Hemmer erhielten, wurden Fälle von Neutropenie/Agranulozytose, Thrombozytopenie und Anämie beschrieben. Bei Patienten mit normaler Nierenfunktion und ohne andere Risikofaktoren wird eine Neutropenie selten beobachtet. Triveram muss mit extremer Vorsicht angewendet werden bei Patienten mit kollagenen Gefässerkrankungen, bei solchen, die mit Immunsuppressiva, Allopurinol oder Procainamid behandelt werden, oder bei einer Kombination dieser Risikofaktoren, insbesondere bei vorbestehender Einschränkung der Nierenfunktion. Einige dieser Patienten entwickelten schwere Infektionen, die in gewissen Fällen auch auf intensive Antibiotikatherapie nicht ansprachen. Wenn Triveram bei diesen Patienten angewendet wird, wird eine regelmässige Kontrolle der Leukozytenzahl empfohlen, und die Patienten sollten angewiesen werden, jedes Zeichen einer Infektion zu melden (z.B. Halsschmerzen, Fieber).
Ethnische Gruppen
ACE-Hemmer verursachen bei Patienten schwarzer Hautfarbe eine höhere Inzidenz von Angioödemen.
Triveram, das den ACE-Hemmer Perindopril enthält, kann bei Patienten schwarzer Hautfarbe bei der Blutdrucksenkung weniger wirksam sein.
Husten
Bei der Anwendung von ACE-Hemmern wurde über Husten berichtet. Typischerweise ist der Husten nicht-produktiv, persistierend und klingt nach Beendigung der Behandlung ab. Ein durch ACE-Hemmer induzierter Husten sollte bei Patienten mit Husten, die mit Triveram behandelt werden, differentialdiagnostisch in Betracht gezogen werden.
Chirurgischer Eingriff/Anästhesie
Bei Patienten, die sich einem grossen chirurgischen Eingriff oder einer Narkose mit Anästhetika, die eine Blutdrucksenkung bewirken, unterziehen müssen, kann Triveram die Produktion von Angiotensin II blockieren. Die Behandlung sollte einen Tag vor dem Eingriff abgesetzt werden.
Hyperkaliämie
Erhöhungen des Kaliumblutspiegels wurden bei manchen Patienten beobachtet, die mit ACE-Hemmern, einschliesslich Perindopril, behandelt wurden. Risikofaktoren für die Entwicklung einer Hyperkaliämie sind (unter anderem): Niereninsuffizienz, Einschränkung der Nierenfunktion, Alter (>70 Jahre), Diabetes mellitus, interkurrente Ereignisse wie Dehydration, akute Herzdekompensation, metabolische Azidose und gleichzeitiger Gebrauch von kaliumsparenden Diuretika (zum Beispiel: Spironolacton, Eplerenon, Triamteren oder Amilorid), Kaliumsupplementen oder kaliumhaltigen Salzersatzstoffen oder andere Behandlungen, die eine Erhöhung des Kaliumblutspiegels hervorrufen (zum Beispiel: Heparin, andere ACE-Hemmer, Angiotensin-II-Rezeptor-Antagonisten, Acetylsalicylsäure ≥3 g/Tag, COX-2-Hemmer und nicht selektive NSAID, Immunsuppressiva wie Ciclosporin oder Tacrolimus, Trimethoprim oder auch Co-Trimoxazol (ebenfalls bekannt als Trimethoprim/Sulfamethoxazol). Der Gebrauch von Kaliumsupplementen, kaliumsparenden Diuretika oder kaliumhaltigen Salzersatzstoffen, besonders bei Patienten mit beeinträchtigter Nierenfunktion, kann zu einem signifikanten Anstieg des Kaliumblutspiegels führen. Hyperkaliämie kann schwerwiegende, manchmal tödliche Arrhythmien verursachen. Wenn die gleichzeitige Anwendung von Triveram und den oben genannten Arzneimitteln unbedingt notwendig ist, müssen diese mit Vorsicht und unter häufiger Kontrolle des Kaliumblutspiegels angewendet werden (siehe "Interaktionen" ).
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
Siehe "Interaktionen" .
Primärer Hyperaldosteronismus
Patienten mit primärem Hyperaldosteronismus sprechen im Allgemeinen nicht auf antihypertensive Behandlungen an, die durch Hemmung des Renin-Angiotensin-Systems wirken. Aus diesem Grund wird dieses Medikament bei derartigen Patienten nicht empfohlen.
Lactose
Triveram enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Sodium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette , d.h. es ist nahezu "natriumfrei" .
Interaktionen
Mit Triveram und anderen Arzneimitteln wurden keine Arzneimittel-Interaktionsstudien durchgeführt, aber es wurden separate Studien mit Atorvastatin, Perindopril und Amlodipin durchgeführt. Die Resultate sind im Folgenden aufgeführt.
Medikamente, die das Risiko eines Angioödems erhöhen:
Die gleichzeitige Anwendung von ACE-Hemmern mit der Kombination Sacubitril/Valsartan ist wegen des erhöhten Risikos eines Angioödems kontraindiziert (siehe "Kontraindikationen" und "Warnhinweise und Vorsichtsmassnahmen" ). Die Behandlung mit Sacubitril/Valsartan sollte nicht innerhalb von 36 Stunden nach der letzten Dosis einer Perindopril-haltigen Therapie begonnen werden. Die Behandlung mit Perindopril sollte nicht innerhalb von 36 Stunden nach der letzten Dosis von Sacubitril/Valsartan begonnen werden (siehe "Kontraindikationen" und "Warnhinweise und Vorsichtsmassnahmen" ).
Die gleichzeitige Anwendung von ACE-Hemmern mit Racecadotril, mTOR-Inhibitoren (z.B. Sirolimus, Everolimus, Temsirolimus) und Gliptinen (z.B. Linagliptin, Saxagliptin, Sitagliptin, Vildagliptin) kann zu einem erhöhten Risiko eines Angioödems führen (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Arzneimittel, die eine Hyperkaliämie induzieren
Gewisse Arzneimittel bzw. therapeutische Klassen können das Auftreten von Hyperkaliämien verstärken: Aliskiren, Kaliumsalze, kaliumsparende Diuretika, ACE-Hemmer, Angiotensin-II-Rezeptor Antagonisten (ARA II), NSAID, Heparine, Immunsuppressiva wie Ciclosporin oder Tacrolismus und Trimethoprim. Die gleichzeitige Anwendung dieser Arzneimittel erhöht das Risiko einer Hyperkaliämie. Daher wird die Kombination von Triveram mit den oben genannten Medikamenten nicht empfohlen. Wenn eine gleichzeitige Anwendung angezeigt ist, sollte sie mit Vorsicht und unter häufiger Überwachung des Blutkaliumspiegels erfolgen.
Interaktionen von Triveram mit anderen Arzneimitteln
Substanzen, die Triveram-Komponente Veränderung von Empfehlungen zur Einnahme und
Interaktionen AUC* und Cmax Interaktionsmechanismus
aufweisen
Gleichzeitige
Anwendung kontraindi
ziert oder nicht
empfohlen
Aliskiren ARA II Perindopril Nicht relevant Die gleichzeitige Behandlung mit
Pharmakodynamische Triveram und Aliskiren ist
Interaktion: Erhöhun kontraindiziert bei Patienten mit
g der unerwünschten Diabetes oder Niereninsuffizienz
Wirkungen (Hyperkali (siehe "Kontraindikationen" ),
ämie, Verminderung aufgrund des Risikos für
der Nierenfunktion), Hyperkaliämie, Verschlechterung
Verstärkung der der Nierenfunktion, kardiovaskulär
blutdrucksenkenden e Morbidität und Anstieg der
Wirkung Mortalität. Es gibt Hinweise,
dass die gleichzeitige Anwendung
von Angiotensin-Konversionsenzym-H
emmer (ACE-Hemmer), Angiotensin-II
-Rezeptor-Antagonisten (ARA II)
oder Aliskiren das Risiko für
Hypotonie, Hyperkaliämie und eine
Verminderung der Nierenfunktion
(einschliesslich eines akuten
Nierenversagens) erhöht. Eine
duale Blockade des RAAS durch die
gleichzeitige Anwendung von
ACE-Hemmer, ARA II oder Aliskiren
wird deshalb nicht empfohlen.
Wenn die Therapie mit einer
dualen Blockade als absolut
notwendig erachtet wird, sollte
dies nur unter Aufsicht eines
Spezialisten und unter
Durchführung engmaschiger
Kontrollen von Nierenfunktion,
Elektrolytwerten und Blutdruck
erfolgen. ACE-Hemmer und ARA-II
dürfen bei Patienten mit
diabetischer Nephropathie nicht
gleichzeitig angewendet werden.
Behandlung mittels Perindopril Interaktion nicht Wegen des Risikos für
extrakorporellem untersucht anaphylaktoide Reaktionen sind
Kreislauf Behandlungen mittels extrakorporel
lem Kreislauf kontraindiziert,
die einen Kontakt mit negativ
geladenen Oberflächen mit sich
bringen, z.B. Dialyse oder
Hämofiltration mit bestimmten
Membranen hoher Permeabilität
(beispielsweise Polyacrylnitril-Me
mbranen), ebenso die Apherese von
Lipoproteinen geringer Dichte mit
Dextransulfat (siehe "Kontraindika
tionen" ). Wenn diese Art von
Behandlung erforderlich ist,
sollte man die Verwendung eines
anderen Dialyse-Membrantyps oder
eine andere Klasse antihypertensiv
er Medikamente in Betracht ziehen.
Sacubitril/Valsartan Perindopril Nicht zutreffend Die gleichzeitige Verabreichung
Racecadotril Pharmakodynamische eines ACE-Hemmers wie Triveram
Interaktion: Steiger mit NEP-Hemmern (z.B. die
ung der unerwünschte Kombination Sacubitril/Valsartan
n Wirkungen (Angioöd oder Racecadotril) kann das
em) Risiko für Angioödem erhöhen
(siehe "Kontraindikationen" und
"Warnhinweise und Vorsichtsmassnah
men" ).
Co-Trimoxazol Perindopril Nicht zutreffend Patienten die gleichzeitig
(Trimethoprim/Sulfam Pharmakodynamische Co-Trimoxazol (Trimethoprim/Sulfam
ethoxazol) Interaktion: Steiger ethoxazol) erhalten haben ein
ung der unerwünschte erhöhtes Risiko für Hyperkaliämie
n Wirkungen (Hyperka (siehe "Warnhinweise und
liämie) Vorsichtsmassnahmen" ).
Starke und mässig Die gleichzeitige Anwendung von
starke CYP3A4-Inhibi starken CYP3A4-Inhibitoren und
toren Triveram sollte möglichst
vermieden werden. Wenn die
gleichzeitige Anwendung dieser
Medikamente und von Triveram
nicht vermieden werden kann, ist
der Übergang zu Einzelkomponenten
und die Anpassung an geringere
Atorvastatin- und Amlodipin-Dosen
zu erwägen. Eine geeignete
klinische Überwachung des
Patienten wird empfohlen.
Atorvastatin wird von Cytochrom
P450 3A4 (CYP3A4) metabolisiert
und ist ein Substrat für die
hepatischen Transporter, die
organischen Anionentransportpolype
ptide 1B1 (OATP1B1) und 1B3
(OATP1B3). Metaboliten von
Atorvastatin sind Substrate für
OATP1B1. Atorvastatin wird auch
als Substrat der Efflux-Transporte
r P-Glykoprotein (P-gp) und das
Breast Cancer Resistance Protein
(BCRP) identifiziert, die die
intestinale Absorption und die
biliäre Clearance von
Atorvastatin einschränken können
(siehe Pharmakokinetik).
Atorvastatin
Glecaprevir (400 mg 10 mg 1xTag, 7 Tage ↑ AUC 8.3-fach Die gleichzeitige Anwendung von
1x Tag) / Pibrentasv Triveram ist aufgrund eines
ir (120 mg 1xTag, 7 erhöhten Myopathierisikos
Tage) kontraindiziert
Elbasvir (50 mg, 10 mg als Einmalgabe ↑ AUC 1.95-fach Die gleichzeitige Gabe von
1x/Tag )/ Grazoprevi BRCP-hemmenden Medikamenten wie
r (200 mg, 1x/Tag, Elbasvir oder Grazoprevir kann
13 Tage) die Plasma-Konzentration von
Atorvastatin und das Risiko für
Myopathie erhöhen, infolgedessen
kann in Abhängigkeit von der
verschriebenen Dosis eine
Anpassung der Atorvastatin-Dosis
erwogen werden. Die Dosierung von
Atorvastatin darf bei
gleichzeitiger Gabe von Elbasvir
oder Grazoprevir 20 mg/Tag nicht
überschreiten (siehe "Dosierung/An
wendung" und "Warnhinweise und
Vorsichtsmassnahmen" ). Es wurde
gezeigt, dass die starken
CYP3A4-Inhibitoren zu einer
deutlichen Erhöhung der
Atorvastatin-Konzentration und
einem erhöhten Myopathie-Risiko
führen. Die Kombination von
starken CYP3A4-Inhibitoren mit
Atorvastatin sollte soweit
möglich vermieden werden. Wenn
die Kombination dieser
Arzneimittel unbedingt notwendig
ist, darf die tägliche Dosis von
10 mg Atorvastatin nicht
überschritten werden. Eine
engmaschige klinische Überwachung
des Patienten wird empfohlen.
z.B. Clarithromycin 80 mg 1x/Tag, 8 Tage ↑ AUC 4,4-fach ↑
(500 mg 2x/Tag, 9 Cmax 5,4-fach
Tage),
Telithromycin,
Delavirdin, Stiripen
tol, Ketoconazol,
Voriconazol,
Itraconazol (200 mg 40 mg als Einmalgabe ↑ AUC 3,3-fach ↑ Bei Patienten, die Clarithromycin
1x/Tag, 4 Tage) Cmax 20% oder Itraconazol erhalten, soll
die tägliche Dosis von 20 mg
Atorvastatin nicht überschritten
und mit Vorsicht angewendet
werden. Patienten, die mit der
Kombination der HIV-Protease-Inhib
itoren Tipranavir/Ritonavir oder
einem Hepatitis-C-Protease-Inhibit
or, behandelt werden, müssen die
gleichzeitige Anwendung von
Atorvastatin vermeiden.
Patienten, welche die Kombination
der HIV-Protease-Inhibitoren
Lopinavir/Ritonavir einnehmen,
müssen mit Vorsicht und der
niedrigsten notwendigen Dosis
Atorvastatin behandelt werden.
Bei Patienten, welche die
Kombination der HIV-Protease-Inhib
itoren Saquinavir/Ritonavir,
Darunavir/Ritonavir, Fosamprenavir
oder Fosamprenavir/Ritonavir
erhalten,soll die tägliche Dosis
von 20 mg Atorvastatin nicht
überschritten und mit Vorsicht
angewendet werden. Bei Patienten,
welche den HIV-Protease-Inhibitor
Nelfinavir erhalten, darf die
tägliche Dosis 40 mg Atorvastatin
nicht übersteigen. Diese
Patienten sollen engmaschig
überwacht werden.
Posaconazol, HIV-Pro
tease-Inhibitoren
wie Ritonavir
Lopinavir (400 mg 20 mg 1x/Tag, 4 Tage ↑ AUC 5.9-fach
2x/Tag/ Ritonavir
(100 mg 2x/Tag, 14
Tage), Atazanavir,
Indinavir,
Darunavir (300 mg 10 mg 1x/Tag, 4 Tage ↑ AUC 3.4-fach ↑
2x/Tag)/ Ritonavir Cmax 2.25-fach
(100 mg 2x/Tag, 9
Tage),
Tipranavir (500mg, 10 mg als Einmalgabe ↑ AUC 9.4-fach ↑
2x/Tag)/ Ritonavir Cmax 8.6-fach
(200 mg 2x/Tag, 7
Tage),
¥ Saquinavir (400 40 mg 1x/Tag, 4 Tage ↑ AUC 3.9-fach ↑
mg 2x/Tag)/Ritonavir Cmax 4.3-fach
(400 mg 2x/Tag, 15
Tage),
Fosamprenavir (700 10 mg 1x/Tag, 4 Tage ↑ AUC 2.53-fach ↑
mg 2x/Tag)/Ritonavir Cmax 2.84-fach
(100 mg 2x/Tag, 14
Tage),
Fosamprenavir (1400 10 mg 1x/Tag, 4 Tage ↑ AUC 2.3-fach ↑
mg 2x/Tag, 14 Tage), Cmax 4.04-fach
Nelfinavir (1250 mg 10 mg 1x/Tag, 28 ↑ AUC 74% ↑ Cmax
2x/Tag, 14 Tage) Tage 2.2-fach
etc.,
Ciclosporin (5.2 10 mg 1x/Tag, 28 ↑ AUC 8.7-fach ↑ Inhibitoren von Transportproteinen
mg/kg/Tag, stabile Tage Cmax 10.7-fach (z.B. Ciclosporin, Letermovir)
Dosis), können die systemische
Atorvastatin-Exposition erhöhen.
Die Auswirkung der Hemmung der
hepatischen Aufnahmetransporter
auf die Atorvastatin-Konzentration
in Leberzellen ist nicht
bekannt. Die gleichzeitige
Anwendung von Atorvastatin bei
Patienten,die Letermovir in
Kombination mit Ciclosporin
einnehmen, sollte vermieden
werden. Die Dosis von
Atorvastatin sollte bei
gleichzeitiger Verabreichung mit
Letermovir täglich nicht 20 mg
überschreiten.
Letermovir (480 mg 20 mg 1x/Tag, 10 ↑ AUC 3,29-fach
1x/Tag,10 Tage) Tage
Erythromycin, (500 10 mg als Einmalgabe ↑ AUC 33% ↑ Cmax 38% Die moderaten CYP3A4-Inhibitoren
mg 4x/Tag, 7 Tage), können die Plasmakonzentration
von Atorvastatin erhöhen. Ein
erhöhtes Risiko für Myopathie
wurde bei der Kombination von
Erythromycin und Statinen
beobachtet. Die tägliche Dosis
von 20 mg Atorvastatin soll nicht
überschritten und mit Vorsicht
angewendet werden.
Fluconazol,
Verapamil, Interaktion nicht Es wurden keine Interaktionsstudie
untersucht Voraussic n zur Beurteilung des Einflusses
htlich: ↑ von Amiodaron oder Verapamil auf
Atorvastatin durchgeführt. Sowohl
Amiodaron als auch Verapamil
hemmen bekanntermassen die
CYP3A4-Aktivität und eine
Kombination mit Atorvastatin kann
zu einer erhöhten Exposition von
Atorvastatin führen.
Diltiazem (240 mg 40 mg als Einmalgabe ↑ AUC 51% ↔ Cmax Eine geeignete klinische
1x/Tag, 28 Tage), Überwachung des Patienten wird
nach Behandlungsbeginn oder nach
Dosisanpassungen von Diltiazem
empfohlen.
Amlodipin Die gleichzeitige Anwendung von
Amlodipin mit starken oder
moderaten CYP3A4-Inhibitoren kann
zu einer bedeutenden Erhöhung der
Plasmakonzentration von Amlodipin
führen. Die klinischen
Konsequenzen der veränderten
Pharmakokinetik können bei
älteren Patienten ausgeprägter
sein.
Diltiazem (180 5 mg ↑ AUC 57%
mg/Tag),
Erythromycin ↑ AUC 22%
Clarithromycin Interaktion nicht Es besteht ein erhöhtes
untersucht Hypotonie-Risiko bei Patienten,
die Clarithromycin und Amlodipin
gleichzeitig erhalten. Im Falle
einer gleichzeitigen Verabreichung
ist eine sehr engmaschige
Überwachung der Patienten
angezeigt.
Ciclosporin Ciclosporin ↑ AUC Es sind keine Studien zur
0-40% Interaktion von Ciclosporin und
Amlodipin bei gesunden Probanden
oder bei anderen Populationen,
ausser jener von nierentransplanti
erten Patienten, durchgeführt
worden. Es wurde gezeigt, dass
die gleichzeitige Gabe von
Ciclosporin und Amlodipin einen
Einfluss auf die Talkonzentration
von Ciclosporin hatte (vom
Ausbleiben einer Veränderung bis
zu einer durchschnittlichen
Erhöhung um 40%). Bei
nierentransplantierten Patienten
unter Amlodipin sollten die
Ciclosporin-Spiegel speziell
überwacht werden.
Tacrolimus Amlodipin Interaktion nicht Bei gleichzeitiger Verabreichung
untersucht Voraussic von Amlodipin besteht ein
htlich: Tacrolimus erhöhtes Risiko für erhöhte
↑ AUC Blutspiegel von Tacrolimus. Zur
Vermeidung der Toxizität von
Tacrolimus müssen bei
Verabreichung von Amlodipin bei
Patienten, die mit Tacrolimus
behandelt werden, die Blutspiegel
von Tacrolimus überwacht und die
Dosis von Tacrolimus bei Bedarf
angepasst werden.
Theophyllin, Ergotam Interaktion nicht Calcium Antagonisten können mit
in untersucht dem Cytochrom-p450-abhängigen
Metabolismus von Theophyllin und
Ergotamin interferieren. Da keine
In-vitro- und In-vivo-Interaktions
studien mit Theophyllin bzw.
Ergotamin und Amlodipin verfügbar
sind, wird empfohlen, zu Beginn
einer gleichzeitigen Verabreichung
die Blutspiegel von Theophyllin
oder Ergotamin regelmässig zu
kontrollieren.
Dantrolen (Infusion) Amlodipin Nicht relevant Die gleichzeitige Anwendung von
Pharmakodynamische Triveram und Dantrolen muss
Interaktion: Erhöhun vermieden werden. Im Tiermodell
g der unerwünschten wurden nach Verabreichung von
Wirkungen (Hyperkali Verapamil und von intravenösem
ämie) Dantrolen Fälle von Kammerflimmern
und letalem kardiovaskulärem
Kollaps in Verbindung mit
Hyperkaliämie beobachtet.
Aufgrund des Hyperkaliämierisikos
wird empfohlen, bei Patienten,
die anfällig für eine maligne
Hyperthermie sind, und bei der
Behandlung einer malignen
Hyperthermie die gleichzeitige
Gabe von Calciumkanalblockern wie
Triveram zu vermeiden.
#Grapefruits oder Atorvastatin 40 mg ↑ AUC 37% ↑ Cmax Die Anwendung von Triveram
Grapefruitsaft (240 als Einmalgabe 16% Voraussichtlich: zusammen mit Grapefruits oder
ml 1x/Tag) Amlodipin ↑ AUC ↑ Cmax Grapefruitsaft wird nicht
empfohlen, denn bei einigen
Patienten kann die Bioverfügbarkei
t erhöht sein, was zu einer
Verstärkung der blutdrucksenkenden
Wirkung führen kann.
Estramustin Perindopril Nicht relevant Die gleichzeitige Anwendung von
Pharmakodynamische Triveram und Estramustin wird
Interaktion: Erhöhun nicht empfohlen, aufgrund des
g der unerwünschten Risikos einer Erhöhung
Wirkungen (Angioödem unerwünschter Wirkungen wie
) angioneurotisches Ödem
(Angioödem).
Lithium Perindopril Interaktion nicht Die gleichzeitige Anwendung von
untersucht Voraussic Triveram und Lithium wird nicht
htlich: ↑ Lithium empfohlen, aber wenn die
Kombination unbedingt notwendig
ist, sollte der Lithium-Blutspiege
l sorgfältig überwacht werden
(siehe "Warnhinweise und
Vorsichtsmassnahmen" ).
Reversible Erhöhungen von
Serum-Lithiumkonzentrationen und
Lithiumtoxizität wurden bei
gleichzeitiger Anwendung von
ACE-Hemmern beobachtet.
mTOR-Inhibitoren Perindopril Pharmakodynamische Die Patienten mit gleichzeitiger
(z.B. Sirolimus, Interaktion: Erhöhun Behandlung mit mTOR-Inhibitoren
Everolimus, Temsirol g der unerwünschten können einem erhöhten Risiko für
imus) Wirkungen (Angioödem Angioödem ausgesetzt werden
) (siehe "Warnhinweise und
Vorsichtsmassnahmen" ).
Amlodipin Interaktion nicht Die mTOR-Hemmer sind Substrate
untersucht Voraussic von CYP3A4. Amlodipin ist ein
htlich: ↑ mTOR-Hemme schwacher CYP3A4-Inhibitor. Bei
r gleichzeitiger Verabreichung kann
Amlodipin die Exposition
gegenüber mTOR-Inhibitoren
erhöhen.
Kaliumsparende Perindopril Nicht relevant Die Kombination von Triveram und
Diuretika (z. B.: Pharmakodynamische diesen Arzneimitteln wird nicht
Amilorid, Eplerenon, Interaktion: Erhöhun empfohlen. Wenn die gleichzeitige
Spironolacton), g des Risikos für Anwendung dennoch indiziert ist,
Kaliumsalze Hyperkaliämie müssen diese Arzneimittel mit
Vorsicht und unter häufiger
Kontrolle des Kaliumblutspiegels
und des Serumkreatinin-Spiegels
angewendet werden (siehe
"Warnhinweise und Vorsichtsmassnah
men" ). Risiko für Hyperkaliämie
(mit potentiell tödlichem
Ausgang), besonders im
Zusammenhang mit Niereninsuffizien
z (Kumulierung der kaliumerhöhende
n Wirkungen). Mit Eplerenon und
Spironolacton in Dosen zwischen
12,5 mg und 50 mg täglich und
niedrig dosierten ACE-Hemmern:
Bei der Behandlung einer
Herzinsuffizienz der NYHA-Klasse
II bis IV mit einer Auswurfsfrakti
on von <40% und vorangegangener
Therapie mit ACE-Hemmern und
Schleifendiuretika besteht das
Risiko für eine potentiell
tödliche Hyperkaliämie,
insbesondere bei Nichtbeachten
der Verschreibungsempfehlungen
für diese Kombination. Vor dem
Einsatz dieser Kombination müssen
Hyperkaliämie und Niereninsuffizie
nz ausgeschlossen werden. Eine
engmaschige Kontrolle der Kalium-
und Kreatinin-Blutspiegel wird
empfohlen: einmal pro Woche im
ersten Monat der Behandlung und
danach einmal pro Monat.
Gleichzeitige
Anwendung, die
besondere Vorsichtsm
assnahmen erfordert
Nicht-kaliumsparende Perindopril Nicht relevant Im Falle einer Hypotonie ist vor
Diuretika Pharmakodynamische der Behandlung mit Triveram das
Interaktion: Verstär Diuretikum abzusetzen oder für
kung der blutdruckse Volumenerhöhung bzw. Salzzufuhr
nkenden Wirkung zu sorgen. Patienten, die mit
Diuretika behandelt werden,
besonders solche mit Hypovolämie
und/oder Salz- und Wassermangel,
können nach Behandlungsbeginn mit
einem ACE-Hemmer einen starken
Abfall des Blutdrucks erfahren.
Der hypotensive Effekt kann
reduziert werden durch Absetzen
des Diuretikums, durch
Volumenerhöhung oder Salzeinnahme,
bevor die Behandlung mit
Perindopril in niedrigen,
progressiv ansteigenden Dosen
eingeleitet wird. Wenn bei
arterieller Hypertonie eine
vorangegangene Diuretikatherapie
eine Hypovolämie und/oder einen
Elektrolyt- und Wasserverlust
verursacht haben kann, muss das
Diuretikum vor dem Einsatz von
Perindopril abgesetzt werden; in
diesem Fall kann anschliessend
entweder die diuretische
Behandlung mit einem nicht-kaliums
parenden Diuretikum wiederaufgenom
men werden oder dann muss
Perindopril in niedriger,
progressiv ansteigender Dosierung
eingeführt werden. In der
diuretischen Behandlung einer
kongestiven Herzinsuffizienz muss
Perindopril in sehr niedriger
Dosierung eingeführt werden, nach
vorheriger Reduzierung des
gleichzeitig gegebenen
nicht-kaliumsparenden
Diuretikums. In jedem Fall muss
die Nierenfunktion (Kreatinin-Spie
gel) in den ersten Wochen einer
Behandlung mit Perindopril
überwacht werden.
CYP3A4-Induktoren Die Anwendung von Triveram
zusammen mit Induktoren des
Isoenzyms CYP3A4 muss mit
Vorsicht erfolgen. Die
gleichzeitige Anwendung von
Induktoren von Cytochrom P450 3A4
kann unterschiedliche
Verminderungen der Plasmakonzentra
tionen von Atorvastatin und
Amlodipin verursachen.
Z.B. Efavirenz 600 Atorvastatin 10 mg ↓ AUC 41% ↓ Cmax 1%
mg 1x/Tag, 14 Tage, für 3 Tage
†Rifampicin (600 mg 40 mg als Einmalgabe ↑ AUC 30% ↑ Cmax Infolge des dualen Interaktions-me
1x/Tag, 7 Tage, 2.7-fach chanismus von Rifampicin
gleichzeitige (Induktion von Cytochrom P450 3A4
Verabreichung), und Hemmung des hepatischen
Aufnahme-Transporters OATP1B1)
wird die gleichzeitige Einnahme
von Triveram und von Rifampicin
empfohlen, da eine verzögerte
Verabreichung von Atorvastatin
nach der Gabe von Rifampicin mit
einer signifikanten Verminderung
der Plasmakonzentration von
Atorvastatin verbunden war.
Allerdings ist die Wirkung von
Rifampicin auf die Konzentration
von Atorvastatin in Leberzellen
noch unbekannt und falls eine
gleichzeitige Anwendung nicht
vermieden werden kann, muss die
Wirksamkeit der Behandlung streng
überwacht werden.
†Rifampicin (600 mg 40 mg als Einmalgabe ↓ AUC 80% ↓ Cmax 40%
1x/Tag, 5 Tage,
getrennte Verabreich
ung), Johanniskraut
[Hypericum perforatu
m]
Amlodipin Interaktion nicht
untersucht Voraussic
htlich: