CompositionPrincipes actifs
Triptoréline, sous forme d'embonate de triptoréline.
Excipients
Polymère D,L lactide-co-glycolide, Mannitol, Carmellose sodique*, Polysorbate 80.
Solvant: Eau pour préparations injectables.
*la quantité de sodium apportée par la carmellose sodique correspond à 2.2 mg par dose
Forme pharmaceutique et quantité de principe actif par unitéPoudre et solvant pour suspension injectable à libération prolongée (i.m.; s.c. (uniquement chez l'homme atteint d'un cancer de la prostate)). Chaque flacon de poudre contient une quantité prélevable de 3,75 mg de triptoréline. Après reconstitution avec 2 ml d'eau pour préparations injectables, la suspension pour injection contient 1,875 mg de triptoréline par ml.
Indications/Possibilités d’emploiCancer de la prostate hormonodépendant au stade avancé.
Cancer de la prostate hormono-dépendant localisé à haut risque ou localement avancé traité en association à une radiothérapie (voir "Efficacité clinique" ).
Endométriose.
Downregulation dans le cadre de la procréation médicalement assistée.
Traitement adjuvant, en association avec le tamoxifène ou un inhibiteur de l'aromatase, du cancer du sein exprimant des récepteurs hormonaux (oestrogène et/ou progestérone) à un stade précoce chez des femmes à haut risque de récidive, confirmées comme pré-ménopausées à l'issue d'une chimiothérapie (voir "Contre-indications" , "Mises en garde et précautions" , "Effets indésirables" et "Pharmacodynamique" ).
Posologie/Mode d’emploiLa préparation Pamorelin LA 3,75 mg ne doit être utilisée que par les médecins ou le personnel médical.
Mode d'administration
La préparation Pamorelin LA 3,75 mg doit être injectée par voie intramusculaire ou par voie sous-cutanée (uniquement chez l'homme atteint d'un cancer de la prostate).
Du fait que Pamorelin LA 3,75 mg est une suspension de microgranules, toute injection intravasculaire doit absolument être évitée. Le site d'injection doit changer périodiquement.
Pour la préparation de la suspension injectable prête à l'emploi, se reporter à la rubrique "Remarques particulières" , paragraphe "Mode de préparation" .
Posologie usuelle
Cancer de la prostate
La posologie usuelle est d'une injection intramusculaire ou sous-cutanée de Pamorelin LA 3,75 mg chaque mois (4 semaines) sous contrôle médical.
L'efficacité du traitement peut être contrôlée par dosage des taux sériques de la testostérone et de l'antigène spécifique de la prostate (PSA) et appréciation subjective (amélioration des symptômes tels que troubles mictionnels, douleurs cancéreuses, etc.). La testostérone peut être dosée immédiatement avant ou après l'injection.
Endométriose
La posologie usuelle est d'une injection intramusculaire de Pamorelin LA 3,75 mg chaque mois (4 semaines) sous contrôle médical.
Une amélioration des symptômes (p.ex. dysménorrhée, dyspareunie, ténesme, douleurs pelviennes) est à prévoir pendant le traitement. Au besoin le suivi thérapeutique peut s'appuyer sur les constantes biologiques habituelles (E2, progestérone).
Durée du traitement
Dans l'endométriose, la durée usuelle de traitement est de 4-6 mois, soit 4-6 injections de Pamorelin LA 3,75 mg.
Procréation médicalement assistée
La posologie usuelle est d'une injection intramusculaire de Pamorelin LA 3,75 mg chaque mois (4 semaines) sous contrôle médical.
Différents protocoles sont proposés pour l'emploi de Pamorelin LA 3,75 mg:
Downregulation dans le cadre de la procréation médicalement assistée (FIV, GIFT) ou induction de la maturation folliculaire lors de méthodes de traitement non assisté, etc.
-Dans le "long protocol" une injection unique de Pamorelin LA 3,75 mg provoque une suppression hypophysaire intégrale (downregulation) avant l'induction de la stimulation sous gonadotrophines exogènes. L'ampleur de la suppression hypophysaire se mesure au taux d'œstrogènes circulants. La stimulation par gonadotrophines exogènes ne sera induite que lorsque le taux d'E2 est <50 pg/ml.Le "long protocol" est également appliqué hors de la procréation médicalement assistée. La posologie des gonadotrophines administrées pour induire une maturation folliculaire doit être adaptée, car le but du traitement est une maturation monofolliculaire.
-Dans le "short protocol" la stimulation par gonadotrophines exogènes est induite en même temps ou très peu de temps après l'injection unique de Pamorelin LA 3,75 mg. Dans ce cas, l'effet des agonistes de la GnRH pendant les premiers jours de la stimulation potentialise ceux des gonadotrophines exogènes ( "flare-up" ). Le "short protocol" ne doit pas être utilisé en dehors de la procréation médicalement assistée.
L'ampleur de la suppression hypophysaire (dans le "long protocol" ) peut être évaluée par le dosage du taux d'E2. Des examens biologiques et endocrinologiques réguliers avec contrôles échographiques sont requis lors de la procréation médicalement assistée. En cas de stimulation ovarienne excessive, réduire ou interrompre l'apport de gonadotrophines.
Cancer du sein:
Une injection intramusculaire renouvelée toutes les 4 semaines en association avec le tamoxifène ou un inhibiteur de l'aromatase.
Le traitement par la triptoréline doit être initié à l'issue de la chimiothérapie, dès que le statut de pré-ménopause a été confirmé (voir "Mises en garde et précautions" ).
Le traitement par la triptoréline doit être initié au moins 6 à 8 semaines avant de débuter le traitement par inhibiteur de l'aromatase. Au minimum deux injections de triptoréline (avec un intervalle de 4 semaines entre les injections) doivent être administrées avant le début du traitement par inhibiteur de l'aromatase.
Pendant le traitement par un inhibiteur de l'aromatase, le traitement par la triptoréline ne doit pas être interrompu afin d'éviter une augmentation rebond des œstrogènes circulants chez les femmes non ménopausées.
La durée recommandée du traitement adjuvant en association avec d'autres hormonothérapies peut aller jusqu'à 5 ans.
Instructions posologiques particulières
Enfants et adolescents
La sécurité et l'efficacité de Pamorelin LA 3,75 mg n'ont pas été étudiées chez les enfants et les adolescents. Aucune indication n'existe donc pour ce groupe d'âge.
Patients âgés
Une adaptation de la dose en fonction de l'âge n'est pas nécessaire.
Patients présentant des troubles de la fonction rénale
Aucune adaptation de la posologie n'est requise pour les patients souffrant d'une fonction rénale limitée.
Patients présentant des troubles de la fonction hépatique
Aucune adaptation de la posologie n'est requise pour les patients souffrant d'une fonction hépatique limitée.
Contre-indicationsContre-indications générales
Hypersensibilité à la triptoréline, à d'autres analogues de la GnRH, ou à l'un des excipients selon la composition.
Grossesse et allaitement (voir "Grossesse et Allaitement" ).
Cancer de la prostate
Pamorelin LA 3,75 mg ne doit pas être administré s'il y a des indices en faveur du fait que la tumeur n'est pas hormonodépendante ou après castration chirurgicale.
Pamorelin LA 3,75 mg est contre-indiqué chez les patients ayant une compression médullaire sur des métastases de leur carcinome prostatique.
Endométriose/Procréation médicalement assistée
Saignements vaginaux inexpliqués
Mises en garde et précautionsMises en garde générales
Réactions d'hypersensibilité:
Peu après l'injection de Pamorelin LA 3,75 mg ont été observées quelques rares réactions allergiques. De rares cas de choc anaphylactique et d'oedème angioneurotique ont été décrits après administration de triptoréline.
Apoplexie hypophysaire:
De rares cas d'apoplexie hypophysaire (syndrome clinique résultant d'un infarcissement hypophysaire) ont été décrits chez les patients traités avec des agonistes de la GnRH. La plupart des cas se sont produits dans les 2 semaines, certains dans l'heure ayant suivi la première injection. L'apoplexie hypophysaire s'est manifestée par céphalées soudaines, vomissements, troubles visuels, ophtalmoplégie, altération de l'état mental et parfois collapsus cardiovasculaire.
Une intervention médicale immédiate est indispensable.
Il ne faut donc pas administrer d'agoniste de la GnRH en cas d'adénome hypophysaire connu.
Troubles de l'humeur/Dépression:
Des troubles de l'humeur allant jusqu'à des dépressions (dont certaines sévères) ont été rapportés sous traitement par triptoréline. De rares cas d'idées suicidaires ou de tentatives de suicide ont également été rapportés sous traitement par d'autres analogues de la GnRH. Les patients souffrant de dépression (même dans leur anamnèse) doivent donc être étroitement surveillés pendant la prise de Pamorelin LA 3,75 mg. Les patients doivent être avertis du risque d'apparition de tels symptômes (et de la possibilité d'une aggravation d'une dépression préexistante).
Convulsions:
Des cas de convulsions ont été rapportés sous traitement par des analogues de la GnRH, en particulier chez les femmes et les enfants. Certains de ces patients présentaient des facteurs de risque de convulsions (comme des antécédents d'épilepsie, des tumeurs intracrâniennes ou un traitement concomitant avec des médicaments connus pour présenter un risque de réactions sous forme de convulsions). Mais des cas de convulsions chez des patients ne présentant aucun facteur de risque de ce type ont également été déclarés.
Patients sous anticoagulants:
Une prudence particulière est de mise chez les sujets sous anticoagulants en raison du risque d'hématome au site d'injection.
Autres précautions
Paresthésies et migraines sévères sont rares. Dans les cas graves ou récidivants, interrompre le traitement.
Une augmentation du nombre de lymphocytes a été décrite chez des patients sous traitement par analogues de la GnRH.
Mises en garde dans le traitement du cancer de la prostate
Symptômes et complications du cancer de la prostate: Comme les autres agonistes de la GnRH, la triptoréline provoque une ascension passagère du taux de testostérone circulante au cours de la première semaine après la première injection de la forme à libération retardée du principe actif. Ce qui est également possible si l'intervalle entre 2 injections est > 1 mois. Contrairement à la chute du taux de testostérone suite à une orchidectomie, un faible pourcentage de patients (<5%) peut présenter une aggravation passagère des signes et symptômes de carcinome prostatique en raison de l'ascension initiale du taux de testostérone circulante. Ce qui se manifeste la plupart du temps par une aggravation des douleurs cancéreuses, principalement par une neuropathie, une hématurie et des douleurs osseuses pouvant être maîtrisées par un traitement symptomatique. Des cas isolés peuvent présenter une aggravation de leurs symptômes, soit une obstruction de l'uretère ou du sphincter vésical, ou une compression médullaire par métastases, pouvant s'accompagner de paralysies avec ou sans issue fatale.
Si une compression médullaire ou une insuffisance rénale se déclare, il s'agit de mettre en route un traitement standard de ces complications et d'envisager à l'extrême une orchidectomie en urgence. Un contrôle consciencieux est donc indispensable pendant les premières semaines de traitement, spécialement chez les patients souffrant de métastases vertébrales et/ou d'obstructions des voies urinaires.
Pendant la phase initiale du traitement, envisager l'administration concomitante d'un antiandrogène pour compenser l'ascension initiale du taux sérique de testostérone et prévenir l'aggravation de la symptomatologie clinique.
Ostéoporose / densité osseuse:
L'administration d'analogues de la GnRH synthétiques dans le traitement du carcinome prostatique peut provoquer une fonte osseuse pouvant aller jusqu'à l'ostéoporose et augmenter ainsi le risque de fractures. La conséquence peut être un faux diagnostic de métastases osseuses. Une attention particulière est nécessaire pour les patients présentant des facteurs de risques additionnels d'ostéoporose (comme un abus chronique d'alcool, le tabagisme, la malnutrition, des anamnèses familiales positives d'ostéoporose ou un traitement de longue durée par des médicaments réduisant la densité osseuse tels que les corticoïdes ou les anticonvulsifs).
Risque de diabètes / risque cardiovasculaire:
Des études épidémiologiques ont mis en évidence des changements métaboliques (par exemple une pertubation de la tolérance au glucose, une stéatose hépatique) et un risque accru de diabète sucré et / ou des maladies cardiovasculaires chez les hommes traités avec des agonistes de la GnRH. Il est donc conseillé de surveiller les patients souffrant d'hypertension, d'hyperlipidémie ou de troubles cardio-vasculaires à l'égard de ce risque au cours du traitement par la triptoréline.
Effet sur l'intervalle QT/QTc:
La privation d'androgène à long terme peut prolonger l'intervalle QT. Il est donc conseillé de surveiller les patients ayant un syndrome d'allongement de l'intervalle QT, des troubles électrolytiques ou une insuffisance cardiaque. L'utilisation concomitante de triptoréline avec des médicaments connus pour allonger l'intervalle QT ou capables d'induire des torsades de pointes tels que les anti-arythmiques de classe IA (ex. quinidine, disopyramide) ou de classe III (ex. amiodarone, sotalol) doit être évaluée avec précaution.
Risque d'anémie:
En raison de la privation androgénique, le traitement par les analogues de la GnRH peut augmenter le risque d'anémie. Ce risque doit être évalué chez les patients traités et faire l'objet d'une surveillance appropriée.
Mises en gardes dans le traitement de l'endométriose
Il faut déterminer l'étiologie d'éventuelles hémorragies vaginales avant l'administration de triptoréline.
Avant d'entreprendre un traitement de l'endométriose par Pamorelin LA 3,75 mg, toute éventuelle grossesse doit être exclue. Durant le traitement et après sa fin, jusqu'au rétablissement de cycles menstruels normaux, il faut recourir à des méthodes contraceptives non hormonales. Pamorelin LA 3,75 mg provoque normalement une aménorrhée; si elle persiste, les patientes doivent en informer leur médecin.
Après la ménopause un traitement médicamenteux de l'endométriose n'est indiqué que dans de rares exceptions (p.ex. dans les tumeurs productrices d'œstrogènes impliquant une réactivation de l'endométriose et si un traitement chirurgical est contre-indiqué).
Chez les patientes traitées par des analogues de la GnRH pour l'endométriose, il a été démontré que l'ajout d'un THS (un œstrogène et un progestatif) réduit la perte de densité minérale et les symptômes vasomoteurs.
L'utilisation d'agonistes de la GnRH n'est pas recommandée chez les patientes de moins de 18 ans. Une attention particulière doit être accordée aux adolescentes et aux jeunes femmes (en particulier de moins de 16 ans), qui peuvent ne pas avoir atteint leur densité minérale osseuse maximale.
Aucune donnée sur les effets cliniques d'une thérapie d'une durée supérieure à 6 mois n'est disponible. Si une durée d'utilisation plus longue est prévue la densité minérale osseuse devrait être mesurée avant le début du traitement et contrôlée au besoin à intervalles réguliers pendant le traitement. Afin d'éviter une perte de la densité osseuse due au traitement, un apport suffisant en calcium et en vitamine D (par l'alimentation) est recommandé. Il faut conseiller au besoin au patient de modifier son mode de vie en faisant p.ex. des exercices physiques réguliers entraînant une charge sur le squelette, en arrêtant de fumer et en consommant modérément de l'alcool.
Mises en gardes dans la procréation médicalement assistée
Tout risque d'hyperstimulation ovarienne ne peut être exclu, même lors d'un traitement préalable par triptoréline. Une extrême prudence (surveillance clinique et échographique) s'impose dès les premiers signes d'hyperstimulation, surtout si elle a été induite sous gonadotrophines exogènes pendant ou en fin de phase lutéinique.
Les signes cliniques et paracliniques d'une hyperstimulation même modérée sont hypovolémie, tachycardie, hypotension, oligurie, déshydratation, ascite, épanchement pleural ainsi que troubles de la fonction rénale et de la coagulation, pouvant nécessiter une hospitalisation en fonction de leur sévérité.
En cas de stimulation induite par gonadotrophines exogènes (dans le cadre de la procréation médicalement assistée), le risque de grossesse gémellaire ou ectopique est augmenté. C'est pourquoi une surveillance échographique de la grossesse s'impose au cours des 4 premières semaines.
Mises en garde dans le cancer du sein
Le traitement des femmes pré-ménopausées atteintes d'un cancer du sein exprimant des récepteurs hormonaux à un stade précoce, avec la triptoréline en association avec le tamoxifène ou un inhibiteur de l'aromatase doit faire l'objet d'une évaluation individuelle attentive des risques et des bénéfices.
Chez les patientes pré-ménopausées atteintes d'un cancer du sein, le traitement par un inhibiteur de l'aromatase ne peut être instauré qu'après avoir atteint une suppression suffisante de la fonction ovarienne grâce au traitement par la triptoréline (voir également "Posologie/Mode d'emploi" ). Pour ce faire, le traitement par la triptoréline doit être administré pendant au moins 6 à 8 semaines avant le début d'un traitement par inhibiteur de l'aromatase, et les injections de triptoréline doivent être administrées comme prévu toutes les 4 semaines et sans interruption pendant le traitement par inhibiteur de l'aromatase.
Les patientes qui ont arrêté le traitement par la triptoréline doivent également arrêter les inhibiteurs de l'aromatase dans le mois suivant la dernière administration de la triptoréline (formulation 28 jours).
Une chimiothérapie peut induire une aménorrhée passagère ou une perte durable de la fonction ovarienne liée à une atteinte cytotoxique du tissu gonadique. Néanmoins, les patientes qui sont pré-ménopausées au moment du diagnostic ou qui présentent une aménorrhée pendant la chimiothérapie peuvent parfois continuer d'avoir une production ovarienne d'œstrogènes. Indépendamment de la présence éventuelle de menstruations, il convient de s'assurer après la chimiothérapie et avant le début du traitement par la triptoréline que les concentrations d'œstradiol et de FSH (hormone folliculostimulante) se situent dans les fourchettes de référence pour les femmes pré-ménopausées, afin d'éviter un traitement inutile par la triptoréline en cas de ménopause induite par la chimiothérapie.
Après le début du traitement par la triptoréline, il est important de confirmer une suppression suffisante de la fonction ovarienne (c.-à-d. une ménopause induite par l'analogue de la GnRH) en contrôlant régulièrement les taux d'œstradiol circulant et de FSH, si l'on envisage un traitement par un inhibiteur de l'aromatase pour ce sous-groupe de patientes, conformément aux recommandations actuelles des directives cliniques.
Par conséquent, la suppression de la fonction ovarienne doit être confirmée par des taux sanguins bas de FSH et d'œstradiol avant de débuter le traitement par inhibiteur de l'aromatase et les dosages doivent être répétés tous les 3 mois pendant la durée de l'association de la triptoréline avec un inhibiteur de l'aromatase.
Ceci a pour objectif d'éviter une augmentation rebond des taux d'œstrogènes circulants induite par l'inhibiteur de l'aromatase avec des répercutions sur le cancer du sein. Il est à noter que les taux de FSH circulants sont abaissés en réponse à la suppression de la fonction ovarienne induite par l'inhibition de la fonction gonadotrope par l'analogue de la GnRH (ménopause induite), contrairement à une ménopause naturelle où les taux de FSH sont élevés.
L'hypertension a été très fréquemment rapportée comme effet indésirable faisant l'objet d'une surveillance particulière lors de l'association de la triptoréline avec l'exemestane ou le tamoxifène (voir "Effets indésirables" ). Les femmes pré-ménopausées atteintes d'un cancer du sein recevant de la triptoréline en association avec l'exémestane ou le tamoxifène doivent faire l'objet d'un suivi régulier concernant les facteurs de risque cardiovasculaire et la pression artérielle.
L'hyperglycémie et le diabète ont été fréquemment rapportés comme effets indésirables faisant l'objet d'une surveillance particulière lors de l'association de la triptoréline avec l'exémestane ou le tamoxifène (voir "Effets indésirables" ). Les femmes pré-ménopausées atteintes d'un cancer du sein recevant de la triptoréline en association avec l'exémestane ou le tamoxifène doivent faire l'objet d'un suivi régulier concernant les facteurs de risque de diabète avec une surveillance régulière de la glycémie et un traitement antidiabétique doit être initié si nécessaire, selon les recommandations nationales.
La sécurité de la triptoréline chez les femmes pré-ménopausées atteintes d'un cancer du sein avec statut positif des récepteurs hormonaux a été examinée dans deux études: SOFT et TEXT (voir "Propriétés/Effets" ). Dans tous les groupes de traitement de ces études, une dépression est survenue chez environ 50% des patientes traitées par la triptoréline en association avec le tamoxifène ou l'exemestane, mais moins de 5% des patientes présentaient une dépression sévère (grade 3-4). Les patientes doivent être informées en conséquence et traitées comme il convient en cas d'apparition de symptômes. Les patientes souffrant de dépression ou ayant des antécédents connus de dépression doivent être surveillées attentivement pendant le traitement.
Le risque de troubles musculosquelettiques (dont les douleurs articulaires ou musculosquelettiques) lorsque la triptoréline est utilisée en association avec un inhibiteur de l'aromatase ou le tamoxifène est respectivement d'environ 89% et 76%.
Une attention particulière doit également être portée aux résumés des caractéristiques du produit de l'exemestane et du tamoxifène concernant les informations de sécurité pertinentes lorsqu'ils sont administrés en association avec la triptoréline.
Excipients pharmaceutiques revêtant un intérêt particulier
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement "sans sodium" .
InteractionsInteractions pharmacodynamiques
Quand la triptoréline est coadministrée avec des médicaments affectant la sécrétion hypophysaire de gonadotrophines, une attention particulière doit être donnée et il est recommandé de superviser l'état hormonal du patient.
Interactions pharmacocinétiques
Les cytochromes P450 (CYP) sont peu probablement impliqués dans le métabolisme et l'élimination de la triptoréline. De plus, des données in vitro ont montré que la triptoréline n'est pas un inhibiteur ou un inducteur de CYP, ni un substrat ou inhibiteur de P-glycoprotéine (P-gp). Par conséquence, les interactions pharmacocinétiques avec la triptoréline sont peu probables.
Grossesse, allaitementGrossesse
Toute grossesse doit être exclue avant la prescription de Pamorelin LA 3,75 mg (voir "Contre-indications" ).
Aucune étude n'a été réalisée chez les femmes enceintes. La triptoréline est contre-indiquée pendant la grossesse, car l'utilisation des agonistes de la GnRH est associée à un risque théorique d'avortement ou d'anomalie fœtale.
Femmes en âge de procréer
Des méthodes de contraception non hormonale devront être utilisées jusqu'au retour des menstruations.
Allaitement
On ignore si la triptoréline passe dans le lait maternel ou pourrait influer sur la production de lait maternel. La triptoréline est contre-indiquée pendant l'allaitement.
Fertilité
La fertilité masculine peut être perturbée par un traitement par triptoréline. Par conséquent, les hommes devraient envisager la cryopréservation de leur sperme avant de commencer un traitement par Pamorelin LA 3,75 mg. L'expérimentation animale a démontré des effets négatifs sur les paramètres de la reproduction (voir "Données précliniques" ).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n'a été effectuée.
Mais plusieurs effets indésirables tels qu'apathie, crises épileptiques et troubles visuels peuvent atténuer les réflexes et diminuer l'aptitude à la conduite, à l'utilisation d'outils ou de machines.
Effets indésirablesGénéralités
Quelques rares réactions allergiques ont été constatées peu après l'injection de Pamorelin LA 3,75 mg, qui ont régressé sous traitement conventionnel.
Les effets indésirables les plus fréquents observés sous traitement par la triptoréline ont été attribuables à ses effets physiologiques prévus: ascension initiale du taux de testostérone, suivie d'une suppression quasi-totale de la testostérone.
Cancer de la prostate
Une aggravation des douleurs cancéreuses peut survenir pendant 7 à 10 jours après la première injection, du fait de l'augmentation passagère du taux de testostérone (voir "Mises en garde et précautions" ). Ces douleurs régressent habituellement dès que le carcinome répond au traitement. Un traitement temporaire par un antiandrogène peut être envisagé.
Les effets observés le plus fréquemment étaient les bouffées de chaleur (70%), les douleurs osseuses (26%) et la diminution des organes génitaux (12%).
Les effets indésirables suivants ont été signalés lors des essais cliniques ou de la pharmacovigilance. En fonction de leur incidence ces effets indésirables sont classés comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1'000, <1/100); rares (≥1/10'000, <1/1'000); très rares (<1/10'000), inconnus (reposant principalement sur des annonces spontanées provenant de la surveillance du marché, la fréquence précise ne pouvant être indiquée).
Infections
Fréquent: infections urinaires.
Néoplasmes
Fréquent: flambée passagère de la tumeur.
Circulation sanguine et lymphatique
Occasionnel: thrombocytose.
Rare: lymphadénopathie.
Inconnu: anémie.
Système immunitaire
Occasionnel: réactions d'hypersensibilité (voir aussi "Mises en garde et précautions" ).
Troubles endocriniens
Pendant la phase post-marketing, de rares cas d'apoplexie hypophysaire ont été décrits (voir "Mises en garde et précautions" ).
Troubles du métabolisme et de la nutrition
Fréquent: ascension de la phosphatase alcaline, hyperuricémie.
Occasionnel: hyperglycémie, ascension de l'azote uréique, diabète, ascension du taux sanguin d'azote ne provenant pas des protéines, prise pondérale.
Troubles psychiatriques
Fréquent: changements d'humeur, baisse de la libido, dépression.
Occasionnel: nervosité, amnésie, euphorie.
Système nerveux
Fréquent: céphalées, crises vertigineuses, insomnie.
Occasionnel: paresthésies, somnolence, pertes de connaissance.
Rare: migraine, dysgueusie, compression médullaire, hypoesthésie.
Inconnu: convulsions.
Troubles oculaires
Fréquent: douleurs visuelles, conjonctivite.
Rare: troubles visuels, papille de stase, perturbations du champ visuel.
Oreille
Occasionnel: acouphènes.
Troubles cardiaques
Rare: ischémie myocardique.
Inconnu: allongement de l'intervalle QT.
Troubles vasculaires
Très fréquent: bouffées de chaleur (70%).
Fréquent: hypertension.
Occasionnel: hypotension, thrombose veineuse profonde, embolie pulmonaire.
Organes respiratoires
Fréquent: toux, dyspnée, pharyngite.
Occasionnel: rhinite.
Troubles gastro-intestinaux
Fréquent: douleurs abdominales, nausée, constipation, diarrhée, dyspepsie.
Occasionnel: vomissement, ténesme, reflux gastro-oesophagien.
Troubles hépato-biliaires
Fréquent: perturbation des fonctions hépatiques.
Occasionnel: hépatite cholestatique.
Troubles cutanés et tissus sous-cutanés
Fréquent: exanthème.
Occasionnel: transpiration plus abondante, alopécie, prurit anal, eczéma, éruption bulleuse.
Rare: urticaire, réactions de photosensibilisation.
Troubles musculosquelettiques
Très fréquent: douleurs osseuses (26%).
Fréquent: dorsalgies, douleurs dans les jambes, arthralgies, myalgies, crampes musculaires des membres inférieurs.
Occasionnel: arthrose, faiblesse musculaire.
Rare: fractures pathologiques.
Troubles rénaux et urinaires
Fréquent: dysurie, rétention urinaire.
Occasionnel: pollakiurie, nycturie, troubles fonctionnels de l'urètre, incontinence urinaire, douleurs des reins, hématurie, fonction rénale anormale.
Organes de reproduction et seins
Très fréquent: diminution de volume des organes génitaux (12%).
Fréquent: impuissance, gynécomastie, douleurs de la glande mammaire
Occasionnel: troubles prostatiques, troubles testiculaires, inflammation de la glande mammaire.
Troubles généraux et accidents liés au site d'administration
Fréquent: douleurs, fatigue, douleurs dans la cage thoracique, asthénie, oedèmes (idiopathiques), douleurs au site d'injection.
Occasionnel: malaise, accentuation des problèmes postopératoires, inflammations et autres réactions au site d'injection.
Rare: douleurs périnéales.
Femmes pré-ménopausées
En raison de l'augmentation passagère des œstrogènes pendant les dix premiers jours de traitement, une intensification des troubles subjectifs peut s'observer. Ces troubles régressent également lors de l'abaissement des taux d'œstrogènes et de progestérone à un niveau équivalent à celui de la castration.
Les effets indésirables les plus fréquents observés lors du traitement par triptoréline pendant une période allant jusqu'à 5 ans en association avec le tamoxifène ou un inhibiteur de l'aromatase dans les études TEXT et SOFT étaient les bouffées de chaleur, les troubles musculosquelettiques, la fatigue, l'insomnie, l'hyperhidrose, la sécheresse vulvovaginale et la dépression.
Les fréquences des effets indésirables observés avec la triptoréline en combinaison avec tamoxifène (N = 2325) ou exemestane (N = 2318) sont montrés ci-après.
En fonction de leur incidence les effets indésirables sont classés comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1'000, <1/100); rares (≥1/10'000, <1/1'000); très rares (<1/10'000), inconnus (reposant principalement sur des annonces spontanées provenant de la surveillance du marché, la fréquence précise ne pouvant être indiquée).
Système immunitaire
Fréquent: réactions d'hypersensibilité.
Très rare: réactions allergiques.
Troubles endocriniens
Pendant la phase post-marketing, de rares cas d'apoplexie hypophysaire ont été décrits (voir "Mises en garde et précautions" ).
Troubles du métabolisme et de la nutrition
Fréquent: diabète (intolérance au glucose), hyperglycémie (traitement adjuvant du cancer du sein).
Troubles psychiatriques
Très fréquent: insomnie (58%), dépression (50% lors du traitement adjuvant du cancer du sein), perte de la libido (18-45 %), troubles émotionnels (15%).
Système nerveux
Très fréquent: céphalées (17%).
Occasionnel: ischémie cérébrale. hémorragie du système nerveux central.
Rare: migraine, paresthésies.
Inconnu: convulsions.
Troubles cardiaques
Occasionnel: ischémie myocardique.
Troubles vasculaires
Très fréquent: bouffées de chaleur (presque 100%), hypertension (22-23%).
Fréquent: embolie, autres troubles vasomoteurs.
Troubles gastro-intestinaux
Très fréquent: nausées.
Troubles hépatobiliaires:
Inconnu: fonction hépatique anormale.
Troubles cutanés et tissus sous-cutanés
Inconnu: exanthème (éruption bulleuse inclus).
Troubles musculosquelettiques
Très fréquent: trouble musculosquelettique (82%), ostéoporose (32%).
Fréquent: fracture.
Un traitement de l'endométriose de plus de 6 mois doit être évité car la chute de l'oestradiol qu'il provoque à long terme fait diminuer la densité osseuse (voir "Mises en garde et précautions" ).
Troubles rénaux et urinaires
Très fréquent: incontinence urinaire (15%).
Organes de reproduction et seins
Très fréquent: spotting (56%), sécheresse vulvo-vaginale (25-50%), dyspareunie (30%).
Troubles généraux et accidents liés au site d'administration
Très fréquent: fatigue (62%), sudation.
Fréquent: réactions au site d'injection.
Inconnu: réactions au site d'injection (rougeur, inflammation et douleur)
Description des effets indésirables spécifiques
L'ostéoporose a été rapportée avec une fréquence plus élevée lors de l'utilisation de la triptoréline en association à l'exemestane que lors de l'association au tamoxifène (39% versus 25%) (voir "Mises en garde et précautions" ).
Les troubles musculosquelettiques et les fractures ont également été plus fréquemment rapportés lors de l'association à l'exemestane que lors de l'association au tamoxifène (respectivement troubles musculosquelettiques: 89% versus 76%; fractures: 7% versus 5% respectivement)
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLes caractéristiques pharmacologiques de triptoréline rendent tout surdosage accidentel ou intentionnel improbable. L'expérimentation animale montre qu'aucun autre effet que l'effet thérapeutique prévu sur la concentration des hormones sexuelles et le système reproducteur ne se produit, même à des doses plus élevées de triptoréline.
Traitement
Un éventuel surdosage doit bénéficier d'un traitement symptomatique.
Propriétés/EffetsCode ATC
L02AE04
Mécanisme d'action
Le remplacement de l'acide aminé glycine par le D-tryptophane en position 6 de la gonadoréline donne un agoniste dont l'activité biologique est plus puissante que celle de l'hormone naturelle Gonadotropine-Releasing-Hormone (GnRH). Cette augmentation de l'effet peut être attribuée à une affinité renforcée pour les récepteurs hypophysaires et à une inactivation plus lente dans le tissu cible.
Pharmacodynamique
Lors de l'administration unique et intermittente de GnRH, la libération de LH et de FSH par l'hypophyse est stimulée. En cas de dosage continu par contre, comme cela se produit lors de la libération retardée après l'injection de Pamorelin LA 3,75 mg, un effet "paradoxal" peut être observé: les taux plasmatiques de LH, FSH, testostérone et œstrogènes/progestérone descendent au niveau de la castration en l'espace de quelque 2 semaines, après une augmentation passagère enregistrée au début du traitement.
Chez des femmes en bonne santé pré-ménopausées, le temps jusqu'à la suppression de l'oestradiol était d'environ 4,2 jours (geomean) et la durée de la suppression de l'oestradiol était d'environ 26,7 jours (geomean). Malgré une haute variabilité intersujet, globalement, 5 jours après l'injection IM de Pamorelin LA 3,75 mg, la suppression d'oestradiol était observée pour une durée d'environ 30 jours.
En médecine reproductive, la suppression hypophysaire sélective préalablement obtenue sous triptoréline dans le cadre du traitement d'un couple stérile se traduit par une amélioration du succès de la stimulation ovarienne sous gonadotrophines exogènes.
Lors de la stimulation sous gonadotrophines, en raison de la rapide augmentation de la concentration plasmatique d'oestradiol, il se produit plus souvent un pic précoce de LH accompagné d'une lutéinisation du follicule immature et le cycle thérapeutique doit être alors interrompu. Tel est le cas chez quelque 30% des patientes non traitées préalablement dans le cadre d'un programme FIV et dans 30-50% des cycles dans le syndrome polykystique ovarien. Le traitement préalable par triptoréline induit une suppression hypophysaire intégrale (downregulation) avec blocage de la libération de LH. La stimulation ovarienne est contrôlée uniquement par l'apport de gonadotrophines exogènes. Ce qui permet d'obtenir une amélioration de la maturation folliculaire, de l'activité ovocytaire et du nombre de grossesses, ainsi qu'une baisse de l'incidence du syndrome d'hyperstimulation et des interruptions de traitement.
Les dérivés embonate et acétate de triptoréline sont équivalents en matière de pharmacodynamique et de toxicité et sont interchangeables.
Efficacité clinique
Cancer de la prostate
Lors d'un essai clinique randomisé de phase III, (EORTC 22961) incluant 970 patients atteints de cancer de la prostate localement avancé (principalement T2c-T4, avec des patients T1c à T2b avec un envahissement ganglionnaire régional) et traités par radiothérapie, 483 patients ont été traités par une suppression androgénique courte (6 mois) associée et 487 patients par une suppression androgénique longue (3 ans ) associée. Globalement, la mortalité totale à 5 ans était de 19% dans le groupe "traitement hormonal court" et de 15% dans le groupe "traitement hormonal long" , soit un risque relatif de 1,42. La mortalité à 5 ans spécifiquement liée au cancer de la prostate était 4,78% dans le groupe "traitement hormonal court" et de 3,2% dans le groupe "traitement hormonal long", soit un risque relatif de 1,71.
Endométriose
Le concept thérapeutique de l'endométriose par Pamorelin LA 3,75 mg consiste en une inhibition limitée dans le temps et réversible de la libération des gonadotrophines hypophysaires. Ce qui fait que les œstrogènes et la progestérone s'abaissent à un niveau équivalent à celui de la castration. La conséquence est une amélioration des symptômes tels que dysménorrhée, ténesmes, dysurie, dyspareunie, douleurs abdominales et sacrées, ainsi que de la résorption des foyers ectopiques d'endométriose.
Cancer du sein
Des études cliniques réalisées chez des femmes pré-ménopausées atteintes d'un cancer du sein exprimant les récepteurs hormonaux à un stade précoce ont été réalisées avec la triptoréline afin de supprimer la sécrétion ovarienne d'œstradiol, principale source d'œstrogènes. Sur la base d'études réalisées chez des femmes en bonne santé et des femmes atteintes d'endométriose, l'effet de la triptoréline est atteint 3 à 4 semaines après la première administration.
Deux études de phase 3 (SOFT et TEXT) ont exploré le bénéfice de la suppression de la fonction ovarienne (SFO) sur 5 ans en association avec le tamoxifène (T) ou un inhibiteur de l'aromatase (exemestane - E) chez des femmes pré-ménopausées atteintes d'un cancer du sein exprimant les récepteurs hormonaux à stade précoce.
La triptoréline était le principal traitement utilisé pour obtenir la SFO (91,0% des sujets randomisés dans l'étude SOFT et 100% dans l'étude TEXT). Les 9% de femmes restantes de l'étude SOFT ont subi une ovariectomie bilatérale ou une irradiation ovarienne bilatérale.
L'étude SOFT comprenait n=2023 patientes ayant subis une chirurgie mammaire qui sont restées pré-ménopausées après l'achèvement de la chimiothérapie adjuvante ou néo-adjuvante et des femmes pré-ménopausées qui n'avaient pas reçu de chimiothérapie et pour qui le T adjuvant seul a été jugé un traitement approprié. Les sujets ont été randomisés pour recevoir E + SFO, T + SFO ou T seul. Dans l'étude TEXT, les femmes ont été incluses après la chirurgie mammaire et randomisées pour un traitement avec T + SFO ou E + SFO; les patientes recevant une chimiothérapie l'ont commencée concurremment avec l'analogue de la GnRH après randomisation. L'efficacité des deux études a été mesurée à l'aide du paramètre primaire de survie sans maladie (DFS) à 5 ans et des paramètres secondaires incluant l'intervalle sans cancer du sein (BCFI), l'intervalle sans récurrence (DRFI) et la survie globale (OS).
L'étude SOFT a été conçue pour répondre à la question de la valeur ajoutée de la SFO associée au tamoxifène en tant que traitement adjuvant chez des femmes pré-ménopausées atteintes d'un cancer du sein exprimant les récepteurs hormonaux à stade précoce.
Résultats de l'étude SOFT:
Cette analyse de question SFO a comparé DFS entre des sujets attribués au hasard à T + OFS versus T seul. À un suivi médian de 67 mois (5,6 ans), des cas de DFS ont été signalés pour 14,7% des sujets dans la population de l'intention de traiter (ITT).
Globalement, 53,3% des sujets ont reçu une chimiothérapie antérieure (c.-à-d. des sujets qui avaient tendance à avoir un risque élevé de récidive du cancer du sein). La différence absolue à 5 ans a été plus notable chez les sujets qui ont reçu une chimiothérapie antérieure: DFS, 80,7% (T + SFO) contre 77,1% (T seul) (tableau 1).
Tableau 1: Question SFO: Résultats d'efficacité à 67 mois pour les sujets ayant reçus une chimiothérapie antérieure (population ITT)
Paramètres d'efficac T seul N=542 T+SFO N=542 T seul vs T+SFO
ité Rapport de danger
(95% IC)
Evènements Fréquence sans Evènements Fréquence sans
évènement (%) évènement (%)
DFS[a] 122 77.1 107 80.7 0.82 (0.64 à 1.07)
BCFI 116 78.0 97 82.5 0.78 (0.60 à 1.02)
DRFI 90 83.6 82 84.8 0.87 (0.64 à 1.17)
OS[b] 57 90.9 39 94.5 0.64 (0.42 à 0.96)
BCFI= intervalle sans cancer du sein, IC= intervalle de confiance, DFS= survie sans maladie, DRFI= intervalle sans récurrence, ITT=intention de traiter, SFO= suppression de la fonction ovarienne, OS= survie globale, T=tamoxifène
a La survie sans maladie est définie comme la première occurrence d'une récurrence locale ou lointaine, d'un cancer du sein controlatéral ou d'une mort de toute cause
b Données de survie globales immatures à 67 mois.
Résultats combinés des études SOFT et TEXT
L'étude TEXT a été conçue pour évaluer le rôle des inhibiteurs de l'aromatase (AIs) (exemestane) dans le traitement adjuvant chez les femmes pré-ménopausées atteintes d'un cancer du sein exprimant les récepteurs hormonaux à stade précoce qui sont traitées avec SFO.
L'analyse de la question du AI a combiné les études TEXT et SOFT et comparé le DFS entre les sujets attribués au hasard à E + SFO versus T + SFO. L'analyse a inclus un total de 4 690 patientes.
À un suivi médian de 68 mois (5,7 ans), des événements DFS ont été signalés pour (11,0% des sujets dans la population d'ITT. Dans l'ensemble, le DFS estimé à 5 ans a été amélioré de 91,1% (95% IC, 89,7% à 92,3%) parmi les sujets assignés à E + SFO contre 87,3% (95% IC, 85,7% à 88,7%) chez les sujets assignés à T + SFO (HR = 0.717; 95% IC, 0,602 à 0,855; p = 0.0002). Le tableau 2 montre les résultats d'efficacité pour les sujets qui ont reçu une chimiothérapie antérieure dans l'analyse de l'IA.
Tableau 2: Question AI: Résultats d'efficacité à 68 mois pour les sujets ayant reçus une chimiothérapie antérieure (population ITT)
Paramètres d'efficac E+SFO N=544 T+SFO N=543 Rapport de danger
ité E+FSO vs T+SFO (95%
IC)
Evènements Fréquence sans Evènements Fréquence sans
évènement (%) évènement (%)
DFS[a] 81 84.3 98 80.6 0.838 (0.625 à
1.125)
BCFI 72 86.1 90 82.2 0.818 (0.600 à
1.116)
DRFI 61 88.0 77 84.6 0.808 (0.577 à
1.131)
OS[b] 46 91.8 35 94.1 1.387 (0.894 à
2.154)
AI= inhibiteur de l'aromatase, BCFI= intervalle sans cancer du sein, IC= intervalle de confiance, DFS= survie sans maladie, E=exemestane, DRFI= intervalle sans récurrence, ITT=intention-to-treat, SFO= suppression de la fonction ovarienne, OS= survie globale, T=tamoxifène
a La survie sans maladie est définie comme la première occurrence d'une récurrence locale ou lointaine, d'un cancer du sein controlatéral ou d'une mort de toute cause
b Données de survie globales immatures à 68 mois.
Une analyse actualisée après un suivi médian de 8 ans a confirmé les résultats de l'analyse à 5 ans.
PharmacocinétiqueAbsorption
Les pics de concentration plasmatique d'environ 30 ng/l sont atteints 1-3 heures après l'injection intramusculaire de Pamorelin LA 3,75 mg à des volontaires sains adultes de sexe masculin. Les concentrations diminuent rapidement et se stabilisent à des taux plasmatiques d'environ 0,1 ng/l qui se maintiendront pendant 1 mois au moins. Environ 80% du principe actif sont libérés pendant cet intervalle de 4 semaines. Il n'y aucun argument en faveur d'une accumulation du principe actif après administration répétée.
Chez des femmes en bonne santé pré-ménopausées, après une injection intramusculaire de Pamorelin LA 3,75 mg, des concentrations maximales de triptoréline autour de 2 heures après l'injection ont été observées, avec une valeur moyenne géométrique de la Cmax de 18,5 ng/ml.
Distribution
Après une administration intraveineuse en bolus, la distribution de la triptoréline correspond à un modèle à 3 compartiments avec des demi-vies de 6 minutes, 45 minutes et 3 heures. Le volume de distribution correspond approximativement à 30 litres à l'état d'équilibre. Dans des concentrations cliniquement relevantes la triptoréline ne se lie pas aux protéines plasmatiques.
Métabolisme
Aucun métabolite de la triptoréline n'a été découvert chez l'être humain. Mais les données pharmacocinétiques humaines montrent que les fragments C-terminaux produits par destruction tissulaire sont soit entièrement détruits dans les tissus, soit rapidement définitivement détruits dans le plasma soit éliminés par les reins. L'implication des enzymes CYP450 dans le métabolisme est peu probable.
Élimination
La triptoréline est éliminée par le foie et les reins. Après injection i.v. de 0,5 mg de triptoréline, 42% de cette dose ont été éliminés dans les urines sous forme de triptoréline non métabolisée.
La clearance totale de la triptoréline est d'environ 200 ml/min et sa demi-vie terminale de 2,8 heures.
Cinétique pour certains groupes de patients
Patients âgés
L'influence de l'âge sur la pharmacocinétique de la triptoréline n'a pas été systématiquement étudiée. Les données pharmacocinétiques recueillies sur de jeunes volontaires de sexe masculin âgés de 20 à 22 ans ayant une clairance de la créatinine supraphysiologique (env. 150 ml/min) indiquent cependant que la triptoréline est éliminée deux fois plus vite chez les jeunes, ce qui est imputable au fait que la clairance de la créatinine diminue avec l'âge.
Troubles de la fonction rénale
En cas d'insuffisance rénale, la clairance de la triptoréline diminue proportionnellement à celle de la créatinine. La demi-vie était de 6,7 heures chez les patients ayant une insuffisance rénale modérée (clearance de la créatinine moyenne de 40 ml/min) et de 7,8 heures chez les patients souffrant d'insuffisance rénale grave.
Troubles de la fonction hépatique
Chez les patients ayant une fonction hépatique limitée, l'AUC de la triptoréline était environ 3,7 fois plus élevée que chez des sujets sains et la demi-vie de triptoréline était de 7,65 heures. La part de triptoréline non métabolisée éliminée par les urines s'est accrue à 62% chez ces patients.
Données précliniquesLa toxicité aiguë de la triptoréline est très faible. Les effets observés ont essentiellement résulté du dépassement de l'effet pharmacologique de la triptoréline.
Après injection sous-cutanée de 10 µg/kg à des rates aux jours 6 à 15 de la gestation (comparativement à la dose clinique de 3,75 mg toutes les 4 semaines chez l'être humain) la triptoréline n'a eu aucun effet embryotoxique, tératogène ni foetotoxique. A 100 µg/kg par contre une diminution de la prise pondérale des mères a été observée, de même qu'une augmentation des résorptions.
Toxicité en cas d'administration répétée
Aucune étude sur la fertilité chez le rat mâle n'a été effectuée; dans les études de la toxicité chronique à des doses cliniques, la triptoréline a provoqué des lésions macro- et microscopiques des organes reproducteurs des rats et des chiens. Elles sont considérées comme reflétant la réaction à la suppression de la fonction gonadique due à l'activité pharmacologique de ce principe actif. Ces lésions ont partiellement régressé lors de la phase de récupération.
Mutagénicité
La triptoréline n'est pas mutagène, pas plus in vitro qu'in vivo.
Carcinogénicité
Une étude de carcinogenèse de 23 mois chez le rat a montré à chaque palier posologique une manifestation de presque 100% de tumeurs hypophysaires bénignes ayant entraîné la mort prématurée. Cette incidence accrue de tumeurs hypophysaires bénignes chez le rat est un effet fréquent du traitement par agonistes de la GnRH. L'importance clinique de cette observation n'est pas connue.
Administrée à des souris à des doses allant jusqu'à 6'000 µg/kg, la triptoréline n'a fait preuve d'aucun effet oncogène après 18 mois de traitement.
Toxicité sur la reproduction
A une dose 8 fois supérieure à celle recommandée chez l'être humain (par rapport à la surface corporelle), l'expérimentation animale a montré une toxicité chez le rat pour l'organogenèse (toxicité maternelle et embryotoxicité). Des cas isolés d'hydro-uretère ont été constatés chez des jeunes rats exposés in utero à des doses élevées de triptoréline.
Remarques particulièresIncompatibilités
Aucune étude de tolérance n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Influence sur les méthodes de diagnostic
La triptoréline à doses thérapeutiques provoque une suppression du système hypophyso-gonadique. La fonction normale est d'habitude rétablie après l'arrêt du traitement. Les résultats des tests fonctionnels diagnostiques hypophyso-gonadiques effectués pendant le traitement ou 4 à 12 semaines après interruption des agonistes de la GnRH peuvent donc induire en erreur.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention "EXP" sur l'emballage.
Pour des raisons microbiologiques, la suspension doit être injectée immédiatement après sa reconstitution.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25°C.
Ne pas congeler.
Conserver dans l'emballage d'origine.
Conserver le récipient fermé.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
La préparation de la suspension pour injection doit se faire immédiatement avant l'injection.
Voir le mode d'emploi illustré en fin de document.
Numéro d’autorisation52815 (Swissmedic)
PrésentationPamorelin LA 3,75 mg est délivré en 2 présentations:
-1 flacon avec poudre pour 3,75 mg de triptoréline,
-1 seringue pré-remplie contenant 2 ml de solvant,
-1 adaptateur de flacon et 2 aiguilles (1 aiguille pour administration i.m. et 1 aiguille pour administration s.c.) (A)
ou
-1 flacon avec poudre pour 3,75 mg de triptoréline,
-1 ampoule contenant 2 ml de solvant,
-1 seringue et 3 aiguilles (1 aiguille pour la reconstitution, 1 aiguille pour administration i.m. et 1 aiguille pour administration s.c.) (A)
Titulaire de l’autorisationDebiopharm Research & Manufacturing SA, 1920 Martigny
Mise à jour de l’informationMai 2025
02-010628/12
Instructions pour la préparation de la suspension
Instructions générales et recommandations
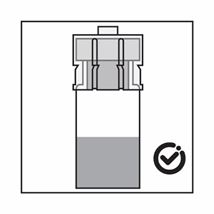
Le produit est une suspension de microparticules:
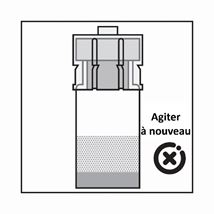
-Le produit est une suspension de microparticules qui peuvent sédimenter dans le diluant. Le produit devrait être d'apparence homogène, épaisse et laiteuse. Si le produit sédimente dans le flacon, agiter-le à nouveau:
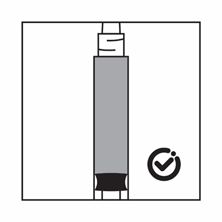
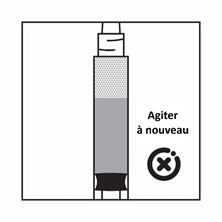
-Si les particules sédimentent dans la seringue, cela entraîne un blocage de l'aiguille lors de l'administration. Il est très important d'injecter le produit dans les 2 minutes suivant la reconstitution dans le flacon.
-Si le produit sédimente dans la seringue, reprendre un peu d'air dans la seringue, puis agiter à nouveau, et expulser l'air (sans amorcer l'aiguille) avant de l'administrer.
Instructions pour la préparation de la suspension de Pamorelin LA 3,75 mg dans la présentation avec seringue pré-remplie de solvant
1 Prendre le flacon contenant la poudre. Enlever le
couvercle plastique du flacon.
2 Retirer le film protecteur du système d'adaptation. Ne
pas retirer l'adaptateur de flacon du blister. Déposer
le flacon sur une surface plate et dure. Centrer
l'adaptateur de flacon sur le bouchon du flacon et
appuyer jusqu'à ce qu'un déclic se fasse entendre.
Retirer et éliminer le blister.
3 Prendre la seringue, la tenir par le connecteur
(rotatif) plastique entre l'index et le pouce d'une
main puis dévisser son capuchon de l'autre main. En
tenant toujours la seringue par le connecteur rotatif,
l'attacher verticalement à l'adaptateur en opérant un
demi-tour dans le sens des aiguilles d'une montre
(seulement jusqu'à ce qu'une résistance soit
ressentie). Attention un serrage excessif peut
entraîner une déconnexion et des fuites.
4 En tenant bien le flacon au niveau de l'adaptateur
d'une main, pousser le piston de la seringue de l'autre
main puis injecter lentement tout le contenu de la
seringue dans le flacon. A ce stade préparer le patient
pour l'injection. Les étapes suivantes doivent être
réalisées sans interruption.
5 Tenir tout le dispositif (seringue + adaptateur +
flacon) fermement dans la main puis agiter
levigoureusement de haut en bas pendant 30 secondes.
Vérifier l'apparence de la suspension en regardant par
le fond du flacon. La suspension devrait être
d'apparence homogène, épaisse et laiteuse. Agiter le
dispositif de nouveau en cas de sédimentation Si une
partie de la suspension remonte dans la seringue
pendant l'agitation, pousser le piston pour remettre la
suspension dans le flacon et agiter à nouveau avant de
passer à l'étape suivante. Le produit doit maintenant
être injecté dans les 2 minutes.
6 Tourner immédiatement le dispositif de sorte à ce que
le flacon soit en haut et la seringue en bas et tirer
doucement la tige du piston afin d'aspirer tout le
contenu du flacon dans la seringue.
7 Une fois tout le contenu aspiré dans la seringue,
chasser l'air de la seringue dans le flacon. S'arrêter
quand la suspension arrive à la base de la tête de la
seringue. Déconnecter la seringue de l'adaptateur en
tenant la seringue d'une main et de l'autre main
tourner l'adaptateur dans le sens inverse des aiguilles
d'une montre. En tenant la seringue par le connecteur
rotatif, attacher l'aiguille pour injection
intramusculaire (longue) ou sous-cutanée (courte).
S'assurer que le produit est homogène, épais, laiteux
et qu'il n'y a pas de sédimentation avant l'injection.
8 Déplacez la gaine de sécurité en arrière de l'aiguille
et vers le corps de la seringue. La gaine de sécurité
reste dans la position où elle a été mise. Retirer la
protection transparente de l'aiguille. Ne pas amorcer
l'aiguille avec la suspension. La seringue contenant la
suspension est maintenant prête à être administrée. La
suspension doit être administrée immédiatement (moins
de 2 minutes après reconstitution) pour éviter un
épaississement excessif de la suspension.
9 Injecter la suspension relativement rapidement et sans Intramusculaire
interruption par voie intramusculaire. Veiller à ce que Sous-cutanée
toute la quantité de produit soit injectée dans les 10
secondes sans interruption. Les sites d'injection
doivent être alternés. Utiliser l'aiguille d'injection
plus courte pour l'administration en sous-cutanée (pour
les hommes adultes uniquement). Injecter la suspension
pour injection relativement rapidement et sans
interruption. Activer le système de sécurité de
l'aiguille d'injection en centrant votre pouce ou votre
index sur la zone texturée de la gaine de sécurité et
en le poussant vers l'avant sur l'aiguille jusqu'à ce
que vous entendiez ou sentiez qu'il se verrouille.
Effectuer l'opération avec une seule main et activer le
mécanisme loin de vous et des autres. Jeter
immédiatement la seringue dans un conteneur pour objets
tranchants après une seule utilisation.
Jeter les aiguilles dans un conteneur prévu à cet effet.
A usage unique seulement. Toute suspension non utilisée doit être éliminée.
Instructions pour la préparation de la suspension de Pamorelin LA 3,75 mg dans la présentation avec ampoule de solvant
1. Préparation de l'injection2 aiguilles sont fournies dans le set:
-L'aiguille de reconstitution sans système de sécurité -L'aiguille
d'injection avec système de sécurité -Tapoter la solution se trouvant
éventuellement dans le sommet de l'ampoule pour la faire couler dans le
réservoir principal de l'ampoule de solvant. -Tourner l'aiguille sans système
de sécurité sur la seringue (ne pas encore enlever la protection de
l'aiguille!). -Casser l'ampoule de solvant (point contre soi).
-Retirer la protection de l'aiguille de reconstitution et aspirer tout le
solvant dans la seringue (fig. A). -Mettre de côté la seringue contenant le
solvant. -Prendre le flacon contenant la poudre. -Enlever le couvercle
plastique du flacon.
-Reprendre la seringue contenant le solvant et enfoncer l'aiguille dans le
bouchon en caoutchouc du flacon et injecter lentement le solvant de manière à
ce qu'il coule largement sur la paroi du flacon (fig. B). -A ce stade
préparer le patient pour l'injection. Les étapes suivantes doivent être
complétées sans interruption.
-Retirer l'aiguille en dessus du niveau du liquide et agiter vigoureusement
le flacon pendant 30 secondes. La suspension doit avoir un aspect laiteux et
homogène (fig. C). Vérifier qu'il ne reste pas de poudre dans le flacon, et
si nécessaire continuer la mise en suspension jusqu'à disparition complète de
la poudre.Attention: le mélange ne doit pas se faire par aspirations et
vidanges répétées avec la seringue! -Le produit doit maintenant être injecté
dans les 2 minutes.
-Aspirer ensuite la totalité de la suspension pour injection dans la seringue
(fig. D).
-Enlever l'aiguille de reconstitution. Tourner fermement l'aiguille à E2
injection pour injection intramusculaire (longue) ou sous-cutanée (courte)
avec système de sécurité sur la seringue (à fond). Ne saisir que la gaine de
couleur. -Déplacez la gaine de sécurité en arrière de l'aiguille et vers le
corps de la seringue (fig. E1). La gaine de sécurité reste dans la position
où elle a été mise. -Retirer la protection de l'aiguille d'injection. -Puis
administrer immédiatement l'entièreté de la seringue. -Ne pas amorcer
l'aiguille avec la suspension (fig. E2).
2. Injection -Injecter la suspension pour injection relativement rapidement Intramusculaire
et sans interruption par voie intramusculaire (fig. F). -Utiliser l'aiguille Sous-cutanée
d'injection plus courte pour l'administration en sous-cutanée (pour les
hommes adultes uniquement). Injecter la suspension pour injection
relativement rapidement et sans interruption
3. Après usage -Activer le système de sécurité de l'aiguille d'injection Ou
selon l'une des méthodes suivantes: -presser d’une main sur la sécurité vers
l’avant pour recouvrir l’aiguille et refermer la sécurité (fig. G). Toujours
garder l’index ou le pouce derrière la pointe de l’aiguille.Ou -Appuyer la
sécurité dirigée vers le bas sur une surface plane, p.ex. la table, pour
recouvrir l'aiguille et refermer la sécurité (fig. H). -La sécurité de
l'aiguille pour injection est refermée dès que la pointe de l'aiguille est
complètement recouverte (fig. I).S'en assurer par des signes audibles,
perceptibles et/ou optiques. -Jeter les aiguilles dans un conteneur prévu à
cet effet. -A usage unique seulement. Toute suspension non utilisée doit être
éliminée.
|




