CompositionPrincipe actifs
Telmisartan.
Excipients
Hydroxyde de sodium, hypromellose, sorbitol (E420), povidone K90, méglumine, mannitol (E421), stéarate de magnésium.
Telmisartan-Mepha 40 mg contient max. 2.68 mg de sodium et 19.20 mg de sorbitol par comprimé.
Telmisartan-Mepha 80 mg contient max. 5.35 mg de sodium et 38.40 mg de sorbitol par comprimé.
Indications/Possibilités d’emploiTraitement de l'hypertension artérielle légère à modérée.
Réduction du risque d'infarctus du myocarde et d'accident vasculaire cérébral chez les patients présentant un risque cardiovasculaire élevé et/ou un diabète sucré de type 2.
Posologie/Mode d’emploiAdultes
Traitement de l'hypertension artérielle légère à modérée
La posologie recommandée est de 40 mg de Telmisartan-Mepha une fois par jour à la même heure, par exemple le matin. Si l'effet est insuffisant, à savoir si la baisse tensionnelle visée n'est pas atteinte, on peut augmenter la dose jusqu'à un maximum de 80 mg.
Lors d'une augmentation de la posologie, il doit être tenu compte du fait que l'effet antihypertenseur maximal est généralement atteint quatre à huit semaines après l'instauration du traitement. Le telmisartan peut également être utilisé en association avec des diurétiques de type thiazidique, comme l'hydrochlorothiazide, ou des bloqueurs des canaux calciques, comme l'amlodipine, avec lesquels un effet antihypertenseur supplémentaire est avéré en association avec le telmisartan.
Réduction du risque d'infarctus du myocarde et d'accident vasculaire cérébral chez les patients présentant un risque cardiovasculaire élevé et/ou un diabète sucré de type 2
La dose recommandée est de 80 mg une fois par jour. On ignore si des doses inférieures à 80 mg de telmisartan par jour sont efficaces pour prévenir la morbidité et la mortalité cardiovasculaires.
Il est recommandé de surveiller la pression artérielle lors de l'instauration d'un traitement par le telmisartan visant à réduire le risque d'infarctus du myocarde et d'accident vasculaire cérébral chez les patients présentant un risque cardiovasculaire élevé et/ou un diabète sucré de type 2; un ajustement des médicaments antihypertenseurs peut éventuellement s'avérer nécessaire.
Il est recommandé de prendre Telmisartan-Mepha avec un peu de liquide. Telmisartan-Mepha peut être pris indépendamment des repas.
L'association de Telmisartan-Mepha avec d'autres antihypertenseurs a été étudiée pour l'hydrochlorothiazide et l'amlodipine et a montré qu'elle est possible.
Au cas où le patient aurait oublié de prendre Telmisartan-Mepha, il peut prendre la dose oubliée le même jour. S'il ne peut le faire, il prendra le lendemain sa dose journalière habituelle (ne pas doubler la dose!).
Remarques concernant la manipulation
Compte tenu des propriétés hygroscopiques des comprimés, ceux-ci ne doivent être retirés de l'emballage blister scellé qu'immédiatement avant l'administration.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Chez les patients souffrant d'une altération légère à modérée de la fonction hépatique, le traitement de l'hypertension artérielle ne doit pas dépasser une dose journalière de 40 mg (voir «Contre-indications»).
Patients présentant des troubles de la fonction rénale
L'expérience est limitée concernant l'utilisation chez les patients atteints d'une altération sévère de la fonction rénale ou les patients traités par hémodialyse. Chez les patients présentant une altération de la fonction rénale, un ajustement de la posologie n'est pas nécessaire.
Patients âgés
Aucun ajustement de la posologie n'est nécessaire.
Enfants et adolescents
La sécurité et l'efficacité du telmisartan pour les patients de moins de 18 ans n'ont pas été établies. Les données actuellement disponibles sont décrites dans les rubriques «Efficacité clinique» et «Pharmacocinétique»; aucune recommandation posologique ne peut cependant être fournie.
Contre-indications·Deuxième et troisième trimestres de la grossesse (voir «Grossesse, Allaitement»)
·Allaitement (voir «Grossesse, Allaitement»)
·Troubles sévères de la fonction hépatique, maladies obstructives des voies biliaires, cholestase
·Hypersensibilité au principe actif ou à l'un des autres composants de Telmisartan-Mepha
·Comme pour tous les bloqueurs des récepteurs de l'angiotensine II, si un œdème angioneurotique est survenu lors d'un traitement antérieur par un inhibiteur de l'ECA ou un bloqueur des récepteurs de l'angiotensine II.
·L'utilisation concomitante du telmisartan avec des médicaments contenant de l'aliskirène est contre-indiquée chez les patients atteints de diabète sucré ou insuffisants rénaux (DFG <60 ml/min/1,73 m²).
Mises en garde et précautionsGrossesse
Un traitement par bloqueurs des récepteurs de l'angiotensine II ne doit pas être commencé pendant une grossesse. Chez les patientes qui envisagent une grossesse, le traitement antihypertenseur doit être modifié en faveur d'un autre traitement hypotenseur présentant un profil de sécurité établi pour les femmes enceintes, à moins qu'une poursuite du traitement par des bloqueurs des récepteurs de l'angiotensine II ne soit considérée comme indispensable. Si une grossesse est constatée, le traitement par bloqueurs des récepteurs de l'angiotensine II doit être immédiatement arrêté et remplacé, le cas échéant, par un autre traitement.
Patients avec déplétion sodée et/ou hypovolémie
Chez les patients souffrant de déplétion sodée et/ou d'hypovolémie sévère (p.ex. lors d'un traitement par des diurétiques à fortes doses, de diarrhées et de vomissements, de régime hyposodé), une hypotension symptomatique peut apparaître après le début d'un traitement par des inhibiteurs du système rénine-angiotensine. La déplétion sodée et/ou l'hypovolémie sont à corriger avant d'entreprendre un traitement par Telmisartan-Mepha. Si cela s'avère opportun, la dose du diurétique doit être réduite provisoirement.
Hypertension rénovasculaire
Les patients, atteints de sténose bilatérale ou unilatérale de l'artère rénale en cas de rein unique, qui suivent un traitement par des médicaments exerçant une influence sur le système rénine-angiotensine-aldostérone, présentent un risque accru d'hypotension sévère et d'insuffisance rénale.
Altération de la fonction rénale et greffe du rein
Suite à l'inhibition du système rénine-angiotensine-aldostérone, il faut s'attendre à des modifications de la fonction rénale chez les patients prédisposés. Un contrôle périodique de la kaliémie et du taux de créatinine sérique est recommandé. À ce jour, on ne dispose pas d'expérience concernant le traitement des patients ayant subi une greffe du rein.
Le telmisartan n'est pas éliminé du sang par hémofiltration et n'est pas dialysable.
Double inhibition du système rénine-angiotensine-aldostérone (SRAA)
Certains éléments indiquent que l'administration concomitante d'inhibiteurs de l'ECA, de bloqueurs des récepteurs de l'angiotensine II ou d'aliskirène accroît le risque d'hypotension, d'hyperkaliémie et de diminution de la fonction rénale (y compris la défaillance rénale aiguë). Une double inhibition du SRAA par l'administration concomitante d'inhibiteurs de l'ECA, de bloqueurs des récepteurs de l'angiotensine II ou d'aliskirène n'est donc pas recommandée (voir «Interactions»).
Si le traitement par une double inhibition est jugé absolument nécessaire, il exige une surveillance par un spécialiste ainsi que des contrôles étroits de la fonction rénale, des taux d'électrolytes et de la tension artérielle.
Les inhibiteurs de l'ECA et les bloqueurs des récepteurs de l'angiotensine II ne doivent pas être utilisés concomitamment chez les patients présentant une néphropathie diabétique.
Autres situations avec stimulation du système rénine-angiotensine-aldostérone
Chez les patients dont le tonus vasculaire et la fonction rénale sont pour l'essentiel liés à l'activité du système rénine-angiotensine-aldostérone (p.ex. les patients souffrant d'insuffisance cardiaque sévère ou de néphropathie sous-jacente, y compris une sténose de l'artère rénale), un traitement par des médicaments agissant sur ce système a été associé à une hypotension aiguë, une hyperazotémie, une oligurie ou dans de rares cas, à une défaillance rénale aiguë.
Aldostéronisme primaire
Les patients atteints d'aldostéronisme primaire ne répondent en général pas aux antihypertenseurs dont l'effet repose sur l'inhibition du système rénine-angiotensine. De ce fait, l'utilisation du telmisartan n'est pas recommandée.
Sténose aortique ou mitrale, cardiomyopathie hypertrophique obstructive
Comme pour d'autres vasodilatateurs, la prudence est de mise chez les patients atteints de sténose aortique ou mitrale ou de cardiomyopathie hypertrophique obstructive.
Hyperkaliémie
Au cours du traitement par des médicaments agissant sur le système rénine-angiotensine-aldostérone, une hyperkaliémie peut apparaître, en particulier chez les patients souffrant d'une altération de la fonction rénale et/ou d'insuffisance cardiaque. Un contrôle adéquat de la kaliémie est recommandé chez les patients à risque.
En vertu de l'expérience acquise avec des médicaments intervenant dans le système rénine-angiotensine, l'administration concomitante de diurétiques d'épargne potassique, de supplémentation en potassium, de substituts de sel contenant du potassium ou d'autres médicaments pouvant donner lieu à une élévation de la kaliémie (héparine, etc.), peut entraîner une augmentation du potassium sérique. C'est pourquoi ces médicaments ne doivent être administrés qu'avec prudence en concomitance avec Telmisartan-Mepha.
Altération de la fonction hépatique
Le telmisartan est principalement éliminé par voie biliaire. La clairance du produit est susceptible d'être réduite chez les patients atteints de troubles obstructifs de la fonction biliaire, de cholestase ou d'insuffisance hépatique grave. Telmisartan-Mepha ne doit pas être utilisé chez ces patients (voir «Contre-indications»). Telmisartan-Mepha doit être administré avec prudence en cas de trouble léger à modéré de la fonction hépatique.
Diabète sucré
Comme l'ont montré des analyses post-hoc de deux études sur le telmisartan contrôlées contre placebo, chez les patients atteints de diabète sucré n'ayant, dans leurs antécédents médicaux, ni maladie coronarienne ni infarctus du myocarde connus et ne prenant pas d'acétylsalicylique, pas de bêta-bloquants et pas de nitrates, en cas de traitement concomitant par le telmisartan, le risque d'infarctus du myocarde fatals et de décès cardiovasculaires inattendus (décès pour lesquels une cause cardiovasculaire ischémique a été supposée, mais non confirmée qui sont survenus dans les 24 heures suivant les premiers symptômes et pour lesquels aucune autre étiologie n'a été attestée) est accru (ratio de risque 3.25; intervalle de confiance à 95% 1.38-7.65). Chez les patients atteints de diabète sucré, la maladie coronarienne peut avoir un déroulement asymptomatique et ne donc pas être diagnostiquable. En conséquence, les patients atteints de diabète sucré doivent subir un diagnostic en ce sens et bénéficier d'un traitement approprié avant qu'un traitement par Telmisartan-Mepha puisse commencer.
Différences ethniques
Comme cela est observé avec les inhibiteurs de l'enzyme de conversion de l'angiotensine, les bloqueurs des récepteurs de l'angiotensine, y compris le telmisartan, sont manifestement moins efficaces chez les patients à peau foncée que chez les patients blancs. Cela est probablement imputable à la plus forte prévalence de taux de rénine faibles chez les patients hypertendus de ce groupe de population.
Cardiopathie ischémique
Comme avec tout médicament hypotenseur, une chute excessive de la pression artérielle chez les patients atteints de cardiopathie ischémique ou de maladie cardiovasculaire ischémique peut conduire à un infarctus du myocarde ou à un accident vasculaire cérébral.
Angiœdème intestinal
Des cas d'angiœdèmes intestinaux ont été rapportés chez des patients traités par des antagonistes des récepteurs de l'angiotensine II (voir «Effets indésirables»). Ces patients présentaient des douleurs abdominales, des nausées, des vomissements et de la diarrhée. Les symptômes se sont résolus après l'arrêt des antagonistes des récepteurs de l'angiotensine II. Si un angiœdème intestinal est diagnostiqué, Telmisartan-Mepha doit être arrêté et une surveillance appropriée doit être mise en œuvre jusqu'à disparition complète des symptômes.
Sorbitol
Telmisartan-Mepha 40 mg contient 19.20 mg de sorbitol par comprimé. Telmisartan-Mepha 80 mg contient 38.4 mg de sorbitol par comprimé.
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par comprimé, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsAucune interaction significative d'un point de vue clinique n'a été mise en évidence lors de l'administration concomitante du telmisartan avec les substances suivantes:
hydrochlorothiazide, glibenclamide, ibuprofène, paracétamol, warfarine, amlodipine et simvastatine.
Autres antihypertenseurs
Le telmisartan peut renforcer l'effet hypotenseur d'autres antihypertenseurs.
Digoxine
Une augmentation de 20% (39% dans un seul cas) des concentrations plasmatiques minimales moyennes de digoxine a été observée. Pour cette raison, un contrôle des taux plasmatiques de digoxine est à prendre en considération.
Ramipril
Dans une étude, l'administration concomitante de telmisartan et de ramipril a multiplié jusqu'à 2.5 fois l'AUC0-24 et la Cmax du ramipril et du ramiprilate. La signification clinique de cette observation n'est pas connue; pour des raisons de sécurité, cette association ne doit être utilisée qu'avec prudence (voir «Mises en garde et précautions»).
Lithium
Une augmentation réversible de la concentration sérique du lithium et de sa toxicité a été rapportée lors de l'administration concomitante de lithium et d'inhibiteurs de l'enzyme de conversion de l'angiotensine. Quelques cas ont été signalés sous bloqueurs des récepteurs de l'angiotensine II, y compris les préparations de telmisartan. Un contrôle attentif des taux sériques de lithium est recommandé en cas d'administration concomitante.
Médicaments pouvant augmenter la kaliémie ou provoquer une hyperkaliémie
Les diurétiques d'épargne potassique, les préparations à base de potassium, les substituts du sel ou d'autres médicaments comme l'héparine peuvent augmenter la kaliémie. Cet effet peut être potentialisé par le telmisartan qui influence le système rénine-angiotensine (voir «Mises en garde et précautions»).
Anti-inflammatoires non stéroïdiens (AINS)
Le traitement par des anti-inflammatoires non stéroïdiens (c'est-à-dire l'acide acétylsalicylique à des doses anti-inflammatoires, les inhibiteurs de la COX-2 et les AINS non sélectifs) a été associé à un risque d'insuffisance rénale aiguë chez des patients déshydratés. Des substances telles que le telmisartan, qui influencent le système rénine-angiotensine, peuvent présenter des actions synergiques. Les patients qui reçoivent des anti-inflammatoires non stéroïdiens et Telmisartan-Mepha doivent être suffisamment hydratés et la fonction rénale doit être contrôlée au début du traitement combiné.
En raison de l'inhibition des prostaglandines vasodilatatrices, une diminution de l'effet des médicaments antihypertenseurs tels que des préparations de telmisartan a été observée lors de l'administration concomitante avec des anti-inflammatoires non stéroïdiens.
Double inhibition du système rénine-angiotensine-aldostérone (SRAA)
Certains éléments indiquent que l'administration concomitante d'inhibiteurs de l'ECA, de bloqueurs des récepteurs de l'angiotensine II ou d'aliskirène accroît le risque d'hypotension, d'hyperkaliémie et de diminution de la fonction rénale (y compris la défaillance rénale aiguë). Une double inhibition du SRAA par l'administration concomitante d'inhibiteurs de l'ECA, de bloqueurs des récepteurs de l'angiotensine II ou d'aliskirène n'est donc pas recommandée.
Si le traitement par une double inhibition est jugé absolument nécessaire, il exige une surveillance par un spécialiste ainsi que des contrôles étroits de la fonction rénale, des taux d'électrolytes et de la tension artérielle.
Les inhibiteurs de l'ECA et les bloqueurs du récepteur de l'angiotensine II ne doivent pas être utilisés concomitamment chez les patients présentant une néphropathie diabétique (voir «Mises en garde et précautions»).
Grossesse, allaitementGrossesse
Les études précliniques réalisées avec le telmisartan n'ont pas révélé d'effet tératogène. Elles ont cependant montré une fœtotoxicité.
Il n'existe pas de données suffisantes concernant l'emploi du telmisartan chez la femme enceinte.
On sait que les bloqueurs des récepteurs de l'angiotensine II, administrés pendant le deuxième et le troisième trimestres de la grossesse, sont toxiques pour le fœtus humain (diminution de la fonction rénale, oligohydramnios, retard d'ossification du crâne) et le nouveau-né (défaillance rénale, hypotension, hyperkaliémie).
L'utilisation de bloqueurs des récepteurs de l'angiotensine II est contre-indiquée pendant le deuxième et le troisième trimestres de la grossesse.
L'utilisation de bloqueurs des récepteurs de l'angiotensine II pendant le premier trimestre de la grossesse n'est pas recommandée et ne doit pas être commencée pendant la grossesse. En cas de survenue d'une grossesse, le traitement par les bloqueurs des récepteurs de l'angiotensine II doit être arrêté immédiatement et, le cas échéant, un autre traitement doit être instauré.
Dans la mesure où un traitement par des bloqueurs des récepteurs de l'angiotensine II n'est pas considéré comme étant absolument nécessaire, il est recommandé de modifier le traitement antihypertenseur chez les patientes qui envisagent une grossesse en utilisant d'autres antihypertenseurs ayant un profil de sécurité établi pendant la grossesse.
En cas d'exposition à des bloqueurs des récepteurs de l'angiotensine II à partir du deuxième trimestre de la grossesse, il est recommandé de réaliser un contrôle échographique de la fonction rénale et du crâne.
Les nourrissons, dont les mères ont pris des bloqueurs des récepteurs de l'angiotensine II, doivent être étroitement surveillés afin de dépister une hypotension.
Allaitement
Le telmisartan est contre-indiqué pendant l'allaitement, car on ne sait pas si le telmisartan est excrété dans le lait maternel chez la femme. Des études chez l'animal ont montré une excrétion du telmisartan dans le lait maternel.
Fertilité
Aucune étude portant sur la fertilité n'a été effectuée chez l'être humain.
Dans les études précliniques, aucun effet du telmisartan sur la fertilité masculine ou féminine n'a été observé.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude portant sur l'effet sur l'aptitude à la conduite et l'utilisation de machines n'a été effectuée. Toutefois, il faut tenir compte du fait qu'un traitement antihypertenseur peut occasionnellement provoquer des vertiges ou un évanouissement et que, par conséquent, la conduite de véhicules et l'utilisation de machines peuvent être influencées.
Effets indésirablesLa fréquence des effets secondaires n'était pas dose-dépendante et n'était pas corrélée avec le sexe, l'âge ou la race des patients.
Dans les études cliniques contrôlées contre placebo chez des patients traités pour une hypertension artérielle, l'incidence totale des événements indésirables du telmisartan était comparable à celle du placebo.
Le profil de sécurité du telmisartan chez les patients ayant participé au programme d'études ONTARGET englobant plus de 31 000 patients, correspondait à celui observé chez des patients hypertendus.
Les effets indésirables mentionnés ci-dessous proviennent d'essais cliniques contrôlés chez des patients traités pour une hypertension artérielle et de rapports post-marketing. Les effets indésirables sévères et ceux ayant conduit à une interruption du traitement, rapportés dans trois études cliniques au long cours, ont également été pris en considération dans l'énumération. 21'642 patients ont été inclus dans ces études et traités par le telmisartan pendant une durée allant jusqu'à six ans.
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante:
«très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10 000 à <1/1000), «très rares» (<1/10 000).
La fréquence des effets indésirables qui n'ont pas été observés dans les études cliniques, mais qui ont été rapportés spontanément après la mise sur le marché, n'est pas connue.
Infections et infestations
Occasionnels: Infection des voies respiratoires supérieures, infection des voies urinaires, cystite.
Rares: Tableaux cliniques septiques, également d'issue fatale.
Affections hématologiques et du système lymphatique
Occasionnels: Anémie.
Rares: Thrombocytopénie, éosinophilie.
Affections du système immunitaire
Rares: Hypersensibilité, réaction anaphylactique.
Troubles du métabolisme et de la nutrition
Occasionnels: Hyperkaliémie.
Rares: Hypoglycémie (chez les diabétiques), hyponatrémie.
Affections psychiatriques
Occasionnels: Insomnie, dépression.
Rares: Anxiété.
Affections du système nerveux
Occasionnels: Syncopes/évanouissements.
Affections oculaires
Rares: Troubles visuels.
Affections de l'oreille et du labyrinthe
Occasionnels: Vertiges.
Affections cardiaques
Occasionnels: Hypotension (y compris hypotension orthostatique), bradycardie.
Rares: Tachycardie.
Affections vasculaires
Occasionnels: Hypotension (y compris hypotension orthostatique).
Affections respiratoires, thoraciques et médiastinales
Occasionnels: Dyspnée.
Affections gastro-intestinales
Occasionnels: Douleurs abdominales, diarrhée, dyspepsie, ballonnements, vomissements.
Rares: Sécheresse buccale, troubles gastriques.
Fréquence inconnue: Angiœdème intestinal.
Affections hépatobiliaires
Rares: Fonction hépatique anormale/affection hépatique.
Affections de la peau et du tissu sous-cutané
Occasionnels: Hyperhidrose, prurit, rash.
Rares: Eczéma, érythème, exanthème médicamenteux, angio-œdème (d'issue fatale), exanthème cutané toxique, urticaire.
Affections musculo-squelettiques et systémiques
Occasionnels: Myalgie, crampes musculaires (crampes dans les mollets), dorsalgies.
Rares: Arthralgie, douleurs dans les extrémités (douleurs dans les jambes), douleur tendineuse (symptômes de pseudotendinite).
Affections du rein et des voies urinaires
Occasionnels: Altération rénale, y compris défaillance rénale aiguë.
Troubles généraux et anomalies au site d'administration
Occasionnels: Douleurs thoraciques, asthénie (faiblesse).
Rares: Affection pseudogrippale.
Investigations
Occasionnels: Augmentation des taux sanguins de créatinine.
Rares: Augmentation des taux sanguins d'acide urique, des enzymes hépatiques ou de la créatine phosphokinase, baisse des taux d'hémoglobine.
Description de certains effets indésirables
Angiœdème intestinal
Des cas d'angiœdème intestinal ont été rapportés après l'utilisation d'antagonistes des récepteurs de l'angiotensine II (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageOn ne dispose que d'une expérience limitée concernant les cas de surdosage chez l'homme.
Signes et symptômes
Les manifestations les plus importantes lors d'un surdosage de telmisartan ont été l'hypotension et la tachycardie; des cas de bradycardie sont également survenus.
Traitement
En cas d'hypotension symptomatique, un traitement de soutien doit être mis en place. Le telmisartan ne peut pas être éliminé par hémodialyse et n'est pas dialysable.
Propriétés/EffetsCode ATC
C09CA07
Mécanisme d'action
Le telmisartan est un bloqueur efficace par voie orale et spécifique du récepteur de l'angiotensine II (type AT1). Le telmisartan déplace avec une très forte affinité l'angiotensine II de son site de fixation sur le récepteur AT1, responsable des effets connus de l'angiotensine II. Le telmisartan n'a aucun effet agoniste partiel sur le récepteur AT1. Il ne présente aucune affinité notable pour d'autres récepteurs. Il n'inhibe pas la rénine plasmatique humaine et ne bloque pas les canaux ioniques. Le telmisartan n'inhibe pas l'enzyme de conversion de l'angiotensine (kininase II), enzyme également responsable de la dégradation de la bradykinine.
Au cours des essais cliniques, l'incidence de la toux sèche a été nettement moindre chez les patients traités par telmisartan que chez les patients traités par d'autres inhibiteurs de l'ECA. L'incidence de la toux sèche chez les patients traités par telmisartan a été comparable à celle du groupe placebo.
Pharmacodynamique
Traitement de l'hypertension artérielle légère à modérée
Chez l'homme, une dose de 80 mg de telmisartan inhibe presque totalement l'augmentation de la pression artérielle engendrée par l'angiotensine II. L'effet inhibiteur se maintient 24 heures et reste mesurable 48 heures après la prise.
Après la première prise, l'effet antihypertenseur se manifeste progressivement au cours des 3 premières heures. En général, la réduction maximale de la pression artérielle est obtenue 4 à 8 semaines après le début du traitement et persiste en cas de traitement au long cours.
Les mesures de la pression artérielle effectuées sur une longue période ont montré que l'effet antihypertenseur est constant au cours des 24 heures suivant l'administration, y compris pendant les 4 dernières heures qui précèdent l'administration suivante. Les rapports pic/vallée mesurés au cours des études cliniques contrôlées contre placebo, uniformément supérieurs à 80% après administration de 40 mg et 80 mg de telmisartan, le confirment.
Chez les patients souffrant d'hypertension artérielle, le telmisartan abaisse la pression artérielle systolique et diastolique sans effet sur la fréquence du pouls. Après interruption du traitement par telmisartan, la pression artérielle revient progressivement en l'espace de quelques jours à sa valeur initiale. Il n'existe aucun indice de réaction excessive de la pression artérielle après interruption du traitement (rebond).
Dans des études cliniques incluant des patients présentant une hypertension artérielle et une hypertrophie cardiaque gauche, il a été démontré que le traitement par telmisartan est associé à une diminution statistiquement significative de la masse ventriculaire gauche et de l'index de masse ventriculaire gauche.
Réduction du risque d'infarctus du myocarde et d'accident vasculaire cérébral chez des patients présentant un risque cardiovasculaire élevé et/ou un diabète sucré de type 2
Efficacité clinique
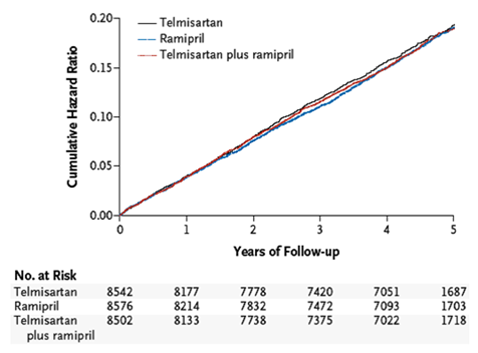
Dans l'étude ONTARGET, une étude clinique comparative, randomisée, en double aveugle, versus l'inhibiteur de l'ECA ramipril, le bloqueur du récepteur de l'angiotensine II telmisartan s'est avéré aussi efficace que le ramipril pour réduire le critère d'évaluation composite primaire (mortalité cardiovasculaire, infarctus du myocarde aigu, accident vasculaire cérébral et hospitalisation pour insuffisance cardiaque) et plusieurs critères d'évaluation secondaires prédéfinis, tout en présentant une meilleure tolérance et une meilleure observance au traitement.
Dans la population globale des patients testés dans l'étude ONTARGET, l'association des deux médicaments n'a pas entraîné de diminution supplémentaire des événements cardiovasculaires, mais le profil d'effets secondaires s'est modifié de manière défavorable, ce qui explique pourquoi l'utilisation d'une association de telmisartan et de ramipril n'est pas recommandée dans cette population.
Dans cette étude incluant à l'échelle mondiale 25'620 patients présentant un risque cardiovasculaire élevé et une tension artérielle normale ou bien contrôlée ont été évalués pendant une période de suivi de 56 mois en moyenne.
Les patients présentant une intolérance aux inhibiteurs de l'ECA ont été exclus de l'étude pendant la phase de screening et une «phase de run-in en simple aveugle» de 28 jours, puis les patients restants ont été randomisés dans l'un des trois bras thérapeutiques suivants:
·8576 patients ont reçu 10 mg de ramipril
·8542 patients ont reçu 80 mg de telmisartan
·8502 patients ont reçu le traitement combiné
La population examinée se composait de 73% d'hommes et 83% des patients étaient hypertendus. Une grande partie des patients avaient déjà été traités avant le début de l'étude par des antiagrégants plaquettaires (80%), des statines (62%), des bêtabloquants (57%), des diurétiques (28%), des bloqueurs du calcium (33%)
Le faible taux de «cas perdus de vue au cours du suivi» (0.19% = 48 patients sur 25'620) montre la qualité élevée des résultats de l'étude.
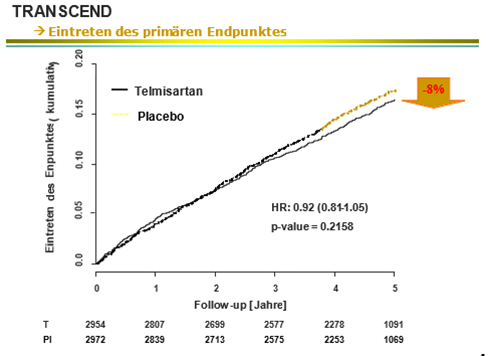
L'étude TRANSCEND réalisée parallèlement a évalué la réduction du risque du même critère composite primaire, provoquée par 80 mg de telmisartan versus un traitement standard qui pouvait être adapté au cours de l'étude, chez 5926 patients à risque qui ne se différenciaient de la population de l'étude ONTARGET que par une intolérance à un inhibiteur de l'ECA et une proportion élevée de femmes de 43%.
L'analyse a montré que l'utilisation de telmisartan permettait, malgré un traitement standard optimisé, une réduction du risque de 8% concernant les critères évalués.
PharmacocinétiqueAbsorption
Le telmisartan est absorbé avec une valeur tmax médiane de 1 heure. La quantité absorbée varie d'un individu à l'autre et pour un même individu. Après l'administration d'une dose de 80 mg, les pics plasmatiques obtenus sont de 160 µg/ml chez les hommes et de 440 µg/ml chez les femmes (Cmax). Les concentrations plasmatiques bien que 2 à 3 fois plus élevées chez les femmes que chez les hommes n'ont pas d'influence notable ni sur l'efficacité ni sur la sécurité. La biodisponibilité absolue moyenne du telmisartan s'élève à 42% après une dose de 40 mg et à 57% après une dose de 160 mg (intervalle de confiance à 95%, à savoir 32-57 et 51-65%).
Lorsque le telmisartan est pris avec des aliments, la surface sous la courbe de la concentration du telmisartan en fonction du temps (ASC0-∞) diminue légèrement entre 6 % environ pour une dose de 40 mg et 19% environ pour une dose de 160 mg. Les concentrations plasmatiques sont similaires trois heures après la prise, que le telmisartan ait été pris à jeun ou avec des aliments.
Cette faible diminution de l'ASC n'a pas d'influence sur l'effet thérapeutique.
À des posologies supérieures à 40 mg, la concentration plasmatique maximale Cmax et, dans une moindre mesure, la surface sous la courbe des concentrations plasmatiques en fonction du temps (ASC) n'augmentent pas de façon proportionnelle avec la dose. Il n'existe pas d'indice témoignant d'une accumulation clinique significative avec une posologie allant jusqu'à 160 mg/jour.
Distribution
Le telmisartan est fortement lié aux protéines plasmatiques, principalement à l'albumine et à l'alpha-1-glycoprotéine acide (>99.5%). Le volume de distribution à l'état d'équilibre (Vdss) est de l'ordre de 500 l.
Métabolisme
Le telmisartan est métabolisé par glucuronoconjugaison. Aucune activité pharmacologique n'a été mise en évidence pour le métabolite.
Élimination
Le telmisartan est caractérisé par une dégradation cinétique bi-exponentielle avec une demi-vie d'élimination terminale > 20 heures (t½ term).
Après administration orale (et intraveineuse), le telmisartan est presque exclusivement excrété par les fèces, principalement sous forme inchangée. L'excrétion urinaire cumulée représente moins de 1% de la dose. La clairance plasmatique (Cltot) est élevée (env. 1000 ml/min) comparativement au débit sanguin hépatique (env. 1500 ml/min).
Cinétique pour certains groupes de patients
Enfants et adolescents
La pharmacocinétique de deux doses de telmisartan a été évaluée comme second objectif chez des patients hypertendus (n = 57) âgés de 6 à < 18 ans après la prise de 1 mg/kg ou de 2 mg/kg de telmisartan sur une période de traitement de quatre semaines. La détermination de l'état d'équilibre du telmisartan chez les enfants et les adolescents et l'examen des différences dues à l'âge faisaient partie des objectifs pharmacocinétiques. Bien qu'en raison de sa petite taille l'étude ne permette pas une évaluation pertinente de la pharmacocinétique chez les enfants âgés de moins de 12 ans, les résultats coïncidaient en général avec les résultats obtenus chez les adultes et confirment la non-linéarité du telmisartan, en particulier pour la Cmax.
Troubles de la fonction hépatique
Les études pharmacocinétiques réalisées chez des patients souffrant d'une altération de la fonction hépatique ont démontré une augmentation de la biodisponibilité absolue de près de 100% (Cmax + ASC augmentées) (voir «Contre-indications», «Mises en garde et précautions»). En revanche, la demi-vie d'élimination est pratiquement inchangée.
Troubles de la fonction rénale
Chez les patients insuffisants rénaux dialysés, de plus faibles concentrations plasmatiques ont été observées. Le telmisartan reste fortement lié aux protéines plasmatiques chez les patients insuffisants rénaux et ne peut être éliminé par hémodialyse.
Sexe
Différentes concentrations plasmatiques ont été observées. Chez les femmes, la Cmax est environ trois fois supérieure et l'ASC environ deux fois supérieure à celle des hommes; un effet significatif de cette différence sur l'efficacité n'a toutefois pas été constaté.
Patients âgés
Il n'existe aucune différence concernant la pharmacocinétique du telmisartan entre les patients jeunes et âgés.
Données précliniquesIl n'existe aucun indice d'effet mutagène et d'activité clastogène significative dans les études in vitro et aucun indice d'effet carcinogène chez les rats et les souris.
Il n'existe aucun indice clair de potentiel tératogène ou embryotoxique pour le telmisartan. À des doses toxiques, les expérimentations animales indiquent toutefois un certain risque potentiel du telmisartan pour le développement fœtal (incidence accrue de résorptions tardives chez le lapin) et pour le développement postnatal de la descendance des animaux traités par le telmisartan: poids corporel plus faible, ouverture des yeux retardée, mortalité plus importante.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine. Ne pas conserver au-dessus de 30°C. Conserver hors de la portée des enfants.
Numéro d’autorisation62921 (Swissmedic).
PrésentationTelmisartan-Mepha à 40 mg: 30 et 100 comprimés (sécables, avec rainure de fragmentation) [B]
Telmisartan-Mepha à 80 mg: 30 et 100 comprimés (sécables, avec rainure de fragmentation) [B]
Titulaire de l’autorisationMepha Pharma AG, Basel.
Mise à jour de l’informationMai 2025.
Numéro de version interne: 9.1
|


