Propriétés/EffetsCode ATC
A06AX04
Mécanisme d'action
Le linaclotide est un agoniste du récepteur de la guanylate cyclase de type C (GC-C) avec une activité analgésique au niveau viscéral et une activité sécrétoire.
Le linaclotide est un peptide synthétique de 14 acides aminés structurellement lié à la famille du peptide endogène guanyline. Le linaclotide de même que son métabolite actif se lient tous deux au récepteur GC-C, à la surface luminale de l'épithélium intestinal. Par son action sur le GC-C, le linaclotide a entraîné une réduction de la douleur viscérale et une accélération du transit gastro-intestinal dans les modèles animaux. De même il a été montré qu'il entraînait une accélération du transit colique chez l'être humain. L'activation de la protéine GC-C induit une augmentation des concentrations tant extracellulaire qu'intracellulaire de guanosine monophosphate cyclique (GMPc). Il est admis que la GMPc extracellulaire inhibe l'activité des fibres nociceptives, entraînant une réduction de la douleur viscérale dans les modèles animaux. La GMPc intracellulaire stimule la sécrétion de chlorure et de bicarbonates dans la lumière intestinale, via l'activation du CFTR (cystic fibrosis transmembrane conductance regulator), qui entraîne un accroissement du liquide intestinal et une accélération du transit colique.
Pharmacodynamique
Dans une étude en cross-over d'interaction avecl'alimentation, 18 sujets en bonne santé ont reçu 290 µg d'Axulta pendant 7 jours, à jeun ou après avoir mangé. Par rapport à la prise du médicament à jeun, la prise d'Axulta immédiatement après un petit-déjeuner riche en lipides a provoqué des selles plus fréquentes et plus molles ainsi qu'un plus grand nombre d'effets indésirables gastro-intestinaux.
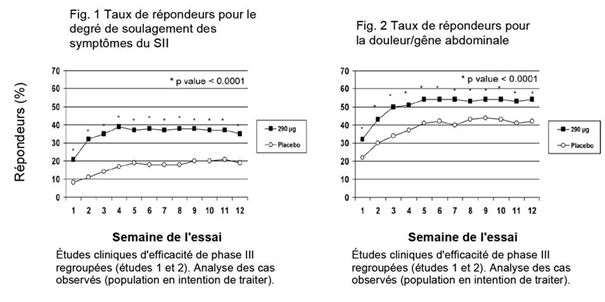
Efficacité clinique
L'efficacité du linaclotide a été démontrée dans deux études cliniques de phase III randomisées, en double aveugle, contrôlées contre placebo, chez des patients atteints de SII-C. Dans la première de ces études cliniques (étude 1), 802 patients ont été traités par 290 µg d'Axulta ou un placebo, une fois par jour pendant 26 semaines. Dans la seconde étude clinique (étude 2), 800 patients ont été traités pendant 12 semaines par 290 µg d'Axulta ou un placebo, puis à nouveau randomisés pour une période supplémentaire de 4 semaines. Pendant les 2 semaines de la période d'inclusion précédant le début du traitement, les patients présentaient un score moyen de douleurs abdominales de 5,6 (sur une échelle de 0 à 10), un score moyen de ballonnement de 6,6 (sur une échelle de 0 à 10), et une moyenne de 1,8 selles spontanées par semaine et, en moyenne, il n'y avait pas de douleurs abdominales pendant 2,2 % de jours lors de cette période.
Les caractéristiques de la population de patients inclus dans les essais cliniques de phase III étaient les suivantes: âge moyen de 43,9 ans [compris entre 18 et 87 ans, avec 5,3 % de patients âgés de 65 ans ou plus], 90,1 % de femmes. Tous les patients répondaient aux critères de Rome II pour le SII-C et devaient présenter un score de douleurs abdominales ≥3 sur une échelle d'évaluation numérique de 0 à 10 points (des critères qui correspondent à une population atteinte de SII modéré à sévère), < 3 selles spontanées complètes et ≤5 selles spontanées par semaine pendant la période initiale de 2 semaines.
Les critères d'évaluation combinés principaux des deux études cliniques étaient d'une part le taux de réponse à 12 semaines pour le degré de soulagement des symptômes du SII et, d'autre part, le taux de répondeurs à 12 semaines pour le soulagement des douleurs/gênes abdominales. Un répondeur pour le soulagement des symptômes du SII était défini comme un patient considérablement ou totalement soulagé pendant au moins 50 % de la durée du traitement (score ≤2 sur une échelle allant de 0 à 6). Un répondeur pour les douleurs/gênes abdominales était un patient qui présentait une amélioration de 30 % ou plus pendant au moins 50 % de la durée du traitement.
En ce qui concerne le traitement après 12 semaines, l'étude 1 a montré que 39 % des patients traités par linaclotide étaient répondeurs pour le soulagement des symptômes du SII, contre 17 % de ceux sous placebo (p < 0,0001), et 54 % des patients traités par linaclotide étaient répondeurs pour le soulagement des douleurs/gênes abdominales contre 39 % de ceux sous placebo (p < 0,0001).
L'étude 2 a montré que 37 % des patients traités par linaclotide étaient répondeurs pour le soulagement des symptômes du SII contre 19 % de ceux sous placebo (p < 0,0001), et 55 % des patients traités par linaclotide étaient répondeurs pour le soulagement des douleurs/gênes abdominales contre 42 % de ceux sous placebo (p = 0,0002).
En ce qui concerne le traitement après 26 semaines, l'étude 1 a montré que 37% resp. 54% des patients traités par linaclotide contre 17% et 36% de ceux sous placebo étaient répondeurs pour le soulagement des symptômes du SII (p < 0,0001) resp. pour le soulagement des douleurs/gênes abdominales (p < 0,0001).
Dans les deux études, les premières améliorations ont été observées dès la première semaine et se sont maintenues pendant toute la durée du traitement (figures 1 et 2). Il a pu être montré que le linaclotide n'induisait pas d'effet rebond quand le traitement a été interrompu après 3 mois de traitement continu.
D'autres signes et symptômes du SII-C s'étaient améliorés chez les patients traités par le linaclotide par rapport à ceux ayant reçu un placebo (p < 0,0001), comme le montre le tableau suivant. Ces effets ont été obtenus dès la première semaine et se sont maintenus pendant toute la durée du traitement.
Effet d'Axulta sur les symptômes du SII-C pendant les 12 premières semaines de traitement dans les études regroupées d'efficacité de phase III (études 1 et 2).
|
Principaux critères secondaires d'efficacité
|
Placebo (N = 797)
|
Linaclotide (N = 805)
|
| |
|
À l'inclusion
moyenne
|
12 semaines
moyenne
|
Variation moyenne par rapport à l'inclusion
|
À l'inclusion
moyenne
|
12 semaines
moyenne
|
Variation moyenne par rapport à l'inclusion
|
Différence des moyennes des LS
| |
Ballonnement (échelle d'évaluation numérique à 11 points)
|
6,5
|
5,4
|
-1,0
|
6,7
|
4,6
|
-1,9
|
-0,9*
| |
Nombre de SSC/semaine
|
0,2
|
1,0
|
0,7
|
0,2
|
2,5
|
2,2
|
1,6*
| |
Consistance des selles (score BSFS)
|
2,3
|
3,0
|
0,6
|
2,3
|
4,4
|
2,0
|
1,4*
| |
Effort de poussée/selles douloureuses (échelle ordinale à 5 points)
|
3,5
|
2,8
|
-0,6
|
3,6
|
2,2
|
-1,3
|
-0,6*
|
* p < 0,0001, linaclotide versus placebo. LS: Least Square = moindres carrés
SSC: selles spontanées complètes, avec sensation de vidange intestinale complète
BSFS: Bristol Stool Form Scale
|

