Propriétés/EffetsCode ATC
D11AH05
Mécanisme d'action
Le dupilumab est un anticorps monoclonal humain recombinant de type IgG4 qui inhibe la voie de signalisation de l'interleukine 4 (IL-4) et de l'interleukine 13 (IL-13). Le dupilumab inhibe la voie de signalisation de l'IL-4 via le récepteur de type 1 (IL-4Rα/γc) et les voies de signalisation de l'IL-4 et de l'IL-13 via le récepteur de type II (IL-4Rα/IL-13Rα).
L'IL-4 et l'IL-13 sont des cytokines des pathologies inflammatoires de type 2 telles que la dermatite atopique et l'asthme. Le blocage de la voie de l'IL-4/IL-13 avec le dupilumab diminue plusieurs médiateurs de l'inflammation de type 2.
Le dupilumab normalise le profil d'expression de l'ARN des biopsies œsophagiennes, y compris les gènes liés à l'inflammation de type 2, aux éosinophiles et à d'autres voies biologiques impliquées dans l'œsophagite à éosinophiles (comme la prolifération cellulaire, la fonction barrière, la fibrose et le remodelage).
Pharmacodynamique
Au cours des études cliniques conduites dans la dermatite atopique, le traitement par le dupilumab a été associé à une baisse, par rapport aux valeurs initiales, des concentrations en biomarqueurs de l'immunité de type 2 telles que le taux de Chimiokine thymique régulée par activation (TARC/CCL17), les IgE sériques totales et la concentration sérique en IgE spécifiques à certains allergènes. Une réduction du taux de lactate déshydrogénase (LDH) a été observée sous traitement par dupilumab chez les adultes et les adolescents atteints de dermatite atopique.
Le traitement s'accompagne d'une augmentation des taux d'IgG4, due à la présence de dupilumab. Les effets d'une exposition à un anticorps monoclonal IgG4 sur le long terme n'ont pas été investigués de façon conclusive.
Au cours des essais cliniques portant sur l'asthme, le traitement par le dupilumab a nettement réduit la fraction de monoxyde d'azote expirée (FeNO) et les concentrations circulantes d'éotaxine-3, d'IgE totale, d'IgE spécifique d'un allergène, de TARC et de périostine chez les sujets asthmatiques comparativement au placebo. Ces réductions de biomarqueurs inflammatoires de type 2 étaient comparables pour les schémas posologiques de 200 mg 1x/2 semaines et de 300 mg 1x/2 semaines. Ces marqueurs étaient quasiment non détectables après 2 semaines de traitement, sauf l'IgE, qui a diminué plus lentement. Ces effets étaient maintenus pendant toute la durée du traitement.
Chez les patients atteints de BPCO, le traitement par dupilumab a diminué les biomarqueurs de type 2, notamment la FeNO et les IgE totales, par rapport au placebo. Une diminution de la FeNO a été observée dès la semaine 4. Ces effets sur les biomarqueurs de type 2 se sont maintenus tout au long du traitement par le dupilumab.
Efficacité clinique
1) Dermatite atopique
Efficacité et sécurité cliniques dans la dermatite atopique chez l'adulte:
L'efficacité et la sécurité de l'emploi de dupilumab en monothérapie et en association avec un traitement par des corticostéroïdes topiques ont été évaluées lors de trois études pivots randomisées, contrôlées contre placebo et menées en double aveugle (SOLO 1, SOLO 2 et CHRONOS) chez 2119 patients de 18 ans et plus qui étaient atteints de dermatite atopique (DA) modérée à sévère définie par un score ≥3 selon l'évaluation globale de l'investigateur (Investigator's Global Assessment, IGA), un score EASI (Eczema Area and Severity Index) ≥16 et 10 % ou plus de surface corporelle atteinte. Les patients éligibles inclus dans ces trois études avaient précédemment répondu de manière inappropriée à un traitement topique.
Dans les trois études, les patients ont reçu 1) une dose initiale de 600 mg de dupilumab (deux injections à 300 mg) le jour 1, suivie d'une dose de 300 mg toutes les deux semaines (Q2W); 2) une dose initiale de 600 mg de dupilumab le jour 1, suivie d'une dose de 300 mg une fois par semaine (QW); ou 3) un placebo correspondant. dupilumab a été administré par injection sous-cutanée (SC) dans toutes les études. En cas de besoin de contrôle de symptômes intolérables de la dermatite atopique, les patients ont été autorisés à recevoir un traitement de secours (comprenant des stéroïdes topiques plus puissants ou des immunosuppresseurs administrés par voie générale) à la discrétion du médecin-investigateur. Les patients qui ont reçu un traitement de secours ont été considérés comme ne répondant pas au traitement.
L'étude SOLO 1 comprenait 671 patients (224 sous placebo, 224 sous dupilumab 300 mg Q2W et 223 sous dupilumab 300 mg QW) qui ont été traités sur une durée de 16 semaines.
L'étude SOLO 2 comprenait 708 patients (236 sous placebo, 233 sous dupilumab 300 mg Q2W et 239 sous dupilumab 300 mg QW) qui ont été traités sur une durée de 16 semaines.
L'étude CHRONOS incluait 740 patients (315 sous placebo + CST, 106 sous dupilumab 300 mg Q2W + CST et 319 sous dupilumab 300 mg QW + CST) qui ont été traités sur une durée de 52 semaines. Les patients ont reçu dupilumab ou un placebo en association avec un traitement concomitant par des CST selon un schéma thérapeutique standard dès le début de l'étude. Les patients ont également été autorisés à recevoir des inhibiteurs topiques de la calcineurine.
Critères primaires:
Dans les trois études pivots, les co-critères d'évaluation principaux étaient la part des patients qui présentaient un score IGA de 0 ou 1 («disparition» ou «quasi-disparition») avec une réduction ≥2 points sur une échelle IGA de 0 à 4 ainsi que la part des patients dont l'EASI s'est amélioré d'au moins 75% (EASI-75) entre le début de l'étude et la semaine 16. Les autres résultats évalués comprenaient la part des patients dont l'EASI s'est amélioré d'au moins 50% (EASI-50) ou 90% (EASI-90), la diminution des démangeaisons évaluée sur une échelle numérique (EN) pour l'évaluation du prurit (peak pruritus Numerical Rating Scale [NRS]) et le pourcentage de variation du score SCORAD (SCORing Atopic Dermatitis) entre le début de l'étude et la semaine 16. Les critères d'évaluation secondaires supplémentaires incluaient la variation moyenne des scores POEM (Patient Oriented Eczema Measure), DLQI (Dermatology Life Quality Index) et HADS (Hospital Anxiety and Depression Scale) entre le début de l'étude et la semaine 16. Dans l'étude CHRONOS, l'efficacité a également été évaluée à la semaine 52.
Caractéristiques de base:
Sur l'ensemble des groupes de traitement des études sur l'utilisation en monothérapie (SOLO 1 et SOLO 2), l'âge moyen était de 38,3 ans et le poids moyen de 76,9 kg, 42,1% des participants étaient de sexe féminin, 68,1% étaient de race blanche, 21,8% étaient asiatiques et 6,8% étaient noirs. Dans ces études, 51,6% des patients présentaient un score IGA initial de 3 (DA modérée) et 48,3% des patients un score IGA initial de 4 (DA sévère), et 32,4% des patients avaient reçu précédemment des immunosuppresseurs par voie générale. En moyenne, le score EASI initial était de 33,0, le score de prurit hebdomadaire initial sur l'EN de 7,4, le SCORAD initial de 67,8, le score POEM initial de 20,5, le DLQI initial de 15,0, et le score total HADS initial de 13,3.
Sur l'ensemble des groupes de traitement de l'étude avec emploi concomitant de CST (CHRONOS), l'âge moyen était de 37,1 ans et le poids moyen de 74,5 kg, 39,7% des participants étaient de sexe féminin, 66,2% étaient de race blanche, 27,2% étaient asiatiques et 4,6% étaient noirs. Dans cette étude, 53,1% des patients présentaient un score IGA initial de 3 et 46,9% des patients un score IGA initial de 4, et 33,6% des patients avaient reçu précédemment des immunosuppresseurs par voie générale. En moyenne, le score EASI initial était de 32,5, le score de prurit hebdomadaire initial sur l'EN de 7,3, le SCORAD initial de 66,4, le score POEM initial de 20,1, le DLQI initial de 14,5 et le score total HADS initial de 12,7.
Réponse clinique: études de 16 semaines sur l'emploi en monothérapie (SOLO 1 et SOLO 2)
Dans les études SOLO 1 et SOLO 2, la part des patients chez lesquels on a obtenu, entre le début de l'étude et la semaine 16, un score IGA 0 ou 1, un score EASI-75 et/ou une amélioration >4 points du score de prurit sur l'EN était supérieure chez les patients ayant reçu dupilumab après randomisation que chez les patients sous placebo (voir tableau 6).
Une amélioration rapide du score de prurit sur l'EN (définie comme une amélioration ≥4 points dès la semaine 2; p <0,01) a été constatée chez une part significativement plus élevée de patients sous dupilumab après randomisation que sous placebo, et la part des patients répondant au traitement selon cette échelle a continué à augmenter pendant toute la période sous traitement. L'amélioration du score de prurit sur l'EN s'est accompagnée d'une amélioration des signes objectifs de la dermatite atopique.
La figure 1 et la figure 2 montrent respectivement le pourcentage moyen de variation du score EASI initial et du score de prurit initial sur l'EN jusqu'à la semaine 16.
Tableau 6: Résultats relatifs à l'efficacité de dupilumab en monothérapie à la semaine 16
|
|
SOLO 1 (EAI)a
|
SOLO 2 (EAI)a
| |
|
Placebo
|
dupilumab 300 mg Q2S
|
Placebo
|
dupilumab 300 mg Q2S
| |
Patients randomisés
|
224
|
224
|
236
|
233
| |
IGA 0 ou 1b,
% de répondeursc
|
10,3 %
|
37,9 %e
|
8,5 %
|
36,1 %e
| |
EASI-50,
% de répondeursc
|
24,6 %
|
68,8 %e
|
22,0 %
|
65,2 %e
| |
EASI-75,
% de répondeursc
|
14,7 %
|
51,3 %e
|
11,9 %
|
44,2 %e
| |
EASI-90,
% de répondeursc
|
7,6 %
|
35,7 %e
|
7,2 %
|
30,0 %e
| |
Nombre de patients avec un score de prurit initial sur l'EN ≥4
|
212
|
213
|
221
|
225
| |
Prurit sur l'EN (amélioration ≥4 points),
% de répondeursc, d
|
12,3 %
|
40,8 %e
|
9,5 %
|
36,0 %e
|
a L'ensemble d'analyse intégral (EAI) comprend tous les patients randomisés.
b A été considéré comme répondant au traitement («répondeur») tout patient présentant un score IGA 0 ou 1 («disparition» ou «quasi-disparition») avec une réduction >2 points sur l'échelle IGA de 0 à 4.
c Les patients qui ont reçu un traitement de secours ou pour lesquels il manquait des données ont été considérés comme ne répondant pas au traitement.
d A la semaine 2, la part des patients chez lesquels on a enregistré une amélioration du score de prurit sur l'EN ≥4 points était significativement plus élevée sous dupilumab que sous placebo (p <0,01).
e p <0,0001
Figure 1: Variation moyenne (en %) du score EASI initial au cours des études SOLO 1a et SOLO 2a (EAI)b

Figure 2: Variation moyenne (en %) du score de prurit initial sur l'EN au cours des études SOLO 1a et SOLO 2a (EAI)b
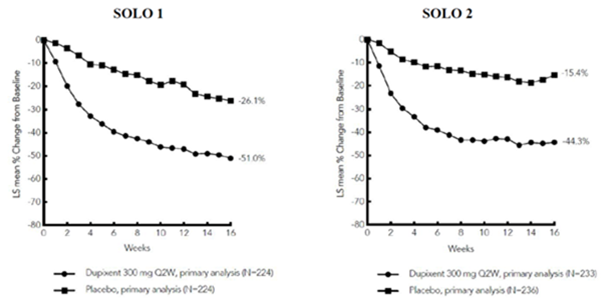
MC = moindres carrés
a Dans les analyses primaires des critères d'évaluation de l'efficacité, les patients qui ont reçu un traitement de secours ou pour lesquels il manquait des données ont été considérés comme ne répondant pas au traitement.
b L'ensemble d'analyse intégral (EAI) comprend tous les patients randomisés.
Les effets du traitement dans les sous-groupes (poids, âge, sexe, origine ethnique et traitement de fond, y compris immunosuppresseurs) des études SOLO 1 et SOLO 2 concordaient avec les résultats obtenus dans la population globale des études.
Réponse clinique: étude de 52 semaines avec emploi concomitant de CST (CHRONOS)
Dans l'étude CHRONOS, la part des patients chez lesquels on a obtenu un score IGA 0 ou 1, un score EASI-75 et/ou une amélioration >4 points du score de prurit sur l'EN entre le début de l'étude et les semaines 16 et 52 était significativement plus élevée chez les patients qui ont reçu l'association dupilumab 300 mg Q2W + CST après randomisation que chez les patients sous placebo + CST (voir tableau 7).
Une amélioration rapide du score de prurit sur l'EN (définie comme une amélioration de >4 points dès la semaine 2; p <0,05) a été constatée chez une part significativement plus élevée de patients ayant reçu l'association dupilumab + CST après randomisation que sous placebo + CST et la part des patients répondant au traitement selon cette échelle a continué à augmenter pendant toute la période sous traitement. L'amélioration du score de prurit sur l'EN s'est accompagnée d'une amélioration des signes objectifs de la dermatite atopique.
La figure 3 et la figure 4 montrent respectivement le pourcentage moyen de variation du score EASI initial et du score initial sur l'EN jusqu'à la semaine 52 dans l'étude CHRONOS.
Tableau 7: Résultats relatifs à l'efficacité de dupilumab utilisé en association avec un traitement concomitant par des CSTa aux semaines 16 et 52 dans l'étude CHRONOS
|
|
Semaine 16 (EAI)b
|
Semaine 52 (EAI Semaine 52)b
| |
|
Placebo
+
CST
|
Dupilumab 300 mg
Q2S + CST
|
Placebo
+
CST
|
Dupilumab 300 mg
Q2S + CST
| |
Patients
randomisés
|
315
|
106
|
264
|
89
| |
IGA 0 ou 1c,
% de répondeursd
|
12,4 %
|
38,7 %f
|
12,5 %
|
36,0 %f
| |
EASI-50,
% de répondeursd
|
37,5 %
|
80,2 %f
|
29,9 %
|
78,7 %f
| |
EASI-75,
% de répondeursd
|
23,2 %
|
68,9 %f
|
21,6 %
|
65,2 %f
| |
EASI-90,
% de répondeursd
|
11,1 %
|
39,6 %f
|
15,5 %
|
50,6 %f
| |
Nombre de patients avec un score de prurit initial sur l'EN ≥4
|
299
|
102
|
249
|
86
| |
Prurit sur l'EN
(amélioration ≥4 points),
% de répondeursd, e
|
19,7 %
|
58,8 %f
|
12,9 %
|
51,2 %f
|
a Tous les patients recevaient un traitement de fond par des corticostéroïdes topiques. Les patients étaient autorisés à prendre des inhibiteurs topiques de la calcineurine.
b L'ensemble d'analyse intégral (EAI) comprend tous les patients randomisés. L'EAI à la semaine 52 comprend tous les patients randomisés au moins un an avant la date limite de l'analyse primaire.
c A été considéré comme répondant au traitement («répondeur») tout patient présentant un score IGA 0 ou 1 («disparition» ou «quasi-disparition») avec une réduction ≥2 points sur l'échelle IGA de 0 à 4.
d Les patients qui ont reçu un traitement de secours ou pour lesquels il manquait des données ont été considérés comme ne répondant pas au traitement.
e A la semaine 2, la part des patients chez lesquels on a enregistré une amélioration du score de prurit sur l'EN ≥4 points était significativement plus élevée sous dupilumab
que sous placebo (p <0,05).
f p < 0,0001
Figure 3: Variation moyenne (en %) du score EASI initial au cours de l'étude CHRONOSa (EAI à la semaine 52)b
CHRONOS
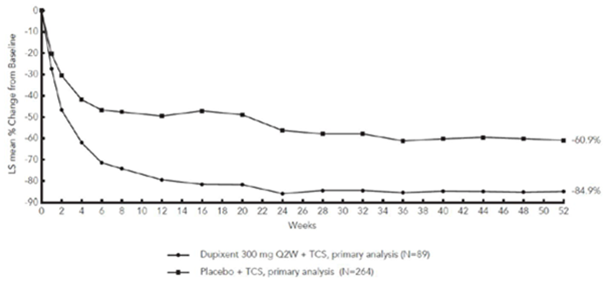
Figure 4: Variation moyenne (en %) du score de prurit initial sur l'EN au cours de l'étude CHRONOSa (EAI à la semaine 52)b
CHRONOS
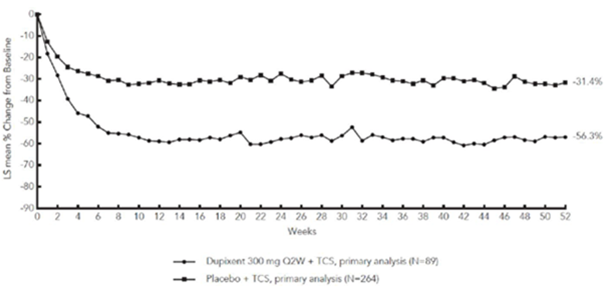
MC = moindres carrés
a Dans les analyses primaires des critères d'évaluation de l'efficacité, les patients qui ont reçu un traitement de secours ou pour lesquels il manquait des données ont été considérés comme ne répondant pas au traitement.
b L'EAI à la semaine 52 comprend tous les patients randomisés au moins un an avant la date limite de l'analyse primaire.
Les effets du traitement dans les sous-groupes (poids, âge, sexe, origine ethnique et traitement de fond, y compris immunosuppresseurs) de l'étude CHRONOS correspondaient aux résultats obtenus dans la population globale des études.
Réponse Clinique: patients chez qui un traitement par des cyclosporines ne permet pas de contrôler efficacement la maladie, n'est pas toléré ou n'est pas recommandé (étude CAFE)
L'étude CAFE visait à évaluer l'efficacité de dupilumab associé à un traitement concomitant par des CST face à un placebo sur une période de traitement de 16 semaines chez des patients adultes atteints de dermatite atopique sévère chez qui un traitement oral par une cyclosporine ne permet pas de contrôler efficacement la maladie, n'est pas toléré, est actuellement contre-indiqué ou n'est pas recommandé d'un point de vue médical.
Au total, l'étude incluait 325 patients, dont 210 avaient été exposés précédemment à une cyclosporine et 115 n'avaient jamais reçu auparavant de cyclosporines ou chez qui un traitement par une cyclosporine n'était pas recommandé d'un point de vue médical. L'âge moyen des patients était de 38,4 ans et 38,8% des patients étaient de sexe féminin. En moyenne, l'EASI initial était de 33,1, le BSA de 55,7, le score de prurit hebdomadaire initial sur l'EN était de 6,4, le SCORAD initial de 67,2 et le DLQI initial de 13,8.
Le critère d'évaluation principal était la part des patients avec un score EASI-75 à la semaine 16.
Les critères d'évaluation principaux et secondaires de l'étude CAFE de 16 semaines sont résumés dans le tableau 8.
Tableau 8: Résultats correspondant aux critères d'évaluation principaux et secondaires de l'étude CAFE
|
|
Placebo + CST
|
Dupilumab 300 mg Q2W + CST
| |
Patients randomisés
|
108
|
107
| |
EASI-75, répondeurs (en %)
|
29,6 %
|
62,6 %
| |
EASI, pourcentage de variation moyen (MC) par rapport aux valeurs initiales (+/- ES)
|
-46,6
(2,76)
|
-79,8
(2,59)
| |
Score de prurit sur l'EN, pourcentage de variation moyen (MC) par rapport aux valeurs initiales (+/- ES)
|
-25,4 % (3,39)
|
-53,9 % (3,14)
| |
SCORAD, pourcentage de variation moyen (MC) par rapport aux valeurs initiales (+/- ES)
|
-29,5 % (2,55)
|
-62,4 % (2,48)
| |
DLQI, variation moyenne (MC) par rapport aux valeurs initiales (ES)
|
-4,5
(0,49)
|
-9,5
(0,46)
|
Dans le sous-groupe de patients de l'étude CHRONOS de 52 semaines considéré comme similaire à la population de l'étude CAFE, un score EASI-75 a été obtenu chez 69,6% des patients traités par dupilumab 300 mg Q2W contre 18,0% des patients sous placebo à la semaine 16, et chez 52,4% des patients traités par dupilumab 300 mg Q2W contre 18,6% des patients sous placebo à la semaine 52. Dans ce sous-groupe, le pourcentage moyen de variation du score de prurit initial sur l'EN atteignait, à la semaine 16, -51,4% dans le groupe sous dupilumab 300 mg Q2W contre -30,2% sous placebo et, à la semaine 52, -54,8% dans le groupe sous dupilumab 300 mg Q2W contre -30,9% sous placebo.
Entretien et durabilité de la réponse (étude SOLO CONTINUE)
Pour évaluer l'entretien et la durabilité de la réponse, les sujets traités par dupilumab pendant 16 semaines dans le cadre des études SOLO 1 et SOLO 2 chez qui on avait obtenu un score IGA 0 ou 1 ou un score EASI-75 ont été soumis à une nouvelle procédure de randomisation dans le cadre de l'étude SOLO CONTINUE afin de recevoir soit un traitement supplémentaire par dupilumab, soit un placebo pendant 36 semaines, pour atteindre une durée cumulée de traitement de 52 semaines. Les critères d'évaluation ont été évalués aux semaines 51 ou 52.
Les co-critères d'évaluation principaux étaient l'écart entre le début (semaine 0) et la semaine 36 du pourcentage de variation du score EASI par rapport aux valeurs initiales des études SOLO 1 et SOLO 2, et le pourcentage de patients avec un score EASI-75 à la semaine 36 parmi les patients ayant un score EASI-75 initialement.
Les patients qui ont poursuivi le même schéma posologique que dans les études SOLO 1 et SOLO 2 (300 mg Q2S ou 300 mg QS) ont montré l'effet optimal du maintien de la réponse clinique, alors que l'efficacité pour d'autres schémas posologiques a baissé de manière dose-dépendante.
Les critères d'évaluation principaux et secondaires de l'étude SOLO CONTINUE de 52 semaines sont résumés dans le tableau 9.
Tableau 9: Résultats correspondant aux critères d'évaluation principaux et secondaires de l'étude SOLO CONTINUE
|
|
Placebo
|
Dupilumab 300 mg
| |
|
N = 83
|
Q8S
N = 84
|
Q2S/QS
N = 169
| |
Co-critères d'évaluation principaux
| |
Écart moyen (MC) (+/- ES) entre le début et la semaine 36 du pourcentage de variation du score EASI par rapport aux valeurs initiales des études parents
|
21,7
(3,13)
|
6,8***
(2,43)
|
0,1***
(1,74)
| |
Pourcentage de patients avec un score EASI-75 à la semaine 36 parmi les patients ayant un score EASI-75 initialement, n (%)
|
24/79
(30,4 %)
|
45/82*
(54,9 %)
|
116/162***
(71,6 %)
| |
Critères d'évaluation secondaires clés
| |
Pourcentage de patients dont la réponse IGA à la semaine 36 ne s'écartait pas de plus d'1 point de la valeur initiale dans le sous-ensemble de patients ayant un score IGA (0, 1) initialement, n (%)
|
18/63
(28,6)
|
32/64†
(50,0)
|
89/126***
(70,6)
| |
Pourcentage de patients avec un score IGA (0, 1) à la semaine 36 dans le sous-ensemble de patients ayant un score IGA (0, 1) initialement, n (%)
|
9/63
(14,3)
|
21/64†
(32,8)
|
68/126***
(54,0)
| |
Pourcentage de patients dont la valeur maximale du prurit sur l'EN augmentait de ≥3 points entre le début et la semaine 35 dans le sous-ensemble de patients ayant une valeur maximale du prurit sur l'EN ≤7 initialement, n (%)
|
56/80
(70,0)
|
45/81
(55,6)
|
57/168***
(33,9)
|
†p < 0,05; *p < 0,01; ***p ≤0,0001
Dans l'étude SOLO CONTINUE, une tendance à une production plus forte d'anticorps anti-médicament (ADA) émergeant en cours de traitement a été observée avec l'allongement des intervalles d'administration.
ADA émergeant en cours de traitement: QS: 1,2%; Q2S: 4,3%; Q4S: 6,0%; Q8S: 11,7%. Réponses de type AAM subsistant plus de 12 semaines: QS: 0,0%; Q2S: 1,4%; Q4S: 0,0%; Q8S: 2,6%.
Qualité de vie / résultats rapportés par les patients
Dans les études SOLO 1 et SOLO 2, dupilumab a significativement amélioré les symptômes liés à la dermatite atopique (DA), la qualité de vie liée à la santé et les symptômes d'anxiété et de dépression, tels que mesurés par les scores totaux POEM, DLQI et HADS, respectivement, en comparaison au placebo.
Dans l'étude CHRONOS, dupilumab a significativement amélioré les symptômes liés à la DA et la qualité de vie liée à la santé, tels que mesurés par les scores totaux POEM et DLQI, respectivement, à 16 semaines, comparé au placebo.
Dans SOLO 1 et SOLO 2, les variations moyennes (± SE) des moindres carrés des scores totaux POEM, DLQI et HADS entre le début et la 16ème semaine étaient significativement plus élevés chez les patients recevant dupilumab que chez ceux recevant un placebo (p <0,0001 pour toutes les comparaisons excepté HADS dans SOLO 2, p <0,001), voir le tableau 10.
Dans l'étude CHRONOS, les variations moyennes (± SE) des moindres carrés des scores totaux POEM et DLQI entre le début et la 16ème semaine étaient significativement plus importants chez les patients dupilumab que chez ceux recevant le placebo (p <0,0001 pour toutes les comparaisons), voir tableau 10.
Tableau 10: Résultats additionnels des critères d'évaluation secondaires de dupilumab avec ou sans TCS à la semaine 16
|
|
Monotherapie à la semaine 16
|
Traitement concomitant par des TCS à la semaine 16
| |
|
SOLO1
|
SOLO2
|
CHRONOS
| |
|
Placebo
|
Dupilumab 300 mg Q2S
|
Placebo
|
Dupilumab 300 mg Q2S
|
Placebo
|
Dupilumab 300 mg Q2S
| |
Patients
randomisés
|
224
|
224
|
236
|
233
|
315
|
106
| |
POEM, variation moyenne (MC) par rapport aux valeurs initiales (ES)
|
-5,1
(0,67)
|
-11,6a
(0,49)
|
-3,3
(0,55)
|
-10,2a
(0,49)
|
-5,3
(0,41)
|
-12,7a
(0,64)
| |
DLQI, variation moyenne (MC) par rapport aux valeurs initiales (ES)
|
-5,3
(0,50)
|
-9,3a
(0,40)
|
-3,6
(0,50)
|
-9,3a
(0,38)
|
-5,8
(0,34)
|
-10,0a
(0,50)
|
MC = moindres carrés; ES = erreur standard
a p < 0,0001
Efficacité et securité cliniques chez les adolescents atteints de dermatite atopique:
L'efficacité et la sécurité du dupilumab en monothérapie chez les patients adolescents ont été évaluées dans une étude multicentrique, randomisée, en double aveugle, contrôlée versus placebo (AD-1526) chez 251 patients adolescents âgés de 12 à 17 ans atteints de dermatite atopique (DA) modérée à sévère définie par un score IGA ≥3 dans l'évaluation globale des lésions de la DA sur une échelle de sévérité de 0 à 4, un score EASI ≥16 sur une échelle de 0 à 72, et une surface corporelle atteinte minimale (BSA) ≥10%. Les patients éligibles inclus dans cette étude présentaient auparavant une réponse insuffisante aux traitements topiques.
Les patients ont reçu:
1.une dose initiale de 400 mg du dupilumab (deux injections de 200 mg) le jour 1, suivie par 200 mg une fois toutes les deux semaines (1x/2 semaines) pour les patients ayant un poids corporel initial < 60 kg, ou une dose initiale de 600 mg de dupilumab (deux injections de 300 mg) le jour 1, suivie par 300 mg 1x/2 semaines pour les patients ayant un poids corporel initial ≥60 kg;
2.une dose initiale de 600 mg de dupilumab (deux injections de 300 mg) le jour 1, suivie par 300 mg une fois toutes les quatre semaines (1x/4 semaines) quel que soit le poids corporel initial ou
3.un placebo.
Le dupilumab a été administré par injection sous-cutanée (SC). En cas de symptômes intolérables, les patients étaient autorisés à recevoir un traitement de secours à la discrétion de l'investigateur. Les patients ayant reçu un traitement de secours ont été considérés comme non-répondeurs.
Dans cette étude, la moyenne d'âge était de 14,5 ans, le poids médian était de 59,4 kg, 41,0% des sujets étaient de sexe féminin, 62,5% étaient de race blanche, 15,1% étaient asiatiques, et 12,0% étaient de race noire. À l'inclusion dans l'étude, 46,2% des patients avaient un score IGA de 3 (DA modérée), 53,8% des patients avaient un score IGA à l'inclusion dans l'étude de 4 (DA sévère), l'atteinte moyenne de la BSA était de 56,5%, et 42,4% des patients avaient reçu un traitement antérieur par des immunosuppresseurs systémiques. Le score EASI (Eczema Area and Severity Index) moyen à l'inclusion dans l'étude était de 35,5, le score NRS de prurit moyen hebdomadaire à l'inclusion dans l'étude était de 7,6, le SCORAD (SCORing Atopic Dermatitis) moyen à l'inclusion dans l'étude était de 70,3, le score POEM (Patient Oriented Eczema Measure) moyen à l'inclusion dans l'étude était de 21,0, et le score CDLQI (Children Dermatology Life Quality Index [index de qualité de vie des enfants en dermatologie]) moyen à l'inclusion dans l'étude était de 13,6. Globalement, 92,0% des patients présentaient au moins un état allergique coexistant; 65,6% présentaient une rhinite allergique, 53,6% de l'asthme, et 60,8% des allergies alimentaires.
Les co-critères d'évaluation principaux étaient la proportion de patients avec un score IGA égal à 0 ou 1 avec une amélioration d'au moins 2 points, et la proportion de patients avec un EASI-75 (amélioration d'au moins 75% du score EASI) entre l'inclusion dans l'étude et la semaine 16. Les autres critères d'évaluation incluaient la proportion de sujets avec un EASI-50 ou EASI-90 (amélioration du score EASI d'au moins 50% et 90% respectivement par rapport à l'inclusion dans l'étude), la réduction du prurit mesuré par le score de prurit maximal NRS, et le pourcentage de variation du score de l'échelle SCORAD entre l'inclusion dans l'étude et la semaine 16. Les autres critères d'évaluation secondaires incluaient la variation moyenne entre l'inclusion dans l'étude et la semaine 16 des scores POEM et CDLQI.
Réponse clinique
Les résultats de l'efficacité à la semaine 16 pour l'étude réalisée chez les adolescents atteints de dermatite atopique sont présentés dans le tableau 11.
Tableau 11: Résultats de l'efficacité du dupilumab dans l'étude réalisée chez les adolescents atteints de dermatite atopique à la semaine 16 (population FAS)
|
|
AD-1526 (FAS)a
| |
|
Placebo
|
Dupilumab 200 mg (< 60 kg) et 300 mg (≥60 kg) 1x/2 sem.
| |
Patients randomisés
|
85a
|
82a
| |
IGA 0 ou 1b, % de répondeursc
|
2,4 %
|
24,4 %
| |
EASI-50, % de répondeursc
|
12,9 %
|
61,0 %
| |
EASI-75, % de répondeursc
|
8,2 %
|
41,5 %
| |
EASI-90, % de répondeursc
|
2,4 %
|
23,2 %
| |
EASI, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-23,6 %
(5,49)
|
-65,9 %
(3,99)
| |
SCORAD, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude
(+/- ES)
|
-17,6 %
(3,76)
|
-51,6 %
(3,23)
| |
Score NRS de prurit, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-19,0 %
(4,09)
|
-47,9%
(3,43)
| |
Score NRS de prurit (amélioration > 4 points), % de répondeursc
|
4,8 %
|
36,6 %
| |
BSA, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-11,7 %
(2,72)
|
-30,1 %
(2,34)
| |
CDLQI, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-5,1
(0,62)
|
-8,5
(0,50)
| |
CDLQI (amélioration ≥6 points), % de répondeurs
|
19,7 %
|
60,6 %
| |
POEM, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-3,8
(0,96)
|
-10,1
(0,76)
| |
POEM (amélioration ≥ 6 points), % de répondeurs
|
9,5 %
|
63,4 %
|
a La population FAS (Full Analysis Set) comprend tous les patients randomisés.
b Un répondeur est défini comme un sujet avec un score IGA de 0 ou 1 («blanchi» ou «presque blanchi») avec une réduction ≥2 points sur l'échelle IGA 0 - 4.
c Les patients ayant reçu un traitement de secours ou avec des données manquantes ont été considérés comme non-répondeurs (58,8% et 20,7% respectivement dans les bras placebo et Dupixent).
Toutes les valeurs p < 0,0001.
Une proportion plus importante de patients randomisés dans le groupe placebo a eu besoin d'un traitement de secours (dermocorticoïdes topiques, corticostéroïdes systémiques ou immunosuppresseurs non-stéroïdiens systémiques) par comparaison au groupe dupilumab (58,8% et 20,7% respectivement).
Une proportion significativement plus importante de patients randomisés dans le groupe dupilumab a présenté une amélioration rapide du score NRS de prurit par comparaison au placebo (définie comme une amélioration > 4 points dès la semaine 4; valeurs nominales de p < 0,001) et la proportion de patients ayant une amélioration du score NRS de prurit a continué à augmenter pendant toute la période de traitement (voir figure 5 ci-dessous). L'amélioration du score NRS de prurit a été accompagnée d'une amélioration des signes objectifs de dermatite atopique.
Figure 5: Proportion de patients adolescents avec une amélioration ≥4 points du score NRS de prurit dans l'étude AD-1526a (FAS)b
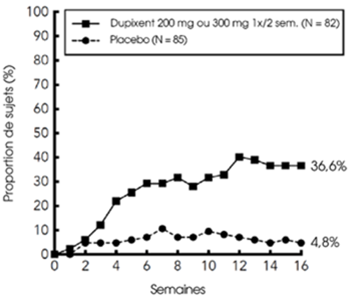
a Dans les analyses principales des critères d'évaluation de l'efficacité, les sujets ayant reçu un traitement de secours ou ayant des données manquantes ont été considérés comme non-répondeurs.
b La population FAS (Full Analysis Set) inclut tous les sujets randomisés.
Dans le groupe dupilumab, une amélioration significative a été observée en termes de symptômes rapportés par le patient et d'impact de la DA sur le sommeil et la qualité de vie liée à la santé, tel que mesuré par les scores POEM, SCORAD et CDLQI à 16 semaines par comparaison au placebo.
L'efficacité à long terme du dupilumab chez les patients adolescents atteints de DA modérée à sévère qui avaient participé à des essais cliniques antérieurs portant sur le dupilumab a été évaluée dans une étude d'extension en ouvert (AD-1434). Les données d'efficacité issues de cette étude suggèrent que le bénéfice clinique obtenu à la semaine 16 a été maintenu jusqu'à la semaine 52.
Efficacité et sécurité cliniques chez les enfants (6 à 11 ans) souffrant de dermatite atopique
L'efficacité et la sécurité de l'utilisation du dupilumab en même temps que les CST chez des sujets pédiatriques ont été évaluées dans un essai multicentrique, randomisé, en double aveugle et contrôlé par placebo (AD-1652) chez 367 sujets âgés de 6 à 11 ans, la dermatite atopique étant définie par un score IGA de 4 (échelle de 0 à 4), un score EASI ≥21 (échelle de 0 à 72) et une BSA minimale de ≥15%. Les sujets admissibles inscrits à cet essai avaient auparavant une réponse inadéquate au médicament topique. L'inclusion a été stratifiée en fonction du poids de base (<30 kg; ≥30 kg).
Les sujets du groupe dupilumab Q4W + CST ont reçu une dose initiale de 600 mg le jour 1, suivie de 300 mg Q4W de la semaine 4 à la semaine 12, quel que soit leur poids. Les sujets du groupe dupilumab Q2W + CST ayant un poids de base <30 kg ont reçu une dose initiale de 200 mg le jour 1, suivie de 100 mg Q2W de la semaine 2 à la semaine 14, et les sujets ayant un poids de base de ≥30 kg ont reçu une dose initiale de 400 mg le jour 1, suivie de 200 mg Q2W de la semaine 2 à la semaine 14. Les sujets ont été autorisés à recevoir un traitement de secours à la discrétion de l'investigateur. Les sujets qui ont reçu un traitement de secours ont été considérés comme non-répondants.
Dans l'étude AD-1652, l'âge moyen était de 8,5 ans, le poids médian était de 29,8 kg, 50 % des sujets étaient des femmes, 69,2% étaient des Blancs, 16,7% des Noirs et 7,6% des Asiatiques. Au départ, l'implication moyenne de la BSA était de 57,6%, et 16,9% avaient déjà reçu des immunosuppresseurs systémiques non stéroïdiens. En outre, au départ, le score moyen de l'EASI était de 37,9 et la moyenne hebdomadaire du score quotidien de la pire démangeaison était de 7,8 sur une échelle de 0 à 10, le score SCORAD moyen à l'inclusion dans l'étude était de 73,6, le score POEM à l'inclusion dans l'étude était de 20,9 et le CDLQI moyen à l'inclusion dans l'étude était de 15,1. Dans l'ensemble, 91,7% des sujets avaient au moins une affection comorbide allergique; 64,4% avaient des allergies alimentaires, 62,7% avaient d'autres allergies, 60,2% avaient une rhinite allergique et 46,7% étaient asthmatiques.
Le principal critère d'évaluation était la proportion de sujet présentant un IGA 0 (clair) ou 1 (presque clair) à la semaine 16. Les autres résultats évalués comprenaient la proportion de sujets présentant un EASI-75 ou un EASI-90 (amélioration d'au moins 75% ou 90% de l'EASI par rapport au niveau de référence, respectivement), le pourcentage de changement du score EASI entre l'inclusion dans l'étude et la semaine 16 et la réduction des démangeaisons telle que mesurée par le score NRS de prurit (amélioration ≥4 points). Les autres critères d'évaluation secondaires incluaient la variation moyenne entre l'inclusion dans l'étude et la semaine 16 des scores POEM et CDLQI.
Le tableau 12 présente les résultats par tranche de poids de base pour les schémas posologiques approuvés.
Tableau 12: Résultats d'efficacité de Dupixent avec CST concomitant dans AD-1652 à la semaine 16 (population FAS)a
|
|
Dupixent
300 mg Q4Wd
+ CST
(N=61)
|
Placebo
+ CST
(N=61)
|
Dupixent
200 mg Q2We
+ CST
(N=59)
|
Placebo
+ CST
(N=62)
| |
<30 kg
|
<30 kg
|
≥30 kg
|
≥30 kg
| |
IGA 0 ou 1 b, % de répondeurs c
|
29,5%
|
13,1%
|
39,0%
|
9,7%
| |
EASI-50, % de répondeurs c
|
95.1%
|
42,6%
|
86,4%
|
43,5%
| |
EASI-75, % de répondeurs c
|
75,4%
|
27,9%
|
74,6%
|
25,8%
| |
EASI-90, % de répondeurs c
|
45,9%
|
6,6%
|
35,6%
|
8,1%
| |
EASI, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-84,3%
(3,08)
|
-49,1%
(3,30)
|
-80,4%
(3,61)
|
-48,3%
(3,63)
| |
SCORAD, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude
(+/- ES)
|
-65,3%
(2,87)
|
-28,9%
(3,05)
|
-62,7%
(3,14)
|
-30,7%
(3,28)
| |
Score NRS de prurit, variation moyenne en % (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-55,1%
(3,94)
|
-27,0%
(4,24)
|
-58,2%
(4,01)
|
-25,0%
(3,95)
| |
Score NRS de prurit (amélioration ≥4 points), % de répondeurs c
|
54,1%
|
11,7%
|
61,4%
|
12,9%
| |
CDLQI, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-11,5
(0,69)
|
-7,2
(0,76)
|
-9,8
(0,63)
|
-5,6
(0,66)
| |
CDLQI (amélioration ≥6 points), % de répondeurs
|
81,8%
|
48,3%
|
80,8%
|
35,8%
| |
POEM, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-14,0
(0,95)
|
-5,9
(1,04)
|
-13,6
(0,90)
|
-4,7
(0,91)
|
a La population FAS (Full Analysis Set) comprend tous les sujets randomisés.
b Le sujet répondant a été défini comme un sujet ayant un IGA 0 ou 1 («clair» ou «presque clair»).
c Les sujets ayant reçu un traitement de secours ou pour lesquels des données manquaient ont été considérés comme des non-répondants.
d Au jour 1, les sujets ont reçu 600 mg de dupilumab.
e Au jour 1, les sujets ont reçu 200 mg (poids de référence <30 kg) ou 400 mg (poids de référence ≥30 kg) de Dupixent.
Une plus grande proportion de sujets randomisés avec dupilumab + CST ont obtenu une amélioration du score NRS de prurit par rapport au placebo + CST (défini comme une amélioration de ≥4 points à la semaine 16). Voir la figure 6.
Figure 6: Proportion de sujets pédiatriques avec une amélioration du score NRS de prurit ≥4 points à la semaine 16 en AD-1652a (FAS)b
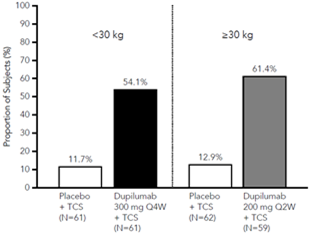
a Dans les analyses primaires des paramètres d'efficacité, les sujets qui ont reçu un traitement de secours ou pour lesquels il manquait des données ont été considérés comme des non-répondants.
b La population FAS (Full Analysis Set) comprend tous les sujets randomisés.
Dans le groupe dupilumab, une amélioration significative a été observée en termes de symptômes rapportés par le patient et d'impact de la DA sur le sommeil et la qualité de vie liée à la santé, tel que mesuré par les scores POEM, SCORAD et CDLQI à 16 semaines par comparaison au placebo.
L'efficacité à long terme du dupilumab + TCS chez les patients pédiatriques atteints de dermatite atopique qui avaient participé aux précédents essais cliniques du dupilumab + TCS a été évalué dans le cadre d'une extension en ouvert étude (AD-1434). Dans cet essai, les données non contrôlées disponibles à la semaine 52 pour 45 patients ont démontré que la proportion de patients présentant des améliorations cliniquement pertinentes pour les scores IGA ou EASI se maintenait au fil du temps.
Efficacité et sécurité clinique chez les enfants (6 mois à 5 ans) souffrant de dermatite atopique
L'efficacité et la sécurité de l'utilisation du dupilumab en même temps que les CST chez des sujets pédiatriques ont été évaluées dans un essai multicentrique, randomisé, en double aveugle et contrôlé par placebo (AD-1539) chez 162 sujets âgés de 6 mois à 5 ans, atteints de dermatite atopique modérée à sévère étant définie par un score IGA ≥3 (échelle de 0 à 4), un score EASI ≥16 (échelle de 0 à 72) et une BSA minimale de ≥10. Les sujets admissibles inscrits à cet essai avaient auparavant une réponse inadéquate au médicament topique. L'inclusion a été stratifiée en fonction du poids de base (≥5 à <15 kg et ≥15 à <30 kg).
Les sujets du groupe dupilumab Q4W + CST ayant un poids de base ≥5 à <15 kg ont reçu une dose initiale de 200 mg le jour 1, suivie de 200 mg Q4W de la semaine 4 à la semaine 12, et les sujets ayant un poids de base ≥15 à <30 kg ont reçu une dose initiale de 300 mg le jour 1, suivie de 300 mg Q4W de la semaine 4 à la semaine 12. Les sujets ont été autorisés à recevoir un traitement de secours à la discrétion de l'investigateur. Les patients qui ont reçu un traitement de secours ont été considérés comme non-répondants.
Dans l'étude AD-1539, l'âge moyen était de 3,8 ans, le poids médian était de 16,5 kg, 38,9% des sujets étaient des femmes, 68,5% étaient des Blancs, 18,5% des Noirs et 6,2% des Asiatiques. Au départ, le score moyen de l'EASI était de 34,1 et 22,8% avaient un score IGA de 3 et 77,2% un score IGA de 4.
Le critère d'évaluation principal était la proportion de sujets présentant un IGA 0 (clair) ou 1 (presque clair) à la semaine 16 et les principaux critères d'évaluations secondaires comprenaient la proportion de sujets présentant un EASI-75 (amélioration d'au moins 75% de l'EASI par rapport au niveau de référence).
Réponse Clinique
Les résultats d'efficacité de la semaine 16 pour AD-1539 sont présentés dans le tableau 13.
Tableau 13: Résultats d'efficacité de Dupixent avec CST concomitant dans AD-1539 à la semaine 16 (population FAS)a chez les sujets pédiatriques âgés de 6 mois à 5 ans atteints de dermatite atopique modérée à sévère
|
|
Dupixent 200 mg (5 à <15 kg) ou 300 mg (15 à <30 kg) Q4Wd
+ CST
(N=83)a
|
Placebo
+ CST
(N=79)a
| |
IGA 0 ou 1b,c
|
27,7%
|
3,9%
| |
EASI-50, % de répondeursc
|
68,7%
|
20,2%
| |
EASI-75c
|
53,0%
|
10,7%
| |
EASI-90c
|
25,3%
|
2,8%
| |
EASI, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-70,0%e
(4,85)
|
-19,6%
(5,13)
| |
SCORAD, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-54,7%e
(3,39)
|
-16,2%
(3,54)
| |
Score NRS de prurit, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)
|
-49,4%e
(5,03)
|
-2,2%
(5,22)
| |
Score NRS de prurit (amélioration ≥4 points)c
|
48,1%
|
8,9%
| |
Qualité du sommeil NRS, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)*
|
2,0e
(0,25)
|
0,3
(0,26)
| |
Douleur cutanée NRS, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)*
|
-3,9e
(0,30)
|
-0,6
(0,30)
| |
POEM, variation moyenne (MC) par rapport à l'inclusion dans l'étude (+/- ES)*
|
-12,9e
(0,89)
|
-3,8
(0,92)
|
a La population FAS (Full Analysis Set) comprend tous les sujets randomisés.
b Le sujet répondant a été défini comme un sujet ayant un IGA 0 ou 1 («clair» ou «presque clair»).
c Les sujets ayant reçu un traitement de secours (62.8% et 19% dans le groupe placebo et le groupe Dupixent respectivement) ou pour lesquels des données manquaient ont été considérés comme des non-répondants.
d Au jour 1, les sujets ont reçus 200 mg (5 à <15 kg) ou 300 mg (15 à <30 kg) de Dupixent
e valeurs de p <0.0001
*Résultat rapporté par le soignant
Une plus grande proportion de sujets randomisés avec dupilumab + CST ont obtenu une amélioration du score NRS de prurit par rapport au placebo + CST (défini comme une amélioration de ≥4 points dès la semaine 3, valeur nominal p <0,005) et la proportion des patients répondants au score NRS de prurit a continué d'augmenter tout au long du traitement (voir la figure 7).
Figure 7: Proportion de sujets pédiatriques âgés de 6 mois à 5 ans avec une amélioration de ≥4 point du score NRS de prurit à la semaine 16 dans AD-1539 (FAS)b
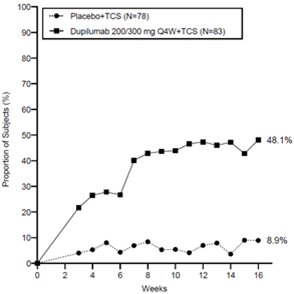
L'efficacité et la sécurité à long terme du dupilumab + TCS chez les patients pédiatriques atteints de dermatite atopique modérée à sévère qui avaient participé aux précédents essais cliniques du dupilumab + TCS a été évalué dans le cadre d'une étude d'extension en ouvert (AD-1434). Dans cet essai, les données d'efficacité démontrent que les améliorations cliniques obtenues à la semaine 16 se maintiennent jusqu'à la semaine 52. Le profil de sécurité du dupilumab chez les patients suivis jusqu'à la semaine 52 était similaire au profil de sécurité observé à la semaine 16 dans l'étude AD-1539.
Dermatite atopique des mains et des pieds
L'efficacité et la sécurité du dupilumab ont été évaluées dans un essai multicentrique de 16 semaines, randomisé, en double aveugle, en groupes parallèles, contrôlé versus placebo (AD-1924) chez 106 patients adultes et 27 patients pédiatriques âgés de 12 à 17 ans présentant une dermatite atopique modérée à sévère des mains et des pieds, définie par un score IGA (mains et pieds) ≥3 (sur une échelle allant de 0 à 4) et un score d'intensité maximale du prurit ≥4 (sur une échelle allant de 0 à 10) sur l'échelle d'évaluation numérique du prurit maximal (NRS) des mains et des pieds. Les patients éligibles présentaient auparavant une réponse insuffisante ou une intolérance au traitement de la dermatite atopique des mains et des pieds par voie topique.
Au début de l'étude, 38% des patients étaient de sexe masculin, 80% étaient de race blanche, 72% des sujets avaient un score IGA (mains et pieds) de 3 à l'inclusion (dermatite atopique modérée des mains et des pieds) et 28% des patients avaient un score IGA (mains et pieds) 4 à l'inclusion (dermatite atopique sévère des mains et des pieds). Le score NRS de prurit moyen hebdomadaire des mains et des pieds était de 7,1 à l'inclusion.
Le critère d'évaluation principal était la proportion de patients avec un score IGA des mains et des pieds égal à 0 («blanchi») ou 1 (« presque blanchi ») à la semaine 16. Le principal critère d'évaluation secondaire était la réduction du prurit, mesurée par le score NRS de prurit maximal des mains et des pieds (amélioration de ≥4 points). Les autres résultats rapportés par les patients incluaient l'évaluation du score NRS (0-10) de douleur cutanée mains et pieds, le score NRS (0-10) de la qualité du sommeil, le score de qualité de vie dans le questionnaire d'eczéma de la main (0-117) (QoLHEQ) et le score de productivité au travail et de gêne des activités (WPAI) (0-100%).
La proportion de patients ayant un IGA (mains et pieds) de 0 («blanchi») à 1 (« presque blanchi ») à la semaine 16 était de 40,3% pour le dupilumab et de 16,7% pour le placebo (différence de traitement 23,6%; IC 95%: 8,84; 38,42; valeur p = 0,0030). La proportion de patients présentant une amélioration (réduction) du score NRS de prurit moyen hebdomadaire des mains et des pieds ≥4 à la semaine 16 était de 52,2% pour le dupilumab et de 13,6% pour le placebo (différence de traitement 38,6%; IC à 95%: 24,06; 53,15; valeur p = 0,0001).
Des améliorations plus importantes du score NRS de douleur cutanée mains et pieds, du score NRS de la qualité du sommeil, du score QoLHEQ et du score WPAI de la perte de productivité au travail et de la gêne des activités entre l'inclusion et la semaine 16 ont été observées dans le groupe dupilumab par rapport au groupe placebo (la variation moyenne des MC du dupilumab par rapport au placebo: - 4,66 vs -1,93 (p <0,0001); 0,88 vs -0,00 (p <0,05); - 40,28 vs -16,18 (p <0,0001); -38,57 % vs - 22,83 % (valeur de p nominal <0,001) et - 36,39 % vs - 21,26 % (valeur de p nominal <0,001) respectivement).
2) Asthme
Efficacité et sécurité clinique chez les adultes et adolescents atteints d'asthme:
Le programme de développement de l'asthme incluait trois études multicentriques, randomisées, en double aveugle, contrôlées contre placebo, en groupes parallèles (DRI12544, QUEST et VENTURE) d'une durée de traitement de 24 à 52 semaines, qui incluaient un total de 2 888 patients (âgés de 12 ans ou plus).
Les patients ont été inclus, quel que soit leur taux d'éosinophiles dans le sang ou des niveaux de FeNO ou d'IgE.
Dans les études DRI12544 et QUEST, les analyses de sous-groupes prédéterminées incluaient des éosinophiles sanguins ≥150 et ≥300 cellules/µl.
L'étude DRI12544 était une étude de recherche de dose de 24 semaines, qui incluait 776 patients (âgés de 18 ans et plus). Le dupilumab a été évalué comparativement au placebo chez des patients adultes présentant un asthme modéré à sévère et recevant une dose moyenne à élevée de corticoïdes inhalés et un bêta-agoniste de longue durée d'action. Le critère d'évaluation principal était la variation du VEMS (litres) entre l'inclusion dans l'étude et la semaine 12 chez les sujets avec des niveaux de base d'éosinophiles ≥300 cellules/µl. Le taux annualisé d'exacerbations sévères d'asthme a également été évalué au cours de la période contrôlée contre placebo de 24 semaines. Les résultats ont été évalués dans la population globale (sans restriction sur le taux minimal d'éosinophiles) et dans les sous-groupes en fonction de la numération d'éosinophiles sanguins à l'inclusion dans l'étude.
L'étude QUEST était une étude de confirmation de 52 semaines, qui comprenait 1 902 patients (âgés de 12 ans ou plus). Le dupilumab a été évalué comparativement au placebo chez 107 adolescents et 1 795 patients adultes présentant un asthme persistant et recevant une corticothérapie inhalée à dose moyenne ou élevée et un second traitement de fond. Les patients nécessitant un troisième traitement de fond pouvaient également être inclus dans cet essai. Les patients ont été randomisés pour recevoir soit 200 mg de dupilumab toutes les deux semaines (N=631), soit 300 mg de dupilumab toutes les deux semaines (N=633) (ou dans le groupe placebo correspondant pour le 200 mg (N=317) ou le 300 mg (N=321)) après administration d'une dose initiale de 400 mg, 600 mg ou de placebo, respectivement. Les critères d'évaluation principaux étaient le taux annualisé d'exacerbations sévères survenant au cours de la période contrôlée contre placebo de 52 semaines et la variation du VEMS mesuré avant administration du bronchodilatateur entre l'inclusion dans l'étude et la semaine 12 dans la population globale (sans restriction sur le nombre minimal d'éosinophiles).
Des critères secondaires supplémentaires incluaient le taux d'exacerbation sévère annualisés et FEV1 dans les sous-groupes en fonction du taux d'éosinophiles sanguins.
L'étude VENTURE était une étude de réduction des corticostéroïdes oraux de 24 semaines conduites chez 210 patients présentant un asthme, sans restriction sur les taux des biomarqueurs de l'inflammation de type 2 à l'inclusion, et qui nécessitaient une corticothérapie orale quotidienne en complément de l'utilisation régulière d'une dose élevée de corticostéroïdes inhalés associés à un autre traitement de fond. Après avoir optimisé la dose de corticostéroïdes oraux (CSO) pendant la période de sélection, les patients ont reçu 300 mg de dupilumab (n = 103) ou un placebo (n = 107) une fois toutes les deux semaines pendant 24 semaines après une dose initiale de 600 mg ou un placebo. Le traitement de fond initial était maintenu pendant l'étude. La dose de CSO était réduite toutes les 4 semaines pendant la phase de réduction des CSO (semaines 4 à 20), tant que l'asthme restait contrôlé. Le critère d'évaluation principal était le pourcentage de réduction de la dose de corticostéroïdes oraux évaluée dans la population globale, correspondant à la différence entre la dose de corticostéroïdes oraux lors des semaines 20 à 24, tout en maintenant le contrôle de l'asthme avec une dose de corticostéroïdes oraux préalablement optimisée dans la population générale (sans restriction du nombre minimum d'éosinophiles de base dans le sang). Des critères secondaires additionnels ont inclus le taux annualisé d'événements d'exacerbation sévère pendant la période de traitement et le taux de répondeurs dans les scores ACQ-5 et AQLQ (S).
Les données démographiques et les caractéristiques de l'asthme à l'inclusion de ces 3 études sont fournies dans le tableau 14.
Tableau 14: Données démographiques et caractéristiques de l'asthme à l'inclusion dans les études
|
Paramètres
|
DRI12544
(n = 776)
|
QUEST
(n = 1 902)
|
VENTURE
(n = 210)
| |
Moyenne d'âge (ans) (ET)
|
48,6 (13,0)
|
47,9 (15,3)
|
51,3 (12,6)
| |
% de femmes
|
63,1
|
62,9
|
60,5
| |
% de race blanche
|
78,2
|
82,9
|
93,8
| |
Durée de l'asthme (ans), moyenne ± ET
|
22,03 (15,42)
|
20,94 (15,36)
|
19,95 (13,90)
| |
Patients n'ayant jamais fumé, (%)
|
77,4
|
80,7
|
80,5
| |
Moyenne des exacerbations l'année précédente ± ET
|
2,17 (2,14)
|
2,09 (2,15)
|
2,09 (2,16)
| |
Utilisation de CSI à dose élevée (%)a
|
49,5
|
51,5
|
88,6
| |
VEMS (litres) avant une dose lors de la visite à l'inclusion ± ET
|
1,84 (0,54)
|
1,78 (0,60)
|
1,58 (0,57)
| |
Pourcentage de variation moyenne du VEMS à l'inclusion dans l'étude (%) (± ET)
|
60,77 (10,72)
|
58,43 (13,52)
|
52,18 (15,18)
| |
% de réversibilité (± ET)
|
26,85 (15,43)
|
26,29 (21,73)
|
19,47 (23,25)
| |
Score ACQ-5 moyen (± ET)
|
2,74 (0,81)
|
2,76 (0,77)
|
2,50 (1,16)
| |
Score AQLQ moyen (± ET)
|
4,02 (1,09)
|
4,29 (1,05)
|
4,35 (1,17)
| |
Antécédents médicaux de maladie atopique % global
(DA %, PN %, RA %)
|
72,9
(8,0, 10,6, 61,7)
|
77,7
(10,3, 12,7, 68,6)
|
72,4
(7,6, 21,0, 55,7)
| |
FeNO moyen en ppb (± ET)
|
39,10 (35,09)
|
34,97 (32,85)
|
37,61 (31,38)
| |
% de patients avec FeNO ppb
| |
≥25
≥50
|
49,9
21,6
|
49,6
20,5
|
54,3
25,2
| |
IgE totale moyenne en UI/ml (± ET)
|
435,05
(753,88)
|
432,40
(746,66)
|
430,58
(775,96)
| |
Numération moyenne d'éosinophiles à l'inclusion dans l'étude (± ET) en cellules/µl
|
350 (430)
|
360 (370)
|
350 (310)
| |
% de patients avec EOS
≥150 cellules/µl
≥300 cellules/µl
|
77,8
41,9
|
71,4
43,7
|
71,4
42,4
|
CSI = corticostéroïdes inhalés; VEMS = volume expiratoire maximal par seconde; ACQ-5 = Asthma Control Questionnaire-5 (questionnaire sur le contrôle de l'asthme à 5 items); AQLQ = Asthma Quality of Life Questionnaire (questionnaire sur la qualité de vie liée à l'asthme); DA = dermatite atopique; PN = polypose nasale; RA = rhinite allergique; FeNO = fraction de monoxyde d'azote expiré; EOS= éosinophiles sanguins
a La population des études du dupilumab dans l'asthme incluait des patients recevant des doses moyennes ou élevées de CSI. La dose moyenne de CSI était définie en terme d'équivalent à 500 µg de fluticasone ou équivalent par jour.
Exacerbations
Les études DRI12544 et QUEST ont évalué la fréquence des exacerbations sévères de l'asthme définies comme une détérioration de l'asthme nécessitant l'utilisation de corticostéroïdes systémiques pendant au moins 3 jours ou une hospitalisation ou une visite aux urgences en raison d'un asthme nécessitant des corticostéroïdes systémiques.
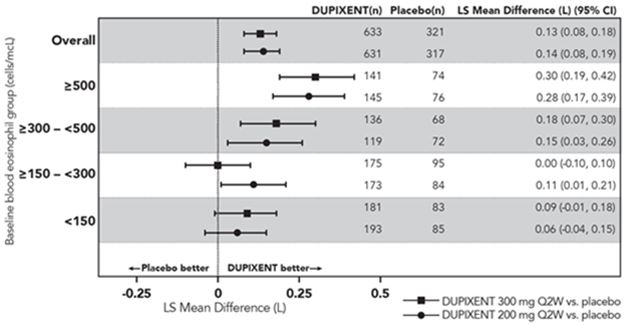
Dans la population d'analyse primaire (sujets avec un taux d'éosinophiles sanguins de base ≥300 cellules/µl dans l'essai DRI12544 et la population globale dans l'essai QUEST), les sujets recevant Dupixent 200 mg ou 300 mg Q2W avaient des réductions significatives du taux d'exacerbations asthmatique par rapport au placebo. Dans la population globale de l'étude QUEST, le taux d'exacerbations sévères était de 0,46 et 0,52 pour Dupixent 200 mg Q2W et 300 mg Q2W, respectivement, par rapport aux taux de placebo de 0,87 et 0,97.
Le rapport des taux d'exacerbations sévères par rapport au placebo était de 0,52 (IC à 95%: 0,41, 0,66) et 0,54 (IC à 95%: 0,43, 0,68) pour Dupixent 200 mg Q2W et 300 mg Q2W, respectivement. Les résultats chez les sujets avec une numération des éosinophiles sanguins au départ ≥150 cellules/µl et ≥300 cellules/µl dans les essais DRI12544 et QUEST sont présentés dans le tableau 15.
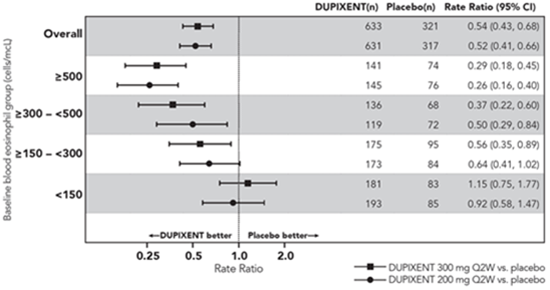
Les taux de réponse par les éosinophiles sanguins de base pour l'étude QUEST sont illustrés à la figure 8. Les analyses de sous-groupes prédéfinies des essais DRI12544 et QUEST ont montré qu'il y avait des réductions plus importantes des exacerbations sévères chez les sujets ayant des niveaux d'éosinophiles sanguins de base plus élevés. Dans l'essai QUEST, les réductions des exacerbations étaient significatives dans le sous-groupe de sujets avec des éosinophiles sanguins initiaux ≥150 cellules/µl. Chez les sujets dont la numération éosinophile dans le sang était < à 150 cellules/µl, des taux d'exacerbation sévère similaires ont été observés entre Dupixent et le placebo.
Dans l'étude QUEST, le rapport des taux d'exacerbations entraînant des hospitalisations et / ou des visites aux urgences par rapport au placebo était de 0,53 (IC à 95%: 0,28, 1,03) et de 0,74 (IC à 95%: 0,32, 1,70) avec Dupixent 200 mg ou 300 mg Q2W, respectivement.
Tableau 15: Taux d'exacerbation sévère dans DRI12544 et QUEST
|
Traitement
|
Niveau sanguin EOS
| |
|
≥150 cellules/µl
|
≥300 cellules/µl
| |
Exacerbations par An
|
% Reduction
|
Exacerbations par An
|
%
Reduction
| |
N
|
Rate
(95% CI)
|
Rate
Ratio (95%CI)
|
N
|
Rate
(95% CI)
|
Rate
Ratio (95%CI)
| |
Toutes les exacerbations sévères
| |
DRI12544 study
| |
Dupilumab 200 mg Q2W
|
120
|
0.29
(0.16, 0.53)
|
0.28a
(0.14, 0.55)
|
72%
|
65
|
0.30
(0.13, 0.68)
|
0.29c
(0.11, 0.76)
|
71%
| |
Dupilumab 300 mg
Q2W
|
129
|
0.28
(0.16, 0.50)
|
0.27b
(0.14, 0.52)
|
73%
|
64
|
0.20
(0.08, 0.52)
|
0.19d
(0.07, 0.56)
|
81%
| |
Placebo
|
127
|
1.05
(0.69, 1.60)
|
|
|
68
|
1.04
(0.57, 1.90)
|
|
| |
QUEST study
| |
Dupilumab 200 mg
Q2W
|
437
|
0.45
(0.37, 0.54)
|
0.44e
(0.34,0.58)
|
56%
|
264
|
0.37
(0.29, 0.48)
|
0.34e
(0.24,0.48)
|
66%
| |
Placebo
|
232
|
1.01
(0.81, 1.25)
|
|
|
148
|
1.08
(0.85, 1.38)
|
|
| |
Dupilumab 300 mg
Q2W
|
452
|
0.43
(0.36, 0.53)
|
0.40 e
(0.31,0.53)
|
60%
|
277
|
0.40
(0.32, 0.51)
|
0.33e
(0.23,0.45)
|
67%
| |
Placebo
|
237
|
1.08
(0.88, 1.33)
|
|
|
142
|
1.24
(0.97, 1.57)
|
|
|
Figure 8: Risque relatif dans le taux d'événements annualisé d'exacerbations sévères à travers la numération des éosinophiles sanguins de base (cellules/µl) dans QUEST
Le délai avant la première exacerbation était plus long pour les sujets recevant Dupixent que pour le placebo dans l'étude QUEST (figure 9).
Figure 9: Courbe d'incidence de Kaplan Meier pour le délai avant la première exacerbation sévère chez les sujets avec des éosinophiles sanguins de base ≥300 cellules/µl (QUEST)a
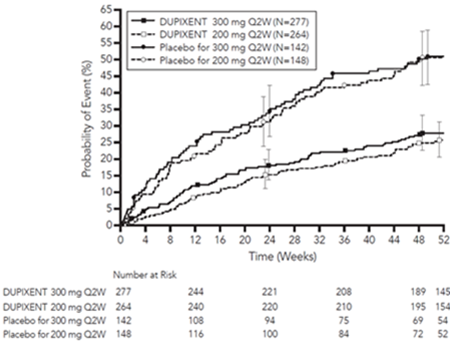
a Au moment de la fermeture de la base de données, tous les patients n'avaient pas terminé la semaine 52.
Fonction pulmonaire
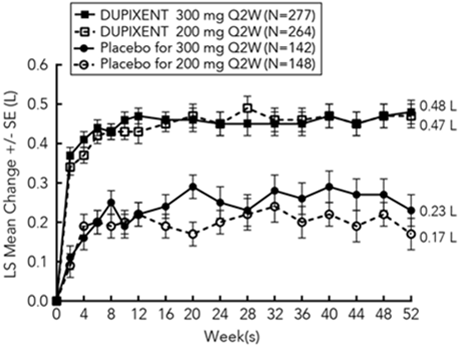
Des augmentations significatives du VEMS pré-bronchodilatateur ont été observées à la semaine 12 pour les essais DRI12544 et QUEST dans les populations analysées primaires (sujets avec un taux éosinophile sanguin de base ≥300 cellules/µl dans l'essai DRI12544 et la population globale dans l'essai QUEST). Dans la population globale de l'étude QUEST, la variation moyenne du FEV1 LS par rapport à la valeur initiale était de 0,32 L (21%) et 0,34 L (23%) pour Dupixent 200 mg Q2W et 300 mg Q2W, respectivement, par rapport à la moyenne placebo de 0,18 L (12%) et 0,21 L (14%).
La différence moyenne de traitement par rapport au placebo était de 0,14 L (IC à 95%: 0,08, 0,19) et de 0,13 L (IC à 95%: 0,08, 0,18) pour Dupixent 200 mg Q2W et 300 mg Q2W, respectivement. Les résultats chez les sujets ayant un taux d'éosinophiles sanguins au départ ≥150 cellules/µl et ≥300 cellules/µl dans les essais DRI12544 et QUEST sont présentés dans le tableau 16. Les améliorations du VEMS par les éosinophiles sanguins au départ pour l'essai QUEST sont illustrées à la figure 10. L'analyse en sous-groupe des essais DRI12544 et QUEST a démontré une plus grande amélioration chez les sujets ayant des éosinophiles sanguins de base plus élevés.
Tableau 16: Changement moyen par rapport à la valeur initiale du VEMS pré-bronchodilatateur à la semaine 12 dans DRI12544 et QUEST
|
Traitement
|
Niveau sanguin de base EOS
| |
|
≥150 cellules/µl
|
≥300 cellules/µl
| |
N
|
LS Mean Δ From baseline
L (%)
|
LS Mean
Difference vs. placebo (95% CI)
|
N
|
LS mean Δ From baseline
L (%)
|
LS Mean
Difference vs. placebo (95% CI)
| |
Etude DRI12544
| |
Dupilumab 200 mg Q2W
|
120
|
0.32 (18.25)
|
0.23a
(0.13, 0.33)
|
65
|
0.43 (25.9)
|
0.26c
(0.11, 0.40)
| |
Dupilumab 300 mg Q2W
|
129
|
0.26 (17.1)
|
0.18b
(0.08, 0.27)
|
64
|
0.39 (25.8)
|
0.21d
(0.06, 0.36)
| |
Placebo
|
127
|
0.09 (4.36)
|
|
68
|
0.18 (10.2)
|
| |
Etude QUEST
| |
Dupilumab 200 mg Q2W
|
437
|
0.36 (23.6)
|
0.17e
(0.11, 0.23)
|
264
|
0.43 (29.0)
|
0.21e
(0.13, 0.29)
| |
Placebo
|
232
|
0.18 (12.4)
|
|
148
|
0.21 (15.6)
|
| |
Dupilumab 300 mg Q2W
|
452
|
0.37 (25.3)
|
0.15e
(0.09, 0.21)
|
277
|
0.47 (32.5)
|
0.24e
(0.16, 0.32)
| |
Placebo
|
237
|
0.22 (14.2)
|
|
142
|
0.22 (14.4)
|
|
a p-value <0.0001, bp-value = 0.0004, cp-value = 0.0008, dp-value = 0.0063, ep-value <0.0001
Figure 10: Différence moyenne de changement LS par rapport à la valeur initiale par rapport au placebo à la semaine 12 dans le pré-bronchodilatateur FEV1 selon le nombre d'éosinophiles sanguins de base (cellules/µl) dans QUEST
Les variations moyennes du VEMS au fil du temps dans QUEST sont illustrées à la figure 11.
Figure 11: Variation moyenne par rapport à la valeur de base dans le pré-bronchodilatateur FEV1 (L) au fil du temps chez les sujets présentant des éosinophiles sanguins initiaux ≥300 cellules/µl (QUEST)
Critères secondaires additionnels:
Qualité de vie/Résultats déclarés par le patient dans l'asthme
ACQ-5 et AQLQ (S) ont été évalués dans QUEST à 52 semaines. Le taux de répondeurs a été défini comme une amélioration du score de 0,5 ou plus (échelle de 0-6 pour ACQ-5 et 1-7 pour AQLQ (S)).
·Le taux de répondeurs ACQ-5 pour Dupilumab 200 mg et 300 mg Q2W dans la population globale était de 69% vs 62% placebo (odds ratio 1,37; IC 95%: 1,01, 1,86) et 69% vs 63% placebo (odds ratio 1,28 IC 95%: 0,94, 1,73), respectivement; et les taux de répondeurs AQLQ (S) étaient respectivement de 62% vs 54% placebo (odds ratio 1,61; IC 95%: 1,17, 2,21) et 62% vs 57% placebo (odds ratio 1,33; IC 95%: 0,98, 1,81).
·Le taux de répondeurs ACQ-5 pour Dupilumab 200 mg et 300 mg Q2W chez les sujets avec des éosinophiles sanguins à la base ≥300 cellules/µl était de 75% vs 67% placebo (odds ratio: 1,46; IC 95%: 0,90, 2,35) et 71% vs placebo à 64% (rapport de cotes: 1,39; IC à 95%: 0,88, 2,19), respectivement; et les taux de répondeurs AQLQ (S) étaient de 71% vs 55% placebo (odds ratio: 2,02; 95% IC: 1,24, 3,32) et 65% vs 55% placebo (odds ratio: 1,79; 95% IC: 1,13, 2,85), respectivement.
Étude de réduction des corticostéroïdes oraux (VENTURE)
VENTURE a évalué l'effet de dupilumab sur la réduction de l'utilisation des corticostéroïdes oraux d'entretien. La dose moyenne initiale de corticostéroïdes oraux était de 12 mg dans le groupe placebo et de 11 mg dans le groupe recevant dupilumab. Le critère d'évaluation principal était le pourcentage de réduction par rapport à la valeur initiale de la dose finale de corticostéroïdes oraux à la semaine 24 tout en maintenant le contrôle de l'asthme.
Par rapport au placebo, les sujets recevant dupilumab ont obtenu des réductions plus importantes de la dose quotidienne de corticostéroïdes par voie orale, tout en maintenant un contrôle de l'asthme. Le pourcentage moyen de réduction de la dose quotidienne d'OCS par rapport à l'inclusion était de 70% (médiane 100%) chez les sujets recevant dupilumab (IC 95%: 60%, 80%) par rapport à 42% (médiane 50%) chez les sujets recevant le placebo (IC 95%): 33%, 51%). Des réductions de 50% ou plus de la dose d'OCS ont été observées chez 82 (80%) sujets recevant dupilumab contre 57 (53%) chez ceux recevant le placebo. La proportion de sujets avec une dose finale moyenne inférieure à 5 mg aux semaines 24 était de 72% pour dupilumab et de 37% pour le placebo (rapport de cotes 4,48 IC 95%: 2,39, 8,39). Un total de 54 (52%) sujets recevant dupilumab versus 31 (29%) sujets dans le groupe placebo ont eu une réduction de 100% de leur dose d'OCS.
Dans cette étude de 24 semaines, les exacerbations de l'asthme (définies comme une augmentation temporaire de la dose de corticostéroïdes oraux pendant au moins 3 jours) étaient plus faibles chez les sujets recevant dupilumab par rapport à ceux recevant le placebo (taux annualisé 0,65 et 1,60 pour le groupe dupilumab et le placebo, respectivement; le rapport de taux de 0,41 [IC à 95% 0,26, 0,63]) et l'amélioration du VEMS pré-bronchodilatateur de la ligne de base à la semaine 24 étaient plus importants chez les sujets recevant dupilumab que chez ceux recevant le placebo (différence moyenne LS pour dupilumab versus placebo de 0,22 L [95% IC: 0,09 à 0,34 L]). Les effets sur la fonction pulmonaire et sur la réduction des stéroïdes et des exacerbations par voie orale étaient similaires, indépendamment des taux d'éosinophiles sanguins de base. L'ACQ-5 et l'AQLQ (S) ont également été évalués dans VENTURE et ont montré des améliorations similaires à celles de QUEST.
Etude d'extension à long terme (TRAVERSE)
La sécurité à long terme du dupilumab a été évaluée dans l'étude d'extension en ouvert (TRAVERSE) chez 2193 adultes et 89 adolescents souffrant d'asthme modéré à sévère, incluant 185 adultes souffrant d'asthme dépendant aux corticostéroïdes oraux, qui avaient participé aux précédents essais cliniques du dupilumab (DRI12544, QUEST et VENTURE) (voir «Effets indésirables»). L'efficacité, mesurée comme critère d'évaluation secondaire, était similaire aux résultats observés dans les études pivots et s'est maintenue jusqu'à 96 semaines. Chez les adultes souffrant d'asthme dépendant aux corticostéroïdes oraux, on a observé une réduction maintenue des exacerbations et une amélioration de la fonction pulmonaire jusqu'à 96 semaines, malgré la diminution ou l'arrêt de la dose de corticostéroïdes oraux.
Efficacité et sécurité cliniques chez les enfants (âgés de 6 à 11 ans) atteints d'asthme:
L'efficacité et la sécurité du dupilumab chez les patients pédiatriques ont été évaluées dans une étude multicentrique, randomisée, en double aveugle, contrôlée par placebo, d'une durée de 52 semaines (VOYAGE) chez 408 patients âgés de 6 à 11 ans souffrant d'asthme modéré à sévère et recevant un corticostéroïde inhalé (CSI) à dose moyenne ou élevée et un deuxième médicament de contrôle ou un CSI à dose élevée seul. Les patients ont été randomisés entre le dupilumab (N = 273) et le placebo correspondant (N = 135) toutes les deux semaines en fonction du poids corporel ≤30 kg ou >30 kg, respectivement
Le critère d'évaluation principal était le taux annualisé d'exacerbations sévères pendant la période de 52 semaines contrôlée par placebo et le critère d'évaluation secondaire était le changement par rapport à la ligne de base du VEMS pré-bronchodilatateur en pourcentage prédit à la semaine 12. Les autres critères d'évaluation secondaires comprenaient le changement moyen par rapport aux valeurs initiales et les taux de réponse aux scores de l'ACQ-7-IA et du PAQLQ(S)-IA.
Les données démographiques et les caractéristiques à l'inclusion dans l'étude VOYAGE sont présentées dans le tableau 17.
Tableau 17: Données démographiques et caractéristiques à l'inclusion dans l'étude VOYAGE
|
Paramètres
|
ITT
(N=408)
| |
Moyenne d'âge (ans) (ET)
|
8,9 (1,6)
| |
% de femmes
|
35,8
| |
% de race blanche
|
88,2
| |
Poids corporel moyen (kg)
|
35,91
| |
Moyenne des exacerbations l'année précédente ± ET
|
2,44 (2,18)
| |
Utilisation de CSI à dose (%)
|
| |
Moyenne
|
55,1
| |
Elevée
|
44,1
| |
VEMS pré-dose (L) à l'inclusion (± ET)
|
1,48 (0,41)
| |
VEMS moyen en pourcentage prédit (%) (± ET)
|
78,07 (14,72)
| |
Réversibilité moyenne en % (± ET)
|
19,58 (20,76)
| |
Score moyen ACQ-7-IA (± ET)
|
2,13 (0,73)
| |
Score moyen PAQLQ(S)-IA (± ET)
|
4,91 (1,13)
| |
Antécédents atopiques % Général
(DA %, RA %)
|
92,4
(36,3, 81,9)
| |
IgE totales médianes IU/ml (± ET)
|
792,28 (1093,46)
| |
FeNO moyenne ppb (± ET)
|
27,71 (23,84)
| |
% de patients avec FeNO ppb ≥20
|
49,7
| |
Numération moyenne d'éosinophiles à l'inclusion dans l'étude (± ET) en cellules/µl
|
500 (400)
| |
% de patients avec EOS
|
| |
≥150 cellules/µl
|
81,1
| |
≥300 cellules/µl
|
63,5
|
Les exacerbations étaient définies comme une détérioration de l'asthme nécessitant l'utilisation de corticostéroïdes systémiques pendant au moins 3 jours ou une hospitalisation ou une visite aux urgences en raison d'un asthme nécessitant des corticostéroïdes systémiques. Le dupilumab a significativement réduit le taux annualisé d'événements d'exacerbation sévère de l'asthme pendant la période de traitement de 52 semaines par rapport au placébo dans la population présentant l'inflammation de type 2 (taux d'éosinophiles sanguins ≥150 cellules/µl ou FeNO ≥20 ppb) et dans la population définie par des éosinophiles sanguins de base ≥300 cellules/µl. Des analyses de sous-groupes concernant l'efficacité du dupilumab basées sur soit les éosinophiles sanguins de base ou le taux de FeNO de base étaient similaires aux résultats des essais cliniques chez les patients adolescents (12 à 17 ans) et des patients adultes (voir ci-dessus). Chez les patients avec des éosinophiles sanguins de base de <150 cellules/µl et un taux de FeNO <20 ppb, le taux annualisé d'exacerbation sévère de l'asthme observé était similaire entre le dupilumab et le placébo. Les résultats de l'efficacité de VOYAGE sont présentés dans le tableau 18.
Tableau 18: Taux d'exacerbations sévères, variation moyenne du VEMS par rapport à l'inclusion
|
Traitement
|
EOS ≥150 cellules/µl ou FeNO ≥20 ppb
|
EOS
≥300 cellules/µl
| |
Taux annualisé d'exacerbations sévères sur 52 semaines
| |
|
N
|
Taux
(95% CI)
|
Taux
(95% CI)
|
N
|
Taux
(95% CI)
|
Taux (95% CI)
| |
Dupixent 100 mg toutes les 2 semaines (<30 kg)/
200 mg toutes les deux semaines (≥30 kg)
|
236
|
0,305
(0,223, 0,416)
|
0,407
(0,274, 0,605)
|
175
|
0,235
(0,160, 0,345)
|
0,353
(0,222, 0,562)
| |
Placébo
|
114
|
0,748
(0,542, 1,034)
|
|
84
|
0,665
(0,467, 0,949)
|
| |
Variation moyenne par rapport au début de l'étude du pourcentage de VEMS prédit à la semaine 12
| |
|
N
|
LS Δ moyen par rapport à la ligne de base en pourcentage de VEMS prédit
|
N
|
LS Δ moyen par rapport à la ligne de base en pourcentage de VEMS prédit
| |
DUPIXENT
100 mg toutes les 2 semaines (<30 kg)/
200 mg toutes les deux semaines (≥30 kg)
|
229
|
10,53
|
168
|
10,15
| |
Placébo
|
110
|
5,32
|
80
|
4,83
|
Des améliorations significatives du pourcentage du VEMS prédit avant le bronchodilatateur ont été observées à la semaine 12. Des améliorations significatives du pourcentage de VEMS prédit ont été observées dès la semaine 2 et se sont maintenues jusqu'à la semaine 52 dans l'étude VOYAGE.
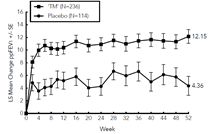
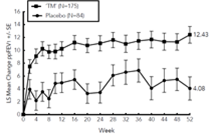
Les améliorations du pourcentage de VEMS prédit au fil du temps dans l'étude VOYAGE sont présentées dans la figure 12.
Figure 12: Variation moyenne du pourcentage prédit du VEMS par rapport à l'inclusion avant le bronchodilatateur (litres) au fil du temps dans l'étude VOYAGE (éosinophiles sanguins de base ≥150 cellules/µl ou FeNO ≥20 ppb, éosinophiles de base ≥300 cellules/µl)
|
Eosinophiles sanguins de base ≥150 cellules/µl ou FeNO ≥20 ppb
|
Eosinophiles sanguins de base ≥300 cellules/µl
| |
|
|
|
|
Des améliorations ont été observées pour ACQ-7-IA et PAQLQ(S)-IA à la semaine 24 et étaient maintenues jusqu'à la semaine 52. Les taux de réponse dans les populations présentant des taux d'éosinophiles sanguins de ≥150 cellules/µl ou une FeNO ≥20 ppb et avec des taux d'éosinophiles sanguins de ≥150 cellules/µl étaient plus élevés pour ACQ-7IA et PAQLQ(S)-IA comparé au placébo à la semaine 24. Le taux de réponse était défini comme une amélioration de 0,5 ou plus sur échelle (de 0-6 pour ACQ-7-IA et de 1-7 pour PAQLQ(S)-IA). Dans le sous-groupe de patients avec des éosinophiles sanguins de ≥300 cellules/µl de départ, Dupixent présentait une proportion plus élevée de patients avec une réponse ACQ-7_IA (80,6% versus 64,3% pour placébo) avec un odds ratio (OR) de 2,79 (95% CI: 1,43; 5,44), et une réponse PAQLQ(S)-IA (72,8% versus 63,0% pour placébo) avec un OR de 1,84 (95% CI: 0,92; 3,65) à la semaine 24.
Etude d'extension à long terme (EXCURSION)
L'efficacité du dupilumab, mesurée comme critère secondaire, a été évaluée chez 365 patients pédiatriques atteints d'asthme (âgés de 6 à 11 ans) dans l'étude d'extension à long terme (EXCURSION). Une réduction durable des exacerbations nécessitant une hospitalisation et/ou des visites aux urgences et une réduction de l'exposition aux corticostéroïdes systémiques oraux ont été observées. Des améliorations durables de la fonction pulmonaire ont été observées pour plusieurs paramètres, notamment le pourcentage de VEMS prédit, le pourcentage de CVF prédit, le rapport VEMS/CVF et le pourcentage de FEF 25-75 % prédit. De plus, 75% des patients ont atteint et/ou maintenu une fonction pulmonaire normale avec un VEMS pré-bronchodilatateur en pourcentage de la valeur prédite > 80% à la fin de l'étude EXCURSION. L'efficacité a été maintenue pendant une durée cumulée de traitement allant jusqu'à 104 semaines (VOYAGE et EXCURSION).
3) Efficacité clinique dans la polypose naso-sinusienne
Le programme de développement dans la polypose naso-sinusienne comprenait deux études randomisées, en double aveugle, en groupes parallèles, multicentriques et contrôlées contre placebo (SINUS-24 et SINUS 52) chez 724 patients âgés de 18 ans et plus avec un traitement de fond par des corticostéroïdes administré par voie nasale. Ces études ont inclus des patients présentant une polypose naso-sinusienne sévère malgré une chirurgie naso-sinusienne ou un traitement préalable, ou des patients non éligibles à un traitement par des corticostéroïdes systémiques au cours des 2 dernières années. Un traitement de secours par des corticostéroïdes systémiques ou par chirurgie au cours des études était autorisé sur décision de l'investigateur.
Dans l'étude SINUS-24, un total de 276 patients a été randomisé pour recevoir 300 mg de dupilumab (n = 143) ou un placebo (n = 133) toutes les deux semaines pendant 24 semaines. Dans l'étude SINUS-52, 448 patients ont été randomisés pour recevoir 300 mg de dupilumab (n = 150) toutes les deux semaines pendant 52 semaines, 300 mg de dupilumab (n = 145) toutes les deux semaines jusqu'à la semaine 24 suivi de 300 mg toutes les 4 semaines jusqu'à la semaine 52, ou un placebo (N = 153). Tous les patients présentaient des signes d'opacification des sinus sur le score de tomodensitométrie (TDM) des sinus de Lund MacKay et 73% à 90% des patients présentaient une opacification de l'ensemble des sinus. Les patients ont été stratifiés selon leurs antécédents chirurgicaux et la présence concomitante d'un asthme/maladie respiratoire exacerbée par les anti-inflammatoires non stéroïdiens.
Les critères principaux associés d'évaluation de l'efficacité étaient la variation du score endoscopique bilatéral des polypes nasaux entre l'entrée dans l'étude et la semaine 24 évalué par des lecteurs centralisés en aveugle et la différence moyenne du score d'obstruction/congestion nasale sur 28 jours, reporté quotidiennement par les patients dans leur cahier de suivi. Pour le score endoscopique les polypes de chaque côté du nez étaient classés selon une échelle catégorielle (0 = aucun polype; 1 = petits polypes dans le méat médian n'atteignant pas le bord inférieur du cornet moyen; 2 = polypes atteignant le bord inférieur du cornet moyen; 3 = gros polypes atteignant le bord inférieur du cornet inférieur ou polypes au milieu du cornet moyen; 4 = gros polypes entraînant une obstruction complète de la cavité nasale inférieure). Le score total correspondait à la somme des scores du côté droit et du côté gauche. La congestion nasale a été évaluée quotidiennement par les patients selon une échelle de gravité catégorielle de 0 à 3 (0 = aucun symptôme; 1 = symptômes légers; 2 = symptômes modérés; 3 = symptômes sévères).
Dans les deux études, les principaux critères d'évaluation secondaires à la semaine 24 étaient les variations par rapport aux valeurs à l'inclusion dans l'étude: score sinusal TDM de Lund MacKay score total des symptômes, test d'identification des odeurs de l'Université de Pennsylvanie (UPSIT), perte quotidienne de l'odorat et questionnaire à 22 items d'évaluation des symptômes naso-sinusiens (SNOT-22). Dans les deux études regroupées, la réduction de la proportion de patients ayant eu recours à un traitement de secours par corticothérapie systémique et/ou chirurgie naso-sinusienne ainsi que l'amélioration du VEMS dans le sous-groupe asthme ont été évaluées. Les autres critères d'évaluation secondaires comprenaient le questionnaire de contrôle de l'asthme à 6 items (ACQ-6) dans le sous-groupe de patients présentant un asthme concomitant.
Les données démographiques et les caractéristiques initiales dans ces 2 études sont présentées dans le tableau 19.
Tableau 19: Données démographiques et caractéristiques initiales des études portant sur la PNS
|
Paramètres
|
SINUS-24
(N=276)
|
SINUS-52
(N=448)
| |
Age moyen (années) (ET)
|
50,49 (13,39)
|
51,95 (12,45)
| |
% patients de sexe masculin
|
57,2
|
62,3
| |
Durée moyenne de la polypose naso-sinusienne(années) (ET)
|
11,11 (9,16)
|
10,94 (9,63)
| |
Patients avec ≥1 chirurgie (%)
|
71,7
|
58,3
| |
Patients traités par corticothérapie systémique au cours des 2 dernières années (%)
|
64,9
|
80,1
| |
SPN endoscopique moyen bilatéral (ET), score 0 à 8
|
5,75 (1,28)
|
6,10 (1,21)
| |
Score de congestion nasale moyena (ET), score 0 à 3
|
2,35 (0,57)
|
2,43 (0,59)
| |
Score sinusal TDM de Lund MacKay total, moyennea , (ET), score 0 à 24
|
19,03 (4,44)
|
17,96 (3,76)
| |
Score moyen du test de l'odorat (UPSIT)a (ET), score 0 à 40
|
14,56 (2,71)
|
13,61 (8.02)
| |
Score de la perte de l'odorat (matin) moyena , (ET), score 0 à 3
|
2,71 (0,54)
|
2,75 (0,52)
| |
Score SNOT-22 total moyena (ET), score 0 à 110
|
49,40 (20,20)
|
51,86 (20,90)
| |
Score de sévérité de la rhinosinusitea , (ET), 0 à 10 cm
|
7,68 (2,05)
|
8,00 (2,08)
| |
Taux moyen d'éosinophiles dans le sang (cellules/µl) (ET)
|
437 (333)
|
431 (353)
| |
Taux total moyen (IgE) IU/ml (ET)
|
211,97 (275,73)
|
239,84
(341,53)
| |
% global d'atopie (maladies inflammatoires de type 2) dans les antécédents médicaux
|
75,4%
|
82,4%
| |
Asthme (%)
|
58,3
|
59,6
| |
VEMS moyen (L)(ET)
|
2,69
(0,96)
|
2,57
(0,83)
| |
Pourcentage de la valeur prédite du VEMS (%) (ET)
|
85,30
(20,23)
|
83,39
(17,72)
| |
Score ACQ-6 moyena (ET)
|
1,62
(1,14)
|
1,58
(1,09)
| |
Maladie respiratoire exacerbée par les anti-inflammatoires non stéroïdiens (%)
|
30,4
|
26,8
|
a Les scores les plus élevés indiquent une sévérité plus importante de la maladie, à l'exception du test UPSIT, où les scores les plus élevés indiquent une maladie moins sévère, ET = écart type; SPN = score des polypes nasaux; UPSIT = score d'identification des odeurs de l'Université de Pennsylvanie; SNOT-22 = questionnaire d'évaluation des symptômes naso-sinusiens à 22 items; EVA = échelle visuelle analogique; VEMS = volume expiratoire maximal par seconde; ACQ-6 = questionnaire du contrôle de l'asthme à 6 items.
Réponse clinique (SINUS-24 et SINUS-52)
Les résultats des critères d'évaluation principaux et secondaires pour les études portant sur la polypose naso-sinusienne sont présentés dans le tableau 20.
Tableau 20: Résultats des critères d'évaluation principaux et secondaires dans les études cliniques portant sur la polypose naso-sinusienne
|
|
SINUS -24
|
SINUS -52
| |
|
Placebo
(n=133)
|
Dupilumab
300mg 1x/2sem
(n=143)
|
Variation moyenne des MC par rapport au placebo
(IC à 95%)
|
Placebo
(n=153)
|
Dupilumab
300mg 1x/2sem
(n=295)
|
Variation moyenne des MC par rapport au placebo
(IC à 95%)
| |
Critères d'évaluation Principaux à la Semaine 24
| |
Scores
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
| |
SPN
|
5,86
|
0,17
|
5,64
|
-1,89
|
-2,06
(-2,43; -1,69)
|
5,96
|
0,10
|
6,18
|
-1,71
|
-1,80
(-2,10; -1,51)
| |
CN
|
2,45
|
-0,45
|
2,26
|
-1,34
|
-0,89
(-1,07; -0,71)
|
2,38
|
-0,38
|
2,46
|
-1,25
|
-0,87
(-1,03; -0,71)
| |
Critères d'évaluation secondaires clés à la Semaine 24
| |
Scores
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
| |
Score TDM de LMK des sinus
|
19,55
|
-0,74
|
18,55
|
-8,18
|
-7,44
(-8,35; -6,53)
|
17,65
|
-0,09
|
18,12
|
-5,21
|
-5,13
(-5,80; -4,46)
| |
Score total des symptômes
|
7,28
|
-1,17
|
6,82
|
-3,77
|
-2,61
(-3,04; -2,17)
|
7,08
|
-1,00
|
7,30
|
-3,45
|
-2,44
(-2,87; -2,02)
| |
UPSIT
|
14,44
|
0,70
|
14,68
|
11,26
|
10,56
(8,79; 12,34)
|
13,78
|
-0,81
|
13,53
|
9,71
|
10,52
(8,98; 12,07)
| |
Perte de l'odorat
|
2,73
|
-0,29
|
2,70
|
-1,41
|
-1,12
(-1,31; -0,93)
|
2,72
|
-0,23
|
2,77
|
-1,21
|
-0,98
(-1,15; -0,81)
| |
SNOT-22
|
50,87
|
-9,31
|
48,0
|
-30,43
|
-21,12
(-25,17; -17,06)
|
53,48
|
-10,40
|
51,02
|
-27,77
|
-17,36
(-20,87; -13,85)
| |
EVA
|
7,96
|
-1,34
|
7,42
|
-4,54
|
-3,20
(-3,79; -2,60)
|
7,98
|
-1,39
|
8,01
|
-4,32
|
-2,93
(-3,45, -2,40)
|
Une réduction du score représente une amélioration, à l'exception du test UPSIT où une augmentation du score représente une amélioration.
Le score total des symptômes est un score composite de la sévérité consistant en la somme des symptômes quotidiens de la congestion nasale, perte de l'odorat et de la rhinorrhée antérieure/postérieure.
CN = congestion nasale, SPN = score de polypose nasale; LMK = score TDM de Lund-Mackay total; UPSIT = score d'identification des odeurs de l'Université de Pennsylvanie; SNOT-22 = questionnaire d'évaluation des symptômes naso-sinusiens à 22 items; STS = score total des symptômes; EVA = échelle visuelle analogique pour la rhinosinusite (toutes valeurs p <0,0001, nominales pour l'EVA)
Les résultats de l'étude SINUS-52 à la semaine 52 sont présentés dans le tableau 21.
Tableau 21: Résultats d'efficacité de l'étude SINUS-52 à la semaine 52
|
|
Placebo
(n=153)
|
Dupilumab
300mg 1x/2sem
(n=150)
|
Variation moyenne des MC par rapport au placebo (IC à 95%)
|
Dupilumab
300mg 1x/2sem-1x/4sem
(n=145)
|
Variation moyenne des MC par rapport au placebo (IC à 95%)
| |
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
|
Moyenne à l'inclusion dans l'étude
|
Variation moyenne des MC
| |
SPN
|
5,96
|
0,15
|
6,07
|
-2,24
|
-2,40
(-2,77; -2,02)
|
6,29
|
-2,06
|
-2,21
(-2,59; -1,83)
| |
CN
|
2,38
|
-0,37
|
2,48
|
-1,35
|
-0,98
(-1,17; -0,79)
|
2,44
|
-1,48
|
-1,10
(-1,29; -0,91)
| |
Score TDM de LMK des sinus
|
17,65
|
0,11
|
18,42
|
-6,83
|
-6,94
(-7,87; -6,01)
|
17,81
|
-5,60
|
-5,71
(-6,64; -4,77)
| |
Score total des symptômes
|
7,08
|
-0,94
|
7,31
|
-3,79
|
-2,85
(-3,35; -2,35)
|
7,28
|
-4,16
|
-3,22
(-3,73; -2,72)
| |
UPSIT
|
13,78
|
-0,77
|
13,46
|
9,53
|
10,30
(8,50; 12,10)
|
13,60
|
9,99
|
10,76
(8,95; 12,57)
| |
Perte de l'odorat
|
2,72
|
-0,19
|
2,81
|
-1,29
|
-1,10
(-1.31, -0.89)
|
2,73
|
-1,49
|
-1,30
(-1,51; -1,09)
| |
SNOT-22
|
53,48
|
-8,88
|
50,16
|
-29,84
|
-20,96
(-25,03; -16,89)
|
51,89
|
-30,52
|
-21,65
(-25,71; -17,58)
| |
EVA
|
7,98
|
-0,93
|
8,24
|
-4,74
|
-3,81
(-4,46; -3,17)
|
7,78
|
-4,39
|
-3,46
(-4,10, -2,81)
|
Une réduction du score représente une amélioration, sauf dans le cas du test UPSIT où c'est une augmentation du score qui représente une amélioration.
Le score total des symptômes est un score composite de sévérité consistant en la somme des symptômes quotidiens de la congestion nasale, la perte de l'odorat et la rhinorrhée antérieure/postérieure.
CN = congestion nasale, SPN = score des polypes nasaux; LMK = score TDM de Lund-Mackay total; UPSIT = score d'identification des odeurs de l'Université de Pennsylvanie; SNOT-22 = questionnaire d'évaluation des symptômes naso-sinusiens à 22 items; STS = score total des symptômes; EVA = échelle visuelle analogique pour la rhinosinusite (toutes les valeurs p <0,0001)
Une efficacité statistiquement et cliniquement significative a été observée dans l'étude SINUS-24 en ce qui concerne l'amélioration du SPN endoscopique bilatéral à la semaine 24. Au cours de la période post-traitement durant laquelle l'administration du dupilumab avait été interrompue, l'effet du traitement a diminué au cours du temps (voir figure 13a). Des résultats similaires ont également été observés dans l'étude SINUS-52 à la semaine 24 et à la semaine 52 avec une amélioration progressive au cours du temps (voir figure 13b).
Figure 13: Variation moyenne des moindres carrés (MC) du score des polypes nasaux bilatéraux (SPN) entre l'inclusion dans l'étude dans les études SINUS-24 et SINUS-52 – Population en ITT
|
Figure 13a. SINUS-24
|
Figure 13b. SINUS-52
| |
|
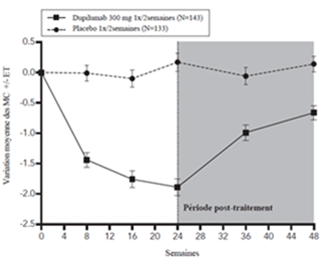
|
|
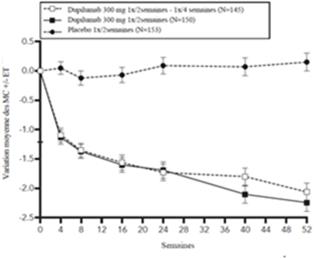
|
Dans les deux études, des améliorations significatives de la congestion nasale et de la sévérité de la perte quotidienne de l'odorat ont été observées dès la première évaluation à la semaine 4. La variation moyenne des moindre carrés (MC) pour la congestion nasale (CN) à la semaine 4 dans le groupe dupilumab par rapport au groupe placebo était de -0,41 (IC à 95%: -0,52; -0,30) dans l'étude SINUS-24 et de -0,37 (IC à 95%: -0,46; -0,27) dans l'étude SINUS-52. La variation moyenne des moindres carrés (MC) pour la perte d'odorat à la semaine 4 dans le groupe dupilumab par rapport au groupe placebo était de -0,34 (IC à 95%: -0,44; -0,25) dans l'étude SINUS-24 et de -0,31 (IC à 95%: -0,41; -0,22) dans l'étude SINUS-52.
Une réduction de la proportion de patients présentant une anosmie a été observée dans les études SINUS-24 et SINUS-52. A l'inclusion 74% à 79% des patients présentaient une anosmie, qui a été réduite à 24% dans SINUS-24 et à 30% dans SINUS-52 à la semaine 24 comparé à l'absence de variation dans les bras placebo. Une amélioration du débit nasal inspiratoire de pointe (DNIP) a été observée à la semaine 24 dans les études SINUS-24 et SINUS-52. La variation moyenne des MC dans le groupe dupilumab par rapport au groupe placebo était de 40,4 l/min (IC à 95%: 30,4; 50,4) et de 36,6 l/min (IC à 95%: 28,0; 45,3), respectivement.
Parmi les patients présentant un score EVA de rhinosinusite >7 à l'inclusion, un pourcentage plus élevé de patients a atteint un score EVA ≤7 dans le bras dupilumab comparé au bras placebo (83,3% versus 39,4% dans l'étude SINUS-24 et 75,0% versus 39,3% dans l'étude SINUS-52) à la semaine 24.
Dans une analyse prédéfinie des données regroupées des deux études ajustée en fonction de la multiplicité, le traitement par le dupilumab a entraîné une réduction significative de l'utilisation d'une corticothérapie systémique et du besoin de chirurgie naso-sinusienne par rapport au placebo (HR de 0,24; IC à 95%: 0,17; 0,35) (voir figure 14). La proportion de patients nécessitant une corticothérapie systémique a été réduite de 74% (HR de 0,26; IC à 95%: 0,18; 0,38). Le nombre total de cures de corticothérapie systémique par an a été réduit de 75% (RR de 0,25; IC à 95%: 0,17; 0,37). La dose totale annualisée individuelle moyenne de corticostéroïdes systémiques prescrits (en mg) au cours de la période de traitement était de 71% plus faible dans le groupe dupilumab que dans le groupe placebo (60,5 [531,3] mg versus 209,5 [497,2] mg, respectivement). La proportion de patients nécessitant une intervention chirurgicale a été réduite de 83% (HR de 0,17; IC à 95%: 0,07; 0,46).
Figure 14. Courbe de Kaplan Meier du temps écoulé avant la première corticothérapie systémique et/ou intervention chirurgicale naso-sinusienne pendant la période de traitement – Population en ITT [SINUS-24 et SINUS-52 poolées]
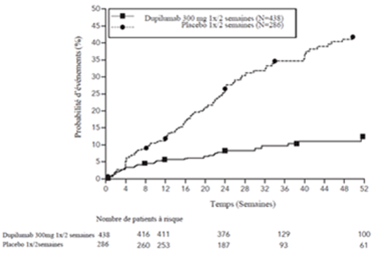
Les effets de dupilumab sur les critères d'évaluation principaux que sont le score des polypes nasaux et la congestion nasale ainsi que les critères d'évaluation secondaires clés sur le score TDM de LMK des sinus étaient similaires chez les patients avant chirurgie et ceux sans chirurgie.
Chez les patients présentant un asthme associé, des améliorations significatives du VEMS et de l'ACQ-6 ont été observées à semaine 24, indépendamment des taux d'éosinophiles sanguins à l'inclusion dans l'étude. La variation moyenne des MC des données regroupées du VEMS entre l'inclusion dans l'étude et la semaine 24 pour le groupe dupilumab 300 1x/2 semaines était de 0,14 contre -0,07 litres pour le groupe placebo, avec une différence de 0,21 litres (IC à 95%: 0,13; 0,29). De plus, des améliorations du VEMS étaient notées dès la première évaluation post inclusion, à la semaine 8 dans l'étude SINUS-24 et à la semaine 4 dans l'étude SINUS-52. Des améliorations de l'ACQ-6 chez les patients présentant un asthme associé ont été observées dans les deux études. La réponse était définie comme une amélioration du score de 0,5 ou plus. La variation moyenne des MC dans le groupe dupilumab et le placebo était de -0,76 (IC à 95%: -1,00 à -0,51) à la semaine 24 dans l'étude SINUS-24 et de -0,94 (IC à 95%: -1,19; -0,69) dans l'étude SINUS-52.
Le taux de réponse ACQ-6 dans le groupe dupilumab 300 mg 1x/2 semaines, à la semaine 24 dans l'étude SINUS-24 était de 56% versus 28% dans le groupe placebo (OR 3,17; IC à 95%: 1,65; 6,09). Le taux de réponse ACQ-6 dans le groupe dupilumab 300 mg 1x/2 semaines, à la semaine 52 dans l'étude SINUS-52 était de 46% versus 14% dans le groupe placebo (OR 7,02; IC à 95%: 3,10; 15,90).
Chez les patients présentant une maladie respiratoire exacerbée par les anti-inflammatoires non stéroïdiens, les effets du dupilumab sur les critères d'évaluation principaux du SPN et de la CN ainsi que les critères d'évaluation secondaires clés sur le score TDM de LMK des sinus étaient similaires avec ceux observés dans la population totale de la PNS.
4) Efficacité Clinique dans le prurigo nodulaire (PN)
Le programme de développement du prurigo nodulaire (PN) comprenait deux études randomisées de 24 semaines, en double aveugle, études multicentriques en groupes parallèles contrôlées par placebo (PRIME et PRIME 2) chez 311 patients âgés de 18 ans et plus avec un PN modéré à sévère, défini comme un prurit sévère (WI-NRS ≥7 sur une échelle de 0 à 10) et supérieur ou égal à 20 lésions nodulaires, dont la maladie n'a pas été suffisamment contrôlée avec des traitements topiques sur ordonnance ou lorsque ces traitements n'étaient pas recommandés. PRIME et PRIME 2 ont évalué l'effet du dupilumab sur l'amélioration des démangeaisons ainsi que son effet sur les lésions de PN, l'indice de qualité de vie dermatologique (DLQI), l'échelle d'anxiété et de dépression hospitalière (HADS) et la douleur cutanée.
Dans ces deux études, les patients ont reçu soit 600 mg de dupilumab sous-cutané (deux injections de 300 mg) le jour 1, suivi de 300 mg une fois toutes les deux semaines (Q2W) pendant 24 semaines, soit un placebo correspondant. Les patients suivant un régime stable de TCS ou TCI de puissance faible à moyenne pourraient continuer leur application concomitante de stéroïdes topiques. Le TCS et le TCI à haute puissance ou super puissants étaient autorisés simultanément en tant que sauvetage.
Dans ces études, l'âge moyen était de 49,5 ans, le poids médian était de 71,3 kg, 65,3% des patients étaient des femmes, 56,6% étaient blancs, 6,1% étaient noirs et 34,1% étaient asiatiques. Au départ, le WI-NRS moyen était de 8,5, 66,3% avaient de 20 à 100 nodules (modéré), 33,7 % avaient plus de 100 nodules (sévère), 99,7% ont reçu des traitements topiques antérieurs, 12,5 % ont reçu des corticostéroïdes systémiques antérieurs, 20,6% ont reçu des immunosuppresseurs systémiques non stéroïdiens et 4,5% de gabapentinoïdes antérieurs. 11% des patients prenaient des doses stables d'antidépresseurs au départ et ont reçu l'instruction de continuer à prendre ces médicaments au cours de l'étude. 43,4% avaient des antécédents d'atopie (définis comme ayant des antécédents médicaux de dermatite atopique, rhinite/rhinoconjonctivite allergique, asthme ou allergie alimentaire).
Le WI-NRS est composé d'un seul élément, noté sur une échelle de 0 («pas de démangeaison») à 10 («pire imaginable»). On a demandé aux participants d'évaluer l'intensité de leur pire prurit (démangeaison) au cours des dernières 24 heures en utilisant cette échelle. L'IGA PN-S est une échelle qui mesure le nombre approximatif de nodules à l'aide d'une échelle en 5 points allant de 0 (clair) à 4 (sévère).
Le critère d'évaluation principal de l'efficacité était la proportion de patients présentant une amélioration (réduction) WI-NRS par ≥4. Les principaux critères d'évaluation secondaires comprenaient la proportion de participants avec IGA PN-S 0 ou 1 (l'équivalent de 0-5 nodules).
Les résultats d'efficacité des études PRIME et PRIME 2 sont présentés dans le tableau 22.
Tableau 22: Résultats des critères d'évaluation primaires et secondaires de PRIME et PRIME 2
|
|
Placebo
(N=76)
|
Dupilumab 300 mg Q2W
(N=75)
|
Différence (95% CI) pour Dupilumab vs. Placebo
|
Placebo
(N=82)
|
Dupilumab 300 mg Q2W
(N=78)
|
Différence (95% CI) pour Dupilumab vs. Placebo
| |
|
PRIME
|
PRIME2
| |
Proportion des patients présentant une amélioration (réduction) du WI-NRS de ≥4 points du départ à la semaine 24 (Critère d'évaluation principal de PRIME) b
|
18,4%
|
60,0%
|
42,7%
(27,76; 57,72)
|
19,5%
|
57,7%
|
42,6%
(29,06; 56,08)
| |
Proportion des patients présentant une amélioration (réduction) du WI-NRS de ≥4 points du départ à la semaine 12 (Critère d'évaluation principal de PRIME2) b
|
15,8% a
|
44,0% a
|
29,2%
(14,49; 43,81) a
|
22,0%
|
37,2%
|
16,8%
(2,34; 31,16)
| |
Proportion des patients avec un IGA PN-S 0 ou 1 à la semaine 24. b
|
18,4%
|
48,0%
|
28,3%
(13,41; 43,16)
|
15,9%
|
44,9%
|
30,8%
(16,37; 45,22)
| |
Proportion des patients présentant à la fois une amélioration (réduction) du WI-NRS de ≥4 points du départ à la semaine 24 et un IGA PN-S 0 ou 1 à la semaine 24 b
|
9,2%
|
38,7%
|
29,6%
(16,42; 42.81)
|
8,5%
|
32,1%
|
25,5%
(13,09; 37,86)
| |
% différence de WI-NRS du départ à la semaine 24 (ES)
|
-22,22 (5,74)
|
-48,89 (5,61)
|
-26,67
(-38,44; -14,90)
|
-36,18 (6,21)
|
-59,34 (6,39)
|
-23,16
(-33,81, -12,51)
| |
Changement de DLQI du départ à la semaine 24 (ES)
|
-5,77 (1,05)
|
-11,97 (1,02)
|
-6,19
(-8,34; -4,05)
|
-6,77 (1,18)
|
-13,16 (1,21)
|
-6,39
(-8,42; -4,36)
| |
Changement de la valeur NRS de douleur cutanée du départ à la semaine 24 (ES)c
|
-2,16 (0,44)
|
-4,33 (0,43)
|
-2,17
(-3,07; -1,28)
|
-2,74 (0,51)
|
-4,35 (0,53)
|
-1,61
(-2,49; -0,73)
| |
Changement par rapport à la valeur à l'inclusion du score HADS à la semaine 24 (ES)c
|
-2,02 (0,94)
|
-4,62 (0,93)
|
-2,60
(-4,52; -0,67)
|
-2,59 (1,03)
|
-5,55 (1,06)
|
-2,96
(-4,73; -1,19)
|
a Non ajusté à la multiplicité dans PRIME.
b Les sujets ayant reçu un traitement de secours plus tôt ou ayant des données manquantes ont été considérés comme des non-répondeurs.
c Les sujets qui ont reçu un traitement de secours plus tôt ou qui ont arrêté en raison d'un manque d'efficacité ont été imputés en utilisant la pire observation reportée; les autres données manquantes ont été imputées par imputation multiple.
Les effets du traitement sur les sous-groupes (poids, âge, genre, race et traitements antérieurs incluant les immunosuppresseurs) dans PRIME et PRIME2 étaient cohérents avec les résultats dans l'ensemble de la population de l'étude.
5) Œsophagite à éosinophiles (EoE)
Efficacité clinique chez les adultes et adolescents atteints d'EoE
Le programme de développement de l'œsophagite à éosinophiles comprenait un protocole en trois parties jusqu'à 52 semaines (TREET) consistant en deux études distinctes randomisées, en double aveugle, en groupes parallèles, multicentriques, contrôlées contre placebo, d'une durée de 24 semaines (TREET partie A et TREET partie B) suivies d'une étude d'extension du traitement actif de 28 semaines (TREET partie C) chez des patients adultes et pédiatriques âgés de 12 à 17 ans, à l'exclusion des patients pesant moins de 40 kg. Tous les patients étaient réfractaires aux IPP puisqu'ils devaient présenter un nombre d'éosinophiles intraépithéliaux (eos) ≥15 par champ de haute puissance (high-power field, hpf) après un traitement d'au moins 8 semaines par un inhibiteur de la pompe à protons (IPP) à forte dose, soit avant, soit pendant la période de sélection. Les patients devaient également avoir un score au questionnaire sur les symptômes de la dysphagie (Dysphagia Symptom Questionnaire, DSQ) ≥10 sur une échelle de 0 à 84. Les patients ont été répartis en fonction de la tranche d'âge au moment de la visite de sélection (12 à 17 ans vs 18 ans et plus) et de l'utilisation d'un IPP au moment de la randomisation. L'étude TREET Partie A a été menée en premier. L'étude TREET partie B a été initiée une fois le recrutement à l'étude TREET partie A était terminé. Les patients ayant terminé les 24 semaines de la période de traitement en double aveugle dans les parties A ou B ont eu la possibilité de s'inscrire à une étude d'extension du traitement actif de 28 semaines (TREET partie C).
Dans la partie A, un total de 81 patients, dont 61 adultes et 20 adolescents âgés de 12 à 17 ans, ont été randomisés pour recevoir 300 mg de dupilumab une fois par semaine (N = 42) ou un placebo (N = 39). Dans la partie B, un total de 240 patients, dont 161 adultes et 79 adolescents âgés de 12 à 17 ans, ont été randomisés pour recevoir soit 300 mg de dupilumab une fois par semaine (N = 80), soit 300 mg de dupilumab toutes les deux semaines (N = 81; le schéma posologique de 300 mg toutes les deux semaines n'est pas approuvé pour l'œsophagite à éosinophiles), soit un placebo (N = 79). Dans la partie C, tous les patients ayant précédemment participé dans la partie A ont reçu 300 mg de dupilumab (N = 77) une fois par semaine. Parmi les patients ayant précédemment participé à la partie B, ceux qui ont reçu du dupilumab dans la partie B ont poursuivi leur schéma posologique dans la partie C et ceux qui ont reçu un placebo ont été randomisés pour recevoir l'un ou l'autre schéma posologique. Le recours à des corticostéroïdes systémiques et/ou topiques oraux ou à une dilatation œsophagienne d'urgence était autorisé pendant l'étude, à la discrétion de l'investigateur.
Dans la partie A, 74,1% des patients inscrits avaient déjà utilisé des corticostéroïdes topiques oraux pour le traitement de l'œsophagite à éosinophiles et 43,2% avaient déjà subi une dilatation de l'œsophage. Dans la partie B, 73,3% des patients inscrits avaient déjà utilisé des corticostéroïdes topiques oraux pour le traitement de l'œsophagite à éosinophiles et 35,4% avaient déjà subi une dilatation de l'œsophage.
Les co-critères d'évaluation principaux de l'efficacité dans les deux essais étaient la proportion de patients atteignant une rémission histologique définie par un taux maximal d'éosinophiles intraépithéliaux œsophagiens ≤6 eos/hpf à la semaine 24 et le changement absolu du score du questionnaire sur les symptômes de la dysphagie (DSQ) rapporté par le patient entre le début de l'étude et la semaine 24. Les critères d'évaluation secondaires comprenaient les changements suivants par rapport à l'inclusion dans l'étude: variation en pourcentage du nombre maximal d'éosinophiles intraépithéliaux œsophagiens (eos/hpf), changement absolu du score moyen de grade du système d'évaluation histologique de l'EoE (Eosinophilic Esophagitis Histology Scoring System, EoEHSS), changement absolu du score moyen de stade de l'EoEHSS, changement absolu du score de référence endoscopique de l'EoE (EoE-Endoscopic Reference Score, EoE-EREFS), et proportion de patients atteignant un nombre maximal d'éosinophiles intraépithéliaux œsophagiens ≤15 eos/hpf.
Les données démographiques et les caractéristiques initiales des études TREET, parties A et B, sont présentées dans le tableau 23.
Tableau 23: Données démographiques et caractéristiques initiales (TREET, parties A et B)
|
Paramètres
|
TREET Partie A
(N=81)
|
TREET Partie B
(N=240)
| |
Age moyen (années) (ET)
|
31,5 (14,3)
|
28,1 (13,1)
| |
% patients de sexe masculin
|
60,5
|
63,8
| |
% de race blanche
|
96,3
|
90,4
| |
Poids (kg), moyenne (ET)
|
77,8 (21,0)
|
76,2 (20,6)
| |
IMC (kg/m2), moyenne (ET)
|
26,1 (6,3)
|
25,7 (6,2)
| |
Durée de l'EoE (ans), moyenne (ET)
|
5,01 (4,3)
|
5,57 (4,8)
| |
Utilisation antérieure de stéroïdes topiques oraux (%)
|
74,1
|
73,3
| |
Antécédents de dilatation de l'oesophage (%)
|
43,2
|
35,4
| |
Utilisation d'IPP lors de la randomisation (%)
|
67,9
|
72,5
| |
Régime d'éviction alimentaire au moment de la visite de sélection (%)
|
40,7
|
37,1
| |
DSQ (0-84a), moyenne (ET)
|
33,6 (12,4)
|
36,7 (11,2)
| |
Nombre maximal d'éosinophiles intraépithéliaux œsophagiens de 3 régions, moyenne (ET)
|
89,3 (48,3)
|
87,1 (45,8)
| |
Nombre moyen d'éosinophiles intraépithéliaux œsophagiens de 3 régions, moyenne (ET)
|
64,3 (37,6)
|
60,5 (32,9)
| |
Score de grade EoEHSS [0-3a], moyenne (ET)
|
1,3 (0,4)
|
1,3 (0,4)
| |
Score de stade EoEHSS [0-3a], moyenne (ET)
|
1,3 (0,4)
|
1,3 (0,3)
| |
Score total EREFS [0-18a], moyenne (ET)
|
6,3 (2,8)
|
7,2 (3,2)
|
aUn score plus élevé indique une plus grande gravité de la maladie
ET = écart type
Les résultats des études TREET parties A et B sont présentés dans le tableau 24.
Tableau 24: Résultats de l'efficacité du dupilumab à la semaine 24 chez les patients âgés de 12 ans et plus atteints d'œsophagite à éosinophiles (TREET, parties A et B)
|
|
TREET Partie A
|
TREET Partie B
| |
Dupilumab
300 mg 1x/sem
N = 42
|
Placebo
N = 39
|
Différence vs. Placebo
(95% IC)d
|
Dupilumab
300 mg 1x/sem
N = 80
|
Placebo
N = 79
|
Différence vs. Placebo
(95% IC)d
| |
Co-critères d'évaluation principaux
| |
Proportion de patients atteignant une rémission histologique (nombre maximal d'éosinophiles intraépithéliaux œsophagiens ≤6 eos/hpf), n (%)
|
25
(59,5)
|
2
(5,1)
|
55,3
(39,58; 71,04)
|
47
(58,8)
|
5
(6,3)
|
53,5
(41,20; 65,79)
| |
Changement absolu du score du questionnaire sur les symptômes de la dysphagie (DSQ) par rapport à l'inclusion dans l'étude (0-84a), moyenne des MC (ES)
|
-21,92
(2,53)
|
-9,60 (2,79)
|
-12,32
(-19,11; -5,54)
|
-23,78
(1,86)
|
-13,86
(1,91)
|
-9,92
(-14,81; -5,02)
| |
Critères d'évaluation secondaires
| |
Variation en pourcentage du nombre maximal d'éosinophiles intraépithéliaux œsophagiens par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-71,24
(6,95)
|
-2,98
(7,60)
|
-68,26
(-86,90; -49,62)
|
-80,24
(8,34)
|
8,38
(10,09)
|
-88,62
(-112,19; 65,05)
| |
Changement absolu du score de grade EoEHSS (0-3b) par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-0,76
(0,06)
|
-0,00 (0,06)
|
-0,76
(-0,91; -0,61)
|
-0,83
(0,04)
|
-0,15
(0,05)
|
-0,682
(-0,79; -0,57)
| |
Changement absolu du score de stade EoEHSS (0-3b) par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-0,75
(0,06)
|
-0,01 (0,06)
|
-0,74
(-0,88, -0,60)
|
-0,80
(0,04)
|
-0,13
(0,04)
|
-0,672
(-0,78; -0,57)
| |
Changement absolu du score EoE-EREFS (0-18c) par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-3,2
(0,41)
|
-0,3
(0,41)
|
-2,9
(-3,91; -1,84)
|
-4,5
(0,36)
|
-0,6
(0,38)
|
-3,8
(-4,77; -2,93)
| |
Proportion de patients atteignant un nombre maximal d'éosinophiles intraépithéliaux œsophagiens <15 eos/hpf, n (%)
|
27
(64,3)
|
3
(7,7)
|
57
(41,69; 73,33)
|
66
(82,5)
|
6
(7,6)
|
74,9
(64,25; 85,5)
|
a Les scores totaux bihebdomadaires du DSQ vont de 0 à 84; des scores plus élevés indiquent une fréquence et une sévérité plus importantes de la dysphagie.
b Les scores EoEHSS vont de 0 à 3; des scores plus élevés indiquent une sévérité et une étendue plus importantes des anomalies histologiques.
c Les scores totaux EoE-EREFS vont de 0 à 18; des scores plus élevés indiquent des observations inflammatoires et de remodelage endoscopiques plus graves.
d Différence moyenne en MC (Moindres Carrés) pour les critères continus et différence absolue en proportions pour les critères catégoriques.
Les résultats d'efficacité pour les co-critères d'évaluation principaux et secondaires clés dans le sous-groupe de patients ayant pris des corticostéroïdes topiques oraux et chez les patients insuffisamment contrôlés par les corticostéroïdes topiques oraux, ou qui présentent une intolérance ou une contre-indication à ces traitements étaient cohérents avec la population globale.
Bien que tous les patients aient été réfractaires aux IPP, comme cela a été démontré avant la randomisation de l'étude, certains patients ont continué à prendre des IPP pendant l'étude. Il n'y a pas eu de différence pertinente dans l'atteinte des co-critères d'évaluation principaux de TREET A et B entre le sous-groupe de patients ayant poursuivi l'utilisation concomitante d'IPP et le sous-groupe de patients ayant interrompu l'utilisation d'IPP.
Dans les parties A et B, une plus grande proportion de patients randomisés dans le groupe dupilumab a atteint une rémission histologique (nombre maximal d'éosinophiles intraépithéliaux œsophagiens ≤6 eos/hpf) par rapport au placebo. La proportion de patients présentant une rémission histologique observée après 24 semaines de traitement dans les Parties A et B a été maintenue pendant 52 semaines dans la Partie C.
Le traitement par dupilumab a également conduit à une amélioration significative de la variation moyenne des MC du score DSQ par rapport au placebo dès la semaine 4 et qui s'est maintenue jusqu'à la semaine 24. L'efficacité dans la Partie C était similaire aux résultats observés dans les Parties A et B, avec une amélioration continue pour le DSQ jusqu'à 52 semaines (voir la figure 15 pour les Parties A et C de l'étude TREET et voir la figure 16 pour les Parties B et C de l'étude TREET).
Figure 15: Variation moyenne du score DSQ par rapport à l'inclusion dans l'étude chez les patients âgés de 12 ans et plus atteints d'œsophagite à éosinophiles (TREET, parties A et C)
Figure 16: Variation moyenne du score DSQ par rapport à l'inclusion dans l'étude chez les patients âgés de 12 ans et plus atteints d'œsophagite à éosinophiles (TREET, parties B et C)
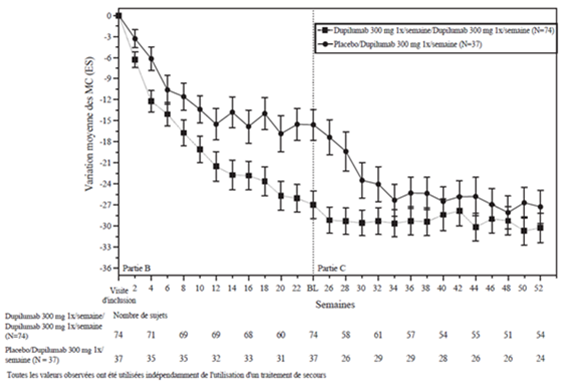
Efficacité clinique chez les enfants âgés de 1 à 11 ans atteints d'EoE et pesant au moins 15 kg
L'efficacité et la sécurité du dupilumab ont été évaluées dans une étude en deux parties (EoE KIDS partie A et partie B) chez des patients pédiatriques âgés de 1 à 11 ans atteints d'EoE. Tous les patients recrutés devaient être en échec de traitement médicamenteux conventionnel (inhibiteurs de la pompe à protons, IPP), 77% des patients étaient traités par un autre traitement médicamenteux conventionnel (corticostéroïdes topiques oraux) avant leur inclusion, et 54% des patients étaient insuffisamment contrôlés par les corticostéroïdes topiques oraux ou présentaient une intolérance ou une contre-indication à ces traitements. Les patients éligibles présentaient un nombre d'éosinophiles intraépithéliaux (eos) ≥15 par champ de haute puissance (high-power field, hpf) malgré un traitement par inhibiteur de la pompe à protons avant ou pendant la période de sélection, et des antécédents de signes et de symptômes de l'EoE. La partie A était une étude randomisée, en double aveugle, en groupes parallèles, multicentrique et contrôlée par placebo, d'une durée de 16 semaines. La partie B était une période d'extension du traitement actif évaluant les schémas posologiques du dupilumab pendant 36 semaines supplémentaires.
La partie A a évalué le dupilumab par rapport à un placebo correspondant à des schémas posologiques basés sur le poids corporel de ≥15 à <30 kg (200 mg toutes les deux semaines) et ≥30 à <60 kg (300 mg toutes les deux semaines). Le schéma posologique du dupilumab a été sélectionné pour les patients pédiatriques âgés de 1 à 11 ans pesant ≥40 kg (300 mg chaque semaine) sur la base de simulations avec un modèle pharmacocinétique de population afin de correspondre aux expositions des patients adultes et pédiatriques âgés de 12 à 17 ans atteints d'EoE recevant 300 mg chaque semaine pour lesquels une efficacité histologique et symptomatique a été observée (voir «Efficacité clinique → Population pédiatrique» et «Pharmacocinétique»).
Au total, 61 patients ont été recrutés dans la partie A. L'âge moyen était de 8 ans (de 1 à 11 ans), le poids médian était de 27,9 kg, 75,4% des patients étaient des hommes, 85,2 % étaient blancs, 11,5% étaient noirs et 1,6% étaient asiatiques. Au total, 59 patients de la partie A ont continué dans la partie B. La majorité des patients recevaient auparavant des corticostéroïdes topiques oraux (CTO) dans le traitement de l'EoE (51 patients sur 61; 83,6%), et 34,4% ont rapportés les CTO comme ayant été efficaces auparavant dans l'EoE. A l'inclusion, le nombre maximal moyen d'éosinophiles intraépithéliaux œsophagiens était respectivement de 97,7 (48,24) et 82,2 (36,14) dans les groupes dupilumab et placebo.
Le critère d'évaluation principal de l'efficacité dans la partie A était la proportion de patients atteignant une rémission histologique définie par un taux maximal d'éosinophiles intraépithéliaux œsophagiens ≤6 eos/hpf à la semaine 16. Les critères d'évaluation secondaires comprenaient la proportion de patients atteignant un nombre maximal d'éosinophiles intraépithéliaux œsophagiens <15 eos/hpf et les changements suivants par rapport à l'inclusion dans l'étude: nombre maximal d'éosinophiles intraépithéliaux œsophagiens (eos/hpf), changement absolu du score moyen de grade du système d'évaluation histologique de l'EoE (Eosinophilic Esophagitis Histology Scoring System, EoEHSS), changement absolu du score moyen de stade de l'EoEHSS et changement absolu du score de référence endoscopique de l'EoE (EoE-Endoscopic Reference Score, EoE-EREFS). L'impact sur les signes de EoE a été mesuré à l'aide des résultats rapportés par les observateurs; le questionnaire pédiatrique sur les signes/symptômes de EoE administré par les soignants (Pediatric EoE Sign/Symptom Questionnaire-Caregiver, PESQ-C) a évalué la proportion de jours avec un ou plusieurs signes de EoE et le score pédiatrique des symptômes de l'œsophagite à éosinophiles (Pediatric Eosinophilic Esophagitis Symptom Score, PEESS) a évalué la fréquence et la sévérité des signes de l'EoE.
Les résultats d'efficacité dans la partie A sont présentés dans le tableau 25.
Tableau 25: Résultats de l'efficacité du dupilumab à la semaine 16 chez les sujets âgés de 1 à 11 ans atteints d'œsophagite à éosinophiles et pesant au moins 15 kg (EoE KIDS, partie A)
|
|
Dupilumaba
N=32
|
Placebo
N=29
|
Différence vs Placebo
(95% IC)
| |
Critère d'évaluation principal
| |
Proportion de sujets atteignant une rémission histologique (nombre maximal d'éosinophiles intraépithéliaux œsophagiens ≤6 eos/hpf), n (%)b
|
21
(65,6)
|
1
(3,4)
|
62,0
(44,00; 79,95)
| |
Critères d'évaluation secondaires
| |
Proportion de sujets atteignant un nombre maximal d'éosinophiles intraépithéliaux œsophagiens <15 eos/hpf, n (%)b
|
26 (81,3)
|
1
(3,4)
|
78,0
(63,10; 92,86)
| |
Variation en pourcentage du nombre maximal d'éosinophiles intraépithéliaux œsophagiens par rapport à l'inclusion dans l'étude (eos/hpf), moyenne des MC (ES)c
|
-83,99
(13,25)
|
20,42
(13,67)
|
-104,41
(-142,06; -66,75)
| |
Changement absolu du score de grade (0-3d) EoEHSS par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-0,907
(0,05)
|
-0,010
(0,05)
|
-0,897
(-1,04; -0,75)
| |
Changement absolu du score de stade (0-3d) EoEHSS par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-0,874
(0,05)
|
-0,002
(0,05)
|
-0,871
(-1,01; -0,73)
| |
Changement absolu du EoE-EREFS (0-18e) par rapport à l'inclusion dans l'étude, moyenne des MC (ES)
|
-3,6
(0,42)
|
0,0
(0,46)
|
-3,6
(-4,89; -2,40)
|
a Dupixent a été évalué selon des schémas posologiques progressifs en fonction du poids corporel: ≥15 à <30 kg (200 mg toutes les deux semaines) et ≥30 à <60 kg (300 mg toutes les deux semaines).
b Pour la rémission histologique, la différence de pourcentage est estimée à l'aide de la méthode de Mantel-Haenszel, en tenant compte du groupe de poids corporel à l'inclusion dans l'étude (≥15 à <30 kg et ≥30 à <60 kg).
c La différence dans le changement absolu ou le changement en pourcentage est estimée à l'aide du modèle ANCOVA avec la mesure à l'inclusion dans l'étude comme covariable et le traitement, le groupe de poids à l'inclusion dans l'étude (≥15 à <30 kg et ≥30 à <60 kg) comme facteurs fixes.
d Les scores EoEHSS vont de 0 à 3; des scores plus élevés indiquent une sévérité et une étendue plus importantes des anomalies histologiques. Les scores moyens de grade EoEHSS à l'inclusion étaient respectivement 1,35 (0,42) et 1,30 (0,37) dans les groupes dupilumab et placebo, et les scores moyens de stade EoEHSS à l'inclusion étaient respectivement de 1,31 (0,32) et 1,33 (0,37) dans les groupes dupilumab et placebo.
e Les scores totaux EoE-EREFS vont de 0 à 18; des scores plus élevés indiquent des observations inflammatoires et de remodelage endoscopiques plus graves.
Dans la partie B, la rémission histologique a été atteinte à la semaine 52 par 17 des 32 patients traités avec le dupilumab dans les parties A et B, et par 8 des 15 patients traités avec le placebo dans la partie A et avec le dupilumab dans la partie B.
Une amélioration numérique de la proportion de jours avec un ou plusieurs signes de l'EoE (selon le PESQ-C) a été observée chez les sujet traités par dupilumab par comparés au placebo après 16 semaines de traitement dans la partie A.
6) Efficacité clinique dans la broncho-pneumopathie chronique obstructive (BPCO)
Le programme de développement de la broncho-pneumopathie chronique obstructive (BPCO) a inclus deux études randomisées, en double aveugle, multicentriques, en groupes parallèles, contrôlées contre placebo (BOREAS et NOTUS) d'une durée de traitement de 52 semaines qui ont inclus un total de 1874 patients adultes atteints de BPCO pour évaluer le dupilumab en traitement de fond additionnel.
Les deux études ont inclus des patients ayant reçu un diagnostic de BPCO avec une limitation modérée à sévère du débit d'air (rapport VEMS/CVF post-bronchodilatateur <0,7 et VEMS post-bronchodilatateur de 30 % à 70% de la valeur prédite), une toux productive chronique pendant au moins 3 mois au cours de l'année écoulée et un taux minimum d'éosinophiles sanguins de 300 cellules/µL à l'inclusion dans l'étude. Les patients étaient incontrôlés avec un score de dyspnée du conseil de la recherche médicale (Medical Research Council, MRC) ≥2 (intervalle 0-4) et des antécédents d'exacerbation d'au moins 2 exacerbations modérées ou 1 exacerbation sévère au cours de l'année précédente malgré un traitement de fond par trithérapie consistant en un antagoniste muscarinique à longue durée d'action (long-acting muscarinic antagonist, LAMA), un béta agoniste à longue durée d'action (long-acting beta agonist, LABA) et un corticostéroïde inhalé (CSI). Les patients étaient autorisés à recevoir un traitement de fond comportant un LAMA et un LABA si un CSI était contre-indiqué. Les exacerbations ont été définies comme étant de sévérité modérée si un traitement par corticostéroïdes systémiques et/ou antibiotiques a été nécessaire, ou comme étant sévères si elles ont entraîné une hospitalisation ou une observation de plus de 24 heures dans un service d'urgence ou un centre de soins d'urgence.
Dans les deux études, les patients ont été randomisés pour recevoir dupilumab 300 mg toutes les deux semaines (Q2W) ou un placebo en plus de leur traitement d'entretien de fond pendant 52 semaines.
Dans les deux études, le critère d'évaluation principal était le taux annualisé d'exacerbations modérées ou sévères de BPCO pendant la période de traitement de 52 semaines. Les critères d'évaluation secondaires comprenaient les variations du VEMS pré-bronchodilatateur entre l'inclusion dans l'étude et les semaines 12 et 52 dans la population globale et dans le sous-groupe de patients présentant une FeNO initiale ≥20 ppb, la variation du score total au questionnaire respiratoire St. Georges (St. George's Respiratory Questionnaire, SGRQ) entre l'inclusion dans l'étude et la semaine 52, et le taux annualisé d'exacerbations modérées ou sévères de BPCO dans le sous-groupe de patients présentant une FeNO initiale ≥20 ppb au cours de la période de traitement de 52 semaines.
Les données démographiques et les caractéristiques initiales des études BOREAS et NOTUS sont présentées dans le tableau 26.
Tableau 26: Données démographiques et caractéristiques à l'inclusion (BOREAS et NOTUS)
|
Paramètres
|
BOREAS
(N = 939)
|
NOTUS
(N = 935)
| |
Age moyen (années) (± ET)
|
65,1 (8,1)
|
65,0 (8,3)
| |
% d'hommes
|
66,0
|
67,6
| |
% de patients caucasiens
|
84,1
|
89,6
| |
Antécédents moyens de tabagisme (pack-années) (± ET)
|
40,5 (23,4)
|
40,3 (27,2)
| |
Fumeurs actifs (%)
|
30
|
29,5
| |
Emphysème (%)
|
32,6
|
30,4
| |
Durée moyenne de la BPCO (années) (± ET)
|
8,8 (6,0)
|
9,3 (6,4)
| |
Nombre moyen d'exacerbations modéréesa ou sévèresb au cours de l'année précédente (± ET)
|
2,3 (1,0)
|
2,1 (0,9)
| |
Nombre moyen d'exacerbations sévèresb au cours de l'année précédente (± ET)
|
0,3 (0,7)
|
0,3 (0,6)
| |
Traitements de fond de la BPCO à l'inclusion:
CSI/LAMA/LABA (%)
|
97,6
|
98,8
| |
Moyenne du rapport VEMS/CVF post-bronchodilatateur (± ET)
|
0,49 (0,12)
|
0,50 (0,12)
| |
Moyenne du VEMS (L) pré-bronchodilatateur (± ET)
|
1,30 (0,46)
|
1,36 (0,50)
| |
Moyenne du VEMS (L) post-bronchodilatateur (± ET)
|
1,40 (0,47)
|
1,45 (0,49)
| |
Moyenne du VEMS post-bronchodilatateur en % de la valeur prédite (± ET)
|
50,6 (13,1)
|
50,1 (12,6)
| |
Score total moyen SGRQ (± ET)
|
48,4 (17,4)
|
51,5 (17,0)
| |
Score E-RS:BPCO moyen (± ET)
|
12,9 (7,1)
|
13,3 (7,0)
| |
Score de l'index BODE moyen (± ET)
|
4,1 (1,7)
|
4,0 (1,6)
| |
FeNO moyenne (ppb) (± ET)
|
24,3 (22,4)
|
24,6 (26,0)
| |
Taux moyen d'éosinophiles sanguins à l'inclusion (cellules/µL) (± ET)
|
401 (298)
|
407 (336)
|
CSI = corticostéroïde inhalé; LAMA = antagoniste muscarinique à longue durée d'action; LABA = bêta agoniste à longue durée d'action; VEMS = volume expiratoire maximal par seconde; CVF = capacité vitale forcée; FeNO = fraction de monoxyde d'azote expiré; BODE = indice de masse corporelle, obstruction du flux d'air, dyspnée, capacité à l'effort (body-mass index, airflow obstruction, dyspnea, exercise capacity, BODE)
a Exacerbations traitées par corticostéroïdes systémiques et/ou antibiotiques
b Exacerbations nécessitant une hospitalisation ou une surveillance de plus de 24 heures dans un service d'urgences ou un établissement de soins d'urgence
Exacerbations
Dans les deux études, dupilumab a montré une réduction statistiquement significative du taux annualisé d'exacerbations modérées ou sévères de BPCO par rapport au placebo lorsqu'il était associé au traitement d'entretien de fond (voir tableau 27).
Tableau 27: Taux annualisé d'exacerbations modéréesa ou sévèresb de BPCO dans les études BOREAS et NOTUS
|
Etude
|
Traitement
(N)
|
Taux (exacerbations/an)
|
Risque relatif vs. Placebo
(IC à 95 %)
|
% de réduction du taux d'exacerbation versus placebo
| |
Critère d'évaluation principal: Exacerbations modéréesa ou sévèresb de BPCO
| |
BOREAS
|
Dupixent 300 mg toutes les 2 semaines
(N = 468)
|
0,78
|
0,705
(0.581, 0.857)c
|
30 %
| |
Placebo
(N = 471)
|
1,10
|
|
| |
NOTUS
|
Dupixent 300 mg toutes les 2 semaines
(N = 470)
|
0,86
|
0,664
(0.535, 0.823)d
|
34 %
| |
Placebo
(N = 465)
|
1,30
|
|
| |
Composant poolé du critère d'évaluation principale: Exacerbations sévères de BPCO
| |
BOREAS et NOTUS
|
Dupixent 300 mg toutes les 2 semaines
(N = 938)
|
0,08
|
0,674
(0,438 à 1,037)
|
33 %
| |
Placebo
(N = 936)
|
0,12
|
|
|
a Exacerbations traitées par corticostéroïdes systémiques et/ou antibiotiques
b Exacerbations nécessitant une hospitalisation, ou une surveillance > 24 heures dans un service d'urgences/établissement de soins d'urgence ou entraînant le décès
c Valeur p = 0,0005
d Valeur P = 0,0002
e L'analyse du composant du critère d'évaluation principal n'a pas été ajustée en fonction de la multiplicité
Dans les deux études, le nombre moyen cumulé d'exacerbations modérées ou sévères observées sur 52 semaines a été plus faible chez les sujets recevant du dupilumab par rapport au placebo (voir Figures 17 et 18).
Figure 17: Nombre moyen cumulé d'exacerbations modérées ou sévères de BPCO sur 52 semaines dans BOREAS

Figure 18: Nombre moyen cumulé d'exacerbations modérées ou sévères de BPCO sur 52 semaines dans NOTUS

Le délai jusqu'à la première exacerbation modérée ou sévère de BPCO a été plus long chez les patients recevant du dupilumab que chez les patients recevant un placebo dans BOREAS (RR: 0,80; IC 95%: 0,66; 0,98) et NOTUS (RR: 0,71; IC 95%: 0,57; 0,889).
Dans l'analyse des sous-groupes de patients présentant une FeNO initiale plus élevée (≥20 ppb) dans BOREAS (N = 383), le traitement par le dupilumab a réduit de façon statistiquement significative le taux annualisé d'exacerbations modérées ou sévères de BPCO par rapport au placebo (Ratio: 0,625; IC 95%: 0,45; 0,869; p = 0,005). Dans NOTUS, le traitement par dupilumab a montré une réduction nominale significative du taux annualisé d'exacerbations modérées ou sévères de BPCO dans le sous-groupe de patients présentant une FeNO initiale plus élevée (≥20 ppb) (N = 355) que dans le groupe placebo (RR: 0,47; IC 95%: 0,33; 0,68).
Des réductions du taux annualisé d'exacerbations modérées ou sévères ont été observées dans tous les sous-groupes prédéfinis, y compris l'âge, le sexe, la race, le tabagisme, le taux d'éosinophiles sanguins, le nombre d'exacerbations au cours de l'année précédente (≤2, 3 et ≥4), les CSI à forte dose à l'inclusion et le VEMS post-bronchodilatateur en pourcentage de la valeur prédite à l'inclusion (<50 %, ≥50 %). Chez les patients présentant un emphysème, la réduction du taux annualisé d'exacerbations modérées ou sévères était cohérente avec la population globale.
Fonction pulmonaire
Dans les deux études, dupilumab a montré une amélioration statistiquement significative du VEMS pré-bronchodilatateur aux semaines 12 et 52 par rapport au placebo lorsqu'il est associé à un traitement d'entretien de fond (voir tableau 28). Des améliorations plus importantes de la fonction pulmonaire (variation moyenne des MC par rapport à l'inclusion du VEMS pré-bronchodilatateur) ont été observées chez les patients traités par dupilumab par rapport au placebo dès la semaine 2 (BOREAS) (première évaluation) et dès la semaine 4 (NOTUS) et se sont maintenues à la semaine 52.
Dans BOREAS, des améliorations rapides du VEMS post-bronchodilatateur, du rapport VEMS/CVF post-bronchodilatateur et de la CVF pré-bronchodilatateur ont été observées avec le traitement par dupilumab par rapport au placebo dès la semaine 2 (première évaluation) et se sont maintenues jusqu'à la semaine 52. Dans NOTUS, des améliorations rapides du VEMS post-bronchodilatateur et du rapport VEMS/CVF post-bronchodilatateur ont été observées avec le traitement par dupilumab par rapport au placebo dès la semaine 8 et la semaine 2, respectivement, et se sont maintenues jusqu'à la semaine 52.
Tableau 28: Variation moyenne par rapport à l'inclusion des critères d'évaluation de la fonction pulmonaire dans BOREAS et NOTUS
|
|
|
BOREAS
|
|
|
NOTUS
|
| |
|
Dupilumab
(N = 468)
|
Placebo
(N=471)
|
Différence (IC 95%) entre le dupilumab et le placebo
|
Dupilumab
(N = 470)
|
Placebo
(N = 465)
|
Différence (IC 95%) entre le dupilumab et le placebo
| |
Variation du VEMS pré-bronchodilatateur à la semaine 12 par rapport à l'inclusion, MC Moyen (ES)
|
0,160 (0,018)
|
0,077
(0,018)
|
0,083
(0,042 à 0,125)a
|
0,139 (0,017)
|
0,057 (0,017)
|
0,082 (0,040 à 0,124)f
| |
Variation du VEMS pré-bronchodilatateur à la semaine 52 par rapport à l'inclusion, MC Moyen (ES)k
|
0,153 (0,019)
|
0,070
(0,019)
|
0,083
(0,038 à 0,128)b
|
0,115 (0,021)
|
0,054 (0,020)
|
0,062
(0,011 à 0,113)g
| |
Variation du VEMS post-bronchodilatateur à la semaine 12 par rapport à l'inclusion, MC Moyen (ES)
|
0,156 (0,018)
|
0,084
(0,018)
|
0,072
(0,030 à 0,115)c
|
0,136 (0,020)
|
0,064 (0,020)
|
0,072 (0,023 à 0,121)h
| |
Variation du rapport VEMS/CVF post-bronchodilatateur à la semaine 12 par rapport à l'inclusion, MC Moyen (ES)
|
0,037 (0,004)
|
0,023
(0,004)
|
0,014
(0,005 à 0,023)d
|
0,030 (0,004)
|
0,013 (0,004)
|
0,017 (0,006 à 0,028)i
| |
Variation de la CVF pré-bronchodilatateur à la semaine 12 par rapport à l'inclusion, MC Moyen (ES)
|
0,098 (0,022)
|
0,029
(0,022)
|
0,069
(0,016 à 0,121)e
|
0,083 (0,024)
|
0,018 (0,024)
|
0,066 (0,005 à 0,126)j
|
MC = moindres carrés, ES = erreur standard, VEMS = volume expiratoire maximal par seconde, CVF = capacité vitale forcée
avaleur p < 0,0001; bvaleur p = 0,0003 (tous statistiquement significatifs contre placebo avec ajustement en fonction de la multiplicité);
cvaleur p nominale = 0,0010; dvaleur p nominale = 0,0016; evaleur p nominale = 0,0103;
fvaleur p nominale = 0,0001; gvaleur p nominale = 0,0182 (tous statistiquement significatifs contre placebo avec ajustement en fonction de la multiplicité);
hvaleur p nominale = 0,0042; ivaleur p nominale = 0,0020; jvaleur p nominale = 0,0327;
kLes résultats d'efficacité portant sur la variation moyenne par rapport à l'inclusion du VEMS pré-bronchodilatateur à la semaine 52 sont présentés pour 721 des 935 patients qui ont terminé la période de traitement de 52 semaines ou qui avaient interrompu l'étude au moment de l'analyse des données.
Dans l'analyse du sous-groupe de patients présentant une FeNO initiale plus élevée (≥20 ppb) dans BOREAS (N=383), le traitement par dupilumab a amélioré de façon statistiquement significative par rapport à linclusion le VEMS pré-bronchodilatateur à la semaine 12 (variation moyenne des MC: 0,232 pour le dupilumab vs 0,108 pour le placebo; différence moyenne des MC: 0,124 [IC 95%: 0,045; 0,203]; p = 0,002) et à la semaine 52 (variation moyenne des MC: 0,247 pour le dupilumab vs 0,120 pour le placebo; différence moyenne des MC: 0,127 [IC 95%: 0,042; 0,212]; p = 0,003) par rapport au placebo. Dans NOTUS, une amélioration statistiquement significative par rapport à l'inclusion a été observée dans le sous-groupe de patients présentant une FeNO initiale plus élevée (≥20 ppb) et traités par le dupilumab à la semaine 12 (N = 355; variation moyenne des MC: 0,221 pour le dupilumab vs 0,081 pour le placebo; différence moyenne des MC: 0,141 [IC 95%: 0,058 – 0,223]; p = 0,001) par rapport au placebo. Le traitement par dupilumab a amélioré le VEMS pré-bronchodilatateur à la semaine 52 dans le sous-groupe de patients ayant une FeNO initiale plus élevée (≥20 ppb) dans l'étude NOTUS (N = 264; variation moyenne des MC: 0,176 pour le dupilumab vs 0,095 pour le placebo; différence moyenne des MC: 0,081 [IC 95%: -0,019; 0,181]) par rapport au placebo, mais n'a pas atteint la signification statistique.
Des améliorations de la fonction pulmonaire mesurée par le VEMS pré-bronchodilatateur ont été observées dans tous les sous-groupes prédéfinis, y compris l'âge, le sexe, la race, le statut tabagique, le taux d'éosinophiles sanguins, le nombre d'exacerbations au cours de l'année précédente (≤2, 3 et ≥4), les CSI à forte dose à l'inclusion et le VEMS post-bronchodilatateur en pourcentage de la valeur prédite à l'inclusion (<50%, ≥50%). Chez les patients présentant un emphysème, l'amélioration de la fonction pulmonaire, mesurée par le VEMS pré-bronchodilatateur, a été cohérente avec la population globale.
Résultats rapportés par les patients
Dans les deux études, la qualité de vie liée à la santé a été mesurée par la variation moyenne des MC du score total au questionnaire respiratoire St. Georges (SGRQ) à la semaine 52. Dans BOREAS, une amélioration statistiquement significative du score total SGRQ a été observée chez les patients traités par dupilumab par rapport au placebo (variation moyenne des MC: -9,73 pour le dupilumab vs -6,37 pour le placebo; différence moyenne des MC: -3,36 [IC 95%: -5,46; -1,27]; p = 0,002). Dans NOTUS, le dupilumab a amélioré de façon nominale le score total SGRQ à la semaine 52 par rapport au placebo (variation moyenne des MC: -9,82 pour le dupilumab vs -6,44 pour le placebo; différence moyenne des MC: -3,37 [IC 95%: -5,81, -0,93]; p = 0,007).
Population pédiatrique:
Dermatite atopique:
La sécurité et l'efficacité du dupilumab ont été établies chez des patients pédiatriques de 6 mois et plus souffrant de dermatite atopique modérée à sévère.
L'utilisation du dupilumab dans ce groupe d'âge est soutenue par l'étude AD 1526 qui a inclus 251 adolescents âgés de 12 à 17 ans atteints de dermatite atopique modérée à sévère, l'étude AD-1652 qui a inclus 367 enfants âgés de 6 à 11 ans atteints de dermatite atopique sévère et l'étude AD-1539 qui a inclus 162 enfants âgés de 6 mois à 5 ans atteints de dermatite atopique modérée à sévère. L'utilisation du dupilumab à long terme est supportée par l'étude AD-1434 qui a inclus 823 patients pédiatriques âgés de 6 mois à 17 ans; dont 275 adolescents, 368 enfants de 6 à 11 ans, et 180 enfants de 6 mois à 5 ans. L'utilisation du dupilumab est supportée par l'étude AD-1924 qui a inclus 27 adolescents âgés de 12 à 17 ans atteints de dermatite atopique modérée à sévère des mains et des pieds. La sécurité et l'efficacité étaient généralement cohérentes entre les patients pédiatriques et adultes.
Aucun nouveau signal de sécurité n'a été identifié dans l'étude AD-1434 (voir «Effets indésirables»).
La sécurité et l'efficacité chez les patients pédiatriques de moins de 6 mois atteints de dermatite atopique n'ont pas été établies.
Asthme:
Patients âgés de 12 à 17 ans
Au total, 107 adolescents âgés de 12 à 17 ans présentant un asthme modéré à sévère ont été inclus dans l'étude QUEST et ont reçu 200 mg (n = 21) ou 300 mg (n = 18) de dupilumab (ou 200 mg [n = 34] ou 300 mg [n = 34] du placebo correspondant) toutes les deux semaines. L'efficacité a été observée chez les adolescents et les adultes en termes d'exacerbations d'asthme sévère et de fonction pulmonaire. Les deux dosages à 200 mg et à 300 mg administrés toutes les deux semaines ont montré des améliorations significatives du VEMS (différence moyenne des MC par rapport à l'inclusion à la semaine 12) de 0,36 L et 0,27 L, respectivement. Une réduction du taux d'exacerbations sévères était observée à la dose de 200 mg administrée toutes les 2 semaines, comme pour l'adulte. Le profil d'effets indésirables chez les adolescents était généralement similaire à celui des adultes.
Enfants (âgés de 6 à 11 ans)
Un total de 408 enfants âgés de 6 à 11 ans présentant un asthme modéré à sévère a été recruté dans l'étude VOYAGE, qui a évalué les doses de 100 mg et 200 mg toutes les deux semaines. L'efficacité du dupilumab 300 mg toutes les quatre semaines chez les enfants âgés de 6 à 11 ans est extrapolée à partir de l'efficacité de 100 mg et 200 mg toutes les deux semaines dans l'étude VOYAGE et de 200 mg et 300 mg toutes les deux semaines chez les adultes et les adolescents (QUEST). Les patients ayant terminé la période de traitement de l'étude VOYAGE pouvaient participer à l'étude d'extension en ouvert (EXCURSION). Quatorze patients (≥15 à <30 kg) sur 365 patients ont été exposés à 300 mg toutes les quatre semaines dans cette étude, et le profil de sécurité était similaire à celui observé dans VOYAGE.
Œsophagite à éosinophiles (EoE)
Au total, 71 patients pédiatriques âgés de 1 à 11 ans ont reçu du dupilumab 100 mg toutes les deux semaines, 200 mg toutes les deux semaines, 300 mg toutes les deux semaines, ou un placebo pendant 16 semaines (EoE KIDS partie A). Parmi ceux-ci, 37 patients traités par dupilumab dans la Partie A ont tous poursuivi le traitement avec ces schémas posologiques de dupilumab pendant 36 semaines supplémentaires (EoE KIDS partie B). L'utilisation du dupilumab chez les patients pédiatriques âgés de 1 à 11 ans atteints d'EoE ayant reçu 300 mg chaque semaine (≥40 kg), ainsi que chez les patients pédiatriques âgés de 12 à 17 ans avec un poids corporel <40 kg aux mêmes doses par paliers de poids que les patients pédiatriques âgés de 1 à 11 ans, est également étayée par une analyse pharmacocinétique de population (voir «Pharmacocinétique»). La sécurité d'emploi et l'efficacité du dupilumab chez les adultes et les patients pédiatriques étaient similaires.
|




















