Composition
Principes actifs
Dexamethasoni natrii phosphas.
Excipients
Dinatrii edetas, Natrii citras dihydricus, Natrii hydroxidum (E 524; ajustement du pH), Glycerolum (E 422), Natrii metabisulfis (E 223) 1 mg, Alcohol benzylicus 10,5 mg, Aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Chaque ampoule de 5 mg/ml contient au maximum 1.1 mg de sodium.
Indications/Possibilités d’emploi
Injection intraveineuse
Une telle injection ne doit être pratiquée que dans des situations aiguës où la vie du patient est menacée telles que:
·un état de choc suite à un traumatisme grave (chez les personnes sous traitement de substitution),
·un état asthmatique,
·un choc anaphylactique (après injection de [nor]adrénaline),
·un incident lors d'une transfusion sanguine,
·un infarctus du myocarde
Dexamethason Zentiva est utilisé pour le traitement de la maladie à coronavirus 2019 (COVID-19) chez les adultes et les adolescents (dès l'âge de 12 ans et pesant au moins 40 kg) ayant besoin d'un supplément d'oxygène.
Injection intramusculaire et sous-cutanée
Une telle injection peut se faire dans une situation aiguë mais qui ne menace pas la vie du patient, lorsque le médecin veut s'assurer de la quantité de corticostéroïde administrée au patient. Elle est naturellement aussi indiquée pour tous les cas où une administration par voie orale n'est pas possible, comme, par exemple, en cas d'inconscience, de troubles gastro-intestinaux ou pendant une narcose.
Les principales indications sont les suivantes:
thérapie de substitution (en complément à l'administration d'un minéralocorticoïde lors d'insuffisance corticosurrénale primaire ou secondaire et lors d'un syndrome adrénogénital), affections rhumatismales aiguës, asthme bronchique, agranulocytose grave, thyroïdite, lupus érythémateux, pemphigus, dermatite aiguë, dermatomyosite, pathologies sanguines aiguës, prévention et traitement de vomissements induits par les cytostatiques.
Injection intra-articulaire
Dans toutes les grandes et petites articulations, à l'exception des articulations intervertébrales, en cas d'arthrose, d'hydrarthrose ou d'arthrite inflammatoire.
Injection périarticulaire
En cas de périarthrite humérocapsulaire, d'épicondylite humérale ou de ténosinovite.
Infiltration du tissu atteint
En cas de rhumatisme abarticulaire, d'étirement de tendons ou de muscles, de chéloïdes, d'une contracture de Dupuytren, de cors ou de ganglions.
Posologie/Mode d’emploi
Dexamethason Zentiva peut être injecté par voie intraveineuse, intramusculaire, sous-cutanée ou localement. On peut aussi l'infiltrer dans la région atteinte.
Dans le cas où Dexamethason Zentiva doit remplacer un traitement par un autre glucocorticoïde, il convient de tenir compte de l'équivalence des doses (voir «Propriétés/Effets»).
Injection intraveineuse
L'injection intraveineuse doit se faire lentement, pendant une durée de 4 à 5 min par 1 ml.
Posologie: La posologie habituelle est de 4–20 mg, selon la gravité du cas. L'injection peut être répétée jusqu'à l'obtention d'une réponse satisfaisante.
La durée du traitement est fonction de la réponse clinique et des besoins spécifiques du patient.
Traitement de la COVID-19
Chez les patients adultes et les adolescents, le traitement de la COVID-19 consiste en une injection intraveineuse de 6 mg une fois par jour pendant au maximum 10 jours.
Injection intramusculaire et sous-cutanée
4 à 8 mg par jour.
Injection intra-articulaire
Grandes articulations: 4 à 6 mg.
Petites articulations: 0,8 à 2 mg.
En général, une seule injection suffit.
Injection périarticulaire
2 à 4 mg. Cette injection peut être répétée si nécessaire.
Infiltration du tissu atteint
1 à 4 mg.
Les injections intra- et périarticulaires doivent être effectuées de manière stérile (voir «Mises en garde et précautions» et «Effets indésirables»).
Instructions posologiques particulières
Enfants et adolescents
Des données limitées sont disponibles pour les patients de moins de 18 ans.
Des doses inférieures à celles recommandées pour l'adulte devraient en principe s'avérer suffisantes, mais il est conseillé de choisir la dose non pas en fonction de l'âge, de la taille ou du poids du patient mais plutôt en fonction de la gravité du cas.
Patients âgés
Aucun ajustement posologique n'est nécessaire en cas de traitement de courte durée.
En cas de corticothérapie prolongée, le risque d'ostéoporose est plus élevé chez les patients âgés et l'utilisation doit être faite avec précaution.
Patients souffrant d'une insuffisance rénale ou hépatique
Aucun ajustement posologique n'est nécessaire en cas de traitement de courte durée.
En cas de corticothérapie prolongée, la métabolisation des stéroïdes peut être retardée en cas d'insuffisance hépatique sévère, ce qui peut nécessiter un ajustement de la dose.
Contre-indications
·En cas d'application systémique:
·ulcères gastriques et intestinaux,
·mycoses systémiques,
·certaines infections virales telles que la varicelle et le herpès génital ou cornéen;
·glaucome.
·En cas d'injection locale:
·infection au niveau de l'endroit d'injection (p.ex. arthrite infectieuse induite par la gonorrhée ou la tuberculose), bactériémies ou mycoses systémiques,
·articulation instable.
·Pour toutes les formes d'application:
·asthme bronchique,
·utilisation chez les nouveau-nés et les prématurés (voir «Effets indésirables»).
·hypersensibilité aux médicaments, aliments ou stimulants contenant des sulfites;
·hypersensibilité à la dexaméthasone.
Cependant, il n'y a en principe pas de contre-indication dans une situation où l'administration de glucocorticoïdes peut sauver la vie du patient.
Dexamethason Zentiva ne doit pas être administré par voie intrathécale ou épidurale en raison de son contenu en alcool benzylique.
Mises en garde et précautions
Les complications possibles d'un traitement par corticostéroïdes dépendent de la posologie et de la durée du traitement. C'est pourquoi il convient d'évaluer individuellement le rapport bénéfice-risque pour chaque patient en ce qui concerne la posologie et la durée du traitement.
Réactions d'hypersensibilité
Dans de rares cas, des réactions allergiques peuvent survenir après l'administration de corticostéroïdes, telles que des réactions cutanées, un angio-œdème ou des réactions anaphylactiques. En particulier, des cas d'œdème de la glotte et de bronchospasme ont été rapportés après l'administration parentérale de glucocorticoïdes, surtout chez des patients présentant des antécédents d'allergie. Par conséquent, il convient de prendre les précautions qui s'imposent avant de l'utiliser, en particulier chez les patients présentant une allergie médicamenteuse connue. En cas de réaction d'hypersensibilité sévère, des soins médicaux intensifs au patient (administration i. v. lente de 0,1 à 0,5 mg d'adrénaline, respiration artificielle) sont nécessaires.
Effets immunosuppresseurs/Sensibilité accrue aux infections
Les corticoïdes peuvent masquer les symptômes d'une infection ou activer des infections latentes, et de nouvelles infections peuvent apparaître sous traitement aux corticoïdes. En cas de maladies infectieuses aiguës, il faut traiter l'infection par des antibiotiques ou une chimiothérapie appropriée.
Si des corticostéroïdes sont utilisés chez les patients atteints de tuberculose latente ou avec réactivité tuberculinique, un contrôle étroit est nécessaire car une réactivation de l'infection peut être possible. En cas de traitement à long terme par corticostéroïdes, ces patients doivent recevoir une prophylaxie antituberculeuse.
Une varicelle survenant pendant un traitement systémique aux corticostéroïdes peut avoir une évolution grave et une issue fatale, particulièrement chez les enfants. Ces cas nécessitent un traitement immédiat avec p.ex. de l'aciclovir i.v. Chez les patients à risque, il est indiqué d'effectuer un traitement préventif à l'aciclovir ou une prévention immunologique passive avec des immunoglobulines contre le virus varicelle-zona.
L'utilisation intra-articulaire de corticostéroïdes augmente le risque d'infections articulaires. Pour éviter les infections, il est indispensable de travailler de manière aseptique. Il convient d'éviter les injections locales dans les articulations déjà infectées. Des douleurs nettement accrues, accompagnées d'un gonflement local, d'une réduction croissante de la mobilité articulaire, de fièvre et d'une sensation de malaise généralisé, indiquent une arthrite septique.
L'administration simultanée de Dexamethason Zentiva avec inhibiteurs puissants du CYP3A4 devrait être évitée en raison d'une éventuelle augmentation de la toxicité des corticostéroïdes (voir «Interactions»). L'utilisation concomitante de cobicistat, utilisée dans le traitement de l'infection par le VIH, un puissant inhibiteur du CYP3A et de plusieurs protéines de transport, avec des corticostéroïdes a été rapportée comme entraînant une augmentation de la toxicité des stéroïdes, voire des cas de syndrome de Cushing. En cas d'utilisation concomitante de Dexamethason Zentiva et de cobicistat, le patient doit être étroitement surveillé afin de déceler d'éventuels effets indésirables des stéroïdes. Le choix d'un stéroïde alternatif dont le métabolisme est indépendant du CYP3A doit être envisagé.
Administration de vaccins
Pour les vaccinations de patients traités par glucocorticoïdes, il convient également de consulter les lignes directrices en vigueur.
Vaccins vivants: Chez les patients recevant des doses immunosuppressives de dexaméthasone, les vaccinations avec des vaccins vivants doivent être administrées au moins un mois après l'arrêt des corticostéroïdes.
En cas d'utilisation locale de dexaméthasone (y compris injection intra-articulaire), une vaccination par des vaccins vivants est possible, à moins qu'il n'existe d'autres contre-indications.
Vaccins atténués ou inactivés: Chez les patients recevant des doses de glucocorticoïdes immunosuppressives (dans le cas de la dexaméthasone ≥3 mg/jour chez les patients d'un poids corporel > 10 kg ou 0,3 mg/kg de poids corporel, en cas d'utilisation pendant plus de 2 semaines), les vaccins atténués ou inactivés ne doivent être administrés qu'après une réduction de la dose ou un arrêt complet du traitement.
Après administration d'un vaccin atténué ou inactivé, il est recommandé d'instaurer un traitement par dexaméthasone non absolument nécessaire au plus tôt après 2 semaines.
En cas de doses non immunosuppressives ainsi qu'en cas d'utilisation locale de glucocorticoïdes (y compris injections intra-articulaires de dexaméthasone), les vaccinations avec des vaccins atténués ou inactivés sont possibles sans restriction.
Effets endocriniens
Les doses pharmacologiques de corticostéroïdes administrés sur une longue période peuvent entraîner une suppression hypothalamo-hypophyso-surrénale (insuffisance corticosurrénale secondaire). L'ampleur et la durée d'une insuffisance corticosurrénale varient d'un patient à l'autre et dépendent de la dose, de la fréquence et de l'heure de l'administration ainsi que de la durée d'une corticothérapie. Cet effet peut être atténué par un traitement alterné.
En cas de stress inhabituel (p.ex. maladie grave, intervention chirurgicale importante, traumatisme grave, etc.), la dose de corticostéroïdes à action rapide doit être augmentée à court terme avant, pendant et après ladite situation de stress chez les patients sous traitement de corticostéroïdes à long terme.
L'arrêt brutal des corticostéroïdes peut entraîner une insuffisance surrénalienne (dont l'issue peut être fatale). Les stéroïdes ne doivent par conséquent pas être arrêtés brusquement, mais la dose doit être réduite progressivement.
Une insuffisance surrénalienne relative peut persister plusieurs mois après l'arrêt du traitement. En cas de situation de stress particulière au cours de cette période (voir ci-dessus), le traitement par stéroïdes doit être repris. Étant donné que la sécrétion de minéralocorticoïdes peut également être limitée, le sel et/ou un minéralocorticoïde doivent également être administrés en complément.
En cas d'arrêt brusque des corticoïdes, un «syndrome d'arrêt des stéroïdes» qui semble indépendant d'une insuffisance surrénale peut également survenir. Ce syndrome comprend des symptômes tels que maux de tête, anorexie, nausées, vomissements, perte de poids, hypotension, desquamation de la peau, arthralgies, myalgies, léthargie et/ou fièvre.
L'effet des corticostéroïdes administrés par voie externe est renforcé chez les patients atteints d'hypothyroïdie.
Étant donné que les corticostéroïdes peuvent provoquer ou aggraver un syndrome de Cushing, ils doivent être évités chez les patients atteints de la maladie de Cushing.
Chez les patients atteints de COVID-19, qui sont déjà traités par corticostéroïdes systémiques (par voie orale) pour d'autres raisons (p.ex. patients atteints d'une maladie pulmonaire obstructive chronique), mais qui n'ont pas besoin de suppléments d'oxygène, les corticostéroïdes systémiques ne doivent pas être arrêtés.
Crise de phéochromocytome
Après l'administration des corticostéroïdes des crises phéochromocytome ont été observées, parfois avec issue fatale. Chez les patients avec un phéochromocytome suspecté ou diagnostiqué des corticostéroïdes ne doivent être utilisées qu'après avoir évalué adéquatement le rapport bénéfice-risque. Si un patient sous traitement par corticostéroïdes présente des symptômes potentiels de crise de phéochromocytome, tels qu'une crise hypertensive, une insuffisance cardiaque, une tachycardie, des céphalées, des douleurs abdominales et/ou thoraciques, il convient de penser à un phéochromocytome non encore identifié.
Effets sur la psyché
La corticothérapie peut entraîner des troubles psychiques potentiellement graves, allant de l'euphorie à la dépression sévère ou à la psychose manifeste, en passant par l'insomnie, des troubles de l'humeur et des modifications de la personnalité. De même, les troubles affectifs existants ou les tendances psychotiques peuvent s'aggraver sous corticostéroïdes. Les symptômes apparaissent généralement dans les jours ou les semaines suivant le début du traitement et disparaissent en règle générale après une réduction de la dose ou l'arrêt du traitement. Un traitement spécifique peut toutefois être nécessaire.
Des effets indésirables sur le système psychique ont également été rapportés après l'arrêt des corticoïdes.
Le patient et ses proches doivent être invités à contacter leur médecin en cas d'apparition de symptômes psychiques sous traitement ou pendant ou après l'arrêt/la réduction du traitement, en particulier si une humeur dépressive ou des intentions suicidaires sont suspectées.
Effets sur le système nerveux
Chez les patients présentant des troubles épileptiques, les corticostéroïdes doivent être utilisés avec prudence.
Des cas de lipomatose épidurale ont été rapportés en lien avec l'utilisation prolongée de corticostéroïdes, en particulier en cas d'utilisation à haute dose.
Effets musculo-squelettiques
En cas de traitement de la myasthénie grave par inhibiteurs de la cholinestérase, les corticostéroïdes peuvent réduire l'effet des inhibiteurs de la cholinestérase et augmenter le risque de crise myasthénique. Par conséquent, les inhibiteurs de la cholinestérase doivent être arrêtés si possible 24 heures avant l'administration de corticostéroïdes (voir «Interactions»).
Des myopathies aiguës ont été signalées dans le cadre de l'utilisation de doses élevées de corticostéroïdes, en particulier chez les patients présentant des troubles de la transmission neuromusculaire (p.ex. myasthénie grave) ou chez les patients recevant simultanément des agents bloquants neuromusculaires (p.ex. pancuronium). De telles myopathies aiguës sont généralisées, peuvent impliquer les muscles oculaires et respiratoires et conduire à une tétraparésie. Le taux de créatine kinase peut augmenter.
L'utilisation à long terme de corticostéroïdes peut conduire à l'ostéoporose, en particulier chez les patientes ménopausées et gériatriques. Dans cette population, un traitement avec des corticostéroïdes ne devrait se faire qu'en cas d'indication absolue et après avoir évalué soigneusement le rapport risque/bénéfice. En cas d'apparition d'une ostéoporose, le traitement par stéroïdes doit être arrêté (sauf pour les indications vitales).
Effets oculaires
Les effets indésirables possibles en cas d'utilisation prolongée de corticostéroïdes sont exophtalmie, cataracte (également chez les enfants) et augmentation de la pression intra-oculaire. Cette dernière peut entraîner un glaucome manifeste avec atteinte du nerf optique allant jusqu'à la cécité. La pression intra-oculaire doit donc être régulièrement mesurée sous traitement par corticostéroïdes à long terme.
Une corticothérapie a également été associée à la survenue d'une choriorétinite pigmentaire séreuse centrale pouvant entraîner un décollement de la rétine.
En outre, un traitement par corticostéroïdes peut favoriser les infections secondaires des yeux par des virus ou des champignons.
Effets cardiovasculaires
Chez les patients atteints d'insuffisance cardiaque, les corticostéroïdes ne doivent être utilisés qu'avec prudence et uniquement lorsqu'ils sont absolument nécessaires.
Une bradycardie peut survenir sous doses élevées de corticostéroïdes.
Effets gastro-intestinaux
Les corticostéroïdes peuvent masquer les symptômes des ulcères peptiques, ce qui peut entraîner une perforation largement asymptomatique ou des saignements gastro-intestinaux aigus. Le risque d'ulcères peptiques augmente avec l'association de corticostéroïdes avec des anti-inflammatoires non stéroïdiens (AINS). Par conséquent, la prudence est de mise chez les patients présentant une gastrite préexistante, une œsophagite ou une diverticulite, ainsi qu'en cas de colite ulcéreuse avec risque accru de perforation ou d'infection pyogène.
De plus, des doses élevées de corticostéroïdes peuvent déclencher une pancréatite aiguë.
Syndrome de lyse tumorale
Après administration de dexaméthasone, seul ou en association avec des agents chimiothérapeutiques, un syndrome de lyse tumorale (SLT) a été rapporté chez des patients atteints d'affections hématologiques malignes. Un syndrome de lyse tumorale entraîne une augmentation des concentrations sériques d'acide urique, de potassium et/ou de phosphate et une réduction de la concentration sérique de potassium ainsi que des arythmies. Les formes de manifestations possibles sont notamment des convulsions et une insuffisance rénale.
Les patients présentant des tumeurs à prolifération rapide ou une charge tumorale élevée ainsi que ceux présentant une sensibilité accrue aux principes actifs cytotoxiques présentent un risque accru de développer un SLT et doivent donc être surveillés étroitement. De plus, des mesures de précaution appropriées doivent être prises.
Autres affections pour lesquelles l'administration de corticostéroïdes doit être effectuée avec une prudence particulière nécessite:
·En cas d'œdème cérébral aigu et d'état asthmatique, Dexamethason Zentiva ne doit pas être administrée en remplacement du traitement conventionnel, mais en complément de celui-ci.
·Métabolisme du glucose: Lors d'un traitement de longue durée et particulièrement en cas de diabète, il faut contrôler le métabolisme du glucose régulièrement, vu que la tolérance au glucose peut être abaissée. Une adaptation posologique des médicaments antidiabétiques peut être nécessaire.
·Affections hépatiques: En cas de cirrhose hépatique, les effets des corticostéroïdes peuvent être renforcés.
·Équilibre hydrique et électrolytique: Les corticostéroïdes, en particulier à doses moyennes et élevées, peuvent entraîner une rétention de sel et de liquide ainsi qu'une augmentation de l'excrétion de potassium. Une restriction en sel alimentaire ou une substitution en potassium peut s'avérer nécessaire.
·Insuffisance rénale: Chez les patients atteints d'insuffisance rénale, les corticostéroïdes doivent être utilisés avec prudence.
·Traitement concomitant par anti-inflammatoires non stéroïdiens: L'acide acétylsalicylique et les autres anti-inflammatoires non stéroïdiens ne doivent être utilisés qu'avec prudence avec les corticostéroïdes. En particulier, la prudence est recommandée en cas d'hypoprothrombinémie lors de l'administration concomitante d'acide acétylsalicylique.
L'utilisation prolongée de dexaméthasone au-delà du traitement d'urgence ne doit pas être utilisée en cas de:
·herpes simplex (voir ci-dessus «Effets immunosuppresseurs/Sensibilité accrue aux infections»)
·pendant la phase virémique d'un herpès zoster
·varicelle
·poliomyélite (à l'exception de la forme encéphalite bulbaire)
·mycoses systémiques
·lymphomes après vaccination BCG
·infection amibienne
·diabète
·antécédents d'affections psychiatrique (voir ci-dessus «Effets sur la psyché»)
·ostéoporose sévère (voir ci-dessus sous «Effets musculo-squelettiques»)
·glaucome à angle ouvert ou fermé (voir ci-dessus «Effets oculaires»)
·insuffisance cardiaque grave (voir ci-dessus «Effets cardiovasculaires»)
·hypertension grave
·ulcères gastro-intestinaux préexistants (voir ci-dessus «Effets gastro-intestinaux»)
·grossesse
Dans de tels cas, il convient d'évaluer attentivement les bénéfices du traitement par la dexaméthasone par rapport aux risques possibles.
Utilisation en pédiatrie
Les enfants et les adolescents sous traitement à long terme par la dexaméthasone doivent être étroitement surveillés en raison du risque de retard de croissance et de fermeture prématurée des épiphyses, et le traitement nécessite une indication stricte dans ce groupe d'âge. Le risque d'effets indésirables peut être réduit par un traitement alterné.
Une cardiomyopathie hypertrophique a été rapportée après une administration systémique de corticostéroïdes incluant de la dexaméthasone à des nourrissons prématurés. Dans la majorité des cas signalés, cette situation était réversible à l'arrêt du traitement. Chez les nourrissons prématurés traités par dexaméthasone systémique, un contrôle échocardiographique de la structure et de la fonction du muscle cardiaque est recommandé.
Effets locaux
L'administration répétée de dexaméthasone (ou d'un autre glucocorticoïde) par voie intramusculaire, intra-articulaire ou sublésionnelle peut entraîner des lésions tissulaires locales graves (pouvant aller jusqu'à l'atrophie et la nécrose).
Excipients particuliers
Dexamethason Zentiva contient des excipients tels que l'alcool benzylique et le disulfure de sodium (E 223).
Alcool benzylique
Ce médicament contient 10,5 mg d'alcool benzylique par ampoule de 5 mg/ml, soit 10,5 mg/ml. L'alcool benzylique peut provoquer des réactions allergiques. L'administration intraveineuse d'alcool benzylique a été associée à des effets indésirables graves et à des décès chez les nouveau-nés («syndrome de halètement») (voir «Contre-indications»). La quantité minimale d'alcool benzylique provoquant une toxicité n'est pas connue. Les jeunes enfants courent un risque accru en raison de l'accumulation.
Le risque de toxicité dépend de la quantité administrée et de la capacité de détoxification du foie et des reins. Par conséquent, en raison du risque d'accumulation et de toxicité («acidose métabolique»), de grandes quantités ne doivent être utilisées qu'avec prudence et en cas d'absolue nécessité, en particulier chez les patients présentant une insuffisance hépatique ou rénale. La quantité minimale d'alcool benzylique à laquelle une toxicité apparaît n'est pas connue, mais une toxicité est plus probable à fortes doses. Lors de l'utilisation de médicaments contenant de l'alcool benzoylique, la somme de la quantité quotidienne d'alcool benzylique doit être prise en compte à partir de l'ensemble des sources.
En raison de la teneur en alcool benzylique, ce médicament ne doit pas être administré aux nouveau-nés et aux prématurés (voir «Contre-indications»).
Disulfite de sodium
Le disulfite de sodium peut provoquer des réactions allergiques chez les patients sensibles, notamment un choc anaphylactique et des crises d'asthme pouvant potentiellement mettre en jeu le pronostic vital, des nausées et des diarrhées, peuvent survenir. La prévalence dans la population est n'est pas connue. L'hypersensibilité aux sulfites est plus fréquente chez les asthmatiques que chez les non asthmatiques. Par conséquent, Dexamethason Zentiva ne doit pas être administrée aux patients atteints d'asthme ou d'hypersensibilité aux produits contenant des sulfites (aliments et boissons, autres médicaments).
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule de 5 mg/ml, c.-à-d. qu'il est essentiellement «sans sodium».
Interactions
Interactions pharmacocinétiques
La dexaméthasone est métabolisée par le CYP3A4.
Les corticostéroïdes peuvent en outre influencer l'activité du CYP3A4 et donc le métabolisme d'autres médicaments.
Influence d'autres médicaments sur la pharmacocinétique de la dexaméthasone
Inhibiteurs enzymatiques
L'administration concomitante avec des inhibiteurs de CYP3A4- puissants (p.ex. itraconazole, voriconazole, clarithromycine, ritonavir, cobicistat) peut accroître l'exposition aux corticostéroïdes et ainsi augmenter le risque d'effets indésirables des stéroïdes. Le bénéfice d'une administration concomitante doit être soigneusement évalué par rapport au risque potentiel. En cas d'utilisation concomitante d'inhibiteurs du CYP3A4, le patient doit faire l'objet d'une surveillance des effets secondaires systémiques des corticostéroïdes.
Inducteurs enzymatiques
Les substances qui induisent les enzymes hépatiques peuvent accélérer la dégradation métabolique des corticostéroïdes et conduire ainsi à une diminution des taux plasmatiques et de l'efficacité physiologique. Il s'agit, par exemple, des barbituriques, de la carbamazépine, de l'éfavirenz, de la phénytoïne, de la primidone et de la rifampicine, ainsi que des médicaments contenant du millepertuis (Hypericum perforatum).
L'éphédrine augmente également la clearance de la dexaméthasone dans le sang et l'excrétion urinaire de ses métabolites.
Substrats du CYP3A4
L'utilisation concomitante d'autres substrats du CYP3A4 (p.ex. l'aprépitant, les benzodiazépines, le diltiazem, le tacrolimus) peut également influencer la clearance hépatique des corticostéroïdes et nécessiter, le cas échéant, un ajustement de la dose.
La ciclosporine réduit également la clearance des corticostéroïdes, probablement par le biais d'une inhibition compétitive des enzymes microsomales hépatiques.
Les hormones sexuelles peuvent également influencer la clearance des corticostéroïdes. Les œstrogènes peuvent notamment renforcer l'effet des corticostéroïdes.
Influence des corticostéroïdes sur la pharmacocinétique d'autres médicaments
Les corticostéroïdes peuvent augmenter les concentrations plasmatiques de ciclosporine à haute dose. Les effets indésirables de la ciclosporine peuvent ainsi être renforcés.
Les corticostéroïdes peuvent accélérer l'élimination des salicylates en cas de prise prolongée de doses élevées, ce qui en réduit l'efficacité. Inversement, la toxicité des salicylates peut être renforcée en cas de réduction de la dose de corticostéroïdes. Par conséquent, si des salicylates sont administrés en même temps que des glucocorticoïdes pendant un traitement à long terme, toute réduction de la dose de glucocorticoïdes doit être effectuée avec précaution.
Chez les patients atteints d'hypoprothrombinémie, l'acide acétylsalicylique ne doit être utilisé qu'avec prudence en association avec des corticostéroïdes.
Interactions pharmacodynamiques
AINS: le risque d'ulcères et de saignements au niveau du tractus gastro-intestinal est accru en cas d'administration concomitante de corticostéroïdes et d'AINS.
Médicaments ayant une influence sur l'équilibre calcique: l'administration concomitante de corticostéroïdes et de médicaments qui augmentent l'excrétion de potassium (en particulier les diurétiques comme le furosémide ou l'hydrochlorothiazide, mais aussi p.ex. l'amphotéricine B ainsi que les dérivés de la xanthine tels que la théophylline) entraîne un risque accru d'hypokaliémie. Par conséquent, les taux de potassium doivent être surveillés chez les patients recevant de tels médicaments.
Glycosides cardiaques: la toxicité des glycosides cardiaques peut être renforcée par l'hypokaliémie induite par les corticostéroïdes.
Antidiabétiques: l'effet hypoglycémiant des antidiabétiques peut être réduit en cas de traitement concomitant par corticostéroïdes, de sorte qu'une augmentation de la posologie de l'antidiabétique peut être nécessaire.
Inhibiteurs de la cholinestérase: les corticostéroïdes peuvent réduire l'efficacité des inhibiteurs de la cholinestérase.
Anticholinergiques: l'atropine et d'autres cholinergiques peuvent conduire à une augmentation supplémentaire d'une pression intra-oculaire déjà élevée.
Sympathomimétiques: les corticostéroïdes peuvent renforcer les effets désirables et les effets indésirables des sympathomimétiques.
Immunosuppresseurs: les corticostéroïdes agissent de manière synergique avec d'autres immunosuppresseurs (p.ex. méthotrexate). Dans certains cas, une dose de stéroïdes plus faible peut être suffisante.
Anticoagulants: l'efficacité des anticoagulants peut être réduite ou augmentée en cas d'administration concomitante de corticostéroïdes. Les paramètres de coagulation doivent donc être surveillés et, le cas échéant, la dose d'anticoagulants doit être adaptée.
Les myorelaxants non dépolarisants: la relaxation musculaire peut être prolongée chez les patients traités par corticostéroïdes. De plus, des myopathies aiguës ont été rapportées.
Psychotropes: l'effet des anxiolytiques et des antipsychotiques peut être réduit en cas de traitement concomitant par des corticostéroïdes.
Vaccins: la réponse vaccinale peut être réduite. Dans le cas des vaccins à virus vivant (p.ex. oreillons, rougeole, rubéole, poliomyélite, varicelle), le risque de toxicité avec des infections virales disséminées est augmenté en raison de l'effet immunosuppresseur des corticostéroïdes.
Grossesse, allaitement
Grossesse
Des études animales ont montré des effets indésirables sur le fœtus. La dexaméthasone franchit la barrière placentaire (notamment l'alcool benzylique, voir «Mises en garde et précautions», rubrique «Autres excipients»).
En cas de traitement prolongé pendant la grossesse, on ne peut pas exclure des troubles de la croissance intra-utérine et en cas d'un traitement en fin de grossesse, il y a, pour le fœtus, danger d'une atrophie corticosurrénale qui peut nécessiter chez le nouveau-né un traitement de substitution avec diminution progressive. Dexamethason Zentiva, ainsi que tous les corticostéroïdes, ne devrait donc être administré, particulièrement pendent les 3 premiers mois de la grossesse, qu'après évaluation sévère du rapport avantages/risques. En cas de nécessité, la prednisolone (ou prednisone) devrait être préférée à tous les autres glucocorticoïdes – surtout aux glucocorticoïdes fluorés – parce que la prednisolone a la plus faible capacité de franchir la barrière placentaire.
Les patientes doivent être informées du fait qu'il est nécessaire qu'elles avertissent le médecin en cas de grossesse ou de grossesse supposée.
Après une utilisation prénatale de courte durée de corticostéroïdes (y compris la dexaméthasone) chez des femmes enceintes présentant une menace d'accouchement prématuré tardif (c'est-à-dire après la 33e semaine de grossesse), des études ont montré un risque accru d'hypoglycémie néonatale.
Allaitement
Les corticoïdes sont sécrétés dans le lait maternel et peuvent perturber la croissance et la fonction surrénale du nourrisson ou montrer d'autres effets indésirables. Les patientes recevant des doses thérapeutiques de corticoïdes devraient donc renoncer à l'allaitment.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude appropriée n'a été faite avec Dexamethason Zentiva.
Effets indésirables
La fréquence et la gravité des effets indésirables des corticoïdes dépendent de la durée du traitement et de la posologie ainsi que de l'âge, du sexe et de la maladie de base du patient. Une utilisation de glucocorticoïdes sur une courte durée, même à fortes doses, ne provoque pratiquement pas d'effets secondaires. Toutefois, lors d'utilisation prolongée, en particulier à doses élevées (c'est-à-dire lorsque la dose-seuil de Cushing >1,5 mg de dexaméthasone par jour est dépassée), des effets peuvent apparaître. Les effets indésirables décrits sous traitement systémique par stéroïdes sont listés ci-dessous par système d'organes (MedDRA). La fréquence de chaque effet indésirable ne peut être estimée de manière fiable du fait de la nature des données sous-jacentes.
Infections et infestations:
augmentation du risque d'infections.
Affections hématologiques et du système lymphatique:
leucocytose.
Troubles du système immunitaire:
diminution de la réponse aux vaccins et aux tests cutanés, réactions d'hypersensibilité (voir «Mises en garde et précautions»).
Troubles endocriniens:
Syndrome de Cushing (p. ex., obésité tronculaire, visage de pleine lune), inhibition de la fonction de l'axe hypothalamus-hypophyse-glandes surrénales pouvant aller jusqu'à l'atrophie des surrénales (ce qui peut persister pendant plus d'une année et représenter un risque grave pour le patient exposé à des situations de stress et de fatigue), déclenchement d'une crise de phéochromocytome chez des patients présentant un phéochromocytome préexistant (également latent).
Troubles métaboliques et alimentaires:
bilan négatif pour l'azote et le calcium, diminution de la tolérance au glucose (particulièrement en cas de diabète), rétention de sodium et d'eau, augmentation du poids, perte de potassium et de phosphate, alkalose hypopotassique, augmentation de l'appétit.
Troubles psychiatriques:
nervosité, irritabilité, agitation, troubles du sommeil, troubles affectifs (humeur dépressive et euphorique), troubles de l'humeur, affectivité, anxiété, états confusionnels, hallucinations, pensées suicidaires, confusion.
Troubles du système nerveux:
convulsions.
Troubles oculaires:
augmentation de la pression intra-oculaire, cataracte subcapsulaire, choriorétinopathie.
Troubles fonctionnels vasculaires:
hypertension, événements thromboemboliques.
Troubles gastro-intestinaux:
ulcérations peptiques avec induction possible d'hémorragies ou de perforations, pancréatite, oesophagite, nausées et vomissements.
Troubles cutanés et des tissus sous-cutanés:
hirutisme, ralentissement du processus de cicatrisation, érythèmes, stries, pétéchies, ecchymoses, acné, troubles de la pigmentation, atrophie cutanée, hyperhidrose.
Troubles fonctionnels de l'appareil locomoteur, du tissu conjonctif et des os:
ostéoporose, nécrose aseptique de l'os, faiblesse musculaire, atrophie musculaire, myopathie, rupture tendineuse (notamment tendon d'Achille), fractures vertébrales, fractures pathologiques.
Troubles des organes reproducteurs et des seins:
troubles menstruels, troubles de la puissance sexuelle.
Troubles généraux et troubles au site d'administration:
œdème, réactions érythémateuses au site d'injection, destruction indolore de l'articulation (semblable à une arthropathie de Charcot) avant tout en cas d'injections intra-articulaires répétées.
En cas d'infiltrations locales, une atrophie des tissus adipeux sous-cutanés est possible (traitement des épicondylites).
Sécurité d'emploi dans la population pédiatrique
Le profil de sécurité d'emploi des corticostéroïdes chez les enfants et les adolescents correspond essentiellement à celui des adultes. En outre, des effets indésirables suivants ont été rapportés chez les enfants et les adolescents:
Troubles du système nerveux:
pseudotumeur cérébrale (hypertension intracrânienne bénigne) avec vomissements et papille congestive.
Troubles cardiaques:
cardiomyopathie hypertrophique chez les prématurés.
Troubles musculo-squelettiques:
fermeture prématurée de l'épiphyse (voir «Mises en garde et précautions»), troubles de la croissance.
Mis à part l'ostéoporose, la nécrose aseptique et les troubles de la croissance chez l'enfant, les effets secondaires potentiels sont la plupart du temps (en fonction de la dose et de la durée du traitement) réversibles après l'arrêt du traitement.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Des intoxications par surdosage aigu de corticostéroïdes sont inhabituelles et la probabilité que cela conduise à des effets graves est faible. En cas d'un surdosage, il n'y a pas d'antidote spécifique et le traitement est donc symptomatique.
Lors d'un surdosage chronique, il faut s'attendre à une augmentation des effets indésirables et des risques décrits sous «Mises en garde et précautions».
Propriétés/Effets
Code ATC
H02AB02
Les ampoules de Dexamethason Zentiva contiennent le sel sodique du dexaméthasone-21-phosphate, qui est bien soluble et miscible avec des anesthésiques locaux. Dexamethason Zentiva est indiqué pour toutes les formes d'administration parentérale.
La dexaméthasone est un glucocorticoïde synthétique doté d'un effet anti-inflammatoire environ 7 fois supérieur à celui de la prednisolone et environ 30 fois plus fort que celui de l'hormone corticosurrénale naturelle, la cortisone. Elle se distingue en particulier par un effet minéralocorticoïde minime et par le fait qu'elle n'induit qu'une faible rétention d'eau et de sel. C'est pourquoi elle est particulièrement appropriée pour l'utilisation chez les patients souffrant d'insuffisance cardiaque ou d'hypertension. Par ailleurs, la dexaméthasone a une longue demi-vie biologique (36–54 heures) et son utilisation est donc particulièrement appropriée dans les cas où un effet glucocorticoïde continu est souhaité. Thérapeutiquement, c'est surtout son effet antiphlogistique et immunosuppresseur (antiallergique) prononcé qui est important.
Les doses d'équivalence entre la dexaméthasone et les autres glucocorticoïdes sont les suivantes: 1 mg de dexaméthasone correspond à 6 mg de triamcinolone ou méthylprednisolone, à 7,5 mg de prednisone ou prednisolone, à 30 mg de hydrocortisone ou à 35 mg de cortisone.
Mécanisme d'action
cf. ci-dessus.
Pharmacodynamique
cf. ci-dessus.
Efficacité clinique
cf. ci-dessus.
Traitement de COVID-19
L'essai RECOVERY (Randomised Evaluation of COVid-19 thERapY,)1 est une étude à l'initiative de la recherche, randomisée individuellement, contrôlée, en ouvert, sur une plateforme adaptative, destinée à évaluer l'efficacité des traitements existants sur des patients hospitalisés pour cause de COVID-19. L'étude a été réalisée dans 176 hôpitaux du Royaume-Uni.
6'425 patients se sont vu administrer de façon randomisée soit du dexaméthasone (2'104 personnes), soit le traitement standard habituel (4'321 personnes). Une infection par le SARS-CoV-2 a été confirmée en laboratoire chez 89 % des patients.
Lors de la randomisation, 16 % des patients avaient déjà reçu une ventilation mécanique invasive ou une oxygénation par membrane extracorporelle, tandis que 60% d'entre eux, seulement de l'oxygène (avec ou sans ventilation non invasive) et 24% aucun soutien respiratoire.
L'âge moyen des patients était de 66,1+/-15,7 ans. 36 % d'entre eux étaient des femmes. L'anamnèse de 24% des patients révélait la présence de diabète, 27% étaient atteints de troubles circulatoires et 21% d'une maladie pulmonaire chronique.
La mortalité était définie comme critère d'évaluation principal après 28 jours.
Critère d'évaluation primaire
Le taux de mortalité de 28 jours s'est avéré nettement inférieur dans le groupe dexaméthasone que dans le groupe traitement standard, soit 22,9% contre 25,7% (rapport des taux [rate ratio, RR]: 0,83; intervalle de confiance à 95% [IC]: 0,75-0,93; P<0,001).
Dans le groupe dexaméthasone, la mortalité était inférieure à celle du groupe ayant reçu le traitement standard tant chez les patients ayant reçu un ventilation mécanique invasive (29,3% vs. 41,4%; RR: 0,64; IC à 95%: 0,51-0,81) que chez ceux n'ayant reçu que des suppléments d'oxygène, sans ventilation mécanique invasive (23,3% vs. 26,2%; RR: 0,82; IC à 95%: 0,72-0,94).
Aucun effet marquant du dexaméthasone n'a été constaté chez les patients n'ayant reçu aucun soutien respiratoire au moment de la randomisation (17,8% vs. 14,0%; RR: 1,19; IC à 95%: 0,91-1,55).
Critères d'évaluation secondaires
Les patients du groupe dexaméthasone ont été hospitalisés moins longtemps que ceux du groupe de traitement standard (moyenne de 12 jours vs. 13) et étaient plus susceptibles quitter l'hôpital dans les 28 jours (RR: 1,10; IC à 95%: 1,03-1,17).
De même que pour le critère d'évaluation primaire, l'impact le plus déterminant relativement à la sortie de l'hôpital dans les 28 jours a été constaté chez les patients qui ont reçu une ventilation mécanique invasive après randomisation (RR: 1,48; IC à 95%: 1,16-1,90), suivis du groupe de patients auxquels n'avait été administré que de l'oxygène (RR: 1,15; IC à 95%: 1,06-1,24). Aucun effet positif particulier n'a été relevé chez les patients n'ayant pas reçu d'oxygène (RR: 0,96; IC à 95%: 0,85-1,08).
1) www.recoverytrial.net
Tableau 1:
|
Résultat |
Dexaméthasone |
Traitement standard |
Rapport risque/taux (RR) |
|
Nombre/Nombre total de patients (%) | |||
|
Résultat primaire | |||
|
Taux de mortalité de 28 jours |
482/2'104 (22,9) |
1'110/4'321 (25,7) |
0,83 (0,75-0,93) |
|
Résultats secondaires | |||
|
Sortie de l'hôpital dans les 28 jours |
143/2'104 (67,2) |
2'745/4'321 (63,5) |
1,10 (1,03-1,17) |
|
Ventilation mécanique invasive ou décès3 |
456/1'780 (25,6) |
994/3'638 (27,3) |
0,92 (0,84-1,01) |
|
Ventilation mécanique invasive |
102/1'780 (5,7) |
285/3'638 (7,8) |
0,77 (0,62-0,95) |
|
Décès |
387/1'780 (21,7) |
827/3'638 (22,7) |
0,93 (0,84-1,03) |
2) Les RR ont été ajustés à l'âge en tenant compte des résultats de la mortalité dans les 28 jours et de la sortie de l'hôpital. Les RR ont été ajustés à l'âge en tenant compte du résultat du bénéfice d'une ventilation mécanique invasive ou du décès et leurs sous-composantes.
3) Les patients ayant reçu une ventilation mécanique invasive au moment de la randomisation ont été exclus de cette catégorie.
Sécurité
Quatre événements indésirables graves (EIG) ont été associés au traitement à l'étude: deux cas d'hyperglycémie, une psychose provoquée par les stéroïdes et une hémorragie gastro-intestinale supérieure. Tous les événements ont cessé.
Analyses des sous-groupes
Tableau 2:
Répercussions de l'affectation au groupe DEXAMÉTHASONE sur le taux de mortalité dans les 28 jours, en fonction de l'âge et de l'assistance respiratoire randomisée4
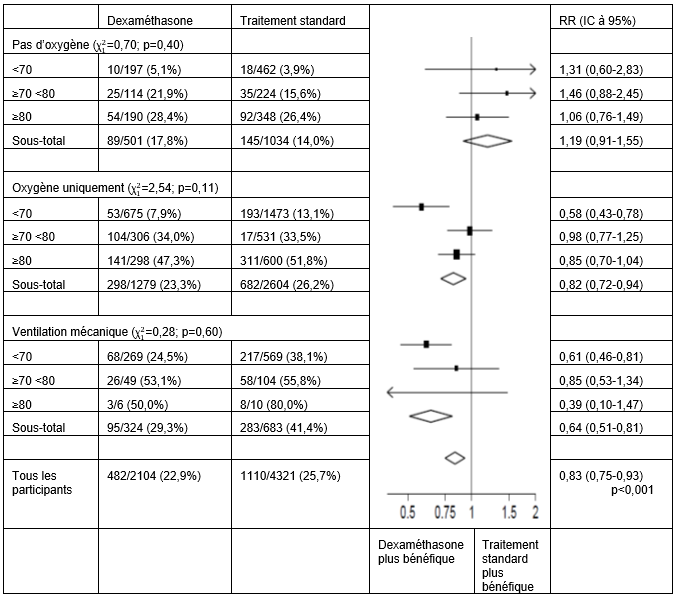
4) (Source: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
Tableau 3
Répercussions de l'affectation au groupe DEXAMÉTHASONE sur le taux de mortalité dans les 28 jours, en fonction du bénéficie de l'assistance respiratoire randomisée et des antécédents de maladie chronique5
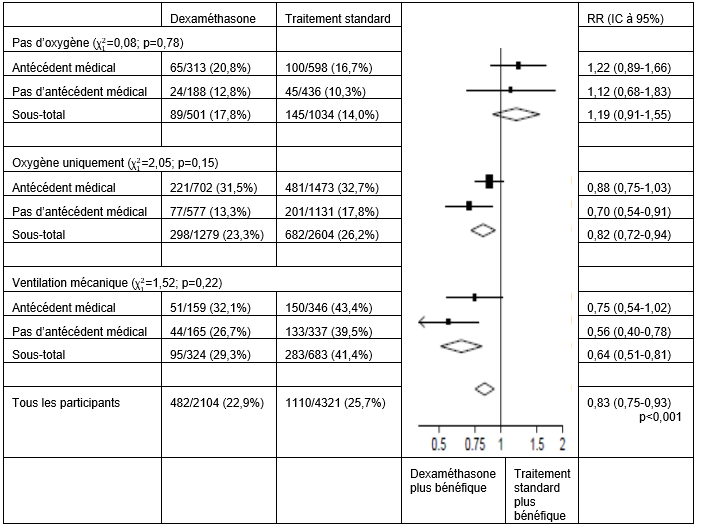
5) (Source: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
Pharmacocinétique
Absorption
Le phosphate de dexaméthasone est rapidement résorbé après injection intramusculaire et est presque entièrement hydrolysé en dexaméthasone.
Après injection i.v., des concentrations plasmatiques maximales sont atteintes en l'espace de quelques minutes. Toutefois, l'effet pharmacologique maximal est retardé (environ 2 heures après l'injection) et se maintient plus longtemps que ce qui correspond à la demi-vie plasmatique.
Distribution
Le volume de distribution total de la dexaméthasone est d'environ 0,58 l/kg. En fonction de la dose, jusqu'à 77% du principe actif peut être lié aux protéines plasmatiques, notamment à la fraction albumine. Dans le LCR, on trouve des concentrations maximales de dexaméthasone 4 heures après une application intraveineuse (environ 15 à 20% de la concentration plasmatique). La concentration de dexaméthasone dans le liquide céphalo-rachidien diminue très lentement; on trouve encore environ 2⁄3 de la concentration maximale après 24 heures.
La dexaméthasone passe dans le placenta, où il est partiellement métabolisé en un dérivé cétostéroïde pharmacologiquement inactif. Elle passe également dans le lait maternel.
Métabolisme
Le dexaméthasone est métabolisé en dérivés hydroxylés et cétostéroïdes avec la participation du CYP3A4, le principal métabolite étant l'hydroxy-6-dexaméthasone. D'autres isoenzymes du cytochrome P450 peuvent également jouer un rôle. Une partie des métabolites est ensuite conjuguée dans le foie en glucuronides et en sulfates.
Élimination
La dexaméthasone et ses métabolites sont éliminés principalement par les reins. En l'espace de 24 heures, 60 % d'une dose apparaissent dans l'urine sous une forme glucoronisée et moins de 10% sous forme de dexaméthasone libre. La clearance plasmatique totale est de 2–5 ml/min/kg. La demi-vie d'élimination se situe entre 3 et 4,5 heures.
Cinétique pour certains groupes de patients
Lors de maladies hépatiques graves (p.ex. hépatite ou cirrhose) et d'hypothyréose, la demi-vie d'élimination de la dexaméthasone est prolongée.
Chez les nouveau-nés, la clearance plasmatique est inférieure à celle que l'on observe chez les enfants et les adultes.
Données précliniques
Des études à long terme effectuées chez l'animal et examinant le potentiel cancérogène ne sont pas disponibles.
Les effets mutagènes de la dexaméthasone n'ont pas été suffisamment étudiés.
Toxicité de reproduction
En expérimentation animale, la dexaméthasone provoque des fentes pallatines chez les souris, les rats, les hamsters, les lapins et les chiens, ainsi que d'autres malformations dans une moindre mesure.
Remarques particulières
Incompatibilités
Il n'y a aucune incompatibilité connue. Le contenu de l'ampoule est miscible avec un anesthésique local.
Influence sur les méthodes de diagnostic
Valeurs augmentées pour la digoxine sérique dosée par immunoassay.
Stabilité
Le médicament ne doit être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver à température ambiante (15-25 °C), à l'abri de la lumière et de l'humidité, et hors de la portée des enfants. Ne pas réutiliser les ampoules ouvertes pour des raisons de stérilité.
Numéro d’autorisation
41074 (Swissmedic).
Présentation
Dexamethason Zentiva sol inj 5 mg amp 1 ml. (B)
Dexamethason Zentiva sol inj 5 mg amp 3× 1 ml. (B)
Dexamethason Zentiva sol inj 5 mg amp 25× 1 ml (emballage hospitalier). (B)
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Août 2024.