Composition
Principes actifs
FEIBA (Factor Eight Inhibitor Bypassing Activity).
Excipients
Natrii citras, Natrii chloridum, Natrii hydroxidum (pour l'ajustement du pH).
Quantité totale de sodium env. 4,09 mg/ml.
Solvant: Aqua ad iniectabile.
Indications/Possibilités d’emploi
Traitement et prévention des hémorragies chez les patients atteints d'hémophilie A avec inhibiteur du facteur VIII,
Traitement et prévention des hémorragies chez les patients atteints d'hémophilie B avec inhibiteur du facteur IX;
En cas d'hémorragies sévères, Feiba NF peut également être utilisé pour le traitement de patients non hémophiles présentant des inhibiteurs acquis contre les facteurs VIII, IX ou XI.
Posologie/Mode d’emploi
Recommandations pour le traitement des patients porteurs d'un inhibiteur: par principe, le traitement par Feiba NF ne doit être entrepris qu'en collaboration avec un centre de traitement d'hémophilie.
La posologie et la durée du traitement sont fonction de la sévérité du trouble de la coagulation, du site et de l'ampleur de l'hémorragie et de l'état clinique du patient. La posologie et la fréquence d'administration doivent toujours s'orienter au cas par cas en fonction de l'efficacité clinique.
En règle générale, on recommande une dose de 50 à 100 U/kg poids corporel (PC). On ne dépassera cependant pas la dose individuelle de 100 U/kg PC et la dose journalière de 200 U/kg PC, sauf si la gravité des saignements nécessite et justifie l'utilisation de doses plus importantes (voir «Mises en garde et précautions»).
Hémorragies spontanées
Hémorragies articulaires, musculaires et des parties molles:
Lors d'hémorragies légères à moyennes, il convient d'administrer une dose de 50 à 75 U/kg PC toutes les 12 heures. Le traitement doit être poursuivi jusqu'à ce qu'une nette amélioration des symptômes cliniques soit observée, telle qu'une diminution de la douleur, une réduction des gonflements ou une mobilisation de l'articulation.
En cas de hémorragies musculaires ou des parties molles graves telles que les hémorragies rétro-péritonéales, une dose de 100 U/kg PC est recommandée toutes les 12 heures.
Hémorragies des muqueuses
Une dose de 50 U/kg PC toutes les 6 heures est recommandée sous surveillance stricte du patient (contrôle visuel du site hémorragique, déterminations répétées de l'hématocrite). Si l'hémorragie ne cesse pas, la dose peut être portée à 100 U/kg PC (sans dépasser la dose maximale journalière de 200 U/kg PC).
Autres hémorragies graves
Les hémorragies graves telles que les hémorragies du SNC ont été traitées avec succès par des doses de 100 U/kg PC toutes les 12 heures. Dans des cas particuliers, une réduction des intervalles d'administration à 6 heures peut s'avérer nécessaire jusqu'à obtention d'une amélioration clinique nette. La dose journalière maximale de 200 U/kg PC ne doit toutefois pas être dépassée.
Interventions chirurgicales
Lors d'interventions chirurgicales, on recommande l'administration de 50 à 100 U/kg PC à des intervalles minimaux de 6 heures, sous réserve de la dose maximale journalière autorisée.
Prophylaxie
·Prophylaxie des hémorragies chez les patients présentant un titre élevé d'inhibiteur et des saignements fréquents chez qui une induction de tolérance immune a échouée ou n'est pas envisagée: Une dose de 70 – 100 U/kg de poids corporel tous les deux jours est recommandée. Cette dose peut être augmentée jusqu'à 100 U/kg de poids corporel par jour si le patient continue à saigner, ou peut être progressivement diminuée.
·Prophylaxie des hémorragies chez les patients présentant un titre élevé d'inhibiteur en cours d'induction de tolérance immune: Feiba NF peut être administré simultanément au concentré de facteur VIII, à des doses de 50 - 100 U/kg de poids corporel, deux fois par jour jusqu'à ce que l'inhibiteur du facteur VIII soit réduit à < 2 U.B.****1 Unité Bethesda (U.B.) est définie comme la quantité d'inhibiteur capable de neutraliser 50% de l'activité du facteur VIII du plasma humain après incubation de 2 h à 37 °C.
Mode d'administration
La dissolution est décrite au paragraphe Mise en solution du lyophilisat (voir «Remarques de manipulation»). Feiba NF doit être injecté lentement par voie intraveineuse. La vitesse d'administration ne devrait pas dépasser 2 U/kg PC/min. Pour un patient de 75 kg de poids corporel, cela correspond à une vitesse de perfusion maximale de 3 ml/min.
Instructions spéciales pour la posologie
On ne dispose pas d'analyses systématiques concernant l'utilisation chez l'adolescent et l'enfant mais de nombreuses études de cas existent. Il convient de noter que les patients souffrant d'hémophilie sévère et présentant un statut hautement répondeur sont habituellement déjà traités dès l'enfance par des concentrés de facteur activé.
Vu la complexité du mécanisme d'action, aucune surveillance directe des ingrédients actifs n'est disponible. Des tests de la coagulation tels que le temps de coagulation du sang complet (WBCT), le thrombo-élastogramme (TEG, valeur r) et le temps de thromboplastine partielle activée (aPTT) ne mettent la plupart du temps en évidence qu'un faible raccourcissement et ne correspondent souvent pas à l'efficacité clinique. Par conséquent, ils ne peuvent être utilisés que dans une certaine limite dans le cadre de la surveillance du traitement par Feiba NF (voir «Mises en garde et précautions»).
Contre-indications
Feiba NF ne doit pas être utilisé dans les situations suivantes, si des thérapies alternatives à FEIBA existent:
·Hypersensibilité au principe actif ou à l'un des composants conformément à la composition
·Coagulation intravasculaire disséminée (CIVD)
·Infarctus du myocarde, thrombose aiguë et/ou embolie
Mises en garde et précautions
Mises en garde
Incidents thromboemboliques
Incidents - thromboemboliques, y compris la CIVD, la thrombose veineuse, l'embolie pulmonaire, l'infarctus du myocarde et l'accident vasculaire cérébral ayant eu lieu pendant le traitement avec FEIBA.
Certains de ces incidents apparaissent à des doses supérieures à 200 U/kg/jour ou chez des patients présentant d'autres facteurs de risque pour des incidents thromboemboliques (y compris CIVD, athérosclérose à un stade avancé, blessure par écrasement, septicémie). Un traitement en association avec un facteur VIIa recombinant peut augmenter le risque de survenue d'événements thromboemboliques. La présence éventuelle de tels facteurs de risque doit toujours être prise en considération chez les patients atteints d'hémophilie congénitale ou acquise.
Aucun cas de microangiopathie thrombotique (MAT) n'a été rapporté dans les études cliniques avec FEIBA. Des cas de MAT ont néanmoins été rapportés dans un essai clinique avec l'emicizumab dans lequel les sujets ont reçu une administration concomitante de FEIBA pour le traitement de saignements intercurrents (information professionnelle de l'emicizumab). La sécurité et l'efficacité de FEIBA n'ont pas été établies pour les saignements intercurrents des patients traités par l'emicizumab. Les bénéfices et les risques doivent être évalués si FEIBA doit être utilisé chez un patient recevant de l'emicizumab en prophylaxie.
Si un traitement avec FEIBA est considéré comme nécessaire pour des patients recevant également de l'emicizumab, ceux-ci devront être étroitement suivis par le médecin.
Les patients ayant reçu plus de 100 U/kg PC doivent être surveillés concernant le développement d'une CIVD et/ou une ischémie coronarienne aiguë. Si utilisé pour l'hémostase, le produit devrait être administré seulement aussi longtemps qu'il est absolument nécessaire d'atteindre le but thérapeutique.
Dans les situations suivantes, Feiba NF ne devrait être administré que dans les cas où un traitement par le concentré de facteur de la coagulation correspondant risque d'échouer par exemple en cas d'un titre élevé de l'inhibiteur ou un saignement ou en cas de risque de saignements qui met en jeu le pronostic vital (p.ex. post-traumatique ou postopératoire):
·CIVD: résultats sérologiques et/ou symptômes cliniques
·Hépatopathie: En raison de la clairance retardée des facteurs de la coagulation activés, le risque de développement de CIVD chez des patients présentant une insuffisance hépatique est accru
·Cardiopathies coronariennes
Hypersensibilité de type allergique
Comme avec tout produit intraveineux de plasma, des réactions d'hypersensibilité de type allergique peuvent apparaître. Les patients doivent être informés des signes précoces des réactions d'hypersensibilité tels éruptions urticariennes, urticaire généralisée, oppression thoracique, sibilances, hypotension et choc anaphylactique. Si ces symptômes surviennent, il faut conseiller aux patients d'arrêter l'utilisation du produit et de contacter immédiatement leur médecin.
Des réactions plus légères peuvent être maîtrisées par l'utilisation d'anti-histaminiques. En cas d'état de choc, le traitement doit suivre les règles de traitement modernes de l'état de choc.
Lorsqu'une réexposition de patients avec une hypersensibilité supposée au produit est prise en considération, l'avantage attendu et le risque de réexposition doivent être soigneusement sous-pesés en tenant compte du type d'hypersensibilité connue ou supposée du patient (allergique ou non-allergique), y compris une éventuelle thérapie corrective et/ou prophylactique ou des agents thérapeutiques alternatifs.
Surveillance de la thérapie
Ne pas dépasser 100 U/kg PC en dose individuelle et 200 U/kg PC par jour. Les patients ayant reçu une dose individuelle de 100 U/kg PC doivent faire l'objet d'une surveillance relative au développement d'une coagulopathie de consommation et aux symptômes d'une ischémie coronarienne aiguë. Des doses élevées de Feiba NF ne doivent être administrées que dans la mesure où leur administration est impérative jusqu'à l'hémostase.
En cas de survenue de signes cliniques tels que variations de la tension artérielle et du pouls irrégulier, dyspnée, douleurs thoraciques ou toux, arrêter immédiatement l'administration de Feiba NF et prendre des mesures diagnostiques et thérapeutiques spécifiques.
Les paramètres biologiques indiquant une coagulopathie de consommation se traduisent par une diminution du taux de fibrinogène, une thrombopénie et/ou la présence de produits de dégradation de la fibrine et/ou du fibrinogène. Les autres signes révélateurs d'une coagulopathie de consommation sont des temps de thrombine, de prothrombine et de thromboplastine partielle activée (aPTT) significativement allongés.
Hémophilie acquise
Les patients non hémophiles présentant des inhibiteurs acquis contre les facteurs VIII, IX ou XI, peuvent présenter en même temps une tendance hémorragique et un risque de thrombose accrus.
Tests sérologiques et efficacité clinique
Les tests de coagulation réalisés in vitro pour le contrôle de l'efficacité ainsi que le temps de thromboplastine partielle activée (aPTT), le temps de coagulation du sang complet (WBCT) et le thrombo-élastogramme (TEG) ne correspondent pas forcément à l'amélioration clinique. Des tentatives visant à normaliser ces valeurs en augmentant la dose de Feiba NF peuvent échouer et sont expressément déconseillées en raison du risque potentiel d'induction d'une CID par surdosage.
En cas d'effet inadéquat d'un traitement par Feiba NF, une numération plaquettaire est recommandée car un nombre suffisant de thrombocytes fonctionnels intacts est considéré comme nécessaire pour établir l'efficacité de Feiba NF.
Sécurité virale
Feiba NF est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche de marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures de sécurité prises sont considérées comme efficaces contre les virus enveloppés tels que VIH, VHB et VHC ainsi que contre le virus non enveloppé de l'hépatite A (VHA).
Les mesures prises peuvent être d'efficacité limitée vis-à-vis des virus non enveloppés tels que parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez les femmes enceintes (infection foetale) et chez les sujets immunodéprimés ou présentant une augmentation de la production de globules rouges (par ex. anémie hémolytique).
Pour les patients qui reçoivent régulièrement des préparations dérivées de sang ou de plasmas humains, une vaccination contre l'hépatite A et l'hépatite B est recommandée par principe.
Lors de chaque administration de Feiba NF à un patient, il est recommandé de documenter le nom et le numéro de lot de la préparation pour pouvoir établir un rapport entre le patient et le lot du produit.
Précautions
Vu les facteurs spécifiques de chaque patient, la réaction à un agent bypassant peut varier. Ainsi en cas d'hémorragies, les patients rencontrant une réaction insuffisante à un agent peuvent réagir éventuellement à un autre agent. En cas de réaction insuffisante à un agent bypassant, l'utilisation d'un autre agent doit être prise en considération.
L'administration de Feiba NF à des patients porteurs d'inhibiteurs peut entraîner une augmentation anamnestique initiale du titre d'inhibiteurs. Si Feiba NF continue à être administré, le titre d'inhibiteurs devrait diminuer avec le temps. Des données cliniques et publiées suggèrent que l'efficacité de Feiba NF n'est pas réduite.
Interférence avec les tests de laboratoire
Feiba NF contient des iso-hémagglutinines (anti-A et anti-B). Une transmission passive d'anticorps aux antigènes érythrocytaires, par exemple A, B, D peut interférer avec des tests sérologiques pour les anticorps érythrocytaires, tels que le test à l'antiglobuline (ou test de Coombs).
Sodium
Flacon de 1000 U:
Feiba NF 1000 U contient env. 81.7 mg de sodium (calculé) par flacon à percer, ce qui équivaut à 4.1 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Flacon de 2500 U:
Feiba NF 2500 U contient env. 204.3 mg de sodium (calculé) par flacon à percer, ce qui équivaut à 10.2 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
En tenir compte en cas de régime hyposodé.
Interactions
Aucune étude suffisante ou bien-contrôlée n'a été menée sur l'utilisation de FEIBA en association ou consécutive à un facteur VIIa recombinant (rFVIIa), à des antifibrinolytiques ou à emicizumab.
Ne pas utiliser de manière concomitante les anti-fibrinolytiques tels que l'acide tranexamique ou l'acide ε-aminocapronique avec Feiba NF.
Si un traitement par anti-fibrinolytique et Feiba NF est malgré tout indiqué, il convient de respecter un intervalle au moins de 6 heures entre l'administration des deux préparations.
En association avec un facteur VIIa recombinant, selon les données in vitro et observations cliniques disponibles, une interaction médicamenteuse peut survenir (entraînant potentiellement des effets indésirables tel qu'un événement thromboembolique).
L'expérience d'un essai clinique avec l'emicizumab suggère qu'une interaction médicamenteuse potentielle pourrait exister avec l'emicizumab lorsque Feiba a été utilisé de façon concomitante pour le traitement de saignements intercurrents (voir «Mises en garde et précautions»).
Grossesse, allaitement
On ne dispose pas d'études cliniques sur la sécurité d'emploi de Feiba NF chez la femme enceinte et pendant l'allaitement. Les expérimentations animales ne sont pas appropriées pour déterminer la sécurité sur la grossesse, le développement de l'embryon, le développement du fœtus et/ou le développement post-natal. En conséquence aucune étude sur la reproduction animale n'a été réalisée avec FEIBA.
Le risque potentiel pour l'être humain n'est pas connu.
La grossesse et la période post-partum se caractérisent par un risque accru de thrombose et plusieurs complications de grossesse sont associées à un risque accru de CIVD.
Le médecin doit soigneusement sous-peser les risques et avantages potentiels pour chaque patient avant de prescrire Feiba NF.
Informations sur les infections par le parvovirus B19 cf. «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucun élément ne permet de mettre en évidence un effet éventuel de Feiba NF sur la capacité à conduire ou à utiliser des machines.
Effets indésirables
FEIBA peut provoquer des réactions d'hypersensibilité allergiques incluant une urticaire, un angioœdème, des manifestations gastro-intestinales, des bronchospasmes, et une chute de tension. Ces reactions peuvent être sevères et systémiques (p.ex. anaphylaxie avec urticaire et angioœdème, bronchospasme, choc circulatoire). D'autres réactions à la perfusion ont également été rapportées telles que frissons, fièvre et hypertension.
Les effets indésirables indiqués dans cette rubrique ont été rapportées dans le cadre des rapports de cas spontanés après autorisation du médicament (pharmacovigilance) et de 2 essais cliniques avec FEIBA pour le traitement des hémorragies chez au moins 9 patients pédiatriques et 55 adultes avec hémophilie A ou B et avec inhibiteurs du facteur VIII ou IX. Dans une étude des patients avec une hémophilie acquise et inhibiteurs du facteur VIII (2 de 49 patients) étaient également inclus. Les effets indésirables d'une troisième étude qui a comparé la prévention avec un traitement «on-demand» chez 9 patients pédiatriques et 27 adultes sont integrés ici.
La fréquence a été définie selon les critères suivants: très fréquent (≥ 10 %), fréquent (≥ 1 % à < 10 %), occasionnel (≥ 0.1 % à < 1 %), rare (≥ 0.01 % à < 0.1 %), très rare (< 0.01 %).
Affections hématologiques et du système lymphatique
Fréquent: augmentation du titre d'inhibiteurs (réponse anamnestique)*
*L'augmentation du titrage de l'inhibiteur (réponse anamnestique) [n'est pas un terme MedDRA] est l'augmentation des précédents titrages de l'inhibiteur se produisant après l'administration de FEIBA. Voir «Mises en garde et précautions».
Cas isolés: CIVD
Affections du système immunitaire
Fréquent: réactions d'hypersensibilité
Cas isolés: urticaire, réaction anaphylactique
Affections du système nerveux
Fréquent: céphalée, vertiges, somnolence, dysgueusie
Cas isolés: insensibilité au niveau du visage et des membres (hypoesthésie), paresthésie, accident vasculaire cérébral thrombotique, accident vasculaire cérébral embolique
Affections cardiaques
Cas isolés: infarctus du myocarde, tachycardie
Affections vasculaires
Fréquent: hypotension
Cas isolés: thrombose, thrombose veineuse, thrombose artérielle, hypertension, bouffée congestive
Affections respiratoires, thoraciques et médiastinales
Fréquent: dyspnée
Cas isolés: embolie pulmonaire, bronchospasme, sibilances, toux
Affections gastro-intestinales
Fréquent: nausées
Cas isolés: vomissement, diarrhée, gêne abdominal
Affections de la peau et du tissu sous-cutané
Fréquent: éruption cutanée
Cas isolés: hypoesthésie faciale, angioœdème, urticaire, prurit
Troubles généraux et anomalies au site d'administration
Fréquent: frissons, pyrexie, douleur thoracique, gêne thoracique
Cas isolés: douleur au site d'injection, malaise, sensation de chaleur
Investigations
Fréquent: anticorps de surface anti-hépatite B positifs
Cas isolés: diminution de la pression sanguine, augmentation des D-dimères de la fibrine
Réactions de classe
Fréquence inconnue: d'autres symptômes de réaction d'hypersensibilité aux médicaments dérivés du sang incluent léthargie et agitation.
Pour d'informations concernant la sécurité virale, voir «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Certains évènements thromboemboliques rapportés sont survenues avec des doses supérieures à 200 U/kg. En cas de signes ou symptômes d'incident thromboembolique, la perfusion doit être arrêtée immédiatement et des mesures diagnostiques et thérapeutiques spécifiques doivent être prises (voir «Mises en garde et précautions»).
Propriétés/Effets
Code ATC
B02BD03
Mécanisme d'action
Bien que Feiba NF ait été développé au début des années 1970 et que son activité de contournement de l'inhibiteur du facteur VIII ait été attestée in vitro et in vivo, ses composants actifs font toujours l'objet de débats scientifiques. Des travaux scientifiques publiés récemment ont toutefois montré que des composants spécifiques du complexe de prothrombine activée, la prothrombine zymogène (facteur II) et le facteur X activé (facteur Xa) jouent un rôle dans le mécanisme d'action de Feiba NF.
Efficacité clinique
Feiba NF a été utilisé avec succès dans le cas d'un patient présentant un inhibiteur, qui souffrait du syndrome de von Willebrand-Jürgens.
Feiba NF a également été utilisé en association avec le concentré de facteur VIII en traitement à long terme dans le but de parvenir à une élimination complète et permanente de l'inhibiteur du facteur VIII pour permettre un traitement normal par un concentré de F VIII comme c'est le cas chez les patients qui ne présentent pas d'inhibiteur.
Pharmacocinétique
Dans la mesure où les composants actifs font encore l'objet de discussions, il n'est pas possible d'établir des affirmations définitives sur les propriétés pharmacocinétiques de Feiba NF.
Données précliniques
Compte tenu d'études de toxicité aiguë chez les souris chez lesquelles le facteur VIII est inhibé, chez les souris normales et chez le rat, utilisant des doses supérieures à la dose journalière maximale chez l'être humain (c'est-à-dire > 200 U/kg PC), on peut en conclure que les effets indésirables associés à Feiba NF sont principalement la conséquence d'une hypercoagulation entraînée par les propriétés pharmacologiques de la préparation.
Des études de toxicité réalisées chez l'animal avec administrations multiples ne sont pas réalisables compte tenu de l'interférence associée aux anticorps se développant contre la protéine hétérologue.
En l'absence de signes d'effets oncogènes et mutagènes des protéines plasmatiques humaines, des analyses expérimentales, en particulier dans le cas d'espèces hétérologues, n'ont pas été considérées nécessaires.
Remarques particulières
Incompatibilités
Pour préserver l'efficacité et la tolérance de cette préparation, Feiba NF, comme tous les autres concentrés coagulants, ne doit pas être mélangé à d'autres médicaments avant administration ni dilué avec des solutions pour perfusion. Il est éventuellement recommandé de rincer avec une solution physiologique, une voie d'accès commune, avant et après l'utilisation de Feiba NF.
Des facteurs de coagulation dérivés du plasma humain peuvent être adsorbés par les surfaces internes de certains types de systèmes d'injection/de perfusion. Le cas échéant, la thérapie pourrait être un échec. L'utilisation de Feiba NF doit donc être uniquement associée à des systèmes de perfusion en plastique approuvés.
Influence sur les méthodes de diagnostic
Après l'administration de doses élevées de Feiba NF, une augmentation passagère d'anticorps de surface de l'hépatite B passivement transférés peut mener à une interprétation ambigüe des résultats positifs dans les tests sérologiques.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Une stabilité chimique et physique de 3 heures, de 20 à 25 °C a été démontrée pour Feiba NF une fois reconstitué. Pour des considérations microbiologiques, la préparation doit être utilisée immédiatement après reconstitution.
Ne pas conserver au réfrigérateur ni congeler les solutions reconstituées.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de +25 °C. Ne pas congeler.
Conserver dans l'emballage d'origine pour préserver le contenu contre la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Diluer Feiba NF immédiatement avant utilisation. Ensuite, la solution doit être utilisée immédiatement (la solution ne contient pas de conservateur). Les solutions qui sont troubles ou présentent un précipité ne doivent pas être utilisées.
Agiter doucement jusqu'à ce que toute la solution soit dissoute. Bien vérifier que Feiba NF est complètement dissout, sinon une part de la substance active FEIBA ne passera pas au travers du filtre.
Avant l'utilisation la solution doit être inspectée visuellement pour mettre en évidence la présence de particules ou un changement de coloration avant l'administration. Ne pas employer de solutions troubles ou présentant des dépôts
Ne pas utiliser le dispositif de transfert ou l'aiguille de transfert si l'emballage stérile ou le conditionnement est abîmé. Eliminer la solution non utilisée et les déchets de manière spécifique.
L'appareil peut contenir soit un système BAXJECT II Hi-Flow soit une canule bilatérale et une aiguille de filtrage.
Pour la dissolution et l'administration avec BAXJECT II Hi-Flow, voir «Variante A».
Pour la dissolution et l'administration par une canule bilatérale et une aiguille de filtrage, voir «Variante B».
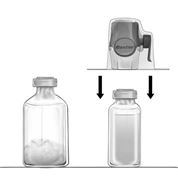
Variante A (si le produit est livré avec le système BAXJECT II Hi-Flow)
Dissolution du lyophilisat:
1.Réchauffer le flacon à percer du solvant (eau pour injection) non ouvert à la température ambiante (15 – 25 °C), p.ex. à l'aide d'un bain d'eau à quelques minutes (max. 37 °C) si nécessaire.
2.Retirer le capuchon de protection des flacons à percer de lyophilisat et de solvant et désinfecter les deux bouchons en caoutchouc. Placer les deux flacons sur une surface plane.
3.Ouvrir l'emballage de BAXJECT II Hi-Flow en retirant le film protecteur sans toucher l'intérieur de l'emballage (Fig. a). Ne pas sortir le système de transfert de l'emballage.
4.Retourner l'emballage vers le bas et insérer la pointe en plastique transparent dans le bouchon en caoutchouc du flacon de solvant (Fig. b). Saisir l'emballage par les rebords puis retirer l'emballage de BAXJECT II Hi-Flow (Fig.c). Ne pas retirer le bouchon bleu de BAXJECT II Hi-Flow.
5.Retourner le flacon de solvant connecté à BAXJECT II Hi-Flow sur lui-même, de sorte que le flacon de solvant se trouve en haut. Insérer la pointe en plastique violet de BAXJECT II Hi-Flow dans le bouchon en caoutchouc du flacon de Feiba NF. Le vide va aspirer le solvant dans le flacon de Feiba NF (Fig. d).
6.Agiter doucement, sans secouer, le système complet jusqu'à dissolution de Feiba NF. S'assurer que Feiba NF est entièrement dissous, afin d'éviter que la substance active soit retenue par le filtre de BAXJECT II Hi-Flow.
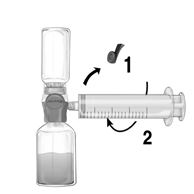
Administration:
1.Retirer le bouchon bleu de BAXJECT II Hi-Flow. Prenez la seringue et connectez-la bien à BAXJECT II Hi-Flow (NE PAS ASPIRER D'AIR DANS LA SERINGUE) (Fig.e). Afin de garantir une bonne connexion entre la seringue et le dispositif BAXJECT II Hi-Flow, l'utilisation d'une seringue luer lock est fortement recommandée (à l'assemblage, tourner la seringue dans le sens des aiguilles d'une montre jusqu'à atteindre la position d'arrêt).
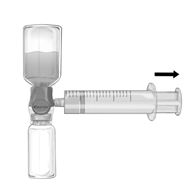
2.Retourner le système de sorte que la solution dissoute se trouve en haut. Remplir la seringue de solution reconstituée de Feiba NF en tirant doucement le piston en arrière et en s'assurant du maintien d'une bonne connexion entre le dispositif BAXJECT II Hi-Flow et la seringue tout au long de l'aspiration (Fig.f).
3.Retirer la seringue.
4.En cas de formation de mousse dans la seringue, attendre la disparition de la mousse. Injecter la solution lentement par voie intraveineuse avec un système d'injection à ailettes au moyen du dispositif de perfusion emballée (ou aiguille à usage unique).
Ne pas dépasser une vitesse d'administration de 2 U de Feiba NF/kg PC/min.
|
Figure a |
Figure b |
Figure c | |||
|
|
|
|
|
|
|
|
Figure d |
Figure e |
Figure f | |||
|
|
|
|
|
|
|
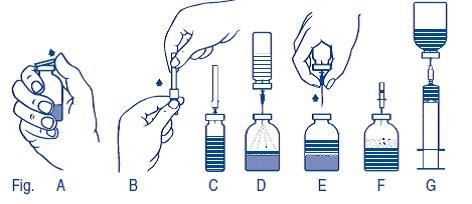
Variante B (si le produit est livré avec aiguille de filtrage, de transfert et d'aération au lieu du système BAXJECT II Hi-Flow)
Dissolution du lyophilisat:
1.Réchauffer le flacon à percer du solvant (eau pour injection) non ouvert à la température ambiante (max. 37 °C), si nécessaire.
2.Enlever le capuchon de protection des flacons à percer du lyophilisat et du solvant (Fig. A) et désinfecter les deux bouchons en caoutchouc.
3.Retirer en tournant et tirant le capuchon protecteur d'une extrémité de l'aiguille de transfert emballée et percer à l'aide de l'aiguille, le bouchon en caoutchouc du flacon à percer du solvant (Fig. B et C).
4.Retirer le bouchon protecteur de l'autre extrémité de l'aiguille de transfert. Ne pas toucher l'extrémité libre de l'aiguille!
5.Retourner le flacon à percer du solvant et percer le centre du bouchon de caoutchouc du flacon de lyophilisat avec l'aiguille de transfert (Fig. D). Le vide existant dans le flacon du lyophilisat entraîne l'aspiration du solvant.
6.Retirer ensemble l'aiguille et le flacon à percer du solvant du flacon de lyophilisat (Fig. E). Accélérer la dissolution en agitant légèrement le flacon de lyophilisat.
7.Après dissolution complète du lyophilisat, enfoncer l'aiguille d'aération jointe à l'emballage (Fig. F), ce qui permet de faire disparaître la mousse qui s'était éventuellement formée. Retirer l'aiguille d'aération.
Administration:
1.Retirer en tournant et en tirant l'extrémité du bouchon protecteur de l'aiguille de filtrage jointe, l'adapter à la seringue à usage unique stérile et aspirer la solution dans la seringue (Fig. G).
2.Retirer l'aiguille de filtrage et injecter la solution avec le nécessaire de perfusion ou l'aiguille à usage unique jointe, lentement, par voie intraveineuse.
Ne pas dépasser une vitesse d'administration de 2 U de Feiba NF/kg PC/min.
Si des dispositifs autres que ceux fournis avec Feiba NF devaient être utilisés, s'assurer de l'utilisation d'un filtre ayant des pores d'au moins 149 µm.
Numéro d’autorisation
41352 (Swissmedic)
Présentation
1 boîte de Feiba NF contient: 1 flacon à percer contenant la poudre pour solution injectable (IV), 1 flacon à percer avec eau pour préparations injectables et 1 dispositif de dissolution et d'injection
Feiba NF 1000 E
Poudre de 1000 U de FEIBA et 20 ml d'eau pour injection
Feiba NF 2500 E
Poudre de 2500 U de FEIBA et 50 ml d'eau pour injection
Catégorie de remise: B
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Mise à jour de l’information
Mai 2024