ZusammensetzungWirkstoffe
Inaktiviertes Hepatitis A-Virus (Stamm HM175)*, Hepatitis B-Oberflächenantigen (HBsAg)**.
* hergestellt in menschlichen diploiden (MRC-5) Zellen
** hergestellt in Hefezellen (Saccharomyces cerevisiae) mittels rekombinanter DNA-Technologie
Hilfsstoffe
Aluminiumphosphat, wasserhaltiges Aluminiumhydroxid zur Adsorption, Natriumchlorid (enthält 3,54 mg Natrium), Wasser für Injektionszwecke.
Rückstände:
Aminosäuren zur Injektion einschliesslich Phenylalanin, Formaldehyd, Neomycinsulfat, Polysorbat 20.
Indikationen/AnwendungsmöglichkeitenTwinrix 720/20 ist indiziert zur aktiven Immunisierung gegen Hepatitis A-Viren und Hepatitis B-Viren bei Kindern ab dem 1. Geburtstag, bei Jugendlichen und Erwachsenen.
Die Hepatitis D tritt nur in Verbindung mit einer Hepatitis B-Infektion auf, somit schützt Twinrix 720/20 auch vor der Hepatitis D.
Die Anwendung von Twinrix 720/20 wird bei allen Personen mit erhöhtem Risiko einer Hepatitis A- und B-Infektion empfohlen. Dazu gehören:
·Medizinisches Personal (Ärzte, Zahnärzte, Pflegepersonal, medizinisches Assistenz- und Laborpersonal, Hebammen und Geburtshelfer, Sanitäter);
·Patienten, bei denen Hämodialyse oder wiederholte Verabreichung von Blut oder Blutderivaten notwendig ist (z.B. bei Hämophilie, Thalassämie, Sichelzellanämie, Zirrhose);
·Patienten mit bevorstehender Organtransplantation;
·Personal und Bewohner von geschlossenen Anstalten, Strafanstalten und Heimen;
·Personen mit erhöhtem Risiko für sexuell übertragbare Erkrankungen (häufiger Partnerwechsel, Homosexuelle, Patienten mit sexuell übertragbaren Erkrankungen);
·Rauschgiftsüchtige (i.v. Drogenabhängige) und deren Betreuer;
·Reisende in Hepatitis A- und Hepatitis B-Endemiegebiete;
·Andere Personen mit erhöhtem Risiko einer HBV- und HAV-Exposition im beruflichen oder privaten Umfeld (z.B. Rettungsdienst, Polizei, Feuerwehr, Sicherheits- und Verteidigungspersonal und andere Personen mit engem Kontakt zu Risikogruppen);
·Personen, die mit Angehörigen der o.g. Gruppen oder mit Patienten mit akuter oder chronischer Hepatitis B in einem Haushalt leben.
Dosierung/AnwendungDie empfohlene Dosis beträgt für Kinder und Jugendliche ab dem 1. Geburtstag bis zum 16. Geburtstag 1 Dosis Twinrix 720/20 (1,0 mL) unter Verwendung des 2-Dosen-Schemas und für Jugendliche ab dem 16. Geburtstag und Erwachsene 1 Dosis Twinrix 720/20 (1,0 mL) unter der Verwendung des 3-Dosen-Schemas (siehe Grundimmunisierung).
Twinrix 720/20 wird intramuskulär injiziert, bei Kindern und Erwachsenen vorzugsweise in die Deltoideusregion, bei Kleinkindern anterolateral am Oberschenkel.
Intradermale Injektionen oder Injektionen in den Gesässmuskel sollten vermieden werden. Diese Injektionswege können zu einer suboptimalen Immunantwort führen.
Grundimmunisierung
Kinder und Jugendliche ab dem 1. bis zum 16. Geburtstag
2-Dosen-Schema:
1. Dosis: zu Beginn der Impfserie
2. Dosis: 6 bis 12 Monate nach der 1. Injektion
Jugendliche ab dem 16. Geburtstag und Erwachsene
3-Dosen-Schema:
1. Dosis: zu Beginn der Impfserie
2. Dosis: 1 Monat später
3. Dosis: 6 Monate nach der 1. Injektion
Wenn ein rascherer Schutz erwünscht ist, kann bei Erwachsenen ausnahmsweise das 0/7/21-Tagesschema angewendet werden, z.B. bei Personen, die mit der Grundimmunisierung erst 1 Monat vor Abreise in hoch endemische Gebiete beginnen können. Die Auffrischimpfung ist 12 Monate nach der 1. Dosis zu verabreichen.
Das empfohlene Impfschema sollte eingehalten werden. Einmal begonnen, sollte die Grundimmunisierung mit dem gleichen Impfstoff zu Ende geführt werden.
Zur Vervollständigung des Impfschutzes gegen Hepatitis A und B und der Erzielung einer Langzeitwirksamkeit müssen unbedingt alle empfohlenen Dosen verabreicht werden.
Auffrischimpfung (Booster)
Für eine Auffrischimpfung wird die Verwendung von Twinrix 720/20 empfohlen. Es kann aber auch der monovalente Hepatitis A- oder B-Impfstoff verwendet werden.
Die beobachtete Persistenz der Anti-HAV-Antikörper und Anti-HBs-Antikörper von bis zu 15 Jahren nach Verabreichung der 1. Dosis der Grundimmunisierung mit Twinrix 720/20 bei Erwachsenen entspricht derjenigen, welche auch durch Verabreichung der monovalenten Impfstoffe erreicht wird.
a) Hepatitis B-Komponente
Es ist bisher nicht vollständig geklärt, ob immunkompetente Personen, die nach vollständiger Grundimmunisierung auf den Hepatitis B-Impfstoff angesprochen haben, zur Gewährleistung eines Langzeitimpfschutzes Auffrischimpfungen benötigen. Einige offizielle Impfprogramme schliessen eine Booster-Empfehlung für eine Hepatitis B-Impfdosis mit ein. Dies sollte respektiert werden.
Für gewisse Gruppen von Personen und Patienten mit HBV-Exposition (z.B. Hämodialyse, Störungen des Immunsystems, intensive Exposition in einem HBV-Endemiegebiet) sollte vorsichtshalber ein Antikörpertiter von 10 I.E./l nicht unterschritten werden.
b) Hepatitis A-Komponente
Es ist bisher nicht vollständig geklärt, ob immunkompetente Personen, die auf Hepatitis A-Impfstoffe angesprochen haben, zur Gewährleistung eines Langzeitimpfschutzes Auffrischimpfungen benötigen oder ob der Langzeitschutz durch das immunologische Gedächtnis gewährleistet ist. Das Persistieren von Anti HAV-Antikörpern lässt sich über mindestens 10 Jahre vorhersagen.
Richtlinien für den Booster basieren auf der Annahme, dass Antikörper für den Schutz benötigt werden.
In Situationen, wo eine Boosterdosis mit Hepatitis A und Hepatitis B gewünscht ist, kann Twinrix 720/20 gegeben werden. Alternativ kann bei Personen, die mit Twinrix 720/20 grundimmunisiert wurden, auch eine Boosterdosis der monovalenten Impfstoffe verabreicht werden.
Spezielle Dosierungsanweisungen
Thrombozytopenie oder Blutgerinnungsstörungen: Weil intramuskuläre Injektionen mit Nachblutungen verbunden sein können, sollte Twinrix 720/20 in solchen Fällen subkutan verabreicht werden. Diese Art der Verabreichung kann jedoch zu einer suboptimalen Immunantwort führen.
Hämodialyse oder Störungen des Immunsystems: Mit der Grundimmunisierung werden unter Umständen keine adäquaten Anti-HAV- und Anti-HBV-Titer erreicht. Die Verabreichung weiterer Impfdosen kann in solchen Fällen erforderlich sein.
Bei Risikogruppen können die Antikörper regelmässig bestimmt und entsprechende Auffrischimpfungen verabreicht werden, sobald der Titer unter den Mindestwert sinkt.
KontraindikationenTwinrix 720/20 sollte bei bekannter Überempfindlichkeit gegenüber einem der Bestandteile des Impfstoffes, inkl. Neomycin nicht verabreicht werden und ebenfalls nicht bei Personen, die nach früherer Verabreichung von Twinrix 720/20 oder des monovalenten Hepatitis A- oder B-Impfstoffes Überempfindlichkeitsreaktionen gezeigt haben.
Die Verabreichung von Twinrix 720/20 muss bei Personen, die an einer akuten, fieberhaften Erkrankung leiden, verschoben werden.
Warnhinweise und VorsichtsmassnahmenTwinrix 720/20 darf unter keinen Umständen intravaskulär injiziert werden.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie bei allen injizierbaren Impfstoffen sollte für den Fall einer anaphylaktischen Reaktion nach der Impfung immer eine angemessene medizinische Behandlung zur Verfügung stehen (z.B. Adrenalin-Lösung 1/1000).
Da eine intradermale Injektion oder intramuskuläre Verabreichung in den Gesässmuskel zu einem suboptimalen Impferfolg führen könnte, sollten diese Injektionswege vermieden werden.
Es wurde beobachtet, dass Übergewicht (definiert als BMI ≥ 30 kg/m2) die Immunantwort auf Hepatitis-A-Impfstoffe verringern kann.
Es wurde eine Reihe von Faktoren beobachtet, die die Immunantwort auf Hepatitis B-Impfstoffe verringern. Zu diesen Faktoren gehören höheres Alter, männliches Geschlecht, Übergewicht, Rauchen, die Art und Weise der Verabreichung des Impfstoffes und einige vorbestehende chronische Erkrankungen. Bei Patienten, bei denen das Risiko besteht, dass keine Seroprotektion nach dem vollständigen Impfschema von Twinrix 720/20 erreicht wird, sollte eine serologische Überprüfung in Betracht gezogen werden. Bei Personen, die keine oder eine nicht ausreichende Immunantwort nach erfolgter vollständiger Impfung zeigen, sollte die Verabreichung zusätzlicher Impfdosen erwogen werden.
Wie bei allen Impfstoffen kann nicht bei allen geimpften Personen eine schützende Immunität erreicht werden.
Bei Patienten mit beeinträchtigter Immunität ist der Impfstoff nicht geprüft worden. Bei Hämodialyse-Patienten und Personen mit einem beeinträchtigten Immunsystem kann es sein, dass nach der Grundimmunisierung keine adäquaten Anti-HAV- und Anti-HBs-Antikörper-Titer erreicht werden. Bei diesen Patienten können zusätzliche Impfdosen notwendig werden.
Twinrix 720/20 wird nicht empfohlen für eine Postexpositions-Prophylaxe (z.B. nach einem Nadelstich).
Impflinge können sich zum Zeitpunkt der Impfung möglicherweise bereits in der Inkubationsphase einer Hepatitis A- oder B-Infektion befinden. In solchen Fällen ist nicht bekannt, ob Twinrix 720/20 die Hepatitis A oder B verhindern kann.
Der Impfstoff wirkt nur gegen Erreger der Hepatitis A und B (einschliesslich D), nicht aber gegen andere Viren (z.B. der Hepatitis C und E) oder sonstige Erreger von Leberinfektionen.
Twinrix 720/20 enthält Spuren von Phenylalanin. Phenylalanin kann schädlich sein, wenn der Patient eine Phenylketonurie hat, eine seltene angeborene Erkrankung, bei der sich Phenylalanin anreichert, weil der Körper es nicht ausreichend abbauen kann.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
InteraktionenEs liegen keine Daten über die gleichzeitige Verabreichung von Twinrix 720/20 mit spezifischem Hepatitis A- oder B-Immunglobulin vor. Bei gleichzeitiger Verabreichung von monovalentem Hepatitis A- bzw. Hepatitis B-Impfstoff mit spezifischen Immunglobulinen wurde jedoch kein Einfluss auf die Serokonversion beobachtet; niedrigere Antikörpertiter sind möglich.
Klinische Daten haben gezeigt, dass Twinrix 720/20 im zweiten Lebensjahr gleichzeitig mit dem kombinierten Diphtherie-Tetanus-azellulären Pertussis-inaktivierten Poliomyelitis- und Haemophilus influenzae Typ b-Impfstoff (DTPa-IPV+Hib) an verschiedenen Injektionsstellen verabreicht werden kann.
Twinrix 720/20 kann gleichzeitig mit dem kombinierten Masern-Mumps-Röteln-Impfstoff verabreicht werden.
Studien über die gleichzeitige Verabreichung der monovalenten Hepatitis A- und B-Komponenten von Twinrix 720/20 mit anderen Impfstoffen zeigten keine Interaktionen auf. Interaktionen mit anderen Impfstoffen sind jedoch nicht zu erwarten, sofern verschiedene Spritzen und Injektionsstellen verwendet werden.
Wie auch bei anderen Impfstoffen ist zu erwarten, dass bei immundefizienten oder immunsupprimierten Patienten möglicherweise keine ausreichende Immunantwort erzielt wird.
Schwangerschaft, StillzeitTwinrix 720/20 sollte während der Schwangerschaft nur angewendet werden, wenn klar notwendig.
Die Wirkung von Twinrix 720/20 auf das embryo-fötale, perinatale und postnatale Überleben und die Entwicklung ist in klinischen Studien nicht prospektiv evaluiert worden.
Die Wirkung von Twinrix 720/20 auf das embryo-fötale, perinatale und postnatale Überleben und die Entwicklung ist in einer Segment III-Studie mit Ratten untersucht worden. Die Studie zeigte keine direkten oder indirekten nachteiligen Wirkungen in Bezug auf die Fertilität, Schwangerschaft, embryonal/fötale Entwicklung, das Gebären oder die post-natale Entwicklung auf.
Es wurden keine Reproduktionsstudien am Tier und keine klinischen Studien bei schwangeren oder stillenden Frauen durchgeführt.
Twinrix 720/20 sollte deshalb bei stillenden Frauen mit Vorsicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenTwinrix 720/20 hat keine oder nur eine unwesentliche Auswirkung auf die Fahrtüchtigkeit und die Fähigkeit zur Bedienung von Maschinen.
Unerwünschte WirkungenDie vorliegende Zusammensetzung von Twinrix 720/20 enthält weder Thiomersal noch irgendein Konservierungsmittel. In einer klinischen Studie war die Inzidenz von Schmerz, Rötung, Schwellung, Müdigkeit, Gastro-Enteritis, Kopfschmerz und Fieber vergleichbar mit derjenigen, die mit der früheren Zusammensetzung, die Thiomersal und ein Konservierungsmittel enthielt, beobachtet wurde.
Die folgenden unerwünschten Effekte wurden nach Verabreichung der sehr häufig verwendeten früheren Formulierung von Twinrix 720/20 mit Konservierungsmittel berichtet.
In einer Vergleichsstudie zwischen Twinrix 720/20 und seinen monovalenten Komponenten (Hepatitis A- bzw. Hepatitis B-Impfstoffe) wurde kein Unterschied in der Häufigkeit der berichteten unerwünschten Ereignisse festgestellt.
Während der klinischen Studien traten am häufigsten Reaktionen an der Injektionsstelle auf (Schmerzen, Rötung und Schwellung).
In einer klinischen Studie an Erwachsenen wurde nach Anwendung des 0/7/21-Tagesschemas sehr häufig über Kopfschmerzen berichtet. Die anderen gemeldeten unerwünschten Begleiterscheinungen traten in derselben Häufigkeit wie bei den anderen Impfschemata auf.
Nach einer 4. Dosis, die nach 12 Monaten verabreicht wurde, war die Häufigkeit der unerwünschten Wirkungen vergleichbar mit den Ereignissen, die nach dem Impfschema 0, 7, 21 Tagen gesehen wurden.
Klinische Studien
Das folgende Sicherheitsprofil basiert auf Daten von mehr als 6'000 Personen, die entweder nach der Standard-Grundimmunisierung 0, 1, 6 Monate (N=5'683) oder dem 0, 7, 21 Tage-Schema (N=320) geimpft wurden.
Häufigkeiten werden wie folgt angegeben: «sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1'000), «selten» (<1/1'000, ≥1/10'000), «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektionen des oberen Respirationstraktes.
Erkrankungen des Blutes und des Lymphsystems
Selten: Lymphadenopathie.
Stoffwechsel- und Ernährungsstörungen
Selten: Verminderter Appetit.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (Impfschema 0,1,6 Mte.: 10,1%; Impfschema 0,7,21 Tage + 12 Mte.: 10,9%).
Gelegentlich: Schwindel.
Selten: Hypoästhesie, Parästhesie.
Gefässerkrankungen
Selten: Tiefer Blutdruck.
Erkrankungen des Gastrointestinaltrakts
Häufig: Gastrointestinale Beschwerden wie Diarrhöe, Übelkeit und Erbrechen.
Gelegentlich: Abdominalschmerzen*.
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Hautausschlag, Pruritus.
Sehr selten: Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Myalgie.
Selten: Arthralgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerz (Impfschema 0,1,6 Mte.: 37,6%; Impfschema 0,7,21 Tage + 12 Mte.: 36,5%) und Rötung an der Injektionsstelle (Impfschema 0,1,6 Mte.: 17,0%; Impfschema 0,7,21 Tage + 12 Mte.: 11,8%), Müdigkeit (Impfschema 0,1,6 Mte.: 11,4%; Impfschema 0,7,21 Tage + 12 Mte.: 13,4%).
Häufig: Schwellung an der Injektionsstelle, Lokalreaktionen, Unwohlsein.
Gelegentlich: Fieber (≥37,5°C).
Selten: Grippeähnliche Erkrankung, Schüttelfrost.
* Unerwünschte Wirkungen in klinischen Studien bei pädiatrischen Probanden beobachtet.
Post-Marketing Überwachung
Über die folgenden unerwünschten Wirkungen ist entweder nach Gabe von Twinrix 720/20 oder nach Gabe der monovalenten Hepatitis A- oder B-Impfstoffe von GlaxoSmithKline berichtet worden:
Infektionen und parasitäre Erkrankungen
Meningitis.
Erkrankungen des Blutes und des Lymphsystems
Thrombozytopenie, thrombozytopenische Purpura.
Erkrankungen des Immunsystems
Anaphylaxie, allergische Reaktionen einschliesslich anaphylaktoider Reaktionen und Reaktionen ähnlich der Serumkrankheit.
Erkrankungen des Nervensystems
Enzephalitis, Enzephalopathie, Neuropathie, Lähmungen, Krampfanfälle, Neuritis, Multiple Sklerose, Myelitis, Facialisparese, Polyneuritis wie Guillain-Barré-Syndrom (mit aufsteigender Lähmung), Optikusneuritis.
Gefässerkrankungen
Vaskulitis.
Erkrankungen der Haut und des Unterhautzellgewebes
Angioneurotisches Ödem, Lichen planus, Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Arthritis, Muskelschwäche.
Untersuchungen
Veränderungen der Leberfunktionsuntersuchungen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sofortige Schmerzen an der Injektionsstelle (unmittelbar nach Impfung), stechendes und brennendes Gefühl.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungWährend der Post-Marketing-Überwachung ist über Fälle von Überdosierung berichtet worden. Die beobachteten unerwünschten Wirkungen waren ähnlich derjenigen, wie sie nach korrekter Anwendung des Impfstoffes gemeldet wurden.
Eigenschaften/WirkungenATC-Code
J07BC20
Wirkungsmechanismus
Twinrix 720/20 ist ein Kombinationsimpfstoff und ist eine sterile Suspension aus inaktivierten Hepatitis A-Viren (HAV, Stamm HM 175) und gentechnologisch gewonnenen Hepatitis B-Oberflächenantigenen (HBsAg), separat adsorbiert auf Aluminiumsalzen.
Twinrix 720/20 entspricht den Anforderungen der WHO zur Herstellung biologischer Substanzen. Hepatitis A-Viren werden in Kulturen humaner diploider MRC-5-Zellen gezüchtet, extrahiert, aufgereinigt und mit Formaldehyd inaktiviert. Rekombinantes Hepatitis B-Oberflächenantigen wird aus Kulturen von Hefezellen (Saccharomyces cerevisiae) gewonnen, welche die genetische Information zur Bildung des Proteins exprimieren. Das Protein wird durch physiko-chemische Verfahren in mehreren Schritten hochgradig aufgereinigt.
Twinrix 720/20 bewirkt eine Immunisierung gegen Hepatitis A- und Hepatitis B-Virus-Infektionen, indem es die Bildung spezifischer Anti-HAV- und Anti-HBs-Antikörper induziert. Die Impfung schützt auch vor einer Hepatitis D, da diese nur in Verbindung mit einer Hepatitis B-Infektion auftritt.
Nach Verabreichung des Impfstoffes baut sich der Schutz gegen Hepatitis A und B innerhalb von 2-4 Wochen auf. Zur Vervollständigung des Impfschutzes gegen Hepatitis A und B und der Erzielung einer Langzeitwirksamkeit müssen unbedingt alle empfohlenen Dosen verabreicht werden.
Pharmakodynamik
Siehe «Wirkungsmechanismus».
Klinische Wirksamkeit
In den klinischen Studien wurden folgende Resultate erzielt:
Hepatitis A: % der Impflinge mit schützenden Antikörpertitern, jeweils 1 Monat nach der Impfung:
|
Gruppe
|
Schema
|
Resultate
| |
Erwachsene
|
|
Monat 1
|
Monat 2
|
Monat 7
| |
0, 1, 6 Monate
|
94,3%
|
99,5%
|
100%
| |
|
Monat 1
|
Monat 2
|
Monat 13
| |
0, 7, 21 Tage, 12 Monate
|
100%
|
99,5%
|
100%
| |
Kinder, Jugendliche
|
|
Monat 1
|
Monat 2
|
Monat 7
| |
0, 6 Monate
|
99,1%
|
99,1%
|
100%
|
Hepatitis B: % der Impflinge mit spezifischen Antikörpertitern, jeweils 1 Monat nach der Impfung (Klammern: % mit Anti-HBs-Titer ≥ 10 I.E./l):
|
Gruppe
|
Schema
|
Resultate
| |
Erwachsene
|
|
Monat 1
|
Monat 2
|
Monat 7
| |
0, 1, 6 Monate
|
70,6%
(33,7%)
|
97,4%
(83,9%)
|
>99%
(>99%)
| |
|
Monat 1
|
Monat 2
|
Monat 13
| |
0, 7, 21 Tage, 12 Monate
|
82%
|
85%
|
100%
| |
Kinder, Jugendliche
|
|
Monat 1
|
Monat 2
|
Monat 7
| |
0, 6 Monate
|
74,2%
(37,4%)
|
85,7%
(43,4%)
|
100%
(98,2%)
|
Im Rahmen von zwei Langzeitstudien bei Erwachsenen im Alter von 17 bis 43 Jahren konnten 15 Jahre nach der Grundimmunisierung mit Twinrix 720/20 Proben von 56 Probanden ausgewertet werden. Die Anti-HAV-Seropositivitätsraten betrugen bei beiden Studien 100% und die Anti-HBs-Seroprotektionsraten 89,3% bzw. 92,9%. Der Abfall der Anti-HAV- und Anti-HBs-Antikörper war vergleichbar mit dem nach Gabe von Einzelimpfstoffen.
Diese Daten wurden mit der früheren Formulierung, die Thiomersal und ein Konservierungsmittel enthielt, erhoben. Eine klinische Studie mit der jetzigen Formulierung in Erwachsenen zeigte, dass mit der neuen Formulierung, verglichen mit der alten, ähnliche Seroprotektions- und Serokonversionsraten erhalten wurden.
In einer klinischen Studie mit über 40-jährigen Probanden wurden die Serokonversionsrate für Anti-HAV-Antikörper und die Seroprotektionsrate gegen Hepatitis B von Twinrix 720/20 nach einem 0-1-6-Monate-Impfschema mit den Serokonversions- und Seroprotektionsraten von monovalenten Hepatitis A- und Hepatitis B-Impfstoffen verglichen, die kontralateral in den Oberarm verabreicht wurden.
Die Seroprotektionsrate gegen Hepatitis B nach Gabe von Twinrix 720/20 betrug 7 und 48 Monate nach der ersten Impfdosis 91,7% bzw. 57,1%. Im Vergleich dazu war sie zu den entsprechenden Zeitpunkten nach Gabe des monovalenten 20 μg Hepatitis B-Impfstoffes von GlaxoSmithKline Biologicals 79,7% bzw. 40,1% und nach Gabe eines anderen zugelassenen monovalenten 10 μg Hepatitis B-Impfstoffes 71,0% bzw. 26,6%. In allen Gruppen nahmen Anti-HBs-Antikörper-Konzentrationen mit zunehmendem Alter und zunehmendem Body-Mass-Index ab und waren bei männlichen Probanden niedriger als bei weiblichen Probanden.
Die Serokonversionsrate für Anti-HAV-Antikörper betrug nach der Gabe von Twinrix 720/20 7 und 48 Monate nach der ersten Dosis jeweils 97,2%, gegenüber 98,9% bzw. 93,9% nach der Gabe des monovalenten Hepatitis A-Impfstoffes von GlaxoSmithKline Biologicals und 98,9% bzw. 96,0% nach Gabe eines anderen zugelassenen monovalenten Hepatitis A-Impfstoffes.
Zur Beurteilung des Immungedächtnisses erhielten die Probanden eine weitere Dosis Twinrix 720/20 48 Monate nach der ersten Dosis zur Grundimmunisierung mit dem gleichen Impfstoff. Einen Monat nach dieser Dosis hatten 95,2% der Geimpften einen Anti-HBV-Antikörpertiter von ≥10 mIE/mL und um 179-fach erhöhte geometrische Mittelkonzentrationen (GMC; GMC = 7'233,7 mIE/mL), die auf ein immunologisches Gedächtnis hinweisen.
PharmakokinetikEine Bewertung von pharmakokinetischen Parametern ist für Impfstoffe nicht erforderlich.
Präklinische DatenPräklinische Daten, die auf generellen Sicherheitsstudien basieren, deuten nicht auf eine besondere Gefährdung des Menschen hin.
Sonstige HinweiseInkompatibilitäten
Twinrix 720/20 sollte nicht mit anderen Impfstoffen in derselben Spritze vermischt werden.
Haltbarkeit
Der Impfstoff darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2°C-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren.
Nicht einfrieren! Einmal gefrorener Impfstoff ist zu verwerfen.
Hinweise für die Handhabung
Der Impfstoff muss vor Gebrauch resuspendiert werden. Der resuspendierte Impfstoff erscheint einheitlich trüb-weiss.
Bei der Lagerung kann sich ein feiner weisser Niederschlag mit klarem, farblosem Überstand bilden.
Resuspendieren des Impfstoffs, um eine einheitlich trüb-weisse Suspension zu erhalten
Zur Resuspension des Impfstoffs sind die nachfolgenden Schritte zu befolgen.
1. Die Spritze aufrecht in der geschlossenen Hand halten.
2. Die Spritze schütteln; dazu wird die Spritze auf den Kopf und wieder zurück gedreht.
3. Diesen Vorgang mindestens 15 Sekunden lang energisch wiederholen.
4. Den Impfstoff erneut auf sein Aussehen prüfen:
a.Wenn der Impfstoff als einheitlich trüb-weisse Suspension erscheint, ist er gebrauchsfertig. Er darf nicht klar aussehen.
b.Sollte der Impfstoff noch immer nicht als einheitlich trüb-weisse Suspension erscheinen, die Spritze noch einmal mindestens 15 Sekunden lang auf den Kopf und zurück drehen. Dann erneut auf Aussehen prüfen.
Vor der Verabreichung ist der Impfstoff optisch auf etwaige Fremdpartikel und/oder physikalische Veränderungen zu untersuchen. Wenn eine derartige Abweichung beobachtet wird, darf der Impfstoff nicht verabreicht werden.
Gebrauchsanweisung für die Fertigspritze
|
|
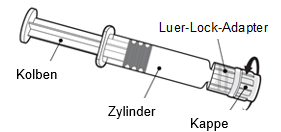
|
Halten Sie die Spritze am Zylinder, nicht am Kolben.
Schrauben Sie die Spritzenkappe ab, indem Sie sie gegen den Uhrzeigersinn drehen.
| |
|
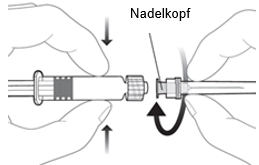
|
Um die Nadel an der Spritze anzubringen, verbinden Sie den Nadelkopf mit dem Luer-Lock-Adapter und drehen Sie die Nadel eine Vierteldrehung im Uhrzeigersinn, bis Sie spüren, dass sie einrastet.
Ziehen Sie den Spritzenkolben nicht aus dem Zylinder heraus. Sollte dies geschehen, verabreichen Sie den Impfstoff nicht.
|
Entsorgung
Nicht verwendeter Impfstoff oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu entsorgen.
Zulassungsnummer00592 (Swissmedic).
PackungenFertigspritzen:
1 Dosis zu 1 mL Suspension in einer gebrauchsfertigen Einmalspritze: 1 und 10 (B).
ZulassungsinhaberinGlaxoSmithKline AG, 6340 Baar
Stand der InformationDezember 2023
|


