ZusammensetzungWirkstoffe
Florbetaben (18F)
Hilfsstoffe
Ascorbinsäure 4.4 mg/mL, Ethanol 118 mg/mL, Macrogol 400 200 mg/mL, Natriumascorbat 28.8 mg/mL (entspricht 3,34 mg Natrium/ml), Wasser für Injektionszwecke 677.5 mg/mL
Spezifikationen
•Nuklide [18F]-Fluor
•Radionuklidreinheit ≥99%
•Radiochemische Reinheit ≥95%
Darreichungsform und Wirkstoffmenge pro EinheitVerwendungsfertiges Radiodiagnostikum zur direkten Anwendung.
Klare, farblose Injektionslösung zur i.v. Injektion.
1 ml Injektionslösung enthält 300 MBq Florbetaben (18F) zum Kalibrierzeitpunkt, der auf der Verpackung angegeben ist. Eine Durchstechflasche enthält zwischen 1 ml und 10 ml Injektionslösung. Die Aktivität je Durchstechflasche liegt zum Kalibrierzeitpunkt zwischen 300 MBq und 3000 MBq.
Indikationen/AnwendungsmöglichkeitenDieses Arzneimittel ist ein Diagnostikum. Neuraceq ist ein radioaktives Arzneimittel für die Positronen-Emissions-Tomographie (PET) zur Darstellung der Dichte neuritischer β-Amyloid-Plaques im Gehirn erwachsener Patienten mit kognitiver Beeinträchtigung, die auf Alzheimer-Krankheit (AK) oder andere Ursachen für kognitive Beeinträchtigungen untersucht werden. Neuraceq sollte in Verbindung mit einer klinischen Untersuchung eingesetzt werden.
Eine negative Aufnahme zeigt wenige bis keine Plaques und spricht gegen eine Alzheimer-Krankheit Diagnose. Zu den Einschränkungen bei der Interpretation einer positiven Aufnahme siehe die Rubriken "Warnhinweise und Vorsichtsmassnahmen" (Einschränkungen der Anwendbarkeit) und "Eigenschaften/Wirkungen" .
Dosierung/AnwendungDie empfohlene Aktivität für einen Erwachsenen beträgt 300 MBq Florbetaben (18F). Die Höchstdosis darf 360 MBq nicht überschreiten und zum Zeitpunkt der Gabe 240 MBq nicht unterschreiten. Das zu injizierende Volumen von Neuraceq kann 0,5 bis 10 ml betragen, um die Zielaktivität von 300 MBq zum Zeitpunkt der i.v. Verabreichung zu erreichen.
Besondere Personengruppen
Ältere Patienten
Eine altersabhängige Dosisanpassung ist nicht erforderlich.
Nieren- und Leberfunktionsstörung
Eine sorgfältige Abwägung der anzuwendenden Aktivität ist erforderlich, da bei diesen Patienten die Möglichkeit einer erhöhten Strahlenexposition besteht, siehe Rubrik "Warnhinweise und Vorsichtsmassnahmen" (Nieren- und Leberfunktionsstörung).
Für dieses Arzneimittel wurden keine ausführlichen Studien zu Dosisbereich und Dosisanpassung bei normalen und besonderen Patientengruppen durchgeführt. Die Pharmakokinetik von Florbetaben (18F) bei Patienten mit Nieren- oder Leberfunktionsstörung wurde nicht untersucht.
Kinder und Jugendliche
Neuraceq findet bei Kindern und Jugendlichen keine Anwendung.
Art der Anwendung
Neuraceq ist zur i.v. Anwendung und zur Anwendung als Mehrfachentnahme bestimmt.
Die Aktivität von Florbetaben (18F) muss unmittelbar vor der Injektion mit einem Aktivimeter (Dosiskalibrator) gemessen werden.
Florbetaben (18F) darf nicht verdünnt werden.
Die Dosis wird intravenös als langsamer Bolus injiziert (6 Sek./ml) gefolgt von einer Spülung mit ungefähr 10 ml isotonischer Natriumchloridlösung für Injektionszwecke, um die vollständige Gabe der Dosis sicherzustellen. Bei einem Injektionsvolumen zwischen 0,5 und 1 ml dürfen nur Spritzen geeigneter Grösse (1 ml) verwendet werden. Die Spritze muss mit Natriumchloridlösung gespült werden (siehe Rubrik "Sonstige Hinweise" (Anweisungen zur Zubereitung von radioaktiven Arzneimitteln).
Die Injektion von Florbetaben (18F) muss streng intravenös erfolgen, um eine Strahlenexposition aufgrund eines lokalen Extravasats sowie Artefakte bei der Bildgebung zu vermeiden.
Bildakquisition
Ungefähr 90 Minuten nach der intravenösen Injektion von Florbetaben (18F) sollte eine 20-minütige PET-Aufnahme beginnen.
Die Patienten sollten dabei auf dem Rücken liegen, wobei der Kopf so positioniert wird, dass das Gehirn und auch das Cerebellum im Bildbereich des PET-Scanners zentriert sind. Zur Verminderung von Kopfbewegungen können Bänder oder andere flexible Gurte verwendet werden. Bei der Rekonstruktion sollte eine Schwächungskorrektur erfolgen, sodass sich eine transaxiale Pixelgrösse zwischen 2,0 und 3,0 mm ergibt.
Strahlenexposition
Die nachstehende Tabelle 1 zeigt die mit der OLINDA (Organ Level INternal Dose Assessment)-Software berechnete Dosimetrie.
Die geschätzten von den Organen absorbierten Strahlendosen sind in Tabelle 1 aufgeführt und beziehen sich auf Daten von gesunden Freiwilligen kaukasischer Abstammung (n = 17). Die Dosimetrieberechnungen wurden auf Erwachsene (mit einem Körpergewicht von 70 kg) umgerechnet.
Tabelle 1: Geschätzte absorbierte Organdosen nach intravenöser Injektion von Neuraceq an Probanden kaukasischer Abstammung
Organ Absorbierte Organdosis je verabreichter Aktivität [mGy/MBq]
Nebennieren 0,0130
Gehirn 0,0125
Mammae 0,0074
Gallenblasenwand 0,137
Gastrointestinaltrakt
Unterer Dickdarm 0,0351
Dünndarm 0,0314
Magen 0,0116
Oberer Dickdarm 0,0382
Herz 0,0139
Nieren 0,0238
Leber 0,0386
Lunge 0,0148
Muskeln 0,00948
Ovarien 0,0156
Pankreas 0,0139
Rotes Knochenmark 0,0122
Osteogene Zellen 0,0148
Haut 0,00689
Milz 0,0102
Hoden 0,00913
Thymus 0,00892
Schilddrüse 0,00842
Blase 0,0695
Uterus 0,0163
Übrige Organe 0,0110
Effektive Dosis (mSv/MBq) 0,0193
Die effektive Dosis nach Gabe der maximal empfohlenen Aktivität von 360 MBq beträgt bei einem Erwachsenen mit einem Gewicht von 70 kg ungefähr 7,0 mSv. Wenn im Rahmen der PET-Aufnahme gleichzeitig ein CT durchgeführt wird, erhöht sich die Strahlenbelastung in Abhängigkeit von den für die CT-Aufnahme gemachten Einstellungen. Bei einer verabreichten Aktivität von 360 MBq beträgt die übliche absorbierte Strahlendosis am Zielorgan (Gehirn) 4,5 mGy.
Bei einer verabreichten Aktivität von 360 MBq beträgt die üblicherweise an kritischen Organen absorbierte Strahlendosis 49,3 mGy an der Gallenblase, 25,0 mGy an der Harnblase, 13,8 mGy an der oberen Dickdarmwand, 12,6 mGy an der unteren Dickdarmwand, 11,3 mGy am Dünndarm und 13,9 mGy an der Leber.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Warnhinweise und VorsichtsmassnahmenIndividuelle Abwägung des Nutzen-/Risiko Verhältnisses
Bei jedem Patienten muss die Strahlenexposition durch den zu erwartenden diagnostischen Nutzen gerechtfertigt sein. Die verabreichte Aktivität sollte in jedem Fall so gering wie möglich gehalten werden, und darf nicht höher bemessen werden, als für den Erhalt der diagnostischen Information erforderlich ist.
Die Lösung enthält 33,4 mg/10 ml (Maximaldosis) Natrium., entsprechend 1,6 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Dieses Arzneimittel enthält maximal 118 mg/ ml Alkohol (Äthanol). Einem Patienten wird maximal 10 ml verabreicht, also max. 1180 mg Alkohol. Die Menge in 10 mL dieses Arzneimittels entspricht 30 ml Bier oder 12 ml Wein. Es ist unwahrscheinlich, dass die Alkoholmenge in diesem Arzneimittel Auswirkungen auf Erwachsene hat. Die Alkoholmenge in diesem Arzneimittel kann die Wirkungen anderer Arzneimittel verändern. Sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin, wenn Sie andere Arzneimittel einnehmen. Wenn Sie schwanger sind oder stillen, sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin, bevor Sie dieses Arzneimittel einnehmen.
Nieren- und Leberfunktionsstörung
Bei diesen Patienten ist eine sorgfältige Abwägung des Nutzen-/Risiko Verhältnisses erforderlich, da die Strahlenexposition erhöht sein kann. Florbetaben (18F) wird primär über das hepatobiliäre System ausgeschieden. Bei Patienten mit eingeschränkter Leberfunktion besteht die Möglichkeit einer erhöhten Strahlenexposition. Siehe Rubrik "Dosierung/Anwendung" (Besondere Personengruppen).
Kinder und Jugendliche
Neuraceq findet bei Kindern und Jugendlichen keine Anwendung.
Interpretation der Neuraceq-Aufnahmen
Neuraceq Aufnahmen sollten nur von für die Interpretation von PET-Aufnahmen mit Florbetaben (18F) geschulten Auswertern beurteilt werden. Eine negative Aufnahme zeigt keine oder eine geringe Dichte kortikaler β-Amyloid-Plaques, eine positive Aufnahme zeigt eine mittlere bis hohe Dichte. Bei der Bestimmung der Dichte von neuritischen β-Amyloid-Plaques im Gehirn wurden Interpretationsfehler, einschliesslich falsch negativer und falsch positiver Befunde, beobachtet.
Die PET-Aufnahmen werden in transaxialer Orientierung mithilfe einer Grau-Skala beurteilt. Der Auswerter vergleicht die Signalintensität der kortikalen grauen Substanz mit der maximalen Signalintensität der weissen Substanz. Die Aufnahmen werden systematisch ausgewertet (Abbildung 1), beginnend auf Höhe des Kleinhirns und weiter nach oben durch den lateralen Temporallappen und den Frontallappen zum Bereich des posterioren cingulären Cortex und des Precuneus und schliesslich zum Parietallappen.
Die Beurteilung der Aufnahmen erfolgt anhand des visuellen Vergleichs der Aktivität in der kortikalen grauen Substanz mit der Aktivität in der angrenzenden kortikalen weissen Substanz. Jede dieser Gehirnregionen (lateraler Temporal- und Frontallappen, posteriorer cingulärer Cortex, Precuneus und Parietallappen) ist systematisch visuell zu begutachten und gemäss dem Score für die regionale kortikale Tracer-Anreicherung (Regional Cortical Tracer Uptake, RCTU) zu bewerten (Tabelle 2).
Tabelle 2: Definitionen der kortikalen Tracer-Anreicherung (Regional Cortical Tracer Uptake, RCTU)
RCTU-Score Bewertungsgrundlage
RCTU-Score Bewertungsgrundlage
1 (Keine Tracer-Anre Die Tracer-Anreicherung (d. h. die Signalintensität) in der grauen Substanz
icherung) ist geringer als in der weissen Substanz.
2 (Mittlere ausgeprä Kleinere(r) Bereich(e) mit einer Tracer-Anreicherung in der grauen Substanz,
gte Tracer-Anreicher die mindestens so gross ist wie in der weissen Substanz; erstreckt sich über
ung) die Grenze zur weissen Substanz hinaus bis zum äusseren kortikalen Rand und
tritt in der Mehrzahl der Schnittbilder der entsprechenden Region auf.
3 (Umfangreiche Grosser zusammenhängender Bereich mit einer Tracer-Anreicherung in der grauen
Tracer-Anreicherung) Substanz, die mindestens so gross ist wie in der weissen Substanz und sich
über die Grenze zur weissen Substanz hinaus bis zum äusseren kortikalen Rand
erstreckt und in der gesamten Region einschliesslich der Mehrzahl der
Schnittbilder der entsprechenden Region auftritt.
Hinweis: Um positiv für eine Tracer-Anreicherung im Cortex bewertet zu werden, muss der Befund in der Mehrzahl der Schnittbilder der fraglichen Region aufgetreten sein.
Abbildung 1: Neuraceq-PET-Fälle mit Beispielen für Aufnahmen eines negativen Florbetaben (18F) PET-Scans, (obere Reihe) und eines positiven Scans, (untere Reihe)
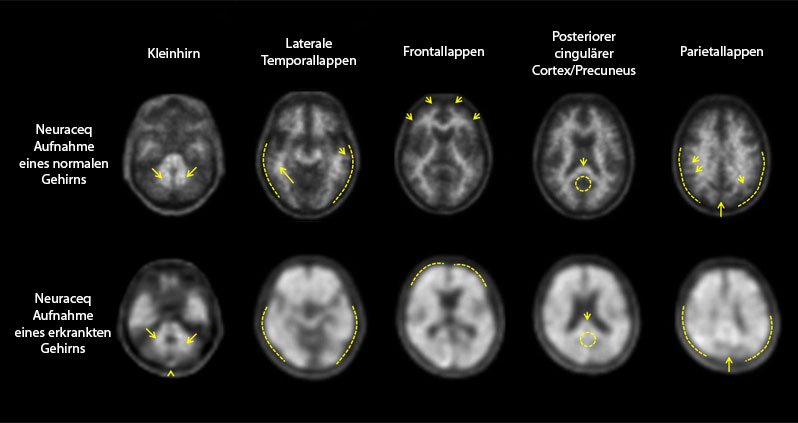
Die Gesamtbewertung der visuellen PET-Scan-Auswertung ist Patienten-basiert und stützt sich auf ein binäres Ergebnis als „positiv“ oder „negativ“. Ein Patient wird gemäss dem Score für die Belastung des Gehirns mit Beta-Amyloid-Plaques (Brain Amyloid Plaque Load, BAPL; Tabelle 3), der sich von den RCTU-Scores der vier Gehirnregionen ableitet (Tabelle 2), als „positiv“ oder „negativ“ eingestuft.
Tabelle 3: Definition der Gehirnbelastung mit Amyloid-Plaques (Brain Amyloid Plaque Load, BAPL)
Bewertung BAPL-Score Bewertungsgrundlage
Negativer Scan 1 Aufnahme ohne RCTU-Score 1 in jeder der vier
Beta-Amyloid-Ablager Gehirnregionen (lateraler
ung Temporallappen, Frontallappen,
posteriorer cingulärer
Cortex/Precuneus, Parietallappen)
Positiver Scan 2 Aufnahme mit mittler RCTU-Score 2 in einer oder allen
en Beta-Amyloid-Abla 4 Gehirnregionen und kein Score
gerungen von 3 in einer dieser 4
Gehirnregionen
3 Aufnahme mit umfangr RCTU-Score 3 in
eichen Beta-Amyloid- mindestens einer
Ablagerungen der 4 Gehirnregionen
Verwendung quantitativer Informationen als Ergänzung zur visuellen Beurteilung
Quantitative Informationen, die von CE-gekennzeichneter Bildquantifizierungssoftware für die Quantifizierung von Amyloid-beta-PET-Scans erzeugt werden, können als Ergänzung zur visuellen Auswertung verwendet werden (Siehe Rubrik "Eigenschaften/Wirkungen" , Abschnitt "Ergänzende Nutzung quantitativer Informationen zur Bildinterpretation" ). Die Benutzer der CE-gekennzeichneten Software sollten vom Hersteller geschult werden und die Quantifizierung gemäss den Anweisungen des Herstellers durchführen, einschliesslich Qualitätskontrollen des quantitativen Prozesses. Die Auswerter sollten den Scan visuell interpretieren und dann das Quantifizierungsergebnis mit typischen Bereichen für negative und positive Scans vergleichen. Wenn die Quantifizierungswerte nicht mit der visuellen Beurteilung übereinstimmen, sollte der Auswerter die folgenden Aspekte überprüfen:
1.Falls zutreffend, sollte die Platzierung der Region of Interest (ROI) in den grauen Substanzbereichen des Gehirns überprüft werden, ohne dabei grössere Anteile der weissen Substanz oder des Liquors einzuschliessen. Der mögliche Einfluss von Atrophie und Ventrikelerweiterung auf die Quantifizierung sollte berücksichtigt werden.
2.Falls zutreffend, sollte die Platzierung der Referenzregion-ROI(s) überprüft werden, um die Passgenauigkeit der Region zu bestätigen. Der mögliche Einfluss struktureller Auffälligkeiten auf die Quantifizierung sollte berücksichtigt werden.
3.Die Grundlage für eine positive oder negative visuelle Beurteilung sollte überprüft werden:
a.Im Fall eines initial visuell als amyloidpositiv interpretierten Befunds bei gleichzeitig negativer Quantifizierung sollte der Auswerter berücksichtigen, ob die positive visuelle Interpretation möglicherweise auf einer Tracer-Anreicherung in Regionen beruht, die von der quantitativen Software nicht erfasst werden. Ein fokaler Uptake kann ebenfalls zu einem negativen Quantifizierungsergebnis führen, wenn die Software eine grössere Region auswertet. Auch eine ausgeprägte Atrophie kann zu einem Signalverlust und damit zu negativen quantitativen Ergebnissen führen.
b.Im Fall eines initial visuell als amyloidnegativ interpretierten Befunds bei gleichzeitig amyloidpositiver Quantifizierung sollte die korrekte Platzierung der ROIs in den Referenzregionen und im Kortex überprüft werden, um festzustellen, ob möglicherweise weisse Substanz einbezogen wurde, was zu erhöhten Quantifizierungswerten führen kann.
Die abschliessende Interpretation der PET-Aufnahme sollte auf der visuellen Beurteilung basieren, nachdem die in den Schritten 1 bis 3 zusammengefassten Überprüfungen durchgeführt wurden.
Einschränkungen der Anwendbarkeit
Die Injektion von Florbetaben (18F) muss streng intravenös erfolgen, um eine Strahlenexposition aufgrund eines lokalen Extravasats sowie Artefakte bei der Bildgebung zu vermeiden.
Eine positive Aufnahme alleine bedeutet keine gesicherte Diagnose Alzheimer-Krankheit oder einer anderen kognitiven Funktionsstörung, da Ablagerungen neuritischer Plaques in der grauen Substanz bei asymptomatischen älteren Patienten und einigen neurodegenerativen Erkrankungen (Alzheimer-Krankheit, Lewy-Körper-Demenz, Parkinson’sche Erkrankung) auftreten können.
Zu Einschränkungen der Anwendbarkeit bei Patienten mit leichter kognitiver Beeinträchtigung (MCI), siehe Rubrik "Eigenschaften / Wirkungen" .
Die Wirksamkeit von Florbetaben (18F) zur Vorhersage der Entwicklung einer Alzheimer-Krankheit oder zur Überwachung eines Therapieansprechens ist nicht erwiesen (siehe Abschnitt 14).
Einige Aufnahmen können aufgrund von Bildrauschen, Atrophie mit einhergehendem dünneren Kortex oder Bildunschärfe schwierig zu interpretieren sein, was zu falschen Ergebnissen bei der Auswertung der Aufnahmen führen kann. In Fällen, in denen Unsicherheit hinsichtlich der Lokalisierung der grauen Substanz und der Abgrenzung der grauen von der weissen Substanz in der PET-Aufnahme besteht und eine Aufnahme einer kürzlich ko-registrierten CT oder MRT vorliegt, soll der Auswerter ein fusioniertes PET-CT- oder PET-MRT-Bild heranziehen, um die räumliche Beziehung der PET-Radioaktivität zur Anatomie der grauen Substanz abzuklären.
In einigen Fällen wurde eine erhöhte Anreicherung in extrazerebralen Strukturen wie Gesicht, Kopfhaut und Knochen festgestellt. Im Sinus sagittalis superior kann manchmal eine Restaktivität beobachtet werden (siehe Rubrik "Pharmakokinetik" ).
Nach der Untersuchung
Enger Kontakt mit Kleinkindern und schwangeren Frauen sollte in den ersten 24 Stunden nach der Injektion vermieden werden
InteraktionenEs wurden keine In-vivo-Studien zur Erfassung von Wechselwirkungen durchgeführt.
In Bindungsassays mit Radioliganden wurde bei Verwendung einer breiten Palette an tierischen und menschlichen Rezeptoren, Ionenkanälen und Transportern keine signifikante Bindung festgestellt.
In-vitro-Studien mit humanen Lebermikrosomen ergaben keine Hinweise auf eine mögliche Hemmung des Cytochrom-P450-Enzymsystems.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Falls beabsichtigt ist, einer Frau im gebärfähigen Alter ein Radiopharmakon zu verabreichen, ist es wichtig festzustellen, ob diese Frau schwanger ist oder nicht. Jede Frau mit ausgebliebener Menstruation muss als schwanger betrachtet werden, bis das Gegenteil bewiesen ist. Bestehen Zweifel hinsichtlich einer möglichen Schwangerschaft (falls eine Regelblutung ausgeblieben ist, falls die Regelblutungen sehr unregelmässig sind usw.), müssen der Patientin alternative Untersuchungsmethoden angeboten werden, bei denen keine ionisierende Strahlung eingesetzt wird (sofern es diese gibt).
Schwangerschaft
Nuklearmedizinische Untersuchungen bei Schwangeren beinhalten auch eine Strahlenexposition des Fötus. Deshalb dürfen während einer Schwangerschaft nur zwingend erforderliche Untersuchungen durchgeführt werden, bei denen der wahrscheinliche Nutzen weit grösser ist als das von Mutter und ungeborenem Kind eingegangene Risiko.
Es wurden keine Studien an Schwangeren durchgeführt. Es wurden keine tierexperimentellen Studien zur Untersuchung in Bezug auf eine Reproduktionstoxizität von Florbetaben (18F) durchgeführt (Rubrik "Präklinische Daten" ).
Stillzeit
Es ist nicht bekannt, ob Florbetaben (18F) in die Muttermilch ausgeschieden wird. Vor der Verabreichung eines Radiopharmakons an eine stillende Mutter sollte geprüft werden, ob eine Verschiebung der Untersuchung auf einen Zeitpunkt nach Beendigung der Stillperiode möglich ist, und ob im Hinblick auf die Ausscheidung von Radioaktivität in die Muttermilch das am besten geeignete Radiopharmakon gewählt wurde. Wenn die Anwendung unerlässlich ist, muss das Stillen 24 Stunden lang unterbrochen und die abgepumpte Milch verworfen werden.
Enger Kontakt mit Kleinkindern sollte in den ersten 24 Stunden nach der Injektion eingeschränkt werden.
Fertilität
Es wurden keine Fertilitätsstudien durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Das Gesamtsicherheitsprofil von Neuraceq beruht auf den Daten von 1295 Verabreichungen von Neuraceq an 1077 Patienten sowie 12 Patienten, die nur das Vehikel erhielten. Wiederholte Dosisgaben in jährlichen Abständen ergaben keine Unterschiede im Sicherheitsprofil nach der ersten, zweiten oder dritten Dosisgabe.
Auflistung der unerwünschten Wirkungen
Die aufgeführten Häufigkeiten sind wie folgt definiert: sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1.000, < 1/100); selten (≥ 1/10.000, < 1/1.000); sehr selten (< 1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Obwohl die Nebenwirkungen in der Realität mit einer geringeren Häufigkeit als der genannten auftreten können, ist eine Einstufung in eine kleinere Häufigkeitsgruppe als „gelegentlich“ (≥ 1/1.000, < 1/100) aufgrund der Datenbankgrösse nicht möglich.
Organklasse Unerwünschte Wirkungen Häufigkeit
Erkrankungen des Gastrointestinaltrakt Diarrhö, Übelkeit Gelegentlich
s
Allgemeine Erkrankungen und , Schmerzen an der Injektionsstelle, Häufig
Beschwerden am Verabreichungsort Erythem an der Applikationsstelle/Inje
ktionsstelle
Schmerzen an der Katheterstelle, Gelegentlich
Gereizte Injektionsstelle,
Beschwerden an der Injektionsstelle,
Hämatom an der Injektionsstelle,
Wärme an der Injektionsstelle,
Reaktion an der Punktionsstelle,
Schmerz an der Gefässpunktionsstelle,
Ermüdung, Wärmegefühl, Fieber.
Leber- und Gallenerkrankungen Leberfunktion anomal Gelegentlich
Untersuchungen Kreatinin im Blut erhöht. Gelegentlich
Ionisierende Strahlen können Krebs
und Erbgutveränderungen verursachen.
Da die effektive Dosis nach
Verabreichung der maximalen
empfohlenen Aktivität von 300 MBq
Florbetaben (18F) ungefähr 5.8 mSv
beträgt, ist das Auftreten dieser
Nebenwirkungen mit geringer
Wahrscheinlichkeit zu erwarten.
Skelettmuskulatur, Bindegewebs- und Gliederbeschwerden, Schmerz in einer Gelegentlich
Knochenerkrankungen Extremität
Erkrankungen des Nervensystems Brennen, Kopfschmerzen, Neuralgie, Gelegentlich
Tremor
Erkrankungen der Haut und des Hyperhidrosis, Ausschlag, toxischer Gelegentlich
Unterhautzellgewebes Hautausschlag
Gefässerkrankungen Hitzegefühl, Hämatom, Hypotonie Gelegentlich
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAufgrund der geringen pro Dosis eingesetzten Substanzmenge sind bei Überdosierung keine pharmakologischen Wirkungen von Florbetaben (18F) zu erwarten. Bei Überdosierung des Radiopharmakons sollte die zu erwartende strahlungsbedingte, effektive Dosis durch Steigerung der Ausscheidung des Radionuklids reduziert werden, wenn möglich durch häufige Entleerung der Blase und des Darms. Es kann hilfreich sein, die strahlungsbedingte, effektive Dosis abzuschätzen.
Eigenschaften/WirkungenATC-Code
V09AX06
Physikalische Eigenschaften
Fluor (18F) zerfällt mit einer Halbwertszeit von etwa 110 Minuten unter Positronenemission mit einer Energie von 634 keV und anschliessender Emission von zwei Annihilierungsphotonen mit einer Energie von 511 keV zu stabilem Sauerstoff (18O).
Wirkungsmechanismus
Florbetaben (18F) bindet an neuritische β-Amyloid-Plaques im Gehirn. In vitro zeigt Florbetaben (18F) eine nanomolare Bindungsaffinität zu synthetischen β-Amyloidfibrillen und zu Homogenat des Gehirns von Patienten mit Alzheimer-Krankheit. Darüber hinaus wurde die Bindung von Florbetaben (18F) an β-Amyloid-Plaques in postmortal entnommenen Gehirnschnitten von Alzheimer-Patienten mittels Autoradiographie nachgewiesen und mittels Immunhistochemie oder Bielschowsky-Färbung bestätigt.
Nicht untersucht wurde die quantitative in-vivo-Korrelation bei Patienten am Lebensende zwischen der Florbetaben(18F)-Anreicherung in der kortikalen grauen Substanz und den Ablagerungen aus bei der Autopsie entnommenen Proben wurde nicht untersucht. Die In-vivo-Bindung von Florbetaben (18F) an andere β-Amyloid-Strukturen oder andere Hirnstrukturen oder Rezeptoren ist derzeit nicht untersucht.
Pharmakodynamik
Bei den geringen chemischen Konzentrationen in Neuraceq hat Florbetaben (18F) keine nachweisbare pharmakodynamische Aktivität.
In abgeschlossenen klinischen Studien wurde die Anreicherung von Florbetaben (18F) in 7 vordefinierten kortikalen Hirnbereichen (frontaler, parietaler, lateraler und medialer temporaler und okzipitaler, Cortex und Ncl. Caudatus, posteriorer cingulärer Cortex/Precuneus sowie anteriorer Gyrus cinguli) und im Kleinhirn unter Verwendung von standardisierten Uptake Values (SUV) quantitativ bestimmt. Die kortikalen SUV-Quotienten (SUV-Ratios [SUVRs], relativ zur Kleinhirnrinde) sind bei Alzheimer-Patienten grösser als bei gesunden Probanden
Klinische Wirksamkeit
Eine pivotale Studie mit 31 Patienten am Lebensende zielte darauf ab, die diagnostische Wirksamkeit von Florbetaben (18F) bei der Bestimmung der kortikalen Dichte neuritischer β-Amyloid-Plaques (keine oder geringe versus mittlere oder hohe) gemäss den CERAD-Kriterien zu bestimmen. Die PET-Ergebnisse wurden mit der maximalen Dichte an neuritischen Plaques verglichen, die bei der Autopsie des Patienten an Schnitten des Gyrus frontalis medius, Gyrus temporalis superior, Gyrus temporalis medius, Lobulus parietalis inferior, Hippocampus und anderen Hirnregionen gemessen wurden. Der kognitive Status der Patienten konnte nicht zuverlässig bestimmt werden. Bei allen 31 Patienten ergab eine verblindete visuelle patientenspezifische PET-Auswertung von 3 verblindeten Auswertern mehrheitlich eine Sensitivität von 100 % (95%-KI: 80,5 - 100 %) und eine Spezifität von 85,7 % (95%-KI: 67,4 - 100 %). In einer Post-hoc-Analyse betrugen die Sensitivität und die Spezifität der visuellen Beurteilungen der patientenspezifischen PET-Auswertungen im Vergleich zur Histopathologie in einer grösseren Population (74 Patienten) mehrheitlich 97,9 % (95%-KI: 93,8 - 100 %) bzw. 88,9 % (95%-KI: 77 - 100 %).
Die Sensitivität und Spezifität der Bestimmung von Beta-Amyloid-Ablagerungen mit Florbetaben (18F) wurde in einer zusätzlichen Studie weiter untersucht. In dieser Studie bewertete eine andere Gruppe von 5 auf elektronischem Wege geschulten, verblindeten Auswertern die Aufnahmen von 54 Patienten aus der pivotalen Studie, die einschliesslich bis zur Autopsie untersucht wurden. Die histopathologischen Kriterien unterschieden sich von den CERAD-Kriterien. Die Ergebnisse waren niedriger als in der pivotalen Studie: die Sensitivität reichte von 77,5 bis 90 % und die Spezifität lag zwischen 62,5 und 85,7 %. Die Übereinstimmung zwischen den Auswertern, beurteilt mit Hilfe der Fleiss‘-Kappa-Werte, reichte von 0,68 bis 0,87. Ein Vergleich der PET-Scans mit den histopathologischen Untersuchungen, die von allen Teilnehmern entnommen wurden (die gleichen Proben, die für die originale pivotale Studie und die Post-hoc-Analyse verwendet wurden), ergab mehrheitlich eine Sensitivität und Spezifität von 100 % (95%-KI: 89,4-100 %) bzw. 71,4 % (95%-KI: 52,1-90,8 %).
In einer Longitudinal-Studie wurde bei 45 Patienten (mit klinischer Diagnose einer leichten kognitiven Beeinträchtigung [mild cognitive impairment, MCI]) zu Beginn eine Florbetaben (18F)-PET-Aufnahme angefertigt. Die Patienten wurden dann 24 Monate beobachtet, um den Zusammenhang zwischen der Florbetaben (18F)-Bildgebung und der Veränderung des diagnostischen Status auszuwerten. 29 (64,4 %) der Patienten mit leichter kognitiver Beeinträchtigung waren bei der PET-Aufnahme Florbetaben (18F) positiv. Bei der Nachuntersuchung nach 24 Monaten wiesen 19 (42,2 %) der Patienten eine klinische Alzheimer-Krankheit auf. Von den 29 Patienten mit leichter kognitiver Beeinträchtigung, bei denen die PET-Aufnahme positiv war, wurde bei 19 (65,5 %) Patienten 24 Monate später die klinische Diagnose einer Alzheimer-Krankheit gestellt, verglichen mit 0 (0 %) der 16 Patienten, bei denen die Aufnahme negativ war. Die Sensitivität des Florbetaben (18F)-Scans beim Nachweis der Progression von einer leichten kognitiven Beeinträchtigung zu einer Alzheimer-Krankheit betrug bei 19 Patienten, die eine Alzheimer-Krankheit ausgebildet hatten, 100 %, die Spezifität bei 26 Patienten ohne Progression lag bei 61,5 % (95%-KI: 42,8-80,2 %) und die positive Likelihood Ratio betrug 2,60 (1,60-4,23). Das Studiendesign erlaubt keine Abschätzung des Risikos für die Progression von einer leichten kognitiven Beeinträchtigung zu einer klinischen Alzheimer-Krankheit.
Ergänzende Nutzung quantitativer Informationen zur Bildinterpretation
Die Zuverlässigkeit der Verwendung quantitativer Informationen als Ergänzung zur visuellen Beurteilung wurde in einer retrospektiven klinischen Studie untersucht. Dabei wurden (i) die diagnostische Performance (d. h. Sensitivität und Spezifität) der quantitativen Auswertung von Florbetaben-PET-Scans im Vergleich zur histopathologischen Bestätigung bei der Detektion von β-Amyloid-Neuritenplaques im Gehirn von Patienten am Lebensende (n = 81) und kognitiv normal gesunden jungen Kontrollpersonen (n = 10) sowie (ii) die Übereinstimmung zwischen der visuellen Mehrheitsbewertung durch fünf unabhängige verblindete Bewerter und der quantitativen Auswertung von Florbetaben-PET-Scans (n = 386) analysiert.
Drei CE-gekennzeichnete Softwarelösungen, die das gesamte Kleinhirn als Referenzregion verwenden, wurden eingesetzt, um die β-Amyloid-Belastung mithilfe standardisierter Uptake-Value-Ratios (Hermes BRASS v.5.1.1, Neurocloud v.1.4) bzw. Centiloids (MIMneuro v.7.1.2) zu bestimmen. Alle Scans wurden einer Qualitätskontrolle unterzogen, um die korrekte Platzierung der ROIs sicherzustellen; Fälle, die die Qualitätskontrolle nicht bestanden, wurden von der Analyse ausgeschlossen (durchschnittlich 2.6 % der mit CE-gekennzeichneter Software analysierten Fälle).
Die durchschnittliche Sensitivität und Spezifität der drei CE-gekennzeichneten Softwarelösungen zur Amyloidquantifizierung betrugen 95.8 ± 1.8 % bzw. 98.1 ± 1.4 %. Die Schwellenwerte für die Amyloidquantifizierung wurden aus Proben mit postmortaler Bestätigung des Amyloidstatus im Gehirn als Referenzstandard (aus einer zentralen klinischen Autopsie-Kohorte) mittels receiver operating characteristics (ROC) Kurvenanalyse abgeleitet. In einem zweiten Datensatz wurden die abgeleiteten Schwellenwerte zur Kategorisierung einer Testkohorte verwendet und die binäre quantitative Auswertung mit der visuellen Beurteilung verglichen. In einem qualitätsgeprüften Datensatz lag die durchschnittliche Übereinstimmung zwischen der visuellen Beurteilung und den CE-gekennzeichneten Softwarelösungen bei 91.2 ± 1.7 % bzw. bei 96.2 ± 1.8 % in einer Untergruppe, in der alle Auswerter die Scans einheitlich beurteilt hatten (d. h. visuelle Beurteilung im Konsens).
Kinder und Jugendliche
Neuraceq findet bei Kindern und Jugendlichen keine Anwendung.
PharmakokinetikDistribution
Nach einer intravenösen Bolus-Injektion wird 10 Minuten nach der Injektion im arteriellen Plasma eine Aktivität von 2-3 % der injizierten Dosis/l erreicht.
Florbetaben (18F) ist in hohem Masse an Plasmaproteine gebunden (> 98,5 %).
Organaufnahme
Die Anreicherung der Aktivität im Gehirn erfolgt rasch und erreicht 10 Minuten nach der Injektion einen Wert von 6 % der injizierten Aktivität.
Gesunde Probanden zeigen eine relativ geringe Anreicherung von Florbetaben (18F) im Cortex. Die höchsten Anreicherungswerte wurden für den Pons und andere Bereiche mit weisser Substanz gemessen. Bei Alzheimer-Patienten zeigen Bereiche in Cortex und Striatum eine signifikant grössere Anreicherung als bei Kontrollprobanden. Bei Alzheimer-Patienten wie auch bei Kontrollprobanden findet sich im Pons und anderen Bereichen mit weisser Substanz eine umfangreiche Anreicherung.
In manchen Fällen wurde auch eine Anreicherung in extrazerebralen Strukturen wie in Gesicht und Kopfhaut festgestellt. Der Grund hierfür ist nicht bekannt, könnte aber auf eine Anreicherung von Florbetaben (18F) oder eines seiner radioaktiven Metabolite oder auf Radioaktivität im Blut zurückzuführen sein.
In manchen Fällen kann als normale Variation im Sinus sagittalis superior eine Restaktivität beobachtet werden, die wahrscheinlich auf die Anwesenheit des Tracers im Blut zurückzuführen ist.
Die biophysikalische Grundlage der Anreicherung von Florbetaben (18F) in der weissen Substanz im Gehirn lebender Menschen ist nicht vollständig bekannt. Es wird vermutet, dass eine unspezifische Bindung des Radiopharmakons an die lipidhaltigen Myelinscheiden zur Anreicherung in der weissen Substanz beitragen könnte.
Metabolismus
Florbetaben (18F) wird mit einer mittleren biologischen Halbwertszeit von ungefähr 1 Stunde aus dem Plasma von Alzheimer-Patienten entfernt. Ungefähr 4 Stunden nach der Injektion konnte keine Aktivität im Blut mehr festgestellt werden.
Auf Grundlage von Untersuchungen in vitro wird Florbetaben (18F) überwiegend von CYP2J2 und CYP4F2 metabolisiert.
Elimination
Bis 12 Stunden nach der Injektion werden bis zu ca. 30 % der injizierten Aktivität mit dem Urin ausgeschieden. Zu späteren Zeitpunkten konnte keine weitere Aktivität im Urin nachgewiesen werden.
Halbwertszeit
Fluor (18F) hat eine physikalische Halbwertszeit von 110 Minuten. Zwölf Stunden nach der Injektion sind 98,93 % der Aktivität zerfallen, und 24 Stunden nach der Injektion sind 99,99 % der Aktivität zerfallen.
Kinetik spezieller Patientengruppen
Patienten mit Nieren- und Leberfunktionsstörung
Die Pharmakokinetik bei Patienten mit Nieren- oder Leberfunktionsstörung wurde nicht untersucht.
Präklinische DatenBasierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei einmaliger und wiederholter Gabe und Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Die potenzielle Toxizität einer wiederholten intravenösen Injektion von Florbetaben über 28 Tage wurde an Ratten und Hunden untersucht, und der gefundene NOAEL betrug mindestens das 20-Fache der maximalen Humandosis.
Es wurden keine Studien mit chronischer Gabe und zum kanzerogenen Potential durchgeführt, da das Arzneimittel nicht zur regelmässigen oder kontinuierlichen Verabreichung vorgesehen ist.
Es wurden keine Studien zur Reproduktionstoxizität durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Siehe Rubrik "Warnhinweise und Vorsichtsmassnahmen" , Abschnitt "Einschränkungen der Anwendbarkeit"
Haltbarkeit
Bis zu 10 Stunden ab dem Zeitpunkt der Herstellung (Ende der Synthese). Das Arzneimittel darf nur bis zu der auf der Packung mit EXP bezeichneten Uhrzeit des Produktionstages verwendet werden.
Besondere Lagerungshinweise
Das Arzneimittel muss bei Raumtemperatur (15 - 25°C) im Originalbehältnis und Bleitopf gelagert werden.
Hinweise für die Handhabung
Anweisungen zur Zubereitung von radioaktiven Arzneimitteln
Zubereitung
Die Packung muss vor der Anwendung überprüft und die Aktivität muss mit einem Aktivimeter (Dosiskalibrator) bestimmt werden. Florbetaben (18F) darf nicht verdünnt werden.
Der Inhalt sollte unter aseptischen Bedingungen entnommen werden. Die Durchstechflaschen dürfen nicht vor der Desinfektion des Stopfens geöffnet werden, und die Lösung muss durch den Stopfen hindurch mittels Einwegspritze mit einer geeigneten Schutzabschirmung und sterilen Einwegnadeln oder mit einem dafür freigegebenen automatischen Anwendungssystem entnommen werden. Das Arzneimittel darf nicht verwendet werden, wenn ihre Unversehrtheit nicht gewährleistet ist.
Qualitätskontrolle
Die Lösung sollte vor der Anwendung visuell überprüft werden. Es dürfen nur klare Lösungen, die frei von sichtbaren Partikeln sind, verwendet werden.
Gesetzliche Bestimmungen
Die Anwendung radioaktiver Stoffe an Menschen ist durch die Strahlenschutzverordnung gesetzlich geregelt. Für den Umgang mit den radioaktiven Stoffen ist eine Bewilligung des Bundesamtes für Gesundheitswesen erforderlich. Beim Umgang mit radioaktiven Stoffen sowie der Beseitigung aller anfallenden radioaktiven Abfälle sind die Schutzvorkehrungen der oben erwähnten Verordnung zu beachten, um jede unnötige Strahlenbelastung von Patienten und Personal zu vermeiden. Die nicht verbrauchten radioaktiven Lösungen und die mit diesen kontaminierten Gegenstände müssen bis zum Abklingen der Aktivität auf die Freigrenze des Radionuklids in einem für diese Zwecke eingerichteten Abklingraum aufbewahrt werden. Die Strahlenschutzverordnung (StSV, SR 814.501) ist zu beachten.
Zulassungsnummer66210 (Swissmedic)
PackungenDas Arzneimittel wird in einer farblosen 15 ml Mehrfachdosis Durchstechflasche aus Glas Typ I bereitgestellt, die mit einem Chlorobutylstopfen und einem Aluminiumsiegel verschlossen ist.
Jede Mehrfachdosis Durchstechflasche enthält 1.0 bis 10 ml Lösung, was zum Kalibrierzeitpunkt 300 bis 3000 MBq entspricht.
Aufgrund von Unterschieden im Herstellungsprozess können einige Durchstechflaschen mit punktiertem Gummistopfen ausgeliefert werden.
Packungsgrösse: eine Durchstechflasche
Abgabekategorie: A
ZulassungsinhaberinSWAN Isotopen AG, Bern
Stand der InformationOktober 2025
|

