ZusammensetzungWirkstoffe
Inaktiviertes Hepatitis-A-Virus (Stamm HM175)*.
*hergestellt in menschlichen diploiden (MRC-5) Zellen
Hilfsstoffe
Havrix 1440
Wasserhaltiges Aluminiumhydroxid zur Adsorption, Aminosäuren (enthält 0,166 mg Phenylalanin), Natriummonohydrogenphosphat, Kaliumdihydrogenphosphat, Natriumchlorid, Kaliumchlorid, Polysorbat 20, Wasser für Injektionszwecke.
Spuren: Neomycinsulfat.
Gesamtnatriumgehalt: maximal 3,6 mg/Dosis.
Gesamtkaliumgehalt: maximal 0,5 mg/Dosis.
Havrix 720
Wasserhaltiges Aluminiumhydroxid zur Adsorption, Aminosäuren (enthält 0.083 mg Phenylalanin), Natriummonohydrogenphosphat, Kaliumdihydrogenphosphat, Natriumchlorid, Kaliumchlorid, Polysorbat 20, Wasser für Injektionszwecke.
Spuren: Neomycinsulfat.
Gesamtnatriumgehalt: maximal 1,7 mg/Dosis.
Gesamtkaliumgehalt: maximal 0,2 mg/Dosis.
Indikationen/AnwendungsmöglichkeitenHavrix wird eingesetzt für die aktive Immunisierung gegen eine Hepatitis A-Virus-Infektion bei exponierten Personen.
1. In Gebieten mit niedriger und mittlerer Hepatitis A-Durchseuchung wird die Impfung mit Havrix besonders für Personen empfohlen, die einem erhöhten Infektionsrisiko ausgesetzt sind oder sein können, wie:
·Reisende in Endemiegebiete wie Afrika, Asien, Mittelmeerländer, Mittlerer Osten, Zentral- und Südamerika (z.B. Touristen, Angehörige von Missionen, Entwicklungshelfer, Angehörige von Hilfscorps, Militärpersonen).
·Personen, die engen Kontakt mit Hepatitis A-Kranken, -Infizierten, möglicherweise Infizierten oder mit kontaminierten Gegenständen haben: Da die Virusausscheidung von Infizierten über einen verlängerten Zeitraum erfolgen kann, sollten Personen, die in engem Kontakt mit infizierten Personen leben, geimpft werden.
·Aus arbeitsmedizinischer Sicht sollten auch Personen geimpft werden, die, beruflich bedingt, in Berührung mit möglicherweise kontaminierten Gegenständen/Materialien kommen, wie z.B. Kanal- und Klärwerksarbeiter u.a.
·Mitarbeiter von Tagespflegestätten, Kliniken, Heimen und pädiatrischen Einrichtungen: Angestellte von Tagespflegestätten sollten geimpft werden, um zu vermeiden, dass sie nach Ansteckung durch infizierte Kinder selbst zur Infektionsquelle werden.
·Personen, die mit der Herstellung und der Verteilung von Lebensmitteln beschäftigt sind: Da HAV-kontaminierte Lebensmittel eine Hauptinfektionsquelle darstellen, sollten Angestellte in Restaurants und Hotels geimpft werden.
·Rauschgiftsüchtige, insbesondere i.v. Drogenabhängige und deren Betreuer.
·Patienten mit erhöhtem Risiko für sexuell übertragbare Erkrankungen, insbesondere Personen mit häufigem Partnerwechsel, Homosexuelle, Patienten mit sexuell übertragbaren Erkrankungen.
·Patienten mit Hämophilie.
·Personen mit chronischen Lebererkrankungen (z.B. chronische Träger der Hepatitis B oder C; Alkoholkranke). Eine Hepatitis A kann bei chronischer Lebererkrankung die Prognose verschlechtern.
·Spezifische Populationsgruppen mit einer bekannten höheren Inzidenz für Hepatitis A (z.B. Personen in Gemeinden mit einer Hepatitis A-Epidemie; Indianer; Eskimos).
2. In Gebieten mit mittlerer bis hoher Hepatitis A-Durchseuchung (z.B. Afrika, Asien, Mittelmeerländer, Mittlerer Osten, Zentral- und Südamerika) kann die Impfung für alle nicht immunen Personen in Betracht gezogen werden.
Dosierung/AnwendungJede Impfdosis besteht aus einer gebrauchsfertigen Suspension. Es muss die gesamte Impfdosis verabreicht werden.
Übliche Dosierung
Für die Grundimmunisierung genügt eine Einmaldosis:
·Erwachsene ab dem 19. Geburtstag:
Einmaldosis Havrix 1440 (1,0 mL Suspension).
·Kinder und Jugendliche ab dem 1. bis zum 19. Geburtstag:
Einmaldosis Havrix 720 (0,5 mL Suspension).
Um eine langdauernde Immunität zu erzielen, wird eine Nachimpfung (Booster) zwischen 6 und 12 Monaten nach der Grundimmunisierung empfohlen. Bei Erwachsenen erfolgt die Auffrischimpfung mit Havrix 1440, bei Kindern und Jugendlichen mit Havrix 720. Es gibt Literaturdaten, welche bei erwachsenen Reisenden eine erfolgreiche Boosterung der Antikörperreaktion auch bis 6 Jahre nach der Grundimmunisierung beschreiben. Es wurde jedoch nicht belegt, dass bei diesem Verabreichungsmodus zwischen den beiden Injektionen ein ausreichender Schutz vor einer Hepatitis A-Infektion besteht. Eine unkontrollierte Untersuchung in einem Endemiegebiet (Alaska) konnte nachweisen, dass die verzögerte Verabreichung der Boosterimpfung bei Kindern < 2 Jahren zu einem signifikant verminderten Anstieg der Antikörperreaktion im Vergleich zur verzögerten Verabreichung der Boosterimpfung bei älteren Personen führte.
Spezielle Dosierungsanweisungen
Ist ein Schutz gegen Hepatitis A unmittelbar erforderlich, z.B. nach einer Exposition, ist die erste Dosis von Havrix gleichzeitig mit Hepatitis A-Immunglobulin zu verabreichen (aktive/passive Immunisierung). Dabei sollten die Injektionen an 2 verschiedenen Stellen vorgenommen werden.
Patienten mit anderen Grunderkrankungen
Hämodialyse oder Störungen des Immunsystems: Mit der Grundimmunisierung werden unter Umständen keine adäquaten Antikörpertiter erreicht. Die Verabreichung weiterer Impfdosen kann in solchen Fällen erforderlich sein.
Thrombozytopenie oder Blutgerinnungsstörungen: Weil intramuskuläre Infektionen mit Nachblutungen verbunden sein können, sollte Havrix in solchen Fällen subkutan verabreicht werden. Eine abgeschwächte Immunantwort ist möglich.
Art der Anwendung
Havrix soll intramuskulär (i.m.) verabreicht werden. Die Injektion sollte bei Kindern und Erwachsenen in den Deltoideus erfolgen, bei Kleinkindern anterolateral am Oberschenkel.
Eine intradermale oder subkutane Verabreichung oder die i.m. Injektion in die Glutealmuskeln sollte unterbleiben, weil diese Applikationen möglicherweise zu einer verminderten Immunantwort führen können.
Der Impfstoff sollte vor Gebrauch visuell auf Niederschläge oder Farbveränderungen kontrolliert werden. Die Fertigspritze ist zu verwerfen, wenn fremde Partikel und/oder Veränderungen physikalischer Eigenschaften festgestellt werden.
Vor der Verabreichung von Havrix ist die Fertigspritze gut zu schütteln, um eine leicht weisslich-trübe Suspension zu erhalten.
KontraindikationenBekannte Überempfindlichkeit gegen Havrix, gegen einen seiner Bestandteile oder bei bereits aufgetretener Überempfindlichkeit nach vorgängiger Anwendung.
Wie bei anderen Impfstoffen soll die Anwendung von Havrix bei Personen mit schwerer fieberhafter Erkrankung zurückgestellt werden.
Leichte Infekte sowie eine HIV-Infektion stellen keine Kontraindikation dar.
Warnhinweise und VorsichtsmassnahmenHavrix darf unter keinen Umständen intravaskulär injiziert werden!
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Impflinge können sich zum Zeitpunkt der Impfung möglicherweise bereits in der Inkubationsphase einer Hepatitis A befinden. In solchen Fällen ist nicht bekannt, ob Havrix die Entwicklung der klinisch manifesten Erkrankung verhindern kann.
Injizierbare Impfstoffe können in seltenen Fällen anaphylaktische Reaktionen auslösen. Deshalb sollten geeignete Behandlungsmöglichkeiten stets gebrauchsfertig verfügbar sein (z.B. Adrenalin-Lösung 1/1000).
Bei Hämodialysepatienten und Personen mit einem defekten Immunsystem kann es sein, dass adäquate Anti-HAV-Antikörpertiter nach einer Einzeldosis ausbleiben. Bei solchen Patienten können zusätzliche Impfdosen notwendig sein.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
Dieses Arzneimittel enthält Kalium, jedoch weniger als 1 mmol (39 mg) Kalium pro Dosis, d.h. es ist nahezu «kaliumfrei».
Havrix 1440 enthält 0,166 mg Phenylalanin pro Dosis. Havrix 720 enthält 0,083 mg Phenylalanin pro Dosis. Phenylalanin kann schädlich sein, wenn der Patient eine Phenylketonurie hat, eine seltene angeborene Erkrankung, bei der sich Phenylalanin anreichert, weil der Körper es nicht ausreichend abbauen kann.
InteraktionenDa es sich bei Havrix um einen inaktivierten Impfstoff handelt, ist es unwahrscheinlich, dass die gleichzeitige Verabreichung mit anderen Impfstoffen zu einer Beeinträchtigung der Immunantwort führt.
Eine gleichzeitige Verabreichung mit Immunglobulinen hat keinen negativen Einfluss auf die Wirksamkeit von Havrix.
Bei gleichzeitiger Anwendung mit anderen Impfstoffen sollen verschiedene Spritzen verwendet und verschiedene Injektionsstellen gewählt werden.
Klinische Erfahrungen über die gleichzeitige Verabreichung von Havrix mit rekombinantem Hepatitis B-Impfstoff (Engerix-B) sind gut. Eine gleichzeitige Impfung gegen Typhus, Gelbfieber, Cholera (injizierbar) oder Tetanus beeinflusst die Immunantwort auf Havrix nicht.
Schwangerschaft, StillzeitEs wurden weder Reproduktionsstudien am Tier noch klinische Studien bei schwangeren oder stillenden Frauen durchgeführt. Wie bei allen inaktivierten Virusimpfstoffen sind die Risiken für den Foetus als vernachlässigbar anzusehen.
Schwangerschaft
Schwangere Frauen sollten nur dann mit Havrix geimpft werden, wenn eine eindeutige Indikation dafür besteht.
Stillzeit
Während der Stillzeit sollte zurückhaltend geimpft werden, obschon die Risiken als vernachlässigbar gelten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs liegen keine Untersuchungen zur Fahrtüchtigkeit und zum Bedienen von Maschinen nach Verabreichung von Havrix vor (siehe «Unerwünschte Wirkungen»).
Unerwünschte WirkungenDas Sicherheitsprofil basiert auf Daten von mehr als 5'300 Personen.
Häufigkeiten werden wie folgt angegeben:
«Sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1'000, <1/100), «selten» (≥1/10'000, <1/1'000), «sehr selten» (<1/10'000).
Klinische Studien
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektionen des oberen Respirationstraktes, Rhinitis.
Stoffwechsel- und Ernährungsstörungen
Häufig: Appetitverlust.
Psychiatrische Erkrankungen
Sehr häufig: Reizbarkeit (Havrix 1440: --; Havrix 720: 18,9%).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (Havrix 1440: 11,2%; Havrix 720: 5,2%).
Häufig: Benommenheit.
Gelegentlich: Schwindel.
Selten: Hypoästhesie, Parästhesie.
Erkrankungen des Gastrointestinaltrakts
Häufig: gastrointestinale Symptome wie Diarrhöe, Übelkeit und Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Hautausschlag.
Selten: Pruritus.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Myalgie, den Bewegungsapparat betreffende Steifheit.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerz (Havrix 1440: 51,9%; Havrix 720: 18,2%) und Rötung an der Injektionsstelle (Havrix 1440: 15,7%; Havrix 720: 14,9%), Müdigkeit (Havrix 1440: 11,6%).
Häufig: Schwellung, Unwohlsein, Fieber (> 37,5°C), Reaktion an der Injektionsstelle wie Verhärtung.
Gelegentlich: Grippe-ähnliche Erkrankung.
Selten: Schüttelfrost.
Unerwünschte Wirkungen aus der Postmarketingphase
Erkrankungen des Immunsystems
Anaphylaxie, allergische Reaktionen, einschliesslich anaphylaktoider Reaktionen und Reaktionen ähnlich der Serumkrankheit.
Erkrankungen des Nervensystems
Konvulsionen.
Wie bei anderen Impfstoffen zu beobachten ist, können sehr selten entzündliche Reaktionen des peripheren oder zentralen Nervensystems auftreten, einschliesslich aufsteigender Lähmungen, wie z.B. Guillain-Barré-Syndrom.
Gefässerkrankungen
Vaskulitis.
Erkrankungen der Haut und des Unterhautgewebes
Angioneurotisches Oedem, Urtikaria, Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Arthralgie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungÜber Fälle von Überdosierung während der Marktüberwachung nach Einführung ist berichtet worden. Die beobachteten unerwünschten Wirkungen waren ähnlich denjenigen, die nach korrekter Anwendung beobachtet wurden.
Eigenschaften/WirkungenATC-Code
J07BC02
Wirkungsmechanismus, Pharmakodynamik
Havrix ist ein Impfstoff gegen die Hepatitis A. Er besteht aus einer sterilen Suspension von Formaldehyd-inaktiviertem Hepatitis A-Virus (Stamm HM 175), adsorbiert an Aluminiumhydroxid.
Die Viren werden in Kulturen humaner diploider Zellen (MRC-5) gezüchtet. Um Bestandteile des Kulturmediums zu entfernen, werden die Zellen vor der Extraktion der Viren umfassend gewaschen. Anschliessend werden die Zellen lysiert und die Viren mit Ultrafiltrationstechniken und Gelchromatographie aufgereinigt. Die Inaktivierung der Viren wird durch Behandlung mit Formalin sichergestellt.
Der Gehalt an viralem Antigen wird mit einem ELISA-Test (Enzyme-Linked Immuno Sorbent Assay) bestimmt.
Havrix erfüllt die WHO-Bestimmungen für die Herstellung biologischer Produkte.
Havrix verleiht eine Immunität gegen Hepatitis A-Virus (HAV)-Infektionen, indem es die Produktion von spezifischen Anti-HAV-Antikörpern bewirkt.
Klinische Wirksamkeit
In klinischen Studien waren 99% der Impflinge 30 Tage nach der 1. Dosis seropositiv. In einer Untergruppe von klinischen Studien, wo die Kinetik der Immunantwort studiert wurde, konnte eine frühe und rasche Serokonversion nach Anwendung einer Einzeldosis Havrix gezeigt werden: in 79% der Impflinge am 13., in 86,3% am 15., in 95,2% am 17. und in 100% am 19. Tag. (Die Inkubationszeit der Hepatitis A beträgt 15 – 49 Tage.)
In einer in Alaska durchgeführten Studie wurden ungefähr 5'000 Personen mit 1 Dosis Havrix dem Alter entsprechend geimpft, um eine Hepatitis A-Epidemie zu stoppen. 92% der getesteten Impflinge entwickelten messbare Anti-HAV-Antworten.
Havrix konnte auch bei verschiedenen anderen Hepatitis A-Epidemien (in der Slowakei, USA, Grossbritannien, Israel und Italien) erfolgreich eingesetzt werden. Eine Durchimpfung von 80% der Bevölkerung führte innerhalb von 4 – 8 Wochen zu einem Ende des Hepatitis A-Ausbruchs.
In klinischen Studien waren einen Monat nach der Auffrischimpfung alle Impflinge seropositiv.
Um eine langdauernde Immunität zu erzielen, wird eine Auffrischdosis zu irgendeinem Zeitpunkt zwischen 6 und 12 Monaten nach der Grundimmunisierung empfohlen. Bei Erwachsenen erfolgt die Auffrischimpfung mit Havrix 1440, bei Kindern und Jugendlichen mit Havrix 720. Es gibt Literaturdaten, welche bei erwachsenen Reisenden eine erfolgreiche Boosterung der Antikörperreaktion auch bis 6 Jahre nach der Grundimmunisierung beschreiben. Es wurde jedoch nicht belegt, dass bei diesem Verabreichungsmodus zwischen den beiden Injektionen ein ausreichender Schutz vor einer Hepatitis A-Infektion besteht. Eine unkontrollierte Untersuchung in einem Endemiegebiet (Alaska) konnte nachweisen, dass die verzögerte Verabreichung der Boosterimpfung bei Kindern < 2 Jahren zu einem signifikant verminderten Anstieg der Antikörperreaktion im Vergleich zur verzögerten Verabreichung der Boosterimpfung bei älteren Personen führte.
Durch Extrapolation der vorhandenen Daten lässt sich voraussagen, dass Antikörper während mindestens 20 Jahren persistieren.
Das Langzeit-Vorkommen von Hepatitis A-Antikörpertitern nach 2 Dosen Havrix ist in zwei Studien geprüft worden. Die 10-Jahres-Daten erlauben die Voraussage, dass wenigstens 97% aller Personen 25 Jahre nach der Impfung seropositiv bleiben (Titer von > 20 mIU/mL).
Aufgrund der verfügbaren Daten ist es bis jetzt noch nicht abschliessend geklärt, ob bei immunkompetenten Personen, die eine korrekt durchgeführte Grundimmunisierung mit 2 Dosen Havrix erhalten haben, eine Boosterimpfung (3. Dosis) vorgenommen werden muss.
PharmakokinetikEine Beurteilung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Präklinische DatenEntsprechende Tests wurden durchgeführt.
Primaten wurden zwei Tage nach einer Hepatitis A-Virusexposition geimpft. Bei diesen Tieren führte diese nachträgliche Impfung zu einer vollständigen Schutzwirkung.
Sonstige HinweiseInkompatibilitäten
Havrix darf nicht mit anderen Impfstoffen oder Immunglobulinen gemischt werden.
Hinweise
Havrix schützt nicht vor Hepatitiden, die durch andere Erreger als HAV hervorgerufen werden, wie z.B. durch Hepatitis B-Virus, Hepatitis C-Virus, Hepatitis E-Virus und andere.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren.
Nicht einfrieren. Gefrorener Impfstoff ist zu verwerfen.
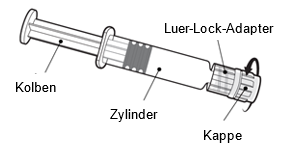
Gebrauchsanweisung für die Fertigspritze
|
|
|
Halten Sie die Spritze am Zylinder, nicht am Kolben.
Schrauben Sie die Spritzenkappe ab, indem Sie sie gegen den Uhrzeigersinn drehen.
| |
|
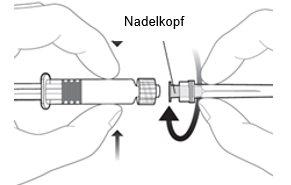
|
Um die Nadel an der Spritze anzubringen, verbinden Sie den Nadelkopf mit dem Luer-Lock-Adapter und drehen Sie die Nadel eine Vierteldrehung im Uhrzeigersinn, bis Sie spüren, dass sie einrastet.
Ziehen Sie den Spritzenkolben nicht aus dem Zylinder heraus. Sollte dies geschehen, verabreichen Sie den Impfstoff nicht.
|
Entsorgung
Nicht verwendetes Arzneimittel oder Abfallmaterial sollten gemäss den nationalen Anforderungen entsorgt werden.
ZulassungsnummerHavrix 1440: 00558 (Swissmedic)
Havrix 720: 00599 (Swissmedic)
PackungenHavrix 1440: 1 Fertigspritze zu 1 Dosis à 1 mL (B)
Havrix 720: 1 Fertigspritze zu 1 Dosis à 0,5 mL (B)
ZulassungsinhaberinGlaxoSmithKline AG, 6340 Baar
Stand der InformationApril 2023
|


