ZusammensetzungWirkstoffe
Diphtherie-Toxoid; Tetanus-Toxoid; Pertussis-Toxoid (PT); filamentöses Hämagglutinin (FHA) von Bordetella pertussis; Pertactin (PRN) von Bordetella pertussis; Hepatitis B-Oberflächenantigen (HBsAg); inaktiviertes Poliovirus Typ 1 (Mahoney-Stamm); inaktiviertes Poliovirus Typ 2 (MEF-1-Stamm); inaktiviertes Poliovirus Typ 3 (Saukett-Stamm); gereinigtes Kapselpolysaccharid von Haemophilus influenzae Typ b (konjugiert).
Hilfsstoffe
In der DTPa-HBV-IPV-Komponente: Aluminiumhydroxid, Aluminiumphosphat, Natriumchlorid corresp. Natrium 1,8 mg, Medium 199, Wasser für Injektionszwecke q.s. ad 0,5 mL.
In der Hib-Komponente: Laktose, Aluminiumphosphat.
Rückstände
Neomycinsulfat, Polymyxin B-Sulfat, Polysorbat 20 und 80, Formaldehyd.
Indikationen/AnwendungsmöglichkeitenInfanrix hexa (DTPa-HBV-IPV+Hib) ist zur Grundimmunisierung und Auffrischimpfung gegen Diphtherie, Tetanus, Pertussis, Hepatitis B, Poliomyelitis und Haemophilus influenzae Typ b bei Säuglingen und Kleinkindern ab dem Alter von 6 Wochen indiziert.
Infanrix hexa ist nicht vorgesehen für die Anwendung bei Kindern, die mehr als 36 Monate alt sind.
Infanrix hexa sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/AnwendungÜbliche Dosierung
Reguläre Grundimmunisierung
Sie besteht aus drei Impfungen im Abstand von 2 Monaten:
1. Dosis im Alter von 2 Monaten.
2. Dosis im Alter von 4 Monaten.
3. Dosis im Alter von 6 Monaten.
Alternativ kann die Grundimmunisierung mit 3 Dosen auch im Abstand von mindestens einem Monat zwischen den Dosen gemäss den offiziellen Empfehlungen verabreicht werden.
Zusätzlich liegen Daten ab einem Alter von 8 Wochen mit einem Grundimmunisierungsschema von zwei Impfdosen im Abstand von mindestens 2 Monaten vor (siehe «Eigenschaften/Wirkungen» für Impfschemata, die in klinischen Studien untersucht wurden).
Die Impfung mit Infanrix hexa (DTPa-HBV-IPV+Hib) gemäss dem EPI-Schema (Expanded Program on Immunisation; Impfung im Alter von 6, 10 und 14 Wochen) sollte nur vorgenommen werden, wenn der Impfling eine Hepatitis B-Impfung bei Geburt erhalten hat.
Wurde zum Zeitpunkt der Geburt eine Dosis Hepatitis B-Impfstoff verabreicht, kann Infanrix hexa (DTPa-HBV-IPV+Hib) als Ersatz für zusätzliche Dosen des Hepatitis B-Impfstoffes ab dem Alter von 6 Wochen gegeben werden. Falls eine zweite Impfung gegen Hepatitis B vor diesem Zeitpunkt nötig ist, sollte ein monovalenter Hepatitis B-Impfstoff benutzt werden. Infanrix hexa (DTPa-HBV-IPV+Hib) kann auch für ein gemischtes Immunisierungsschema mit dem kombinierten pentavalenten Impfstoff gegen Diphtherie, Tetanus, azelluläre Pertussis, inaktivierte Poliomyelitis und Haemophilus influenzae Typ b (DTPa-IPV+Hib) von GSK gemäss den offiziellen Empfehlungen verwendet werden.
Austauschbarkeit
Infanrix hexa (DTPa-HBV-IPV+Hib) kann durch die Verabreichung des pentavalenten DTPa-IPV+Hib-Impfstoffs von GSK ersetzt werden, der gleichzeitig mit dem Hepatitis B-Impfstoff von GSK verabreicht wird.
Auffrischimpfung
Nach einer Grundimmunisierungsserie mit Infanrix hexa sollte eine Auffrischimpfung entsprechend den offiziellen Empfehlungen verabreicht werden.
Infanrix hexa (DTPa-HBV-IPV+Hib) kann als Auffrischimpfung gegeben werden, wenn das Kind eine vollständige Grundimmunisierung mit jedem der im Impfstoff enthaltenen Antigene erhalten hat, unabhängig davon, ob diese mit monovalenten oder Kombinationsimpfstoffen durchgeführt wurden.
Infanrix hexa kann als Auffrischimpfung bei Kindern verwendet werden, die zuvor mit einem anderen hexavalenten Impfstoff geimpft wurden, der zum Zeitpunkt der Auffrischimpfung lokal nicht verfügbar ist, oder die mit einem pentavalenten DTPa-IPV+Hib-Impfstoff in Kombination mit einem monovalenten Hepatitis B-Impfstoff geimpft wurden.
Andere Antigenkombinationen wurden in klinischen Studien nach Grundimmunisierung mit Infanrix hexa (DTPa-HBV-IPV+Hib) untersucht und können zur Auffrischimpfung verwendet werden: DTPa, DTPa-IPV+Hib, DTPa-HBV-IPV.
Art der Anwendung
Infanrix hexa (DTPa-HBV-IPV+Hib) ist tief intramuskulär zu injizieren. Empfohlene Injektionsorte sind der anterolaterale Bereich des Oberschenkels (bevorzugte Stelle bei Säuglingen im Alter unter einem Jahr) oder der Deltamuskel am Oberarm.
KontraindikationenInfanrix hexa (DTPa-HBV-IPV+Hib) darf bei Kindern mit einer bekannten Überempfindlichkeit auf eine Komponente des Impfstoffes (inkl. Neomycin und Polymyxin) oder bei Kindern, die nach einer früheren Anwendung von Diphtherie-, Tetanus-, Pertussis-, Hepatitis B-, Polio- oder Hib-Impfstoffen Zeichen einer Überempfindlichkeit zeigten, nicht angewendet werden.
Infanrix hexa (DTPa-HBV-IPV+Hib) ist kontraindiziert, wenn das Kind innerhalb von 7 Tagen nach einer früheren Pertussis-Impfung an einer Enzephalopathie unbekannter Genese gelitten hat. Unter diesen Umständen sollte eine Impfung gegen Pertussis ausgesetzt und die Immunisierung mit Diphtherie/Tetanus-, Hepatitis B-, inaktivierten Polio- und Hib-Impfstoffen fortgesetzt werden.
Wie bei anderen Impfstoffen sind Personen mit akuten, schweren, mit Fieber einhergehenden Erkrankungen auch von einer Impfung mit Infanrix hexa zurückzustellen. Eine leichte Infektion stellt keine Kontraindikation dar.
Warnhinweise und VorsichtsmassnahmenInfanrix hexa (DTPa-HBV-IPV+Hib) darf unter keinen Umständen intravasal oder intradermal gegeben werden!
Gemäss üblicher 'guter Impfpraxis' soll der Impfung eine Überprüfung der Krankengeschichte (vorwiegend bezüglich früherer Impfungen und möglicher Nebenwirkungen) und allenfalls eine klinische Untersuchung vorangehen.
Wie bei allen injizierbaren Impfstoffen sollte für den seltenen Fall einer anaphylaktischen Reaktion nach der Impfung immer eine angemessene medizinische Behandlung zur Verfügung stehen und eine Beaufsichtigung des Impflings sichergestellt sein.
Infanrix hexa (DTPa-HBV-IPV+Hib) sollte bei Kindern mit Thrombozytopenie oder einer Blutgerinnungsstörung mit Vorsicht angewendet werden, da bei diesen Kindern nach einer intramuskulären Injektion eine Blutung auftreten kann.
Bei untenstehenden Erscheinungen, die in zeitlichem Bezug zu einer Gabe eines Impfstoffs mit Pertussis-Komponenten stehen, sollte die Verabreichung von weiteren Pertussis-Komponenten enthaltenden Dosen sorgfältig erwogen werden:
·Temperaturerhöhung auf ≥40,0°C innerhalb von 48 Stunden nach der Impfung ohne andere erkennbare Ursache;
·Kollaps oder schockähnlicher Zustand (hypotonisch-hyporesponsive Episode) innerhalb von 48 Stunden nach der Impfung;
·untröstliches Weinen, das mehr als 3 Stunden anhält und innerhalb von 48 Stunden nach der Impfung eintritt;
·Konvulsionen mit oder ohne Fieber, die innerhalb von 3 Tagen nach der Impfung auftreten.
Unter gewissen Umständen, z.B. hoher Keuchhusten-Inzidenz, können die potentiellen Vorteile der Impfung die möglichen Risiken überwiegen.
Wenn bei einem Säugling oder Kind eine ernsthafte neurologische Erkrankung zum ersten Mal auftritt oder eine progrediente schwerwiegende neurologische Erkrankung vorliegt, sollte – wie bei jeder Impfung – Nutzen und Risiko einer Immunisierung mit Infanrix hexa gegenüber einem Aufschub dieser Impfung sorgfältig abgewogen werden.
Eine schützende Immunantwort kann nicht in allen Geimpften erhalten werden.
Infanrix hexa verhindert keine Erkrankung, die durch andere pathogene Keime als Corynebacterium diphtheriae, Clostridium tetani, Bordetella pertussis, Hepatitis B-Virus, Poliovirus oder Haemophilus influenzae Typ b verursacht werden. Es kann jedoch davon ausgegangen werden, dass durch eine Immunisierung eine Hepatitis D verhindert werden kann, weil sie nicht ohne eine Hepatitis B-Infektion auftritt.
Vorherige Fieberkrämpfe beim Impfling sowie aus der Familienanamnese bekanntgewordene Krampfanfälle oder plötzlicher Kindstod (SIDS) stellen keine Kontraindikationen dar für eine Impfung mit Infanrix hexa. Fieberkrämpfe in der Anamnese des Impflings bedürfen besonderer Aufmerksamkeit, da solche unerwünschten Wirkungen innerhalb von 2 – 3 Tagen nach der Impfung auftreten können.
Bei Kleinkindern, die Infanrix hexa und Prevenar erhielten, wurde im Vergleich zu Kleinkindern, die den Sechsfachimpfstoff allein bekamen, über eine hohe Inzidenz von Fieber (> 39,5°C) berichtet.
Bei gleichzeitiger Verabreichung von Infanrix hexa und Prevenar 13 wurden erhöhte Melderaten von Konvulsionen (mit und ohne Fieber) und hypotonisch-hyporesponsiven Episoden (HHE) beobachtet (siehe «Unerwünschte Wirkungen»).
Eine antipyretische Behandlung kann gemäss den lokalen Therapierichtlinien eingeleitet werden, wobei berücksichtigt werden sollte, dass die antipyretische Therapie zur Abschwächung der Impfreaktion auf einzelne Impfstoffkomponenten beider Impfstoffe führen kann. Vorzugsweise sollte eine zeitlich getrennte Verabreichung von Infanrix hexa und Prevenar 13 durchgeführt werden.
Es kann als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Besondere Populationen
Eine HIV-Infektion stellt keine Kontraindikation zur Infanrix hexa (DTPa-HBV-IPV+Hib)-Impfung dar. Die erwünschte Immunreaktion kann bei immunsupprimierten Patienten nach der Impfung ausbleiben.
Klinische Daten zeigen, dass Infanrix hexa bei Frühgeborenen angewendet werden kann, wobei erwartungsgemäss in dieser Population eine tiefere Immunantwort für bestimmte Antigene beobachtet wurde. Eine Verminderung der klinischen Schutzwirkung z.B. bezüglich Hepatitis B kann nicht ausgeschlossen werden (siehe «Unerwünschte Wirkungen» und «Eigenschaften/Wirkungen»). Das im Schweizerischen Impfplan aufgeführte beschleunigte Impfschema für Frühgeborene vor der 33. Schwangerschaftswoche mit einem Geburtsgewicht < 1500 Gramm wurde in den Studien mit Infanrix hexa in dieser Population nicht untersucht.
Das potentielle Risiko von Apnoen und die Notwendigkeit einer Überwachung der Atmung über 48 – 72 Stunden sollte im Rahmen der Grundimmunisierung von sehr unreifen Frühgeborenen (geboren vor der vollendeten 28. Schwangerschaftswoche) in Betracht gezogen werden. Dies gilt insbesondere für diejenigen, die in der Vorgeschichte Zeichen einer Lungenunreife gezeigt haben. Da der Nutzen der Impfung für diese Säuglingsgruppe hoch ist, sollte sie ihnen weder vorenthalten noch verschoben werden.
Bei Frühgeborenen wurde mit Infanrix hexa ausschliesslich die reguläre Grundimmunisierung mit 3 Dosen untersucht.
Beeinflussung von Labortests
Weil das Hib-Kapselpolysaccharid im Urin ausgeschieden wird, kann 1 – 2 Wochen nach der Impfung ein positiver Urintest beobachtet werden. Weitere Prüfungen sollten durchgeführt werden, damit eine Hib-Infektion während dieser Periode bestätigt werden kann.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Impfdosis, d.h. es ist nahezu «natriumfrei».
InteraktionenEs liegen ungenügende Daten über die gleichzeitige Verabreichung von Infanrix hexa (DTPa-HBV-IPV+Hib) und eines Masern-Mumps-Rubella-Impfstoffes bezüglich Sicherheit und Wirksamkeit vor, um eine Empfehlung geben zu können.
Daten zur gleichzeitigen Verabreichung von Infanrix hexa (DTPa-HBV-IPV+Hib) mit dem konjugierten Pneumokokkenimpfstoff (Prevenar) geben bei Grundimmunisierung mit 3 Impfdosen keine Hinweise auf eine klinisch signifikante Interferenz der Antikörperantwort auf die einzelnen Antigene. Nach gleichzeitiger Gabe von Infanrix hexa und Prevenar wurde jedoch über eine hohe Inzidenz von Fieber (> 39,5°C) berichtet im Vergleich zu Kleinkindern, die den Sechsfachimpfstoff allein bekamen (siehe «Warnhinweise und Vorsichtsmassnahmen» für eine Anleitung zu Prevenar und Prevenar 13). Vorzugsweise sollte eine zeitlich getrennte Verabreichung von Infanrix hexa und Prevenar 13 durchgeführt werden.
In der Studie DTPa-HBV-IPV-111 erhielten 68 Probanden Infanrix hexa als Boosterdosis (4. Dosis nach Grundimmunisierung mit dem 3-4-5 Monate Schema) zusammen mit dem konjugierten Pneumokokkenimpfstoff (Prevenar). Es zeigte sich ein leicht abschwächender Effekt von Prevenar auf die anti-HBs-Antikörper ≥100 mIU/mL Responder (88,2% versus 94,2%) sowie auf die absolute Höhe der mittleren geometrischen Antikörperkonzentrationen (GMC, 4709,0 mIU/mL versus 11255,7 mIU/mL).
Wie bei anderen Impfstoffen kann bei Patienten unter immunsuppressiver Behandlung eine adäquate Immunantwort ausbleiben.
Die Behandlung mit Antipyretika wie z.B. mit Paracetamol kann zu einer Abschwächung der Impfreaktion auf einzelne Komponenten von Infanrix hexa als auch von anderen gleichzeitig verabreichten Impfstoffen wie z.B. Pneumokokkenimpfstoffen führen.
Schwangerschaft, StillzeitDa Infanrix hexa (DTPa-HBV-IPV+Hib) nicht zur Anwendung bei Erwachsenen vorgesehen ist, stehen keine ausreichenden Humandaten über eine Anwendung während der Schwangerschaft und Stillzeit und keine adäquaten Reproduktionsstudien bei Tieren zur Verfügung.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenKlinische Studien
Das folgende Nebenwirkungsprofil basiert auf Daten von mehr als 16'000 Kindern.
Wie bei anderen DTPa-Impfstoffen und DTPa-haltigen Impfstoff-Kombinationen wurde nach der Boosterimpfung mit Infanrix hexa eine im Vergleich zur Grundimmunisierung erhöhte lokale Reaktogenität und Fieber festgestellt. Eine ödematöse Schwellung, die gelegentlich zu einer Zunahme des Umfangs der Extremität führte, in die der Impfstoff injiziert worden war, wurde in klinischen Studien nach einer Boosterdosis Infanrix hexa mit einer Häufigkeit von 2,3% beobachtet. Alle diese Reaktionen klangen ohne Folge ab.
Klinische Studien zur Ko-Administration
In klinischen Studien, in welchen einige der Impflinge Infanrix hexa gleichzeitig mit Prevenar als Boosterdosis (4. Dosis) erhielten, trat Fieber ≥38°C bei 43,4% aller Fälle auf, wenn beide Impfstoffe gleichzeitig verabreicht wurden. Bei der alleinigen Impfung mit Infanrix hexa war dies bei 30,5% der verabreichten Impfungen der Fall. Fieber > 39,5°C wurde bei 2,6% der Impflinge bei gleichzeitiger Verabreichung von Infanrix hexa und Prevenar und bei 1,5% der Impflinge bei alleiniger Verabreichung von Infanrix hexa beobachtet.
Die Inzidenz von Fieber nach Ko-Administration dieser beiden Impfstoffe bei der Grundimmunisierung war tiefer als bei der Verabreichung der Boosterdosis.
Zusammenfassende Auflistung der unerwünschten Wirkungen aus klinischen Prüfungen
Häufigkeiten pro Dosis werden wie folgt angegeben: Sehr häufig: ≥1/10; häufig: ≥1/100 bis < 1/10; gelegentlich: ≥1/1'000 bis < 1/100; selten: ≥1/10'000 bis < 1/1'000; sehr selten: < 1/10'000.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektionen der oberen Atemwege.
Erkrankungen des Immunsystems
Häufig: Virale Infektionen, Candida-Infektionen, Otitis media.
Gelegentlich: Infektionen.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Appetitverlust (17,8%).
Psychiatrische Erkrankungen
Sehr häufig: Reizbarkeit (37,4%), ungewöhnliches Weinen (12,3%), Unruhe (19,7% nach Grundimmunisierung, 19,0% nach Boosterung).
Häufig: Erregbarkeit.
Gelegentlich: Schlaflosigkeit.
Erkrankungen des Nervensystems
Sehr häufig: Somnolenz (31%).
Sehr selten: Krampfanfälle (mit oder ohne Fieber)***; Bewusstseinstrübungen oder -verlust; Kollaps oder schockähnlicher Zustand (hypotone-hyporesponsive Episode).
Augenerkrankungen
Häufig: Konjunktivitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Infektionen der oberen Atemwege, Bronchitis, Husten*, Schnupfen, Pharyngitis.
Gelegentlich: Bronchospasmus, Laryngitis, Stridor.
Sehr selten: Unregelmässige Atmung, Apnoe.
Erkrankungen des Gastrointestinaltrakts
Häufig: Durchfall, Enteritis, Gastroenteritis, Erbrechen.
Gelegentlich: Bauchschmerzen, Verstopfung.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautausschlag, Dermatitis, Pruritus.
Gelegentlich: Ekzeme.
Sehr selten: Urtikaria.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gesamter Körper:
Sehr häufig: Fieber ≥38°C (23,5%), ungewöhnliches Weinen (12,3%), Unruhe (19,5%).
Häufig: Fieber > 39,5°C.
Gelegentlich: Müdigkeit.
Sehr selten: Allergische Reaktionen (einschliesslich Hautausschlag und Pruritus), anaphylaktische Reaktionen (einschliesslich Urtikaria).
An der Impfstelle:
Sehr häufig: Schmerzen (25,9%), Rötung (35,2%), Schwellung (25,9%), lokale Schwellung an der Injektionsstelle (≤50 mm) [nach Grundimmunisierung: 23,8%, Grad 3 (> 20 mm) 3,1%; nach Boosterung: 34,1%, Grad 3: 7,8%].
Häufig: Lokale Schwellung an der Injektionsstelle (> 50 mm)**, Induration an der Injektionsstelle.
Gelegentlich: Diffuse Schwellung der von der Injektion betroffenen Gliedmasse, teils mit Involvierung des Nachbarglieds.
Sehr selten: Schwellung der gesamten Gliedmasse um die Injektionsstelle.
Unerwünschte Wirkungen aus der Postmarketingphase
Erkrankungen des Blutes und des Lymphsystems
Lymphknoten-Schwellung, Thrombozytopenie.
Erkrankungen des Immunsystems
Allergische Reaktionen (einschliesslich Hautausschlag und Pruritus), anaphylaktische Reaktionen, anaphylaktoide Reaktionen (einschliesslich Urtikaria und Angioödeme*).
Erkrankungen des Nervensystems
Krampfanfälle (mit oder ohne Fieber); Bewusstseinstrübungen oder -verlust; Kollaps oder schockähnlicher Zustand (hypotone-hyporesponsive Episode)***.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Unregelmässige Atmung, Apnoe (bei sehr unreifen Frühgeborenen siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Haut und des Unterhautgewebes
Angioneurotisches Ödem*.
An der Impfstelle:
** Induration an der Injektionsstelle, Schwellung der gesamten Gliedmasse um die Injektionsstelle. Kinder, die mit azellulären Pertussis-Impfstoffen grundimmunisiert wurden, haben ein grösseres Risiko, Schwellungsreaktionen nach einer Auffrischdosis zu erfahren, als Kinder, die mit einem Ganzzell-Pertussis-Impfstoff grundimmunisiert wurden. Diese Reaktionen verschwanden gewöhnlich innert 4 Tagen wieder.
* Beobachtet mit anderen DTPa-Impfstoffen von GlaxoSmithKline.
** Siehe unter «Unerwünschte Wirkungen aus der Postmarketingphase», letzter Paragraf.
*** Beim Vergleich von Gruppen, die über die Anwendung von Infanrix hexa mit Prevenar 13 berichteten, mit Gruppen, die die Anwendung von Infanrix hexa allein meldeten, deutet die Auswertung der Melderaten nach Markteinführung auf ein potenziell erhöhtes Risiko von Konvulsionen (mit und ohne Fieber) und HHE hin. Vorzugsweise sollte eine zeitlich getrennte Verabreichung von Infanrix hexa und Prevenar 13 durchgeführt werden.
Verträglichkeit bei Frühgeborenen
Die Sicherheit von Infanrix hexa wurde in drei Studien an ca. 300 Frühgeborenen (geboren Ende der 24. bis Ende der 36. Schwangerschaftswoche) bzw. Geburten mit niedrigem Geburtsgewicht nach einer Grundimmunisierung mit 3 Dosen, verabreicht im Alter von 2, 4 und 6 Monaten, im Vergleich zu Normalgeburten untersucht. Die Sicherheit einer Auffrischimpfung im Alter von 18 bis 24 Monaten wurde an ca. 200 Frühgeborenen bzw. Geburten mit niedrigem Geburtsgewicht untersucht. Die lokale und systemische Reaktogenität von Infanrix hexa war bei den Frühgeborenen bzw. Geburten mit niedrigem Geburtsgewicht ähnlich wie bei den Normalgeburten. Vor allem bei den Frühgeborenen vor der 28. Woche wurde von den Prüfärzten direkt nach der Impfung mit Infanrix hexa über als kausal bedingt beurteilte Fälle von Apnoe, Hypoxie und Bradykardie berichtet. Es gab insgesamt einen Fall von SIDS bei den mit Infanrix hexa geimpften Frühgeborenen. Bei der Impfung von Frühgeborenen vor der 33. Woche bzw. mit einem Geburtsgewicht <1500 g müssen die speziellen Anweisungen im Schweizerischen Impfplan beachtet werden.
Sicherheit bei Säuglingen und Kleinkindern von Müttern, die während der Schwangerschaft mit dTpa geimpft wurden
In klinischen Studien wurde Infanrix hexa bei mehr als 500 Kindern verabreicht, die von Müttern geboren wurden, die während der Schwangerschaft mit dTpa oder Placebo geimpft wurden. Das Sicherheitsprofil von Infanrix hexa war vergleichbar, unabhängig davon, ob eine Exposition gegenüber dTpa während der Schwangerschaft stattgefunden hat oder nicht.
Erfahrung mit dem Hepatitis B-Impfstoff
In der Post-Marketing-Phase wurde über Meningitis, allergische Reaktionen, die Serumkrankheit vortäuschen können, Paralyse, Enzephalitis, Enzephalopathie, Neuropathie, Neuritis, Hypotension, Vaskulitis, Lichen Planus, Erythema multiforme, Arthritis, Muskelschwäche, Guillain-Barré Syndrom und Thrombozytopenien nach Impfung mit dem Hepatitis B-Impfstoff von GlaxoSmithKline (Engerix-B) bei Kindern berichtet. Ein ursächlicher Zusammenhang mit dem Impfstoff konnte nicht festgestellt werden.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungFälle von Überdosierung sind nicht bekannt.
Eigenschaften/WirkungenATC-Code
J07CA09 (kombinierter Bakterien- und Virenimpfstoff).
Die Diphtherie- und Tetanus-Toxoide werden durch Formaldehyd-Behandlung von gereinigten Corynebacterium diphtheriae- und Clostridium tetani-Toxinen gewonnen. Die azellulären Pertussis-Impfstoffkomponenten werden aus Bordetella pertussis-Kulturen der Phase I extrahiert und gereinigt, gefolgt von irreversibler Detoxifizierung des Pertussis-Toxins durch Glutaraldehyd- und Formaldehyd-Behandlung und einer Formaldehyd-Behandlung des FHA und PRN. Das HBsAg wird aus Kulturen von Hefezellen (Saccharomyces cerevisiae) gewonnen, die die genetische Information zur Bildung des Proteins exprimieren. Das Oberflächenantigen wird in einer Reihe von physikalisch-chemischen Schritten gereinigt. Diphtherie- und Tetanus-Toxoide, die azellulären Pertussis- sowie die Hepatitis B-Komponenten werden an Aluminiumsalze adsorbiert.
Die drei Polioviren werden auf einer kontinuierlichen VERO-Zelllinie kultiviert, gereinigt und mit Formaldehyd inaktiviert.
Die DTPa-HBV-IPV-Komponenten werden in einer Kochsalzlösung suspendiert.
Das Hib-Polysaccharid wird aus Haemophilus influenzae Typ b, Stamm 20'752, gewonnen und - nach Aktivierung mit Cyanbromid und Derivatisierung mit einem Fetthydrazid-Spacer - durch Carbodiimid-Kondensation an Tetanus-Toxoid gebunden. Nach einer Reinigung wird das Konjugat an Aluminiumsalze adsorbiert und mit Laktose als Stabilisator lyophilisiert.
Infanrix hexa (DTPa-HBV-IPV+Hib) erfüllt die WHO-Bestimmungen für die Herstellung von biologischen Produkten, von Diphtherie-, Tetanus-, Pertussis- und Kombinationsimpfstoffen, von mittels rekombinanten DNA-Verfahren hergestellten Hepatitis B-Impfstoffen, von inaktivierten Poliomyelitis-Impfstoffen und von Hib-Konjugat-Impfstoffen.
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Immunogenität
Serologische Impfschutzkorrelate wurden für Diphtherie, Tetanus, Polio, Hepatitis B und Hib bestimmt. Für Pertussis existiert kein serologisches Impfschutzkorrelat.
Die Immunogenität von Infanrix hexa wurde in klinischen Studien bei Kindern ab einem Alter von 6 Wochen inkl. Verwendung von Infanrix hexa als aktive Kontrollgruppe zu anderen hexavalenten Impfstoffen untersucht. Der Impfstoff wurde im Rahmen eines 2-Dosen- und 3-Dosen-Grundimmunisierungsschemas, einschliesslich des Impfschemas des Expanded Program on Immunisation der WHO, sowie als Auffrischimpfung untersucht. Die Ergebnisse dieser Studien sind in den Tabellen unten zusammengefasst.
Nach einer Grundimmunisierung mit 3 Dosen hatten mindestens 95,7% der Kinder seroprotektive oder seropositive Antikörperspiegel gegen jedes der Impfstoff-Antigene entwickelt. Nach der Auffrischimpfung (nach der 4. Dosis) entwickelten mindestens 98,4% der Kinder seroprotektive oder seropositive Antikörperspiegel gegen jedes der Impfstoff-Antigene.
Anteil der Kinder mit Antikörpertitern oberhalb des cut-off-Wertes einen Monat nach einer Grundimmunisierung mit 3 Dosen und nach einer Auffrischimpfung mit Infanrix hexa:
|
Antikörper
(cut-off-Wert)
|
Nach der 3. Dosis
|
Nach der 4. Dosis
(Auffrischimpfung im 2. Lebensjahr nach einer Grundimmunisierung mit 3 Dosen)
| |
2-3-4 Monate
N=196
(2 Studien)
|
2-4-6 Monate
N=1693
(6 Studien)
|
3-4-5 Monate
N=1055
(6 Studien)
|
6-10-14 Wochen
N=265
(1 Studie)
|
N=2009
(12 Studien)
| |
%
|
%
|
%
|
%
|
%
| |
Anti-Diphtherie
(0,1 IU/mL)#
|
100
|
99,8
|
99,7
|
99,2
|
99,9
| |
Anti-Tetanus
(0,1 IU/mL) #
|
100
|
100
|
100
|
99,6
|
99,9
| |
Anti-PT
(5 EL.U/mL)
|
100
|
100
|
99,8
|
99,6
|
99,9
| |
Anti-FHA
(5 EL.U/mL)
|
100
|
100
|
100
|
100
|
99,9
| |
Anti-PRN
(5 EL.U/mL)
|
100
|
100
|
99,7
|
98,9
|
99,5
| |
Anti-HBs
(10 mIU/mL) #
|
99,5
|
98,9
|
98,0
|
98,5*
|
98,4
| |
Anti-HBs
(100 mIU/mL)
|
84,1
|
92,2
|
85,3
|
79,3
|
84,8
| |
Anti-Polio Typ 1
(1/8 Verdünnung) #
|
100
|
99,9
|
99,7
|
99,6
|
99,9
| |
Anti-Polio Typ 2
(1/8 Verdünnung) #
|
97,8
|
99,3
|
98,9
|
95,7
|
99,9
| |
Anti-Polio Typ 3
(1/8 Verdünnung) #
|
100
|
99,7
|
99,7
|
99,6
|
99,9
| |
Anti-PRP (Hib)
(0,15 µg/mL) #
|
96,4
|
96,6
|
96,8
|
97,4
|
99,7
|
N = Anzahl der Kinder
* In einer Subgruppe von Kindern, die bei der Geburt keinen Hepatitis B-Impfstoff erhalten hatten, hatten 77,7% der Kinder Anti-HBs-Titer ≥ 10 mIE/mL.
# Allgemein anerkannter cut-off-Wert, der auf eine Schutzwirkung hinweist.
Nach einer kompletten Impfserie mit Infanrix hexa mit 2 Dosen zur Grundimmunisierung und einer Auffrischimpfung entwickelten mindestens 97,9% der Kinder seroprotektive oder seropositive Antikörperspiegel gegen jedes der Impfstoff-Antigene.
Anteil der Kinder mit Antikörpertitern oberhalb des cut-off-Wertes einen Monat nach einer Grundimmunisierung mit 2 Dosen und einen Monat nach einer Auffrischimpfung mit Infanrix hexa:
|
|
Nach der 2. Dosis
|
Nach der 3. Dosis
| |
Antikörper
(cut-off-Wert)
|
2-4-12 Monate
N=223
(1 Studie)
|
2-4-12 Monate
N=592
(Kontrollgruppe in publizierter Studie)
|
3-5-11 Monate
N=530
(4 Studien)
|
2-4-12 Monate
N=196
(1 Studie)
|
2-4-12 Monate
N=580
(Kontrollgruppe in publizierter Studie)
|
3-5-11 Monate
N=532
(3 Studien)
| |
%
|
%
|
%
|
%
|
%
|
%
| |
Anti-Diphtherie
(0,01 IU/mL) (0,1 IU/mL)#
|
NA
99,6#
|
99,47^
39,86
|
NA
98,0#
|
NA
100#
|
99,83^
71,63
|
NA
100#
| |
Anti-Tetanus
(0,1 IU/mL)§
|
100
|
97,50
|
100
|
100
|
94,97
|
100
| |
Anti-PT
(5 EL.U/mL)
|
100
|
98,95
|
99,5
|
99,5
|
99,64
|
100
| |
Anti-FHA
(5 EL.U/mL)
|
100
|
96,54
|
99,7
|
100
|
99,12
|
100
| |
Anti-PRN
(5 EL.U/mL)
|
99,6
|
91,58
|
99,0
|
100
|
98,25
|
99,2
| |
Anti-HBs
(10 mIU/mL)§
|
99,5
|
96,35
|
96,8
|
99,8
|
98,72
|
98,9
| |
Anti-HBs
(100 mIU/mL)
|
95,8
|
80,55
|
85,3
|
99,0
|
95,14
|
97,7
| |
Anti-Polio Typ 1
(1/8 Verdünnung)§
|
89,6
|
96,39
|
99,4
|
98,4
|
99,83
|
99,8
| |
Anti-Polio Typ 2
(1/8 Verdünnung)§
|
85,6
|
97,42
|
96,3
|
98,4
|
100
|
99,4
| |
Anti-Polio Typ 3
(1/8 Verdünnung)§
|
92,8
|
95,16
|
98,8
|
97,9
|
99,65
|
99,2
| |
Anti-PRP (Hib)
(0,15 µg/mL) §
|
84,3‡
|
77,87‡
|
91,7‡
|
100*
|
99,37
|
99,6*
|
N = Anzahl der Kinder
# ELISA mit seroprotektivem cut-off-Wert von 0,1 IU/mL.
^ Mikrometabolischer Inhibitionstest mit seroprotektivem cut-off-Wert von 0,01 IU/mL.
§ Allgemein anerkannter cut-off-Wert, der auf eine Schutzwirkung hinweist.
‡ Vor der Auffrischimpfung hatten 63,1% der Kinder in einer Studie (N=196), 48,08% der Kinder in einer anderen Studie (N=600) mit einem 2-4-12-Monate-Impfschema und 86,3% der Kinder (N=524) mit einem 3-5-11 Monate-Impfschema eine Anti-PRP-Konzentration ≥0,15 µg/mL).
* Nach der Auffrischimpfung hatten 94,4% der Kinder mit einer Impfung im Alter von 2, 4, 12 Monaten bzw. 97,0% der Kinder mit einer Impfung im Alter von 3, 5, 11 Monaten eine Anti-PRP-Konzentration ≥1 µg/mL, was einen Langzeitschutz anzeigt.
Da die Immunantwort auf die Pertussis-Antigene nach Verabreichung von Infanrix hexa und Infanrix DTPa gleich ist, wird erwartet, dass die klinische Schutzwirkung der beiden Impfstoffe gegen Pertussis gleich ist.
Schutzwirkung gegen Pertussis
Den klinischen Schutz der Pertussis-Komponente von Infanrix DTPa gegen eine typische den WHO-Kriterien entsprechende Pertussiserkrankung (≥21 Tage anfallsartiger Husten) nach einer Grundimmunisierung mit 3 Dosen zeigten folgende Studien:
|
Studie
|
Land
|
Impfschema
|
Wirksamkeit des Impfstoffes
|
Hinweise
| |
Prospektive verblindete Haushaltskontaktstudie
|
Deutschland
|
3,4,5 Monate
|
88,7%
|
Basierend auf Daten über Sekundärkontakte, die in Haushalten mit einem typischen Pertussisfall erhoben wurden.
| |
Wirksamkeitsstudie, gesponsert vom NIH (National Institute of Health, USA)
|
Italien
|
2,4,6 Monate
|
84%
|
In einer Folgeuntersuchung der gleichen Kohorte wurde die Wirksamkeit bis zu 60 Monate nach Beendigung der Grundimmunisierung ohne eine Boosterimpfung gegen Pertussis bestätigt.
|
Ergebnisse einer Langzeit-Studie in Schweden zeigen, dass azelluläre Pertussis-Impfstoffe bei Säuglingen wirksam sind, die die Grundimmunisierung mit 3 und 5 Monaten und eine Auffrischimpfung im Alter von ca. 12 Monaten erhalten haben. Allerdings deuten die Daten darauf hin, dass die Schutzwirkung gegen Pertussis im Alter von 7 bis 8 Jahren bei diesem Impfschema (3-5-12 Monate) möglicherweise abnimmt. Dies lässt bei Kindern im Alter von 5 bis 7 Jahren, die vorher nach diesem Impfschema (3-5-12 Monate) geimpft wurden, eine 2. Auffrischimpfung gerechtfertigt erscheinen.
Immunogenität bei Säuglingen und Kleinkindern von Müttern, die während der Schwangerschaft mit dTpa geimpft wurden
Die Immunogenität von Infanrix hexa bei Säuglingen und Kleinkindern von gesunden Müttern, die in der 27. bis 36. Schwangerschaftswoche mit dTpa geimpft wurden, wurde in zwei klinischen Studien untersucht.
Infanrix hexa wurde den Säuglingen gleichzeitig mit einem 13-valenten Pneumokokken-Konjugat-Impfstoff entweder im Rahmen eines 3-Dosen-Grundimmunisierungsschemas im Alter von 2, 4 und 6 Monaten oder 2, 3 und 4 Monaten (n=241) oder im Rahmen eines 2-Dosen-Grundimmunisierungsschemas im Alter von 3 und 5 Monaten oder 2 und 4 Monaten (n=27) verabreicht. Dieselben Säuglinge bzw. Kleinkinder erhielten Infanrix hexa im Alter von 11 bis 18 Monaten als Auffrischimpfung (n=229).
Nach der Grundimmunisierung und nach der Auffrischimpfung zeigten immunologische Daten keine klinisch relevante Beeinträchtigung der Immunantworten von Säuglingen und Kleinkindern auf die Diphtherie-, Tetanus-, Hepatitis B-, inaktivierten Poliovirus-, Haemophilus influenzae Typ b- oder Pneumokokken-Antigene durch die mütterliche Impfung mit dTpa.
Es wurden niedrigere Antikörperkonzentrationen gegen Pertussis-Antigene nach der Grundimmunisierung (PT, FHA und PRN) und nach der Auffrischimpfung (PT, FHA) bei Säuglingen und Kleinkindern von Müttern, die während der Schwangerschaft mit dTpa geimpft wurden, beobachtet. Die Steigerung der Anti-Pertussis-Antikörperkonzentrationen vom Zeitpunkt vor der Auffrischimpfung bis 1 Monat nach der Auffrischimpfung lag bei Säuglingen und Kleinkindern sowohl von Müttern, die mit dTpa geimpft wurden, als auch von Müttern, die mit Placebo geimpft wurden, im gleichen Bereich. Dies zeigt ein wirksames Priming des Immunsystems. In Ermangelung von Korrelaten für den Schutz gegen Pertussis muss die klinische Relevanz dieser Beobachtungen noch vollständig verstanden werden. Aktuelle epidemiologische Daten zur Erkrankung mit Pertussis nach der Durchführung maternaler Immunisierung mit dTpa lassen jedoch keine klinische Relevanz dieser immunologischen Beeinträchtigung erkennen.
Immunogenität bei Frühgeborenen
Die Immunogenität von Infanrix hexa wurde in drei Studien an ca. 300 Frühgeborenen (geboren Ende der 24. bis Ende der 36. Schwangerschaftswoche) bzw. Geburten mit niedrigem Geburtsgewicht nach einer Grundimmunisierung mit 3 Dosen, verabreicht im Alter von 2, 4 und 6 Monaten, untersucht. Die Immunogenität einer Auffrischimpfung im Alter von 18 bis 24 Monaten wurde an ca. 200 Frühgeborenen bzw. Geburten mit niedrigem Geburtsgewicht untersucht.
Einen Monat nach der Grundimmunisierung waren mindestens 98,7% der Probanden serologisch gegen Diphtherie, Tetanus und die Polioviren Typ 1 und 2 geschützt; mindestens 90,9% wiesen seroprotektive Antikörpertiter gegen PRP- und Poliovirus Typ 3-Antigene auf; alle Probanden waren seropositiv für Antikörper gegen FHA und PRN, und 94,9% wiesen eine Seropositivität für Anti-PT-Antikörper auf.
Einen Monat nach der Auffrischimpfung wiesen mindestens 98,2% der Probanden seroprotektive oder seropositive Antikörpertiter gegen die einzelnen Antigene auf, ausgenommen gegen PT (mindestens 96,8%) und Hepatitis B.
Die beiden Studien DTPa-HBV-IPV-070 und DTPa-HBV-IPV-090 untersuchten den Einfluss von Infanrix hexa bei der Grundimmunisierung von Frühgeborenen unter Anwendung eines 3-Dosen-Impfschemas im Alter von 2, 4 und 6 Monaten im Vergleich zu normalgeborenen Säuglingen bzw. von Neugeborenen mit niedrigem bzw. mit hohem Geburtsgewicht. In den nachfolgenden Studien DTPa-HBV-IPV-083 BST:070 und DTPa-HBV-IPV-103 BST:090 wurde die erste Booster-Impfung mit Infanrix hexa (= 4. Dosis) untersucht. Bezüglich Hepatitis B Impfschutz lag auch nach der Booster Dosis eine unvollständige Schutzwirkung bei den anti-HBs ≥100 mIU/mL Respondern vor (im Jahr 2016 angenommener Schutzwert für Hepatitis B Impfstoffe). Dies macht möglicherweise zu späteren Zeitpunkten die Verabreichung von zusätzlichen monovalenten Hepatitis B Impfungen erforderlich. Die folgende Tabelle zeigt die gefundenen Ergebnisse bezüglich anti-HBs Respondern ≥10 mIU/mL, anti-HBs Respondern ≥100 mIU/mL und mittleren geometrischen Antikörperkonzentrationen (GMC).
|
Studie
|
Gruppe
|
Zeitpunkt
|
N
|
% ≥10 mIU/mL
(95% KI)
|
% ≥100 mIU/mL
(95% KI)
|
GMC
(95% KI)
| |
DTPa-HBV-IPV-070
DTPa-HBV-IPV-083 BST:070
|
Frühgeborene
|
PreVacc
|
92
|
10,9
(5,3-19,1)
|
2,2
(0,3-7,6)
|
6,6
(5,5-8,0)
| |
PD3
|
91
|
93,4
(86,2-97,5)
|
87,9
(79,4-93,8)
|
634,1
(433,8-927,0)
| |
PreBST
|
84
|
75,0
(64,4-83,8)
|
41,7
(31,0-52,9)
|
56,8
(39,6-81,4)
| |
PostBST
|
83
|
91,6
(83,4-96,5)
|
90,4
(81,9-95,7)
|
1771,0
(1060,3-2958,1)
| |
Normalgeborene Säuglinge
|
PreVacc
|
87
|
9,2
(4,1-17,3)
|
5,7
(1,9-12,9)
|
7,2
(5,5-9,4)
| |
PD3
|
84
|
95,2
(88,3-98,7)
|
86,9
(77,8-93,3)
|
867,1
(576,6-1303,9)
| |
PreBST
|
67
|
80,6
(69,1-89,2)
|
38,8
(27,1-51,5)
|
58,1
(39,1-86,3)
| |
PostBST
|
68
|
98,5
(92,1-100)
|
88,2
(78,1-94,8)
|
1965,0
(1180,1-3272,0)
| |
DTPa-HBV-IPV-090
DTPa-HBV-IPV-103 BST:090
|
Neugeborene mit niedrigem Geburtsgewicht
|
PreVacc
|
78
|
6,4
(2,1-14,3)
|
1,3
(0,0-6,9)
|
5,7
(5,1-6,4)
| |
PD3
|
79
|
93,7
(85,8-97,9)
|
83,5
(73,5-90,9)
|
444,1
(303,6-649,4)
| |
PreBST
|
59
|
61,0
(47,4-73,5)
|
18,6
(9,7-30,9)
|
23,5
(15,7-35,3)
| |
PostBST
|
62
|
88,7
(78,1-95,3)
|
85,5
(74,2-93,1)
|
1026,5
(536,6-1963,8)
| |
Neugeborene mit hohem Geburtsgewicht
|
PreVacc
|
82
|
8,5
(3,5-16,8)
|
0,0
(0,0-4,4)
|
5,6
(5,1-6,2)
| |
PD3
|
79
|
94,9
(87,5-98,6)
|
83,5
(73,5-90,9)
|
576,4
(382,3-869,0)
| |
PreBST
|
56
|
69,6
(55,9-81,2)
|
28,6
(17,3-42,2)
|
32,7
(21,6-49,4)
| |
PostBST
|
57
|
96,5
(87,9-99,6)
|
86,0
(74,2-93,7)
|
1785,6
(1027,0-3104,5)
|
PreVacc: Antikörpertiter vor Impfung
PD3: Post-Dose 3 (einen Monat nach Grundimmunisierung mit 3 Dosen Infanrix hexa)
PreBST: PreBooster (kurz vor der Auffrischimpfung mit Infanrix hexa im zweiten Lebensjahr)
PostBST: PostBooster (einen Monat nach der Auffrischimpfung mit Infanrix hexa)
In einer Folgestudie ca. 2,5 bis 3 Jahre nach der Auffrischimpfung waren mindestens 95,7% der Kinder noch immer gegen die drei Poliovirus-Typen und PRP geschützt.
Persistenz der Immunantwort
In 5 Studien wurde die Persistenz der Hepatitis B Immunantwort nach der Grundimmunisierung mit Infanrix hexa sowie der Effekt eines monovalenten Boosters mit einem Hepatitis B-Impfstoff (Engerix-B) einige Jahre später untersucht. Die folgende Tabelle zeigt die beobachteten anti-HBs-Antikörper mit dem cut-off Wert ≥10 mIE/mL und ≥100 mIE/mL in Abhängigkeit vom verwendeten Grundimmunisierungsschema mit Infanrix hexa inkl. dem ersten Booster mit Infanrix hexa im 2. Lebensjahr bis zur Verabreichung von Engerix-B. In Fällen mit hoher endemischer oder individueller Hepatitis B Exposition bietet ein anti-HBs-Antikörper ≥100 mIU/mL Schwellenwert einen zuverlässigeren Schutz vor Hepatitis B Infektionen im Vergleich zu niedrigeren anti-HBs-Antikörper Schwellenwerten.
Persistenz der Immunantwort und Antwort auf eine Dosis eines Hepatitis B-Impfstoffs nach Grundimmunisierung und Auffrischimpfung mit Infanrix hexa:
|
|
|
|
Persistenz
|
Antwort auf Hepatitis B-Impfstoff
| |
Studie
|
Impfschema
|
Zeit seit der letzten Dosis Infanrix hexa
|
≥10 mIE/mL
|
≥100 mIE/mL
|
≥10 mIE/mL
|
≥100 mIE/mL
| |
%
(95%-KI)
|
%
(95%-KI)
|
%
(95%-KI)
|
%
(95%-KI)
| |
112
(N=286)
|
3 Dosen vor dem Alter von 9 Monaten und Booster zwischen 11 und 18 Monaten
|
Ca. auf 3 Jahre geschätzt
|
85,3
(80,6-89,2)
|
47,0
(41,1-53,0)
|
98,6
(96,5-99,6)
|
95,8
(92,8-97,8)
| |
111
(N=188)
|
2-4-6 Monate und Booster zwischen 12 und 23 Monaten oder
3-4-5 Monate und Booster zwischen 12 und 23 Monaten
|
3,6 Jahre
|
86,0
(80,2-90,7)
|
53,8
(46,3-61,1)
|
98,4
(95,4-99,7)
|
92,0
(87,2-95,5)
| |
113
(N=284)
|
3 Dosen vor dem Alter von 9 Monaten und Booster zwischen 11 und 18 Monaten
|
Ca. auf 6 Jahre geschätzt
|
72,2
(66,6-77,3)
|
30,6
(25,3-36,4)
|
98,9
(96,7-99,8)
|
95,8
(92,6-97,9)
| |
110
(N=187)
|
3-4-5 Monate und Booster zwischen 12 und 18 Monaten
|
6,4 Jahre
|
78,0
(71,3-83,7)
|
33,9
(27,1-41,2)
|
98,9
(96,2-99,9)
|
93,6
(89,1-96,6)
| |
126
(N=95)
|
3-5 Monate und Booster im Alter von 11 Monaten
|
10,7 Jahre
|
48,4
(38,0-58,9)
|
14,7
(8,3-23,5)
|
96,8
(91,0-99,3)
|
93,6
(86,6-97,6)
|
N = Anzahl der Probanden
Es wurden keine Langzeit-Persistenzdaten für Anti-HBV-Antikörper nach der Impfung von Säuglingen und Kleinkindern nach einem Impfschema im Alter von 2, 4 und 12 Monaten ermittelt.
In 2 der 5 Studien wurde auch die Persistenz der Antikörper gegenüber den anderen Impfstoff-Antigenen in Infanrix hexa (D, T, aP, Polio, Hib) bis zur Verabreichung des monovalenten Boosters mit einem Hepatitis B-Impfstoff (Engerix-B) untersucht. Die folgende Tabelle zeigt die beobachteten Antikörper Verläufe in Abhängigkeit vom verwendeten Grundimmunisierungsschema mit Infanrix hexa inkl. dem ersten Booster mit Infanrix hexa im 2. Lebensjahr bis zur Verabreichung von Engerix-B. Es liegen keine Persistenzdaten für Antikörper gegen D, T, Pa, Polio und Hib nach Verabreichung von Infanrix hexa nach einem 2+1-Impfschema vor.
Anteil der Probanden mit Antikörpertitern oberhalb des cut-off-Wertes nach Grundimmunisierung und Auffrischimpfung mit Infanrix hexa:
|
Antikörper
(cut-off)
|
Kinder im Alter von 4-5 Jahren
2-4-6 Monate Impfschema und Auffrischimpfung im Alter von 12-23 Monaten (ca. 3,6 Jahre nach der letzten Dosis Infanrix hexa)
|
Kinder im Alter von 7-8 Jahren
3-4-5 Monate Impfschema und Auffrischimpfung im Alter von 12-18 Monaten (ca. 6,4 Jahre nach der letzten Dosis Infanrix hexa)
| |
N
|
%
|
N
|
%
| |
Anti-Diphtherie
(0,1 IE/mL)
|
198
|
68,7
|
51
|
66,7
| |
Anti-Tetanus
(0,1 IE/mL)
|
198
|
74,7
|
51
|
64,7
| |
Anti-PT
(5 EL.E/mL)
|
197
|
25,4
|
161
|
32,3
| |
Anti-FHA
(5 EL.E/mL)
|
197
|
97,5
|
161
|
98,1
| |
Anti-PRN
(5 EL.E/mL)
|
198
|
90,9
|
162
|
87,0
| |
Anti-Polio Typ 1
(1/8 Verdünnung)
|
185
|
95,7
|
145
|
91,0
| |
Anti-Polio Typ 2
(1/8 Verdünnung)
|
187
|
95,7
|
148
|
91,2
| |
Anti-Polio Typ 3
(1/8 Verdünnung)
|
174
|
97,7
|
144
|
97,2
| |
Anti-PRP (Hib)
(0,15 µg/mL)
|
198
|
98,0
|
193
|
99,5
|
N = Anzahl der Probanden
Postmarketing-Erfahrungen zur klinischen Wirksamkeit
Die Wirksamkeit der Hib-Komponente von Infanrix hexa wurde in einer ausgedehnten Post-Marketing-Surveillance-Studie in Deutschland untersucht. Über einen Zeitraum von 7 Jahren betrug die Wirksamkeit der Hib-Komponenten von zwei hexavalenten Impfstoffen, von denen einer Infanrix hexa war, 89,6% nach vollständiger Grundimmunisierung und 100% nach vollständiger Grundimmunisierung mit Auffrischimpfung (unabhängig vom für die Grundimmunisierung verwendeten Hib-Impfstoff).
Wurden im Sinne einer konservativen Sensitivitätsanalyse alle Fälle von Haemophilus Infektionen eingeschlossen, inkl. denen, wo eine Typisierung nicht bekannt war oder nicht durchgeführt worden war, so betrug die Schutzwirkung in einer Gruppe, die nur unvollständig geimpfte Personen umfasste, d.h. eine Gruppe, welche die Dosis im 2. Jahr erhielt aber nicht vollständig immunisiert war, 74,7% (95% KI 19,4%-94,6%). Unter dieser Annahme betrug die geschätzte Wirksamkeit des Impfstoffes 89,8% (95% KI 77,1%-95,4%) nach vollständiger Grundimmunisierung und 98,2% (95% KI 87,2%-99,7%) nach vollständiger Grundimmunisierung mit Auffrischimpfung.
Infanrix hexa ist seit 2006 der hauptsächlich verfügbare Impfstoff mit Hib-Komponente in Italien. Der Impfstoff wird im Alter von 3, 5 und 11 Monaten verabreicht, die Durchimpfungsrate liegt bei über 95%. Die Hib-Erkrankung ist weiterhin gut unter Kontrolle, wobei zwischen 2006 und Oktober 2011 jährlich nicht mehr als drei bestätigte Hib-Fälle bei italienischen Kindern unter 5 Jahren gemeldet wurden.
Bei altersunabhängiger Analyse aller Hib-Fälle in Italien wurden maximal 7 Hib-Fälle pro Jahr erfasst. Parallel zum Rückgang der Haemophilus influenzae Typ b Infektionen nehmen die invasiven Infektionen der nicht verkapselten Stämme von Haemophilus influenzae relativ erheblich zu und machen mittlerweile bei europaweiten Untersuchungen 2008/2009 einen Anteil von ca. 68% aus. Eine absolute Zunahme der nicht verkapselten Stämme von Haemophilus influenzae kann zum jetzigen Zeitpunkt noch nicht robust bestätigt aber auch nicht ausgeschlossen werden.
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
PharmakokinetikEine Beurteilung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenDie Ergebnisse herkömmlicherweise durchgeführter präklinischer Studien zur Sicherheit, zur spezifischen und wiederholten Toxizität sowie Kompatibilität der Bestandteile deuten nicht auf eine besondere Gefährdung des Menschen hin.
Sonstige HinweiseInkompatibilitäten
Infanrix hexa (DTPa-HBV-IPV+Hib) darf mit keinem anderen Impfstoff in der gleichen Spritze gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren.
Die DTPa-HBV-IPV-Suspension und den rekonstituierten Impfstoff nicht einfrieren!Gefrorener Impfstoff ist zu verwerfen.
Hinweise für die Handhabung
Die Fertigspritze mit der DTPa-HBV-IPV-Suspension ist vor Gebrauch kräftig zu schütteln, bis eine homogene, trübe, weisse Suspension entsteht. Die DTPa-HBV-IPV-Suspension ist vor Gebrauch optisch auf mögliche Fremdpartikel und/oder Zustandsveränderungen zu untersuchen. Wenn solche Abweichungen beobachtet werden, darf der Impfstoff nicht verabreicht werden.
Impfstoffrekonstitution:
Der Impfstoff wird rekonstituiert, indem man den gesamten Inhalt der Fertigspritze mit der DTPa-HBV-IPV-Suspension der Durchstechflasche mit dem Hib-Pulver zusetzt. Vor Verabreichung ist das Gemisch kräftig zu schütteln, bis das Pulver vollständig gelöst ist. Gelösten Impfstoff vollständig zurück in die Fertigspritze aufziehen.
Die Trübung des rekonstituierten Impfstoffes erscheint etwas stärker als die der flüssigen Komponente allein. Die Wirksamkeit des Impfstoffs wird dadurch jedoch nicht beeinflusst.
Der rekonstituierte Impfstoff sollte optisch auf mögliche Fremdpartikel und/oder Zustandsveränderungen untersucht werden. Wenn Abweichungen beobachtet werden, darf der Impfstoff nicht verabreicht werden.
Nach der Rekonstitution sollte der Impfstoff umgehend injiziert werden. Der rekonstituierte Impfstoff kann jedoch bei Raumtemperatur (21°C) bis zu maximal 8 Stunden aufbewahrt werden.
Gebrauchsanweisung für die Fertigspritze:
|
|
|
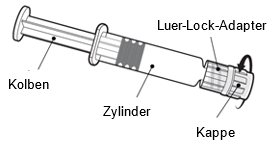
Halten Sie die Spritze am Zylinder, nicht am Kolben.
Schrauben Sie die Spritzenkappe ab, indem Sie sie gegen den Uhrzeigersinn drehen.
| |
|
|
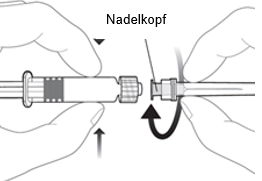
Um die Nadel an der Spritze anzubringen, verbinden Sie den Nadelkopf mit dem Luer-Lock-Adapter und drehen Sie die Nadel eine Vierteldrehung im Uhrzeigersinn, bis Sie spüren, dass sie einrastet.
Rekonstituieren Sie den Impfstoff wie oben beschrieben.
Ziehen Sie den Spritzenkolben nicht aus dem Zylinder heraus. Sollte dies geschehen, verabreichen Sie den Impfstoff nicht.
|
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer00640 (Swissmedic)
PackungenPackung mit 1 Fertigspritze DTPa-HBV-IPV-Impfstoff in Suspension und 1 Durchstechflasche Hib-Impfstoff als Pulver (Nadeln separat) (B).
Packung mit 10 Fertigspritzen DTPa-HBV-IPV-Impfstoff in Suspension und 10 Durchstechflaschen Hib-Impfstoff als Pulver (Nadeln separat) (B).
ZulassungsinhaberinGlaxoSmithKline AG, 6340 Baar
Stand der InformationMai 2024
|


