ZusammensetzungWirkstoffe
Dantrolenum natricum.
Hilfsstoffe
Mannitolum (E421) Natrii hydroxidum (zur pH-Einstellung).
Indikationen/AnwendungsmöglichkeitenMaligne Hyperthermie.
Dosierung/AnwendungSchnelle i.v. Infusion von 2,5 mg/kg Körpergewicht innerhalb weniger Minuten. Die Infusion solange fortsetzen, wie die klinischen Hauptsymptome Tachykardie, Hypoventilation, anhaltende Hyperazidität und Hyperthermie andauern (Überwachung von pH- und pCO2- erforderlich). Diese Dosis muss bis zu einer Gesamtmenge von 10 mg/kg Körpergewicht in 5-Minuten-Abständen appliziert werden. In den meisten Fällen ist eine Gesamtmenge von 10 mg/kg KG pro 24 Stunden ausreichend. Ist nach einer kumulierten Dosis von 10 mg/kg Körpergewicht ein eindeutiger Effekt nicht zu beobachten, so muss die Diagnose in Zweifel gezogen werden. Gelegentlich kann eine Dosis von über 10 mg/kg Körpergewicht erforderlich sein, um eine maligne Hyperthermie endgültig zu beherrschen. Gesamtdosen von mehr als 40 mg/kg Körpergewicht sind aus Einzelfällen bekannt. Aufgrund dieser Erfahrungen können bei Bedarf in Einzelfällen höhere Dosierungen verabreicht werden.
Kinder und Jugendliche
Gleiche Dosierung bei Kindern und Erwachsenen.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstige Bestandteile, siehe Abschnitt «Zusammensetzung».
Warnhinweise und VorsichtsmassnahmenNach Gabe von DANTROLEN i.v. kann eine Muskelschwäche mit Beeinträchtigung der Atemfunktion auftreten. Die Atemtätigkeit ist daher zu überwachen.
Der Einsatz von DANTROLEN i.v. bei der Behandlung der malignen Hyperthermie ist kein Ersatz für andere unterstützende Massnahmen. Diese sollen individuell fortgeführt werden.
DANTROLEN i.v. darf nur intravenös infundiert werden. Wegen des hohen pH-Wertes der Lösung (pH 9,5) ist extravasale Injektion unbedingt zu vermeiden, weil sie zu Gewebsnekrosen führen kann. Wegen der Gefahr von Gefässverschlüssen sind intraarterielle Injektionen zu vermeiden. Ausserdem ist aufgrund des möglichen Vorhandenseins von ungelösten Kristallen bzw. Partikeln in der Lösung nach Rekonstitution und der damit verbundenen Gefahr einer Verschlimmerung einer Reaktion an der Infusionsstelle bzw. einer Gewebenekrose, verursacht durch Kristalle in betroffenen Durchstechflaschen, die Verwendung der Filtriervorrichtung beim Aufziehen der Injektionslösung unverzichtbar.
Jede Durchstechflasche DANTROLEN i.v. enthält 3 g Mannitol (zur Einstellung einer isotonischen Lösung). Diese Menge sollte berücksichtigt werden, falls Mannitol zur Vorbeugung und Behandlung von Nierenkomplikationen im Zusammenhang mit maligner Hyperthermie eingesetzt wird.
DANTROLEN i.v. enthält weniger als 1 mmol Natrium (23 mg) pro Durchstechflasche, d.h. es ist nahezu «natriumfrei».
Vorsicht ist beim Auftreten von Hyperkaliämie-Symptomen (muskuläre Paralyse, EKG-Veränderungen, bradykarde Herzrhythmusstörungen) oder bei bereits bestehender Hyperkaliämie (Niereninsuffizienz, Digitalisintoxikation etc.) geboten, da im Tierversuch eine Erhöhung des Serumkaliums durch Dantrolen gezeigt wurde.
Unter DANTROLEN i.v.-Therapie können Leberschädigungen auftreten. Diese sind abhängig von der Dosierung und der Therapiedauer und können einen letalen Verlauf nehmen.
Dosen von mehr als 10 mg Wirkstoff/kg Körpergewicht/24 Stunden können Muskelschwäche, hervorrufen.
InteraktionenPharmakodynamische Interaktionen
Tierexperimentelle Untersuchungen weisen auf eine Wechselwirkung von Dantrolen und Verapamil (u.U. auch anderen Calciumantagonisten) in Form von Herzflimmern hin. DANTROLEN i.v. und Verapamil oder andere Calciumantagonisten sollen nicht gleichzeitig angewendet werden.
Wirkung von DANTROLEN i.v. auf andere Arzneimittel
Die gleichzeitige Gabe von DANTROLEN i.v. und nicht-depolarisierenden Muskelrelaxantien wie Vecuronium kann deren Wirkung verstärken.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine hinreichenden Daten zur Anwendung von Dantrolen bei Schwangeren. In tierexperimentelle Studien fand sich eine Reproduktionstoxizität (siehe «Präklinische Daten»).
Da Erfahrungen mit DANTROLEN i.v.-Behandlung schwangerer Frauen fehlen, sollte eine Anwendung nur erfolgen, wenn dies eindeutig erforderlich ist (vitale Indikation).
Stillzeit
Dantrolen geht in die Plazenta über und wurde in der Muttermilch nachgewiesen. DANTROLEN i.v. sollte bei stillenden Müttern nicht angewendet werden. Wenn eine Behandlung mit DANTROLEN i.v. notwendig ist, sollte abgestillt werden.
Fertilität
Es gibt keine klinischen Daten zu den Auswirkungen von Dantrolen auf die Fertilität. In tierexperimentelle Studien gibt es keinen Nachweis einer direkten Auswirkung von Dantrolen auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDANTROLEN i.v. hat Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, da es zu Schwindel, Benommenheit und Schwäche führen kann. Dies gilt vor allem im Zusammenwirken mit Alkohol oder anderen das Zentralnervensystem dämpfenden Arzneimitteln (Beruhigungsmittel). Postoperativ sind bis zu 48 Stunden eine Greifschwäche und eine Schwäche der Beinmuskulatur zu erwarten, die sich vor allem beim Treppenlaufen bemerkbar machen kann.
Unerwünschte WirkungenDie Häufigkeit folgender Erkrankungen kann auf Grundlage der verfügbaren Daten nicht abgeschätzt werden:
·Erkrankungen des Immunsystems: allergische Reaktionen, Anaphylaxie
·Stoffwechselund Ernährungsstörungen: Hyperkaliämie
·Erkrankungen des Nervensystems: Schläfrigkeit, Konvulsionen, Sprachstörung, Schwindel, Schwächegefühl, Kopfschmerzen
·Herzerkrankungen: Herzinsuffizienz, Bradykardie, Tachykardie
·Gefässerkrankungen: Thrombophlebitis
·Erkrankungen der Atemwege, des Brustraums und Mediastinums: Pleuraerguss, Respiratorische Insuffizienz, Atemdepression, Lungenödem
·Erkrankungen des Gastrointestinaltrakts: Übelkeit, Erbrechen, Diarrhö, Bauchschmerzen/-Krämpfe, gastrointestinale Blutungen
·Leber- und Gallenerkrankungen: Ikterus, Hepatitis/Hepatotoxizität, Leberfunktionsstörungen einschliesslich tödlichem Leberversagen, idiosynkratische oder hypertensive Lebererkrankung
·Erkrankungen der Haut und des Unterhautzellgewebes: Hyperhidrose, Urtikaria, Erytheme
·Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Muskelschwäche, Muskelermüdung
·Erkrankungen der Nieren und Harnwege: Kristallurie
·Erkrankungen der Geschlechtsorgane und der Brustdrüse: Uterine Hypotonie
·Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Reaktionen an der Applikationsstelle, Müdigkeit
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungBei der malignen Hyperthermie handelt es sich um eine Notfallsituation, in der die rasche Infusion einer hohen Dosis von DANTROLEN i.v. notwendig ist.
Anzeichen und Symptome
Spezifische Symptome einer DANTROLEN i.v.-Überdosierung sind nicht bekannt. Vorsicht ist bei Zeichen einer Hyperkaliämie geboten.
Behandlung
Der Nutzen einer Dialyse ist nicht bekannt.
Eigenschaften/WirkungenATC-Code
M03CA01
Wirkungsmechanismus
Dantrolen entkoppelt Reiz und Kontraktion des Skelettmuskels durch Hemmung der Calciumfreisetzung aus dem sarkoplasmatischen Retikulum. Es wirkt hier spezifisch, beeinflusst weder die neuro-muskuläre Übertragung noch hat es messbare Wirkung auf die elektrisch erregbare Oberflächenmembran.
Bei dem durch Anästhetika induzierten Syndrom maligne Hyperthermie weisen Anzeichen auf eine genetisch bedingte Anomalie der Muskelzelle hin. Man nimmt an, dass die Triggersubstanzen einen plötzlichen Anstieg des myoplasmatischen Calciums verursachen, indem sie seine Freisetzung verstärken und die Speicherung im sarkoplasmatischen Retikulum verhindern. Der resultierende Anstieg des myoplasmatischen Calcium führt zu einem Hypermetabolismus, der die Ursache der Hyperthermie, der metabolischen Azidose sowie der weiteren Symptome der malignen Hyperthermie ist.
Pharmakodynamik
Dantrolen kann den akuten Katabolismus innerhalb der Muskelzelle verhüten, indem es die Freisetzung von Calcium aus dem sarkoplasmatischen Retikulum in das Myoplasma hemmt. So können die physiologischen, metabolischen und biochemischen Veränderungen, die mit der Krise verbunden sind, umgekehrt oder geschwächt werden.
Klinische Wirksamkeit
Keine Angaben.
PharmakokinetikAbsorption
Keine Angaben.
Distribution
Maximale Blutkonzentrationen von 4,3 – 6,5 mg/l wurden bei 6 Patienten mit vermuteter maligner Hyperthermie gefunden, denen eine prophylaktische i.v. Infusion von 2,5 mg/kg über eine Zeit von 10 – 30 Min. verabreicht wurde.
Metabolismus
Dantrolen wird in der Leber zu 5-Hydroxydantrolen und Acetylamino-Dantrolen metabolisiert. Der Metabolit 5-Hydroxydantrolen ist pharmakologisch aktiv, hat ca. 50% der Aktivität der Ausgangssubstanz, während Acetylamino-Dantrolen keine muskelrelaxierende Wirkung zeigt.
Elimination
Die Eliminationshalbwertszeit beträgt 12 Std. bei Patienten mit maligner Hyperthermie. Für die diaplazentare Passage wurde ein Faktor von 0,4 gefunden.
Präklinische DatenLangzeittoxizität
In Studien zur chronischen Toxizität an Ratten, Hunden und Affen führte die orale Gabe von > 30 mg/kg/d Dantrolen (humane Äquivalenzdosis 4,8 mg/kg, 16,2 mg/kg bzw. 9,6 mg/kg) zu Verminderung des Wachstums oder der Körpergewichtsentwicklung und zu toxischen Lebereffekten und möglicherweise Okklusionsnephropathien, die reversibel waren.
Mutagenität
Dantrolen war in in-vitro-Mutagenitätstests (Ames-Tests) bei einigen Bakterienstämmen in An- und Abwesenheit von Rattenleberhomogenat positiv.
Karzinogenität
Diätetische Dosen von Dantrolen bei Ratten in Dosen von bis zu 60 mg/kg/Tag (humane Äquivalenzdosis 9,6 mg/kg) über einen Zeitraum von bis zu 18 Monaten führten zu einer Zunahme gutartiger hepatischer Lymphgefässneubildungen, zu vermehrten hepatischen Lymphangiomen und hepatischen Angiosarkomen und nur bei weiblichen Tieren zu einer Zunahme von Brusttumoren.
Die Relevanz dieser Daten für die klinische Anwendung von Dantrolen ist nicht bekannt.
Reproduktionstoxizität
Bei männlichen und weiblichen erwachsenen Ratten hatte Dantrolen bis zu einer oralen Dosis von 45 mg/Körpergewicht/Tag (humane Äquivalenzdosis 7,3 mg/kg/Tag) keine nachteiligen Auswirkungen auf die Fertilität oder die allgemeine Fortpflanzungsfähigkeit. Die Verabreichung von Dantrolen an trächtige Ratten (ab 20 mg/kg/Tag; humane Äquivalenzdosis 3,2 mg/kg/Tag) und Kaninchen (45 mg/kg/Tag; humane Äquivalenzdosis 14,5 mg/kg/Tag) führte zu einer verstärkten Bildung ein- oder beidseitiger überzähliger Rippen bei den Jungtieren.
Sonstige HinweiseDie zubereitete DANTROLEN i.v.-Lösung darf nicht mit anderen Infusionslösungen gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «verwendbar bis» bezeichneten Datum verwendet werden.
Nach Rekonstitution und Filtration ist die Lösung gebrauchsfertig und muss SOFORT verwendet werden. Übriggebliebene Lösung entsorgen.
Besondere Lagerungshinweise
Für Kinder unzugänglich aufbewahren.
Trockensubstanz nicht über 25 °C lagern.
Die Lösung ist vor direktem Licht zu schützen und zwischen 15-25 °C zu lagern.
Hinweise für die Handhabung
Lösungsvorschrift: Zu jeder Durchstechflasche DANTROLEN i.v. werden 60 ml Wasser für Injektionszwecke gegeben und solange geschüttelt, bis die Lösung klar ist.
Wichtig - vor Gebrauch lesen:
Rekonstitution von DANTROLEN i.v. (Dantrolen-Natrium)
Die rekonstituierte DANTROLEN -i.v.-Lösung muss vor der Anwendung am Patienten filtriert werden, um Partikelfreiheit zu gewährleisten. Dazu ist wie folgt vorzugehen:
1.Die Durchstechflasche mit 60 ml Wasser für Injektionszwecke rekonstituieren. Zur Zugabe des Wassers NICHT die Einweg-Filtriervorrichtung verwenden.
2.Nach der Rekonstitution muss die Lösung beim Aufziehen in die Spritze durch die beiliegende Filtriervorrichtung gefiltert werden. Bei jeder neuen DANTROLEN i.v. Durchstechflasche eine NEUE Einweg-Filtriervorrichtung verwenden. Die Lösung muss innerhalb 6 Stunden verwendet werden, aber unmittelbar vor der Verwendung filtriert werden.
3.Die Einweg-Filtriervorrichtung von der Spritze entfernen, durch eine i.v. Kanüle oder ein Verabreichungsset ersetzen und das Präparat SOFORT nach Filtration verabreichen.
4.Die Filtriervorrichtung und die Durchstechflasche mit dem Produkt in einem geprüften Sicherheitsbehälter (Sharps Collector) entsorgen.
Achtung: Nur für i.v. Infusion. Nur die beiliegende Einweg-Filtriervorrichtung verwenden. Mehrfache Verwendung der Filtriervorrichtung kann zu Infektionen oder anderen Erkrankungen/Verletzungen führen. Die Filtriervorrichtung nicht autoklavieren. Bei Beschädigung von Einzelverpackungen nicht verwenden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Information über Rekonstitution und Filtration von DANTROLEN i.v.
|
|

|
1) Eine Kanüle auf eine Spritze setzen und 60 ml Wasser für Injektionszwecke aufziehen.
| |
|

|
2) Eine DANTROLEN i.v. Durchstechflasche mit aufgezogenem Wasser für Injektionszwecke rekonstituieren. Leicht schütteln bis das Pulver vollständig gelöst ist. Die Kanüle verwerfen.
| |
|

|
3) Die Sicherheitskappe entfernen und die Spitze der Einwegfiltriervorrichtung in die Durchstechflasche stecken.
| |
|

|
4) Die Spritze anschliessen und die gesamte 60 ml rekonstituierte Lösung aus der Durchstechflasche in die Spritze ziehen und im Anschluss die Filtriervorrichtung verwerfen.
| |
|
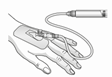
|
5) Die Spritze mit der filtrierten rekonstituierten Lösung direkt mit der intravenösen Kanüle oder einem Verabreichungsset verbinden. Abhängig von der klinischen Notwendigkeit wird das Produkt entweder sofort verabreicht oder als manuelle Infusion bzw. über eine Pumpe. Siehe Abschnitt Dosierung/Anwendung für die maximale Dosis.
|
Warnhinweis für die Handhabung:
|
|
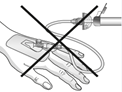
|
Achtung:
Für den Transfer der filtrierten Lösung von der Spritze in die intravenöse Kanüle bzw. Verabreichungsset nicht die Filtriervorrichtung verwenden!
|
Zulassungsnummer45217 (Swissmedic)
Packungen1x12 und 3x12 Durchstechflaschen zu je 20 mg Dantrolen-Natrium
Für jede Durchstechflasche liegt eine Einweg-Filtriervorrichtung bei.
ZulassungsinhaberinNorgine AG, 6005 Luzern
Stand der InformationFebruar 2021
| 





