ZusammensetzungKleberprotein-Lösung:
Wirkstoffe: Fibrinogenum humanum, Factor XIII, Aprotininum syntheticum
Hilfsstoffe: Albuminum humanum, L-Histidinum, Nicotinamidum, Natrii citras dihydricum, Polysorbatum 80 (Tween 80), Aqua ad iniectabilia
Thrombin-Lösung:
Wirkstoffe: Thrombinum humanum, Calcii chloridum dihydricum
Hilfsstoffe: Albuminum humanum, Natrii chloridum, Aqua ad iniectabilia
Galenische Form und Wirkstoffmenge pro EinheitFibrinkleber, tiefgefroren.
Die Kleberprotein-Lösung enthält pro ml:
Fibrinogen (als clottierbares Protein) 72 - 1101 mg
Aprotinin (synthetisch) 3000 KIE2
Faktor XIII 0.6 – 10 IE3
Die Thrombin-Lösung enthält pro ml:
Thrombin 500 IE4
Calciumchlorid Dihydrat 40 mmol (5.88 mg)
1 Enthalten in einer Gesamtprotein-Konzentration von 110.5 mg/ml
2 1 EPU (European Pharmacopeia Units) entspricht 1800 KIE (Kallidogenase-Inaktivator-Einheiten)
31 Einheit (IE) Faktor XIII entspricht jener Aktivität, die in 1 ml frischem Normalplasma enthalten ist
4Die Thrombin-Aktivität wird gemäss dem aktuellen internationalen WHO-Standard für Thrombin ermittelt
Indikationen/AnwendungsmöglichkeitenTISSEEL unterstützt die Blutstillung, wenn chirurgische Standardtechniken nicht ausreichen.
TISSEEL ist ein Fibrinkleber zur Klebung und Abdichtung von Geweben, oder zur Sicherung von chirurgischen Nähten in der Gefässchirurgie oder bei gastrointestinalen Anastomosen. Ausserdem dient TISSEEL der Klebung und Abdichtung von Geweben und der Nahtsicherung in der Neurochirurgie und bei chirurgischen Eingriffen, bei denen es zum Kontakt mit Liquor, Dura Mater kommen kann, wie beispielsweise otologische, rhinologische, ophthalmische und vertebrale Eingriffe.
Bei der Anwendung von TISSEEL wird zum Teil auch biokompatibles Material wie z.B. Kollagenvlies als Träger- und Verstärkermaterial eingesetzt.
Dosierung/AnwendungTISSEEL darf nur von erfahrenen Chirurgen angewendet werden, die in der Anwendung von TISSEEL geschult wurden.
Dosierung
Das erforderliche Volumen an TISSEEL-Lösung richtet sich nach der Grösse der zu klebenden oder zu beschichtenden Fläche bzw. nach der Grösse des auszufüllenden Defektes. Ausserdem ist es von der gewählten Applikationsmethode abhängig.
Die bei der Erstapplikation auf eine anatomische Struktur bzw. Zielfläche eingesetzte Menge sollte ausreichen, um den betreffenden Bereich vollständig abzudecken.
Die Anwendung kann bei Bedarf wiederholt erfolgen. Eine Wiederanwendung von TISSEEL auf eine bestehende polymerisierte TISSEEL Schicht sollte jedoch vermieden werden, da TISSEEL auf einer polymerisierten Schicht nicht klebt.
Bei der Klebung von Flächen kann als Anhaltspunkt dienen, dass die Packungsgrösse TISSEEL 2,0 ml (d.h. 1 ml Kleberprotein-Lösung und 1 ml Thrombin-Lösung zu gleichen Teilen) für eine Fläche von mindestens 10 cm² ausreicht.
Wird der Fibrinkleber durch Sprühen appliziert, so kann mit der gleichen Menge (d.h. 1 ml Kleberprotein-Lösung und 1 ml Thrombin-Lösung) je nach Indikation eine Fläche von 25 bis 100 cm² beschichtet werden.
Verabreichungen ausserhalb der vorgesehenen Applikationsfläche sollten vermieden werden.
TISSEEL nur als dünne Schicht auftragen. Ein zu dickes Fibringerinnsel kann sich auf die Wirksamkeit des Produkts und die Wundheilung auswirken.
TISSEEL wurde bei Früh- wie Neugeborenen, Kleinkindern bis hin zu Jugendlichen, zum Teil in grösserer Zahl angewendet; dies gilt insbesondere für die Gebiete Lebertransplantation, Oesophagus/Trachea (besonders bei Fisteln), Herzchirurgie, Urogenitalbereich, Bauchhöhle/Darm, sowie Nervenanastomosen.
Die Anwendung und Sicherheit bei Kindern und Jugendlichen ist bis jetzt nicht geprüft worden.
Art der Anwendung
Zur topischen Anwendung auf der Wundfläche. Nicht injizieren.
Um optimale Sicherheit bei der Anwendung von TISSEEL zu gewährleisten, sollen die folgenden Empfehlungen befolgt werden:
Bei offener Chirurgie soll ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 2,0 bar (28,5 psi) beträgt.
Bei minimal invasiven/laparoskopischen Eingriffen soll ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 1,5 bar (22 psi) beträgt und das ausschliesslich Kohlendioxidgas verwendet.
Vor dem Aufbringen von TISSEEL muss die Wundoberfläche mittels Standardtechniken (z. B. intermittierende Anwendung von Kompressen, Tupfern, Anwendung von Saugern) getrocknet werden. Verwenden Sie keine Druckluft oder Gas um die Applikationsstelle zu trocknen. TISSEEL darf nur auf sichtbare Applikationsstellen gesprüht werden.
TISSEEL darf nur gemäss den Anweisungen und unter Verwendung der Produkte und Geräte rekonstituiert bzw. verabreicht werden, die für dieses Produkt empfohlen werden (siehe “Hinweise zur Handhabung“).
Für die Sprühapplikation siehe “Warnhinweise und Vorsichtmassnahmen” und “Hinweise zur Handhabung” mit besonderen Empfehlungen zum erforderlichen Druck und Gewebeabstand je nach Art des Eingriffs und zur Länge der Applikationshilfen.
Unmittelbar vor der Anwendung sollten die ersten Tropfen von der Applikationskanüle ausgeschieden und verworfen werden, um die Verwendung eines ausreichend vermischten Präparates sicherzustellen.
KontraindikationenTISSEEL alleine ist nicht indiziert zur Behandlung von massiven arteriellen und venösen Blutungen.
TISSEEL darf nicht intravaskulär angewendet werden. Eine intravaskuläre Anwendung kann lebensbedrohliche thromboembolische Ereignisse zur Folge haben. Bei Überempfindlichkeit gegenüber einem der Wirkstoffe oder sonstigen Bestandteile, sowie bei bekannter Überempfindlichkeit gegen Rinderprotein oder synthetisches Aprotinin, darf TISSEEL nicht angewendet werden.
Eine Injektion in die Nasenschleimhaut darf nicht erfolgen, da hier schwerwiegende allergischanaphylaktoide Reaktionen aufgetreten sind und es zu thromboembolischen Komplikationen im Versorgungsbereich der Arteria ophthalmica kommen kann.
Warnhinweise und VorsichtsmassnahmenNur zur Anwendung auf Wundflächen. Nicht intravaskulär anwenden.
Bei Patienten mit allergischer Diathese oder Arzneimittelüberempfindlichkeit sowie bei Patienten, die Aprotinin bereits in der Vergangenheit erhalten haben, ist eine sorgfältige Risiko/Nutzen-Abwägung erforderlich. Es empfiehlt sich, Antihistaminika vor der Gabe von Aprotinin zu verabreichen.
Bei der Injektion von Kleberprotein- und/oder Thrombin-Lösungen in Weichteilgewebe besteht das Risiko einer anaphylaktischen Reaktion.
Wie bei allen Proteinprodukten sind allergische Überempfindlichkeitsreaktionen nicht ausgeschlossen.
TISSEEL sollte nicht intravaskulär angewendet werden, da dies zu anaphylaktischen Reaktionen und / oder thromboembolischen Komplikationen führen kann, die beide lebensbedrohlich sein können.
Eine intravaskuläre Anwendung kann die Wahrscheinlichkeit und den Schweregrad von akuten Überempfindlichkeitsreaktionen bei empfindlichen Patienten erhöhen.
Zeichen auf Überempfindlichkeitsreaktionen sind: Bradykardie, Tachykardie, Hypotonie, Hitzegefühl, Bronchspasmus, Giemen, Dyspnoe, Übelkeit, Urtikaria, Angioödem, Pruritus, Erythem, Parästhesie. Es wurde auch über schwerwiegende anaphylaktische Reaktionen, einschliesslich anaphylaktischer Schock mit TISSEEL berichtet (siehe Unerwünschte Wirkungen).
Bei Auftreten eines dieser Symptome ist die Anwendung unverzüglich abzubrechen und die derzeit gültigen Standardmassnahmen für eine Schockbehandlung einzuleiten.
Bereits appliziertes Präparat muss von der Applikationsstelle entfernt werden.
TISSEEL enthält synthetisches Aprotinin, ein monomerisches Polypeptid das bekannt ist, mit dem Risiko von anaphylaktischen Reaktionen im Zusammenhang zu stehen. Auch bei strikt lokaler Anwendung besteht das Risiko von anaphylaktischen Reaktionen auf Aprotinin, insbesondere im Fall einer vorangegangenen Exposition.
Deshalb sollte jede Verwendung von Aprotinin oder aprotininhaltigen Präparaten in der Krankenakte vermerkt werden.
Da synthetisches Aprotinin die identische Struktur wie das bovine Aprotinin aufweist, sollte die Anwendung von TISSEEL bei Patienten mit Allergien gegen Rinderproteine sorgfältig abgewogen werden.
In zwei retrospektiven, nicht randomisierten Studien in der koronaren Bypass-Chirurgie zeigten Patienten, die Fibrinkleber erhielten ein statistisch signifikant erhöhtes Mortalitätsrisiko. Obwohl diese Studien keinen kausalen Zusammenhang belegen, kann ein Zusammenhang zwischen dem erhöhten Risiko und der Verabreichung von TISSEEL nicht ausgeschlossen werden. Um eine unerwünschte intravasale Verabreichung zu vermeiden, ist daher besondere Vorsicht geboten.
Bei der Verabreichung von Fibrinklebern mit einem Sprühgerät ist Vorsicht geboten.
TISSEEL soll nur als dünne Schicht aufgetragen werden. Eine zu dicke Schicht kann die Wirksamkeit des Produkts und die Wundheilung negativ beeinflussen.
Bei der Verwendung von Sprühgeräten mit Druckgasreglern zur Verabreichung von TISSEEL sind lebensbedrohliche/tödliche Luft- oder Gasembolien aufgetreten. Dieses Ereignis scheint mit der Verwendung von Spray-Sets mit höherem als dem empfohlenen Druck und/oder mit einem zu geringen Abstand zur Gewebeoberfläche zusammenzuhängen. Das Risiko scheint höher zu sein, wenn Fibrinkleber mit Luft aufgesprüht werden, als beim Sprühen mit CO2 und ist daher beim Aufsprühen von TISSEEL auf offene Operationswunden nicht auszuschliessen.
Wird TISSEEL mittels Sprühapplikation aufgetragen, muss sichergestellt werden, dass ein Druck verwendet wird, der im vom Hersteller des Sprühgeräts empfohlenen Druckbereich liegt (siehe Tabelle unter „Hinweise zur Handhabung“ für Drücke und Abstände).
TISSEEL darf nur per Sprühapplikation verabreicht werden, wenn der Sprühabstand exakt beurteilt werden kann. Nicht näher als im empfohlenen Abstand aufsprühen.
Beim Aufsprühen von TISSEEL sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luft- oder Gasembolie besteht (siehe auch „Dosierung/Anwendung“).
TISSEEL darf nicht mit dem Easy Spray / Spray Set System in geschlossenen Körperbereichen angewendet werden.
Ohne zusätzliche blutstillende Massnahmen ist TISSEEL Fibrinkleber nicht zur Behandlung von massiven und starken arteriellen Blutungen indiziert.
Kleberprotein- und/oder Thrombin-Lösungen, die bei der Anwendung auf Gewebe ausserhalb des zu klebenden Bereichs gelangt sind, sollten nach Möglichkeit entfernt werden. Vor der Verwendung von TISSEEL müssen alle Körperteile ausserhalb der zu behandelnden Fläche sorgfältig abgedeckt werden, um eine Gewebeadhäsion an einer unerwünschten Stelle zu vermeiden.
Werden Fibrinkleber in geschlossen Bereichen angewendet, besteht das Risiko von Kompressionskomplikationen.
TISSEEL Fibrinkleber wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt werden, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie den Einsatz effektiver Schritte zur Inaktivierung / Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie z.B. HIV, HBV und HCV sowie gegen das unbehüllte Hepatitis A Virus (HAV) betrachtet. Für Parvovirus B19 können die getroffenen Massnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fötale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Es wird empfohlen, bei jeder Verabreichung von TISSEEL Fibrinkleber an einen Patienten den Namen und die Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Während der Herstellung von TISSEEL wird Heparin (aus Schweinemucosa) als Hilfsstoff verwendet. Im Endprodukt ist kein Heparin mehr nachweisbar.
Oxidierte Cellulose-haltige Präparate können die Wirksamkeit von TISSEEL vermindern und sollten deshalb nicht als Trägermaterial eingesetzt werden (siehe „Sonstige Hinweise“)
InteraktionenEs wurden keine formalen Wechselwirkungsstudien durchgeführt.
Alkohol-, jod- oder schwermetallhaltige Lösungen interferieren wegen der Denaturierung von Proteinen oder anderen Mechanismen mit der Wirksamkeit des Präparates. Deshalb sollten diese Substanzen vor der Anwendung von TISSEEL Fibrinkleber weitestmöglich entfernt werden.
TISSEEL Fibrinkleber kann auch bei voll heparinisierten Patienten, z.B. bei extrakorporalem Kreislauf, angewendet werden.
Schwangerschaft, StillzeitDie Sicherheit der Anwendung von Fibrinklebern während der Schwangerschaft und Stillzeit wurde nicht in kontrollierten klinischen Studien untersucht.
Es liegen keine hinreichenden tierexperimentellen Studien zur Auswirkung auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Fötus und/oder die postnatale Entwicklung vor. Daher, und weil ein Gehalt an Parvovirus B19 in TISSEEL nicht kategorisch ausgeschlossen werden kann (siehe “Warnhinweise und Vorsichtsmassnahmen“) sollte das Medikament in der Schwangerschaft und während der Stillzeit nicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenIn seltenen Fällen können bei Patienten, die mit Fibrinkleber/Hämostatika behandelt werden, Überempfindlichkeitsreaktionen oder allergische Reaktionen auftreten (z.B. Angioödeme, Brennen und Stechen am Verabreichungsort, Bradykardie, Bronchospasmus, Schüttelfrost, Atemnot, Hautrötungen (Flush), generalisierte Urtikaria, Kopfschmerzen, Nesselsucht, Hypotonie, Lethargie, Übelkeit, Juckreiz, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, Stenoseatmung).
In Einzelfällen sind diese Reaktionen bis zur schweren Anaphylaxie fortgeschritten. Solche Reaktionen können besonders dann beobachtet werden, wenn das Präparat wiederholt oder bei Patienten angewendet wird, bei denen bereits früher eine Überempfindlichkeit gegenüber Aprotinin, Rinderproteine (siehe „Warnhinweise und Vorsichtsmassnahmen“) oder einen anderen Bestandteil des Präparats aufgetreten ist.
Selbst wenn eine erste Behandlung mit TISSEEL gut vertragen wurde, kann eine weitere Anwendung des Präparats oder die systemische Anwendung von Aprotinin schwere anaphylaktische Reaktionen zur Folge haben.
In seltenen Fällen können sich Antikörper gegen Bestandteile des Fibrinklebers bilden.
Intravaskuläre Verabreichung kann zu thromboembolischen Komplikationen führen, und es besteht ein Risiko anaphylaktischer Reaktionen.
Speziell bei koronaren Bypass-Operationen sollte TISSEEL mit Vorsicht angewendet werden, um jegliches Risiko der intravaskulären Anwendung zu minimieren.
Hinweise zur Sicherheit in Bezug auf übertragbare Erreger siehe „Warnhinweise und Vorsichtsmassnahmen“.
In klinischen Studien und aus der post-marketing surveillance (markiert mit einem p in der nachfolgenden Auflistung) mit Baxter Fibrinkleber wurde über folgende unerwünschten Wirkungen mit TISSEEL berichtet.
In den klinischen Studien wurde TISSEEL als Zusatzhämostatikum in der Kardio-, Vaskular-, Hüftgelenkersatz-, Leber- und Milz-Chirurgie verabreicht. Andere klinische Studien schlossen die Klebung von Lymphgefässen in Patienten mit axillärer Lymphknotenentfernung, Klebung von Kolon-Anastomosen und Duraklebung in der hinteren Schädelgrube ein. Da die Häufigkeit von unerwünschten Wirkungen, welche aus der Post-Marketing-Surveillance berichtet wurden, anhand der vorhandenen Daten nicht abgeschätzt werden kann, wurde, wenn immer möglich, die obere Grenze des 95% Konfidenzintervalls unter Anwendung des Dreisatzes wie folgt berechnet: 3/1146 = 0.0026 oder 0.26% d.h. gelegentlich (wobei „1146“ die totale Anzahl Patienten ist, die in klinischen Studien mit TISSEEL behandelt wurden).
Sehr häufig (³ 1/10), häufig (³ 1/100 bis <1/10), gelegentlich (³ 1/1,000 bis <1/100), selten (³ 1/10,000 bis <1/1,000), sehr selten (< 1/10,000), unbekannt (kann nicht anhand der vorhandenen Daten geschätzt werden).
|
Allgemeine Bereiche
|
Nebenwirkung
|
Häufigkeit
| |
Infektionen und parasitäre Erkrankungen
|
Postoperative Wundinfektion
|
häufig
| |
Störungen des Blutes und des Lymphsystems
|
Erhöhung von Fibrinabbauprodukten
|
gelegentlich
| |
Störungen des Immunsystems
|
Überempfindlichkeitsreaktionen* p
|
gelegentlich
| |
Anaphylaktische Reaktionen* p
|
gelegentlich
| |
Anaphylaktischer Schock* p
|
gelegentlich
| |
Parästhesie p
|
gelegentlich
| |
Bronchospasmus p
|
gelegentlich
| |
Giemen p
|
gelegentlich
| |
Pruritus p
|
gelegentlich
| |
Erythem p
|
gelegentlich
| |
Störungen des Nervensystems
|
Sensorische Missempfindungen
|
häufig
| |
Funktionsstörungen des Herzens
|
Bradykardie p
|
gelegentlich
| |
Tachykardie p
|
gelegentlich
| |
Funktionsstörungen der Gefässe
|
Achselvenenthrombose **
|
häufig
| |
Hypotonie
|
selten
| |
Hämatome p
|
gelegentlich
| |
Arterielle Embolie p
|
gelegentlich
| |
Luftembolie*** p
|
unbekannt
| |
Embolie der Zerebralarterien p
|
gelegentlich
| |
Zerebralinfarkt** p
|
gelegentlich
| |
Respiratorische, thorakale und mediastinale Funktionsstörungen
|
Dyspnoe p
|
gelegentlich
| |
Gastrointestinale Beschwerden
|
Übelkeit
|
gelegentlich
| |
Intestinale Obstruktion p
|
gelegentlich
| |
Funktionsstörungen der Haut und des Unterhautgewebes
|
Hautausschlag
|
häufig
| |
Urtikaria p
|
gelegentlich
| |
Gestörte Wundheilung p
|
gelegentlich
| |
Störungen der Skelettmuskulatur und des Bindegewebes
|
Gliederschmerzen
|
häufig
| |
Allgemeine Störungen und Reaktionen an der Applikationsstelle
|
Schmerzen
|
häufig
| |
Erhöhte Körpertemperatur
|
häufig
| |
Hautrötung p
|
gelegentlich
| |
Ödeme p
|
gelegentlich
| |
Verletzungen und Vergiftungen
|
Postprozeduale Schmerzen
|
gelegentlich
| |
Serom
|
sehr häufig
| |
Angioödem p
|
gelegentlich
|
* anaphylaktische Reaktionen und anaphylaktischer Schock schliessen tödliche Reaktionen ein.
** als Folge intravaskulärer Applikation im Sinus petrosus superior.
*** wie mit anderen Fibrinklebern sind auch unter TISSEEL bei der Verwendung von Druckgas lebensbedrohliche/tödliche Luft- und Gasembolien aufgetreten. Diese Ereignisse scheinen mit einer unsachgemässen Anwendung von Sprühgeräten im Zusammenhang zu stehen (z.Bsp. mit einem höheren Druck als empfohlen und in unmittelbarer Nähe der Gewebsoberfläche).
p unerwünschte Wirkungen aus der post-marketing surveillance.
Klasseneffekte
Andere Nebenwirkungen, welche mit Fibrinkleber/Hämostatika assoziiert werden, schliessen Überempfindlichkeitsreaktionen ein, welche sich durch Reizung an der Applikationsstelle, Brustkorbbeschwerden, Schüttelfrost, Kopfschmerz, Lethargie, Unruhe und Erbrechen manifestieren können.
ÜberdosierungDer Fibrinkleber sollte nur als dünne Schicht aufgetragen werden, da zu dicke Schichten die Wirksamkeit des Präparates und den Wundheilungsprozess stören können.
Eigenschaften/WirkungenATC-Code: B02BC30
TISSEEL Fibrinkleber ist ein biologischer Zweikomponentenkleber. Die beiden Komponenten liegen tiefgefroren vor und müssen vor der Anwendung aufgetaut werden. Während oder unmittelbar vor der Anwendung werden die beiden Komponenten (Kleberprotein-Lösung und Thrombin-Lösung) vermischt (siehe Applikationsmethoden). Es entsteht eine viskose Kleberprotein-Thrombin-Lösung, die rasch zu einer weissen, elastischen Masse wird, welche fest am Gewebe haftet. Die Verfestigung läuft analog der physiologischen Gerinnung ab und dient zur Blutstillung, zum Wundverschluss sowie zur Gewebeklebung. Im Verlauf der Wundheilung kommt es zu einer vollständigen Resorption des verfestigten Fibrinklebers.
Das folgende Schema soll den Ablauf verdeutlichen:
|
Kleberprotein-Lösung
(mit Aprotinin)
|
|
|
|
| |
|
|
|
| |
|
|
|
|
| |
|
|
|
Kleberprotein-Thrombin-
Lösung
| |
|
|
| |
|
|
|
|
| |
Thrombin-Lösung
(mit Calciumchlorid Dihydrat)
|
|
|
|
| |
|
|
|
| |
|
|
|
Verfestigter Fibrinkleber
|
PharmakokinetikDie Fibrinklebung führt analog zur letzten Stufe der natürlichen Blutgerinnung innerhalb weniger Minuten zur Ausbildung eines physiologischen Fibringerüstes. Dieses Gerüst in Form eines dreidimensionalen Netzwerkes wird in der Folge von Fibroblasten besiedelt. Die einsetzende Kollagensynthese der Fibroblasten führt zur bindegewebigen Organisation des Wundgebietes.
Gleichzeitig kommt es zu einer allmählichen Resorption des Fibrins, wobei histomorphologisch kein Unterschied zum Abbau körpereigenen, extravasalen Fibrins feststellbar ist. Die Geschwindigkeit des Fibrinabbaus wird einerseits durch die fibrinolytische Aktivität des umgebenden Gewebes und die eingewanderten Granulozyten, andererseits durch die Menge des dem Kleber zugesetzten Fibrinolyseinhibitors Aprotinin beeinflusst. Das im TISSEEL in geringer Menge vorhandene Plasminogen wird unter Einwirkung von Plasminogen-Aktivatoren aus dem umgebenden Gewebe in Plasmin überführt, welches Fibrin zu löslichen Spaltprodukten (FDP) abbaut. Die Fibrinspaltprodukte werden durch die neben den Fibroblasten in das Wundgebiet eingewanderten Granulozyten und Makrophagen phagozytiert und weiter abgebaut.
Thrombin bildet einen Komplex mit Antithrombin III. Dieser Komplex und Aprotinin werden proteolytisch abgebaut, während das CaCl2 dem Elektrolythaushalt zugeführt wird.
Aufgrund der pharmakokinetischen Profile konnte Bioäquivalenz von bovinem und synthetischem Aprotinin gezeigt werden.
Präklinische DatenTISSEEL mit (bovinem oder synthetischem) Aprotinin hat sich in in-vivo-Studien inklusive solcher zur Wundheilung bei Ratten und Kaninchen als gut verträglich erwiesen.
In humanen Fibroblasten-Kulturen zeigte die Kleberproteinlösung von TISSEEL hervorragende Zellkompatibilität bei fehlender Zytotoxizität. Darüberhinaus konnte in geeigneten In vitro-Tests keine Mutagenität nachgewiesen werden.
Subkutane akute Toxizitätsstudien an Ratten und Kaninchen zeigten keine akute Toxizität von TISSEEL bei guter lokaler Verträglichkeit. Synthetisches und bovines Aprotinin wurden selbst nach einmaliger intravenöser und paravenöser Applikation sehr hoher Dosen (bis 1‘500‘000 IU/kg bei Ratte oder Maus toleriert. Die beobachteten No-Observed_Adverse-Event-Effect Level wurden mit < 100‘000 IU/kg (Maus) und < 200‘000 IU/kg (Ratte) bestimmt. In geeigneten Meerschweinchen-Modellen gab es weder Anzeichen für sensibilisierendes noch für anaphylaktisches Potential von synthetischem oder bovinem Aprotinin.
Basierend auf einer systematischen Literaturanalyse können auf für TISSEEL verwendeten Lösungsmitteln / Detergentien / Reagentien beruhende Nebenwirkungen oder Toxizitäten ausgeschlossen werden.
Sonstige HinweiseInkompatibilitäten
Oxidierte Zellulose-haltige Präparate können die Wirksamkeit von TISSEEL vermindern und sollten deshalb nicht als Trägermaterial eingesetzt werden.
TISSEEL darf nicht mit anderen Arzneimitteln gemischt werden.
Alkohol-, jod- oder schwermetallhaltige Lösungen interferieren wegen der Denaturierung von Proteinen oder anderen Mechanismen mit der Wirksamkeit des Präparates. Lässt sich deren Verwendung nicht vermeiden, so sind etwaige Reste vor Beginn der Klebung möglichst vollständig zu entfernen.
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit ’’Exp:’’ bezeichneten Datum verwendet werden.
Die aufgetauten Lösungen innerhalb von höchstens 72 Stunden nach dem Auftauen verwenden. Bis zum Gebrauch bei Raumtemperatur (15 – 25°C) in ungeöffneter und unbeschädigter Sterilverpackung lagern.
Nach dem Auftauen nicht mehr einfrieren und nicht im Kühlschrank lagern!
Besondere Lagerungshinweise
Tiefgekühlt (≤-20 °C) lagern. Die Kühlkette bis zur Anwendung nicht unterbrechen.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Für Kinder unerreichbar aufbewahren!
Hinweise für die Handhabung
Allgemeines
Vor der Verwendung von TISSEEL müssen alle Körperteile ausserhalb der zu behandelnden Fläche sorgfältig abgedeckt werden, um eine Gewebeadhäsion an einer unerwünschten Stelle zu vermeiden.
Um ein Haftenbleiben des Fibrinklebers zu vermeiden, Handschuhe und Instrumente, die mit Kleberprotein-Thrombin-Lösung in Berührung kommen können, vorher mit steriler Kochsalzlösung anfeuchten.
Eine separate, sequentielle Anwendung der beiden Komponenten muss vermieden werden. Das heisst beide Komponenten müssen gemeinsam aufgetragen werden und dürfen nicht getrennt appliziert werden.
Vorbereitung und Rekonstitution
Die Kleberprotein- und Thrombinlösung befinden sich je in einer Fertigspritze zum Einmalgebrauch. Das Präparat wurde unter aseptischen Bedingungen in zwei sterilen Beuteln verpackt. Der innere Beutel und dessen Inhalt sind steril, solange die äussere Verpackung unbeschädigt ist.
Es wird empfohlen, beide Kleberkomponenten in einem sterilen Wasserbad bei 33°C – 37°C aufzutauen und zu erwärmen. Das Wasserbad darf eine Temperatur von 37°C nicht überschreiten (um den vorgegebenen Temperaturbereich zu überwachen die Wassertemperatur mit einem Thermometer kontrollieren und gegebenenfalls das Wasser wechseln. Wird ein steriles Wasserbad für das Auftauen und Erwärmen verwendet, die Fertigspritze aus den Beuteln entnehmen).
Die Schutzkappe der Spritze erst nach vollständigem Auftauen entfernen und die Applikationsnadel sofort aufsetzen. TISSEEL nicht anwenden, bis die Lösungen vollständig aufgetaut sind.
Das Auftauen und Erwärmen der Fertigspritze kann nach einer der vier folgenden Methoden vorgenommen werden:
1. Schnelles Auftauen / Erwärmen (steriles Wasserbad) – empfohlene Methode
Den inneren Beutel in den Sterilbereich bringen, die Fertigspritze aus dem Innenbeutel entnehmen und direkt in das sterile Wasserbad legen. Sicherstellen, dass der Inhalt der Fertigspritze vollständig in das Wasser eingetaucht ist.
Tabelle 1: Auftau- und Erwärmungszeiten im sterilen Wasserbad bei 33 °C bis maximal 37 °C
|
Packungsgrösse
|
Mindestzeit für Auftauen und Erwärmen auf 33 °C bis maximal 37 °C im
sterilen Wasserbad
(Präparat ohne Beutel)
| |
PRIMA-Spritze
| |
2 ml
|
5 Minuten
| |
4 ml
|
5 Minuten
|
2. Auftauen / Erwärmen in einem nicht sterilen Wasserbad
Als Alternative kann das Präparat ausserhalb des sterilen Bereiches unter Anwendung eines nicht sterilen Wasserbads aufgetaut werden.
Hierzu die Fertigspritze in den beiden Beuteln belassen und für die entsprechende Dauer in ein Wasserbad ausserhalb des Sterilbereiches legen (siehe Tabelle 2). Sicherstellen, dass die Beutel während der gesamten Auftaudauer in das Wasser eingetaucht bleiben. Nach dem Auftauen aus dem Wasserbad entnehmen, den Aussenbeutel trocknen und den Innenbeutel mit der Fertigspritze in den Sterilbereich bringen.
Tabelle 2: Auftau- und Erwärmzeiten in einem nicht sterilen Wasserbad bei 33 °C bis maximal 37 °C
|
Packungsgrösse
|
Mindestzeit für Auftauen- und Erwärmen auf 33 °C bis maximal 37 °C im
nicht sterilen Wasserbad
(Präparat in Beuteln)
| |
PRIMA-Spritze
| |
2 ml
|
15 Minuten
| |
4 ml
|
20 Minuten
|
3. Auftauen und Erwärmen in einem Inkubator
Alternativ können die Kleberkomponenten auch in einem Inkubator bei 33 - 37°C aufgetaut und erwärmt werden.
Die Auftau- und Erwärmungszeiten im Inkubator sind in Tabelle 3 angegeben. Bei diesen Angaben wird davon ausgegangen, dass sich das Produkt in den Beuteln befindet.
Tabelle 3: Auftau- und Erwärmungszeiten im Inkubator von 33°C bis maximal 37°C
|
Packungsgrösse
|
Mindestzeit für Auftauen- und Erwärmen auf 33 °C bis maximal 37 °C,
im Inkubator
(Präparat in Beuteln)
| |
PRIMA-Spritze
| |
2 ml
|
40 Minuten
| |
4 ml
|
50 Minuten
|
4) Auftauen bei Raumtemperatur (nicht über +25°C) / Erwärmen vor der Anwendung in einem Inkubator auf 33°C – 37°C
Das Präparat kann bei Raumtemperatur aufgetaut werden. Die in Tabelle 4 angeführten Zeitangaben sind Minimalzeiten für das Auftauen bei Raumtemperatur. Nach dem Auftauen ist das Präparat bei Raumtemperatur zu lagern und muss innerhalb von 72 Stunden verwendet werden.
Wenn das Auftauen bei Raumtemperatur erfolgt, muss das Präparat kurz vor Gebrauch zusätzlich in einem Inkubator auf 33°C – 37°C erwärmt werden. Die entsprechenden Erwärmungszeiten sind ebenfalls in Tabelle 4 angeführt.
Tabelle 4: Auftau- und Erwärmungszeiten bei Raumtemperatur (RT), gefolgt von einem zusätzlichen Erwärmen vor Gebrauch im Inkubator bei 33°C bis maximal 37°C.
|
Packungs-grösse
|
Mindestzeit für Auftauen bei Raumtemperatur (nicht über 25°C), gefolgt von einem zusätzlichen Erwärmen vor der Anwendung in einem Inkubator bei 33° bis maximal 37 °C
(Präparat in Beuteln)
| |
PRIMA Spritze
| |
Auftauzeiten bei Raumtemperatur
|
Erwärmzeiten im Inkubator
| |
2 ml
|
80 Minuten
|
+ 11 Minuten
| |
4 ml
|
90 Minuten
|
+ 13 Minuten
|
–Das Produkt zum Auftauen nicht in den Händen halten!
–Nicht in die Mikrowelle geben!
–Nach dem Auftauen nicht in den Kühlschrank geben und nicht wieder einfrieren!
Bei Raumtemperatur aufgetaute ungeöffnete Beutel können bei kontrollierter Raumtemperatur (nicht über +25 °C) bis zu 72 Stunden gelagert werden. Wird das Präparat nicht innerhalb von 72 Stunden nach dem Auftauen verwendet, muss es verworfen werden.
Um eine optimale Vermischung der beiden Lösungen zu erzielen, müssen die beiden Kleberkomponenten unmittelbar vor der Anwendung auf 33–37°C erwärmt werden. TISSEEL darf nicht Temperaturen über 37 °C exponiert werden und nicht in die Mikrowelle gegeben werden.
Die Kleberproteinlösung und die Thrombinlösung sollten klar bis leicht opaleszierend sein. Lösungen, die trüb sind oder Ablagerungen aufweisen, nicht verwenden. Die aufgetauten Präparate vor der Anwendung visuell auf Schwebstoffe und Verfärbungen überprüfen.
Die aufgetaute Kleberproteinlösung sollte eine leicht viskose Flüssigkeit sein. Wenn die Lösung die Konsistenz eines verfestigten Gels aufweist, ist davon auszugehen, dass sie denaturiert wurde (z.B. aufgrund einer Unterbrechung der Kühlkette oder durch Überhitzen während des Erwärmens). In diesem Fall darf TISSEEL nicht angewendet werden.
Die Spritze erst kurz vor der Anwendung aus dem Beutel entnehmen. Die Spritzenschutzkappen erst zur Anwendung von den Spritzen entfernen.
Bei der PRIMA-Spritze soll um das Entfernen der Schutzkappe zu erleichtern, zuerst die Spritzenkappe hin-und her bewegt werden. Erst dann die Schutzkappe abziehen.
TISSEEL erst verwenden, wenn das Präparat vollständig aufgetaut und auf 33° bis 37° Grad erwärmt ist (flüssige Konsistenz).
Zu weiteren Anweisungen für die Vorbereitung bitte das zuständige Krankenpflegepersonal oder den Arzt befragen.
Verabreichung mit der PRIMA-Spritze
Für die Applikation die Doppelkammer-Fertigspritze mit der Kleberprotein- und der Thrombin-Lösung an ein Anschluss-Stück und eine Applikationskanüle anschliessen, die im Set mit dem Applikationszubehör mitgeliefert wurden. Die Doppelkolbenstange der Doppelkammer-Fertigspritze stellt sicher, dass gleiche Mengen der Kleberkomponenten über das Anschluss-Stück in die Applikationskanüle gelangen, wo sie gemischt und anschliessend aufgetragen werden.
Arbeitsanleitung für die Handhabung der PRIMA-Spritze
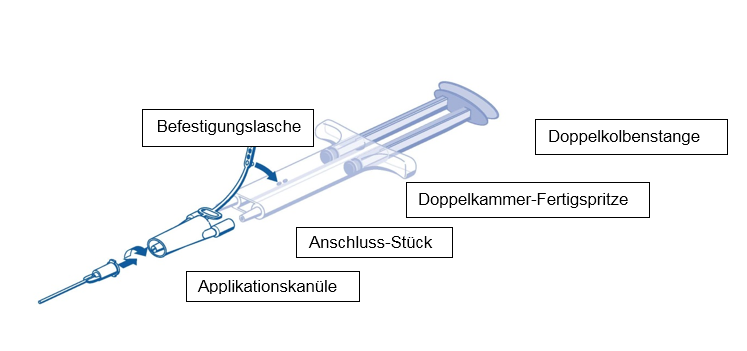
1.Spritze vor dem Anbringen der Applikationsteile vollständig entlüften.
2.Das Anschluss-Stück und die Befestigungslasche an der Seite der Spritze mit dem Befestigungsloch für die Befestigungslasche ausrichten.
3.Die Konusse der Doppelkammer-Fertigspritze mit dem Anschluss-Stück verbinden. Dabei auf festen Halt achten. Das Anschluss-Stück mit der Befestigungslasche an der Doppelkammer-Fertigspritze fixieren.Wenn die Befestigungslasche reisst, das mitgelieferte Ersatz-Anschluss-Stück verwenden.Wenn das Ersatz-Anschluss-Stück nicht vorhanden ist, kann das System trotzdem verwendet werden, sofern sorgfältig darauf geachtet wird, dass die Verbindung fest sitzt und dicht ist. Nicht die Luft im Anschluss-Stück herausdrücken.
4.Eine Applikationskanüle auf das Anschluss-Stück stecken. Die Luft im Anschluss-Stück und in der Applikationskanüle erst bei Beginn der eigentlichen Applikation mit herausdrücken, da sonst die Applikationskanüle verstopfen könnte.
Hinweis: Vor der Anwendung von TISSEEL muss die Wundoberfläche mit Standardtechniken (z. B. mehrmaliges Aufdrücken von Kompressen oder Tupfern, Verwendung von Sauggeräten) getrocknet werden. Zum Trocknen keine Druckluft und kein Gas verwenden.
Die gemischte Kleberprotein-Thrombin-Lösung auf die vorgesehene Oberfläche oder auf die Flächen der zu verklebenden Teile durch Ausüben von Druck auf die Rückseite der Doppelkolbenstange auftragen.
Bei chirurgischen Eingriffen, die das Auftragen eines Mindestvolumens des Fibrinklebers verlangen, wird empfohlen, die ersten Tropfen des Produkts herauszudrücken und zu verwerfen.
Nach Auftragen von TISSEEL mindestens 2 Minuten vergehen lassen, um eine ausreichende Polymerisation zu erzielen.
Wenn die Applikation der Fibrinkleberkomponenten unterbrochen wird, kann es unmittelbar zu einer Verstopfung der Kanüle kommen. Die Applikationskanüle in diesem Falle erst unmittelbar vor der Fortsetzung der Applikation gegen eine neue austauschen. Sollten die Austrittsöffnungen des Anschluss-Stücks verstopft sein, das mitgelieferte Ersatz-Anschluss-Stück verwenden.
Hinweis:
Wegen der hohen Konzentration der Thrombin-Lösung (500 I.E./ml) setzt die Verfestigung des Fibrinklebers innerhalb von Sekunden nach Vermischung ein.Der Fibrinkleber kann auch mit anderem von Baxter gelieferten Zubehör aufgetragen werden, das sich besonders für beispielsweise den endoskopischen Einsatz, die minimal-invasive Chirurgie oder die Applikation auf grosse oder schwer zugängliche Flächen eignet. Beim Einsatz solcher Applikationshilfen bitte genau nach Bedienungsanleitung vorgehen.
Nach der Applikation von TISSEEL mindestens 2 Minuten warten, um eine genügende Polymerisation zu erhalten.
Bei der Anwendung von TISSEEL wird zum Teil auch biokompatibles Material wie z.B. Kollagenvlies als Träger- und Verstärkermaterial eingesetzt.
Wird TISSEEL mit Hilfe eines Sprühgeräts aufgetragen, muss sichergestellt werden, dass der Druck und der Gewebeabstand innerhalb der folgenden, vom Hersteller empfohlenen Bereiche liegen:
|
Empfohlener Druck, Gewebeabstand und Sprühgeräte für die Applikation von TISSEEL
| |
Art der Chirurgie
|
Zu verwendendes Sprühset
|
Zu verwendende Applikationshilfe
|
Zu verwendender Druckregler
|
Empfohlener Abstand vom Zielgewebe
|
Empfohlener Sprühdruck
| |
Offene Wunde
|
Tisseel / Artiss Spray Set
|
n. z.
|
EasySpray
|
10-15 cm
|
1,5-2,0 bar
(21,5-28,5 psi)
| |
Tisseel / Artiss Spray Set 10er-Pack
|
n. z.
|
EasySpray
| |
| |
Laparoskopie/ minimal invasive Eingriffe
|
n. z.
|
Duplospray MIS Applikator 20 cm
|
Duplospray MIS Regulator
|
2–5 cm
|
1,2-1,5 bar (18-22 psi)
| |
Duplospray MIS Regulator NIST B11
| |
Duplospray MIS Applikator 30 cm
|
Duplospray MIS Regulator
| |
Duplospray MIS Regulator NIST B11
| |
Duplospray MIS Applikator 40 cm
|
Duplospray MIS Regulator
| |
Duplospray MIS Regulator NIST B11
| |
Austauschbare Spitze
|
Duplospray MIS Regulator
| |
Duplospray MIS Regulator NIST B11
|
Beim Aufsprühen von TISSEEL sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luft- oder Gasembolie besteht (siehe „Dosierung/Anwendung“ und „Warnhinweise und Vorsichtsmassnahmen“).
Zulassungsnummer52'618 (Swissmedic)
PackungenPackung mit:
TISSEEL 2 ml: enthält 1 ml Kleberprotein-Lösung und 1 ml Thrombin-Lösung (B)
TISSEEL 4 ml: enthält 2 ml Kleberprotein-Lösung und 2 ml Thrombin-Lösung (B)
1 PRIMA Spritze:
mit tiefgefrorener Kleberprotein-Lösung und Thrombin-Lösung in einer vorgefüllten Doppelkammer-Fertigspritze (aus Polypropylen), mit einer Spitzenkappe verschlossen, verpackt in 2 Beuteln zusammen mit einem Medizinprodukt, bestehend aus 2 Anschluss-Stücken und 4 Applikationskanülen.
Der Gerätesatz wurde mit Ethylenoxid sterilisiert und ist bei ungeöffneter und unbeschädigter Verpackung steril und pyrogenfrei.
Nur für Einmalgebrauch! Nicht resterilisieren!
ZulassungsinhaberinBaxter AG, 8152 Opfikon
Stand der InformationJanuar 2018
|

