ZusammensetzungPulver
Wirkstoff: Nonacogum alfa (rekombinanter Blutgerinnungsfaktor IX).
Hilfsstoffe: Histidinum, Glycinum, Saccharum, Polysorbatum 80.
Lösungsmittel
Natriumchlorid-Lösung (0.234%) zur Injektion: Natrii chloridum, aqua ad injectabilia.
Galenische Form und Wirkstoffmenge pro EinheitWeisses/nahezu weisses Pulver und klares, farbloses Lösungsmittel zur Herstellung einer Injektionslösung.
BeneFIX 250
Durchstechflasche à 250 I.E. Nach Rekonstitution mit dem mitgelieferten Lösungsmittel (5 ml): 50 I.E./ml.
BeneFIX 500
Durchstechflasche à 500 I.E. Nach Rekonstitution mit dem mitgelieferten Lösungsmittel (5 ml): 100 I.E./ml.
BeneFIX 1000
Durchstechflasche à 1000 I.E. Nach Rekonstitution mit dem mitgelieferten Lösungsmittel (5 ml): 200 I.E./ml.
BeneFIX 2000
Durchstechflasche à 2000 I.E. Nach Rekonstitution mit dem mitgelieferten Lösungsmittel (5 ml): 400 I.E./ml.
BeneFIX 3000
Durchstechflasche à 3000 I.E. Nach Rekonstitution mit dem mitgelieferten Lösungsmittel (5 ml): 600 I.E./ml.
BeneFIX 250, 500, 1000, 2000 und 3000
Die Aktivität (I.E.) wird anhand eines Ein-Stufen-Tests gemäss Europäischer Pharmakopöe bestimmt. Die spezifische Aktivität von BeneFIX beträgt mindestens 200 I.E./mg Protein.
Indikationen/AnwendungsmöglichkeitenBehandlung und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (angeborener Mangel an Faktor IX).
Dosierung/AnwendungDie Therapie muss unter Aufsicht eines in der Behandlung von Hämophilie erfahrenen Arztes eingeleitet werden.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren. Die Patienten können eine der ablösbaren Etiketten von der Durchstechflasche in ihrem Tagebuch einkleben um die Chargennummer zu dokumentieren.
Kontrolle der Behandlung
Zur Bestimmung der benötigten Dosis und Infusionshäufigkeit wird während der Behandlung eine genaue Kontrolle des Faktor-IX-Spiegels empfohlen. Das Ansprechen des individuellen Patienten auf Faktor IX kann individuell unterschiedlich sein, da individuell schwankende Halbwertszeiten und Wiederfindungsraten (recovery-Werte) gefunden werden. Bei unter- oder übergewichtigen Patienten kann eine Anpassung der auf dem Körpergewicht basierenden Dosis erforderlich sein. Insbesondere bei grösseren chirurgischen Eingriffen ist eine präzise Überwachung der Substitutionstherapie durch Gerinnungsanalyse (Faktor-IX-Aktivität im Plasma) unerlässlich.
Bei Verwendung des einstufigen In-vitro-Gerinnungstests auf Basis der Thromboplastinzeit (aPTT) zur Bestimmung der Faktor-IX-Aktivität in Blutproben des Patienten können die Ergebnisse der Faktor-IX-Aktivität sowohl von der Art des verwendeten aPTT-Reagenz als auch vom verwendeten Referenzstandard erheblich beeinflusst werden. Dies ist besonders dann zu beachten, wenn das Labor und/oder die im Test verwendeten Reagenzien gewechselt werden.
Dosierung
Die Behandlung mit allen Faktor-IX-Präparaten, einschliesslich BeneFIX, erfordern eine individuelle Anpassung der Dosierung. Dosierung und Dauer der Substitutionstherapie sind vom Schweregrad des Faktor-IX-Mangels, Ort und Ausmass der Blutung und vom klinischen Zustand des Patienten abhängig.
Die Anzahl der verabreichten Faktor-IX-Einheiten wird in Internationalen Einheiten (I.E.), die dem aktuellen WHO-Standard für Faktor-IX-Präparate entsprechen, angegeben. Die Faktor-IX-Aktivität im Plasma wird entweder in Prozenten (bezogen auf normales Plasma vom Menschen) oder in Internationalen Einheiten (bezogen auf einen internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) an Faktor-IX-Aktivität entspricht der Menge von Faktor IX in 1 ml normalem humanem Plasma.
Bedarfsbehandlung
Die Berechnung der benötigten Dosis an BeneFIX kann auf der Grundlage erfolgen, dass eine Einheit der Faktor-IX-Aktivität pro kg Körpergewicht bei Patienten ≥12 Jahre den Spiegel an zirkulierendem Faktor IX durchschnittlich um 0.7 I.E./dl, bei Patienten <12 Jahren durchschnittlich um 0.6 I.E./dl (üblicher Bereich, altersabhängig von 0.34 bis 1.4 I.E./dl) erhöht (= beobachtete Recovery, weitere Informationen siehe «Pharmakokinetik»).
Die benötigte Dosis wird unter Verwendung der nachfolgenden Formel bestimmt:
Erforderliche Faktor-IX-Einheiten (I.E.) = Körpergewicht (kg) × erwünschter Faktor-IX-Anstieg (%) oder (I.E./dl) × reziproke beobachtete Recovery.
Die zur Berechung gemäss obenstehender Formel erforderliche «reziproke beobachtete Recovery» ist daher bei Patienten ≥12 Jahre durchschnittlich 1.4 I.E./kg; bei Patienten <12 Jahre durchschnittlich 1.7 I.E./kg.
Die zu verabreichende Dosis und die Häufigkeit der Anwendung sollten stets an der individuellen klinischen Wirksamkeit ausgerichtet sein.
Bei den folgenden hämorrhagischen Ereignissen darf die Faktor-IX-Aktivität im angeführten Zeitraum nicht unter den angegebenen Aktivitätsspiegel im Plasma (in % des Normalwerts oder in I.E./dl) fallen. Die folgende Tabelle kann als Richtlinie für Blutungsepisoden und chirurgische Eingriffe verwendet werden:
|
Grad der Blutung/Art der Operation
|
Benötigter Faktor-IX- Spiegel (in % oder I.E./dl)
|
Dosierungshäufigkeit (Stunden)/Therapiedauer (in Tagen)
| |
Blutung
| |
Frühe Hämarthrose, Muskel- oder orale Blutung
|
20-40
|
Wiederholung alle 24 Stunden. Mindestens 1 Tag, bis die durch Schmerzen angezeigte Blutung gestillt oder Heilung erfolgt ist.
| |
Mittelschwere Hämarthrose, Muskelblutung oder Hämatome
|
30-60
|
Injektion alle 24 Stunden für 3-4 Tage oder länger wiederholen, bis Schmerzen und Behinderungen beseitigt sind.
| |
Lebensbedrohende Blutungen
|
60-100
|
Injektion alle 8-24 Stunden wiederholen, bis die Gefahr vorüber ist.
| |
Chirurgische Eingriffe
| |
Kleine, einschliesslich Zahnextraktionen
|
30-60
|
Alle 24 Stunden, mindestens 1 Tag, bis Wundheilung erreicht ist.
| |
Grosse
|
80-100
(prä- und postoperativ)
|
Injektion alle 8-24 Stunden bis zur adäquaten Wundheilung wiederholen, danach Therapie für mindestens 7 weitere Tage fortsetzen, um eine Faktor-IX-Aktivität von 30%-60% (I.E./dl) aufrechtzuerhalten.
|
Prophylaxe
BeneFIX kann zur Langzeitprophylaxe von Blutungen bei Patienten mit schwerer Hämophilie B verabreicht werden. In klinischen Studien wurde zur routinemässigen Sekundärprophylaxe bei vorbehandelten Patienten (PTP) eine Dosis von ca. 40 I.E./kg (Bereich: 13-78 I.E./kg) in 3- bis 4-tägigem Abstand verabreicht.
In einigen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen erforderlich sein.
Überwachung im Hinblick auf Inhibitoren
Die Patienten müssen auf die Bildung von Faktor-IX-Inhibitoren überwacht werden. Wird die erwartete Faktor-IX-Aktivität im Plasma nicht erreicht oder können Blutungen nicht mit einer angemessenen Dosis gestillt werden, muss ein biologischer Test durchgeführt werden, um festzustellen, ob ein Faktor-IX-Inhibitor vorhanden ist.
Bei Patienten mit hohen Inihibitorspiegeln kann sich eine Faktor-IX-Therapie als nicht wirksam erweisen und andere therapeutische Massnahmen müssen in Betracht gezogen werden. Die Behandlung solcher Patienten sollte von Ärzten mit Erfahrung in der Behandlung von Hämophilie durchgeführt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Spezielle Dosierungsanweisungen
Pädiatrie
Es gibt für Kinder im Alter unter 6 Jahren in begrenztem Umfang Daten zur Bedarfsbehandlung und Behandlung bei chirurgischen Eingriffen mit BeneFIX.
Die mittlere Prophylaxedosis (±Standardabweichung) betrug 63.7 (±19.1) I.E./kg verabreicht in 3- bis 7-tägigem Abstand. Bei jüngeren Patienten können kürzere Dosierungsintervalle oder höhere Dosen erforderlich sein. Der Faktor-IX-Verbrauch zur Routineprophylaxe betrug bei den 22 auswertbaren Patienten pro Jahr 4'607 (±1'849) I.E./kg bzw. monatlich 378 (±152) I.E./kg.
Sowohl die Faktor-IX-Aktivität im Plasma, als auch die pharmakokinetischen Parameter, wie z.B. Recovery und Halbwertszeit, müssen entsprechend den klinischen Erfordernissen eng überwacht werden, um die Dosierung je nach Bedarf anzupassen.
Ältere Patienten
In den klinischen Studien mit BeneFIX war keine ausreichende Zahl von Patienten im Alter von 65 Jahren oder älter eingeschlossen, um feststellen zu können, ob diese Patienten anders auf die Behandlung reagieren als jüngere Patienten. Wie bei allen Patienten, die mit BeneFIX behandelt werden, muss die Dosis bei älteren Patienten individuell angepasst werden.
Art der Verabreichung
Nachdem das Pulver zur Herstellung einer Injektionslösung mit dem mitgelieferten Lösungsmittel (0.234%ige w/v Natriumchlorid-Lösung) aus der Fertigspritze aufgelöst wurde, wird BeneFIX intravenös (i.v.) verabreicht (siehe «Hinweise für die Handhabung»).
Die Lösung sollte sofort oder innerhalb von 3 Stunden verabreicht werden.
Die Anwendung als kontinuierliche Infusion ist nicht zugelassen und wird nicht empfohlen (siehe auch «Warnhinweise und Vorsichtsmassnahmen», «Unerwünschte Wirkungen» und «Sonstige Hinweise»).
BeneFIX sollte langsam injiziert werden, um lokalisierte Reaktionen wie Schmerzen und Brennen zu vermeiden. In den meisten Fällen wurde eine Injektionsrate von 4 ml/min verwendet. Die Injektionsrate sollte dem Zustand des Patienten angepasst werden.
Im Falle einer vermuteten Überempfindlichkeitsreaktion im Zusammenhang mit der Verabreichung von BeneFIX, sollte die Infusionsrate vermindert oder die Infusion gestoppt werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»).
Agglutination von roten Blutkörperchen im Schlauchsystem oder der Spritze
Es wurde während der Verabreichung von BeneFIX über Agglutination von roten Blutkörperchen im Schlauchsystem oder der Spritze berichtet. Es wurden keine unerwünschten Wirkungen im Zusammenhang mit diesen Berichten beobachtet. Um die Möglichkeit einer Agglutination zu minimieren, ist es wichtig, die Blutmenge, die in das Infusionsbesteck gelangt, zu begrenzen. Es darf kein Blut in die Spritze gelangen. Wenn eine Agglutination von roten Blutkörperchen im Schlauchsystem oder in der Spritze bemerkt wird, muss das ganze Material (Schlauchsystem, Spritze, BeneFIX-Lösung) verworfen werden und der Verabreichungsvorgang mit einer neuen Packung wiederholt werden.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Bekannte Überempfindlichkeit gegen Hamsterproteine.
Warnhinweise und VorsichtsmassnahmenÜberempfindlichkeit
Wie bei allen intravenös verabreichten Proteinprodukten können Überempfindlichkeitsreaktionen vom allergischen Typ auftreten. BeneFIX enthält Spuren von Hamsterproteinen. Es wurden bei Faktor-IX-Produkten, wie auch bei BeneFIX, potentiell lebensbedrohliche anaphylaktische/anaphylaktoide Reaktionen beobachtet. Wenn Symptome von Überempfindlichkeit auftreten, sollten Patienten angewiesen werden, die Anwendung des Arzneimittels sofort abzubrechen und ihren Arzt aufzusuchen. Die Patienten müssen über frühe Anzeichen von Überempfindlichkeitsreaktionen aufgeklärt werden, darunter Atembeschwerden, Kurzatmigkeit, Schwellung, Urtikaria, Juckreiz, Engegefühl in der Brustgegend, Bronchospasmus, Laryngospasmus, verschwommenes Sehen, Stenoseatmung, Blutdruckabfall und Anaphylaxie.
In einigen Fällen führten diese Reaktionen zu einer schweren Anaphylaxie. Bei Schock muss die Behandlung den Regeln der modernen Schocktherapie folgen. Im Falle von schweren allergischen Reaktionen sollten alternative hämostatische Massnahmen in Erwägung gezogen werden.
Aktivitätsneutralisierende Antikörper (Inhibitoren)
Bei Patienten, die bereits mit Faktor-IX-haltigen Produkten behandelt wurden (previously treated patients = PTPs), werden gelegentlich Inhibitoren nachgewiesen. Da bei klinischen Studien ein mit BeneFIX behandelter PTP einen klinisch relevanten niedrigtitrigen Inhibitor entwickelte und da zur Antigenität des rekombinanten Faktor IX noch wenig Erfahrungswerte vorliegen, müssen Patienten, die mit BeneFIX behandelt werden, sorgfältig auf die Bildung von Faktor-IX-Inhibitoren überwacht werden. Für diese Inhibitoren muss unter Verwendung geeigneter biologischer Testverfahren eine Titration in Bethesda-Einheiten (B.U.) durchgeführt werden.
In der Literatur wurde über einen Zusammenhang zwischen dem Auftreten eines Faktor-IX-Inhibitors und allergischen Reaktionen berichtet. Der einzige vorbehandelte Patient, der einen geringen Inhibitortiter aufwies, zeigte ebenfalls vorübergehend während der Anwesenheit des Inhibitors allergische Reaktionen (leichtes Engegefühl in der Brust). Deshalb sollten Patienten, die eine allergische Reaktion entwickeln, auf die Anwesenheit eines Inhibitors untersucht werden. Weiterhin sollte bedacht werden, dass bei Patienten mit Faktor-IX-Inhibitoren ein erhöhtes anaphylaktisches Risiko bei erneuter Exposition gegenüber Faktor IX besteht. Vorläufige Informationen weisen auf einen möglichen Zusammenhang zwischen grösseren Deletionsmutationen des Faktor-IX-Gens und erhöhtem Risiko zu Inhibitorbildung sowie zu akuten Hypersensitivitätsreaktionen hin. Patienten mit bekannten grösseren Deletionsmutationen des Faktor-IX-Gens sollten genau auf Anzeichen und Symptome von akuten Hypersensitivitätsreaktionen beobachtet werden, speziell während der Anfangsphase der erstmaligen Exposition gegenüber dem Produkt.
Aufgrund des Risikos von allergischen Reaktionen auf Faktor-IX-Konzentrate, sollte die anfängliche Behandlung mit Faktor IX nach Ermessen des behandelnden Arztes unter medizinischer Beobachtung erfolgen, um die Möglichkeit einer angemessenen Therapie der allergischen Reaktionen sicherzustellen.
Thrombotische Ereignisse
Obwohl BeneFIX nur Faktor IX enthält, muss das Risiko einer Thrombosebildung und einer Verbrauchskoagulopathie (DIC) berücksichtigt werden. Da bei Verwendung von Konzentraten mit Faktor-IX-Komplexen in der Vergangenheit thromboembolische Komplikationen beobachtet wurden, können Produkte mit Faktor IX eine potentielle Gefährdung darstellen für Patienten, die Anzeichen einer Fibrinolyse aufweisen oder unter Verbrauchskoagulopathie (DIC) leiden. Wegen des Risikos thromboembolischer Komplikationen ist bei Patienten mit Lebererkrankungen, bei frisch operierten Patienten, bei Neugeborenen und bei Patienten, bei denen das Risiko thrombotischer Ereignisse oder einer Verbrauchskoagulopathie besteht, eine klinische Beobachtung mit geeigneten biologischen Testverfahren erforderlich, um Frühzeichen von Thrombose und Verbrauchskoagulopathie festzustellen. In den genannten Fällen muss der Vorteil einer Behandlung mit BeneFIX gegen die Risiken abgewogen werden.
Die Sicherheit und Wirksamkeit der Anwendung von BeneFIX als kontinuierliche Infusion ist nicht belegt (siehe auch «Dosierung/Anwendung» und «Unerwünschte Wirkungen»). Nach Markteinführung gab es Berichte über das Auftreten von thrombotischen Ereignissen, einschliesslich des lebensbedrohlichen Vena-cava-superior-Syndroms (SVC-Syndrom) bei kritisch kranken Neugeborenen, die eine kontinuierliche Infusion von BeneFIX über einen zentralvenösen Katheter erhielten (siehe auch «Unerwünschte Wirkungen»). BeneFIX ist für die Verabreichung als kontinuierliche Infusion nicht zugelassen.
Kardiovaskuläre Ereignisse
Bei Patienten mit bestehenden kardiovaskulären Risikofaktoren kann sich durch die Substitutionstherapie mit Faktor IX das kardiovaskuläre Risiko erhöhen.
Nephrotisches Syndrom
Es liegen Berichte über das Auftreten eines nephrotischen Syndroms nach versuchter Immuntoleranzinduktion bei Hämophilie B-Patienten mit Faktor-IX-Inhibitor und allergischen Reaktionen in der Anamnese vor. Die Sicherheit und Wirksamkeit von BeneFIX zur Immuntoleranzinduktion wurde nicht nachgewiesen.
Besondere Populationen
Zur Behandlung von Patienten, die noch nicht mit Faktor-IX-Präparaten behandelt wurden (previously untreated patients = PUPs), mit BeneFIX liegen keine ausreichenden Ergebnisse aus klinischen Studien vor.
InteraktionenEs wurden keine Wechselwirkungen von Produkten mit humanem Blutgerinnungsfaktor IX (rDNA) mit anderen Arzneimitteln gemeldet.
Schwangerschaft/StillzeitEs wurden keine Reproduktionsstudien bei Tieren mit Faktor-IX-Präparaten durchgeführt. Wegen des geringen Auftretens von Hämophilie B bei Frauen gibt es keine Erfahrungen zur Anwendung von Faktor IX während der Schwangerschaft und Stillzeit. Deshalb sollte Faktor IX in der Schwangerschaft und Stillzeit nur bei eindeutiger Indikationsstellung angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenBeneFIX hat keinen Einfluss auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen.
Unerwünschte WirkungenÜberempfindlichkeitsreaktionen oder allergische Reaktionen (mit z.B. Angioödem, Brennen und Stechen an der Infusionsstelle, Schüttelfrost, Hitzegefühl, generalisierte Urtikaria, Kopfschmerzen, Quaddeln, Hypotonie, Lethargie, Übelkeit, Unruhe, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, Keuchen) wurden beobachtet, die in manchen Fällen zu schwerer Anaphylaxie (einschliesslich Schock) fortschreiten können. In manchen Fällen entwickelten sich diese Reaktionen zu einer schweren Anaphylaxie, und sie traten in enger zeitlicher Beziehung mit der Entwicklung von Faktor-IX-Inhibitoren (siehe auch «Warnhinweise und Vorsichtsmassnahmen») auf.
Sehr selten wurde eine Entwicklung von Antikörpern gegen Hamsterproteine mit entsprechenden Überempfindlichkeitsreaktionen beobachtet.
Entwicklung von Inhibitoren
Patienten mit Hämophilie B können neutralisierende Antikörper (Inhibitoren) gegen Faktor IX entwickeln. Wenn solche Inhibitoren auftreten, manifestiert sich dieser Zustand als unzureichendes klinisches Ansprechen. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen.
Bei Hämophilie-B-Patienten mit Faktor-IX-Inhibitoren und allergischen Reaktionen in der Anamnese wurde nach versuchter Immuntoleranz-Induktion über das Auftreten eines nephrotischen Syndroms berichtet.
Thromboembolische Ereignisse
Es besteht ein potenzielles Risiko für das Auftreten thromboembolischer Ereignisse nach der Verabreichung von Faktor-IX-Produkten, siehe «Warnhinweise und Vorsichtsmassnahmen».
Die untenstehenden Daten werden gemäss der MedDRA-Systemorganklasse (SOC und Preferred Term-Level) aufgeführt. Die Häufigkeiten wurden nach der folgenden Konvention eingeteilt: sehr häufig (≥1/10); häufig (<1/10, ≥1/100); gelegentlich (<1/100, ≥1/1'000), nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar). In der Tabelle sind Nebenwirkungen aufgeführt, die in klinischen Studien mit PTPs und nach der Markteinführung gemeldet worden sind. Die Häufigkeiten basieren auf den behandlungsbedingten Nebenwirkungen unabhängig von der Kausalität in gepoolten klinischen Studien mit 224 Probanden.
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Zellulitis an der Infusionsstelle (einschliesslich Zellulitis).
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Faktor-IX-Hemmung aufgrund neutralisierender Antikörper.
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeit (einschliesslich Arzneimittelüberempfindlichkeit, Angioödem, Bronchospasmus, Keuchen, Dyspnoe und Laryngospasmus).
Nicht bekannt: Anaphylaktische Reaktion*.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerz (einschliesslich Migräne, Sinus-Kopfschmerz) (26.8%).
Häufig: Schwindelgefühl, Dysgeusie.
Gelegentlich: Somnolenz, Tremor.
Augenerkrankungen
Gelegentlich: Sehstörungen (einschliesslich Flimmerskotom und verschwommenes Sehen).
Herzerkrankungen
Gelegentlich: Tachykardie (einschliesslich erhöhte Herzfrequenz, Sinustachykardie).
Gefässerkrankungen
Häufig: Phlebitis, Rötung (einschliesslich Hitzewallungen, Wärmegefühl, Hauterwärmung).
Gelegentlich: Hypotension (einschliesslich erniedrigter Blutdruck).
Nicht bekannt: Vena-cava-superior-Syndrome* (bei kritisch kranken Neugeborenen, die eine kontinuierliche Infusion von BeneFIX über einen zentralvenösen Katheter erhielten), tiefe Venenthrombose*, Thrombose*, Thrombophlebitis*.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Husten (einschliesslich produktiver Husten) (14.3%).
Erkrankungen des Gastrointestinaltrakts
Häufig: Erbrechen, Übelkeit.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Ausschlag (einschliesslich makulöser Ausschlag, papulöser Ausschlag und makulopapulöser Ausschlag), Urtikaria.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Niereninfarkt#.
# entwickelt von einem Hepatitis C-Antikörper-positiven Patienten 12 Tage nach einer Dosis BeneFIX wegen einer Blutungsepisode.
Nicht bekannt: Nephrotisches Syndrom†.
† gemeldet nach versuchter Immuntoleranz-Induktion bei Hämophilie-B-Patienten mit Faktor-IX-Inhibitoren und allergischen Reaktionen in der Anamnese.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Fieber (18.8%).
Häufig: Beschwerden im Brustraum (einschliesslich Schmerz im Brustraum und Engegefühl im Brustraum), Reaktionen an der Infusionsstelle (einschliesslich Pruritus an der Infusionsstelle und Erythem an der Infusionsstelle), Schmerz an der Infusionsstelle (einschliesslich Schmerz an der Injektionsstelle, Beschwerden an der Infusionsstelle).
Nicht bekannt: unzureichendes klinisches Ansprechen*.
Untersuchungen
Nicht bekannt: unzureichende Faktor-IX-Recovery* (Dies ist ein wortgetreuer Begriff, kein MedDRA 17.1 PT zugeordnet).
* Unerwünschte Wirkungen identifiziert nach der Markteinführung
Beschreibung ausgewählter unerwünschter Wirkungen
Überempfindlichkeitsreaktionen/Allergische Reaktionen
Falls vermutete Überempfindlichkeitsreaktionen auftreten, die möglicherweise mit der Verabreichung von BeneFIX im Zusammenhang stehen könnten, siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen».
Entwicklung von Inhibitoren
Bei 1 von 65 mit BeneFIX behandelten Patienten (einschliesslich 9 Patienten aus einer Studie in der Chirurgie), die zuvor Plasmaprodukte erhalten hatten, wurde ein klinisch relevanter, geringer Inhibitortiter nachgewiesen. Bei diesem Patienten konnte die Behandlung mit BeneFIX fortgesetzt werden, ohne Anstieg der Inhibitoren oder anaphylaktischer Reaktionen gegenüber anamnestischen Werten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Pädiatrie
Allergische Reaktionen könnten bei Kindern häufiger auftreten als bei Erwachsenen.
Es gibt keine ausreichenden Daten über das Auftreten von Inhibitoren bei PUPs (siehe auch «Eigenschaften/Wirkungen»).
ÜberdosierungEs wurden keine Symptome einer Überdosierung im Zusammenhang mit rekombinanten Koagulationsfaktor-IX-Präparaten gemeldet.
Eigenschaften/WirkungenATC-Code: B02BD04
BeneFIX enthält rekombinanten Blutgerinnungsfaktor IX (Nonacog alfa). Beim rekombinanten Blutgerinnungsfaktor IX handelt es sich um ein einkettiges Glykoprotein mit 415 Aminosäuren und einer relativen Molekülmasse von ca. 55'000 Dalton, das zur Familie der Serin-Proteasen der Vitamin K-abhängigen Blutgerinnungsfaktoren gehört. Die primäre Aminosäuresequenz ist vergleichbar mit der Allelform Ala148 des plasmaisolierten Faktors IX. Einige post-translationale Modifikationen des rekombinanten Moleküls unterscheiden sich von denen des plasmaisolierten Moleküls.
Der rekombinante Blutgerinnungsfaktor IX BeneFIX ist ein Glykoprotein, das von gentechnisch veränderten Säugetierzellen (Ovarial-Zelllinie des Chinesischen Hamsters [CHO]) sezerniert wird.
Der rekombinante Blutgerinnungsfaktor IX ist ein rekombinantes Proteintherapeutikum, dessen strukturelle und funktionelle Eigenschaften mit denen des endogenen Faktor IX vergleichbar sind.
Faktor IX wird durch einen Komplex aus Faktor VII und Gewebefaktor auf exogenem Weg (extrinsisches System) sowie durch Faktor XIa auf endogenem Weg (intrinsisches System) aktiviert. Der aktivierte Faktor IX aktiviert in Verbindung mit dem aktivierten Faktor VIII den Faktor X. Dies führt zur Umwandlung von Prothrombin in Thrombin, das dann Fibrinogen in Fibrin umsetzt. Damit wird die Blutgerinnung (Gerinnselbildung) ermöglicht. Die Aktivität des Faktors IX ist bei Hämophilie B entweder nicht vorhanden oder aber stark vermindert. Eine Substitutionstherapie kann erforderlich sein.
Hämophilie B ist eine X-chromosomal rezessiv vererbbare Blutgerinnungsstörung aufgrund eines verminderten Faktor IX-Spiegels, die – entweder spontan oder aufgrund eines Unfalls oder chirurgischen Eingriffs – zu einer profusen Blutung in Gelenken, Muskeln oder inneren Organen führt. Da bei einer Substitutionstherapie der Faktor-IX-Plasmaspiegel erhöht ist, werden eine vorübergehende Korrektur des Faktormangels und eine Abnahme der Blutungstendenz ermöglicht.
In zwei offenen Studien erwies sich BeneFIX bei einmal wöchentlicher Gabe von 100 I.E./kg als unbedenklich. Aufgrund der Halbwertszeit des Produkts und der begrenzten Daten aus pharmakokinetischen Studien bezüglich der einmal wöchentlichen Gabe kann dieses Dosierungsschema im Allgemeinen jedoch nicht zur Langzeitprophylaxe bei Patienten mit schwerer Hämophilie B empfohlen werden.
Pädiatrie
Die Wirksamkeitsanalyse in Studie 3090A1-301-WW basierte auf 22 auswertbaren pädiatrischen Patienten, die ein Prophylaxeregime erhielten, darunter 4 Patienten, die nach kurzer Zeit der Bedarfsbehandlung zur Prophylaxebehandlung wechselten. 2 Patienten unterzogen sich operativen Eingriffen (Beschneidung und Einsatz eines Portkatheters). Die Sicherheitsanalyse von 25 auswertbaren Patienten zeigte ein erwartungsgemässes Sicherheitsprofil. Das einzige dokumentierte schwerwiegende Ereignis, welches mit BeneFIX im Zusammenhang stand, wurde bei dem einzigen eingeschlossenen PUP berichtet, bei dem Überempfindlichkeit und Entwicklung von Hemmkörpern auftrat.
PharmakokinetikIn einer randomisierten Crossover-Studie zur Pharmakokinetik an 24 vorbehandelten Patienten (≥12 Jahre) mit einer Dosis von 75 IE/kg wurde gezeigt, dass BeneFIX rekonstituiert mit Natriumchlorid-Lösung 0.234% pharmakokinetisch dem zuvor vertriebenen BeneFIX (rekonstituiert mit sterilem Wasser) entspricht. Darüber hinaus wurden bei 23 der obigen Patienten nach wiederholter Verabreichung von BeneFIX die pharmakokinetischen Parameter für sechs Monate nachverfolgt und waren dabei unverändert im Vergleich zu den bei der ersten Auswertung erhalten Parameter. Eine Zusammenfassung der pharmakokinetischen Daten wird in nachfolgender Tabelle präsentiert.
Berechnete pharmakokinetische Parameter für BeneFIX (75 IE/kg) zum Zeitpunkt 0 und nach 6 Monaten bei vorbehandelten Patienten mit Hämophilie B
|
Parameter
|
Zeitpunkt 0,
n=24
Mittelwert ± SD
|
Nach 6 Monaten,
n=23
Mittelwert ± SD
| |
Cmax (IE/dl)
|
54.5 ± 15.0
|
57.3 ± 13.2
| |
AUC∞ (IE∙h/dl)
|
940 ± 237
|
923 ± 205
| |
t½ (h)
|
22.4 ± 5.3
|
23.8 ± 6.5
| |
CL (ml/h/kg)
|
8.47 ± 2.12
|
8.54 ± 2.04
| |
Recovery
(IE/dl pro IE/kg)
|
0.73 ± 0.20
|
0.76 ± 0.18
|
Abkürzungen: AUC∞ = Fläche unter der Plasmakonzentrations-Zeit-Kurve von 0 bis unendlich; Cmax = Maximalkonzentration; t½ = Plasma-Eliminationshalbwertszeit; CL = Clearance; SD = Standardweichung.
Es wurde ein populations-pharmakokinetisches Modell entwickelt, welches gesammelte Daten von 92 Kindern im Alter von 0.6 bis 12 Jahren und 99 Jugendlichen und Erwachsenen im Alter von über 12 Jahren verwendet. Die untenstehende Tabelle zeigt die mittels des finalen 2-Kompartment-Modells geschätzten Parameter. Bei Kindern fanden sich im Durchschnitt eine höhere Clearance, ein grösseres Verteilungsvolumen, eine kürzere Halbwertszeit und eine niedrigere Recovery als bei Erwachsenen.
Mittelwert ± SD der PK Parameter basierend auf individuellen Bayes-Schätzungen aus einer Populations-PK-Untersuchung
|
Altersgruppe (Jahre)
|
Kleinkinder
(<2 Jahre)
|
Kinder
(2 bis 12 Jahre)
|
Jugendliche und Erwachsene
(>12 Jahre)
| |
Anzahl Probanden
|
53
|
39
|
99
| |
Clearance (ml/h/kg)
|
13.1 ± 2.1
|
13.2 ± 2.8
|
8.5 ± 2.2
| |
Vss (ml/kg)
|
252 ± 35
|
260 ± 26
|
229 ± 55
| |
Eliminationshalbwertszeit (h)
|
15.6 ± 1.2
|
16.7 ± 1.8
|
22.9 ± 4.8
| |
Recovery (I.E./dl pro I.E./kg)
|
0.61 ± 0.10
|
0.59 ± 0.08
|
0.72 ± 0.18
|
PK = Pharmakokinetik; SD = Standardabweichung (Standard Deviation); Vss = Verteilungsvolumen (Volume of distribution at steady state)
Präklinische DatenPräklinische Daten zeigen auf der Basis konventioneller Studien zur Genotoxizität kein potentielles Risiko.
Es wurden keine Studien zur Kanzerogenität, zur Beeinträchtigung der Fertilität oder zur fetalen Entwicklung durchgeführt.
Sonstige HinweiseInkompatibilitäten
BeneFIX darf nicht mit anderen Arzneimitteln gemischt werden. Es sollte nur das beigepackte Infusionsset verwendet werden. Behandlungsfehler können, als Folge einer Adsorption des humanen Blutgerinnungsfaktors IX an der Innenoberfläche einiger Infusionsbestecke, auftreten.
Beeinflussung diagnostischer Methoden
Eine vorübergehende Korrektur der partiellen Thromboplastinzeit (PTT) wurde beobachtet. Es wurde keine Auswirkung auf die normale Prothrombinzeit festgestellt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Das Produkt enthält keine Konservierungsmittel, und die rekonstituierte Lösung sollte sofort oder innerhalb von 3 Stunden nach Rekonstitution verwendet werden. Die chemische und physikalische Stabilität bei der Anwendung wurde für 3 Stunden bei Temperaturen bis 25 °C nachgewiesen.
Die rekonstituierte Lösung enthält Polysorbat 80, welches erfahrungsgemäss die Extraktionsrate von Di(2-ethylhexyl)phthalat (DEHP) aus Polyvinyl (PVC) erhöht. Bei der Auflösung und Verabreichung von BeneFIX sollte dieser Faktor mitberücksichtigt werden. Es ist wichtig, dass die Angaben unter Gebrauchsanweisung genau befolgt werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Bei 2-30 °C lagern.
BeneFIX nicht einfrieren, um eine Beschädigung der Fertigspritze zu vermeiden.
Hinweise für die Handhabung
Genaue Anweisungen zur Auflösung und Verabreichung sind der Gebrauchsanweisung zu entnehmen.
Nachdem das Pulver zur Herstellung einer Injektionslösung mit dem mitgelieferten Lösungsmittel (0.234%ige w/v Natriumchlorid-Lösung) aus der Fertigspritze aufgelöst wurde, wird BeneFIX intravenös (i.v.) verabreicht.
Die Lösung sollte klar und farblos sein. Die Lösung bei sichtbarer Trübung oder Verfärbung verwerfen.
Nach dem Auflösen ist die Lösung unverzüglich oder innerhalb von 3 Stunden zu verwenden.
Da die Anwendung von BeneFIX als kontinuierliche Infusion nicht untersucht wurde, sollte BeneFIX nicht mit anderen Infusionslösungen gemischt oder als Tropfinfusion gegeben werden.
Nicht verwendete Lösung, leere Durchstechflaschen sowie verwendete Kanülen und Spritzen sachgemäss entsorgen.
Zulassungsnummer54510 (Swissmedic).
PackungenJede Packung BeneFIX enthält:
·1 Durchstechflasche mit Pulver zur intravenösen Injektion nach Auflösen.
·1 Fertigspritze mit Lösungsmittel mit einem Spritzenkolben.
·1 sterilen Adapter für die Durchstechflasche als Hilfsmittel zur Rekonstitution.
·1 steriles Infusionsset.
·2 Alkoholtupfer.
·1 Heftpflaster.
·1 Tupfer aus Verbandmull.
BeneFIX 250
Pulver mit 250 I.E. rekombinantem Blutgerinnungsfaktor IX (Nonacog alfa) und 5 ml Natriumchlorid-Lösung (0.234%) zur Injektion [B].
BeneFIX 500
Pulver mit 500 I.E. rekombinantem Blutgerinnungsfaktor IX (Nonacog alfa) und 5 ml Natriumchlorid-Lösung (0.234%) zur Injektion [B].
BeneFIX 1000
Pulver mit 1000 I.E. rekombinantem Blutgerinnungsfaktor IX (Nonacog alfa) und 5 ml Natriumchlorid-Lösung (0.234%) zur Injektion [B].
BeneFIX 2000
Pulver mit 2000 I.E. rekombinantem Blutgerinnungsfaktor IX (Nonacog alfa) und 5 ml Natriumchlorid-Lösung (0.234%) zur Injektion [B].
BeneFIX 3000
Pulver mit 3000 I.E. rekombinantem Blutgerinnungsfaktor IX (Nonacog alfa) und 5 ml Natriumchlorid-Lösung (0.234%) zur Injektion [B].
ZulassungsinhaberinPfizer AG, Zürich.
Stand der InformationNovember 2017.
LLD V015
Gebrauchsanweisung
Verwenden Sie BeneFIX immer genau nach Anweisung des Arztes. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Die Dosierung von BeneFIX wird vom Arzt festgelegt. Die Dosierung und die Behandlungsdauer hängen von Ihrem individuellen Bedarf für die Faktor-IX-Substitutionstherapie und von Ihren pharmakokinetischen Daten (Recovery und Halbwertszeit), die regelmässig überprüft werden müssen, ab. Möglicherweise bemerken Sie einen Unterschied in der Dosis, die Sie erhalten, wenn Sie von einem aus Plasma hergestellten Faktor-IX-Produkt zu BeneFIX wechseln.
Im Ermessen des Arztes kann während der Behandlung mit BeneFIX eine Dosisänderung erfolgen.
Auflösung und Verabreichung
Die unten beschriebene Vorgehensweise stellt nur eine Richtlinie für das Auflösen und die Verabreichung von BeneFIX dar. Bitte halten Sie sich genau an die von Ihrem Arzt beschriebenen Anweisungen, insbesondere zur Venenpunktion.
Nachdem das Pulver zur Herstellung einer Injektionslösung mit dem mitgelieferten Lösungsmittel (0.234%ige w/v Natriumchlorid-Lösung) aus der Fertigspritze aufgelöst wurde, wird BeneFIX intravenös (i.v.) verabreicht.
Vor Durchführung der folgenden Verfahren stets die Hände waschen. Bitte unbedingt auf eine aseptische Arbeitsweise (das heisst sauber und keimfrei) achten.
Auflösung
BeneFIX wird nach Auflösen mit dem sterilen Lösungsmittel zur Injektion intravenös (i.v.) verabreicht.
1.Bringen Sie eine Durchstechflasche mit gefriergetrocknetem BeneFIX und die Fertigspritze mit Lösungsmittel auf Zimmertemperatur.
2.Entfernen Sie die «flip-off»-Schutzkappe aus Plastik von der BeneFIX-Durchstechflasche, so dass der mittlere Teil des Gummistopfens sichtbar wird.
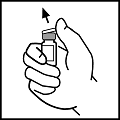
3.Wischen Sie den Gummistopfen der Durchstechflasche mit einem der beiliegenden Alkoholtupfer oder mit einer anderen Lösung zur Desinfektion ab, und lassen Sie ihn trocknen. Berühren Sie den Gummistopfen nach der Reinigung nicht mehr mit der Hand und lassen Sie ihn nicht mit anderen Oberflächen in Berührung kommen.
4.Ziehen Sie die Folie von der klaren Verpackung des Adapters für die Durchstechflasche. Entnehmen Sie den Adapter nicht aus der Verpackung.
5.Stellen Sie die Durchstechflasche auf eine ebene Oberfläche. Halten Sie die Verpackung des Adapters fest und platzieren Sie den Adapter senkrecht über der Durchstechflasche. Drücken Sie den Adapter kräftig auf, bis die Spitze des Adapters den Verschlussstopfen der Durchstechflasche vollständig durchdringt und der Adapter oben auf der Durchstechflasche richtig einrastet.
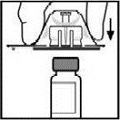
6.Heben Sie die Verpackung vom Adapter ab und entsorgen Sie diese.
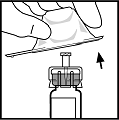
7.Befestigen Sie den Spritzenkolben an der Fertigspritze mit dem Lösungsmittel, indem Sie den Kolben in die Öffnung des Verschlussstopfens der Spritze einsetzen und dann den Kolben kräftig andrücken und einschrauben, bis er fest in dem Stopfen sitzt.
8.Brechen Sie die beschädigungsresistente Plastikkappe an der Perforation von der Spritze ab, indem sie die Perforation der Kappe brechen. Dies erreichen Sie durch ein Hin- und Herbiegen der Kappe bis die Perforation bricht. Berühren Sie weder die Innenseite der Kappe noch die Spitze der Spritze. Legen Sie die Kappe mit der Bruchstelle nach oben ab, denn es kann sein, dass die Kappe nochmals aufgesteckt werden muss (wenn Sie das aufgelöste BeneFIX nicht sofort anwenden).

9.Stellen Sie die Durchstechflasche auf eine ebene Oberfläche. Verbinden Sie die Spritze mit dem Lösungsmittel mit dem Adapter, indem Sie die Spitze der Spritze auf den Adapter aufstecken und die Spritze dann mit Druck im Uhrzeigersinn einschrauben, bis sie fest sitzt.
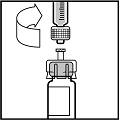
10.Drücken Sie langsam den Spritzenstempel hinunter, um alles Lösungsmittel in die Durchstechflasche mit BeneFIX zu injizieren.

11.Schwenken Sie die Durchstechflasche leicht, bis das Pulver gelöst ist, ohne die Spritze zu entfernen.

12.Die fertige Lösung sollte vor Verabreichung optisch auf Teilchen geprüft werden. Die Lösung sollte klar und farblos erscheinen.Anmerkung: Wenn Sie mehr als eine Durchstechflasche BeneFIX je Infusion verwenden, sollte jede Durchstechflasche wie oben beschrieben aufgelöst werden. Die Lösungsmittelspritze wird entfernt, wobei der Adapter auf der Durchstechflasche verbleibt, und eine separate, grössere Luer-Lock-Spritze kann benutzt werden, um die Lösungen der einzelnen Durchstechflaschen aufzuziehen.
13.Stellen Sie sicher, dass der Spritzenstempel noch vollständig nach unten gedrückt ist und drehen Sie die Durchstechflasche auf den Kopf. Ziehen Sie die Lösung langsam vollständig in die Spritze auf.
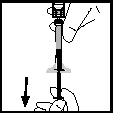
14.Nehmen Sie die Spritze vom Adapter ab, indem Sie sie vorsichtig gegen den Uhrzeigersinn drehend abziehen. Verwerfen Sie die Durchstechflasche mit dem darauf befestigten Adapter.Anmerkung: Wenn die Lösung nicht sofort gebraucht wird, sollte die Spritzenkappe vorsichtig wieder aufgesetzt werden. Berühren Sie weder die Spritzenspitze noch das Innere der Kappe.
BeneFIX unverzüglich oder innerhalb von 3 Stunden nach Auflösen verabreichen. Die gebrauchsfertige Lösung kann bis zur Verabreichung bei Raumtemperatur gelagert werden.
Verabreichung (intravenöse Injektion)
Verwenden Sie zur Verabreichung von BeneFIX die Lösungsmittel-Fertigspritze oder eine sterile Luer-Lock-Einmalspritze aus Kunststoff. Ziehen Sie die Lösung mit Hilfe des Adapters aus der Durchstechflasche auf.
BeneFIX sollte über mehrere Minuten intravenös verabreicht werden. Ihr Arzt kann Ihre empfohlene Infusionsrate verändern, um die Infusion für Sie angenehmer zu machen.
BeneFIX nicht mit Infusionslösungen mischen oder als kontinuierliche Infusion («Tropf») verabreichen, da die Verwendung von BeneFIX als kontinuierliche Infusion nicht untersucht wurde.
Um Verletzungen zu vermeiden, nicht verwendete Lösung, leere Durchstechflaschen sowie verwendete Kanülen und Spritzen bitte in einem dafür vorgesehenen Behälter entsorgen.
|








