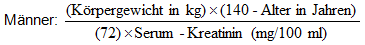ZusammensetzungWirkstoffe
Ertapenem als Ertapenem-Natrium.
Hilfsstoffe
Natriumhydrogencarbonat, Natriumhydroxid zur pH-Einstellung auf 7,5.
Jede Durchstechflasche enthält ca. 137 mg Natrium.
Indikationen/AnwendungsmöglichkeitenInvanz ist indiziert zur Behandlung von Patienten mit nachfolgenden mässigen bis schweren Infektionen, die durch empfindliche Mikroorganismen verursacht sind:
·Komplizierte intra-abdominale Infektionen
·Infektionen der Haut und Weichteile beim diabetischen Fuss nach Nachweis der mikrobiellen Empfindlichkeit des Erregers (siehe Tabelle der empfindlichen Erreger sowie Rubrik «Warnhinweise und Vorsichtsmassnahmen»)
·bei ambulant erworbener Pneumonie
·bei komplizierten Infektionen der Harnwege einschliesslich Pyelonephritis nach Nachweis der mikrobiellen Empfindlichkeit des Erregers (siehe Tabelle der empfindlichen Erreger)
·bei folgenden gynäkologischen Infektionen: postpartale Endometritis und septischem Abort. Hinweis: Bei gynäkologischen Infektionen sind häufig Chlamydien beteiligt, teilweise auch alleinige Ursache. Da Invanz nicht gegen Chlamydien wirksam ist, sollte Invanz in diesem Indikationsgebiet daher nur in Kombination mit einem gegen Chlamydien wirksamen, zusätzlichen Arzneimittel verwendet werden.
Offizielle Empfehlungen zum angemessenen Gebrauch von Antibiotika sollen beachtet werden, insbesondere Anwendungsempfehlungen zur Verhinderung der Zunahme der Antibiotikaresistenz.
Dosierung/AnwendungÜbliche Dosierung
Patienten ab 13 Jahren und älter
Die übliche Dosis für Patienten ab 13 Jahren und älter beträgt 1 Gramm (g) Invanz einmal täglich.
Kinder ab 3 Monaten bis 12 Jahren
Die übliche Dosis von Invanz bei 3 Monate bis 12 Jahre alten Patienten beträgt 15 mg/kg zweimal täglich (maximal 500 mg zweimal täglich).
Für Kinder unter 3 Monaten liegen keine Daten zur Wirksamkeit und Sicherheit von Invanz vor. Eine Anwendung in dieser Altersgruppe wird daher nicht empfohlen.
Invanz wird als intravenöse Infusion verabreicht. Invanz sollte über einen Zeitraum von 30 Minuten infundiert werden.
Normalerweise beträgt die Therapiedauer mit Invanz 3-14 Tage, wobei sie nach Art und Schwere der Infektion und den zugrunde liegenden Krankheitserregern entsprechend variieren kann (siehe «Indikationen/Anwendungsmöglichkeiten»). Wenn klinisch angezeigt, kann bei entsprechender Verbesserung des klinischen Befundes auf ein geeignetes orales Antibiotikum umgestellt werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit eingeschränkter Leberfunktion wird keine Dosisanpassung empfohlen (siehe «Pharmakokinetik, Kinetik spezieller Patientengruppen, Leberfunktionsstörungen»).
Patienten mit Nierenfunktionsstörungen
Erwachsene:
Invanz kann zur Behandlung von Infektionen bei erwachsenen Patienten mit Niereninsuffizienz eingesetzt werden. Bei Patienten mit einer Kreatinin-Clearance >30 ml/min/1,73 m2 ist keine Dosisanpassung erforderlich. Erwachsene Patienten mit einer fortgeschrittenen Niereninsuffizienz (Kreatinin-Clearance ≤30 ml/min/1,73 m2 einschliesslich Hämodialyse-Patienten) - sollten eine Tagesdosis von 0,5 g erhalten.
Wenn nur das Serum-Kreatinin zur Verfügung steht, kann die folgende Formel (Cockcroft) zur Bestimmung der Kreatinin-Clearance verwendet werden. Das Serum-Kreatinin sollte die Nierenfunktion im Steady-State widerspiegeln.
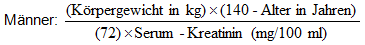
Frauen: (Wert für Männer) x (0,85)
Kinder und Jugendliche:
Es gibt keine Daten für Kinder und Jugendliche mit Niereninsuffizienz.
Hämodialyse-Patienten
Erwachsene:
Im Rahmen einer klinischen Studie wurden nach Gabe einer intravenösen Einzeldosis von 1 g, die unmittelbar vor einer Hämodialyse gegeben wurde, ca. 30 % der Dosis im Dialysat wieder gefunden. Wenn erwachsenen Hämodialyse-Patienten die empfohlene Tagesdosis von 500 mg Invanz innerhalb von 6 Stunden vor der Hämodialyse gegeben wird, wird eine zusätzliche Dosis von 150 mg nach der Hämodialyse empfohlen. Liegt die Gabe von Invanz bei Beginn der Hämodialyse länger als 6 Stunden zurück, ist keine zusätzliche Dosis erforderlich. Es liegen keine Daten von Patienten unter Peritonealdialyse oder Hämofiltration vor.
Kinder und Jugendliche:
Es gibt keine Daten für Kinder und Jugendliche mit Hämodialyse.
Ältere Patienten
In der empfohlenen Dosis ist für ältere Patienten (≥65 Jahre) im Allgemeinen keine Dosisanpassung erforderlich. Da Ertapenem jedoch überwiegend renal ausgeschieden wird und ältere Patienten öfter eine verminderte Nierenfunktion aufweisen, sollte das Vorhandensein einer fortgeschrittenen Niereninsuffizienz ausgeschlossen werden (siehe «Dosierung bei Patienten mit Nierenfunktionsstörungen», vgl. auch Altersabhängigkeit in Cockcroft Formel).
KontraindikationenErtapenem ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber einem der Bestandteile dieses Arzneimittels oder gegenüber anderen Arzneimitteln derselben Klasse sowie bei Patienten, die auf andere Beta-Laktam-Antibiotika bereits eine anaphylaktische Reaktion zeigten.
Warnhinweise und VorsichtsmassnahmenSchwere und gelegentlich auch letale Überempfindlichkeitsreaktionen (Anaphylaxie) wurden bei Patienten unter Behandlung mit Beta-Laktam-Antibiotika berichtet. Diese Reaktionen sind insbesondere bei Personen mit multiplen Allergien in der Anamnese zu erwarten. Es liegen einzelne Berichte von Patienten mit Penicillin-Überempfindlichkeit vor, die auf die Behandlung mit einem Beta-Laktam-Antibiotikum schwere Überempfindlichkeitsreaktionen zeigten. Vor Beginn der Behandlung mit Ertapenem ist eine sorgfältige Anamneseerhebung hinsichtlich einer früheren Überempfindlichkeitsreaktion auf Penicilline, Cephalosporine, andere Beta-Laktam-Antibiotika und sonstige Allergene einzuholen. Bei Auftreten einer allergischen Reaktion auf Ertapenem muss das Arzneimittel sofort abgesetzt werden. Schwerwiegende anaphylaktische Reaktionen erfordern sofortige Notfallmassnahmen.
Überempfindlichkeitsreaktionen können auch zum Kounis-Syndrom führen, einer schweren allergischen Reaktion, die in einem Myokardinfarkt enden kann. Zu den ersten Symptomen solcher Reaktionen können Brustschmerzen gehören, die in Verbindung mit einer allergischen Reaktion auf Beta-Lactam-Antibiotika auftreten.
Schwere kutane Arzneimittelreaktionen (SCAR) wie das Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), Erythema multiforme und akute generalisierte exanthematöse Pustulosis (AGEP) wurden bei Patienten unter Behandlung mit Beta-Laktam-Antibiotika, einschliesslich Ertapenem, berichtet (siehe auch «Unerwünschte Wirkungen»). Beim Auftreten solcher Reaktionen ist Invanz unverzüglich abzusetzen und eine Alternativtherapie ist in Erwägung zu ziehen.
Fallberichte in der Literatur haben gezeigt, dass die Ko-Administration von Carbapenemen einschliesslich Ertapenem bei Patienten, welche Valproinsäure oder Divalproex Natrium erhielten, eine Reduktion der Valproinsäurekonzentrationen zur Folge hatte. Als Resultat dieser Interaktion können die Valproinsäurekonzentrationen unterhalb des therapeutischen Bereiches fallen und damit das Risiko von «Breakthrough Seizures» erhöhen. Eine Erhöhung der Dosierung von Valproinsäure oder Divalproex Natrium ist möglicherweise nicht genügend, um dieser Interaktion erfolgreich entgegenzuwirken. Die gemeinsame Anwendung von Ertapenem und Valproinsäure/Divalproex Natrium wird im Allgemeinen nicht empfohlen. Es sollten andere Antibiotika anstelle von Carbapeneme zur Behandlung von Infektionen bei Patienten, deren Krampfanfälle unter Valproinsäure oder Divalproex Natrium gut kontrolliert sind, in Betracht gezogen werden. Wenn die Anwendung von Invanz notwendig ist, sollte eine zusätzliche antikonvulsive Therapie in Betracht gezogen werden (siehe «Interaktionen»).
Wie bei anderen Antibiotika kann die Langzeitbehandlung mit Ertapenem zu einem überschiessenden Wachstum nicht empfindlicher Erreger führen. Der Zustand des Patienten ist unbedingt wiederholt zu kontrollieren. Wenn eine Superinfektion während der Behandlung auftritt, sind entsprechende Massnahmen zu ergreifen. Der Einfluss von Ertapenem auf die Darmflora wurde nicht systematisch untersucht.
Eine pseudomembranöse Colitis wurde von praktisch allen Antibiotika einschliesslich Ertapenem berichtet; ihr Verlauf kann leicht bis lebensbedrohlich sein. Deshalb ist diese Diagnose unbedingt in Erwägung zu ziehen, wenn bei Patienten nach der Verabreichung von Antibiotika Durchfälle auftreten. Studien weisen darauf hin, dass ein von Clostridium difficile produziertes Toxin eine primäre Ursache für eine Antibiotika-assoziierte Colitis ist.
In klinischen Studien wurden bei erwachsenen Patienten, die mit Invanz (1 g einmal täglich) behandelt wurden, während der Studiendauer und einer 14-tägigen Nachbeobachtungsphase Krampfanfälle berichtet. Von diesen Ereignissen waren zumeist ältere Patienten, Patienten mit vorbestehenden ZNS-Erkrankungen (z.B. Hirnläsionen oder Krampfanfälle in der Anamnese) und/oder mit eingeschränkter Nierenfunktion betroffen. Nach Markteinführung wurden ähnliche Beobachtungen gemacht und zusätzlich verminderte Bewusstseinszustände verbunden mit Verlust der Spontanatmung und Notwendigkeit künstlicher Beatmung und ein Einzelfall von Koma. Bei Patienten mit relevanten ZNS-bezogenen unerwünschten Wirkungen soll eine geeignete neurologische Evaluation und medizinisches Management veranlasst werden und die Dosierung von Invanz erneut überprüft werden um zu entscheiden, ob diese verringert werden sollte oder Invanz abgesetzt werden sollte.
Invanz wird für Kinder unter 3 Monaten nicht empfohlen, weil keine Daten zur Wirksamkeit und Sicherheit verfügbar sind.
Die Wirksamkeit von Ertapenem bei Behandlung von Infektionen des diabetischen Fusses mit gleichzeitiger Osteomyelitis ist nicht nachgewiesen.
Invanz enthält ca. 137 mg Natrium pro Durchstechflasche, entsprechend 6,85% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
InteraktionenBei der gleichzeitigen Gabe mit Probenecid hemmt Probenecid die renale Ausscheidung von Ertapenem, da beide Substanzen um den gleichen aktiven tubulären Sekretionsmechanismus konkurrieren. Dies führt zu geringen, aber statistisch signifikanten Erhöhungen der systemischen Exposition (25%) und der Eliminations-Halbwertszeit (19%). Bei gleichzeitiger Anwendung mit Probenecid ist trotzdem keine Dosisanpassung erforderlich. Aufgrund des geringen Einflusses auf die Halbwertszeit wird die gleichzeitige Anwendung mit Probenecid zur Verlängerung der Halbwertszeit von Ertapenem nicht empfohlen.
In-vitro-Studien lassen darauf schliessen, dass Ertapenem den durch Glykoprotein P vermittelten Transport von Digoxin oder Vinblastin nicht hemmt und kein Substrat für den Glykoprotein P vermittelten Transport ist.
In-vitro-Studien an menschlichen Lebermikrosomen zeigen, dass Ertapenem kein Inhibitor der 6 Haupt-Isoformen des Cytochrom P450 (CYP) ist: 1A2, 2C9, 2C19, 2D6, 2E1 und 3A4. Wechselwirkungen mit Arzneimitteln, die aufgrund einer Hemmung der durch Glykoprotein P oder der durch CYP vermittelten Clearance von Arzneimitteln verursacht werden, sind unwahrscheinlich (siehe «Pharmakokinetik, Distribution, Metabolismus»).
Mit Ausnahme von Probenecid wurden keine spezifischen klinischen Interaktionsstudien durchgeführt.
Fallberichte in der Literatur haben gezeigt, dass die Ko-Administration von Carbapenemen einschliesslich Ertapenem bei Patienten, welche Valproinsäure oder Divalproex Natrium erhielten, eine Reduktion der Valproinsäurekonzentrationen zur Folge hatte. Als Resultat dieser Interaktion können die Valproinsäurekonzentrationen unterhalb des therapeutischen Bereiches fallen und damit das Risiko von «Breakthrough Seizures» erhöhen. Obwohl der Mechanismus dieser Interaktion nicht bekannt ist, lassen Daten von in vitro Studien und Studien an Tieren vermuten, dass Carbapeneme die Hydrolyse des Glukuronid Metaboliten der Valproinsäure (VPA-g) zurück zur Valproinsäure hemmen könnten und dadurch die Serumkonzentrationen der Valproinsäure erniedrigen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine kontrollierten Studien bei Schwangeren. Tierstudien ergaben keinen Hinweis auf direkte oder indirekte schädigende Wirkungen im Hinblick auf eine Schwangerschaft, die embryo-fetale Entwicklung, den Geburtsvorgang oder die postnatale Entwicklung.
Ertapenem sollte während der Schwangerschaft nur angewendet werden, wenn es unabdingbar ist.
Stillzeit
Ertapenem tritt in die Muttermilch über. Aufgrund möglicher unerwünschter Wirkungen auf den gestillten Säugling und unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter ist zu entscheiden, ob während der Behandlung nicht gestillt oder das Arzneimittel abgesetzt werden soll.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenSchwindel und Schläfrigkeit können auftreten (siehe «Unerwünschte Wirkungen») was bei einigen Patienten die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen kann.
Unerwünschte WirkungenErwachsene Patienten
Insgesamt wurden im Rahmen von klinischen Studien über 1'900 Patienten mit Ertapenem behandelt, von denen mehr als 1'850 Ertapenem in einer Dosierung von 1 g erhielten. Nebenwirkungen (d.h. vom Untersucher als möglicherweise, wahrscheinlich oder sicher arzneimittelbedingt bewertet) traten bei ca. 20% der mit Ertapenem behandelten Patienten auf. Bei 1,3% der Patienten kam es zu einem Abbruch der Therapie aufgrund von Nebenwirkungen.
Bei Patienten, die nur mit Invanz behandelt wurden, traten während der Therapie mit Invanz und einer 14-tägigen Nachbeobachtungsphase folgende Nebenwirkungen am häufigsten auf: Diarrhö (4,8%), Komplikationen an der Infusionsstelle (4,5%) und Übelkeit (2,8%). Die häufigsten beobachteten Laborveränderungen in dieser Population waren: Anstieg von ALT (Alaninaminotransferase) (4,6%), AST (Aspartataminotransferase) (4,6%), alkalischer Phosphatase (3,8%) und Thrombocytenzahl (3,0%). In vergleichenden Studien mit Piperacillin/Tazobactam wurde ein Neutrophilenabfall auf weniger als 1800/µl (oder auf weniger als 50% des Ausgangswertes, falls dieser weniger als 1800/µl betrug) bei 3,4% der Patienten unter Behandlung mit Ertapenem gemessen und damit 2,48-fach häufiger als unter Piperacillin/Tazobactam (1,4%, signifikant).
Darüber hinaus wurden in den genannten Studien die folgenden unerwünschten Wirkungen beobachtet:
Sehr häufig (≥1/10); häufig (≥1/100 bis <1/10); gelegentlich (≥1/1000 bis <1/100); selten (≥1/10'000 bis <1/1000); sehr selten (<1/10'000)
Infektionen und parasitäre Erkrankungen
Gelegentlich: Candidiasis, Pilzinfektion, Bakteriurie, Hefepilze im Urin, positiver Testbefund für Clostridium difficile-Toxin.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anstieg der Thrombozytenzahl.
Gelegentlich: Abnahme von Hämoglobin, Hämatokrit, Leukozyten, segmentkernigen neutrophilen Granulozyten und Thrombozyten, Anstieg der Leukozyten, der eosinophilen Granulozyten und der segmentkernigen neutrophilen Granulozyten; Anstieg der aktivierten partiellen Thromboplastinzeit (aPTT) (bei Kindern auch der Prothrombinzeit).
Selten: Neutropenie, Thrombozytopenie, Abnahme der Lymphozyten, Anstieg der Monozyten, der stabkernigen neutrophilen Granulozyten, der Myelozyten, der Metamyelozyten, der Lymphozyten und der atypischen Lymphozyten.
Erkrankungen des Immunsystems
Selten: allergische Reaktionen.
Post-Marketing Erfahrung: Anaphylaxie, einschliesslich anaphylaktoide Reaktionen (sehr selten).
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Anstieg der Serumglucose.
Selten: Hypoglykämie, Erniedrigung des Serum-Bikarbonats und Serumkaliums, Erhöhung des Serum-Phosphors und Serumkaliums.
Psychiatrische Erkrankungen
Gelegentlich: Verwirrtheit.
Selten: Unruhe, Angst, Depression.
Post-Marketing Erfahrung: Halluzinationen und veränderter mentaler Zustand (einschliesslich Unruhe, Aggression, Delirium, Desorientiertheit).
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Gelegentlich: Schwindel, Schläfrigkeit, Schlaflosigkeit, Krampfanfälle.
Selten: Tremor, Synkope.
Post-Marketing Erfahrung: Verminderter Bewusstseinszustand verbunden mit Verlust der Spontanatmung und der Notwendigkeit künstlicher Beatmung und ein Einzelfall von Koma; Dyskinesie, Myoklonus, Gangstörung, Enzephalopathie (die Erholung kann bei Patienten mit eingeschränkter Nierenfunktion verlängert sein).
Augenerkrankungen
Selten: Veränderungen an der Sklera.
Herzerkrankungen
Selten: Arrhythmie, Tachykardie.
Gefässerkrankungen
Häufig: Phlebitis/Thrombophlebitis.
Gelegentlich: Hypotonie.
Selten: Erhöhter Blutdruck, Blutungen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnö, Beschwerden im Rachen.
Selten: verstopfte Nase, Husten, Nasenbluten, Pneumonie, Rasselgeräusche, Giemen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhö, Übelkeit, Erbrechen.
Gelegentlich: Bauchschmerzen, Anorexie, Dyspepsie, Obstipation, Mundtrockenheit, Säurereflux, orale Candidiasis, pseudomembranöse Enterocolitis.
Selten: Dysphagie, Stuhlinkontinenz.
Post-Marketing Erfahrung: fleckige Zähne
Leber- und Gallenerkrankungen
Häufig: Transaminasenerhöhung (ALT, AST), Erhöhung der alkalischen Phosphatase.
Gelegentlich: Erhöhung des Gesamtbilirubins, des direkten Bilirubins und des indirekten Bilirubins im Serum.
Selten: Veränderungen der Leberfunktion, Cholecystitis, Ikterus, Erhöhung der Serum-LDH, Anstieg des Urobilinogens.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Ausschlag, Pruritus.
Gelegentlich: Erythem.
Selten: Dermatitis, Dermatomykose, Desquamation, postoperative Wundinfektion.
Post-Marketing Erfahrung: akute generalisierte exanthematische Pustulose (AGEP), Arzneimittelwirkung mit Eosinophilie und systemischen Symptomen (DRESS Syndrom), Urtikaria, Hypersensitivitätsvaskulitis. Weitere schwere kutane Arzneimittelreaktionen (SCAR) wurden bei Patienten berichtet, die mit Beta-Laktam-Antibiotika behandelt wurden (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Muskelkrämpfe, Schulterschmerzen.
Post-Marketing Erfahrung: Muskelschwäche
Erkrankungen der Nieren und Harnwege
Gelegentlich: Anstieg des Serum-Kreatinins und des Serumharnstoffs, vermehrter Nachweis von Epithelzellen, Erythrozyten und Leukozyten im Urin.
Selten: Harnwegsinfektion, Niereninsuffizienz, akute Niereninsuffizienz, Erniedrigung des Serum-Kreatinins.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Vaginitis.
Selten: Abort, genitale Blutungen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Komplikationen an der Infusionsstelle.
Gelegentlich: Extravasation, Asthenie/Müdigkeit, Fieber, Ödeme/Schwellungen, Schmerzen im Brustkorb, Geschmacksveränderungen.
Selten: Verhärtungen an der Infusionsstelle, Unwohlsein, Pelveoperitonitis.
Kinder und Jugendliche
In klinischen Studien wurden insgesamt 384 pädiatrische Patienten mit Ertapenem behandelt. Das Sicherheitsprofil bei pädiatrischen Patienten ist mit demjenigen bei Erwachsenen vergleichbar. Unerwünschte Ereignisse (d.h. die vom Untersuchenden als möglicherweise, wahrscheinlich oder eindeutig mit dem Arzneimittel zusammenhängend betrachtet wurden), wurden bei 20,8% der mit Ertapenem behandelten pädiatrischen Patienten beobachtet. Bei 0,5% der Patienten wurde die Therapie wegen unerwünschter Ereignisse abgebrochen.
Die häufigsten unerwünschten Wirkungen, welche bei pädiatrischen Patienten, die nur Invanz erhielten, während der Therapie und einer Nachbeobachtungszeit von 14 Tagen nach Therapieende beobachtet wurden, waren Schmerzen an der Infusionsstelle (6,1%) und Diarrhoe (5,2%).
Die häufigsten gemeldeten Laborveränderungen in dieser pädiatrischen Population waren: Anstieg von ALT (2,9%) und AST (2,8%) sowie ein Abfall der Neutrophilen (3,0%).
Es wurden bei pädiatrischen Patienten, die nur Invanz erhielten, während der Therapie und einer Nachbeobachtungszeit von 14 Tagen nach Therapieende die folgenden unerwünschten Ereignisse beobachtet:
Erkrankungen des Blutes und des Lymphsystems
Häufig: Abfall der Neutrophilen.
Gelegentlich: Anstieg der Thrombozyten, der aktivierten partiellen Thromboplastin-Zeit (aPTT) und der Prothrombin-Zeit, Abfall des Hämoglobins.
Psychiatrische Erkrankungen
Post-Marketing Erfahrung: Halluzinationen und veränderter mentaler Zustand (einschliesslich Aggression).
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerzen.
Gefässerkrankungen
Gelegentlich: Flush, Hypertonie, Petechien.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhoe.
Gelegentlich: Verfärbter Stuhl, Meläna.
Leber- und Gallenerkrankungen
Häufig: Anstieg von ALT und AST.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Windeldermatitis
Gelegentlich: Erythem, Ausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen an der Infusionsstelle.
Gelegentlich: Rötung, Wärmegefühl, Pruritus, Brennen an der Infusionsstelle.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs gibt keine spezifischen Informationen zur Behandlung einer Überdosierung mit Ertapenem. Eine absichtliche Überdosierung von Ertapenem ist unwahrscheinlich. Die intravenöse Gabe einer 3-g-Tagesdosis Ertapenem über 8 Tage bei erwachsenen Probanden führte zu keinen signifikanten toxischen Wirkungen. In klinischen Studien bei Erwachsenen führten unbeabsichtigt höhere Gaben von bis zu 3 g pro Tag nicht zu klinisch signifikanten Nebenwirkungen. Wie bei anderen beta-Laktamen muss bei Überdosierung von Ertapenem mit dem Auftreten von cerebralen Krampfanfällen gerechnet werden. In klinischen Studien bei Kindern und Jugendlichen bewirkte eine einzelne IV-Dosis von 40 mg/kg bis zu maximal 2 g keine Toxizität.
Im Fall einer Überdosierung ist Ertapenem abzusetzen und allgemeine unterstützende Massnahmen sind zu ergreifen, bis Ertapenem renal ausgeschieden ist.
Ertapenem ist hämodialysierbar; es gibt jedoch keine Daten über den Einsatz der Hämodialyse zur Behandlung der Überdosierung.
Eigenschaften/WirkungenATC-Code
J01DH03 (Carbapenem, Ertapenem)
Wirkungsmechanismus
Invanz (Ertapenem zur Injektion) ist ein steriles, synthetisches langwirksames, parenterales 1-β-Methylcarbapenem, das mit Betalaktam-Antbiotika wie Penicillinen und Cephalosporinen strukturverwandt ist. Ertapenem ist in vitro wirksam gegen ein breites Spektrum von grampositiven und gramnegativen aeroben und anaeroben Bakterien. Die bakterizide Wirkung von Ertapenem beruht auf einer Hemmung der Zellwandsynthese infolge einer Bindung von Ertapenem an Penicillin-bindende Proteine (PBPs). Bei Escheria coli hat es eine hohe Affinität zu den PBPs 1a, 1b, 2, 3, 4, und 5, vorzugsweise zu den PBPs 2 und 3. Ertapenem weist eine hohe Stabilität gegen die Hydrolyse durch die meisten Beta-Laktamase-Klassen auf, nämlich Penicillin- und Cephalosporinasen, sowie Beta-Laktamasen mit erweitertem Spektrum (ESBL) mit Ausnahme der Metallo-Beta-Laktamasen.
Pharmakodynamik
Mikrobiologische Empfindlichkeit
Die Clinical and Laboratory Standards Institute (CLSI) MHK Grenzwerte sind wie folgt:
·Enterobacteriaceae und Staphylokokken: S ≤2 mg/l und R ≥8 mg/l
·S. pneumoniae: S ≤1 mg/l und R ≥4 mg/l
·Streptococcus spp. (nur beta-hämolytisch): S ≤1 mg/l
·Haemophilus spp.: S ≤0,5 mg/l
·Anaerobier: S ≤4 mg/l und R ≥16 mg/l
(Bemerkung: Die Breakpoints für Staphylococci und S. pneumoniae beziehen sich nur auf methicillin-empfindliche Staphylokokken bzw. penicillin-empfindliche Pneumokokken.)
Das Vorkommen von Resistenzen kann bei bestimmten Spezies geographisch schwanken und sich mit der Zeit verändern, weshalb lokale Resistenzdaten wünschenswert sind, insbesondere bei der Behandlung schwerer Infektionen. Die unten stehende Tabelle kann nur einen Anhalt für die Wahrscheinlichkeit geben, ob die Mikroorganismen Ertapenem-sensibel sein werden oder nicht.
Antibakterielles Spektrum
Mikroorganismen gegen die Invanz in vitro wirksam ist:
Tabelle 1:
|
Organismus
|
Ertapenem
| |
MHK90 µg/ml
| |
Empfindliche Organismen
| |
Gram-Positive Aerobier
| |
Staphylococcus aureus (MET S)*
|
0,25
| |
Staphylococcus, Koagulase-negativ (MET S)
|
2
| |
Streptococcus agalactiae*
|
0,06
| |
Streptococcus pneumoniae (PEN S)*
|
0,03
| |
Streptococcus pyogenes*
|
0,016
| |
Viridans streptococci
|
2
| |
Gram-Negative Aerobier
| |
Citrobacter freundii
|
0,25
| |
Enterobacter aerogenes
|
0,5
| |
Enterobacter cloacae
|
1
| |
Escherichia coli (ESBL +)
|
0,25
| |
Escherichia coli* (ESBL -)
|
0,016
| |
Haemophilus influenzae*
|
0,06
| |
Haemophilus parainfluenzae
|
0,125
| |
Klebsiella oxytoca
|
0,03
| |
Klebsiella pneumoniae (ESBL +)
|
0,25
| |
Klebsiella pneumoniae* (ESBL -)
|
0,016
| |
Moraxella catarrhalis*
|
0,016
| |
Morganella morganii
|
0,06
| |
Proteus mirabilis*
|
0,03
| |
Proteus vulgaris
|
0,125
| |
Serratia marcescens
|
0,25
| |
Anaerobier
| |
Bacteroides fragilis*
|
2
| |
Clostridium spp. (ohne C. difficile)*¹
|
2
| |
Eubacterium spp.*²
|
2
| |
Fusobacterium spp.³
|
2
| |
Peptostreptococcus spp.*4
|
0,5
| |
Porphyromonas asaccharolytica*
|
0,03
| |
Prevotella spp.*5
|
0,25
| |
Resistente Organismen
| |
Gram-Positive Aerobier
| |
Corynebacterium jeikeium
|
>32
| |
Enterococcus faecalis
|
16
| |
Enterococcus faecium
|
64
| |
Staphylococcus aureus (MET R)
|
32
| |
Staphylococcus epidermidis (MET R)
|
32
| |
Staphylococcus, Koagulase-negativ (MET R)
|
>16
| |
Gram-Negative Aerobier
| |
Aeromonas hydrophila
|
16
| |
Acinetobacter spp.6
|
16
| |
Burkholderia cepacia
|
32
| |
Pseudomonas aeruginosa
|
>16
| |
Stenotrophomonas maltophilia
|
32
| |
Anaerobier
| |
Lactobacillus spp.7
|
32
| |
Andere:
| |
Chlamydia spp.
Mycoplasma spp.
Rickettsia spp.
Legionella spp.
|
|
MHK = Minimale Hemmkonzentration
MET R = Methicillin resistent
MET S = Methicillin empfindlich
PEN S = Penicillin empfindlich
ESBL - = Beta-Laktamasen mit erweitertem Spektrum - nicht produzierende
ESBL + = Beta-Laktamasen mit erweitertem Spektrum - produzierende
* Klinische Wirksamkeit wurde für empfindliche Isolate in den genehmigten klinischen Indikationen gezeigt.
1 einschliesslich Clostridium bifermentans, C. butyricum, C. cadaveris, C. clostridioforme, C. innocuum, C. perfringens, C. ramosum, C. symbiosum, C. tertium und Clostridium spp.
2 einschliesslich Eubacterium lentum und Eubacterium spp.
3 einschliesslich Fusobacterium gonidiaformans, F. mortiferum, F. naviforme, F. necrophorum, F. russii, F. varium, F. nucleatum, Fusobacterium spp.
4 einschliesslich Peptostreptococcus anaerobius, P. asaccharolyticus, P. magnus, P. micros, P. prevotii, P. tetradius, Peptostreptococcus spp.
5 einschliesslich Prevotella bivia, P. corporis, P. disiens, P. enoeca, P. heparinolytica, P. melaninogenica, P. oralis, P. oris, Prevotella spp.
6 einschliesslich Acinetobacter anitratus, A. baumannii, A. lwoffii, und Acinetobacter spp.
7 Lactobacillus Organismen wurden nicht spezifiziert.
Bei Bakterienstämmen, die als Ertapenem-sensibel gelten, war in Surveillancestudien in Europa selten eine Resistenz zu beobachten. Von den resistenten Isolaten zeigten einige, wenn auch nicht alle eine Resistenz gegen andere Substanzen der Carbapenem-Klasse. Enterobacteriaceae, die aufgrund der Produktion von Cephalosporinasen und/oder ESBL gegen Cephalosporine oder Breitspektrum-Betalactam-Antibiotika resistent sind, sind im Allgemeinen gegen Ertapenem empfindlich.
Der Wirkmechanismus von Ertapenem unterscheidet sich von dem anderer Antibiotika-Klassen wie z.B. Chinolonen, Aminoglykosiden, Makroliden und Tetrazyklinen. Zwischen Ertapenem und diesen Substanzen gibt es keine Kreuzresistenz durch Veränderung der Zielstruktur.
Erreger können auf mehr als eine Antibiotikaklasse resistent sein, wenn der Mechanismus auf Permeabilitätsbarrieren und/oder einem Effluxpumpenmechanismus beruht oder einen solchen einschliesst.
Wie bei jeder Antibiotikatherapie sind die epidemiologischen Daten zur Resistenzsituation der vermuteten Erreger zu berücksichtigen, wenn das Antibiotikum empirisch eingesetzt wird.
Empfindlichkeitstests
Dilutionstest
Zur Bestimmung der minimalen antibiotischen Hemmkonzentrationen (MHK) wurden quantitative Methoden verwendet. Diese MHK erlauben die Einschätzung der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Substanzen. Die MHK-Werte sollten mit einer Standardmethode bestimmt werden. Standardmethoden basieren auf einem Dilutionstest (Bouillon oder Agar), wie demjenigen des Clinical and Laboratory Standards Institute (CLSI) oder äquivalenten Tests mit Standard-Inoculum-Konzentrationen und Standardkonzentrationen von Ertapenem.
Diffusionstest
Quantitative Methoden basierend auf der Messung von Zonendurchmessern ergeben reproduzierbare Angaben zur Empfindlichkeit der Bakterien gegen antibakterielle Substanzen. Eine dieser Standardmethoden des CLSI erfordert die Verwendung von Standard-Inoculum-Konzentrationen. Bei dieser Methode werden Ertapenem-Disks mit 10 µg Ertapenem verwendet.
Anaerobe Methoden
Für Anaerobier kann die Empfindlichkeit gegen Ertapenem mit einer Standardmethode (CLSI) ermittelt werden.
Klinische Wirksamkeit
Erwachsene
Ertapenem wurde bei Erwachsenen in einer klinischen Studie zur Behandlung komplizierter intra-abdominaler Infektionen evaluiert. In dieser Studie an 665 Patienten wurde Ertapenem (1 g IV einmal täglich) mit Piperacillin/Tazobactam (3,375 g IV alle 6 Stunden) während 5 bis 14 Tagen verglichen. 1 bis 2 Wochen nach Therapieende waren die klinischen und mikrobiologischen Erfolgsraten 89,6% (190/212) für Ertapenem und 82,7% (162/196) für Piperacillin/Tazobactam. 4 bis 6 Wochen nach Therapieende (Überprüfung der Heilung) waren die Erfolgsraten 86,7% (176/203) für Ertapenem und 81,3% (157/193) für Piperacillin/Tazobactam.
Ergänzend wurde eine zweite randomisierte klinische Multizenterdoppelblindstudie bei komplizierten intra-abdominaler Infektion durchgeführt. Diese Studie verglich ebenfalls Ertapenem (1 g IV einmal täglich) mit Piperacillin/Tazobactam (3,375 g IV alle 6 Stunden) bei 500 Patienten. Bei der mikrobiologisch evaluierbaren Population waren die klinischen Erfolgsraten 2 Wochen nach Therapieende 82,0% (100/122) für Ertapenem und 81,3% (87/107) für Piperacillin/Tazobactam und 4-6 Wochen nach Therapieende 78,6% (88/112) für Ertapenem und 78,7% (74/94) für Piperacillin/Tazobactam.
Ertapenem wurde in einer randomisierten, kontrollierten klinischen Studie an 586 erwachsenen Patienten zur Behandlung von Infektionen bei diabetischem Fuss untersucht. Es wurde Ertapenem (einmal täglich 1 g i.v.) mit Piperacillin/Tazobactam (alle 6 Stunden 3,375 g i.v.) verglichen. Beide Therapieregime liessen die Möglichkeit zu, nach minimal 5 Tagen intravenöser Behandlung auf eine orale Therapie mit Amoxicillin/Clavulansäure umzustellen, mit einer Gesamtbehandlungsdauer von 5-28 Tage (parenteral und oral). Die klinische Erfolgsrate lag 10 Tage nach Therapieende bei 87,4% (180/206) für Ertapenem und 82,7% (162/196) für Piperacillin/Tazobactam.
Ertapenem wurde in 2 klinischen Studien an insgesamt 866 erwachsenen Patienten mit ambulant erworbener Pneumonie untersucht. In beiden Studien wurde Ertapenem (1 g parenteral einmal täglich) mit Ceftriaxon (1 g parenteral einmal täglich) verglichen. Beide Therapieregime liessen die Option zu, auf oral verabreichtes Amoxicillin/Clavulansäure umzustellen mit einer Gesamtbehandlungsdauer von 10 – 14 Tagen (parenteral und oral). Die klinischen Erfolgsraten (kombiniert für beide Studien) lagen 7-14 Tage nach Therapieabschluss (Überprüfung der Heilung) bei 92,0% (335/364) für Ertapenem und bei 91,8% (270/294) für Ceftriaxon.
Ertapenem wurde in 2 klinischen Studien an insgesamt 850 erwachsenen Patienten mit komplizierten Harnwegsinfektionen einschliesslich Pyelonephritis untersucht. In beiden Studien wurde Ertapenem (1 g parenteral einmal täglich) mit Ceftriaxon (1 g parenteral einmal täglich) verglichen. Beide Therapieregime liessen die Option zu, auf oral verabreichtes Ciprofloxacin (500 mg zweimal täglich) umzustellen mit einer Gesamtbehandlungsdauer von 10–14 Tagen (parenteral und oral). Die mikrobiologischen Erfolgsraten (kombiniert für beide Studien) lagen 5–9 Tage nach Therapieabschluss (Überprüfung der Heilung) bei 89,5% (229/259) für Ertapenem und bei 91,1% (204/224) für Ceftriaxon.
Ertapenem wurde in einer klinischen Studie an insgesamt 412 erwachsenen Patienten mit akuten Infektionen des Beckenraumes, darunter 350 Patientinnen mit natalen/postnatalen Infektionen und 45 Patientinnen mit septischem Abort, untersucht. In dieser Studie wurde Ertapenem (1 g intravenös einmal täglich) mit Piperacillin/Tazobactam (3,375 g intravenös alle 6 Stunden) über 3-10 Tage verglichen. Die klinischen Erfolgsraten 2-4 Wochen nach Therapieabschluss (Überprüfung der Heilung) lagen bei 93,9% (153/163) für Ertapenem und bei 91,5% (140/153) für Piperacillin/Tazobactam.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Ertapenem wurde auch in zwei randomisierten klinischen Multizenterstudien bei Kindern und Jugendlichen im Alter von 3 Monaten bis 17 Jahren evaluiert.
Die erste Studie umfasste 404 Patienten und verglich Ertapenem (15 mg/kg IV alle 12 Stunden bei 3 Monate bis 12 Jahre alten Patienten bzw. 1 g IV täglich bei 13 bis 17 Jahre alten Patienten) mit Ceftriaxone (50 mg/kg IV in zwei Dosen pro Tag bei 3 Monate bis 12 Jahre alten Patienten und 50 mg/kg pro Tag IV als tägliche Einzeldosis bei 13 bis 17 Jahre alten Patienten) für die Behandlung komplizierter Infektionen der ableitenden Harnwege (UTI), Haut- und Bindegewebsinfektionen (SSTI) oder ambulant erworbener Pneumonien (CAP). Bei beiden Therapieoptionen bestand die Möglichkeit, für bis zu 14 Behandlungstage auf Amoxicillin/Clavulanat (parenteral und oral) zu wechseln. Die mikrobiologischen Erfolgsraten in der nach Protokoll evaluierbaren Population (EPP) betrug bei den Patienten mit UTI 87,0% (40/46) für Ertapenem und 90,0% (18/20) für Ceftriaxone. Die klinischen Erfolgsraten in der EPP-Analyse bei Patienten mit SSTI betrugen 95,5% (64/67) für Ertapenem und 100% (26/26) für Ceftriaxone, und bei Patienten mit CAP 96,1% (74/77) für Ertapenem und 96,4% (27/28) für Ceftriaxone.
Die zweite Studie umfasste 112 Patienten und verglich Ertapenem (15 mg/kg IV alle 12 Stunden bei 3 Monate bis 12 Jahre alten Patienten und 1 g IV einmal täglich bei 13 bis 17 Jahre alten Patienten) mit Ticarcillin/Clavulanate (50 mg/kg bei <60 kg oder 3,0 g bei >60 kg schweren Patienten, 4 oder 6 Mal täglich) bis zu 14 Tage für die Behandlung komplizierter intra-abdominaler Infektionen (IAI) und akuter Beckeninfektionen (API). Bei Patienten mit IAI (vorrangig Patienten mit perforierter oder komplizierter Appendizitis) betrugen die klinischen Erfolgsraten 83,7% (36/43) für Ertapenem und 63,6% (7/11) für Ticarcillin/Clavulanat in der EPP-Analyse. Bei Patienten mit API (postoperative oder spontane Geburts-Endomyometritis oder septischer Abort) betrugen die klinischen Erfolgsraten 100% (23/23) für Ertapenem und 100% (4/4) für Ticarcillin/Clavulanat in der EPP-Analyse.
PharmakokinetikDistribution
Ertapenem weist eine starke Bindung an menschliche Plasmaproteine auf. Bei jungen gesunden Erwachsenen nahm die Proteinbindung von Ertapenem mit zunehmenden Plasmakonzentrationen von ca. 95% Bindung bei einer Plasmakonzentration von <100 Mikrogramm/ml auf ca. 85% Bindung bei einer ungefähren Plasmakonzentration von ca. 300 Mikrogramm/ml ab.
Die durchschnittlichen Plasmakonzentrationen von Ertapenem nach einer 30-minütigen Infusion einer Einzeldosis von 1 oder 2 g bei jungen gesunden Erwachsenen sind in Tabelle 2 dargestellt.
Tabelle 2:
Plasmakonzentration von Ertapenem nach Gabe einer Einzeldosis
|
Dosis
|
Mittlere Plasmakonzentration (Mikrogramm/ml)
| |
|
0,5 Std.
|
1 Std.
|
2 Std.
|
4 Std.
|
6 Std.
|
8 Std.
|
12 Std.
|
18 Std.
|
24 Std.
| |
1 g i.v.*
|
155
|
115
|
83
|
48
|
31
|
20
|
9
|
3
|
1
| |
2 g i.v.*
|
283
|
202
|
145
|
86
|
58
|
36
|
16
|
5
|
2
|
* Intravenöse Dosen wurden mit konstanter Geschwindigkeit über 30 Minuten infundiert.
Die Fläche unter der Plasmakonzentrationskurve (AUC) von Ertapenem bei Erwachsenen nimmt in einem Dosisbereich von 0,5-2 g nahezu proportional zur Dosis zu.
Nach mehrfach verabreichten intravenösen Dosen von 0,5-2 g täglich erfolgt bei Erwachsenen keine Kumulation von Ertapenem.
Die durchschnittlichen Plasmakonzentrationen (µg/ml) von Ertapenem bei Kindern und Jugendlichen sind in der Tabelle 3 angegeben.
Tabelle 3:
Plasmakonzentration von Ertapenem bei pädiatrischen Patienten nach Einzeldosis IV*
|
Alter (Dosis)
|
Durchschnittliche Plasmakonzentration (µg/ml)
| |
0,5 Std.
|
1 Std.
|
2 Std.
|
4 Std.
|
6 Std.
|
8 Std.
|
12 Std.
|
24 Std.
| |
3-23 Monate
| |
(15 mg/kg)†
|
103,8
|
57,3
|
43,6
|
23,7
|
13,5
|
8,2
|
2,5
|
-
| |
(20 mg/kg)†
|
126,8
|
87,6
|
58,7
|
28,4
|
-
|
12,0
|
3,4
|
0,4
| |
(40 mg/kg)‡
|
199,1
|
144,1
|
95,7
|
58,0
|
-
|
20,2
|
7,7
|
0,6
| |
2-12 Jahre
| |
(15 mg/kg)†
|
113,2
|
63,9
|
42,1
|
21,9
|
12,8
|
7,6
|
3,0
|
-
| |
(20 mg/kg)†
|
147,6
|
97,6
|
63,2
|
34,5
|
-
|
12,3
|
4,9
|
0,5
| |
(40 mg/kg)‡
|
241,7
|
152,7
|
96,3
|
55,6
|
-
|
18,8
|
7,2
|
0,6
| |
13-17 Jahre
| |
(20 mg/kg)†
|
170,4
|
98,3
|
67,8
|
40,4
|
-
|
16,0
|
7,0
|
1,1
| |
(1 g)§
|
155,9
|
110,9
|
74,8
|
-
|
24,0
|
-
|
6,2
|
-
| |
(40 mg/kg)‡
|
255,0
|
188,7
|
127,9
|
76,2
|
-
|
31,0
|
15,3
|
2,1
|
* IV Dosen wurden konstant über 30 Minuten infundiert.
† bis zur Maximaldosis von 1 g/Tag
‡ bis zur Maximaldosis von 2 g/Tag
§ Basiert auf 3 Patienten aus 2 Sicherheits- und Wirksamkeitsstudien, die sich für eine pharmakokinetische Evaluation zur Verfügung stellten und 1 g Ertapenem erhielten.
Das Verteilungsvolumen (Vdss) von Ertapenem beträgt 8,6 bis 8,9 Liter bei Männern und 7,0 bis 7,5 Liter bei Frauen, ungefähr 0,2 Liter/kg bei 3 Monate bis 12 Jahre alten Kindern und ungefähr 0,16 Liter/kg bei 13 bis 17 Jahre alten Kindern und Jugendlichen.
Ertapenem penetriert in soginduzierte Hautblasen. Die Ertapenem-Konzentrationen, die in der Blasenflüssigkeit am 3. Tag nach einer intravenös verabreichten Dosis von 1 g einmal täglich bei allen Probenentnahmezeitpunkten erreicht wurden, sind in Tabelle 4 dargestellt. Das Verhältnis der AUC der Blasenflüssigkeit zur AUC im Plasma beträgt 0,61.
Tabelle 4:
Ertapenem-Konzentrationen (Mikrogramm/ml) bei Erwachsenen in der Blasenflüssigkeit bei allen Probenerhebungen am 3. Tag nach intravenös verabreichten Dosen von 1 g einmal täglich
|
0,5 Std.
|
1 Std.
|
2 Std.
|
4 Std.
|
8 Std.
|
12 Std.
|
24 Std.
| |
7
|
12
|
17
|
24
|
24
|
21
|
8
|
Metabolismus
Bei jungen gesunden Erwachsenen entsprach nach intravenöser Gabe einer radioaktiv markierten Dosis von 1 g Ertapenem 94% der Radioaktivität im Plasma unverändertem Ertapenem. Der Hauptmetabolit von Ertapenem entsteht durch Hydrolyse des Beta-Laktam-Ringes in der Niere.
Elimination
Ertapenem wird vorwiegend über die Nieren ausgeschieden. Die Plasmahalbwertszeit bei jungen gesunden Erwachsenen und 13 bis 17 Jahre alten Patienten beträgt bei Frauen ca. 3,5 Stunden, bei Männern ca. 4,2 Stunden und bei 3 Monate bis 12 Jahre alten Kindern ungefähr 2,5 Stunden.
Nach intravenöser Gabe einer radioaktiv markierten Dosis von 1 g Ertapenem an junge gesunde Erwachsene wurden ca. 80% im Urin und 10% in den Fäzes wieder gefunden; von den 80% der im Urin wieder gefundenen Dosis wurden ca. 38% unverändert und ca. 37% in Form des Hauptmetaboliten ausgeschieden.
Nach intravenöser Gabe einer 1-g-Dosis an junge gesunde Erwachsene lagen die durchschnittlichen Ertapenem-Konzentrationen im Urin 0-2 Stunden nach Infusion über 985 Mikrogramm/ml und in der Zeit von 12-24 Stunden nach Infusion über 52 Mikrogramm/ml.
Kinetik spezieller Patientengruppen
Geschlecht
Die Plasmakonzentrationen von Ertapenem sind bei Männern und Frauen leicht unterschiedlich, was aber klinisch unbedeutend ist (höhere Cmax und kürzere t1/2 bei Frauen bei höherer renaler Clearance von Frauen).
Leberfunktionsstörungen
Die Pharmakokinetik von Ertapenem bei Patienten mit Leberinsuffizienz wurde nicht untersucht. Da der Abbau von Ertapenem durch die Leber sehr gering ist, ist bei Patienten mit eingeschränkter Leberfunktion keine wesentliche Beeinträchtigung der Pharmakokinetik von Ertapenem zu erwarten (siehe «Dosierung/Anwendung»).
Nierenfunktionsstörungen
Nach Einzeldosis
Nach intravenöser Gabe einer Einzeldosis von 1 g Ertapenem an Erwachsene sind die AUCs der Gesamtkonzentration von Ertapenem (gebunden und ungebunden) und des ungebundenen Ertapenem von Patienten mit leichter Niereninsuffizienz (Kreatinin-Clearance 60-90 ml/min/1,73 m2) mit jenen von gesunden Erwachsenen (25-82 Jahre) vergleichbar. Bei mässiger Niereninsuffizienz (Kreatinin-Clearance 31-59 ml/min/1,73 m2) sind die AUCs für Gesamt-Ertapenem bzw. ungebundenes Ertapenem ca. 1,5mal bzw. 1,8mal höher als jene von gesunden Erwachsenen. Bei Patienten mit fortgeschrittener Niereninsuffizienz (Kreatinin-Clearance 5-30 ml/min/1,73 m2) sind die AUCs der Gesamtkonzentration bzw. des ungebundenen Ertapenem ca. 2,6 mal bzw. 3,4 mal höher als jene von gesunden Erwachsenen. Bei hämodialysepflichtigen Patienten sind die AUCs der Gesamtkonzentration bzw.- des ungebundenen Ertapenem zwischen den Dialysebehandlungen ca. 2,9mal bzw. 6,0mal höher als jene von gesunden Erwachsenen (siehe «Dosierung/Anwendung»).
Nach Mehrfachdosierung
Die Pharmakokinetik im Steady State nach intravenöser Mehrfachdosierung bei Niereninsuffizienz wurde nicht untersucht. Eine Akkumulation von Ertapenem bei diesen Patienten kann nicht ausgeschlossen werden.
Es gibt keine Daten für Kinder und Jugendliche mit Niereninsuffizienz.
Ältere Patienten
Die Plasmakonzentrationen von Ertapenem liegen bei älteren Erwachsenen (≥65 Jahre) nach intravenöser Gabe einer Dosis von 1 g oder 2 g etwas höher (ca. 39% bzw. 22%) als bei jüngeren Erwachsenen (<65 Jahre) (siehe «Dosierung/Anwendung, Ältere Patienten»).
Kinder und Jugendliche
Die Plasmakonzentrationen bei 13 bis 17 Jahre alten Kindern und Jugendlichen sind mit denjenigen von Erwachsenen nach einer einmaligen IV-Tagesdosis von 1 g vergleichbar.
Nach einer Dosis von 20 mg/kg (bis zu einer Maximaldosis von 1 g) waren die pharmakokinetischen Parameterwerte bei 13 bis 17 Jahre alten Patienten im Allgemeinen mit denjenigen von gesunden jungen Erwachsenen vergleichbar. Drei von sechs 13 bis 17 Jahre alten Patienten erhielten weniger als eine 1 g-Dosis. Um eine Schätzung der pharmakokinetischen Daten für den Fall zu erlangen, dass alle Patienten dieser Altersgruppe eine Dosis von 1 g erhalten würden, wurden die pharmakokinetischen Daten rechnerisch an eine 1 g-Dosis angepasst, wobei Linearität angenommen wurde. Ein Vergleich der Ergebnisse zeigt, dass eine tägliche Dosis von 1 g Ertapenem bei 13 bis 17 Jahre alten Patienten ein pharmakokinetisches Profil erzielt, das mit demjenigen von Erwachsenen vergleichbar ist. Die Verhältnisse (13 bis 17 Jahre im Vergleich zu Erwachsenen) für AUC, die Konzentration unmittelbar am Ende der Infusion und die Konzentration in der Mitte des Dosierungsintervalls waren 0,99, 1,20, beziehungsweise 0,84.
Die Plasmakonzentrationen in der Mitte des Dosierungsintervalls nach einer einzelnen IV-Dosis von 15 mg/kg Ertapenem bei 3 Monate bis 12 Jahre alten Patienten sind mit den Plasmakonzentrationen in der Mitte des Dosierungsintervalls nach einer täglichen IV-Dosis von 1 g bei Erwachsenen vergleichbar (siehe «Distribution»). Die Plasmaclearance (ml/min/kg) von Ertapenem bei 3 Monate bis 12 Jahre alten Patienten ist im Vergleich zu derjenigen von Erwachsenen um ungefähr das Zweifache höher. Bei der 15 mg/kg-Dosis war der AUC-Wert (verdoppelt, um eine zweimalige tägliche Dosierung zu modellieren, d.h. Einwirkung 30 mg/kg/Tag) bei 3 Monate bis 12 Jahre alten Patienten vergleichbar mit dem AUC-Wert von jungen, gesunden Erwachsenen, die eine 1 g IV-Dosis Ertapenem erhalten.
Präklinische DatenBasierend auf den konventionellen Studien zur Sicherheit, Pharmakologie, chronischen Toxizität, Genotoxizität, Mutagenität und Reproduktionstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Es wurden keine tierexperimentellen Langzeitstudien zur Untersuchung des kanzerogenen Potenzials von Ertapenem durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien mit Invanz vorliegen, darf es unter keinen Umständen mit anderen Arzneimitteln oder anderen Infusionslösungen gemischt werden. Für die Rekonstitution und Applikation von Ertapenem dürfen keine Lösungsmittel oder Infusionslösungen verwendet werden, welche Alpha-D-Glukose (Dextrose) enthalten.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Rekonstituierte Lösung (Stammlösung) und Infusionslösung: Die rekonstituierte Lösung (Stammlösung) wird sofort mit 0,9%iger (isotonischer) Natriumchloridlösung verdünnt (siehe «Hinweise für die Handhabung») und kann anschliessend bei Raumtemperatur (25°C) aufbewahrt und innerhalb von 6 Stunden verwendet werden oder 24 Stunden lang bei 2-8°C (im Kühlschrank) aufbewahrt und innerhalb von 4 Stunden nach Entnahme aus dem Kühlschrank verwendet werden.
Invanz Lösungen nicht einfrieren. Gefrorene Lösungen verwerfen.
Besondere Lagerungshinweise
Vor Auflösung: Bei Raumtemperatur (15-25°C) lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Invanz wird als intravenöse Infusion verabreicht. Es sollte über einen Zeitraum von 30 Minuten infundiert werden.
13 Jahre alte und ältere Patienten:
Vorbereitung zur intravenösen Anwendung:
Invanz muss vor der Anwendung aufgelöst und sofort verdünnt werden.
1.Lösen Sie den Inhalt einer 1-g-Durchstechflasche Invanz mit 10 ml eines der folgenden Lösungsmittel auf: Wasser für Injektionszwecke, 0,9%ige (isotonische) Natriumchloridlösung oder konservierungsmittelhaltiges Wasser für Injektionszwecke (0,1 g/ml Ertapenem).
2.Zum Auflösen gut schütteln und den Inhalt der Durchstechflasche sofort in 50 ml 0,9%ige isotonische Natriumchloridlösung transferieren.
3.Die Infusion ist innerhalb von 6 Stunden nach Auflösung durchzuführen.
3 Monate bis 12 Jahre alte Kinder:
Vorbereitung zur intravenösen Anwendung:
Invanz muss vor der Anwendung aufgelöst und sofort verdünnt werden.
1.Lösen Sie den Inhalt einer 1-g-Durchstechflasche Invanz mit 10 ml eines der folgenden Lösungsmittel auf: Wasser für Injektionszwecke, 0,9%ige (isotonische) Natriumchloridlösung oder konservierungsmittelhaltiges Wasser für Injektionszwecke (0,1 g/ml Ertapenem).
2.Zum Auflösen gut schütteln und sofort ein Volumen entsprechend 15 mg/kg Körpergewicht (nicht über 500 mg zweimal täglich) entnehmen und in 0,9%iger isotonischer Natriumchloridlösung bis zu einer Endkonzentration von 20 mg/ml oder weniger verdünnen.
3.Die Infusion ist innerhalb von 6 Stunden nach Auflösung durchzuführen.
Parenteral anzuwendende Arzneimittel sind vor Gebrauch auf sichtbare Partikel oder Verfärbung zu prüfen. Invanz Lösungen sind farblos bis blassgelb. Farbschwankungen innerhalb dieser Palette beeinträchtigen die Wirksamkeit dieses Arzneimittels nicht.
Zulassungsnummer55902 (Swissmedic).
PackungenInvanz 1 g: 15 ml Typ I-Glasdurchstechflaschen mit einem grauen Butylstopfen und einer weissen Plastikkappe mit einem goldfarbenen Aluminiumstreifen als Siegel, für die Einmalverwendung.
Packungen zu 1 Durchstechflasche. (A)
ZulassungsinhaberinMSD MERCK SHARP & DOHME AG, Luzern.
Stand der InformationJuli 2025
Implementation HMV4/RCN000024665-CH
|