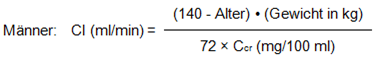ZusammensetzungWirkstoffe
Fluconazolum.
Hilfsstoffe
Kapseln 50 mg: Lactosum monohydricum 16.6 mg, Cellulosum microcristallinum, Maydis amylum pregelificatum, Silica colloidalis anhydrica, Magnesii stearas, Natrii laurilsulfas (=0.014 mg Natrium), Titanii dioxidum (E 171), Chinolingelb (E 104), Ferri oxidum flavum (E 172), Patentblau V (E 131), Gelatina.
Kapseln 150 mg: Lactosum monohydricum 49.8 mg, Cellulosum microcristallinum, Maydis amylum pregelificatum, Silica colloidalis anhydrica, Magnesii stearas, Natrii laurilsulfas (=0.041 mg Natrium), Titanii dioxidum (E 171), Chinolinum flavum (E 104), Gelborange S (E 110) 0.02 mg, Gelatina.
Kapseln 200 mg: Lactosum monohydricum 66.40 mg, Cellulosum microcristallinum, Maydis amylum pregelificatum, Silica colloidalis anhydrica, Magnesii stearas, Natrii laurilsulfas (=0.054 mg Natrium), Titanii dioxidum (E 171), Gelatina.
Indikationen/AnwendungsmöglichkeitenCandidosen der Schleimhäute. Diese schliessen den Befall des Oropharyngealtraktes und des Oesophagus sowie die mukokutane und chronische orale atrophische Candidose ein (Reizung bei Gebissträgern).
Patienten ohne Begleiterkrankungen sowie Patienten mit verminderter Immunitätslage können behandelt werden.
Akute oder rezidivierende vaginale Candidose.
Prophylaxe von Candidainfektionen bei Patienten mit Malignomen, die für solche Infektionen als Folge der zytotoxischen Chemotherapie oder Radiotherapie prädisponiert sind.
Dermatomykosen einschliesslich Tinea pedis, Tinea corporis, Tinea cruris, dermale Candidainfektionen.
Pityriasis versicolor, wenn eine topische Behandlung nicht in Frage kommt oder nicht ausreichend wirksam war.
Die Anwendung bei Nagelmykosen ist klinisch nicht belegt.
Candidämie.
Kryptokokken-Meningitis und Rezidiv-Prophylaxe einer Kryptokokken-Meningitis bei AIDS-Patienten. Bei einem Teil der Patienten mit Kryptokokken-Meningitis wirkt Fluconazol mykologisch langsamer als Amphotericin B oder die Kombination von Amphotericin B und Flucytosin. Die Heilungsraten sind jedoch nicht signifikant unterschiedlich.
Fluconazol Zentiva kann auch angewendet werden bei anderen Kryptokokken-Infektionen (z.B. pulmonale, kutane).
Patienten ohne Begleitkrankheiten, Patienten mit AIDS, Organtransplantationen und andere Patienten mit Immunsuppression können ebenfalls mit Fluconazol behandelt werden.
Fluconazol Zentiva sollte bei Kindern und Jugendlichen nicht zur Behandlung der Tinea capitis angewendet werden.
Dosierung/AnwendungDie Tagesdosis von Fluconazol soll aufgrund der Art und des Schweregrades der Pilzinfektion bestimmt werden. Die meisten Fälle einer vaginalen Candidose sprechen auf eine Einmaldosis-Behandlung an. Die Therapie jener Infektionen, welche multiple Dosen erfordern, soll solange fortgesetzt werden, bis die klinischen Parameter oder die Laboruntersuchungen zeigen, dass die aktive Pilzinfektion abgeklungen ist. Eine zu kurze Behandlungsdauer kann zu Rezidiven der aktiven Infektion führen.
Bei der Behandlung invasiver Mykosen sollten auch die jeweils geltenden Behandlungs-Richtlinien der europäischen und amerikanischen Fachgesellschaften berücksichtigt werden.
Ausserdem sollte bei der Festlegung auch die MHK der jeweiligen Spezies berücksichtigt werden.
Erwachsene
1.oropharyngeale Candidiasis: Initialdosis 200-400 mg am ersten Tag, gefolgt von 100-200 mg einmal täglich über 7-21 Tage (bis zur Remission).Bei stark immunkompromittierten Patienten kann die Behandlung ggf. über längere Zeit fortgesetzt werden.
2.oesophageale Candidose: Initialdosis 200-400 mg am ersten Tag, gefolgt von 100-200 mg einmal täglich für 14-30 Tage (bis zur Remission).Bei stark immunkompromittierten Patienten kann die Behandlungsdauer verlängert werden.
3.Candidämie: Initialdosis 800 mg am ersten Tag, gefolgt von 400 mg einmal täglich. Die Behandlungsdauer hängt vom klinischen Ansprechen ab. Im Allgemeinen wird empfohlen, die Behandlung nach der ersten negativen Blutkultur und nach klinischer Besserung noch für weitere 2 Wochen fortzusetzen.
4.Prophylaxe von Candidainfektionen bei Patienten mit anhaltender Neutropenie: 200-400 mg einmal täglich, abhängig vom Risiko des Patienten eine Candidainfektion zu entwickeln. Die Behandlung sollte mehrere Tage vor dem erwarteten Beginn der Neutropenie begonnen und noch über weitere 7 Tage fortgesetzt werden, nachdem die Neutrophilenzahl wieder auf >1000 Zellen/mm3 angestiegen ist.
5.Rezidivprophylaxe von Schleimhaut-Candidosen bei immunkompromittierten Patienten: 100-200 mg einmal täglich oder 200 mg dreimal wöchentlich. Bei Patienten mit chronischer Immunsuppression sollte die Prophylaxe auf unbestimmte Zeit fortgeführt werden.
6.atrophische orale Candidiasis bei Gebissträgern: 50 mg einmal täglich über 14 Tage.Gleichzeitig muss eine antiseptische Behandlung des Gebisses durchgeführt werden.
7.akute vaginale Candidiasis: 150 mg Fluconazol als orale Einzeldosis.
8.Behandlung und Prophylaxe rezidivierender vaginaler Candidosen: 150 mg jeden 3. Tag über insgesamt 3 Dosen (Tag 1, 4 und 7), anschliessend Erhaltungsdosis mit 150 mg einmal wöchentlich für 6 Monate.
9.Behandlung der Kryptokokken-Meningitis: Initialdosis von 400 mg an Tag 1, gefolgt von 200-400 mg einmal täglich. Bei lebensbedrohlichen Infektionen kann die Tagesdosis auf 800 mg erhöht werden. Die Behandlungsdauer hängt vom klinischen und mykologischen Ansprechen ab. Sie beträgt in der Regel mindestens 6-8 Wochen.
10.Rezidivprophylaxe einer Kryptokokken-Meninigitis bei Patienten mit hohem Rezidivrisiko (d.h. HIV-Patienten oder anderweitig immunkompromittierten Patienten): 200 mg einmal täglich. Behandlungsdauer: unbegrenzt.
11.Dermatomykosen (z.B. Tinea pedis, Tinea corporis, Tinea cruris) und Candidainfektionen der Haut: 150 mg einmal pro Woche oder 50 mg einmal täglich über 2-4 Wochen. Bei Tinea pedis kann eine Therapiedauer von bis zu 6 Wochen erforderlich sein.
12.Pityriasis versicolor: 300-400 mg einmal wöchentlich über 1-3 Wochen oder 50 mg einmal täglich über 2-4 Wochen.
Art der Anwendung
Fluconazol steht sowohl für die orale (Kapseln und Pulver zur Herstellung einer Suspension) als auch für die intravenöse Anwendung (Infusionslösung) zur Verfügung. Die Verabreichungsform hängt vom klinischen Zustand des Patienten ab.
Da die Bioverfügbarkeit bei oraler Gabe jener bei intravenöser Anwendung vergleichbar ist, ist eine Umstellung von der intravenösen auf eine orale Verabreichungsform (bzw. umgekehrt) ohne Dosisanpassung möglich.
Fluconazol Zentiva kann mit oder ohne Nahrung eingenommen werden.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Fluconazol Zentiva Kapseln sind für die Anwendung bei Kindern nicht geeignet.
Für Kinder müssen andere Fluconazol-Präparate mit geeigneter galenischer Form (orale Suspension oder Infusionslösung) verwendet werden. Insbesondere ist zu beachten, dass die nachfolgend genannten Dosierungsempfehlungen (in mg/kg) vor allem bei niedrigem Körpergewicht nicht in allen Fällen mit den verfügbaren Dosisstärken der Kapseln umgesetzt werden können.
Die Dosierung bei Kindern und Jugendlichen erfolgt in Abhängigkeit vom Körpergewicht (siehe unten). Eine Maximaldosis von 400 mg pro Tag sollte dabei nicht überschritten werden. Fluconazol wird grundsätzlich einmal täglich verabreicht.
Zur Dosisanpassung bei pädiatrischen Patienten mit eingeschränkter Nierenfunktion siehe Abschnitt «Patienten mit Nierenfunktionsstörungen».
Die Therapiedauer hängt wie bei Erwachsenen vom klinischen und mykologischen Ansprechen der entsprechenden Infektion ab.
Jugendliche ab 12 Jahren
Kinder weisen eine höhere Fluconazol-Clearance auf als Erwachsene (siehe «Pharmakokinetik», Abschnitt «Kinetik spezieller Patientengruppen»). Bei Kindern wird mit einer Dosis von 3, 6 und 12 mg/kg eine vergleichbare Exposition erreicht wie bei Erwachsenen unter Dosen von 100, 200 und 400 mg. Bei Jugendlichen >12 Jahren muss abhängig von Körpergewicht und Stand der pubertären Entwicklung individuell beurteilt werden, ob für den Patienten die Erwachsenen-Dosis geeignet ist oder eine Dosisanpassung erfolgten muss. Im Falle einer Dosisanpassung werden folgende Dosierungen empfohlen:
|
Indikation
|
Dosierung
|
Empfehlungen
| |
Candidosen der Schleimhäute
|
Initialdosis 6 mg/kg,
gefolgt von 3 mg/kg einmal täglich
|
| |
Invasive Candidosen
|
6-12 mg/kg einmal täglich
|
abhängig vom Schweregrad der Erkrankung
| |
Prophylaxe von Candidainfektionen bei immunkompromittierten Patienten
|
3-12 mg/kg einmal täglich
|
abhängig von Schweregrad und Dauer der vorliegenden Neutropenie (siehe Dosierung bei Erwachsenen)
| |
Kryptokokkenmeningitis
|
6-12 mg/kg einmal täglich
|
abhängig vom Schweregrad der Erkrankung
| |
Rezidivprophylaxe der Kryptokokkenmeningitis bei Kindern mit hohem Rezidivrisiko
|
6 mg/kg einmal täglich
|
|
Ältere Patienten
Falls die Nierenfunktion nicht eingeschränkt ist (siehe dort), ist keine Dosisanpassung erforderlich.
Patienten mit Nierenfunktionsstörungen
Fluconazol wird überwiegend unverändert mit dem Urin ausgeschieden. Bei einer Einmaldosis ist keine Dosierungsanpassung erforderlich.
Im Falle mehrerer Fluconazol Zentiva-Gaben sollten Patienten mit eingeschränkter Nierenfunktion eine Anfangsdosis zwischen 50 und 400 mg erhalten. Danach soll die tägliche Dosis (abhängig von der Indikation) wie folgt angepasst werden.
|
Kreatinin-Clearance
(ml/min)
|
Prozent der empfohlenen Dosis
| |
>50
|
100%
| |
≤50 (ohne Dialyse)
|
50%
| |
Hämodialyse
|
100% nach jeder Hämodialyse
|
Wenn nur die Serum-Kreatininwerte (Ccr) bekannt sind, kann die Kreatinin-Clearance (Cl) mit der folgenden Formel abgeschätzt werden:
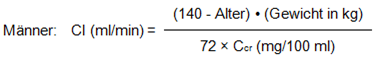
Frauen: 0.85× obiger Wert
Diese Anpassung in Abhängigkeit von der Kreatinin-Clearance gilt auch für Kinder und Jugendliche (siehe auch Dosierungsempfehlung für «Kinder und Jugendliche»).
Patienten mit Leberfunktionsstörungen
Da nur begrenzte Daten zu Patienten mit eingeschränkter Leberfunktion vorliegen, muss Fluconazol bei Patienten mit Leberfunktionsstörungen mit Vorsicht angewendet werden.
Kontraindikationen·bekannte Überempfindlichkeit gegenüber Fluconazol oder einen der Hilfsstoffe von Fluconazol Zentiva sowie gegenüber anderen Azol-Verbindungen.
·gleichzeitige Behandlung mit Arzneimitteln, welche über das Cytochrom P450-Isoenzym CYP3A4 metabolisiert werden und das QT-Intervall verlängern können, wie z.B. Amiodaron, Chinidin, Erythromycin oder Sertindol (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und VorsichtsmassnahmenQT-Dauer
Eine thorough QT study liegt für Fluconazol nicht vor. Einige Azole wurden jedoch mit einer Verlängerung des QT-Intervalls im EKG in Verbindung gebracht, und nach der Markteinführung von Fluconazol wurde sehr selten über Fälle einer QTc-Verlängerung und über Torsades de Pointes berichtet. Fluconazol muss daher bei Vorliegen potentiell proarrhythmischer Risikofaktoren mit Vorsicht angewandt werden. Diese Risikofaktoren umfassen eine kongenitale oder erworbene QT-Verlängerung, Kardiomyopathien (insbesondere bei Vorliegen einer Herzinsuffizienz), vorbestehende symptomatische Arrhythmien, Sinusbradykardie und Störungen des Elektrolythaushaltes (wie insbesondere Hypokaliämie). Das Risiko ist ausserdem erhöht bei gleichzeitiger Anwendung anderer Arzneimittel, die bekanntermassen das QTc-Intervall verlängern. Dies gilt insbesondere für CYP3A4-Substrate mit Potential für eine QT-Verlängerung sowie für Antiarrhythmika wie Amiodaron.
Die gleichzeitige Behandlung mit solchen Arzneimitteln kann daher kontraindiziert sein (siehe auch «Interaktionen» und «Kontraindikationen»).
Vor Beginn und während der Behandlung mit Fluconazol muss der Elektrolythaushalt überwacht und Störungen wie Hypokaliämie, Hypomagnesiämie und Hypocalciämie ggf. ausgeglichen werden.
Hepatotoxizität
Unter Fluconazol wurden seltene Fälle schwerer Hepatotoxizität beobachtet, einschliesslich solcher mit letalem Ausgang, vorwiegend bei Patienten mit schweren Grunderkrankungen. In Fällen von Hepatotoxizität, die im Zusammenhang mit Fluconazol stehen, konnte keine offensichtliche Beziehung zu Tagesgesamtdosis, Behandlungsdauer, Geschlecht oder Alter des Patienten festgestellt werden. Im Allgemeinen war die Hepatotoxizität von Fluconazol nach Behandlungsabbruch reversibel.
Während der Behandlung mit Fluconazol müssen regelmässig Leberfunktionstests durchgeführt werden. Patienten, bei denen sich während der Fluconazol-Behandlung abnorme Leberfunktionswerte entwickeln, sollten im Hinblick auf die Entwicklung einer schwerwiegenderen Leberschädigung überwacht werden. Fluconazol soll abgesetzt werden, falls sich klinische Hinweise auf eine Lebererkrankung entwickeln, die Fluconazol zugeordnet werden kann.
Bei Patienten mit vorbestehenden Leberfunktionsstörungen sollte Fluconazol mit Vorsicht verabreicht werden.
Hautreaktionen
In seltenen Fällen haben Patienten während der Behandlung mit Fluconazol schwere Hautreaktionen wie Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, AGEP (akute generalisierte exanthematische Pustulose) oder DRESS-Syndrom entwickelt. Ein DRESS-Syndrom (Drug Reaction with Eosinophilia and Systemic Symptoms) ist dabei gekennzeichnet durch drei oder mehr der folgenden Symptome: Hautreaktion (wie Exanthem oder exfoliative Dermatitis), Eosinophilie, Fieber und Lymphadenopathie sowie ein oder mehrere systemische Komplikationen wie Hepatitis, Myokarditis, Nephritis, Perikarditis, interstitielle Pneumonie oder Vaskulitis. Das DRESS-Syndrom kann mit einer Latenz von mehreren Wochen auftreten.
Falls bei einem Patienten, der wegen einer oberflächlichen Pilzinfektion behandelt wird, ein Exanthem auftritt, das mit Fluconazol in Zusammenhang gebracht werden kann, soll die Behandlung abgebrochen werden. Falls sich bei Patienten mit invasiven/systemischen Pilzinfektionen Exantheme entwickeln, sollten sie engmaschig überwacht und Fluconazol abgesetzt werden, falls es zu bullösen Hautveränderungen, einem Erythema multiforme oder zusätzlichen systemischen Symptomen wie Fieber oder Lymphadenopathie kommt.
AIDS-Patienten sind anfälliger für das Entstehen schwerer Hautreaktionen.
Anwendung bei Frauen im gebärfähigen Alter
Es liegen Berichte über kongenitale Anomalien bei Kindern vor, deren Mütter während der Schwangerschaft (insbesondere im ersten Trimester) gegenüber Fluconazol exponiert waren (siehe «Schwangerschaft/Stillzeit»). Auch über Spontanaborte wurde berichtet. Frauen im gebärfähigen Alter sollten daher während der Therapie sowie bis ca. 1 Woche (d.h. 5 bis 6 Halbwertszeiten) nach der letzten Dosis eine zuverlässige Kontrazeptionsmethode anwenden.
Endokrine Effekte
Unter der Anwendung von Azol-Antimykotika (einschliesslich Fluconazol) wurde über eine Nebennierenrinden(NNR)-Insuffizienz berichtet. Diese war in den meisten Fällen reversibel. Insbesondere Patienten mit vorbestehenden Risikofaktoren für eine NNR-Insuffizienz sowie solche unter einer systemischen Glucocorticoidtherapie sollten diesbezüglich überwacht werden.
Eingeschränkte Nierenfunktion
Bei Patienten mit Nierenfunktionsstörung sollte Fluconazol mit Vorsicht verabreicht werden (siehe auch «Spezielle Dosierungsanweisungen»).
InteraktionenFluconazol ist ein mittelstarker Inhibitor der Cytochrom P450 Isoenzyme CYP2C9 und CYP3A4 sowie ein Inhibitor von Isoenzym CYP2C19. Die Verabreichung von Fluconazol an Patienten, welche gleichzeitig Substanzen einnehmen, die über CYP2C9, CYP2C19 oder CYP3A4 metabolisiert werden, kann zu erhöhten Serumspiegeln dieser Substanzen führen (siehe «Interaktionen»). Wenn diese Substanzen eine geringe therapeutische Breite haben, sollen die Patienten sorgfältig überwacht werden.
Überempfindlichkeit
Selten wurden Anaphylaxien beschrieben.
Farbstoffe
Fluconazol Zentiva 150 mg enthält den Azofarbstoff Gelborange S (E110). Der Azofarbstoff Gelborange S (E110) kann allergische Reaktionen hervorrufen. Patienten und Patientinnen, die auf Azofarbstoffe, Acetylsalicylsäure sowie Rheuma- und Schmerzmittel (Prostaglandinhemmer) überempfindlich reagieren, sollten Fluconazol Zentiva 150 mg deshalb nicht anwenden.
Lactose
Fluconazol Zentiva 50/150/200 mg Kapseln enthalten 16,60/49,80/66,40 mg Lactose pro Kapsel. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactasemangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Natrium
Fluconazol Zentiva enthält weniger als 1 mmol Natrium (23 mg) pro Kapsel, d.h. es ist nahezu «natriumfrei».
Interaktionen
Pharmakokinetische Interaktionen
Fluconazol ist ein mittelstarker Inhibitor der hepatischen Enzyme CYP3A4 und CYP2C9 sowie auch ein Inhibitor von CYP2C19. Aufgrund dieser Eigenschaften weist der Wirkstoff ein erhebliches Interaktionspotential auf, und es ist nicht möglich, sämtliche potentiellen Interaktionspartner hier namentlich zu nennen. Bei gleichzeitiger Anwendung anderer Arzneimittel sollte daher grundsätzlich auch deren Fachinformation herangezogen werden, um sich über deren Metabolisierungswege sowie über eventuell erforderliche Dosisanpassungen (oder andere Massnahmen) zu informieren. Dies gilt insbesondere bei Patienten mit eingeschränkter Leber- oder Nierenfunktion sowie bei multiplen Komedikationen.
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Fluconazol
Rifampicin
Die gleichzeitige Verabreichung von Fluconazol mit Rifampicin, einem starken CYP Enzym-Induktor, führte zu einer Abnahme der Fluconazol-AUC (Fläche unter der Konzentrations-Zeit-Kurve) um 25% und zu einer Verkürzung der Halbwertszeit von Fluconazol um 20%. Bei gleichzeitiger Rifampicintherapie kann daher eine Dosiserhöhung von Fluconazol erforderlich sein.
Der Einfluss anderer Enzyminduktoren wurde nicht untersucht. Es ist jedoch davon auszugehen, dass eine Komedikation mit anderen starken CYP3A4-Induktoren (wie z.B. Carbamazepin, Phenytoin, Mitotan, Enzalutamid oder Johanniskraut-Präparaten) zu vergleichbaren Veränderungen führt. Dabei ist zu beachten, dass eine Enzyminduktion über mindestens 4 Wochen nach Absetzen des jeweiligen Induktors anhalten kann.
Hydrochlorothiazid
Die gleichzeitige Verabreichung von Hydrochlorothiazid (Mehrfachdosen) und Fluconazol führte zu einem Anstieg der Fluconazol-Plasmakonzentration um 40%. Bei Gesunden ist keine Dosisanpassung erforderlich. Bei Patienten mit Niereninsuffizienz sollte diese Erhöhung der Fluconazol-Exposition jedoch berücksichtigt werden.
Einfluss von Fluconazol auf die Pharmakokinetik anderer Arzneimittel
Fluconazol kann bei gleichzeitiger Verabreichung zusammen mit Arzneimitteln, die über CYP2C9, CYP2C19 oder CYP3A4 metabolisiert werden, zu erhöhten Serumspiegeln dieser Substanzen führen. Entsprechend kann das Risiko für unerwünschte Wirkungen erhöht sein. Die daraus resultierenden Konsequenzen sind abhängig vom jeweiligen Wirkstoff und dessen therapeutischer Breite. Patienten mit derartigen Komedikationen müssen daher sorgfältig überwacht werden und ggf. ist eine Dosisanpassung in Betracht zu ziehen. Hierbei ist zu beachten, dass die enzyminhibierenden Effekte von Fluconazol aufgrund seiner langen Halbwertszeit 4 bis 5 Tage über das Absetzen hinaus anhalten. Bei gleichzeitiger Verabreichung von Substanzen mit engem therapeutischem Fenster (wie z.B. Ciclosporin) sollten deren Plasmaspiegel daher auch nach Absetzen von Fluconazol überwacht und ggf. die Dosis angepasst werden.
Zu beachten ist auch, dass im Falle von Arzneimitteln, bei welchen der Wirkstoff als Prodrug appliziert und unter wesentlicher Beteiligung von CYP3A4, CYP2C9 oder CYP2C19 in den aktiven Wirkstoff umgewandelt wird, die gleichzeitige Anwendung eines Enzyminhibitors wie Fluconazol zu einer klinisch relevanten Abnahme der Plasmakonzentrationen des aktiven Wirkstoffes und damit zu einer reduzierten Wirksamkeit führen kann. Dies gilt z.B. für Losartan. Im Falle einer Komedikation mit Fluconazol sollte der Blutdruck dieser Patienten engmaschig überwacht werden. Weitere Beispiele sind Carbamazepin, Clopidogrel, Primidon oder Valproinsäure.
CYP3A4-Substrate
In klinischen Studien führte die gleichzeitige Verabreichung von Fluconazol zusammen mit CYP3A4-Substraten zu einer Erhöhung der Substrat-Exposition. Bei gleichzeitiger Anwendung von Fluconazol zusammen mit CYP3A4-Substraten, welche das Potential aufweisen, die QT-Dauer zu verlängern, ist dadurch das Risiko für ventrikuläre Tachyarrhythmien einschliesslich Torsades de Pointes erhöht. Die gleichzeitige Anwendung zusammen mit solchen Wirkstoffen ist daher kontraindiziert. Dies gilt z.B. für Amiodaron, Chinidin, Erythromycin oder Sertindol.
CYP2C9/CYP2C19-Substrate
Die gleichzeitige Gabe von Fluconazol zusammen mit Substraten von CYP2C9 bzw. CYP2C19 kann zu einer erhöhten Exposition dieser Wirkstoffe führen. Patienten, die gleichzeitig mit Fluconazol und Substraten dieser Isoenzyme behandelt werden, sollten engmaschig auf unerwünschte Wirkungen überwacht werden.
Die folgende Tabelle zeigt Beispiele von Arzneimitteln, deren Pharmakokinetik durch Fluconazol beeinflusst werden kann. Die Auflistung erhebt keinen Anspruch auf Vollständigkeit. Bei gleichzeitiger Anwendung anderer Arzneimittel zusammen mit Fluconazol sollte daher grundsätzlich auch deren Fachinformation herangezogen werden. Ähnliche Effekte sind auch bei anderen, nicht erwähnten Wirkstoffen zu erwarten, die ebenfalls Substrate von CYP3A4, CYP2C9 oder CYP2C19 sind.
Die nachfolgenden Empfehlungen sind wie folgt definiert:
·«kontraindiziert»: Substrate von CYP3A4, CYP2C9 oder CYP2C19 mit potentiell schwerwiegenden und unter Umständen irreversiblen unerwünschten Wirkungen (wie z.B. Torsades de Pointes, Rhabdomyolyse, etc.). Das Arzneimittel darf unter keinen Umständen zusammen mit Fluconazol verabreicht werden (siehe «Kontraindikationen»).
·«nicht empfohlen»: Substrate von CYP3A4, CYP2C9 oder CYP2C19, bei denen erhöhte oder reduzierte Plasmakonzentrationen mit einem deutlich erhöhten Risiko für klinisch relevante unerwünschte Wirkungen einhergehen bzw. bei welchen eine reduzierte Wirksamkeit ein relevantes Risiko für den Patienten darstellt. Eine Anwendung des jeweiligen Arzneimittels während der Behandlung oder in den ersten beiden Wochen nach Absetzen von Fluconazol sollte vermieden werden, sofern nicht der Nutzen die potentiell erhöhten Risiken überwiegt. Falls aufgrund fehlender Alternativen bzw. einer Unverträglichkeit gegenüber den alternativen Wirkstoffen eine gleichzeitige Verabreichung unvermeidbar ist, muss der Patient sorgfältig und engmaschig überwacht und ggf. die Dosierung des gleichzeitig verabreichten Arzneimittels angepasst werden. Für Wirkstoffe, für welche Zielkonzentrationen definiert sind, wird empfohlen, die Plasmakonzentrationen zu überwachen (sogenanntes «Therapeutic Drug Monitoring», TDM).
·«mit Vorsicht anwenden»: Substrate von CYP3A4, CYP2C9 oder CYP2C19, bei denen erhöhte oder reduzierte Plasmakonzentrationen ein klinisch relevantes Risiko darstellen können. Wird das Arzneimittel zusammen mit Fluconazol angewendet, so wird eine sorgfältige Überwachung empfohlen. Für Wirkstoffe, für welche Zielkonzentrationen definiert sind, wird ein TDM empfohlen. Ggf. muss die Dosierung des gleichzeitig verabreichten Arzneimittels angepasst werden.
·«Anwendung möglich»: keine klinisch relevante Interaktion. Eine gleichzeitige Anwendung des Wirkstoffes zusammen mit Fluconazol ist möglich, und eine Dosisanpassung ist nicht erforderlich.
|
Art der Empfehlung
|
Beispiele für betroffene Wirkstoffe
| |
kontraindiziert
|
CYP3A4-Substrate, für welche eine QT-verlängernde Wirkung bekannt ist (z.B. Amiodaron, Chinidin, Citalopram, Erythromycin, Sertindol)
| |
nicht empfohlen
|
durch CYP3A4 metabolisierte Ergot-Alkaloide
Venetoclax (während der Aufdosierung)
Voriconazol
verschiedene antineoplastische Wirkstoffe (z.B. Olaparib, Vinca-Alkaloide)
| |
mit Vorsicht (und ggf. unter Dosisanpassung) anwenden
|
Abrocitinib
Aprepitant
Avanafil
kurzwirksame Benzodiazepine (z.B. Midazolam, Triazolam)
Calciumantagonisten (z.B. Amlodipin, Felodipin)
Carbamazepin
Celecoxib
Ciclosporin
Everolimus
Isavuconazol
Ivabradin
Ivacaftor
durch CYP3A4 metabolisierte Glukokortikoide
Methadon
NSARs (z.B. Diclofenac, Ibuprofen, Naproxen)
kurzwirksame Opiate (Alfentanil, Fentanyl)
langwirksame Opiate (z.B. Oxycodon)
Protonenpumpeninhibitoren
Ranolazin
Sildenafil
Sirolimus
Statine
Sulfonylharnstoffe
Tacrolimus
Tadalafil
Theophyllin
trizyklische Antidepressiva (Amitriptylin, Nortriptylin)
Vardenafil
Vitamin K-Antagonisten
verschiedene antineoplastische Wirkstoffe (z.B. Bortezomib, Cyclophosphamid, Gefitinib, Ibrutinib, Tofacitinib)
verschiedene antivirale Wirkstoffe (z.B. Atazanavir, Darunavir, Nevirapin, Tipranavir, Zidovudin)
Zopiclon
| |
evtl. Dosisanpassung von Fluconazol erforderlich
|
Bosentan
Carbamazepin
Johanniskrautpräparate
Phenobarbital
Phenytoin
Rifabutin/Rifampicin
|
Bei gleichzeitiger Anwendung antiviraler Kombinationen (HIV oder HCV) ist zu beachten, dass der Nettoeffekt der zu erwartenden Interaktion stark von den pharmakokinetischen Eigenschaften der enthaltenen Wirkstoffe (Enzym-Substrate, -Induktoren, -Inhibitoren) abhängig ist.
Für Arzneimittel, für welche spezifische Interaktionsstudien mit Fluconazol vorliegen, sind in der nachstehenden Tabelle die Ergebnisse im Detail aufgeführt.
|
Arzneimittel
|
Behandlungsschema
|
Veränderung der PK-Parametera
|
Empfehlung
| |
Abrocitinib
|
100 mg Abrocitinib/400 mg Fluconazol an Tag 1 gefolgt von 200 mg Fluconazol QD an Tag 2-7
|
Abrocitinib und aktive Metabolite:
AUC ↑ 2.55 (2.42-2.69)
Cmax ↑ 1.23 (1.08-1.42)
|
mit Vorsicht anwenden
| |
Alfentanil
|
20 µg/kg Alfentanil/400 mg Fluconazol oral
|
Clearance ↓ 55%
Vss ↓ 19%b
t½ ↑ 67%
AUC ↑ 97%
|
mit Vorsicht anwenden
| |
|
20 µg/kg Alfentanil/400 mg Fluconazol IV
|
Clearance ↓ 58%
Vss ↓ 19%
t½ ↑ 80%
AUC ↑ 107%
|
| |
Azithromycin
|
1200 mg Azithromycin oral/800 mg Fluconazol oral
|
Cmax ↔
AUC ↔
|
Anwendung möglich
| |
Benzodiazepine (kurzwirksame):
|
|
|
mit Vorsicht anwenden
| |
orales Midazolam
|
7.5 mg Midazolam 400 mg Fluconazol oral
|
AUC ↑ 200% Cmax ↑ 150%
t½ ↑ 150%
|
| |
|
7.5 mg Midazolam/400 mg Fluconazol IV
|
AUC ↑ 100% Cmax ↑ 100%
t½ ↑ 150%
|
| |
Triazolam
|
0.25 mg Triazolam/50 mg Fluconazol oral QD
|
AUC 1.6 (1.30, 2.34)
Cmax 1.47 (1.08, 2.07)
t½ 1.3 (1.02, 1.70)
|
| |
|
0.25 mg Triazolam/100 mg Fluconazol oral QD
|
AUC 2.10 (1.42, 3.57)
Cmax 1.40 (0.94, 2.34)
t½ 1.8 (1.40, 2.29)
|
| |
|
0.25 mg Triazolam/200 mg Fluconazol oral QD
|
AUC 4.40 (2.38, 9.49)
Cmax 2.33 (1.33, 4.44)
t½ 2.30 (1.67, 3.23)
|
| |
Carbamazepin
|
400 mg Carbamazepin TID/150 mg Fluconazol QD für 3 Tage
|
Clearance ↓ 50%
Serum Carbamazepin Konzentration ↑ 100%
|
mit Vorsicht anwenden
| |
Celecoxib
|
Celecoxib 200 mg mit Fluconazol 200 mg täglich
|
Cmax ↑ 68%
AUC ↑ 134%
|
mit Vorsicht anwenden
| |
Ethinylestradiol/ Levonorgestrel (0.03 mg/0.15 mg) (kombiniertes hormonales Kontrazeptivum)
|
nach gleichzeitiger Gabe von 50 mg Fluconazol pro Tag:
|
Ethinylestradiol AUC ↔
Levonorgestrel AUC ↔
|
Eine Beeinflussung der kontrazeptiven Wirksamkeit ist unwahrscheinlich.
Studien mit Kontrazeptiva mit anderen Gestagenkomponenten wurden nicht durchgeführt.
| |
|
nach gleichzeitiger Gabe von 200 mg Fluconazol pro Tag:
|
Ethinylestradiol AUC ↑ 40% Levonorgestrel AUC ↑ 24%.
|
| |
Fentanyl
|
5 µg/kg Fentanyl IV an Tag 2/400 mg Fluconazol oral an Tag 1 gefolgt von 200 mg Fluconazol oral an Tag 2
|
Clearance 0.81 (0.69, 0.95)
AUC 1.23 (1.05, 1.45)
t½ ↔
|
mit Vorsicht anwenden
| |
NSARs
Flurbiprofen
|
100 mg Flurbiprofen oral/200 mg Fluconazol oral
|
AUC ↑ 81%
Cmax ↑ 23%
|
mit Vorsicht anwenden
| |
Ibuprofen
|
400 mg Ibuprofen oral/400 mg Fluconazol oral an Tag 1 gefolgt von 200 mg Fluconazol oral
|
Pharmakologisch aktives Isomer [S-(+)-Ibuprofen]:
AUC 1.82 (1.72, 1.92) Cmax 1.15 (1.06, 1.24)
|
| |
Rifabutin
|
300 mg Rifabutin oral/200 mg Fluconazol oral
|
AUC ↑ 76%
Cmax ↑ 91%
|
mit Vorsicht anwenden
| |
Saquinavir
|
1200 mg Saquinavir oral/200 mg Fluconazol oral QD
|
AUC ↑ 50%
Cmax ↑ 56%
Clearance ↓ 50%
|
mit Vorsicht anwenden
| |
Tacrolimus
|
0.1 mg/kg/Tag Tacrolimus IV an Tag 1, gefolgt von 0.15 mg/kg oral BID/100 mg oder 200 mg QD Fluconazol oral
|
Median Ctrough ↑ 40% (100 mg/Tag Fluconazol) und ↑ 210% (200 mg/Tag Fluconazol)
|
mit Vorsicht anwenden
| |
Theophyllin
|
240 mg Theophyllin oral/100 mg BID Fluconazol während 14 Tage
|
Kel ↓ 19%c
Clearance ↓ 18%
|
mit Vorsicht anwenden
| |
Voriconazol
|
Voriconazol oral (400 mg alle 12 h für 1 Tag, dann 200 mg alle 12 h für 2.5 Tage), Fluconazol oral (400 mg an Tag 1, dann 200 mg alle 24 h für 4 Tage)
|
Cmax 1.57 (1.20, 2.07)
AUCτ 1.79 (1.41, 2.28)
Dosisreduktion und/oder verlängerte Dosierungsintervalle führten nicht zu einer Abnahme der Interaktion.
|
nicht empfohlen
| |
Zidovudin
|
200 mg Zidovudin oral TID/400 mg Fluconazol oral QD für 7 Tage
|
AUC ↑ 74%,
Cmax ↑ 84%,
Clearance ↓ 43%,
t½ ↑ 128%.
|
mit Vorsicht anwenden
|
a soweit vorhanden: Ratio Test/Referenz (geometric mean changes) mit 90% oder 95%-Konfidenzintervall; sonst Veränderung des jeweiligen Parameters in Prozent.
b «Vss»: Steady-state volume of distribution.
c «kel»: elimination rate constant.
«QD»: einmal täglich, «BID»: zweimal täglich, «TID»: dreimal täglich.
Pharmakodynamische Interaktionen
Vitamin K-Antagonisten
Eine Interaktionsstudie an gesunden Probanden zeigte bei gleichzeitiger Gabe von Fluconazol und Warfarin einen Anstieg der Prothrombinzeit um 12%. Studien mit Acenocoumarol oder Phenprocoumon liegen nicht vor. Nach der Marktzulassung wurde bei Patienten, die gleichzeitig mit Fluconazol und Warfarin behandelt wurden, ein Anstieg der Prothrombinzeit mit Blutungsereignissen, (Epistaxis, Hämaturie, Meläna, gastrointestinale Blutungen) beschrieben. Werden Patienten unter einer Antikoagulation mit Vitamin K-Antagonisten gleichzeitig mit Fluconazol behandelt, sollte die INR engmaschig kontrolliert und ggf. die Dosis der Antikoagulantien angepasst werden.
Amphotericin B
In vitro wurde zwischen Amphotericin B und Azol-Derivaten ein Antagonismus gefunden. Der Wirkmechanismus von Imidazolen beruht auf der Hemmung der Ergosterol-Synthese in der Zellmembran von Pilzen. Amphotericin B bindet an Steroide in der Zellmembran und verändert deren Permeabilität. Ein ähnlicher Effekt kann mit liposomalem Amphotericin B auftreten. Die klinische Bedeutung dieses Antagonismus ist bisher nicht bekannt.
Im Tierversuch zeigte die gleichzeitige Verabreichung von Fluconazol und Amphotericin B bei infizierten immunsupprimierten und immunkompetenten Mäusen folgende Ergebnisse: Antagonismus der beiden Wirkstoffe bei systemischer Infektion mit A. fumigatus; keine Interaktion bei intrakranieller Infektion mit Cryptococcus neoformans; kleiner additiver, antimykotischer Effekt bei systemischer Infektion mit C. albicans. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Schwangerschaft, StillzeitSchwangerschaft
Die Anwendung von Fluconazol während der Schwangerschaft sollte vermieden werden, sofern nicht schwere bzw. potentiell lebensbedrohliche Pilzinfektionen vorliegen, bei denen der erwartete Nutzen das mögliche Risiko für den Feten überwiegt. Vor Beginn der Therapie sollte eine Schwangerschaft ausgeschlossen werden. (zur Anwendung bei Frauen im gebärfähigen Alter siehe «Warnhinweise und Vorsichtsmassnahmen»).
Es liegen Berichte über multiple kongenitale Anomalien bei Kindern vor, deren Mütter während der Schwangerschaft (insbesondere im ersten Trimester) über drei Monate oder länger mit hohen Fluconazoldosen (400-800 mg/Tag) behandelt worden waren. Es handelt sich dabei um ein charakteristisches seltenes Muster von Missbildungen, welches die folgenden Anomalien beinhaltete: Brachyzephalie, Gaumenspalten und andere Gesichtsfehlbildungen, anormale Entwicklung des Schädeldaches, lange Knochen, dünne Rippen, Verkrümmung des Femurs und Arthrogryposis sowie kongenitale Herzfehler. Ein Zusammenhang zwischen dem Einsatz von Fluconazol und diesen unerwünschten Ereignissen kann nicht ausgeschlossen werden.
Auch bei Kindern, deren Mütter im ersten Trimester nur mit 150 mg Fluconazol als Einmaldosis oder Mehrfachdosis behandelt worden waren, liegen Berichte über Spontanaborte und kongenitale Anomalien (insbesondere des Herz-Kreislauf-Systems) vor.
In Tierstudien kam es unter maternaltoxischen Dosierungen ebenfalls zu unerwünschten Wirkungen beim Feten (siehe «Präklinische Daten»).
Stillzeit
Fluconazol tritt in die Muttermilch über. In der Muttermilch wurden ähnlich hohe Fluconazol-Konzentrationen wie im Plasma festgestellt (siehe «Pharmakokinetik»). Die geschätzte tägliche Fluconazol-Aufnahme des Säuglings über die Muttermilch beträgt (bei einer Muttermilchaufnahme von 150 ml/kg/Tag) ungefähr 40% der empfohlenen neonatalen Dosis (für unter 2 Wochen alte Säuglinge) bzw. 13% der empfohlenen Dosis für Säuglinge mit Schleimhaut-Candidose.
Während der Anwendung von Fluconazol, insbesondere in hohen Dosen, wird das Stillen nicht empfohlen.
Nach einer Einzeldosis von 150 mg Fluconazol kann hingegen weiter gestillt werden. Es wird jedoch empfohlen, während der ersten 48 Stunden nach der Einnahme die Milch abzupumpen und zu verwerfen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenStudien zum Einfluss von Fluconazol auf die Fahrtüchtigkeit wurden nicht durchgeführt. Fluconazol kann jedoch zu unerwünschten Wirkungen wie Schwindel sowie in gelegentlichen Fällen zu Krampfanfällen führen, welche die Fähigkeit zum Führen von Fahrzeugen und zum Bedienen von Maschinen einschränken können.
Unerwünschte WirkungenDie folgenden unerwünschten Wirkungen wurden während der Behandlung mit Fluconazol mit folgender Häufigkeit beobachtet: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10'000), nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht zuverlässig abgeschätzt werden).
Erkrankungen des Blutes und des Lymphsystems
Selten: Neutropenie, Leukopenie, Thrombocytopenie, Agranulozytose.
Erkrankungen des Immunsystems
Selten: Anaphylaxie, Angioödem.
Stoffwechsel- und Ernährungsstörungen
Selten: Hypokalämie, Hypertriglyceridämie, Hypercholesterinämie.
Psychiatrische Erkrankungen
Gelegentlich: Schlaflosigkeit, Schläfrigkeit.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Gelegentlich: Schwindel, Parästhesien, Dysgeusie, Krampfanfälle.
Selten: Tremor.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Drehschwindel.
Herzerkrankungen
Selten: QT-Verlängerung, Torsades de Pointes.
Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominalschmerz, Diarrhoe, Nausea, Erbrechen.
Gelegentlich: Mundtrockenheit, Flatulenz, Dyspepsie.
Leber- und Gallenerkrankungen
Häufig: Erhöhung von ALT und/oder AST, Erhöhung der alkalischen Phosphatase.
Gelegentlich: Hyperbilirubinämie, Ikterus, Cholestase.
Selten: Hepatitis, hepatozelluläre Nekrose, Leberversagen (vereinzelt mit letalem Ausgang).
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Exanthem.
Gelegentlich: Pruritus, Urtikaria, verstärktes Schwitzen, Arzneimittelexanthem (einschliesslich fixes Arzneimittelexanthem).
Selten: Alopezie, Gesichtsödem, exfoliative Dermatitis, schwere Hautreaktionen (z.B. Stevens-Johnson Syndrom, toxische epidermale Nekrolyse, AGEP und DRESS-Syndrom; siehe «Warnhinweise und Vorsichtsmassnahmen»).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Myalgie.
Allgemeine Erkrankungen
Gelegentlich: Müdigkeit, Malaise, Asthenie, Fieber.
Bei einigen Patienten, insbesondere bei solchen, die an schweren Grunderkrankungen wie AIDS oder Malignomen leiden, wurden während der Behandlung mit Fluconazol und vergleichbaren Präparaten pathologische Nieren- und Leberwerte sowie hämatologische Störungen, wie Eosinophilie und Anämie (siehe «Warnhinweise und Vorsichtsmassnahmen»), beobachtet, deren klinische Bedeutung und Zusammenhang mit der Fluconazol-Behandlung jedoch unklar sind.
Pädiatrie
In klinischen Studien waren Profil und Häufigkeit unerwünschter Wirkungen (einschliesslich Laborveränderungen) bei Kindern jenen bei Erwachsenen vergleichbar.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Es liegen Fallberichte über Halluzinationen und/oder paranoides Verhalten nach Überdosierungen von Fluconazol (mit Dosen von angeblich bis zu 8200 mg) vor.
Behandlung
Ein spezifisches Antidot existiert nicht. Ggf. sollte eine symptomatische Behandlung (mit supportiven Massnahmen und, falls nötig, Magenspülung) durchgeführt werden.
Fluconazol wird hauptsächlich im Urin ausgeschieden; eine forcierte Volumen-Diurese wird wahrscheinlich die Ausscheidung erhöhen. Eine 3-stündige Hämodialyse vermindert die Plasmakonzentration um ca. 50%.
Eigenschaften/WirkungenATC-Code
J02AC01
Antimykotika zur systemischen Anwendung, Triazol-Derivate.
Wirkungsmechanismus
Fluconazol, ein Triazol-Antimykotikum, ist ein spezifischer Inhibitor der Sterolsynthese von Pilzen. Fluconazol besitzt eine höhere Selektivität für Cytochrom P450-Enzyme von Pilzen als für Cytochrom P450-Enzymsysteme von Säugetieren.
Pharmakodynamik
Mikrobiologie/Resistenzentwicklung
Das antimykotische Wirkspektrum von Fluconazol umfasst in vitro die meisten klinisch relevanten Candida-Spezies (wie insbesondere C. albicans, C. parapsilosis und C. tropicalis).
Für C. glabrata ist die minimale Hemmkonzentration (MHK) tendenziell höher.
Dies gilt auch für C. dubliniensis und C. guilliermondii. Für diese Spezies liegt keine ausreichende Evidenz für eine adäquate Wirksamkeit von Fluconazol vor.
C. krusei ist gegenüber Fluconazol intrinsisch resistent.
C. auris ist tendenziell relativ resistent gegenüber Fluconazol.
Superinfektionen mit gegenüber Fluconazol nicht oder nur wenig empfindlichen non albicans-Spezies (z.B. C. krusei) wurden beschrieben. In diesem Fall ist ggf. eine alternative antimykotische Therapie erforderlich.
Darüber hinaus zeigt Fluconazol in vitro eine Wirksamkeit gegenüber Cryptococcus neoformans und Cryptococcus gattii.
Kreuzresistenzen mit anderen Azol-Antimykotika sind möglich.
EUCAST (European Commitee on Antimicrobial Susceptibility Testing) Breakpoints
Ausgehend von einer Analyse der pharmakokinetischen/pharmakodynamischen Daten sowie der Daten zur In-vitro-Empfindlichkeit und zum klinischen Ansprechen hat die EUCAST-AFST (European Committee on Antimicrobial Susceptibility Testing – Subcommittee on Antifungal Susceptibility Testing) Fluconazol-Breakpoints für Candida-Spezies festgelegt (EUCAST Fluconazole rational document (2020) – v. 3; European Committee on Antimicrobial Susceptibility Testing, antifungal agents, breakpoint tables for interpretation of MICs, v. 10.0, 04.02.2020). Diese Breakpoints sind in der folgenden Tabelle aufgeführt:
|
Erreger
|
MHK-Breakpoint (mg/l)
| |
|
S (empfindlich)
|
R (resistent)
| |
Candida albicans
|
≤2
|
>4
| |
Candida dubliniensis
|
≤2
|
>4
| |
Candida glabrata
|
≤0.001
|
>16*
| |
Candida parapsilosis
|
≤2
|
>4
| |
Candida tropicalis
|
≤2
|
>4
| |
Candida krusei
|
--
|
--
| |
S = empfindlich (susceptible), R = resistent
-- = Empfindlichkeitstestung nicht empfohlen, da Fluconazol für diese Spezies nur wenig geeignet ist.
* Ein erheblicher Anteil der Infektionen betraf C. glabrata mit einer MHK für Fluconazol von 2–16 mg/l und Abwesenheit von Resistenzmechanismen. Da nur wenige Wirkstoffe für die Behandlung von Harnwegsinfektionen und Schleimhautinfektionen in der medizinischen Grundversorgung zur Verfügung stehen, kann Fluconazol eine geeignete Wahl sein. In Fällen, in denen Fluconazol das einzige verfügbare Antimykotikum zur Behandlung von C. glabrata-Infektionen ist, kann eine höhere Dosierung erforderlich sein.
|
Klinische Wirksamkeit
Es liegen keine Daten aus klinischen Studien vor.
Im Tiermodell konnte sowohl nach intravenöser als auch nach oraler Applikation eine Wirksamkeit bei folgenden Pilzinfektionen gezeigt werden:
·Infektionen mit Candida sp., einschliesslich systemischer Candidiasis bei immungeschwächten Tieren,
·Infektionen mit Cryptococcus neoformans, einschliesslich intrakranieller Infektionen,
·Infektionen mit Microsporum sp.,
·Infektionen mit Trichophyton sp..
PharmakokinetikAbsorption
Die pharmakokinetischen Eigenschaften von Fluconazol sind nach intravenöser und oraler Applikation ähnlich. Nach oraler Applikation wird Fluconazol gut resorbiert; Plasmaspiegel und systemische Bioverfügbarkeit betragen über 90% der Plasmakonzentrationen, die nach i.v. Gabe erreicht werden.
Die Plasmakonzentrationen verhalten sich proportional zur Dosis. Die Peak-Plasmakonzentration nach einer oralen Einzelgabe von 100 mg und 400 mg Fluconazol sind 1.9 mg/l und 6.7 mg/l. Die orale Verabreichung über 6 bis 10 Tage führt zu einer um 2.5fach höheren maximalen Plasmakonzentration gegenüber der Einmalgabe.
Steady state Plasmakonzentrationen werden bei oraler Gabe von einmal täglich 50 bis 400 mg innerhalb von 5 bis 10 Tagen erreicht. Wird die Dosis am ersten Behandlungstag verdoppelt, so werden bereits am 2. Tag 90% der steady state Plasmakonzentration erreicht.
Die orale Resorption wird durch gleichzeitige Nahrungsaufnahme nicht beeinträchtigt. Im Nüchternzustand werden die maximalen Plasmakonzentrationen ca. 0,5 bis 1,5 Stunden nach der Medikamenteneinnahme erreicht.
Distribution
Das Verteilungsvolumen liegt nahe beim Gesamtkörperwasser (0,8 l/kg). Die Plasmaproteinbindung ist gering (12%). Die Speichel- und Sputum-Konzentrationen sind ähnlich hoch wie die Plasma-Konzentrationen. Bei Patienten mit meningealem Pilzbefall betragen die Fluconazol-Spiegel im Liquor 80% der Plasmaspiegel. Bei nicht entzündeten Meningen liegen die Liquorkonzentrationen bei 60% der Plasmakonzentrationen.
Im Stratum corneum, der Epidermis und den Schweissdrüsen der Haut werden hohe, über dem Serumspiegel liegende, Fluconazol-Konzentrationen erreicht. Fluconazol akkumuliert im Stratum corneum. Bei einer täglichen Einzeldosis von 50 mg während 12 Tagen betrugen die Fluconazol-Konzentrationen im Stratum corneum nach 12 Tagen 73.3 µg/g und sieben Tage nach Absetzen der Behandlung immer noch 5.8 µg/g. Bei einer Dosierung von 150 mg einmal wöchentlich während 2 Wochen war die maximale Konzentration im Stratum corneum am 7. Tag 23,4 µg/g und 7 Tage nach der zweiten Dosis noch 7.1 µg/g.
Fluconazol passiert die Plazentaschranke und tritt in die Muttermilch über. In einer Studie an n=10 Probandinnen konnte Fluconazol nach Applikation einer Einzeldosis von 150 mg während 48 Stunden in der Muttermilch nachgewiesen werden. Die mittlere Konzentration in der Muttermilch entsprach dabei etwa 98% jener im mütterlichen Plasma.
Metabolismus
Es wurden keine zirkulierenden Metaboliten gefunden.
Elimination
Die Plasma-Halbwertszeit beträgt ungefähr 30 Stunden. Fluconazol wird hauptsächlich renal ausgeschieden; 80% der verabreichten Dosis werden unverändert im Urin ausgeschieden. Die Fluconazol-Clearance ist proportional zur Kreatinin-Clearance.
Die lange Plasma-Halbwertszeit gestattet die einmalige Verabreichung einer Einzeldosis bei vaginaler Candidose und die einmal tägliche bzw. einmal wöchentliche Dosierung bei der Behandlung der anderen Indikationen.
Fluconazol wirkt spezifisch auf Cytochrom P450 abhängige Pilzenzyme. Fluconazol zeigte keine Wirkung auf die Testosteron-Plasmakonzentrationen bei Männern und auf die Steroid-Konzentrationen bei Frauen im gebärfähigen Alter.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche
Die systemische Clearance ist bei Kindern etwa doppelt so hoch wie bei Erwachsenen. Entsprechend ist die Halbwertszeit bei Kindern mit ca. 20 Stunden kürzer als bei Erwachsenen. Bei einmal täglicher Applikation wurde das Steady State bei Kindern nach ungefähr 4-5 Tagen erreicht.
Das Verteilungsvolumen ist bei Kindern höher als bei Erwachsenen: 950 ml/kg bei Kindern mit einem Durchschnittsalter von 6 Monaten und 880 ml/kg bei Kindern mit einem Durchschnittsalter von 10 Jahren.
Pharmakokinetische Daten von Kindern und Jugendlichen
|
Alter
|
Dosierung (mg/kg)
|
N
|
Halbwertszeit (Stunden)
|
Vd
(ml/kg)
|
Cmax
(μg/ml)
|
AUC
(μg∙h/ml)
| |
9 Monate-13 Jahre
|
Single-orale Suspension 2 mg/kg
|
16
|
25.0
(16-45)
|
-
|
2.9
|
94.7
(48-164)
| |
9 Monate-13 Jahre
|
Single-orale Suspension 8 mg/kg
|
14
|
19.5
(10-59)
|
-
|
9.77
|
362.5
(131-725)
| |
5 Jahre–15 Jahre
|
Multiple-i.v. 2 mg/kg
|
4
|
17.4*
(15-20)
|
722
(484-1004)
|
5.5
N=5
|
67.4
(51-84)
| |
5 Jahre–15 Jahre
|
Multiple-i.v. 4 mg/kg
|
5
|
15.2*
(9-24)
|
729
(467-1044)
|
11.4
N=7
|
139.1
(58-192)
| |
5 Jahre–15 Jahre
|
Multiple-i.v. 8 mg/kg
|
7
|
17.6*
(10-26)
|
1069
(725-1680)
|
14.1
N=8
|
196.7
(134-247)
| |
5 Jahre–15 Jahre
|
Multiple-orale Suspension 3 mg/kg
|
11
|
15.5
(11-22)
|
-
|
5.27
|
41.6
(32-59)
|
* Am letzten Tag bestimmt.
Ältere Patienten
Die Pharmakokinetik einer oralen Einzeldosis von 50 mg Fluconazol wurde bei 22 Probanden im Alter von ≥65 Jahren untersucht. 10 dieser Patienten erhielten gleichzeitig Diuretika. Die maximale Plasmakonzentration war gegenüber den Daten aus Populationen jüngerer Erwachsener um etwa den Faktor 1.4 erhöht und wurde 1.2 Stunden nach Einnahme erreicht. Die mittlere AUC war gegenüber Jüngeren um etwa den Faktor 2.2 erhöht, die Halbwertszeit um etwa den Faktor 2.1 verlängert. Darüber hinaus waren bei den älteren Probanden die geschätzte renale Clearance sowie der prozentuale Anteil unveränderter Substanz im Urin niedriger als bei Jüngeren. Im Allgemeinen war bei den älteren Probanden auch die Kreatininclearance erniedrigt (auf durchschnittlich 74 ml/min). Diese Befunde deuten darauf hin, dass die Veränderung der Pharmakokinetik von Fluconazol bei älteren gegenüber jüngeren Patienten durch eine eingeschränkte Nierenfunktion bedingt ist.
Nierenfunktionsstörungen
Die Pharmakokinetik von Fluconazol wird durch eine Einschränkung der Nierenfunktion stark beeinflusst. Die Eliminationshalbwertszeit verhält sich entgegengesetzt zur Kreatinin-Clearance. Bei einer Niereninsuffizienz bedarf es unter Umständen einer Dosis-Reduktion von Fluconazol Zentiva (siehe «Spezielle Dosierungsanweisungen», Abschnitt «Patienten mit Nierenfunktionsstörungen»).
Hämodialyse: Durch eine 3-stündige Hämodialyse werden die Plasmakonzentrationen um ungefähr 50% reduziert.
Leberfunktionsstörungen
Die Pharmakokinetik von Fluconazol wurde bei Patienten mit Leberinsuffizienz nicht untersucht.
Präklinische DatenMutagenität
Mutagenitätsuntersuchungen verliefen bei vier S. typhimurium Stämmen und beim Mäuse Lymphom System L5178Y mit Fluconazol, mit und ohne metabolische Aktivität, negativ. Zytogenetische in vivo-Studien (Knochenmarkszellen von Mäusen nach oraler Verabreichung von Fluconazol) und in vitro-Studien (menschliche Lymphozyten in Fluconazol 1000 µg/ml) ergaben keine Hinweise für chromosomale Mutationen.
Karzinogenität
Langzeitstudien bei Mäusen und Ratten, die Fluconazol während 24 Monaten in täglichen oralen Dosen von 2,5 mg/kg, 5 mg/kg oder 10 mg/kg erhielten (ungefähr 2-7× die empfohlene Dosis beim Menschen), ergaben keinerlei Anhalt für ein karzinogenes Potential von Fluconazol.
Männliche Ratten, die mit 5 mg und 10 mg Fluconazol/kg/Tag behandelt wurden, wiesen eine erhöhte Inzidenz an hepatozellulären Adenomen auf.
Fertilität
Die Fertilität wurde bei männlichen und weiblichen Ratten durch die tägliche Gabe von 5 mg, 10 mg oder 20 mg Fluconazol p.o. bzw. von 5 mg, 25 mg oder 75 mg Fluconazol/kg i.v. nicht beeinflusst, obwohl die Trächtigkeit bei oralen Dosen von 20 mg/kg leicht verlängert war.
Reproduktionstoxizität
In Embryotoxizitätsstudien an Ratten beeinflussten Dosierungen von 5 oder 10 mg/kg den Feten nicht. Bei Dosierungen von 25 mg/kg und 50 mg/kg oder mehr wurden anatomische Anomalien (überzählige Rippe, Nierenbecken-Dilatation) sowie verzögerte Ossifikation vermehrt beobachtet. Bei Ratten, die Dosen zwischen 80 mg/kg (ungefähr 20-60× die empfohlene Dosis beim Menschen) und 320 mg/kg erhielten, kam es gehäuft zu fetalen Anomalien, wie gewellten Rippen, Gaumenspalten und gestörter craniofacialer Ossifikation. Zudem war die Sterberate erhöht. Diese Wirkungen gehen mit einer Hemmung der Östrogensynthese bei Ratten einher und sind möglicherweise Folge der bekannten Wirkung von erniedrigtem Östrogen auf Schwangerschaft, Organogenese und Geburt.
Bei trächtigen Kaninchen kam es unter allen Fluconazol Dosierungsstärken zu einer Beeinträchtigung der Gewichtszunahme. Bei Dosierungen über 20 mg/kg traten Aborte auf.
Bei einer perinatalen Studie mit Ratten, die mit 5 mg, 20 mg und 40 mg Fluconazol i.v./kg behandelt wurden, kam es bei einigen Tieren unter 20 mg/kg (ungefähr 5-15× die empfohlene Dosierung beim Menschen) und unter 40 mg/kg zu Dystokie und Verlängerung des Geburtsvorganges, jedoch nicht unter 5 mg/kg.
Der erschwerte Geburtsvorgang war bei diesen Dosen begleitet von einer leichten Zunahme der Totgeburten und einer Abnahme der Zahl überlebender Neugeborenen.
Die Wirkung auf den Geburtsvorgang bei Ratten kann auf den Spezies spezifischen antiöstrogenen Effekt von hohen Fluconazol Dosen zurückgeführt werden. Bei Frauen, die mit Fluconazol behandelt wurden, ist diese hormonverändernde Wirkungen nicht beobachtet worden.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Fluconazol Zentiva soll unterhalb von 25 °C aufbewahrt werden.
Fluconazol Zentiva muss ausserhalb der Reichweite von Kindern in der Originalpackung aufbewahrt werden.
Hinweise für die Handhabung
Die Kapseln sollen ganz geschluckt werden.
Zulassungsnummer56978 (Swissmedic).
PackungenFluconazol Zentiva Kapseln 50 mg: 7. (B)
Fluconazol Zentiva Kapseln 50 mg: 28. (B)
Fluconazol Zentiva Kapseln 150 mg: 1. (B)
Fluconazol Zentiva Kapseln 150 mg: 4. (B)
Fluconazol Zentiva Kapseln 200 mg: 2. (B)
Fluconazol Zentiva Kapseln 200 mg: 7. (B)
ZulassungsinhaberinHelvepharm AG, Frauenfeld.
Stand der InformationAugust 2022.
|