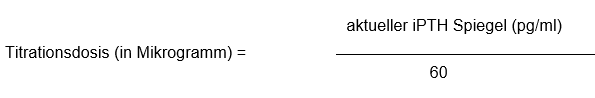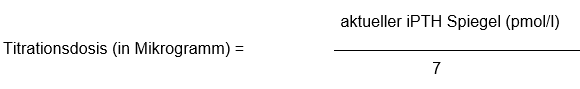ZusammensetzungWirkstoffe
Paricalcitol.
Hilfsstoffe
Weichkapseln 1 µg: mittelkettige Triglyceride, Butylhydroxytoluol (E321), wasserfreies Ethanol (0.71 mg/Weichkapsel), Gelatine, Glycerol, Titandioxid (E171), Eisenoxid schwarz (E172), gereinigtes Wasser, Drucktinte: Propylenglycol (E1520), Eisenoxid schwarz (E172), Polyvinylacetatphtalat, Macrogol 400, Ammoniakhydroxid-Lösung 28%
Weichkapseln 2 µg: mittelkettige Triglyceride, Butylhydroxytoluol (E321), wasserfreies Ethanol (1.42 mg/Weichkapsel), Gelatine, Glycerol, Titandioxid (E171), Eisenoxid rot (E172), Eisenoxid gelb (E172), gereinigtes Wasser, Drucktinte: Propylenglycol (E1520), Eisenoxid schwarz (E172), Polyvinylacetatphtalat, Macrogol 400, Ammoniakhydroxid-Lösung 28%
Indikationen/AnwendungsmöglichkeitenBehandlung des sekundären Hyperparathyreoidismus bei Patienten mit chronischer Niereninsuffizienz in der Prädialysephase (chronic kidney disease (CKD) Stufen 3 und 4) sowie Behandlung des sekundären Hyperparathyreoidismus bei Patienten mit terminaler Niereninsuffizienz (CKD Stufe 5) und chronischer Hämodialyse oder Peritonealdialyse.
Dosierung/AnwendungErwachsene
Chronische Niereninsuffizienz (CKD Stufen 3 & 4)
Zemplar Weichkapseln werden einmal pro Tag entweder täglich oder drei Mal die Woche, d.h. jeden 2. Tag eingenommen.
Zemplar Weichkapseln können unabhängig von den Mahlzeiten eingenommen werden.
Anfangsdosierung
Die Initialdosis von Zemplar Weichkapseln basiert auf den Basis-Serumspiegeln des intakten Parathyroidhormons (iPTH) in metrischen Einheiten (pg/ml). Falls der iPTH Spiegel in SI Einheiten angegeben wird oder eine Umrechnung von metrischen Einheiten in SI Einheiten gewünscht wurde, kann der folgende Konversionsfaktor verwendet werden:
iPTH (pg/ml) = iPTH (pmol/l) / 0,11
|
Tabelle 1: Zemplar Weichkapseln Anfangsdosierung
| |
Basis iPTH Spiegel
|
tägliche Einnahme
|
3x wöchentliche Einnahme *
| |
≤ 500 pg/ml
|
1 μg
|
2 μg
| |
> 500 pg/ml
|
2 μg
|
4 μg
| |
* Verabreichung maximal jeden 2. Tag
|
Dosistitration
Die Dosierung von Zemplar Weichkapseln soll individuell dem Serum- bzw. Plasmaspiegel des Parathyroidhormons angepasst werden. Die Serumspiegel von Kalzium und Phosphor müssen engmaschig überwacht werden.
Tabelle 2 enthält Erläuterungen für das Vorgehen bei einer Dosistitration:
|
Tabelle 2: Zemplar Weichkapseln, Empfehlungen zur Dosistitration
| |
iPTH Spiegel in Relation zum Basiswert
|
Dosierung Zemplar Weichkapseln
|
Dosisanpassung in Intervallen von 2 bis 4 Wochen
| |
tägliche Einnahme
|
3x wöchentliche Einnahme *
| |
Keine Änderung oder Erhöhung
|
Dosis erhöhen
|
1 μg
|
2 μg
| |
Senkung um <30%
| |
Senkung um ≥30% bis ≤60%
|
Dosis beibehalten
|
|
| |
Senkung um >60%
|
Dosis senken**
|
1 μg
|
2 μg
| |
iPTH <60 pg/ml
| |
* Verabreichung maximal jeden 2. Tag
** Falls der Patient bereits die tiefste Dosis einnimmt (täglich bzw. 3x wöchentlich) und eine Dosisreduktion erforderlich ist, kann das Dosisintervall verlängert werden, oder die Behandlung muss unterbrochen werden.
|
Während der Anfangsphase der Therapie mit Zemplar Weichkapseln bzw. während Dosistitrations-Phasen und bei gleichzeitiger Verabreichung von starken CYP 3A Inhibitoren muss der Kalzium-Serumspiegel engmaschig kontrolliert werden. Bei Auftreten einer klinisch signifikanten Hyperkalzämie oder bei Auftreten von anhaltend erhöhtem Kalzium x Phosphor Produkt (Ca x P) welches über 55 mg2/dl2 (über 4,4 mmol2/l2) liegt, muss die Dosierung von Phosphatbindern auf Kalziumbasis reduziert bzw. dessen Verabreichung unterbrochen werden. Alternativ kann auch die Dosis der Zemplar Weichkapseln reduziert oder die Verabreichung vorübergehend abgesetzt werden. Eine Umstellung auf nicht Ca-haltige Phosphatbinder kann erwogen werden. Wurde die Verabreichung von Zemplar Weichkapseln unterbrochen, muss die Therapie mit einer niedrigeren Dosierung wieder begonnen werden, sobald der Kalziumspiegel im Serum sowie das Kalzium x Phosphor Produkt wieder im normalen Bereich liegen.
Terminale Niereninsuffizienz (CKD Stufe 5)
Zemplar Weichkapseln werden entweder jeden Tag oder 3x wöchentlich, d.h. jeden 2. Tag eingenommen.
Zemplar Weichkapseln können unabhängig von den Mahlzeiten eingenommen werden.
Anfangsdosierung
Die Initialdosis von Zemplar Weichkapseln basiert auf den Basis- Serumspiegeln des intakten Parathyroidhormons (iPTH) (pg/ml)/60 [(pmol/l)/7]. Falls der iPTH Spiegel in SI Einheiten angegeben wird oder eine Umrechnung von metrischen Einheiten in SI Einheiten gewünscht wurde, kann der folgende Konversionsfaktor verwendet werden:
iPTH (pg/ml) = iPTH (pmol/l)/0,11.
Dosistitration
Die Dosierung von Zemplar Weichkapseln soll individuell auf die Serumspiegel des Parathyroidhormons sowie auf die Serumspiegel von Kalzium und Phosphor angepasst werden. Die empfohlene Dosistitration mit den Zemplar Weichkapseln stützt sich auf die folgende Formel:
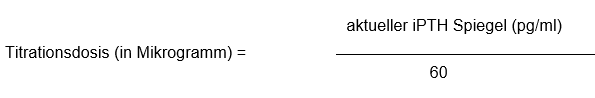
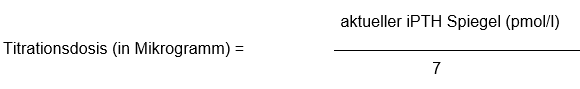
Zu Beginn der Therapie, während der Dosisanpassungs-Phasen und bei gleichzeitiger Verabreichung von starken Cytochrom P450 3A Inhibitoren sollten die Serumspiegel von Kalzium und Phosphor engmaschig überwacht werden. Falls festgestellt wird, dass die Kalziumspiegel über die Norm ansteigen oder das Produkt aus Serum Kalzium × Phosphor (Ca × P) erhöht ist, muss bei Patienten, welche Phosphatbinder auf Kalziumbasis einnehmen, die Dosis des Phosphatbinders reduziert, oder die Verabreichung unterbrochen werden. Allenfalls kann der Patient auch auf einen Phosphatbinder nicht auf Kalziumbasis umgestellt werden. Wenn das Serum-Kalzium (über 11 mg/dl [>2,8 mmol/l]), der Phosphorspiegel oder das Ca x P Produkt (> 70 mg2/dl2 [5,6 mmol2/l2]) erhöht sind, muss die Dosierung von Zemplar Weichkapseln um 2 bis 4 Mikrogramm unter die mittels aktuellem iPTH-Spiegel berechnete Dosierung (iPTH/60 (pg/ml) bzw. [iPTH/7 (pmol/l)]) gesenkt werden. Falls noch weitere Dosisanpassungen notwendig sind, muss die Dosierung der Zemplar Weichkapseln weiter verringert oder die Verabreichung gestoppt werden, bis die betreffenden Parameter wieder im angestrebten Normalbereich liegen.
Wenn der iPTH-Spiegel sich dem angestrebten Normbereich nähert, können kleine und individuelle Dosisanpassungen notwendig sein, um den iPTH-Spiegel zu stabilisieren. Falls die Serumspiegel des iPTH sowie von Kalzium und Phosphor weniger als 1 mal pro Woche kontrolliert werden, ist unter Umständen eine kleinere Initialdosierung und Dosistitration angezeigt.
In klinischen Studien betrug die mittlere Paricalcitol-Dosis in der ersten Woche 3 x 11,2 μg. Die mittlere Dosierung in der Folgewoche betrug 6,3 μg pro Dosis. Die maximal verabreichte und tolerierte Dosis betrug 32 μg.
Leberinsuffizienz
Bei der Behandlung von Patienten mit leichter bis mittelschwerer Leberinsuffizienz ist keine Dosisanpassung erforderlich.
Ältere Patienten
Es konnten keine generellen Unterschiede hinsichtlich der Sicherheit oder der Wirksamkeit einer Therapie mit Zemplar Weichkapseln bei geriatrischen Patienten festgestellt werden. Es kann allerdings nicht ausgeschlossen werden, dass ältere Individuen empfindlicher auf das Arzneimittel reagieren.
Kinder
Die Wirksamkeit und Sicherheit von Zemplar Weichkapseln bei Kindern, die jünger als 10 Jahre sind, wurde nicht untersucht.
CKD Stufen 3 und 4 (Alter 10 bis 16 Jahre und älter)
Anfangsdosierung
Die empfohlene Anfangsdosierung von Zemplar Weichkapseln ist 1 µg dreimal wöchentlich, nicht häufiger als jeden zweiten Tag.
Dosistitration
Nachfolgende Dosierungen soll individuell dem iPTH-Spiegel und den Kalzium- und Phosphat-Serumspiegeln angepasst werden, und zwar so, dass der iPTH Spiegel auf einen Wert im Bereich von 35 bis 70 pg/ml (Stufe 3) bzw. 70 bis 110 pg/ml (Stufe 4) eingestellt wird.
Die Paricalcitol-Dosis kann jeweils alle 4 Wochen in 1 µg-Schritten erhöht werden, wobei die 3-mal wöchentliche Gabe beibehalten werden sollte. Die Dosis kann jederzeit um 1 µg verringert werden und bei Patienten, die die 1 µg Dosis erhalten, kann das Präparat jederzeit gestoppt werden. Die in der klinischen Studie verabreichte Höchstdosis betrug 7 µg pro Gabe.
CKD Stufe 5 (Alter 10 bis 16 Jahre und älter)
Anfangsdosierung
Die empfohlene Anfangsdosierung von Zemplar Weichkapseln in Mikrogramm ist von iPTH-Ausgangsspiegel abhängig und wird mit der Formel (pg/mL)/120 berechnet, wobei jeweils auf die nächste ganze Zahl abgerundet wird. Die Verabreichung erfolgt dreimal wöchentlich, nicht häufiger als jeden zweiten Tag.
Dosistitration
Nachfolgende Dosierungen soll individuell dem iPTH-Spiegel und den Kalzium- und Phosphat-Serumspiegeln angepasst werden, und zwar so, dass der iPTH Spiegel auf einen Wert im Bereich von 150 bis 300 pg/ml eingestellt wird.
Die Paricalcitol-Dosis kann jeweils alle 4 Wochen in 1 µg-Schritten erhöht werden, wobei die 3-mal wöchentliche Gabe beibehalten werden sollte. Sie kann jederzeit bedarfsgerecht in 2 µg-Schritten verringert werden oder gestoppt werden. Die in der klinischen Studie verabreichte Höchstdosis betrug 13 µg pro Gabe.
KontraindikationenZemplar darf Patienten mit einer Hyperkalzämie oder Anzeichen von Vitamin D-Toxizität nicht verabreicht werden.
Als Kontraindikation gilt auch die Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenAkute Überdosierung von Paricalcitol kann eine Hyperkalzämie verursachen und erfordert eine notfallmässige Betreuung.
Übermässige Suppression des Parathyroidhormons kann eine Hyperkalzämie, Hyperkalziurie oder Hyperphosphatämie bewirken und zu einer low-turnover-Osteopathie führen. Akute Hyperkalzämien können kardiale Rhytmusstörungen und Krampfanfälle begünstigen. Chronische Hyperkalzämie kann eine generalisierte Kalkablagerung in Gefässen und im Bindegewebe zur Folge haben. Eine Überwachung des Patienten und individuelle Dosisanpassung sind wichtig.
Wird bei einem Patienten, welcher Phosphatbinder auf Kalziumbasis erhält, eine klinisch relevante Hyperkalzämie festgestellt, sollte die Dosis des Phosphatbinders reduziert, oder die Verabreichung unterbrochen werden.
Bei noch nicht dialysierten Patienten können Paricalcitol wie auch andere Vitamin D-Rezeptor-Aktivatoren das Serumkreatinin erhöhen. Dadurch wird die geschätzte glomeruläre Filtrationsrate (eGFR) erniedrigt ohne die absolute GFR zu verändern.
Es liegen keine Langzeitstudien vor, die den Einfluss von Paricalcitol auf den Verlauf der Niereninsuffizienz untersucht haben. Etwa fehlen kontrollierte Langzeitstudien mit harten klinischen Endpunkten, wie Mortalität, Osteodystrophia fibrosa generalisata.
Eine Zemplar 1 µg Weichkapsel enthält 0.71 mg Alkohol (Ethanol) und eine Zemplar 2 µg Weichkapsel enthält 1.42 mg Alkohol (Ethanol). Die Menge in einer Weichkapsel dieses Arzneimittels entspricht weniger als 1 ml Bier oder 1 ml Wein. Die geringe Alkoholmenge in diesem Arzneimittel hat keine wahrnehmbaren Auswirkungen.
InteraktionenEs wird nicht erwartet, dass Paricalcitol die Clearance von Substanzen hemmt, die über CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6, CYP2E1 oder CYP3A metabolisiert werden oder die Clearance von Substanzen erhöht, die über CYP2B6, CYP2C9 oder CYP3A metabolisiert werden.
Eine Interaktionsstudie mit mehrfachen Dosen von Ketokonazol und Paricalcitol Kapseln zeigte, dass Ketokonazol die AUC0-∞ von Paricalcitol ungefähr verdoppelte. Weil Paricalcitol teilweise über CYP3A metabolisiert wird und Ketokonazol bekanntlich ein starker Hemmer von CYP3A ist, soll Paricalcitol mit Vorsicht zusammen mit Ketokonazol oder anderen starken CYP3A Hemmer angewendet werden.
Phosphathaltige Arzneimittel oder mit Vitamin D verwandte Präparate dürfen nicht gleichzeitig mit Zemplar Weichkapseln eingenommen werden, da ein erhöhtes Risiko einer Hyperkalzämie- und einer Ca x P Produkt-Erhöhung besteht.
Die Digitalis-Toxizität wird durch Hyperkalzämie jeglichen Ursprungs verstärkt, so dass Vorsicht angezeigt ist, wenn Digitalis-Präparate gleichzeitig mit Zemplar Weichkapseln verschrieben werden.
Gleichzeitige Verabreichung von hohen Dosen von kalziumhaltigen Arzneimitteln oder Thiazid-Diuretika mit Zemplar Weichkapseln können das Risiko einer Hyperkalzämie erhöhen.
Magnesiumhaltige Arzneimittel (v.a. Antazida) sollten nicht gleichzeitig mit Zemplar Weichkapseln eingenommen werden, da eine Hypermagnesiämie auftreten kann.
Aluminiumhaltige Arzneimittel (v.a. Antazida, Phosphatbinder) sollten nicht dauernd mit Zemplar Weichkapseln eingenommen werden, da erhöhte Aluminiumwerte im Blut und eine aluminiumbedingte Knochentoxizität auftreten können.
Arzneimittel, die die intestinale Absorption von fettlöslichen Vitaminen beeinflussen, wie z.B. Cholestyramin, können mit der Absorption von Zemplar Weichkapseln interferieren.
Schwangerschaft, StillzeitEs liegen keine klinischen Daten mit Anwendung bei Schwangeren vor.
Tierexperimentelle Studien ergaben Hinweise auf indirekte Toxizität unter maternotoxischen Dosen mit Auswirkung auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Föten und/oder die postnatale Entwicklung. Das potentielle Risiko für den Menschen ist nicht bekannt. Zemplar darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Da keine Daten darüber vorliegen, ob Paricalcitol in die Muttermilch übergeht, darf während der Behandlung mit Zemplar Weichkapseln nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Es kann jedoch erwartet werden, dass die Einnahme von Paricalcitol keinen massgeblichen Einfluss auf die Fahrtüchtigkeit und das Bedienen von Maschinen hat.
Unerwünschte WirkungenCKD Stufen 3 & 4
Zulassungsstudien bei Erwachsenen
Die Sicherheit von Zemplar Weichkapseln wurde an 220 Patienten mit CKD der Stufen 3 und 4 in drei klinischen doppelblinden, placebokontrollierten Multicenter-Studien über eine Dauer von je 24 Wochen untersucht.
Es konnten keine statistisch signifikanten Unterschiede zwischen der mit Paricalcitol behandelten Patientengruppe und der Placebo-Gruppe ausgemacht werden, weder in Bezug auf die Inzidenz von Hyperkalzämie (Zemplar Weichkapseln 2/106 (2%) gegen Placebo 0/111 (0%), p = 0,237) noch in Bezug auf die Inzidenz der Erhöhung des Kalzium x Phosphor-Produktes (Zemplar Weichkapseln 13/106 (12%) gegen Placebo 7/111 (6%), p = 0,161).
Das im Zusammenhang mit Zemplar am häufigsten beobachtete unerwünschte Ereignis war Hautausschlag (bei 2% der Patienten).
Alle unerwünschten Wirkungen (klinische und Labor-Befunde), die in möglichem Zusammenhang mit der Verabreichung von Paricalcitol stehen, sind in Tabelle 3 nach Häufigkeiten geordnet aufgelistet.
Häufigkeiten: sehr häufig (≥1/10), häufig (< 1/10, ≥1/100); gelegentlich (<1/100, ≥1/1000), selten (<1/1000, ≥1/10'000), sehr selten (<1/10'000, einschliesslich gemeldeter Einzelfälle).
|
Tabelle 3: Unerwünschte Wirkungen aus klinischen Studien
| |
Organsystem
|
Häufigkeit
|
Unerwünschte Wirkung
| |
Erkrankungen des Immunsystems
|
gelegentlich
|
Überempfindlichkeitsreaktionen
| |
Erkrankungen des Nervensystems
|
gelegentlich
|
Benommenheit, Geschmacksstörung
| |
Erkrankungen des Gastrointestinaltrakts
|
häufig
|
Abdominale Beschwerden
| |
gelegentlich
|
Verstopfung, trockener Mund
| |
Erkrankungen der Haut und des Unterhautgewebes
|
häufig
|
Ausschlag
| |
gelegentlich
|
Pruritus, Urtikaria
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
gelegentlich
|
Muskelspasmen
| |
Untersuchungen
|
gelegentlich
|
Abnormale hepatische Enzymwerte
|
Studie bei Kindern und Jugendlichen
Die Sicherheit von Paricalcitol-Kapseln wurde in einer multizentrischen klinischen Studie bei Patienten im Alter von 10 bis 16 Jahren mit CKD-Stufe 3 und 4 untersucht. Während der 12-wöchigen verblindeten Phase erhielten insgesamt 18 Patienten Paricalcitol-Kapseln und 18 Patienten erhielten Placebo. In einer anschliessenden unverblindeten Phase erhielten insgesamt 29 Patienten Paricalcitol.
Tabelle 4 enthält alle unerwünschten Wirkungen (sowohl klinische als auch solche, die Laborwerte betreffen), bei denen ein Zusammenhang mit Paricalcitol als zumindest möglich bewertet wurde. Die unerwünschten Wirkungen sind nach Häufigkeiten und MedDRA-Systemorganklassen geordnet. Die folgenden Häufigkeitskategorien werden verwendet: sehr häufig (≥1/10); häufig (≥1/100 und < 1/10); gelegentlich (≥1/1,000 und <1/100); selten (≥1/10,000 und < 1/1,000); sehr selten (< 1/10,000), einschliesslich gemeldeter Einzelfälle.
|
Tabelle 4: Unerwünschte Wirkungen aus klinischen Studien bei pädiatrischen Patienten mit CKD Stufe 3 & 4
| |
Organsystem
|
Häufigkeit
|
Unerwünschte Wirkung
| |
Verblindete Phase
| |
Erkrankungen des Gastrointestinaltrakts
|
häufig
|
Übelkeit
| |
Stoffwechsel- und Ernährungsstörungen
|
häufig
|
Hyperkalzämie*
| |
Unverblindete Phase
| |
Stoffwechsel- und Ernährungsstörungen
|
häufig
|
Hyperphosphatämie
| |
Erkrankungen des Nervensystems
|
häufig
|
Kopfschmerzen
|
*In der verblindeten Phase der klinischen Studie trat bei 5.6% (1/18) der mit Paricalcitol behandelten Patienten Hyperkalzämie auf; in der unverblindeten Phase wurde Hyperkalzämie bei 10.3% (3/29) der mit Paricalcitol behandelten Patienten beobachtet. Hyperkalzämie war definiert als mindestens 2-malig hintereinander aufgetretene Erhöhung des Serum-Kalziumspiegels von >10.2 mg/dl (2.55 mmol/l).
CKD Stufe 5
Zulassungsstudie bei Erwachsenen
Die Sicherheit von Zemplar Weichkapseln wurde an 88 Patienten mit CKD der Stufe 5 in einer klinischen doppelblinden, placebokontrollierten Multizenter-Studie mit einer Dauer von 12 Wochen untersucht.
Es konnten keine statistisch signifikanten Unterschiede zwischen der mit Paricalcitol behandelten Patientengruppe und der Placebo-Gruppe ausgemacht werden, weder in Bezug auf die Inzidenz von Hyperkalzämie (Zemplar Weichkapseln 1/61 (2%) gegen Placebo 0/26 (0%), p=0,999), noch in Bezug auf die Inzidenz der Erhöhung des Kalzium x Phosphor-Produktes (Zemplar Weichkapseln 6/61 (10%) gegen Placebo 1/26 (4%), p=0,669).
Zwischen den unter Zemplar Weichkapseln oder Placebo aufgetretenen unerwünschten Wirkungen konnten in Bezug auf Art und Inzidenz weder statistisch signifikante noch klinisch relevante Unterschiede ausgemacht werden. Der Anteil an Patienten welche aufgrund von unerwünschten Ereignissen frühzeitig aus der Studie ausschieden war 7%, sowohl für die Paricalcitol-Gruppe, wie auch für die Placebo-Gruppe.
Alle unerwünschten Wirkungen (klinische und Labor-Befunde), die in möglichem Zusammenhang mit der Verabreichung von Paricalcitol stehen, sind in Tabelle 5 nach Häufigkeiten geordnet aufgelistet.
Häufigkeiten: sehr häufig (≥1/10), häufig (<1/10, ≥1/100); gelegentlich (<1/100, ≥1/1000), selten (<1/1000, ≥1/10'000), sehr selten (<1/10'00, einschliesslich gemeldeter Einzelfälle).
|
Tabelle 5: Unerwünschte Wirkungen aus klinischen Studien der Phase 3 bei Patienten mit CKD Stufe 5
| |
Organsystem
|
Häufigkeit
|
Unerwünschte Wirkung
| |
Stoffwechsel- und Ernährungsstörungen
|
häufig
|
Hyperkalzämie, Hypokalzämie, verminderter Appetit
| |
Erkrankungen des Nervensystems
|
häufig
|
Benommenheit
| |
Erkrankungen des Gastrointestinaltrakts
|
häufig
|
Diarrhöe, gastro-oesophagealer Reflux
| |
Erkrankungen der Haut und des Unterhautgewebes
|
häufig
|
Akne
| |
Erkrankungen der Geschlechtsorgane und der Brustdrüse
|
häufig
|
Spannungen in der Brust
|
Studie bei Kindern und Jugendlichen
Die Sicherheit von Paricalcitol-Kapseln wurde in einer 12-wöchigen multizentrischen, unverblindeten, einarmigen klinischen Studie untersucht, an der 13 Patienten im Alter von 10 bis 16 Jahren mit CKD-Stufe 5 teilnahmen, die eine Peritonealdialyse oder Hämodialyse erhielten.
Tabelle 6 enthält alle unerwünschten Wirkungen (sowohl klinische als auch solche, die Laborwerte betreffen), bei denen ein Zusammenhang mit Paricalcitol als zumindest möglich bewertet wurde. Die unerwünschten Wirkungen sind nach Häufigkeiten und MedDRA-Systemorganklassen geordnet. Die folgenden Häufigkeitskategorien werden verwendet: sehr häufig (≥1/10); häufig (≥1/100 und < 1/10); gelegentlich (≥1/1'000 und <1/100); selten (≥1/10'000 und < 1/1'000); sehr selten (< 1/10'000), einschliesslich gemeldeter Einzelfälle.
|
Tabelle 6: Unerwünschte Wirkungen aus klinischen Studien bei pädiatrischen Patienten mit CKD Stufe 5
| |
Organsystem
|
Häufigkeit
|
Unerwünschte Wirkung
| |
Stoffwechsel- und Ernährungsstörungen
|
häufig
|
Hyperkalzämie*, Hyperphosphatämie
|
*Hyperkalzämie, definiert als mindestens 2-malig hintereinander aufgetretene Erhöhung des Serum-Kalziumspiegels von >10.2 mg/dl (2.55 mmol/l) wurde bei 23% (3/13) der Patienten beobachtet.
Unerwünschte Wirkungen aus Post Marketing Erfahrung und Post Marketing klinischen Studien
Die folgenden zusätzlichen unerwünschten Wirkungen wurden bei Post Marketing Erfahrung beobachtet. Die unerwünschten Wirkungen sind nach Organklassen dargestellt.
|
Tabelle 7: Unerwünschte Wirkungen aus Post Marketing Erfahrung und Post Marketing klinischen Studien
| |
Erkrankungen des Immunsystems
|
Allergische Reaktion, Urtikaria, Angiooedem und Kehlkopfoedem.
| |
Untersuchungen
|
Blutkreatinin erhöht (siehe «Warnhinweise und Vorsichtsmassnahmen»)
|
In einer off-Label klinischen Studie, in der Paricalcitol in höheren Dosen verabreicht wurde, wurde im Paricalcitol-Arm verglichen zum Placebo-Arm über eine höhere Inzidenz von Hyperkalzämie (P = 0.002) und über eine stärkere Erhöhung des Kalzium x Phosphor-Produktes gegenüber Baseline (P < 0,001) berichtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAkute Überdosierung von Paricalcitol kann eine Hyperkalzämie, Hyperkalziurie, Hyperphosphatämie sowie übermässige Suppression des Parathormons zur Folge haben. Eine hoch dosierte Einnahme von Kalzium und Phosphat zusammen mit Zemplar Weichkapseln kann ähnliche Auswirkungen haben.
Die Therapie einer akuten unabsichtlichen Überdosierung von Zemplar Weichkapseln besteht in allgemein unterstützenden Massnahmen. Falls die Einnahme der Paricalcitol-Überdosis rasch bemerkt wird, kann durch induziertes Erbrechen oder Magenspülung eine weitere Aufnahme des Arzneimittels verhindert werden. Wenn das Arzneimittel bereits den Magen passiert hat, kann durch die Verabreichung von Mineralöl versucht werden, die Ausscheidung via Fäzes zu beschleunigen. Es wird empfohlen, eine fortlaufende Bestimmung der Serum-Elektrolyte (v.a. Kalzium) durchzuführen, sowie die renale Kalziumexkretionsrate zu bestimmen und eventuelle elektrokardiographische Abweichungen bedingt durch eine Hyperkalziämie zu bestimmen. Bei Patienten, welche digitalisiert sind, ist eine derartige Überwachung von entscheidender Wichtigkeit.
Eine eventuelle Kalziumsupplementierung muss abgesetzt werden und eine kalziumarme Diät verschrieben werden. Aufgrund der relativ kurzen pharmakologischen Wirkung von Paricalcitol sind weiterführende Massnahmen unter Umständen nicht nötig.
Schwere Hyperkalzämie kann mittels Verabreichung von Phosphaten und Kortikosteroiden sowie auch durch eine forcierte Diurese behandelt werden.
Paricalcitol wird allerdings mittels Dialyse nicht signifikant eliminiert.
Eigenschaften/WirkungenATC-Code
H05BX02
Wirkungsmechanismus/Pharmakodynamik
Paricalcitol ist ein synthetisches, biologisch aktives Vitamin D-Analogon von Calcitriol mit chemischen Modifikationen an den Seitenketten (D2) und dem A (19-nor)-Ring. Präklinische Studien und in vitro Studien haben gezeigt, dass die biologische Wirkung von Paricalcitol auf der Bindung an den Vitamin D-Rezeptor (VDR) basiert, was zu einer selektiven Aktivierung von Vitamin D-abhängigen Prozessen führt. Es wurde gezeigt, dass Vitamin D und Paricalcitol den PTH Spiegel durch Hemmung der PTH Synthese und der PTH Ausschüttung hemmen.
Sekundärer Hyperparathyreoidsimus ist charakterisiert durch eine Erhöhung des Parathyroidhormons (PTH) verbunden mit unzureichenden Konzentrationen an aktivem Vitamin D. Vitamin D benötigt zwei aufeinanderfolgende Hydroxilierungen in der Leber und der Niere, um an den Vitamin D-Rezeptor (VDR) binden und diesen aktivieren zu können. Der endogene VDR Aktivator Calcitriol (aktiviertes Vitamin D) ist ein Hormon, welches an VDRs in der Nähe der Nebenschilddrüse, des Darms, der Nieren und der Knochen bindet, wodurch die PTH Funktion und die Kalzium und Phosphat-Homöostase aufrechterhalten werden, sowie an VDRs in vielen anderen Geweben wie Prostata, Endothelium und Zellen des Immunsystems.
Die VDR Aktivierung ist essenziell für eine gesunde Entwicklung und Aufrechterhaltung der Knochen. Bei Nierenerkrankungen ist die Vitamin D Aktivierung verringert. Die daraus folgende Erhöhung des PTH führt zu einem sekundären Hyperparathyroidismus und zu einer Störung der Kalzium- und Phosphat-Homöostase. Die erniedrigten Calcitriol-Spiegel und das daraus resultierende erhöhte PTH, welche oft einer Störung im Kalzium- und Phosphats-Spiegel vorausgehen, haben einen Einfluss auf die turnover Rate im Knochen und können zu einer renalen Ostoedystrophie führen.
Klinische Wirksamkeit
CKD Stufen 3 & 4
Zulassungsstudien bei Erwachsenen
Die Sicherheit und Wirksamkeit von Zemplar Weichkapseln wurde an 220 Patienten mit CKD der Stufen 3 und 4 in drei klinischen doppelblinden, placebokontrollierten Multicenter-Studien über eine Dauer von je 24 Wochen untersucht.
Es konnten keine statistisch signifikanten Unterschiede zwischen der mit Paricalcitol behandelten Patientengruppe und der Placebo-Gruppe ausgemacht werden, weder in Bezug auf die Inzidenz von Hyperkalzämie (Zemplar Weichkapseln 2/106 (2%) gegen Placebo 0/111 (0%), p = 0,237) noch in Bezug auf die Inzidenz der Erhöhung des Kalzium x Phosphor-Produktes (Zemplar Weichkapseln 13/106 (12%) gegen Placebo 7/111 (6%), p = 0,161).
Studien bei Kindern und Jugendlichen
Die Sicherheit und Wirksamkeit von Paricalcitol-Kapseln wurden in einer 12-wöchigen multizentrischen, doppelblinden, placebokontrollierten, randomisierten Studie bei Kindern und Jugendlichen im Alter von 10 bis 16 Jahren mit CKD der Stufe 3 und 4 untersucht. In der verblindeten Phase der Studie erhielten insgesamt 18 Patienten Paricalcitol-Kapseln und 18 Patienten erhielten Placebo. Das Durchschnittsalter der Patienten betrug 13,6 Jahre und 69% waren männlich, 86% kaukasischer Abstammung und 8% asiatischer Abstammung. In der Paricalcitol-Behandlungsgruppe schlossen 72% und in der Placebo-Gruppe 89% der Patienten die 12-wöchige verblindete Behandlungsphase ab.
Die Anfangsdosis von Paricalcitol-Kapseln betrug 1 µg dreimal wöchentlich. Alle 2-4 Wochen wurden die iPTH-, Kalzium- und Phosphat-Spiegel bestimmt, um die Werte im Kidney Disease Outcomes Quality Initiatives (KDOQI)-Zielbereich für Patienten mit CKD der Stufe 3 und 4 zu halten. Ab Behandlungswoche 4 konnten die Dosen abhängig von den Sicherheitsdaten und den biochemischen Blutwerten alle 4 Wochen in 1 µg-Schritten erhöht werden. Bedarfsentsprechend konnte die Dosis jederzeit um 1 µg verringert werden bzw. das Präparat abgesetzt werden, wenn der Patient die Dosis von 1 µg erhielt. Die maximal erlaubte Dosis betrug 3 µg dreimal wöchentlich.
Im Anschluss an die 12-wöchige verblindete Phase erhielten 13 der zuvor mit Paricalcitol und 16 der zuvor mit Placebo behandelten Patienten unverblindet Paricalcitol-Kapseln. Während die maximal erlaubte Dosis 16 µg dreimal wöchentlich betrug, war die höchste verabreichte Dosis 7 µg dreimal wöchentlich.
Der primäre Wirksamkeitsendpunkt war der Anteil der Patienten der Stufen 3 und 4, bei denen bei zwei aufeinanderfolgenden Bestimmungen eine Reduktion des iPTH-Spiegels um ≥30% gegenüber dem Ausgangswert festgestellt wurde. Darüber hinaus wurde untersucht, ob der letzte gemessene iPTH-Spiegel im KDOQI-Zielbereich lag. Die Ergebnisse sind in Tabelle 8 dargestellt.
|
Tabelle 8: Veränderung des iPTH gegenüber dem Ausgangswert in der pädiatrischen Studie mit CKD der Stufe 3 und 4
| |
Phase / Behandlung
|
Zwei aufeinanderfolgende Reduktionen des iPTH-Spiegels um ≥30% gegenüber dem Ausgangswert
|
Zuletzt gemessener iPTH-Spiegel im KDOQI-Zielbereich
| |
Verblindete Phase
| |
Placebo
|
0/18 (0%)
|
2/18 (11.1%)
| |
Paricalcitol
|
5/18 (27.8%)*
|
6/18 (33.3%)**
| |
Unverblindete Phase
| |
Placebo zu Paricalcitol
|
7/16 (43.8%)
|
6/16 (37.5%)
| |
Paricalcitol zu Paricalcitol
|
5/13 (38.5%)
|
2/13 (15.4%)
| |
* p < 0.05 gegenüber Placebo
** p = 0.128 gegenüber Placebo
|
Insgesamt wiesen 16/34 (47,1%) der mit Paricalcitol behandelten Patienten bei 2 aufeinanderfolgenden Bestimmungen eine Reduktion des iPTH-Spiegels um mindestens 30% gegenüber dem Ausgangswert auf, und bei 10/34 (29,4%) der Patienten lag der letzte gemessene iPTH-Spiegel innerhalb des KDOQI-Zielbereichs.
In der verblindeten Phase war die zwischen den Behandlungsgruppen zu verzeichnende Differenz bezüglich der mittleren Änderung des iPTH-Spiegels gegenüber dem Ausgangswert bei jedem Termin nach dem Baseline-Termin statistisch signifikant (p < 0,05). Ebenso war die zwischen den Behandlungsgruppen zu verzeichnende Differenz bezüglich der mittleren prozentualen Änderung gegenüber dem Ausgangswert bei jedem Termin nach dem Baseline-Termin statistisch signifikant (p < 0,05). In keiner der anderen sekundären Wirksamkeitsanalysen wurde eine statistisch signifikante Differenz zwischen den Gruppen beobachtet.
CKD Stufe 5
Zulassungsstudie bei Erwachsenen
Die Sicherheit und Wirksamkeit von Zemplar Weichkapseln wurde an 88 Patienten mit CKD der Stufe 5 in einer klinischen doppelblinden, placebokontrollierten Multizenter-Studie mit einer Dauer von 12 Wochen untersucht.
Es konnten keine statistisch signifikanten Unterschiede zwischen der mit Paricalcitol behandelten Patientengruppe und der Placebo-Gruppe ausgemacht werden, weder in Bezug auf die Inzidenz von Hyperkalzämie (Zemplar Weichkapseln 1/61 (2%) gegen Placebo 0/26 (0%), p=0,999), noch in Bezug auf die Inzidenz der Erhöhung des Kalzium x Phosphor-Produktes (Zemplar Weichkapseln 6/61 (10%) gegen Placebo 1/26 (4%), p=0,669).
Studie bei Kindern und Jugendlichen
Die Sicherheit von Paricalcitol-Kapseln wurde in einer 12-wöchigen multizentrischen, unverblindeten, einarmigen Studie untersucht, an der Kinder und Jugendliche im Alter von 10 bis 16 Jahren mit CKD der Stufe 5 teilnahmen, die eine Peritonealdialyse oder Hämodialyse erhielten. Insgesamt erhielten 13 Kinder und Jugendliche Paricalcitol-Kapseln. Das Durchschnittsalter der Patienten betrug 14,5 Jahre und 62% waren weiblich, 62% kaukasischer Abstammung und 15% afroamerikanischer Abstammung. Insgesamt 85% der Patienten schlossen die 12-wöchige Studie ab.
Die empfohlene Paricalcitol-Anfangsdosis war vom iPTH-Ausgangsspiegel abhängig und wurde mit Hilfe der Formel (pg/ml)/120 berechnet, wobei jeweils auf die nächste ganze Zahl abgerundet wurde. Alle 2-4 Wochen wurden die iPTH-, Kalzium- und Phosphat-Spiegel bestimmt, um die Werte im KDOQI-Zielbereich für Patienten mit CKD der Stufe 5 zu halten. Ab Behandlungswoche 4 konnten die Dosen alle 4 Wochen in 1 µg-Schritten erhöht werden. Aus irgendeinem Grund erforderliche Dosisreduktionen hatten in 2-µg-Schritten zu erfolgen. Während die maximal erlaubte Dosis 16 µg dreimal wöchentlich betrug, war die höchste verabreichte Dosis 13 µg dreimal wöchentlich.
Zwar wurde die Wirksamkeit nicht systematisch untersucht, jedoch wurde bei 8/13 Patienten (61,5%) bei zwei aufeinanderfolgenden Bestimmungen eine Reduktion des iPTH-Spiegels um mindestens 30% gegenüber dem Ausgangswert festgestellt (95%-KI: 31,6; 86,1). Bei 5/13 Patienten (38,5%) wurde bei 2 aufeinanderfolgenden Bestimmungen ein iPTH-Wert gemessen, der im KDOQI-Zielbereich lag (95%-KI: 13,9; 68,4).
Bei 2/13 Patienten (15%) wurde eine Hyperkalzämie beobachtet, die definiert war als Kalzium-Spiegel >10,2 mg/dl (2,55 mmol/l) bei mindestens 2 aufeinanderfolgenden Bestimmungen (95%-KI: 1,9 % – 45,4%).
PharmakokinetikAbsorption
Paricalcitol wird gut resorbiert. Nach oraler Administration von 0,24 μg Paricalcitol/kg an gesunde erwachsene Probanden beträgt die mittlere absolute Bioverfügbarkeit ungefähr 72%, die maximale Plasmakonzentration (Cmax), Zeit bis Cmax (tmax) und der AUC-Zeit-Verlauf (AUC0-∞) betragen 0,630 ng/ml (1,512 pmol/ml), 3 Stunden, beziehungsweise 5,25 ng x h/ml (12,60 pmol x h/ml).
Die mittlere absolute Bioverfügbarkeit von Paricalcitol bei haemodialysierten und peritoneal-dialysierten Patienten ist 79%, beziehungsweise 86%, mit einer oberen Grenze des 95%-Konfidenzintervalls von 93%, beziehungsweise von 112%. Eine Studie über den Einfluss von Nahrung an gesunden Probanden zeigte, dass Cmax und die AUC0-∞ unverändert waren, wenn Paricalcitol zusammen mit einer Mahlzeit mit hohem Fettgehalt verabreicht wurde, im Vergleich zu einer Verabreichung an nüchterne Probanden. Daher können Zemplar Weichkapseln unabhängig von der Nahrungseinnahme verabreicht werden.
Die Cmax und AUC0-∞ von Paricalcitol stiegen proportional über den Dosierungsbereich von 0,06 bis 0,48 μg/kg bei gesunden Probanden. Nach mehrfacher Verabreichung an gesunde Probanden, entweder täglich oder dreimal wöchentlich, wurde die Steady-State-Konzentration innerhalb von sieben Tagen erreicht und blieb über den Zeitverlauf konstant.
Distribution
Paricalcitol weist eine starke, im Dosierungsbereich nicht sättigbare Plasmaproteinbindung auf (>99%). Das Steady State Verteilungsvolumen in gesunden erwachsenen Probanden beträgt nach Gabe von 0,24 µg/kg ungefähr 34 l. Bei Patienten mit terminaler Niereninsuffizienz, welche Hämodialyse und peritoneale Dialyse benötigen, beträgt das mittlere Verteilungsvolumen ungefähr 31 bis 35 l, folgend auf eine intravenöse Dosis von 0,24 µg/kg Paricalcitol.
Metabolismus
Nach oraler Administration einer Dosis von 0,48 μg/kg 3H-Paricalcitol erfährt die Ausgangssubstanz eine extensive Metabolisierung, wobei nur 2% der verabreichten Dosis unverändert in den Faeces ausgeschieden werden und keine Ausgangssubstanz im Urin wiedergefunden wird. Ungefähr 70% der Radioaktivität werden via Faeces ausgeschieden und 18% werden im Urin wiedergefunden. Der Hauptanteil der systemischen Exposition geht auf die Ausgangssubstanz zurück. Zwei im Vergleich zu Paricalcitol unbedeutendere Metabolite konnten im humanen Plasma nachgewiesen werden. Bei einem der Metaboliten handelt es sich um 24(R)-Hydroxyparicalcitol, wobei der andere Metabolit nicht identifiziert werden konnte. 24(R)-Hydroxyparicalcitol zeigt weniger starke pharmakologische Aktivität in Bezug auf die Suppression von PTH in einem in vivo Rattenmodell als Paricalcitol.
In vitro Daten deuten darauf hin, dass Paricalcitol durch verschiedene hepatische und nicht-hepatische Enzyme, einschliesslich mitochondrialem CYP24 sowie CYP3A4 und UGT1A4 metabolisiert wird. Die ermittelten Metabolite schliessen die Produkte der 24-R-Hydroxilierung, 24,26- und 24,28-Dihydroxilierung sowie eine direkte Glucuronidierung ein.
Elimination
Bei gesunden erwachsenen Probanden beträgt die Eliminationshalbwertszeit von Paricalcitol 5 bis 7 Stunden über den Dosisbereich von 0,06 bis 0,48 μg/kg. Haemodialytische Verfahren haben keinen wesentlichen Einfluss auf die Elimination von Paricalcitol.
Kinetik spezieller Patientengruppen
Altersgruppen
Es liegen bislang keine pharmakokinetischen Daten für ältere Patienten über 65 Jahre vor.
Kinder und Jugendliche
Die Pharmakokinetik einer 3 µg Einzeldosis von Paricalcitol wurde bei Kindern und Jugendlichen im Alter von 10 bis 16 Jahren mit CKD der Stufe 3 (n=6) und 4 (n=6) untersucht. Bei Kindern und Jugendlichen mit CKD der Stufe 3 betrug die Cmax 0,12 ± 0,06 ng/ml und die AUC0-∞ 2,63 ± 0,76 ng•h/ml. Bei Kindern und Jugendlichen mit CKD der Stufe 4 betrug die Cmax 0,14 ± 0,05 ng/ml und die AUC0-∞ 3,12 ± 0,91 ng•h/ml. Die t1/2 von Paricalcitol lag bei Kindern und Jugendlichen mit CKD der Stufe 3 bei 13,3 ± 4,3 Stunden und bei jenem mit CKD der Stufe 4 bei 15,2 ± 4,4 Stunden.
Die Werte für Cmax, AUC und t1/2 von Paricalcitol fielen bei Kindern und Jugendlichen im Alter von 10 bis 16 Jahren mit CKD der Stufe 3 und 4 ähnlich aus. Eine populationspharmakokinetische Analyse zeigt, dass die Pharmakokinetik von Paricalcitol bei Kindern und Jugendlichen mit CKD der Stufe 5 jener von Kindern und Jugendlichen mit CKD der Stufe 3 und 4 vergleichbar zu sein scheint.
Geschlecht
Im Dosisbereich zwischen 0,06 und 0,48 μg Paricalcitol pro Kilogramm Körpergewicht konnten keine Unterschiede bei den pharmakokinetischen Parametern von Frauen oder Männern festgestellt werden.
Leberinsuffizienz
In einer Studie, welche mit der Zemplar Injektionslösung durchgeführt wurde, wurde die Verfügbarkeit von Paricalcitol in einer Dosierung von 0,24 μg/kg Körpergewicht untersucht bei Patienten mit leichter Leberinsuffizienz (n = 5), sowie bei Patienten mit mässiger Leberinsuffizienz (n = 5) und bei gesunden Probanden mit normaler Leberfunktion (n = 10).
Die Fraktion von nicht gebundenem Paricalcitol ist bei Patienten mit leichter bis mässiger Leberinsuffizienz etwa gleich gross wie bei gesunden Probanden. Daher ist eine Dosisanpassung bei dieser Patientengruppe nicht angezeigt. Es sind keine diesbezüglichen pharmakokinetischen Daten für Patienten mit schwerer Leberinsuffizienz vorhanden.
Niereninsuffizienz
Die Pharmakokinetik von Paricalcitol nach einer einmaligen Verabreichung einer oralen Dosis wurde bei folgenden Patienten-Gruppen untersucht: Patienten mit CKD Stufe 3 oder mässig starker Einschränkung der Nierenfunktion (n = 15, GFR = 36,9 bis 59,1 ml/min/1,73 m2) und CKD Stufe 4 oder schwerwiegender Einschränkung der Nierenfunktion (n = 14, GFR = 13,1 bis 29,4 ml/min/1,73 m2). In Analogie zum endogen hergestellten 1,25 Dihydroxy-Vitamin-D3 werden die pharmakokinetischen Parameter von Paricalcitol, nach oraler Verabreichung, signifikant durch die Niereninsuffizienz beeinflusst. Dies ist in Tabelle 9 dargestellt. Im Vergleich zu gesunden Probanden zeigten Patienten mit CKD der Stufen 3 und 4 eine verminderte renale Clearance und gleichzeitig eine verlängerte Halbwertszeit für Paricalcitol.
|
Tabelle 9: Vergleich der mittleren ± Standardabweichungen der pharmakokinetischen Parameter bei Patienten mit unterschiedlichen Schweregraden von Niereninsuffizienz gegenüber gesunden Probanden
| |
Parameter
|
Gesunde Probanden
|
CKD Stufe 3
|
CKD Stufe 4
| |
n
|
25
|
15
|
14
| |
Dosis (μg/kg)
|
0,240
|
0,047
|
0,036
| |
Cl/F (l/h)
|
3,6 ± 1,0
|
1,8 ± 0,5
|
1,5 ± 0,4
| |
t½(h)
|
5,9 ± 2,8
|
16,8 ± 2,6
|
19,7 ± 7,2
| |
fu* (%)
|
0,06 ± 0,01
|
0,06 ± 0,01
|
0,07 ± 0,02
| |
* Gemessen bei einer Konzentration von 15 nM Paricalcitol.
|
Nach Verabreichung von Zemplar Weichkapseln sind die pharmakokinetischen Profile von Paricalcitol für die Stadien CKD 3 und 4 vergleichbar. Ausser den empfohlenen Dosierungsempfehlungen sind keine weiteren Dosisanpassungen notwendig (siehe «Dosierung/Anwendung»).
Präklinische DatenAuffällige Befunde aus toxikologischen Untersuchungen mit wiederholter Verabreichung des Arzneistoffes an Nagetiere und Hunde können grundsätzlich der kalzämischen Wirkung von Paricalcitol zugeschrieben werden. Wirkungen des Arzneistoffes, welche nicht eindeutig mit einer Hyperkalzämie in Verbindung gebracht werden können, beinhalten eine Abnahme der Anzahl weisser Blutzellen sowie Thymus-Atrophie bei Hunden und veränderte APTT-Werte (erhöht beim Hund, erniedrigt bei der Ratte). Änderungen der Anzahl weisser Blutkörperchen wurden in klinischen Studien am Menschen nicht beobachet.
Paricalcitol beinhaltet kein genotoxisches Potential. Dies geht aus einer Reihe von in vitro und in vivo Genotoxizitäts-Untersuchungen hervor.
In Karzinogenitätsuntersuchungen an Nagetieren zeigten sich keine Anzeichen für Risiken irgendeiner Art in Bezug auf die Anwendung am Menschen.
Es konnte kein Einfluss von Paricalcitol auf die Fertilität von Ratten festgestellt werden. Es gab auch keine Hinweise auf eine teratogene Wirkung bei Ratten oder Kaninchen. Es zeigte sich, dass Paricalcitol die Lebensfähigkeit der Foeten beeinträchtigte und auch eine signifikante Zunahme der peri- und post-natalen Mortalität bei neugeborenen Ratten bewirkte, wenn die Substanz in maternotoxischen Dosen verabreicht wurde.
Sonstige HinweiseBeeinflussung diagnostischer Methoden
Ein Einfluss von Zemplar auf diagnostische Methoden ist nicht bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung und für Kinder unerreichbar aufbewahren.
Nicht über 30 °C lagern.
Zulassungsnummer57'989 (Swissmedic)
PackungenZemplar Weichkapseln mit 1 μg Paricalcitol pro Weichkapsel sind erhältlich in Packungen zu 28 Weichapseln (B).
Zemplar Weichkapseln mit 2 μg Paricalcitol pro Weichkapsel sind erhältlich in Packungen zu 28 Weichkapseln (B).
ZulassungsinhaberinAbbVie AG, 6330 Cham
Stand der InformationDezember 2024
|