ZusammensetzungWirkstoffe
Hexaminolevulinat als Hexaminolevulinathydrochlorid
Hilfsstoffe
Lösungsmittel:
Natriummonohydrogenphosphat-Dihydrat, Kaliumdihydrogenphosphat, Natriumchlorid, Salzsäure, Natriumhydroxid, Wasser für Injektionszwecke
Indikationen/AnwendungsmöglichkeitenDiagnostikum. Hexvix-Blaulicht-Fluoreszenz-Zystoskopie wird bei Patienten mit bekanntem oder stark vermutetem Blasenkarzinom als Ergänzung zur Standard-Weisslicht-Zystoskopie zur Diagnose und Verlaufskontrolle von Blasenkarzinom verwendet (siehe Abschnitt „Eigenschaften/Wirkungen“).
Dosierung/AnwendungEine Hexvix-Zystoskopie darf nur von medizinischem Fachpersonal, das speziell in Hexvix-Blaulicht-Fluoreszenz-Zystoskopie geschult ist, durchgeführt werden. Die Blase sollte vor der Instillation von Hexvix drainiert werden, und eine komplette Examination der Blase mit Weisslicht ist durchzuführen. Eine ausgedehnte Blasenentzündung sollte u.a. ausgeschlossen sein (siehe Abschnitt „Warnhinweise und Vorsichtsmassnahmen“).
Danach werden 50 ml der zubereiteten 8 mmol/l Lösung (Zubereitung der Lösung und Vorsichtsmassnahmen bei der Handhabung bzw. vor der Anwendung des Arzneimittels, siehe Abschnitt „Sonstige Hinweise – Hinweise für die Handhabung“) durch einen Katheter in die Blase instilliert. Die Blase sollte erst nach 60 Minuten entleert werden.
Die zystoskopische Untersuchung sollte unter Blaulicht innerhalb von etwa 60 Minuten und nicht später als 180 Minuten nach der Instillation von Hexvix in die Blase durchgeführt werden. Es sollten 60 Minuten nach der Instillation vergehen, bevor mit der zystoskopischen Untersuchung begonnen wird, auch wenn der Patient Hexvix nicht 1 Stunde lang in der Blase gespeichert hatte.
Zunächst sollte die Blase vollständig unter Weisslicht untersucht werden; danach sollte die Untersuchung mit Blaulicht wiederholt werden.
Für eine optimale Visualisierung wird empfohlen, die gesamte Blase zu untersuchen und zu erfassen, sowohl mit Weisslicht als auch mit Blaulicht, bevor operative Eingriffe vorgenommen werden.
Biopsien aller erfassten Läsionen sollten normalerweise unter Weisslicht entnommen werden, und die vollständige Resektion sollte durch Umschalten auf Blaulicht überprüft werden.
Es dürfen ausschliesslich mit einer CE-Kennzeichnung versehene Zystoskopiegeräte verwendet werden, die mit den erforderlichen Filtern sowohl für die Standard-Weisslicht-Zystoskopie als auch für die Blaulicht-(Wellenlänge 380-450 nm)-Fluoreszenz-Zystoskopie ausgestattet sind.
Die während der Zystoskopie angewendeten Lichtdosen können variieren. Normalerweise liegen die Gesamt-Lichtdosen (Weisslicht und Blaulicht) zwischen 180 und 360 J, bei einer Stärke von 0,25 mW/cm².
Kinder und Jugendliche
Es sind keine Erfahrungen mit der Anwendung bei Patienten unter 18 Jahren vorhanden.
Kontraindikationen·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung
·Porphyrie
Warnhinweise und VorsichtsmassnahmenÜberempfindlichkeitsreaktionen einschliesslich schwerwiegender anaphylaktischer/anaphylaktoider Reaktionen wurden berichtet. Geeignete Einrichtungen für lebensrettende Massnahmen sollten einsatzbereit sein.
Hexvix sollte nicht bei Patienten mit hohem Risiko einer Blasenentzündung, z. B. nach einer BCG-Therapie oder bei mässiger oder schwerer Leukozyturie angewendet werden.
Eine ausgedehnte Blasenentzündung sollte vor der Anwendung des Arzneimittels durch Zystoskopie ausgeschlossen werden.
Eine Entzündung kann zur verstärkten Porphyrinbildung und einem erhöhten Risiko für lokale Toxizität bei der Belichtung sowie zu falscher Fluoreszenz führen.
Wenn während der Weisslichtuntersuchung eine ausgedehnte Blasenentzündung diagnostiziert wird, ist eine Blaulichtuntersuchung zu vermeiden.
Bei Patienten, die sich kurze Zeit zuvor einem chirurgischen Eingriff an der Blase unterzogen haben, besteht ein erhöhtes Risiko für das Auftreten falscher Fluoreszenz im Resektionsbereich.
Als Vorsichtsmassnahme wird empfohlen, auf die Anwendung von Hexvix während der Schwangerschaft zu verzichten. Es gibt nur begrenzt Daten zur Anwendung bei Schwangeren (siehe Abschnitt „Schwangerschaft/Stillzeit“).
InteraktionenEs wurden keine speziellen Wechselwirkungs-Studien mit Hexaminolevulinat durchgeführt.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Hexaminolevulinat bei Schwangeren vor. Tierexperimentelle Studien lassen hinsichtlich der Reproduktionstoxizität nicht auf direkte oder indirekte schädliche Auswirkungen schliessen (siehe Abschnitt „Präklinische Daten“). Als Vorsichtsmassnahme wird empfohlen, auf die Anwendung von Hexvix während der Schwangerschaft zu verzichten (siehe Abschnitt „Warnhinweise und Vorsichtsmassnahmen“).
Stillzeit
Es ist nicht bekannt, ob Hexaminolevulinat oder dessen Metabolite in die Muttermilch übergehen. Ein Risiko für das Neugeborene/Kind kann nicht ausgeschlossen werden. Das Stillen soll während der Behandlung mit Hexvix unterbrochen werden.
Fertilität
Tierexperimentelle Studien ergaben keine Hinweise auf Wirkungen auf die weibliche Fertilität. Zu Wirkungen auf die männliche Fertilität wurden keine tierexperimentellen Studien durchgeführt (siehe Abschnitt „Präklinische Daten“).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Es sind jedoch keine solchen Wirkungen anzunehmen.
Unerwünschte WirkungenDie meisten der berichteten Nebenwirkungen waren vorübergehend und leicht oder mässig ausgeprägt. Die in klinischen Studien (n = 1628) am häufigsten berichteten Nebenwirkungen waren Blasenspasmus (von 2,0 % der Patienten berichtet), Dysurie (1,6 %), Blasenschmerzen (1,4 %) und Hämaturie (1,5 %). Die häufigsten schwerwiegenden unerwünschten Wirkungen waren Hämaturie (0.7 %), Harnretention (0.7 %) und Vorhofflimmern (0.2 %).
Aufgrund von früheren Erfahrungen mit Verfahren wie Standard-Zystoskopie und transurethraler Resektion der Blase (TUR-B) wurde das Auftreten der beobachteten Nebenwirkungen erwartet.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: „sehr häufig“ (≥1/10), „häufig“ (≥1/100, <1/10), „gelegentlich“ (≥1/1‘000, <1/100), „selten“ (≥1/10‘000, <1/1‘000), „sehr selten“ (<1/10‘000), „nicht bekannt“ (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Erkrankungen des Immunsystems
Nicht bekannt: Anaphylaktischer Schock.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Zystitis, Sepsis, Harnwegsinfektion.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Anämie, Leukozytose.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Gicht.
Psychiatrische Erkrankungen
Gelegentlich: Insomnie.
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerzen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen, Obstipation, Diarrhoe, Bilirubin- und Transaminasen-Erhöhung.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Ausschlag, Pruritus.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Rückenschmerzen.
Erkrankungen der Nieren und Harnwege
Häufig: Blasenspasmus, Blasenschmerzen, Dysurie, Harnverhaltung, Hämaturie.
Gelegentlich: Harnröhrenschmerzen, Pollakisurie, Harndrang, Erkrankung der Harnwege.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Balanitis.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Pyrexie, Schmerzen nach dem Eingriff.
Gelegentlich: Postoperatives Fieber.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs liegen keine Erfahrungen mit einer höheren als der empfohlenen Lichtintensität bzw. mit verlängerter Lichtexposition vor.
Eigenschaften/WirkungenATC-Code
V04CX06
Wirkungsmechanismus
Nach intravesikaler Instillation von Hexaminolevulinat kommt es zu einer intrazellulären Akkumulation von Porphyrinen, bevorzugt in malignen Zellen. Die intrazellulären Porphyrine (einschliesslich PpIX) sind photoaktive, fluoreszierende Verbindungen, die bei Blaulichtexzitation rotes Licht ausstrahlen. Infolgedessen leuchten prämaligne und maligne Läsionen vor einem blauen Hintergrund rot. Falsche Fluoreszenz kann bei Entzündungen auftreten.
Klinische Wirksamkeit
Die klinischen Studien mit Hexvix umfassten 1174 Patienten mit Blasenkarzinom, Verdacht auf Blasenkarzinom oder unter Beobachtung für Blasenkarzinom.
Im Vergleich zur Standard-Zystoskopie wurden nach einer Blaulicht-Zystoskopie signifikant mehr Carcinoma in situ (CIS) und papilläre Läsionen erkannt. Die Erkennungsquote für CIS betrug 95 % vs. 49,5 % und für papilläre Läsionen 90,6 % - 100 % vs. 85,4 % - 94,3 %.
Die verbesserte Erkennung betrifft Läsionen im nicht invasiven Stadium.
In einer Studie bei Patienten mit initialem und rezidivierendem Blasenkarzinom und Verdacht auf einen oder mehrere papilläre Tumoren hatten insgesamt 16,4 % der Patienten mit pTa/pT1-Läsionen, 31,7 % der Patienten mit CIS-Läsionen und 3,2 % der Patienten mit T2-T4-Läsionen weitere Läsionen, die nur mittels Hexvix-Blaulicht-Zystoskopie entdeckt wurden. Die Patienten wurden während 9 Monaten nach der Instillation von Hexvix nachbeobachtet. Dabei war der Anteil der Patienten mit Rezidiven in der Hexvix-Gruppe (47,2 %) niedriger als in der Gruppe mit Weisslicht-Zystoskopie (56,1 %). Die relative Reduktion der Rezidivrate betrug in der Hexvix-Gruppe 15,8 %. Nach einer weiteren medianen Nachbeobachtungszeit von 4,5 Jahren war die mediane Zeit bis zum Rezidiv 16 Monate in der Hexvix-Gruppe im Vergleich zu 9 Monaten in der Weisslicht-Gruppe.
Die Gesamtquote falsch positiver Läsionsbefunde war nach einer Blaulicht-Zystoskopie erhöht, 17,3 % bei Weisslicht-Zystoskopie und 21,9 % bei Blaulicht-Zystoskopie.
Eine prospektive, intraindividuell kontrollierte Studie zeigte, dass die Hexvix-Blaulicht-Fluoreszenz-Zystoskopie die Tumordetektion im Vergleich zur Standard-Weisslicht-Zystoskopie verbessert. Bei Patienten mit Blasenkarzinom, die im Hinblick auf ein Tumorrezidiv nachbeobachtet wurden, wurde eine Kontrolluntersuchung mit Weisslicht- und mit Hexvix-Blaulicht-Fluoreszenz-Zystoskopie vorgenommen. Bei 21 % (13/63) der Patienten wurde eine histologisch bestätigte Malignität lediglich durch die Hexvix-Blaulicht-Fluoreszenz-Zystoskopie und nicht durch eine Weisslicht-Untersuchung erkannt, wobei 46 % (6/13) der Patienten ein Rezidiv im Stadium High-GradepTa oder CIS aufwiesen.
PharmakokinetikDistribution und Elimination
Die systemische Bioverfügbarkeit (absolute BV) beträgt 5-10 %, die Cmax 343 ng/ml, die terminale Eliminationshalbwertszeit 76 Stunden und das Vss 248 l.
Präklinische DatenAn Ratten und Hunden wurden siebentägige Studien zur intravesikalen Verträglichkeit ohne Lichtexposition durchgeführt. Bei der Studie an Ratten traten Fälle von Leukozytose auf, was auf eine entzündungsfördernde Wirkung von Hexaminolevulinat hinweist.
Azotämie, rot gefärbter Urin und Gewichtsverlust wurden ebenfalls beobachtet.
Bei den mit Hexaminolevulinat behandelten Hunden traten Übergangszell-Hyperplasie und Basophilie im Harnwegsepithel geringfügig häufiger auf und waren geringfügig stärker ausgeprägt.
Ein lokaler Lymphknoten-Assay an Mäusen hat gezeigt, dass Hexaminolevulinat potenziell eine Hautsensibilisierung verursachen kann.
Genotoxizität
Alle Studien zum genotoxischen Potenzial waren negativ (Ames-Test, TK-Assay, in vivo Mikronukleus-Zellmodell, Chromosomenaberrationen in CHO-Zellen und Comet-Assay an Vesikalproben aus einer Studie an Hunden zur lokalen Verträglichkeit mit Blaulichtaktivierung).
Reproduktionstoxizität
Die Reproduktionstoxizität wurde nach wiederholter intravenöser Gabe von Hexaminolevulinat an Ratten und Kaninchen untersucht. Es wurden keine Effekte auf embryofetale Mortalität, fetales Gewicht oder die Häufigkeit von fetalen Abweichungen und Variationen, einschliesslich Parametern der skelettalen Ossifikation, beobachtet. In Untersuchungen an Ratten wurden keine Wirkungen auf die weibliche Fertilität und auf die frühe Embryonalentwicklung beobachtet.
Kanzerogenität
Karzinogenitätsstudien wurden mit Hexaminolevulinat nicht durchgeführt.
Sonstige HinweiseInkompatibilitäten
Hexvix darf nicht mit anderen Arzneimitteln gemischt werden.
Das Arzneimittel darf nur mit dem mitgelieferten Lösungsmittel verdünnt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden. Nach Auflösung im Lösungsmittel: Die chemische und physikalische in-use-Stabilität wurde für 2 Stunden bei 2-8°C nachgewiesen. Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung unmittelbar nach Rekonstitution zu verwenden. Falls die Lösung nicht sofort angewendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich, die nicht länger als 2 Stunden bei 2-8°C betragen sollte.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) lagern.
Lösung (nach Herstellung): Im Kühlschrank (2-8°C) lagern (siehe auch Abschnitt „Haltbarkeit“).
Hinweise für die Handhabung
Hexaminolevulinat kann durch Hautkontakt eine Sensibilisierung verursachen.
Alle Schritte sind mit sterilem Gerät und unter aseptischen Bedingungen auszuführen.
Anleitung zur Rekonstitution : Hexvix Pulver und Lösungsmittel in Fertigspritze:
|
|
|
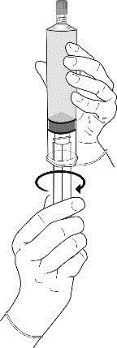
1.Der Kolben wird am Gummistopfen befestigt, indem er im Uhrzeigersinn bis zum Anschlag in die Spritze gedreht wird.
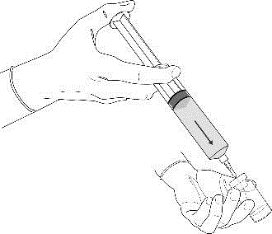
2.Die Schutzkappe wird von der Spritze entfernt und für den späteren Gebrauch aufbewahrt. Eine zur Rekonstitution geeignete Nadel wird auf die Spritze aufgeschraubt. Die Spritze wird senkrecht gehalten und durch vorsichtiges Drücken des Kolbens wird die Luft aus der Spritze entfernt
| |
|
|
3.Etwa 10 ml des Lösungsmittels werden in die Durchstechflasche mit Pulver injiziert, sodass diese zu 3/4 gefüllt ist.
| |
|
|
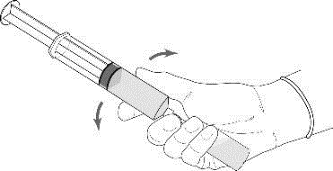
4.Ohne die Nadel herauszuziehen werden die Spritze und die Durchstechflasche mit einem Handgriff festgehalten und vorsichtig geschwenkt, um das Pulver vollständig aufzulösen.
| |
|
|
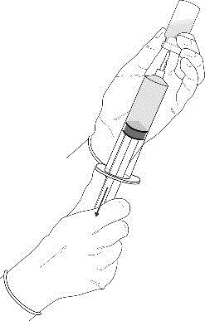
5.Die Lösung wird aus der Durchstechflasche vollständig in die Spritze aufgezogen.
| |
|
|
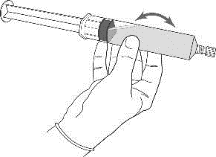
6.Die leere Durchstechflasche wird von der Spritze entfernt. Die Nadel wird von der Spritze abgenommen und verworfen. Es wird die Schutzkappe auf die Spritze aufgebracht und der Inhalt der Spritze vorsichtig gemischt
|
Hexvix ist nun rekonstituiert und gebrauchsfertig. Die so hergestellte Lösung ist klar bis leicht opalisierend und farblos bis blassgelb.
Wenn die Lösung nicht sofort verwendet werden kann, darf sie maximal 2 Stunden nach der Herstellung bei 2-8°C im Kühlschrank gelagert werden. Auf der Etikette der Spritze soll die Verfallzeit vermerkt werden.
Nur zur einmaligen Anwendung. Nicht verwendetes Produkt ist zu entsorgen.
Zulassungsnummer58015 (Swissmedic)
PackungenPackung enthaltend: 10 ml-Durchstechflasche mit Pulver (Hexaminolevulinat 85 mg) und 50 ml-Fertigspritze mit Lösungsmittel (50 ml) [B].
ZulassungsinhaberinFuture Health Pharma GmbH, 8620 Wetzikon ZH
Stand der InformationMai 2022
| 




