ZusammensetzungWirkstoffe
Insulinum Glulisinum DCI (3BLys-29BGlu-humanum insulinum analogum, GT), 100 Einheiten/ml.
Hilfsstoffe
(Menge pro 1 ml) Trometamolum, Natrii chloridum, Polysorbatum 20 (E432), Metacresolum 3,15 mg, Aqua q.s. ad solutionem pro 1 ml, Natrii hydroxidum (E524), Acidum hydrochloridum (E507). Einige der Hilfsstoffe enthalten Natrium; Gesamtmenge Natrium: 1,97 mg/ml.
Insulin Glulisin ist ein Insulin-Analogon, das mittels gentechnischer Methoden unter Verwendung von Escherichia coli gewonnen wird.
Indikationen/AnwendungsmöglichkeitenDiabetes mellitus bei Erwachsenen, Jugendlichen und Kindern ab 4 Jahren, sofern eine Insulinbehandlung erforderlich ist.
Dosierung/AnwendungApidra ist ein rekombinantes Insulin-Analogon, welches äquipotent zu löslichem Humaninsulin ist. Apidra hat einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer als lösliches Humaninsulin.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Apidra soll kurz (0-15 Min.) vor oder unmittelbar nach der Mahlzeit injiziert werden.
Die Dosierung von Apidra muss individuell festgelegt werden.
Patienten mit Leberfunktionsstörungen
Leberfunktionsstörungen können den Insulinbedarf des Patienten vermindern (siehe «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Nierenfunktionsstörungen können den Insulinbedarf des Patienten vermindern (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Es liegen nur wenige Daten bei Kindern unter 8 Jahren vor. Die Anwendung von Apidra bei Kindern unter 4 Jahren wurde nicht untersucht.
Verabreichungsschema
Apidra sollte in einem Therapieschema mit einem länger wirksamen Insulin oder einem basalem Insulin-Analogon gegeben werden oder kann mit oralen Antidiabetika verwendet werden.
Art der Anwendung
Apidra-Patronen sind ausschliesslich für subkutane Injektionen mittels eines wiederverwendbaren Pens (AllStar PRO und JuniorSTAR) geeignet.
Der Apidra SoloStar Fertigpen ist nur für subkutane Injektionen geeignet.
Falls die Verabreichung mittels einer Spritze, einer intravenösen Injektion oder einer Infusionspumpe notwendig ist, sollte eine Apidra-Durchstechflasche verwendet werden.
Subkutane Verabreichung
Apidra wird subkutan injiziert oder mittels einer Pumpe kontinuierlich subkutan verabreicht.
Subkutane Injektion
Apidra soll subkutan in die Bauchwand, den Oberschenkel oder den Oberarm injiziert oder durch kontinuierliche Infusion in die Bauchwand verabreicht werden. Wie bei allen Insulinen ist die Verabreichungsstelle innerhalb des Injektionsbereiches jedes Mal zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren oder zu vermeiden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»). Wie bei allen Insulinen kann die Resorption und folglich Wirkungsbeginn und -dauer beeinflusst werden durch den Injektionsbereich, körperliche Aktivität und andere Faktoren.
Mischen mit anderen Insulinen
Falls Apidra mit NPH-Humaninsulin gemischt wird, soll Apidra zuerst in die Spritze aufgezogen werden. Die Injektion muss sofort nach dem Mischen erfolgen. Über die Mischbarkeit von Insulin Glulisin mit anderen Insulinzubereitungen als mit humanem NPH-Insulin sind keine Daten vorhanden. Apidra darf ausser mit humanem NPH-Insulin nicht mit anderen Insulinzubereitungen gemischt werden.
Kontinuierliche subkutane Infusion mit einer Pumpe
Apidra kann mit den passenden Infusionssets und Reservoiren zur kontinuierlichen subkutanen Insulininfusion (CSII) in Pumpensystemen verwendet werden, die für die Insulininfusion geeignet sind. Patienten, welche ein CSII-System verwenden, müssen umfassend über den Gebrauch des Pumpensystems instruiert werden.
Das Infusionsset und das Reservoir, mit denen Apidra verwendet wird, müssen mindestens alle 48 Stunden aseptisch gewechselt werden. Diese Anweisungen können von den allgemeinen Anweisungen in der Bedienungsanleitung der Pumpe abweichen. Es ist wichtig, dass sich die Patienten bei der Verwendung der Pumpe an die speziell für Apidra geltenden Anweisungen halten. Die Nichteinhaltung dieser Anweisungen kann zu schwerwiegenden unerwünschten Arzneimittelwirkungen führen. Bei Verwendung in einer Insulin-Infusionspumpe darf Apidra weder verdünnt noch mit anderen Insulinen gemischt werden.
Patienten, welche Apidra mit einem CSII-System verwenden, müssen auch ein anderes System für die Insulinzufuhr zur alternativen Verabreichung im Falle eines Pumpenversagens verfügbar haben (siehe «Interaktionen»).
Intravenöse Verabreichung
Apidra kann auch intravenös verabreicht werden, allerdings nur durch eine medizinische Fachperson.
Apidra darf weder mit Glukose- oder Ringerlösung noch mit irgendeinem anderen Insulin gemischt werden.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenDie Apidra Patronen dürfen nur mit folgenden wiederverwendbaren Pens verwendet werden:
·JuniorSTAR, der Apidra in Einzeldosisschritten von 0,5 Einheiten abgibt,
·AllStar PRO, der Apidra in Einzeldosisschritten von 1 Einheit abgibt.
Da die Dosiergenauigkeit nur mit den genannten Pens ermittelt wurde, dürfen Apidra Patronen nicht mit anderen Pens angewendet werden.
Die Umstellung eines Patienten auf ein anderes Insulinpräparat darf nur unter strenger medizinischer Überwachung erfolgen. Änderungen des Präparates, des Insulintyps oder der Insulinart (tierisches Insulin, Humaninsulin oder Insulin-Analogon) und/oder der Herstellungsmethode können eine Dosisänderung erfordern. Eine Anpassung der gleichzeitig verabreichten oralen Antidiabetika kann ebenfalls notwendig werden.
Die Patienten sollten angewiesen werden, die Injektionsstelle bei jeder Verabreichung zu wechseln, um das Risiko der Entwicklung einer Lipodystrophie und einer kutanen Amyloidose zu verringern. Es besteht das potenzielle Risiko einer verzögerten Aufnahme von Insulin sowie einer Verschlechterung der Blutzuckerkontrolle nach Insulininjektionen an Stellen mit diesen Reaktionen. Es wurde berichtet, dass ein plötzlicher Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich eine Hypoglykämie nach sich ziehen kann. Es wird empfohlen, den Blutzuckerspiegel nach dem Wechsel der Injektionsstelle zu überwachen und eine Anpassung der Dosis antidiabetischer Arzneimittel zu erwägen.
Hypoglykämie
Der Zeitpunkt des Auftretens einer Hypoglykämie hängt vom Wirkungsprofil des verwendeten Insulins ab und kann sich deshalb bei einem Wechsel des Therapieschemas ändern.
Eine Dosisanpassung kann auch notwendig werden, wenn Patienten vermehrt körperlich aktiv sind oder ihren üblichen Mahlzeitenplan ändern. Im Vergleich zu löslichem Humaninsulin kann nach Administration von Apidra eine Hypoglykämie früher auftreten.
Begleiterkrankungen können den Insulinbedarf verändern.
Beim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Dies gilt besonders zu Beginn der Behandlung, bei Arzneimittelwechsel, unregelmässigen Insulininjektionen oder unregelmässiger Nahrungsaufnahme sowie allgemein bei nicht optimaler Einstellung (starke Blutzuckerschwankungen). Der Diabetiker muss auf die Gefahr einer Hypoglykämie aufmerksam gemacht werden und auch darauf, dass Alkoholeinnahme die Gefahr zusätzlich erhöht.
Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen.
Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o.ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis mittragen.
In bestimmten Situationen, insbesondere nach Umstellung von tierischem auf humanes Insulin, können die Warnsymptome der Hypoglykämie abgeschwächt sein (siehe «Unerwünschte Wirkungen»).
Die Umstellung auf ein anderes Insulinpräparat oder Änderungen des Dosierungsschemas dürfen nur unter sorgfältiger ärztlicher Kontrolle und Instruktion erfolgen. β-Blocker können die üblichen Hypoglykämie-Warnsymptome abschwächen bzw. maskieren.
Alkoholkonsum kann die Hypoglykämie-Gefahr erhöhen (Hemmung der hepatischen Glukoneogenese). Zu berücksichtigen ist jedoch, dass der Kohlehydratgehalt alkoholischer Getränke auch einen Anstieg des Blutglukosespiegels verursachen könnte.
Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken (andere illegale Substanzen wurden nicht untersucht; andere Interaktionen siehe «Interaktionen»!).
Hypokaliämie
Hypokaliämie gehört zu den potenziellen unerwünschten klinischen Wirkungen einer Insulintherapie, insbesondere bei intravenöser Verabreichung (z.B. zur Behandlung der diabetischen Ketoazidose). Indessen wurde Hypokaliämie weder in klinischen Studien noch im Rahmen der Postmarketing-Überwachung von Apidra als Sicherheitsrisiko identifiziert. Diese potenzielle unerwünschte klinische Wirkung kann bei Patienten zum Tragen kommen, die mit kaliumsenkenden Arzneimitteln therapiert werden, aus einem anderen Grund (z.B. Diarrhoe) Kalium verlieren oder wegen einer diabetischen Ketoazidose behandelt werden.
Zur Vermeidung einer möglichen Übertragung von Krankheiten darf jeder Fertigpen bzw. Insulinpen nur von einer einzigen Person benützt werden.
Kontinuierliche subkutane Insulininfusion
Eine Funktionsstörung der Insulinpumpe oder des Infusionsmaterials oder Bedienungsfehler können rasch zu einer Hyperglykämie, einer Ketose oder einer diabetischen Ketoazidose führen. Die Ursachen für die Hyperglykämie, Ketose oder diabetische Ketoazidose müssen schnell erkannt und behoben werden.
Bei der Gabe von Apidra als kontinulierliche subkutane Infusion mittels einer Pumpe wurde über Fälle von diabetischer Ketoazidose berichtet. Die meisten dieser Fälle waren auf Bedienungsfehler oder ein Pumpenversagen zurückzuführen.
In diesem Fall können zeitweise subkutane Infusionen mit Apidra notwendig sein. Patienten, welche ein System zur kontinulierlichen subkutanen Insulininfusion mit einer Pumpe verwenden, müssen umfassend in die Insulingabe durch Injektion eingewiesen werden und ein anderes System für die Insulinzufuhr zur alternativen Verabreichung im Falle eines Pumpenversagens verfügbar haben (siehe «Dosierung/Anwendung»).
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro 100 Einheiten (1 ml), d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakodynamische Interaktionen
1.Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Glukoneogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme von:oralen Antidiabetika; Alkohol; ACE-Hemmern (z.B. Captopril und Enalapril); antiarrhythmischen Substanzen wie Disopyramid; α-Blockern und Clonidin; SSRI; Fenfluramin; MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie, gelegentlich mit nachfolgender Hyperglykämie); Anti-Malariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z.B. Cotrimoxazol); Cimetidin und Ranitidin.
2.Der Insulinbedarf kann erhöht sein bei gleichzeitiger Anwendung der folgenden Substanzen bzw. Substanzgruppen:Orale Kontrazeptiva und andere Östrogen- oder Progestagen-Präparate; Kortikosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive Sympathikomimetika, sowie nicht selektive wie Epinephrin); Diazoxid; Nikotinsäure und -Derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); antiretrovirale Substanzen; immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus) sowie atypische Neuroleptika (Clozapin und Olanzapin).
3.Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw. abgeschwächt werden:Octreotid-, Salicylsäure-Derivate, Lithium-Salze (selten).β-Blocker können zu einer Verstärkung der Insulinresistenz, aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen begrenzte Daten über Schwangere vor, die während der Schwangerschaft gegenüber Apidra exponiert waren (279 berichtete Schwangerschaften). Diese Daten zeigten keinen Hinweis auf ein Sicherheitsproblem im Zusammenhang mit der Verwendung dieses Arzneimittels während der Schwangerschaft oder auf nachteilige Wirkungen auf den Fötus oder das Neugeborene. Es liegen indessen noch keine Daten aus kontrollierten klinischen Studien zur Anwendung von Apidra in der Schwangerschaft vor.
Tierstudien haben keinen Unterschied zwischen Apidra und Humaninsulin hinsichtlich Schwangerschaft, embryonaler/fötaler Entwicklung, Geburtsvorgang oder postnataler Entwicklung gezeigt (siehe «Präklinische Daten»).
Für Patientinnen mit vorbestehender Diabeteserkrankung oder einem Schwangerschaftsdiabetes ist eine gute Stoffwechselkontrolle während der gesamten Schwangerschaft besonders wichtig. Der Insulinbedarf kann während des ersten Trimenons abfallen und steigt in der Regel während des zweiten und dritten Trimenons wieder an. Unmittelbar nach der Entbindung fällt der Insulinbedarf rasch ab (erhöhtes Hypoglykämierisiko). Eine sorgfältige Überwachung des Blutzuckerspiegels ist daher besonders wichtig.
Stillzeit
Es ist nicht bekannt, ob Apidra in die Muttermilch ausgeschieden wird. Bei stillenden Frauen kann eine Anpassung von Insulindosis und Diät notwendig werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenAufgrund von Hypo- oder Hyperglykämien oder z.B. aufgrund von Sehstörungen kann die Konzentrations- und Reaktionsfähigkeit des Patienten herabgesetzt sein. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen.
Die Patienten sollen angewiesen werden, Vorsichtsmassnahmen zu treffen, um Hypoglykämien während des Fahrens zu vermeiden. Dies ist besonders wichtig für Patienten mit abgeschwächten oder fehlenden Hypoglykämie-Warnsymptomen oder mit häufigen Hypoglykämien. Unter diesen Umständen ist die Fähigkeit zum Führen eines Fahrzeugs bzw. zum Bedienen von Maschinen zu überprüfen.
Unerwünschte WirkungenEs wurde über Medikationsfehler oder Verwechslungen mit anderen Insulinen berichtet. Insbesondere wurden versehentlich lang wirksame Insuline anstelle des Insulinanalogons Glulisin verabreicht.
In klinischen Studien wurden zwischen Insulin Glulisin und den Vergleichssubstanzen (kurzwirksame Insuline) keine klinisch relevanten Unterschiede in der Gesamthäufigkeit von unerwünschten Wirkungen gefunden. Die beobachteten Nebenwirkungen waren für diese Substanzklasse bekannt und sind demzufolge den Insulinen gemeinsam.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: Sehr häufig: ≥1/10; Häufig: ≥1/100, <1/10; Gelegentlich: ≥1/1000, <1/100; Selten: ≥1/10'000, <1/1000; Sehr selten: <1/10'000; Nicht bekannt (kann aus den verfügbaren Daten nicht abgeschätzt werden).
|
MedDRA-Systemorganklassen
|
Sehr häufig
|
Häufig
|
Gelegentlich
|
Selten
|
Nicht bekannt
| |
Stoffwechsel- und Ernährungsstörungen
|
Hypoglykämie
|
|
|
|
Hyperglykämie
| |
Erkrankungen der Haut und des Unterhautgewebes
|
|
Reaktionen an der Injektionsstelle
Lokale Überempfindlichkeitsreaktionen
|
|
Lipodystrophie
|
Kutane Amyloidose
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
|
|
Systemische Überempfindlichkeitsreaktionen
|
|
|
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Stoffwechsel- und Ernährungsstörungen
Hypoglykämie
Zu einer Hypoglykämie, einer häufigen (schwere Hypoglykämien) bis sehr häufigen Nebenwirkung der Insulintherapie, kann es kommen, wenn die Insulindosis den Insulinbedarf überschreitet. Schwere Hypoglykämien, insbesondere wenn sie wiederholt auftreten, können zu neurologischen Schäden führen. Anhaltende oder schwere Hypoglykämien können lebensbedrohlich sein.
Die Symptome einer Hypoglykämie (Blutzuckerabfall unter 2-3 mmol/l) sind:
Neurovegetative Zeichen: Schwitzen, Hungergefühl, Zittern (neurovegetative Warnsymptome), Blässe, Palpitationen, Kopfschmerzen. Neuroglykopenische Zeichen: Konzentrationsstörungen, Verhaltensänderungen (Agitiertheit, Nervosität, Aggressivität, Verwirrtheit u.a.), Bewusstseinsstörungen, Koordinations-, Seh- und Sprachstörungen. Diese können über Benommenheit und Somnolenz bis zum Bewusstseinsverlust fortschreiten. Die Hypoglykämie kann auch zu epileptischen Anfällen führen oder sich wie ein zerebraler Insult, z.B. mit (meist vorübergehender) Hemiparese, Aphasie, positivem Babinskizeichen, manifestieren.
Abgeschwächte/veränderte Warnsymptome: Besonders bei Einstellung auf tiefe Blutzuckerwerte (z.B. bei Mehrfachinjektionen nach dem Basis-Bolus-Prinzip), aber auch bei lang bestehendem Diabetes (u.U. mit Polyneuritis), bei Präparatewechsel u.a. können die Warnsymptome der Hypoglykämie verändert und die neurovegetativen Symptome abgeschwächt sein oder erst spät auftreten. Dies wurde von einigen Patienten auch nach Umstellung von tierischem auf humanes Insulin, aber auch sonst gelegentlich bei Präparatewechsel beobachtet.
Der insulinbehandelte Diabetiker und seine Umgebung sind deshalb zu instruieren, dass sich eine Hypoglykämie auch überraschend und als erstes durch neuroglykopenische Zeichen wie Konzentrationsstörungen, Agitiertheit, Verhaltens- und Bewusstseinsstörungen ankündigen kann, was dazu führen kann, dass er eventuell nicht früh genug mit Einnahme von Zucker reagiert.
Die Umstellung auf ein anderes Insulinpräparat soll nur unter sorgfältiger ärztlicher Kontrolle und nach genauer Instruktion erfolgen. Auch das Behandlungsschema soll nur nach Absprache mit dem Arzt oder auf seine Anweisung geändert werden.
Als Ursachen einer Hypoglykämie kommen in Frage: Auslassen einer Mahlzeit, Erbrechen, Durchfall, aussergewöhnliche körperliche Anstrengung, Insulinüberdosierung, endokrine Krankheiten wie Nebennierenrindeninsuffizienz, Hypothyreose u.a.
Therapie der Hypoglykämie: siehe «Überdosierung».
Nach jeder schweren Hypoglykämie ist die Diabeteseinstellung zu überprüfen; der Patient ist daher anzuweisen, den Arzt so bald als möglich über jede durchgemachte schwere Hypoglykämie zu orientieren.
Hyperglykämie
Ein Anstieg des Blutzuckerspiegels, Hyperglykämie, Ketoazidose und Hyperosmolarität können auftreten, wenn z.B. die Insulindosis im Hinblick auf die Kohlenhydratzufuhr zu niedrig ist, die Wirkung des Insulins nachgelassen hat (z.B. infolge falscher Lagerung), die körperliche Aktivität reduziert wurde, die Insulinempfindlichkeit infolge emotionalen oder körperlichen Stresses (z.B. bei Verletzungen, operativen Eingriffen, fieberhaften Infektionen oder anderen Erkrankungen) verringert ist oder gleichzeitig Arzneimittel mit blutzuckersteigernder Wirkung gegeben werden (siehe «Interaktionen»).
Bei der Gabe von Apidra als kontinulierliche subkutane Infusion mithilfe einer Pumpe wurde über Fälle von diabetischer Ketoazidose berichtet. Die meisten dieser Fälle waren auf Bedienungsfehler oder ein Pumpenversagen zurückzuführen.
In diesem Fall können zeitweise subkutane Infusionen mit Apidra notwendig sein. Patienten, welche ein System zur kontinulierlichen subkutanen Insulininfusion mit einer Pumpe verwenden, müssen umfassend in die Insulingabe durch Injektion eingewiesen werden und ein anderes System für die Insulinzufuhr zur alternativen Verabreichung im Falle eines Pumpenversagens verfügbar haben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Anzeichen und Symptome einer hyperglykämischen Stoffwechselentgleisung sind: Durst, Polyurie, Glykosurie, Acetonurie, Müdigkeit, trockene Haut, Gesichtsrötung, Appetitlosigkeit, arterielle Hypotonie und Tachykardie. Insbesondere bei Symptomen wie Erbrechen, Bauchschmerzen, schnelle tiefe Atmung, Somnolenz oder Koma muss immer auch an eine begleitende Ketoazidose gedacht werden. Eine schwere Hyperglykämie und Ketoazidose kann lebensbedrohlich werden. Eine Ketoazidose kann sich in Abhängigkeit von der Insulinverfügbarkeit innerhalb von Stunden bis Tagen entwickeln. Sobald mögliche Anzeichen und Symptome einer Hyperglykämie oder Ketoazidose bemerkt werden, müssen Blutglukose und Keton im Urin bestimmt und gegebenenfalls unverzüglich Gegenmassnahmen eingeleitet werden.
Erkrankungen der Haut und des Unterhautgewebes:
Wie bei anderen Insulintherapien können sich häufig lokale allergische Reaktionen in Form von Rötungen, Schwellungen und/oder Juckreiz an der Injektionsstelle manifestieren. Diese leichten Reaktionen bilden sich meist innerhalb von wenigen Tagen oder Wochen zurück. Diese Reaktionen können mit anderen Faktoren als dem Insulin in Zusammenhang stehen, z.B. Irritationen durch Hautreinigungsmittel oder schlechte Injektionstechnik.
Wie bei jeder Insulintherapie kann es gelegentlich an der Injektionsstelle zu einer Lipodystrophie und einer kutanen Amyloidose kommen, welche die Insulinresorption verzögert. Ein ständiger Wechsel der Einstichstelle im gegebenen Injektionsbereich kann helfen, diese Reaktionen zu reduzieren oder zu vermeiden (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Weniger häufig, aber potentiell schwerwiegender sind systemische allergische Reaktionen, wie generalisierte Allergien auf Insulin, welche mit Hautreaktionen (einschliesslich Pruritus) am ganzen Körper, Kurzatmigkeit, pfeifendem Atmen, Blutdruckabfall, raschem Puls oder Schwitzen einhergehen können. Schwere Fälle von generalisierter Allergie einschliesslich anaphylaktischer Reaktionen können lebensbedrohlich sein.
Antikörper
In einer Studie mit Typ-1-Diabetikern (n = 333) blieb die Konzentration von kreuzreaktiven Insulinantikörpern (Antikörper, die sowohl mit humanem Insulin als auch mit Insulin Glulisin reagieren) während der ersten sechs Monate bei den Patienten, die mit Insulin Glulisin behandelt wurden, nahe beim Baseline-Wert. Während der folgenden sechs Monate wurde eine Verringerung der Antikörperkonzentration beobachtet. In einer Studie mit Typ-2-Diabetikern (n = 411) wurde während der ersten neun Monate bei den Patienten, die mit Insulin Glulisin behandelt wurden, und bei den Patienten, die mit humanem Insulin behandelt wurden, eine vergleichbare Erhöhung der Konzentration an kreuzreaktiven Insulinantikörpen beobachtet. Danach verringerte sich die Antikörperkonzentration bei den Patienten mit Insulin Glulisin und blieb bei den Patienten mit humanem Insulin unverändert. Es gab keine Korrelation zwischen der Konzentration von kreuzreaktiven Insulinantikörpern und Änderungen von HbA1c, Insulindosis oder Häufigkeit von Hypoglykämien.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungInsuline haben keine spezifische Überdosierungsdefinition, weil Serumglukosekonzentrationen das Ergebnis einer komplexen Interaktion zwischen Insulinspiegel, Glukoseverfügbarkeit und anderen metabolischen Prozessen sind. Hypoglykämien können auftreten, wenn die Insulinaktivität im Verhältnis zur Nahrungsaufnahme und zum Energieverbrauch zu gross ist.
Anzeichen und Symptome
Die Anzeichen und Symptome einer Hypoglykämie sind im Abschnitt «Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen – Stoffwechsel- und Ernährungsstörungen – Hypoglykämie» beschrieben.
Behandlung
Insulinüberdosierungen sind wie folgt zu behandeln:
Leichte bis mässige Hypoglykämieepisoden können normalerweise durch orale Gabe von Kohlehydraten ausgeglichen werden. Es kann eine Anpassung der Arzneimitteldosis, der Essgewohnheiten und der körperlichen Aktivität notwendig werden.
Schwerere hypoglykämische Episoden mit Koma, Krampfanfällen oder neurologischen Ausfällen können mit intramuskulären/subkutanen Glukagongaben oder intravenöser Verabreichung von konzentrierter Glukoselösung behandelt werden. Wiederholte Kohlehydrataufnahme und eine Überwachung können erforderlich sein, da eine Hypoglykämie nach scheinbarer klinischer Erholung wieder auftreten kann.
Eigenschaften/WirkungenATC-Code
A10AB06
Wirkungsmechanismus
Die primäre Wirkung von Insulin und Insulin-Analoga, einschliesslich Insulin Glulisin, ist die Regulation des Blutzuckermetabolismus. Insuline senken den Blutzuckerspiegel durch eine Stimulierung der peripheren Glukoseaufnahme, insbesondere durch die Skelettmuskulatur und das Fettgewebe, sowie durch eine Hemmung der Glukoneogenese in der Leber. Insulin hemmt die Lipolyse in den Fettzellen, hemmt die Proteolyse und erhöht die Proteinsynthese.
Ethnische Zugehörigkeit und Geschlecht
In klinischen Studien bei Erwachsenen zeigten Subgruppenanalysen hinsichtlich ethnischer Herkunft und Geschlecht keine Unterschiede in der Sicherheit und Wirksamkeit von Insulin Glulisin.
Pharmakodynamik
Insulin Glulisin hat bei subkutaner Verabreichung einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer als lösliches Humaninsulin.
Die glukosesenkende Wirkung von Insulin Glulisin setzt 10-20 Min. nach subkutaner Injektion ein. Nach intravenöser Verabreichung wurden im Vergleich zur subkutanen Verabreichung ein rascherer Wirkungseintritt und eine kürzere Wirkungsdauer sowie ein intensiverer Wirkungspeak beobachtet. Bei intravenöser Verabreichung sind Insulin Glulisin und lösliches Humaninsulin äquipotent, d.h. 1 Einheit Insulin Glulisin hat denselben blutglukosesenkenden Effekt wie 1 internationale Einheit Humaninsulin.
|
Bei Typ-1-Diabetikern war das glukosesenkende Profil von Insulin Glulisin und löslichem Humaninsulin sehr ähnlich, wenn Insulin Glulisin 2 min und lösliches Humaninsulin 30 min vor der Mahlzeit in einer Dosis von 0,15 Einheiten/kg subkutan verabreicht wurden (s. Abb.).
|
|

|
Klinische Wirksamkeit
Diabetes Typ 1 – Erwachsene
Im Rahmen einer 26-wöchigen klinischen Phase-III-Studie wurde Insulin Glulisin mit Insulin Lispro, die beide kurz (0-15 Minuten) vor einer Mahlzeit subkutan injiziert wurden, bei Patienten mit Diabetes mellitus Typ 1, welche Insulin Glargin als Basalinsulin verwendeten, verglichen. Insulin Glulisin war hinsichtlich der glykämischen Kontrolle vergleichbar mit Insulin Lispro, was sich in der Veränderung von glykosyliertem Hämoglobin (gemessen als HbA1c-Wert) vom Baseline-Wert bis zum Endpunkt widerspiegelte. Es wurden vergleichbare von den Patienten selbst kontrollierte Blutzuckerwerte beobachtet. Im Gegensatz zu Insulin Lispro war bei Insulin Glulisin keine Erhöhung der Basalinsulin-Dosis erforderlich.
Eine klinische Phase-III-Studie über 12 Wochen, die mit Patienten mit Diabetes mellitus Typ 1 durchgeführt wurde, die Insulin Glargin als basale Therapie erhielten, weist darauf hin, dass bei einer Gabe von Insulin Glulisin unmittelbar nach einer Mahlzeit eine Wirksamkeit erreicht wird, die vergleichbar ist mit der Gabe von Insulin Glulisin unmittelbar vor einer Mahlzeit (0-15 Minuten) oder von löslichem Humaninsulin vor einer Mahlzeit (30-45 Minuten vorher).
Diabetes Typ 1 – Kinder
Im Rahmen einer 26-wöchigen klinischen Phase-III-Studie wurde Insulin Glulisin mit Insulin Lispro, die beide kurz (0-15 Minuten) vor einer Mahlzeit subkutan injiziert wurden, bei Kindern (4-5 Jahre: n = 9; 6-7 Jahre: n = 32; 8-11 Jahre: n = 149) und Jugendlichen (12-17 Jahre: n = 382) mit Diabetes mellitus Typ 1, welche Insulin Glargin oder NPH-Insulin als Basalinsulin verwendeten, verglichen. Insulin Glulisin war hinsichtlich der glykämischen Kontrolle vergleichbar mit Insulin Lispro, was sich in der Änderung der Konzentration des glykosylierten Hämoglobins (gemessen als HbA1c-Wert) vom Baseline-Wert bis zum Endpunkt und in den selbst kontrollierten Blutzuckerwerten widerspiegelte.
Diabetes Typ 2 – Erwachsene
Im Rahmen einer 26-wöchigen klinischen Phase-III-Studie, an die sich eine 26-wöchige Verlängerungsstudie zur Sicherheit/Unbedenklichkeit anschloss, wurde subkutan injiziertes Insulin Glulisin (0-15 Minuten vor einer Mahlzeit) mit löslichem Humaninsulin (30-45 Minuten vor einer Mahlzeit) bei Patienten mit Diabetes mellitus Typ 2 verglichen, die zusätzlich NPH-Insulin als Basalinsulin anwendeten. Der durchschnittliche Body-Mass-Index (BMI) der Patienten betrug 34,55 kg/m². In Bezug auf die Veränderung des HbA1c-Wertes zwischen Baseline-Wert und Endpunkt nach 6 Monaten (-0,46% für Insulin Glulisin und -0,3% für lösliches Humaninsulin, p = 0,0029) und zwischen Baseline-Wert und Endpunkt nach 12 Monaten (-0,23% für Insulin Glulisin und -0,13% für lösliches Humaninsulin, Unterschied nicht signifikant) waren Insulin Glulisin und lösliches Humaninsulin vergleichbar. Im Rahmen dieser Studie mischte die Mehrheit der Patienten (79%) ihr schnell wirksames Insulin unmittelbar vor der Injektion mit NPH-Insulin und 58% der Patienten verwendeten zum Zeitpunkt der Randomisierung orale blutzuckersenkende Arzneimittel. Sie wurden angewiesen, diese in der gleichen Dosierung beizubehalten.
PharmakokinetikAbsorption
Bei Insulin Glulisin wird durch den Ersatz der Aminosäure Asparagin durch Lysine in Position B3 und von Lysin durch Glutaminsäure in Position B29 eine raschere Absorption erreicht.
|
Das pharmakokinetische Profil bei Gesunden und Diabetikern (Typ 1 und Typ 2) zeigte, dass nach Verabreichung von 0,15 Einheiten/kg die Absorption von Insulin Glulisin doppelt so schnell und die Maximalkonzentration doppelt so hoch ist wie bei löslichem Humaninsulin. Tmax betrug 55 resp 82 min, Cmax betrug 82 μEinheiten/ml resp. 46 μEinheiten/ml (s. Abb.).
|
|
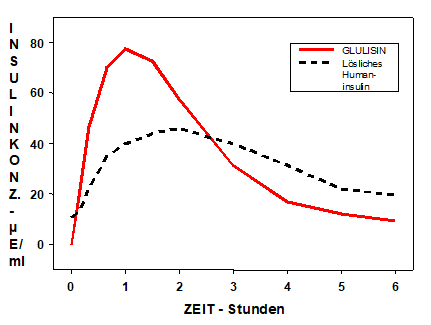
|
Nach subkutaner Verabreichung von Insulin Glulisin in verschiedene Körperbereiche waren die Pharmakokinetikprofile ähnlich, mit einer leicht rascheren Absorption in der Bauchwand als im Oberarm oder Oberschenkel.
Die absolute Bioverfügbarkeit von Insulin Glulisin nach subkutaner Injektion beträgt etwa 70%, unabhängig vom Injektionsbereich (Bauchwand 73%, Oberarm 71%, Oberschenkel 69%).
Distribution
Durch die intravenöse Bolus-Infusion von Insulin Glulisin kommt es zu einer stärkeren systemischen Exposition als nach einer subkutanen Injektion, mit einer ca. 40-mal höheren Cmax.
Die Verteilung und Elimination von Insulin Glulisin und löslichem Humaninsulin sind nach intravenöser Verabreichung ähnlich; die Verteilungsvolumina betragen 13 l resp. 22 l und die Halbwertszeiten 13 min resp. 18 min.
Metabolismus
Es liegen keine Daten vor.
Elimination
Nach subkutaner Verabreichung wird Insulin Glulisin rascher eliminiert als lösliches Humaninsulin und die Halbwertszeiten betragen 42 min resp. 86 min.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Es wurden keine klinischen Studien bei Patienten mit Leberinsuffizienz durchgeführt. Aufgrund der verringerten Glukoneogenese-Kapazität und des verminderten Insulinstoffwechsels kann der Insulinbedarf bei Patienten mit einer Einschränkung der Leberfunktion herabgesetzt sein.
Nierenfunktionsstörungen
In einer klinischen Studie, die mit nicht-diabetischen Patienten durchgeführt wurde und einen breiten Bereich der Nierenfunktion abdeckte (CrCl > 80 ml/min, 30-50 ml/min, < 30 ml/min), blieben die schnell wirkenden Eigenschaften von Insulin Glulisin im Allgemeinen erhalten. Patienten mit moderater und schwerer Niereninsuffizienz zeigten eine reduzierte Clearance von Insulin Glulisin verglichen mit gesunden Probanden. Der Insulinbedarf kann bei eingeschränkter Nierenfunktion vermindert sein.
Adipositas
Der raschere Wirkungseintritt und die kürzere Wirkungsdauer von Insulin Glulisin und Insulin Lispro im Vergleich zu löslichem Humaninsulin blieben auch bei fettleibigen Nichtdiabetikern erhalten. Der rasche Wirkungseintritt blieb mit Insulin Glulisin besser erhalten als mit Insulin Lispro.
Kinder und Jugendliche
Die pharmakokinetischen und pharmakodynamischen Eigenschaften von Insulin Glulisin im Vergleich zu löslichem Humaninsulin, 2 min vor der Mahlzeit sc. verabreicht, wurde bei 10 Kindern (7-11 Jahre) und 10 Jugendlichen (12-16 Jahre) untersucht. In beiden pädiatrischen Subgruppen zeigte Insulin Glulisin eine raschere Absorption, eine kürzere Verweildauer im Blutkreislauf und eine bessere Glukosesenkung als lösliches Humaninsulin.
Präklinische DatenDie präklinischen Daten zeigten keine Toxizitätsbefunde ausser jenen, die mit der blutzuckersenkenden pharmakodynamischen Aktivität (Hypoglykämie) verbunden sind, und waren nicht von denjenigen von löslichem Humaninsulin verschieden.
Sonstige HinweiseAusser Reichweite von Kindern aufbewahren.
Inkompatibilitäten
Subkutane Verabreichung
Es sind keine Daten über die Mischbarkeit von Insulin Glulisin mit anderen Insulinzubereitungen verfügbar, ausser mit NPH-Insulin.
Falls Apidra mit einer Insulinpumpe verabreicht wird, darf es nicht in Kombination mit einem anderen Produkt infundiert werden.
Intravenöse Verabreichung
Apidra ist mit 5%iger Glukose- und Ringerlösung nicht kompatibel und darf demzufolge nicht mit derartigen Lösungen verwendet werden. Die Verwendung anderer Lösungen wurde nicht untersucht.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit bei intravenöser Verabreichung
Insulin Glulisin zur intravenösen Verabreichung in einer Konzentration von 1 Einheit/ml ist bei Raumtemperatur 48 Stunden lang stabil.
Haltbarkeit nach Anbruch
Nach Anbruch der Durchstechflasche, der Patrone bzw. des Fertigpens ist das Präparat nach 4 Wochen zu verwerfen. Deshalb wird empfohlen, das Anbruchsdatum auf dem Etikett der Durchstechflasche, der Patrone bzw. des Fertigpens zu notieren.
Besondere Lagerungshinweise
·Apidra Durchstechflaschen, Patronen bzw. Fertigpens bis zum Anbruch im Kühlschrank (2-8 °C) lagern und sicherstellen, dass der Behälter keinen direkten Kontakt mit dem Gefrierfach oder Kühlelementen hat. Nicht einfrieren! In der Originalverpackung aufbewahren, um den Inhalt vor Licht schützen.
·Angebrochene Behälter dürfen bei Raumtemperatur (15-25 °C) von nicht über 25 °C maximal 4 Wochen lang aufbewahrt werden. Danach sind sie zu verwerfen. Im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Nicht mehr im Kühlschrank lagern, nicht einfrieren!
Hinweise für die Handhabung
Subkutane Verabreichung
Apidra ist vor der Verwendung zu prüfen. Apidra darf nur verwendet werden, wenn die Lösung klar und farblos ist und keine sichtbaren Partikel enthält. Da Apidra eine Lösung ist, darf sie vor Gebrauch nicht geschüttelt oder vermischt werden.
Vor der Anwendung des SoloStars oder von wiederverwendbaren Insulinpens muss die Gebrauchsanweisung am Ende der Packungsbeilage sorgfältig gelesen werden. Die Injektionsgeräte müssen wie in diesen Hinweisen zur Handhabung beschrieben angewendet werden.
Mit Apidra SoloStar kann Insulin in Schritten von 1 Einheit bis zu einer maximalen Einzeldosis von 80 Einheiten dosiert werden.
Der SoloStar muss vor dem ersten Gebrauch 1-2 Stunden bei Raumtemperatur (15-25 °C) aufbewahrt werden. Luftblasen in der Patrone sind vor der Injektion zu entfernen. Die Bedienungsanleitung des SoloStars ist gewissenhaft zu befolgen. Leere SoloStars dürfen nicht wiederverwendet werden und müssen vorschriftsgemäss entsorgt werden.
Die Patronen sind für den Gebrauch in wiederverwendbaren Insulinpens bestimmt (AllStar PRO und JuniorSTAR). Vor Einsetzen der Patronen in einen wiederverwendbaren Pen müssen die Patronen 1-2 Stunden bei Raumtemperatur (15-25 °C) aufbewahrt werden. Luftblasen müssen vor der Injektion aus den Patronen entfernt werden (siehe Bedienungsanleitung des Pens). Die Bedienungsanleitung des Pens ist gewissenhaft zu befolgen. Wenn der Pen beschädigt ist oder nicht einwandfrei funktioniert (infolge eines mechanischen Defekts), muss er entsorgt und ein neuer Pen verwendet werden. Leere Patronen dürfen nicht wieder aufgefüllt werden.
Intravenöse Verabreichung
Zur intravenösen Infusion muss Apidra in einer Konzentration von 1 Einheit/ml Insulin Glulisin in einer 0,9%igen Natriumchlorid-Infusionslösung (9 mg/ml) mit oder ohne 40 mmol/l Kaliumchlorid in einem Kunststoff-Infusionsbeutel aus koextrudiertem Polyolefin/Polyamid mit Infusionsschlauch verwendet werden. Die Lösung mit Insulin Glulisin zur intravenösen Verabreichung in einer Konzentration von 1 Einheit/ml ist bei Raumtemperatur 48 Stunden lang stabil.
Nach der Verdünnung zur intravenösen Verabreichung ist die Lösung vor der Infusion visuell daraufhin zu prüfen, dass sie keinerlei Schwebeteilchen enthält.
Trübe gewordene bzw. Schwebeteilchen enthaltende Lösung auf keinen Fall verwenden. Die Lösung darf nur verwendet werden, wenn sie klar und farblos ist.
Apidra ist mit 5%iger Glukose- und Ringerlösung nicht kompatibel und darf demzufolge nicht mit derartigen Lösungen verwendet werden. Die Verwendung anderer Lösungen wurde nicht untersucht.
Zulassungsnummer57013, 58056 (Swissmedic).
PackungenPatronen zu 3 ml für wiederverwendbare Insulinpens AllStar PRO und JuniorSTAR: 5 (B)
Durchstechflaschen zu 10 ml: 1 (B)
SoloStar (Fertigpen) zu 3 ml: 5 (B)
Zulassungsinhaberinsanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Stand der InformationSeptember 2022.
|


