ZusammensetzungWirkstoffe
Alteplase (mittels rekombinanter DNA-Technologie in Ovarialzellen des chinesischen Hamsters (CHO) hergestellt)
Hilfsstoffe
·In der Durchstechflasche mit Lyophilisat: Argininum, Acidum phosphoricum, Polysorbatum 80.
Indikationen/AnwendungsmöglichkeitenZur Rekanalisation (zur Aspiration von Blut und Infusion von Lösungen) thrombotisch verschlossener zentraler Venenzugänge, einschliesslich der Hämodialysekatheter.
Bei dieser Indikation wird als einzige Darreichungsform die Durchstechflasche mit 2 mg Alteplase empfohlen.
Dosierung/AnwendungDie Anwendung von Actilyse Cathflo 2 mg sollte schnellstmöglich nach Auftreten einer thrombotischen Okklusion von Ports, Einzel- oder Mehrlumenkathetern, einschliesslich Hämodialysekatheter, erfolgen. Sollte die Durchgängigkeit des okkludierten zentralen Venenzugangs bis 120 Minuten nach der ersten Dosis nicht wiederhergestellt sein, kann eine zweite Dosis instilliert werden.
Dosierung
Bei Patienten mit einem Körpergewicht von 30 kg oder darüber sollte jede Instillation mit einer Gesamtdosis von bis zu 2 mg Alteplase in 2 ml rekonstituierter Lösung erfolgen.
Bei Patienten mit einem Körpergewicht unter 30 kg sollte das Volumen der rekonstituierten Alteplase Lösung, die in den verschlossenen zentralen Venenzugang instilliert werden soll, 110 % des Volumens des Lumeninneren des Zugangs entsprechen und die Gesamtdosis von Alteplase pro Instillation 2 mg nicht übersteigen.
Art der Anwendung
Die rekonstituierte Lösung wird in das Lumen des verschlossenen zentralen Venenzugangs instilliert. Die rekonstituierte Lösung ist zur sofortigen Verwendung bestimmt.
Anweisungen zur Instillation der Actilyse Cathflo 2 mg Lösung:
1.Den Inhalt einer Durchstechflasche so rekonstituieren, dass die Endkonzentration 1 mg Alteplase pro ml beträgt (siehe „Hinweise für die Handhabung“: Anleitung zur Rekonstitution von Actilyse Cathflo 2 mg). Für Katheter, deren Lumen ein Volumen von mehr als 2 ml fasst, kann die rekonstituierte Lösung mit steriler Natriumchloridlösung 0,9 % für Injektionszwecke weiter auf das gewünschte Volumen verdünnt werden (siehe Anleitung zur Rekonstitution von Actilyse Cathflo 2 mg unter «Sonstige Hinweise»).
2.Die geeignete Alteplase-Dosis in den verschlossenen zentralen Venenzugang instillieren.
3.Nach 30 Minuten Verweildauer zur Prüfung der Funktionstüchtigkeit des Katheters versuchen, Blut zu aspirieren. Wenn der Katheter wieder durchgängig ist, mit Schritt 6 fortfahren. Wenn der Katheter weiterhin verstopft ist, mit Schritt 4 fortfahren.
4.Nach 120 Minuten Verweildauer zur Prüfung der Funktionstüchtigkeit des Katheters versuchen, Blut und Katheterinhalt zu aspirieren. Wenn der Katheter wieder durchgängig ist, mit Schritt 6 fortfahren. Wenn der Katheter weiterhin verstopft ist, mit Schritt 5 fortfahren.
5.Wenn die erste Dosis nicht ausreicht, um die Funktionstüchtigkeit des Katheters wiederherzustellen, kann eine zweite Dosis gleicher Höhe instilliert werden. Den gesamten Vorgang ab Schritt 1 wiederholen. Sollte die Funktionstüchtigkeit des Katheters nach der zweiten Alteplase-Dosis nicht wiederhergestellt sein, ist zu erwägen, einen neuen Zugang zu legen.
6.Wenn der Katheter wieder durchgängig geworden ist, 4–5 ml Blut (bei Patienten mit einem Körpergewicht ab 10 kg) bzw. 3 ml (bei Patienten mit einem Körpergewicht von weniger als 10 kg) aspirieren, um Actilyse Cathflo 2 mg und Gerinnselreste zu entfernen. Den Katheter anschliessend vorsichtig mit steriler Natriumchloridlösung 0,9 % für Injektionszwecke spülen.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Für Kinder und Jugendliche gilt das allgemeine Dosierschema, wie vorstehend beschrieben.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff Alteplase oder einem der Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenNicht thrombolische Ursachen des Katheter-Verschlusses sollten vor der Anwendung von Actilyse Cathflo 2 mg ausgeschlossen werden, u.a.:
·Malposition
·Katheterkompression
·Präzipitate
Die geeignete Darreichungsform von Alteplase ist dem Anwendungszweck entsprechend sorgfältig auszuwählen. Die 2-mg-Durchstechflasche ist nicht geeignet zur Anwendung bei den Indikationen akuter Herzinfarkt, akute Lungenembolie oder akuter ischämischer Hirnschlag (aufgrund des Risikos einer erheblichen Unterdosierung). Für die Anwendung bei diesen Indikationen sind nur die Durchstechflaschen mit 10 mg, 20 mg und 50 mg Alteplase angezeigt.
Besondere Warnhinweise und Vorsichtsmassnahmen für die Behandlung verschlossenen zentraler Venenzugänge:
Anwendung in Kombination mit Heparin:
Es ist nicht nachgewiesen, dass die Anwendung von Heparin zusätzlich zu Actilyse Cathflo 2 mg die Rate einer erfolgreichen Wiederherstellung der Katheterfunktion erhöht; sie wird daher nicht empfohlen. Wenn Heparin für notwendig gehalten wird, um ein erneutes Verstopfen zu verhindern, sollte dieses getrennt angewendet werden, nachdem die Katheterfunktion wiederhergestellt ist.
Schädigung der Gefässwand und Katheterkollaps:
Neben einer Thrombenbildung gibt es verschiedene andere Gründe, aus denen ein Katheter funktionsuntüchtig werden kann, z.B. schlechte Lage des Katheters, mechanisches Versagen, Einklemmen durch eine Naht oder Fettablagerungen bzw. Ablagerungen ausgefällter Arzneimittelreste im Katheterlumen. Da das Risiko besteht, dass es zu einer Schädigung der Gefässwand oder zum Kollabieren von Kathetern mit weichen Wänden kommt, muss bei der Prüfung der Durchgängigkeit des Katheters auf kräftiges Ansaugen verzichtet werden. Bei der Instillation von Actilyse Cathflo 2 mg in den Katheter darf kein übermässiger Druck ausgeübt werden, da dies zu einer Katheterruptur oder zum Austreiben des Gerinnsels in die Blutbahn führen kann.
Besondere Vorsicht ist erforderlich, wenn zur Instillation kleinvolumige Spritzen (≤1 ml) verwendet werden, besonders bei kleinvolumigen Kathetern, wie sie allgemein in der Pädiatrie Verwendung finden.
Blutungen:
Die häufigste unerwünschte Wirkung, die mit allen Thrombolytika assoziiert ist, ist bei allen zugelassenen Indikationen Blutungen. Actilyse Cathflo 2 mg wurde nicht an Patienten mit verschlossenen Kathetern untersucht, die als Risikopatienten für Blutungsereignisse, wie sie bei der Anwendung von Thrombolytika auftreten können, bekannt sind. Bei Patienten mit aktiven inneren Blutungen und bei solchen, bei denen eines der folgenden Ereignisse weniger als 48 Stunden vor Beginn der Instillation zurückliegt, ist Vorsicht geboten: Operation, Entbindung, perkutane Biopsie eines inneren Organs oder eines tief liegenden Gewebes oder Punktion eines nicht komprimierbaren Gefässes. Darüber hinaus ist auch bei Patienten mit Thrombopenie, sonstigen Störungen der Hämostase (einschliesslich von Störungen im Zusammenhang mit schweren Leber- oder Nierenerkrankungen) oder Erkrankungen, bei denen eine Blutung eine erhebliche Gefährdung darstellen oder wegen ihrer Lokalisation ungewöhnlich schwierig zu behandeln sein würde, Vorsicht geboten sowie bei Patienten mit hohem Risiko für embolische Komplikationen (z.B. Venenthrombosen im Bereich des Katheters). Es wurde auch über Todesfälle und Fälle von bleibender Invalidität bei Patienten berichtet, die unter pharmakologisch wirksamen Dosen eines Thrombolytikum einen Schlaganfall oder eine andere schwerwiegende Blutungsepisode erlitten. Im Falle einer schwerwiegenden Blutung mit kritischer Lokalisation (z.B. intrakranial, gastrointestinal, retroperitoneal, perikardial) muss die Behandlung mit Actilyse Cathflo 2 mg abgebrochen und die instillierte Lösung aus dem Katheter abgezogen werden.
Infektionen:
Die Anwendung von Actilyse Cathflo 2 mg kann bei Patienten, bei denen die Verstopfung durch infizierte Thromben verursacht wurde, zur Freisetzung von Mikroorganismen in den systemischen Blutkreislauf und in der Folge zur Sepsis führen. Wie bei allen Katheterisierungs-Eingriffen muss auf Einhaltung aseptischer Kautelen und, falls erforderlich, ausreichende antibiotische Behandlung geachtet werden.
Wiederholte Verabreichung:
Pro Verstopfungsereignis kann bis zu zweimal eine Einzeldosis von maximal 2 mg Alteplase angewendet werden (insgesamt 4 mg) (siehe «Dosierung/Anwendung»). Bei einem Körpergewicht unterhalb 30 kg darf die Gesamtdosis an Alteplase 2 mg nicht überschreiten. Im Falle einer weiter andauernden Katheterdysfunktion sollte nach anderen Ursachen gesucht werden. Spätere erneute Verschlüsse können auf die gleiche Weise behandelt werden. Dabei ist zu beachten, dass das häufige Auftreten derartiger Dysfunktionen darauf hinweisen kann, dass ein neuer Katheter gelegt werden muss.
Hypersensitivität:
Die Antikörperbildung nach einmaliger oder wiederholter Gabe von Alteplase zur Rekanalisation thrombotisch verschlossener zentraler Venenzugänge, wurde nicht untersucht. Die mit der Anwendung von Actilyse Cathflo 2 mg verbundenen Überempfindlichkeitsreaktionen können durch den Wirkstoff Alteplase oder einen der sonstigen Bestandteile (siehe auch «Kontraindikationen») hervorgerufen werden.
Im Fall einer schweren Überempfindlichkeitsreaktion sollte die Instillation beendet und eine geeignete Behandlung sofort eingeleitet werden.
Es gibt nur wenig Daten bei Kindern unter 2 Jahren.
InteraktionenEs wurden keine formalen Interaktionsstudien mit Actilyse Cathflo 2 mg durchgeführt.
Arzneimittel mit Auswirkungen auf die Blutgerinnung/Thrombozytenfunktion
Arzneimittel, welche die Blutgerinnung oder die Plättchenfunktion beeinflussen, können das Blutungsrisiko vor, während oder nach der Therapie mit Actilyse Cathflo 2 mg erhöhen.
ACE-Hemmer
Die gleichzeitige Behandlung mit ACE-Hemmern kann das Risiko einer Überempfindlichkeitsreaktion erhöhen.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen nur wenige Daten über die Anwendung von Actilyse Cathflo bei schwangeren Frauen vor.
In tierexperimentellen Untersuchungen mit höheren Dosen als denjenigen für Menschen wurden nicht nur die bekannten pharmakologischen Wirkungen, sondern auch fetale Entwicklungsstörungen und/oder Embryotoxizität beobachtet (siehe «Präklinische Daten»).
Bei einer akuten lebensbedrohlichen Krankheit muss der Nutzen anhand des potenziellen Risikos bewertet werden.
Stillzeit
Es ist nicht bekannt, ob Alteplase in die Muttermilch übergeht.
Fertilität
Für Actilyse Cathflo 2 mg liegen keine klinischen Daten zur Fertilität vor. Nicht-klinische Studien zu Alteplase zeigten keine nachteiligen Auswirkungen auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenDie Häufigkeit unerwünschter Wirkungen wird mit Hilfe der MedDRA-Häufigkeitskonvention* angegeben.
*MedDRA-Häufigkeitskonvention:
Sehr häufig ≥1/10
Häufig ≥1/100 bis <1/10
Gelegentlich ≥1/1'000 bis <1/100
Selten ≥1/10'000 bis <1/1'000
Sehr selten <1/10'000 einschliesslich gemeldeter Einzelfälle
Grundsätzlich können alle unerwünschten Wirkungen, die bei der systemischen Anwendung von Alteplase vorkommen (siehe Arzneimittel-Fachinformation von Actilyse), auch bei der Behandlung von verschlossenen Kathetern auftreten, wenn Actilyse Cathflo 2 mg dabei in den systemischen Kreislauf gelangt (z.B. Blutungen, Embolie, Überempfindlichkeitsreaktionen, anaphylaktoide Reaktionen, Blutdrucksenkung, Übelkeit, Erbrechen, Erhöhung der Körpertemperatur), obwohl bei dieser Dosierung keine physiologisch relevanten Plasmakonzentrationen erreicht werden. Jedoch weisen die pharmakokinetischen Daten darauf hin, dass bei korrekter Anwendung keine physiologisch relevanten Plasmakonzentrationen erreicht werden sollten. In klinischen Studien zur Behandlung verschlossener Katheter mit Actilyse Cathflo 2 mg wurden die folgenden unerwünschten Wirkungen beobachtet:
Infektionen und parasitäre Erkrankungen
Gelegentlich: Sepsis.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Katheterbezogene Komplikationen.
Selten: Pyrexie.
Bei der systemischen Anwendung von Actilyse, d.h. bei hohen Dosen bei thromboembolischer Indikation, wurden die folgenden Nebenwirkungen beobachtet:
Störungen des Immunsystems
Anaphylaktoide Reaktionen, welche normalerweise mild verlaufen, können in einigen Fällen lebensbedrohlich sein. Folgende Symptome können auftreten: Rash, Urtikaria, Bronchospasmus, Angioödem, Hypotonie, Schock und andere Symptome, welche mit einer Überempfindlichkeitsreaktion in Verbindung gebracht werden können.
Die erwähnten Störungen des Immunsystems gelten als dosisunabhängig und wurden bisher in klinischen Studien mit Actilyse Cathflo 2 mg nicht beobachtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungSymptome
Trotz der relativen Fibrinspezifität kann es bei Überdosierung zu einer klinisch relevanten Verminderung von Fibrinogen und anderen Blutgerinnungskomponenten kommen.
Behandlung
In der Regel kann in solch einem Falle die physiologische Neusynthese dieser Faktoren nach Absetzen der Alteplase-Therapie abgewartet werden. Tritt jedoch in diesem Zusammenhang eine schwere Blutung auf, wird die Gabe von frisch gefrorenem Plasma oder Frischblut empfohlen und sofern notwendig, können synthetische Antifibrinolytika verabreicht werden.
Eigenschaften/WirkungenATC-Code
B01AD02
Wirkungsmechanismus / Pharmakodynamik
Alteplase ist ein gentechnologisch hergestelltes humanes Glykoprotein, das Plasminogen direkt zu Plasmin aktiviert. Bei intravenöser Verabreichung bleibt Alteplase im Kreislauf relativ inaktiv, bis es an Fibrin bindet. Durch die Bindung an Fibrin wird Alteplase aktiviert, induziert die Umwandlung von Plasminogen zu Plasmin und führt damit zur Auflösung des Fibringerinnsels.
Aufgrund seiner relativen Fibrinspezifität bewirkt Alteplase bei Verabreichung einer Gesamtdosis von 100 mg eine mässige Senkung der zirkulierenden Fibrinogen-Werte auf ca. 60% nach 4 Stunden, wobei diese nach 24 Stunden wieder auf 80% ansteigen. Plasminogen und Alpha-2-Antiplasmin fallen nach 4 Stunden auf 20% bzw. 35% ab, und steigen nach 24 Stunden wieder auf über 80% an. Eine ausgeprägte und langdauernde Senkung des Fibrinogenspiegels im Blut ist nur bei wenigen Patienten zu beobachten.
Klinische Wirksamkeit
Verschlossene zentrale Venenzugänge einschliesslich von zur Hämodialyse verwendeten Zugängen:
In zwei klinischen Studien wurden mehr als 1'100 überwiegend erwachsene Patienten mit schlecht funktionierendem zentralen Venenzugang mit Alteplase behandelt. Die Katheterfunktion konnte bei 74 % bzw. 77 % durch eine Dosis und bei 87 % bzw. 90 % durch zwei Dosen Alteplase wiederhergestellt werden. Die Wiederverschlussrate betrug 26 %.
In Studien mit Hämodialysekathetern, die zum Teil ≥2 Stunden, zum Teil aber auch bis zur nächsten Dialysebehandlung liegen blieben, wurden vergleichbare Raten erzielt.
Pädiatrische Population
In einer Studie mit 310 Kindern war die Gesamtrate der Katheter, deren Durchgängigkeit erfolgreich wiederhergestellt werden konnte, mit 83 % nach maximal zwei Dosen Alteplase der bei Erwachsenen erzielten Rate vergleichbar. In den pivotalen Studien zur Wiederherstellung der Katheter-Durchgängigkeit erhielten insgesamt 432 Patienten unter 17 Jahren bis zu zweimal eine Dosis von maximal 2 mg Alteplase. Die Ergebnisse zur Sicherheit und Wirksamkeit waren bei den pädiatrischen und den erwachsenen Patienten insgesamt ähnlich.
PharmakokinetikDistribution
Die relevante Halbwertszeit T½ alpha beträgt 3,5-5 Minuten. Das bedeutet, dass nach 20 Minuten weniger als 10% des Ausgangswertes im Plasma vorhanden ist. Für die in einem tiefen Kompartiment verbleibende Restmenge wurde eine beta-Halbwertszeit von rund 40 Minuten gemessen.
Das Distributionsvolumen beträgt 2,8-4,4 Liter (V1) bzw. 8-9 Liter (Vss).
Elimination
Alteplase wird rasch aus dem Blutkreislauf ausgeschieden und hauptsächlich über die Leber metabolisiert (Plasma-Clearance 550-680 ml/Min.).
Bei vorschriftsmässiger Anwendung von Alteplase zur Wiederherstellung der Funktion eines verschlossenen zentralen Venenzugangs ist nicht zu erwarten, dass die zirkulierenden Alteplase-Plasmaspiegel pharmakologisch wirksame Konzentrationen erreichen. Wenn eine Dosis von 2 mg Alteplase mittels Bolusinjektion direkt in den systemischen Kreislauf injiziert (statt in den Katheter instilliert) würde, wäre damit zu rechnen, dass die zirkulierende Alteplase–Konzentration innerhalb von 30-60 Minuten unter die Nachweisgrenze zurückkehrt.
Präklinische DatenMutagenität
In Mutagenitäts-Tests zeigten sich keine Hinweise auf ein mutagenes Potential.
Reproduktionstoxizität
Bei trächtigen Tieren wurden nach intravenöser Infusion bzw. pharmakologisch wirksamen Dosen keine teratogenen Wirkungen beobachtet. Bei Kaninchen führten Tagesdosen über 3 mg/kg/Tag zu Embryotoxizität (Embryoletalität, Wachstumsverzögerung). Bei Ratten wurde bei Dosen bis zu 10 mg/kg/Tag kein Einfluss auf die peri- und postnatale Entwicklung oder auf die Fruchtbarkeitsparameter beobachtet.
Sonstige HinweiseInkompatibilitäten
Die rekonstituierte 1 mg/ml Lösung darf aufgrund vermehrt auftretender Trübung der rekonstituierten Lösung nicht weiter mit Wasser für Injektionszwecke oder kohlenhydrathaltigen Infusionslösungen (z.B. Dextrose) verdünnt werden (siehe auch Abschnitt «Hinweise für die Handhabung»).
Actilyse Cathflo 2 mg darf weder mit anderen Arzneimitteln gemischt, noch über denselben Venenzugang (auch nicht mit Heparin) verabreicht werden.
Haltbarkeit und besondere Lagerungshinweise
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Im Kühlschrank (2 - 8°C) lagern.
Arzneimittel für Kinder unzugänglich aufbewahren.
Es wurde eine chemische und physikalische Stabilität der rekonstituierten Lösung von 24 Stunden bei 2-8°C und von 8 Stunden bei 30°C nachgewiesen.
Aus mikrobiologischer Sicht sollte die gebrauchsfertige Lösung sofort nach ihrer Herstellung verwendet werden. Falls aseptisch hergestellt, sollten üblicherweise 24 Stunden bei 2-8°C nicht überschritten werden.
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Hinweise für die Handhabung
Der Inhalt einer Durchstechflasche Actilyse Cathflo 2 mg Trockensubstanz wird unter aseptischen Bedingungen mit 2,2 ml Wasser für Injektionszwecke zu einer Konzentration von 1 mg Alteplase pro ml gelöst. Jede Durchstechflasche enthält einen Überschuss, um sicherzustellen, dass 2 mg Alteplase in 2 ml entnommen werden können. Das Lösungsmittel muss mit einer Spritze mit geeigneter Messgenauigkeit (z.B. mit einer Graduierung in 0,1-ml-Schritten) in die den Wirkstoff enthaltende Flasche überführt werden.
|
Anleitung zur Rekonstitution von Actilyse Cathflo 2 mg
| |
1
|
Rekonstitution unmittelbar vor der Anwendung durchführen.
|
|
| |
2
|
Schutzkappe der Durchstechflasche mit Actilyse Cathflo 2 mg Trockensubstanz mit dem Daumen hochklappen und entfernen.
|
|

| |
3
|
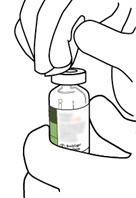
Gummistopfen der Durchstechflasche mit einem Alkoholtupfer abtupfen.
|
|
| |
4
|
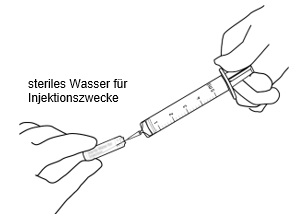
Unter aseptischen Bedingungen 2,2 ml steriles Wasser für Injektionszwecke mit einer Spritze entnehmen.
|
|
| |
5
|
Nadel senkrecht und mittig in den Gummistopfen der Durchstechflasche mit dem Actilyse Cathflo 2 mg Pulver einführen und 2,2 ml steriles Wasser für Injektionszwecke in die Durchstechflasche geben.
|
|

| |
6
|
Durchstechflasche mit rekonstituierter Actilyse Cathflo 2 mg Lösung vorsichtig mit der Hand schwenken, um das restliche Pulver aufzulösen. Nicht schütteln, um Schaumbildung zu vermeiden.
Im Falle von Bläschenbildung die Lösung einige Minuten ungestört stehen lassen, damit diese sich auflösen.
|
|

|

| |
7
|
Die rekonstituierte Lösung besteht aus 1 mg/ml Alteplase. Sie sollte klar und farblos bis schwach gelblich sein und keine Partikel enthalten.
| |
8
|
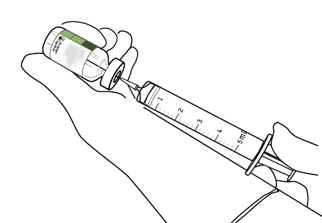
Benötigte Menge mittels Spritze und Nadel entnehmen.
|
|
| |
9
|
Sofort verwenden (siehe unten, falls eine weitere Verdünnung der rekonstituierten Lösung erwogen wird).
Nicht verwendete Lösung entsorgen.
|
Die 1 mg/ml rekonstituierte Lösung sollte vor der Anwendung auf Farbe und Vorhandensein von Partikeln visuell geprüft werden.
Die 1 mg/ml rekonstituierte Lösung kann mit steriler Natriumchloridlösung 9 mg/ml (0,9 %) bis zu einer Mindestkonzentration von 0,2 mg/ml weiter verdünnt werden.
Eine auftretende Trübung der gebrauchsfertig zubereiteten Lösung kann bei weiterer Verdünnung nicht ausgeschlossen werden.
Zulassungsnummer58665 (Swissmedic)
PackungenPackung mit 5 Durchstechflaschen mit 2 mg Wirkstoff
Abgabekategorie: B
ZulassungsinhaberinBoehringer Ingelheim (Schweiz) GmbH, Basel
Stand der InformationOktober 2023
|








