ZusammensetzungWirkstoffe
Paliperidonum (ut Paliperidoni palmitas).
Hilfsstoffe
Polysorbatum 20, Macrogolum 4000, Acidum citricum monohydricum, Dinatrii phosphas, Natrii dihydrogenophosphas monohydricus, Natrii hydroxidum, Aqua ad iniectabile.
1 Fertigspritze à 25 mg enthält 0.917 mg Natrium.
1 Fertigspritze à 50 mg enthält 1.834 mg Natrium.
1 Fertigspritze à 75 mg enthält 2.752 mg Natrium.
1 Fertigspritze à 100 mg enthält 3.670 mg Natrium.
1 Fertigspritze à 150 mg enthält 5.503 mg Natrium.
Indikationen/AnwendungsmöglichkeitenXeplion ist indiziert zur Akut- und Erhaltungstherapie bei Schizophrenie.
Dosierung/AnwendungErwachsene (≥18 Jahre)
Bei Patienten, die niemals zuvor orales Paliperidon oder orales bzw. injizierbares Risperidon angewendet haben, empfiehlt es sich, vor Beginn der Behandlung mit Xeplion die Verträglichkeit von oralem Paliperidon oder oralem Risperidon zu ermitteln.
Therapieeinleitung
Die empfohlene Anfangsdosis von Xeplion beträgt 150 mg am Behandlungstag 1 und 100 mg nach einer Woche, jeweils verabreicht in den Deltoidmuskel.
Erhaltungstherapie
Die empfohlene monatliche Erhaltungsdosis beträgt 75 mg; einige Patienten können je nach individueller Verträglichkeit und/oder Wirksamkeit auch von niedrigeren oder höheren Dosen innerhalb des empfohlenen Bereichs von 25 bis 150 mg profitieren. Nach der zweiten Anfangsdosis können die monatlichen Erhaltungsdosen in den Deltoid- oder Glutealmuskel verabreicht werden.
Gegebenenfalls kann Xeplion monatlich in der niedrigst möglichen wirksamen Erhaltungsdosis angepasst werden. Bei Dosisanpassungen sind die Retardeigenschaften von Xeplion mit verzögerter Wirkstofffreisetzung zu berücksichtigen (siehe «Pharmakokinetik»), da die volle Wirkung der Dosisanpassung möglicherweise erst nach einigen Monaten eintritt.
Das Nutzen-Risiko-Verhältnis muss überprüft werden. Falls Xeplion abgesetzt wird, sind die Retardeigenschaften (siehe «Pharmakokinetik») zu berücksichtigen. Wie auch bei anderen antipsychotischen Arzneimitteln empfohlen, muss die Notwendigkeit der fortgesetzten Gabe von Arzneimitteln gegen vorhandene extrapyramidalmotorische Symptome (EPS) regelmässig überprüft werden.
Umstellung von einem anderen Antipsychotikum auf Xeplion
Speziell zur Umstellung schizophrener Patienten von anderen Antipsychotika auf Xeplion oder zur gleichzeitigen Anwendung mit anderen Antipsychotika liegen keine systematisch erhobenen Daten vor. Bei Patienten, die zuvor nie orales Paliperidon oder orales oder injizierbares Risperidon erhalten haben, sollte die Verträglichkeit mit oralem Paliperidon oder oralem Risperidon vor Behandlungsbeginn mit Xeplion abgeklärt werden (siehe «Dosierung/Anwendung»).
Zuvor angewendete orale Antipsychotika können bei Beginn der Behandlung mit Xeplion schrittweise abgesetzt werden. Die Behandlung mit Xeplion sollte, wie oben in diesem Kapitel beschrieben, begonnen werden. Bei Patienten, die im Steady-State einer Behandlung mit lang wirkenden injizierbaren Antipsychotika sind, kann anstelle der Verabreichung der nächsten vorgesehenen Injektion die Therapie mit Xeplion begonnen werden. Die Verabreichung von Xeplion sollte dann in monatlichen Abständen fortgeführt werden. Das am Anfang dieses Kapitels «Dosierung/Anwendung» beschriebene einwöchige Anfangsdosierungsschema ist nicht erforderlich.
Patienten, die zuvor auf verschiedene Dosen von Paliperidon-Tabletten mit verlängerter Wirkstofffreisetzung eingestellt wurden, können während der Erhaltungstherapie mit monatlichen Dosen von Xeplion gemäss der Staffelung in Tabelle 1 eine vergleichbare Steady-State Paliperidon-Exposition erreichen:
Tabelle 1: Dosen von Paliperidon-Tabletten mit verlängerter Wirkstofffreisetzung und Xeplion, die erforderlich sind, um während der Erhaltungstherapie eine vergleichbare Steady-State Paliperidon-Exposition zu erreichen
|
Darreichungsform
|
Vorgängige Dosis der Paliperidon-Tabletten
mit verlängerter Wirkstofffreisetzung
|
Xeplion per Injektion
| |
Dosierungshäufigkeit
|
Einmal täglich
|
Einmal alle 4 Wochen
| |
Dosis (mg)
|
3 mg
|
25-50 mg äq.
| |
6 mg
|
75 mg äq.
| |
9 mg
|
100 mg äq.
| |
12 mg
|
150 mg äq.
|
Patienten, die zuvor auf verschiedene Dosen von Risperidon in Depotform eingestellt wurden, können während der Erhaltungstherapie mit monatlichen Xeplion-Dosen gemäss folgender Staffelung eine vergleichbare Steady-State Paliperidon-Exposition erreichen:
Depot-Risperidon-Dosen und Xeplion-Dosen, die zur Erreichung einer vergleichbaren Paliperidon-Exposition im «Steady-state» erforderlich sind
|
Bisherige Depot-Risperidon-Dosis Consta
|
Xeplion
| |
25 mg alle 2 Wochen
|
50 mg einmal pro Monat
| |
37,5 mg alle 2 Wochen
|
75 mg einmal pro Monat
| |
50 mg alle 2 Wochen
|
100 mg einmal pro Monat
|
Das Absetzen der bisherigen antipsychotischen Arzneimittel sollte in Übereinstimmung mit den jeweiligen Fachinformationen erfolgen. Beim Absetzen von Xeplion muss die verzögerte Wirkstofffreisetzung berücksichtigt werden. Wie bei anderen antipsychotischen Arzneimitteln empfohlen, sollte dann die Notwendigkeit zur weiteren Verabreichung von Arzneimitteln zur Behandlung fortbestehender extrapyramidalmotorischer Symptome (EPS) regelmässig überprüft werden.
Patienten mit Leberfunktionsstörungen
Xeplion wurde bei Patienten mit eingeschränkter Leberfunktion nicht untersucht. Ausgehend von einer Studie mit oralem Paliperidon ist bei Patienten mit leichter oder mässiger Einschränkung der Leberfunktion keine Dosisanpassung erforderlich. Da Paliperidon bei Patienten mit stark eingeschränkter Leberfunktion nicht untersucht (siehe «Pharmakokinetik») wurde, ist bei diesen Patienten Vorsicht geboten.
Patienten mit Nierenfunktionsstörungen
Xeplion wurde bei Patienten mit eingeschränkter Nierenfunktion nicht systematisch untersucht (siehe «Pharmakokinetik»). Die empfohlene Anfangsdosis von Xeplion bei Patienten mit leichter Einschränkung der Nierenfunktion (Kreatinin-Clearance ≥50 bis <80 ml/Min.) beträgt 100 mg am Behandlungstag 1 und 75 mg nach einer Woche, jeweils verabreicht in den Deltoidmuskel. Anschliessend werden monatlich Injektionen zu 50 mg in den Deltoid- oder Glutealmuskel verabreicht, die innerhalb des Bereiches 25 bis 100 mg angepasst werden, je nach individueller Verträglichkeit und/oder Wirksamkeit.
Bei Patienten mit mässiger oder starker Einschränkung der Nierenfunktion (Kreatinin-Clearance <50 ml/Min.) wird die Anwendung von Xeplion nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Ältere Patienten
In den klinischen Studien mit Xeplion wurden nicht genügend Patienten >65 Jahre untersucht. Daher kann nicht beurteilt werden, ob diese Altersgruppe anders auf Xeplion anspricht als jüngere Patienten.
Die Dosierungsempfehlungen für ältere Patienten mit normaler Nierenfunktion (Kreatinin-Clearance ≥80 ml/min) entsprechen den Empfehlungen für Erwachsene mit normaler Nierenfunktion (siehe ersten Absatz oben unter «Dosierung/Anwendung»). Da die Nierenfunktion bei älteren Patienten jedoch eingeschränkt sein kann, ist gegebenenfalls eine Dosisanpassung entsprechend dem Nierenfunktionsstatus erforderlich (siehe «Dosierung/Anwendung / Patienten mit Nierenfunktionsstörungen»).
Ältere Patienten mit Demenz haben unter der Behandlung mit atypischen Psychotika ein erhöhtes Risiko für Gesamtmortalität und zerebrovaskuläre Ereignisse. Die Anwendung bei diesen Patienten mit Demenz wird nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Xeplion bei Patienten <18 Jahren wurde nicht untersucht. Daher sollte Xeplion in dieser Altersgruppe nicht angewendet werden.
Weitere Patientengruppen
Eine Anpassung der Dosis von Xeplion aufgrund des Geschlechts, der ethnischen Zugehörigkeit oder des Raucherstatus wird nicht empfohlen (schwangere oder stillende Frauen, siehe «Schwangerschaft, Stillzeit»).
Verspätete Dosisgabe
Vermeidung des Auslassens von Dosen
Es empfiehlt sich, die zweite Anfangsdosis von Xeplion eine Woche nach der ersten Dosis zu verabreichen. Um zu vermeiden, dass Dosen ausgelassen werden, kann die zweite Dosis den Patienten 2 Tage vor oder nach Verstreichen des Wochentermins gegeben werden. Entsprechend empfiehlt es sich, die dritte Injektion und Folgeinjektionen nach den Anfangsdosen monatlich zu verabreichen. Um zu vermeiden, dass eine Monatsdosis ausgelassen wird, kann die Injektion den Patienten bis zu 7 Tage vor oder nach Verstreichen des Monatstermins gegeben werden.
Wenn der Termin für die zweite Xeplion Injektion (Tag 8 ± 2 Tage) verpasst wird, hängt der empfohlene Neubeginn von jenem Zeitraum ab, welcher seit der ersten Injektion bei diesem Patienten vergangen ist.
Zweite Anfangsdosis ausgelassen (<4 Wochen nach der ersten Injektion)
Wenn seit der ersten Injektion weniger als 4 Wochen vergangen sind, sollte dem Patienten so schnell wie möglich die zweite Injektion von 100 mg in den Deltoidmuskel verabreicht werden. Eine dritte Xeplion Injektion von 75 mg sollte 5 Wochen nach der ersten Injektion (unabhängig vom Zeitpunkt der zweiten Injektion) in den Deltoidmuskel oder den Glutealmuskel verabreicht werden. Danach sollte der normale monatliche Zyklus von 25-mg- bis 150-mg-Injektionen je nach Verträglichkeit und/oder Wirksamkeit beim jeweiligen Patienten in den Deltoid- oder Glutealmuskel angewendet werden.
Zweite Anfangsdosis ausgelassen (4 bis 7 Wochen nach der ersten Injektion)
Wenn seit der ersten Xeplion-Injektion 4 bis 7 Wochen vergangen sind, setzen Sie die Dosierung mit zwei Injektionen von 100 mg auf folgende Weise fort:
1.so schnell wie möglich eine Injektion in den Deltoidmuskel
2.eine weitere Injektion in den Deltoidmuskel eine Woche später
3.Fortsetzung des normalen monatlichen Zyklus von Injektionen in den Deltoid- oder Glutealmuskel von 25 mg bis 150 mg je nach individueller Verträglichkeit und/oder Wirksamkeit
Zweite Anfangsdosis ausgelassen (>7 Wochen nach der ersten Injektion)
Wenn seit der ersten Xeplion-Injektion mehr als 7 Wochen vergangen sind, beginnen Sie die Dosierung entsprechend der Beschreibung oben für den empfohlenen Beginn der Behandlung mit Xeplion.
Ausgelassene Erhaltungsdosis (1 Monat bis 6 Wochen)
Nach Gabe der Anfangsdosen sollten die Injektionen von Xeplion monatlich erfolgen. Wenn seit der letzten Injektion weniger als 6 Wochen verstrichen sind, sollte die letzte stabilisierte Dosis so bald wie möglich und anschliessend wieder monatlich verabreicht werden.
Ausgelassene Erhaltungsdosis (>6 Wochen bis 6 Monate)
Wenn seit der letzten Injektion von Xeplion mehr als 6 Wochen verstrichen sind, sollte folgendermassen vorgegangen werden:
Bei Patienten, die mit einer Dosis von 25 bis 100 mg eingestellt wurden
1.so schnell wie möglich eine Injektion in der gleichen Dosierung, auf die der Patient zuvor eingestellt wurde in den Deltoidmuskel
2.eine weitere Injektion in den Deltoidmuskel (gleiche Dosis) eine Woche später (Tag 8)
3.Fortsetzung des normalen monatlichen Zyklus von Injektionen in den Deltoid- oder Glutealmuskel von 25 mg bis 150 mg je nach Verträglichkeit und/oder Wirksamkeit bei dem jeweiligen Patienten
Bei Patienten, die mit 150 mg eingestellt wurden
1.so schnell wie möglich eine Injektion in der 100 mg-Dosis in den Deltoidmuskel
2.eine weitere Injektion in der 100-mg-Dosis in den Deltoidmuskel eine Woche später (Tag 8)
3.Fortsetzung des normalen monatlichen Zyklus von Injektionen in den Deltoid- oder Glutealmuskel von 25 mg bis 150 mg je nach Verträglichkeit und/oder Wirksamkeit bei dem jeweiligen Patienten
Ausgelassene Erhaltungsdosis (>6 Monate)
Wenn seit der letzten Injektion von Xeplion mehr als 6 Monate verstrichen sind, muss mit der Dosisgabe, wie für die initiale empfohlene Einleitung der Gabe von Xeplion oben beschrieben, begonnen werden.
Art der Anwendung
Xeplion ist nur für die intramuskuläre Anwendung bestimmt. Die Injektion muss langsam und in das tiefe Muskelgewebe erfolgen. Jede Injektion ist von einer medizinischen Fachperson durchzuführen. Die Anwendung sollte in Form einer Einzelinjektion erfolgen. Die Dosis darf nicht auf mehrere Injektionen aufgeteilt werden. Xeplion darf nicht intravaskulär oder subkutan verabreicht werden.
Die empfohlene Kanülengrösse für die Verabreichung von Xeplion in den Deltoidmuskel richtet sich nach dem Körpergewicht des Patienten. Bei Patienten ≥90 kg wird eine Kanüle der Grösse 22 G und der Länge 3,8 cm empfohlen. Bei Patienten <90 kg wird eine Kanüle der Grösse 23 G und der Länge 2,5 cm empfohlen. Die Injektionen in den Deltamuskel sind abwechselnd in einen der beiden Deltamuskeln vorzunehmen.
Für die Verabreichung von Xeplion in den Glutealmuskel wird eine Kanüle der Grösse 22 G und der Länge 3,8 cm empfohlen. Die Anwendung sollte in den oberen äusseren Quadranten des Glutealbereichs erfolgen. Die Injektionen in den Glutealmuskel sind abwechselnd in einen der beiden Glutealmuskeln vorzunehmen.
Da Paliperidon der aktive Hauptmetabolit von Risperidon ist, ist bei kombinierter Gabe von Xeplion und Risperidon oder oralem Paliperidon über längere Zeiträume hinweg aufgrund erhöhter Exposition Vorsicht geboten (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Datenlage zur Sicherheit der gleichzeitigen Anwendung von Xeplion und anderen Antipsychotika ist begrenzt.
KontraindikationenBekannte Überempfindlichkeit gegenüber Paliperidon oder Risperidon (Paliperidon ist ein aktiver Metabolit von Risperidon) oder einem der Hilfsstoffe gemäss Zusammensetzung.
Demente Patienten mit Parkinsonsymptomen im Sinne von Rigor, Bradykinese und parkinson'schen Haltungsstörungen.
Demente Patienten mit der wahrscheinlichen Diagnose einer Lewy-Körper-Demenz (neben den Symptomen einer Demenz mindestens zwei der folgenden drei Symptome: Parkinsonismus/visuelle Halluzinationen/Fluktuation im Verlauf).
Warnhinweise und VorsichtsmassnahmenQT-Intervall
Oral verabreichtes Paliperidon kann das QT-Intervall verlängern.
Wie bei anderen Antipsychotika ist Vorsicht geboten, wenn Xeplion Patienten mit bekannten kardiovaskulären Erkrankungen, kongenitalem Long-QT-Syndrom sowie mit QT-Verlängerungen in der Familienanamnese verordnet wird sowie auch bei der gleichzeitigen Anwendung mit anderen Arzneimitteln, von denen angenommen wird, dass sie das QT-Intervall verlängern (siehe «Unerwünschte Wirkungen»).
Überempfindlichkeitsreaktionen
Obwohl die Verträglichkeit von oral verabreichtem Paliperidon oder Risperidon vor Beginn der Behandlung mit Xeplion abgeklärt werden sollte, sind während der Anwendungsbeobachtung nach der Markteinführung in sehr seltenen Fällen bei Patienten, die oral verabreichtes Risperidon oder oral verabreichtes Paliperidon zuvor toleriert hatten, anaphylaktische Reaktionen aufgetreten (siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).
Beim Auftreten von Überempfindlichkeitsreaktionen ist die Anwendung von Xeplion zu beenden; allgemeine unterstützende Massnahmen je nach klinischer Indikation sind einzuleiten und der Patient ist zu überwachen, bis die Symptome abgeklungen sind (siehe «Kontraindikationen» und «Unerwünschte Wirkungen»).
Malignes Neuroleptisches Syndrom
In Verbindung mit Antipsychotika einschliesslich Paliperidon wurde über ein malignes neuroleptisches Syndrom (MNS) berichtet, das durch Hyperthermie, Muskelrigidität, autonome Instabilität, Bewusstseinsstörungen und erhöhte Serum-Kreatinphosphokinase-Spiegel gekennzeichnet ist. Weitere klinische Zeichen können Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein. Bei klinischen Hinweisen auf ein MNS sind sämtliche Antipsychotika, einschliesslich Xeplion, abzusetzen.
Tardive Dyskinesie/extrapyramidale Symptome
Arzneimittel mit antagonistischen Effekten auf den Dopamin-Rezeptor werden mit der Induktion von tardiver Dyskinesie in Zusammenhang gebracht, die durch rhythmische unwillkürliche Bewegungen vorzugsweise der Zunge und/oder des Gesichts gekennzeichnet ist. Bei Symptomen einer tardiven Dyskinesie sollte das Absetzen aller Antipsychotika, einschliesslich Xeplion, in Erwägung gezogen werden.
Extrapyramidale Symptome und Psychostimulanzien
Bei Patienten, die gleichzeitig sowohl Psychostimulanzien (z.B. Methylphenidat) als auch Paliperidon erhalten, ist Vorsicht geboten, da bei der Anpassung eines Arzneimittels oder beider Arzneimittel extrapyramidale Symptome auftreten könnten. Es sollte ein Ausschleichen einer der Behandlungen oder beider Behandlungen erwogen werden (siehe «Interaktionen»).
Hyperglykämie und Diabetes mellitus
Während der Behandlung mit Xeplion wurde über Hyperglykämie, Diabetes mellitus und Exazerbation eines vorbestehenden Diabetes berichtet. Die Beurteilung des Zusammenhanges zwischen der Anwendung atypischer Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Grundrisikos für Diabetes mellitus bei Schizophreniepatienten und die steigende Inzidenz von Diabetes mellitus in der Gesamtpopulation erschwert. Angesichts dieser Einflussfaktoren ist der Zusammenhang zwischen dem Einsatz atypischer Antipsychotika und unerwünschten Wirkungen, die mit Hyperglykämie zusammenhängen, nicht vollständig verstanden. Epidemiologische Studien deuten jedoch auf ein erhöhtes Risiko für das Auftreten Hyperglykämie-assoziierter Wirkungen bei Patienten unter einer Therapie mit atypischen Antipsychotika hin. Jeder Patient, der mit atypischen Antipsychotika, einschliesslich Xeplion, behandelt wird, sollte bezüglich Symptomen einer Hyperglykämie und eines Diabetes mellitus überwacht werden (siehe «Unerwünschte Wirkungen»).
Gewichtszunahme
Gewichtszunahme ist bei Einnahme von atypischen Antipsychotika beobachtet worden. Das Gewicht sollte regelmässig kontrolliert werden.
Orthostatische Hypotonie
Paliperidon kann aufgrund seiner α-blockierenden Aktivität bei manchen Patienten eine orthostatische Hypotonie induzieren. Die Anwendung von Xeplion sollte bei Patienten mit bekannten kardiovaskulären Erkrankungen (z.B. Herzinsuffizienz, Myokardinfarkt oder Ischämie, Erregungsleitungsstörungen), zerebrovaskulären Erkrankungen oder für Hypotonie prädisponierenden Zuständen (z.B. Dehydrierung, Hypovolämie und die Behandlung mit blutdrucksenkenden Arzneimitteln) vorsichtig erfolgen.
Hyperprolaktinämie
Wie andere Dopamin D2-Rezeptor Antagonisten erhöht Paliperidon den Prolaktinspiegel, was bei längerer Anwendung persistiert. Der Effekt auf den Prolaktinspiegel ist dem von Risperidon ähnlich und höher als bei anderen antipsychotisch wirksamen Arzneimitteln. Folgen einer Hyperprolaktinämie können Galaktorrhö, Amenorrhö, Gynäkomastie oder Impotenz sein. Eine chronische Hyperprolaktinämie kann eine Abnahme der Knochendichte zur Folge haben.
Prolaktin-abhängige Tumoren
Xeplion darf nicht angewendet werden bei gleichzeitigem Vorliegen von Prolaktin-abhängigen Tumoren, z.B. Prolaktinomen der Hypophyse oder möglicherweise Prolaktin-abhängigen Tumoren, z.B. epithelialen Mamma-Tumoren.
Epileptische Anfälle
Wie alle Antipsychotika sollte auch Xeplion bei Patienten mit anamnestisch bekannten epileptischen Anfällen oder anderen Zuständen, welche mit einer Senkung der Anfallsschwelle einhergehen können, vorsichtig angewendet werden.
Einschränkung der Nierenfunktion
Die Plasmakonzentrationen von Paliperidon sind bei Patienten mit einer Einschränkung der Nierenfunktion erhöht und daher kann bei manchen Patienten eine Dosisanpassung erforderlich sein. Bei Patienten mit mässiger oder schwerer Niereninsuffizienz (Kreatinin-Clearance <50 ml/Min) wird Xeplion nicht empfohlen (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
Einschränkung der Leberfunktion
Es liegen keine Daten zu Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh-Klasse C) vor. Wenn Paliperidonpalmitat in dieser Patientengruppe eingesetzt werden soll, ist Vorsicht geboten.
Ältere Patienten mit Demenz
Xeplion wurde bei älteren Patienten mit Demenz nicht untersucht. Die Anwendung bei älteren Patienten mit Demenz wird nicht empfohlen. In klinischen Studien mit anderen atypischen Antipsychotika wurde ein erhöhtes Risiko für Todesfälle und zerebovaskuläre Ereignisse berichtet (siehe unten «Zerebrovaskuläre Ereignisse» sowie «Dosierung/Anwendung» - «Ältere Patienten» und «Unerwünschte Wirkungen» - «Ältere Patienten»).
Die Erfahrungen mit Risperidon werden ebenfalls für Paliperidon (aktiver Hauptmetabolit von Risperidon) als gültig erachtet.
Erhöhte Gesamtmortalität
In einer Meta-Analyse von 17 kontrollierten klinischen Studien wiesen ältere Patienten mit Demenz, die mit anderen atypischen Antipsychotika, einschliesslich Risperidon, Aripiprazol, Olanzapin und Quetiapin, behandelt wurden, ein höheres Mortalitätsrisiko im Vergleich zur Placebogruppe auf. Bei den mit Risperidon Behandelten betrug die Mortalität 4%, verglichen mit 3,1% unter Placebo. Das mittlere Alter der verstorbenen Patienten betrug 86 Jahre (Altersspanne 67-100 Jahre). Aufgrund dieses beobachteten Klasseneffektes wurde Xeplion bei älteren Patienten mit Demenz nicht untersucht und darf in dieser Patientengruppe nicht angewendet werden (siehe «Dosierung/Anwendung» - «Ältere Patienten»).
Zerebrovaskuläre Ereignisse
Ein ca. 3fach erhöhtes Risiko zerebrovaskulärer Nebenwirkungen, teilweise mit letalem Ausgang, wurde in randomisierten placebokontrollierten klinischen Studien bei der Demenzpopulation mit einigen atypischen Antipsychotika, einschliesslich Risperidon, Aripiprazol und Olanzapin beobachtet. Xeplion soll bei älteren Patienten mit Demenz und Risikofaktoren für einen Schlaganfall nicht angewendet werden (siehe «Dosierung/Anwendung» - «Ältere Patienten»).
Leukopenie, Neutropenie und Agranulozytose
Fälle von Leukopenie, Neutropenie und Agranulozytose sind unter der Anwendung von Antipsychotika (einschliesslich Xeplion) in klinischen Studien und/oder seit Markteinführung berichtet worden. Agranulozytose wurde sehr selten (<1/10'000 Patienten) nach der Markteinführung beobachtet. Patienten mit einer klinisch signifikanten Verminderung der Anzahl weisser Blutkörperchen in der Anamnese oder mit einer Arzneimittel induzierten Leukopenie/Neutropenie sollten während der ersten Monate der Therapie überwacht werden und das Abrechen der Therapie mit Xeplion sollte beim ersten Anzeichen eines signifikanten Absinkens der weissen Blutkörperchen im Falle eines Fehlens anderer kausaler Faktoren erwogen werden.
Patienten mit klinisch signifikanter Neutropenie sollten sorgfältig hinsichtlich Fieber oder anderen Zeichen einer Infektion überwacht und sofort behandelt werden, wenn entsprechende Symptome auftreten. Bei Patienten mit ausgeprägter Neutropenie (absolute Neutrophilenzahl <1× 109/l) sollte die Therapie mit Xeplion abgebrochen und die weissen Blutkörperchen regelmässig überwacht werden.
Venöse Thromboembolie
Im Zusammenhang mit der Anwendung von Antipsychotika sind Fälle von venösen Thromboembolien (VTE) berichtet worden (siehe «Unerwünschte Wirkungen»). Da Patienten, die mit Antipsychotika behandelt werden, häufig erworbene Risikofaktoren für VTE aufweisen, sollten alle möglichen Risikofaktoren für VTE vor und während der Behandlung mit Xeplion identifiziert und Präventivmassnahmen ergriffen werden.
Parkinson-Krankheit und -Demenz mit Lewy-Körperchen(siehe «Kontraindikationen»)
Antipsychotika einschliesslich Xeplion sollten bei Patienten mit einer Parkinson-Krankheit oder Demenz mit Lewy-Körperchen (DLB) nur nach einer ärztlichen Abwägung des Nutzen-Risiko-Verhältnisses verordnet werden. Beide Patientengruppen können unter der Einnahme von Xeplion ein höheres Risiko für ein malignes neuroleptisches Syndrom und eine erhöhte Empfindlichkeit gegenüber Antipsychotika aufweisen. Eine solche erhöhte Empfindlichkeit kann sich zusätzlich zu extrapyramidalmotorischen Symptomen auch mit Verwirrtheit, affektiver Verflachung, verminderter Urteilsfähigkeit und Gleichgewichtsstörungen mit häufigen Stürzen manifestieren.
Suizidalität und Suizidversuch
Eine psychotische Erkrankung ist mit einem erhöhten Risiko für das Auftreten von Suizidalität/Suizidversuch(en) assoziiert. Eine engmaschige Überwachung von Patienten mit hohem Risiko muss deren medikamentöse Therapie begleiten.
Priapismus
Berichten zufolge können eine α-adrenerge Blockade bewirkende Arzneimittel Priapismus hervorrufen. Nach der Markteinführung von Paliperidon wurde über Fälle von Priapismus berichtet (siehe «Unerwünschte Wirkungen»). Die Patienten sollten über dieses Risiko informiert und darauf hingewiesen werden, im Falle einer verlängerten, schmerzhaften Erektion umgehend einen Facharzt aufsuchen.
Regulation der Körpertemperatur
Antipsychotika können die Fähigkeit des Körpers zur Senkung der Körperkerntemperatur beeinträchtigen. Vorsicht ist daher geboten, wenn Xeplion Patienten verordnet wird, die Situationen mit einem Anstieg der Körperkerntemperatur (z.B. anstrengende körperliche Aktivität, Exposition gegenüber extremer Wärme, gleichzeitige Anwendung von Arzneimitteln mit anticholinerger Wirkung oder Dehydrierung) ausgesetzt sind.
Antiemetische Wirkung
In präklinischen Versuchen mit Paliperidon wurde eine antiemetische Wirkung beobachtet. Falls diese Wirkung beim Menschen auftritt, könnte sie Zeichen einer Überdosierung bestimmter Substanzen oder von Erkrankungen wie intestinaler Obstruktion, Reye-Syndrom und Gehirntumor maskieren.
Anwendung
Eine versehentliche Injektion von Xeplion in ein Blutgefäss oder subkutan ist zu vermeiden.
Intraoperatives Floppy-Iris Syndrom
Bei Kataraktoperationen an Patienten unter Behandlung mit Arzneimitteln mit alpha1a-adrenerger antagonistischer Wirkung, wie Xeplion, wurden Fälle von intraoperativem Floppy-Iris-Syndrom (IFIS) beobachtet.
Das IFIS kann das Risiko für Komplikationen am Auge während und nach der Operation erhöhen. Vor der Operation sollte dem Ophthalmochirurgen eine aktuelle oder vorangegangene Anwendung von Arzneimitteln mit alpha1a-adrenerger antagonistischer Wirkung mitgeteilt werden. Der mögliche Nutzen des Absetzens der Therapie mit Alpha1-Antagonisten vor der Kataraktoperation wurde nicht untersucht und ist gegenüber dem Risiko einer Unterbrechung der antipsychotischen Therapie abzuwägen.
Bei Umstellung der Therapie auf eine andere Darreichungsform und/oder ein anderes Arzneimittel mit gleichem Wirkstoff ist Vorsicht geboten. Der Patient sollte adäquat kontrolliert werden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Fertigspritze, d.h. es ist nahezu «natriumfrei».
InteraktionenVorsicht ist geboten, wenn Xeplion zusammen mit Arzneimitteln verordnet wird, die bekanntermassen das QT-Intervall verlängern, wie z.B. Antiarrhythmika der Klassen IA (z.B. Chinidin, Disopyramid) und III (z.B. Amiodaron, Sotalol), einige Antihistaminika, einige andere Antipsychotika und einige Antimalaria-Wirkstoffe (z.B. Mefloquin).
Da Paliperidonpalmitat zu Paliperidon hydrolysiert wird (siehe «Pharmakokinetik»), sind zur Abschätzung des Wirkstoff-Wirkstoff-Wechselwirkungspotenzials die Ergebnisse aus Studien mit oralem Paliperidon zu berücksichtigen.
Andere Interaktionen
Gleichzeitige Anwendung von Xeplion mit Risperidon oder oralem Paliperidon
Oral oder intramuskulär verabreichtes Risperidon wird in unterschiedlichem Masse zu Paliperidon metabolisiert. Da Paliperidon der aktive Hauptmetabolit von Risperidon ist, kann es bei kombinierter Anwendung von Xeplion und Risperidon/Paliperidon zu erhöhten Expositionen kommen.
In Postmarketing-Studien wurden bei Anwendung von Xeplion und oralem Risperidon oder Paliperidon teilweise häufiger unerwünschte Arzneimittelwirkungen gegenüber der alleinigen Anwendung von Xeplion beobachtet. Insbesondere bei längerer kombinierter Anwendung ist daher Vorsicht geboten.
Die Datenlage zur Sicherheit der gleichzeitigen Anwendung von Xeplion und anderen Antipsychotika ist begrenzt.
Gleichzeitige Anwendung von Xeplion mit Psychostimulanzien
Die Anwendung von Psychostimulanzien (z.B. Methylphenidat) in Kombination mit Paliperidon kann bei Veränderung einer Behandlung oder beider Behandlungen zum Auftreten extrapyramidaler Symptome führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Wirkung von Xeplion auf andere Arzneimittel
Bei Paliperidon sind keine klinisch bedeutsamen pharmakokinetischen Wechselwirkungen mit Arzneimitteln, die durch Zytochrom-P450-Isoenzyme verstoffwechselt werden, zu erwarten. In-vitro-Untersuchungen mit humanen Lebermikrosomen haben gezeigt, dass Paliperidon die Metabolisierung von durch Zytochrom-P450-Isoenzyme verstoffwechselten Arzneimitteln bis Konzentrationen von 250 ng/ml nicht wesentlich hemmt (einschliesslich CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 und CYP3A5). Es wird daher nicht davon ausgegangen, dass Paliperidon die Clearance von über diese Stoffwechselwege metabolisierten Arzneimitteln in klinisch relevanter Weise inhibiert. Darüber hinaus besitzt Paliperidon vermutlich keine enzyminduzierenden Eigenschaften.
In-vitro-Studien haben gezeigt, dass Paliperidon ein Substrat des P-GP und ein schwacher Inhibitor des P-GP bei hohen Konzentrationen ist. In-vivo-Daten liegen nicht vor und die klinische Relevanz ist unbekannt.
Angesichts der primären ZNS-Wirkungen von Paliperidon (siehe «Unerwünschte Wirkungen») sollte eine kombinierte Anwendung von Xeplion mit anderen zentral wirksamen Arzneimitteln wie z.B. Anxiolytika, den meisten Antipsychotika, Hypnotika, Opiaten sowie Alkohol vorsichtig erfolgen. Paliperidon kann die Wirkung von Levodopa und anderen Dopamin-Agonisten vermindern. Wird eine solche Kombination als notwendig erachtet, so ist, insbesondere im Endstadium der Parkinson-Krankheit, die niedrigste wirksame Dosierung der jeweiligen Therapie zu verordnen.
Aufgrund seines Potentials eine orthostatische Hypotonie auszulösen (siehe «Warnhinweise und Vorsichtsmassnahmen») kann es zu additiven Effekten kommen, wenn Xeplion gemeinsam mit anderen Arzneimitteln kombiniert wird, die ebenfalls über dieses Potential verfügen wie z.B. mit anderen Antipsychotika, Trizyklika.
Vorsicht ist angeraten, wenn Paliperidon mit anderen Arzneimitteln kombiniert wird, von denen bekannt ist, dass sie die Anfallsschwelle herabsetzen (d.h. Phenothiazine oder Butyrophenone, Trizyklika oder SSRIs, Tramadol, Mefloquin usw.).
Die gleichzeitige Verabreichung von Paliperidon-Retardtabletten im «steady-state» (12 mg einmal täglich) und Natriumvalproat/Valproinsäure Retardtabletten (500 mg bis 2000 mg einmal täglich) hatte keine Wirkung auf die Steady-State-Pharmakokinetik von Valproat.
Es wurden keine Wechselwirkungsstudien zu Xeplion und Lithium durchgeführt. Pharmakokinetische Interaktion zwischen Xeplion und Lithium ist unwahrscheinlich.
Wirkung anderer Arzneimittel auf Xeplion
Paliperidon stellt kein Substrat von CYP1A2, CYP2A6, CYP2C9, CYP2C19 oder CYP3A5 dar. Daher dürften Wechselwirkungen mit Inhibitoren oder Induktoren dieser Isoenzyme unwahrscheinlich sein. In-vitro-Untersuchungen deuten darauf hin, dass CYP2D6 und CYP3A4 am Abbau von Paliperidon in geringem Umfang beteiligt sein könnten. Hingegen gibt es aus in vitro und in vivo Untersuchungen keine Hinweise darauf, dass diese Isoenzyme beim Abbau von Paliperidon eine signifikante Rolle spielen. In vitro-Studien haben gezeigt, dass es sich bei Paliperidon um ein P-Glykoprotein (P-gp)-Substrat handelt.
Paliperidon wird in begrenztem Umfang durch CYP2D6 metabolisiert (siehe «Pharmakokinetik» - «Metabolismus»). In einer Interaktionsstudie, in der gesunde Versuchspersonen orales Paliperidon und gleichzeitig Paroxetin, einen potenten CYP2D6-Inhibitor, erhielten, wurden keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Paliperidon beobachtet.
Die gleichzeitige Gabe von oralem Paliperidon mit retardierter Freisetzung einmal täglich und Carbamazepin 200 mg zweimal täglich führte zu einer Abnahme der mittleren Cmax sowie der AUC von Paliperidon im Steady State um etwa 37%. Diese Abnahme ist zu einem grossen Teil auf einen Anstieg der renalen Clearance von Paliperidon um 35% zurückzuführen, vermutlich infolge eines kombinierten Effektes der Induktion des renalen P-gp durch Carbamazepin sowie eines gering erhöhten Abbaus aufgrund einer CYP3A-Induktion zurückzuführen. Die geringe Abnahme der unverändert über den Urin ausgeschiedenen Wirkstoffmenge lässt vermuten, dass die gleichzeitige Verabreichung von Carbamazepin nur geringfügige Auswirkungen auf die CYP-Metabolisierung oder Bioverfügbarkeit von Paliperidon hat. Grössere Abnahmen der Paliperidon-Plasmakonzentrationen könnten bei höheren Dosen von Carbamazepin auftreten. Zu Beginn einer Behandlung mit Carbamazepin sollte die Dosierung von Xeplion überprüft und ggf. erhöht werden. Umgekehrt sollte beim Absetzen der Carbamazepin-Therapie die Dosierung von Xeplion überprüft und, sofern erforderlich, verringert werden.
Paliperidon, das bei physiologischem pH als Kation vorliegt, wird vorwiegend unverändert renal ausgeschieden, und zwar jeweils etwa zur Hälfte durch Filtration bzw. aktive Sekretion. Die gleichzeitige Anwendung von Trimethoprim, einer bekanntlich den aktiven renalen Kationentransport von Arzneimitteln hemmenden Substanz, blieb ohne Auswirkungen auf die Pharmakokinetik von Paliperidon.
Die gleichzeitige Gabe einer Einzeldosis einer Paliperidon-Retardtablette 12 mg und Natriumvalproat/Valproinsäure Retardtabletten (zwei Tabletten à 500 mg einmal täglich) führte zu einem Anstieg der Cmax- und AUC-Werte von Paliperidon um ca. 50%. Da keine Auswirkungen auf die systemische Clearance beobachtet wurden, ist keine klinisch relevante Wechselwirkung zwischen Natriumvalproat/Valproinsäure Retardtabletten und der intramuskulären Xeplion-Injektion zu erwarten. Diese Wechselwirkung wurde mit Xeplion bisher nicht untersucht.
Schwangerschaft, StillzeitSchwangerschaft
Die Sicherheit von intramuskulär injiziertem Paliperidonpalmitat oder oral dosiertem Paliperidon bei Anwendung während einer Schwangerschaft wurde nicht untersucht.
Eine retrospektive observative Kohortenstudie auf der Grundlage einer US-Datenbank mit abgerechneten Gesundheitsversorgungsleistungen verglich das Risiko angeborener Fehlbildungen bei Lebendgeburten zwischen Frauen mit und solchen ohne Anwendung von Antipsychotika im ersten Schwangerschaftstrimenon. In dieser Studie wurde keine konkrete Beurteilung von Paliperidon, dem aktiven Metaboliten von Risperidon, durchgeführt. Das Risiko angeborener Fehlbildungen bei Anwendung von Risperidon war nach Anpassung im Hinblick auf Störvariablen in der Datenbank gegenüber der Nichtanwendung von Antipsychotika erhöht (relatives Risiko = 1,26, 95%-KI: 1,02-1,56). Es wurde kein biologischer Mechanismus identifiziert, der diese Feststellung erklären konnte, und in präklinischen Studien wurden keine teratogenen Wirkungen beobachtet. Auf der Grundlage der Ergebnisse dieser observativen Einzelstudie wurde kein Kausalzusammenhang zwischen der Risperidonexposition in utero und den angeborenen Fehlbildungen erkannt.
Bei Neugeborenen, deren Mütter während des dritten Trimenons der Schwangerschaft Antipsychotika (einschliesslich Paliperidon) erhielten, besteht nach der Geburt das Risiko für extrapyramidal-motorische und/oder Entzugssymptome. Diese Symptome bei Neugeborenen können Agitation, ungewöhnlich erhöhten oder verminderten Muskeltonus, Tremor, Schläfrigkeit, Schwierigkeiten beim Atmen oder Probleme beim Füttern einschliessen. Diese Komplikationen können einen unterschiedlichen Schweregrad aufweisen. Bei einigen Fällen waren sie selbst limitierend, in anderen Fällen benötigten die Neugeborenen eine Überwachung auf der Intensivstation oder eine längere Hospitalisation.
Da Paliperidon nach Gabe einer Einzeldosis Xeplion bis zu 126 Tage lang im Plasma nachweisbar war, sollte die lange Wirksamkeit von Xeplion in die Überlegungen einbezogen werden. Eine maternale Exposition gegenüber Xeplion vor und während der Schwangerschaft kann unerwünschte Wirkungen beim Neugeborenen hervorrufen.
Teratogene Wirkungen wurden in tierexperimentellen Studien nicht festgestellt, es wurden jedoch andere Arten reproduktionstoxischer Effekte beobachtet. Bei Labortieren, denen eine hohe Paliperidon-Dosis oral verabreicht wurde, zeigte sich eine leichte Zunahme abgestorbener Feten (siehe «Präklinische Daten»).
Während der Schwangerschaft darf das Arzneimittel nicht verabreicht werden, es sei denn dies ist eindeutig erforderlich. Ist während der Schwangerschaft ein Absetzen der Behandlung erforderlich, so soll dies möglichst nicht abrupt geschehen. Der Einfluss von Xeplion auf die Wehentätigkeit und den Geburtsvorgang beim Menschen ist unbekannt.
Stillzeit
In tierexperimentellen Studien mit Paliperidon und Studien am Menschen mit Risperidon trat Paliperidon in die Milch über. Die von beiden Substanzen in der Muttermilch erreichten Konzentrationen waren mit denjenigen im Blutplasma vergleichbar. Xeplion soll während der Stillzeit nicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenXeplion kann sich auf Tätigkeiten, die geistige Aufmerksamkeit erfordern, auswirken und kann Auswirkungen auf den Visus haben (siehe «Unerwünschte Wirkungen»). Die Patienten sollten daher angehalten werden, auf das Steuern eines Fahrzeugs oder das Bedienen von Maschinen zu verzichten, bis ihre individuelle Reaktionsfähigkeit abgeklärt ist.
Unerwünschte WirkungenIm folgenden Abschnitt werden die unerwünschten Wirkungen dargestellt. Unerwünschte Wirkungen sind unerwünschte Ereignisse, bei denen auf Basis einer gründlichen Bewertung der vorliegenden Informationen über das unerwünschte Ereignis ein plausibler Zusammenhang mit der Anwendung von Paliperidonpalmitat angenommen wird. In einzelnen Fällen kann ein ursächlicher Zusammenhang mit Paliperidonpalmitat nicht zuverlässig festgestellt werden. Da zudem klinische Studien unter verschiedenartigen Bedingungen durchgeführt werden, kann die Häufigkeit unerwünschter Wirkungen, die in klinischen Studien mit einem Arzneimittel beobachtet wurden, nicht direkt mit der in klinischen Studien mit einem anderen Arzneimittel beobachteten Häufigkeit verglichen werden und entspricht nicht unbedingt der in der klinischen Praxis beobachteten Auftretenshäufigkeit.
Paliperidonpalmitat wird zu Paliperidon hydrolysiert. Paliperidon ist der aktive Metabolit von Risperidon. Daher sind die Nebenwirkungsprofile beider Substanzen (ihre oralen und injizierbaren Formulierungen einschliessend) von gegenseitiger Relevanz.
Zusammenfassung des Sicherheitsprofiles
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen) wurde bei 7'565 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht.
Die Sicherheit von Paliperidon Retardtabletten wurde bei 2'159 Patienten mit Schizophrenie, schizoaffektiver Störung und Bipolar-I-Störung in klinischen Studien untersucht.
Die Sicherheit von Risperidon (alle Formulierungen) wurde in klinischen Studien bei 12'195 Patienten mit Schizophrenie, schizoaffektiver Störung, bipolarer Störung, autistischer Störung, Verhaltensstörungen bei Patienten mit leichter bis mittelschwerer geistiger Behinderung, Demenz, Störungen des Sozialverhaltens, Alzheimer-Demenz, Alzheimer-Krankheit mit Psychose oder chronischen Psychosen untersucht.
Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%), die im Rahmen von klinischen Studien in Paliperdionpalmitat Depot-Injektionssuspension-behandelten Patienten beobachtet wurden waren: Schlaflosigkeit (12.0%), Reaktion an der Injektionsstelle (9.6%), Gewichtszunahme (9.6%), Infektionen der oberen Atemwege (9.4%), Kopfschmerzen (8.8%), Angst (7.4%), Akathisie (6.7%) und Parkinsonismus (6.1%).
Im Folgenden werden sämtliche unerwünschten Wirkungen aufgeführt, die mit Paliperidon und/oder Risperidon aufgetreten sind. Sie sind nach Häufigkeitsgruppen geordnet, wobei sich die Angaben zur Häufigkeiten ausschliesslich auf klinischen Studien mit Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen) beziehen. Nebenwirkungen, die nicht in klinischen Studien, sondern nach der Marktzulassung für Paliperidonpalmitat berichtet wurden, sind unter der Häufigkeitskategorie nicht bekannt aufgeführt. Dasselbe gilt für alle unerwünschten Wirkungen, die in klinischen Studien oder nach der Marktzulassung für Risperidon (alle Darreichungsformen) oder orales Paliperidon beobachtet wurden.
Es werden die folgenden Häufigkeitskategorien verwendet: «Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000) und «nicht bekannt» (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen
Häufig: Infektionen der oberen Atemwege, Harnwegsinfektion, Influenza.
Gelegentlich: Pneumonie, Bronchitis, Infektion der Atemwege, Sinusitis, Zystitis, Infektion des Ohres, Augeninfektion, Tonsillitis, Onychomykose, Cellulitis, Akrodermatitis, subkutaner Abszess.
Erkrankungen des Blut- und Lymphsystems
Gelegentlich: Abnahme der Anzahl weisser Blutkörperchen, Anämie, Neutropenie, Thrombozytopenie, Zunahme der Anzahl eosinophiler Granulozyten.
Nicht bekannta: Agranulozytose, Abnahme des Hämatokrits.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen.
Nicht bekannta: Anaphylaktische Reaktion.
Endokrine Erkrankungen
Häufig: Hyperprolaktinämieb.
Selten: inadäquate Sekretion des antidiuretischen Hormons, Glukose im Urin.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperglykämie, Gewichtszunahme, Gewichtsabnahme, verminderter Appetit, Anstieg der Triglyzeride.
Gelegentlich: Diabetes mellitusd, Hyperinsulinämie, gesteigerter Appetit, Anorexie, Anstieg des Blutcholesterinspiegels, Polydipsie.
Selten: diabetische Ketoazidose, Hypoglykämie.
Nicht bekannta: Wasser-Intoxikation
Psychiatrische Erkrankungen
Sehr häufig: Schlaflosigkeite.
Häufig: Agitation, Depression, Angst.
Gelegentlich: Schlafstörung, Manie, verminderte Libido, Verwirrtheit, Nervosität, Albträume, Anorgasmie
Selten: Katatonie, Somnambulismus, abgestumpfter Affekt
Nicht bekannta: Schlafbezogene Essstörung (unkontrollierte Essenseinnahme beim Schlafwandeln).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen
Häufig: Parkinsonismusc, Akathisiec, Somnolenz, Dystoniec, Schwindel, Dyskinesiec, Tremor.
Gelegentlich: Tardive Dyskinesie, Konvulsionene, Synkope, psychomotorische Hyperaktivität, posturaler Schwindel, Störung der Aufmerksamkeit, Dysarthrie, Dysgeusie, Hypästhesie, Parästhesie, zerebrovaskuläre Ischämie.
Selten: Malignes neuroleptisches Syndrom, fehlende Stimulusresponse, Bewusstseinsverlust, Verminderung des Bewusstseinsgrades, Gleichgewichtsstörung, Koordinationsstörung, Kopfzittern.
Nicht bekannta: Diabetisches Koma.
Augenerkrankungen
Gelegentlich: verschwommenes Sehen, Konjunktivitis, trockenes Auge.
Selten: Glaukom, Störung der Augenbewegung, Augenrollen, Photophobie, verstärkte Tränensekretion, okuläre Hyperämie.
Nicht bekannta: Floppy-Iris Syndrom (intraoperativ).
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Vertigo, Tinnitus, Ohrenschmerz.
Herzerkrankungen
Häufig: Bradykardie, Tachykardie.
Gelegentlich: Atrioventrikulärer Block, Erregungsleitungsstörung, Vorhofflimmern, verlängertes QT-Intervall im Elektrokardiogramm, posturales tachykardes Syndrom, abnormes Elektrokardiogramm, Palpitationen.
Selten: Sinusarrhythmien.
Gefässerkrankungen
Häufig: Hypertension.
Gelegentlich: Hypotonie, orthostatische Hypotonie, tiefe Venenthrombose
Selten: Lungenembolie, Flush.
Nicht bekannta: Ischämie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten, verstopfte Nase.
Gelegentlich: Dyspnoe, Lungenstauung, Keuchen, pharyngolaryngealer Schmerz, Epistaxis, Stauung der Atemwege,
Selten: Schlaf-Apnoe-Syndrom, Lungenrasseln.
Nicht bekannta: Hyperventilation, Aspirationspneumonie, Dysphonie.
Erkrankungen des Gastrointestinaltrakts
Häufig: abdominelle Schmerzen, Erbrechen, Übelkeit, Obstipation, Diarrhö, Dyspepsie, Zahnschmerzen.
Gelegentlich: abdominelle Beschwerden, Gastroenteritis, Dysphagie, Mundtrockenheit, Flatulenz, geschwollene Zunge
Selten: Pankreatitis, intestinale Obstruktion, Stuhlinkontinenz, Fäkulom, Cheilitis.
Nicht bekannta: Ileus.
Leber- und Gallenerkrankungen
Häufig: erhöhte Transaminasen.
Gelegentlich: erhöhte Gamma-Glutamyl-Transferase-Werte, Leberenzymwerte erhöht.
Nicht bekannta: Ikterus.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Gelegentlich: Urtikaria, Pruritus, Alopezie, Ekzem, trockene Haut, Erythem, Akne.
Selten: Arzneimittelexanthem, Hyperkeratose, seborrhoische Dermatitis, Schuppen.
Nicht bekannta: Stevens-Johnson-Syndrom/Toxische epidermale Nekrolyse, Angioödem, Hautverfärbung.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: muskuloskelettale Schmerzen, Rückenschmerzen, Arthralgie.
Gelegentlich: erhöhter Kreatinphosphokinase-Wert, Muskelkrämpfe, Steifheit der Gelenke, Muskelschwäche, Anschwellen der Gelenke.
Selten: Rhabdomyolyse.
Nicht bekannta: Anomale Haltung, Nackenschmerzen.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Harninkontinenz, Pollakisurie, Dysurie.
Selten: Harnretention.
Schwangerschafts-, Wochenbett- und perinatale Erkrankungen
Sehr selten: Extrapyramidalmotorische Symptome und/oder Entzugserscheinungen beim Neugeborenen (s. «Schwangerschaft, Stillzeit»).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Amenorrhö, Galaktorrhoe, Menstruationsstörunge
Gelegentlich: erektile Dysfunktion, Ejakulationsstörung, Gynäkomastie, sexuelle Dysfunktion, Brustbeschwerden, Brustschmerzen, vaginaler Ausfluss, Brustvergrösserung.
Selten: Priapismus, Brustdrüsenschwellung, Stauungserscheinungen der Brust.
Nicht bekannta: Verspätete Menstruation.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Pyrexie, Asthenie, Fatigue, Reaktionen an der Injektionsstelle.
Gelegentlich: Gesichtsödem, Ödeme, anormaler Gang, erhöhte Körpertemperatur, Schmerzen im Brustkorb, Beschwerden im Brustkorb, Unwohlsein, Induration, Schüttelfrost.
Selten: Hypothermie, Durst, Arzneimittelentzugssyndrom, Abszess an der Injektionsstelle, Cellulitis an der Injektionsstelle, Zyste an der Injektionsstelle, Hämatom an der Injektionsstelle.
Nicht bekannta: Verminderte Körpertemperatur, Nekrose an der Injektionsstelle, Ulkus an der Injektionsstelle.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: Sturz.
a Die Häufigkeit der Nebenwirkungen ist als „nicht bekannt” eingestuft, da sie nicht in klinischen Studien mit Paliperidonpalmitat beobachtet wurden. Sie stammen aus spontanen Berichten nach Markteinführung und die Häufigkeit kann nicht ermittelt werden oder aus klinischen Studien und/oder Berichten nach Markteinführung mit Risperidon (alle Darreichungsformen) oder mit oralem Paliperidon.
b Eine Hyperprolaktinämie kann in einigen Fällen zu Gynäkomastie, Menstruationsstörungen, Amenrorrhoe und Galaktorrhoe führen. Siehe «Hyperprolaktinämie» unten.
c Siehe «Extrapyramidale Symptome» unten.
d In Placebo-kontrollierten Studien wurde Diabetes mellitus bei 0,32% der mit Xeplion behandelten Patienten berichtet, im Vergleich lag die Rate in der Placebo-Gruppe bei 0,39%. Die Gesamtinzidenz aus allen klinischen Studien betrug 0,65% bei allen mit Xeplion behandelten Patienten.
e Schlaflosigkeit beinhaltet: initiale Schlafstörung, Durchschlafstörungen; Konvulsionen beinhaltet: Grand-mal-Anfälle; Ödeme beinhaltet: generalisierte Ödeme, periphere Ödeme, Ödeme mit eindrückbaren Dellen («pitting edema»); Menstruationsstörungen beinhaltet: unregelmässige Menstruation, Oligomenorrhoe.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Paliperidonpalmitat Depot-Injektionssuspension 1-Monatsspritze
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze) wurde bei 4'484 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht. Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%) waren: Schlaflosigkeit (14.4%), Kopfschmerzen (9.9%), Infektion der oberen Atemwege (7.3%), Angstzustände (7.0%), Reaktionen an der Injektionsstelle (7.0%), Gewichtszunahme (6.4%), Parkinsonismus (6.2%) und Akathisie (6.5%).
Die folgenden unerwünschten Wirkungen wurden für Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze) häufiger gemeldet als in den gepoolten Sicherheitsdaten für die 1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen), wie sie in der obigen Liste der unerwünschten Wirkungen beschrieben werden:
Häufig: Mundtrockenheit, Pruritus.
Gelegentlich: Gleichgewichtsstörung, okuläre Hyperämie, Sinusarrhythmien, Stuhlinkontinenz.
Paliperidonpalmitat Depot-Injektionssuspension 3-Monatsspritze
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (3-Monatsspritze) wurde bei 1'191 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht. Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%) waren: Gewichtszunahme(13.5%), Infektion der oberen Atemwege (10.7%), Angstzustände (7.6%), Kopfschmerzen (6.7%), Schlaflosigkeit (6.0%) und Reaktionen an der Injektionsstelle (5.3%).
Die folgenden unerwünschten Wirkungen wurden für Paliperidonpalmitat Depot-Injektionssuspension (3-Monatsspritze) häufiger gemeldet als in den gepoolten Sicherheitsdaten für die 1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen), wie sie in der obigen Liste der unerwünschten Wirkungen beschrieben werden:
Sehr häufig: Infektionen der oberen Atemwege, Gewichtszunahme
Häufig: pharyngolaryngealer Schmerz
Gelegentlich: Glukose im Urin, diabetische Ketoazidose, verstärkte Tränensekretion, Cheilitis
Paliperidonpalmitat Depot-Injektionssuspension 6-Monatsspritze (in der Schweiz nicht zugelassen)
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (6-Monatsspritze, in der Schweiz nicht zugelassen) wurde bei 478 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht. Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%) waren: Infektionen der oberen Atemwege (11.5%), Reaktionen an der Injektionsstelle (10.7%), Gewichtszunahme (9.0%), Kopfschmerzen (6.7%) und Parkinsonismus (5.0%).
Die folgenden unerwünschten Wirkungen wurden für Paliperidonpalmitat Depot-Injektionssuspension (6-Monatsspritze, in der Schweiz nicht zugelassen) häufiger gemeldet als in den gepoolten Sicherheitsdaten für die 1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze, wie sie in der obigen Liste der unerwünschten Wirkungen beschrieben werden:
Sehr häufig: URTI, Reaktionen an der Injektionsstelle
Häufig: Anämie, Diabetes mellitus, Gastroenteritis, erhöhter Kreatinphosphokinase-Wert
Gelegentlich: Kopfzittern, intestinale Obstruktion, seborrhoische Dermatitis, Priapismus
Klasseneffekte
QT-Verlängerungen, ventrikuläre Arrhythmien (ventrikuläres Flimmern, ventrikuläre Tachykardien), plötzliche und unerwartete Todesfälle, Herzstillstand und Torsades de pointes können unter der Behandlung mit Antipsychotika auftreten. Es wurden Fälle von venöser Thromboembolie, einschliesslich Fälle von Lungenembolie und tiefer Beinvenenthrombose unter der Behandlung mit Antipsychotika berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Extrapyramidalmotorische Symptome (EPS)
Die kombinierten Daten aus zwei 13-wöchigen doppelblinden placebokontrollierten Schizophreniestudien mit fixer Dosierung (siehe «Eigenschaften/Wirkungen» - «Wirkungsmechanismus / Pharmakodynamik », R092670-PSY3003, R092670-PSY3004) zeigten hinsichtlich behandlungsbedingter EPS keine Unterschiede zwischen Placebo und Xeplion. Die Evaluierung der EPS umfasste eine kombinierte Analyse folgender EPS-Gruppen: Dyskinesie (Dyskinesie, Choreoathetose, Chorea, Athetose und Myoklonien), Dystonie (einschliesslich Dystonie, Muskelhypertonus, zervikale Spasmen, Torticollis, unwillkürliche Muskelkontraktionen, Tetanie, Blepharospasmus, Okulogyration, Zungenparalyse, Gesichtsspasmus, Laryngospasmus, Myotonie, Opisthotonus, oropharyngealer Spasmus, Pleurothotonus, Zungenspasmus, Risus sardonicus und Trismus), Parkinsonismus (einschliesslich Speichenfluss, muskuloskelettale Steifheit, Parkinsonismus, vermehrter Speichelfluss, Zahnradphänomen, Bradykinese, Hypokinesie, Maskengesicht, Muskelverspannung, Akinese, Steifheit der Nackenmuskulatur, Muskelsteifheit, parkinsonähnlicher Gang, anomaler Glabellareflex und parkinsonähnlicher Ruhetremor), Akathisie (einschliesslich Akathisie, Ruhelosigkeit, Hyperkinesie und Restless-Legs-Syndrom) und Tremor. Die Ergebnisse aller Phasen der Studie zur Langzeitprävention von Rezidiven ergaben vergleichbare Befunde.
In einer 9-wöchigen doppelblinden placebokontrollierten Studie (R092670-SCH-201) war die Inzidenz an Parkinsonismus und Akathisie unter Xeplion 100 mg (18% bzw. 11%) höher als unter Xeplion 50 mg (9% bzw. 5%) und Placebo (7% bzw. 4%).
In der 13-wöchigen Studie mit einer Anfangsdosis von 150 mg (R092670-PSY-3007) war die Inzidenz behandlungsbedürftiger EPS mit der Placebogruppe (8%) vergleichbar, allerdings mit einer dosisabhängigen Korrelation von 6% (150/25 mg), 10% (150/100 mg) und 11% (150/150 mg).
Dystonie
Klasseneffekt: Symptome einer Dystonie, verlängerte abnorme Kontraktion von Muskelgruppen, können bei hierfür empfänglichen Patienten während der ersten Behandlungstage und bei höheren Dosierungen antipsychotischer Arzneimittel auftreten. Insbesondere bei Männern und jüngeren Patienten wird ein erhöhtes Risiko für eine akute Dystonie beobachtet.
Gewichtszunahme
In der 13-wöchigen Studie mit einer Anfangsdosis von 150 mg war der Anteil der Patienten, die ein Gewichtszunahme-Kriterium von ≥7% des Körpergewichts im Vergleich zum Wert zu Studienbeginn erfüllten, unter den Patienten in den Xeplion-Gruppen grösser als in der Placebogruppe. Der Anteil der Patienten mit einer auffälligen Gewichtserhöhung ≥7% zeigte einen dosisabhängigen Trend. So wurde in der Placebogruppe eine Inzidenzrate von 5% ermittelt, gegenüber einer Inzidenzrate von 6%, 8% bzw. 13% in den Gruppen, die 25 mg, 100 mg bzw. 150 mg Xeplion erhielten.
In den beiden 13-wöchigen doppelblinden placebokontrollierten Studien mit fixer Dosierung (kombinierte Daten) betrugen die Anteile der Patienten, die ein Gewichtszunahme-Kriterium von ≥7% des Körpergewichts erfüllten, 6%, 9% bzw. 10% in den mit 25, 50 bzw. 100 mg Xeplion behandelten Gruppen gegenüber einem Anteil von 2% in der Placebogruppe. In der 9-wöchigen doppelblinden placebokontrollierten Studien mit fixer Dosierung erfüllten 8% bzw. 6% der mit 50 bzw. 100 mg Xeplion behandelten Patienten dieses Kriterium und 4% in der Placebogruppe.
Während der 33-wöchigen offenen Übergangs-/Erhaltungsphase der Studie zur Langzeitprävention von Rezidiven erfüllten 12% der mit Xeplion behandelten Patienten dieses Kriterium (Gewichtszunahme von ≥7% von der doppelblinden Phase bis zum Endpunkt); die mittlere Gewichtsveränderung (Standardabweichung) im Vergleich zum Beginn der offenen Phase betrug +0,7 (4,79) kg. In der unterschiedlich langen Doppelblindphase wurde dieses Kriterium von 6% der mit Xeplion behandelten Patienten erfüllt (mittlere Dauer 171 Tage [1 bis 407 Tage]), in der Placebogruppe dagegen von 3% (mittlere Dauer 105 Tage [8 bis 441 Tage]); die mittlere Gewichtsveränderung (Standardabweichung) im Vergleich zum Beginn der Doppelblindphase betrug +0,5 (3,83) kg bei Behandlung mit Xeplion im Vergleich zu –1,0 (3,08) kg bei Placebogabe. In der offenen Verlängerungsphase dieser Studie wurden ähnliche Ergebnisse erzielt.
Hyperprolaktinämie
Eine Hyperprolaktinämie kann in einigen Fällen zu Gynäkomastie, Menstruationsstörungen, Amenrorrhoe und Galaktorrhoe führen.
Die kombinierten Daten aus den beiden 13-wöchigen doppelblinden placebokontrollierten Studien mit fixer Dosierung (siehe «Eigenschaften/Wirkungen» - «Pharmakodynamik») ergaben einen mittleren Anstieg des Serumprolaktins bei Patienten beiderlei Geschlechts nach Erhalt von Xeplion (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Ergebnisse aus der 13-wöchigen Studie mit einer Anfangsdosis von 150 mg, der 9-wöchigen doppelblinden placebokontrollierten Studie mit fixer Dosierung und der Doppelblindphase der Studie zur Langzeitprävention von Rezidiven ergaben vergleichbare Befunde.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungZur Überdosierung liegen nur Erfahrungen mit der oralen Form vor.
Anzeichen und Symptome
Im Allgemeinen resultieren die zu erwartenden klinischen Merkmale einer Überdosierung aus einer Verstärkung der bekannten pharmakologischen Wirkungen von Paliperidon (d.h. Benommenheit und Sedierung, Tachykardie und Hypotonie, QT-Verlängerung sowie extrapyramidale Symptome). Torsade de pointes und Kammerflimmern wurden im Zusammenhang mit einer Überdosierung von oralem Paliperidon berichtet. Im Fall einer akuten Überdosierung sollte an die Möglichkeit einer Intoxikation mit mehreren Arzneimitteln gedacht werden.
Behandlung
Bei der Beurteilung des Behandlungsbedarfs und der Wiederherstellung sollte berücksichtigt werden, dass es sich um eine Formulierung mit retardierter Freisetzung handelt und dass Paliperidon eine lange Halbwertszeit hat. Ein spezifisches Antidot existiert nicht. Es sollten allgemeine unterstützende Massnahmen durchgeführt werden. Die Atemwege sind freizumachen und freizuhalten, eine ausreichende Oxygenierung und Beatmung sind sicherzustellen. Ein Monitoring der Herzkreislauffunktion einschliesslich einer kontinuierlichen EKG-Überwachung im Hinblick auf etwaige Arrhythmien ist unverzüglich einzuleiten. Hypotonie und Herz-Kreislauf-Versagen sind mit geeigneten Massnahmen wie intravenöser Flüssigkeitsgabe und/oder Gabe von Sympathomimetika zu behandeln. Bei schweren extrapyramidalmotorischen Symptomen sollten Anticholinergika zum Einsatz kommen. Die engmaschige Überwachung sollte so lange fortgeführt werden, bis sich der Patient erholt hat.
Eigenschaften/WirkungenATC-Code
N05AX13
Xeplion enthält eine razemische Mischung aus (+)- und (–)-Paliperidon.
Wirkungsmechanismus / Pharmakodynamik
Paliperidone, der Wirkstoff in Xeplion, ist ein psychotroper Wirkstoff, der zur chemischen Klasse der Benzisoxazolderivate gehört (atypisches Antipsychotikum).
Paliperidonpalmitat wird zu Paliperidon hydrolysiert (siehe «Präklinische Daten»). Bei Paliperidon handelt es sich um einen zentral wirkenden Dopamin-D2-Antagonisten mit einer ausgeprägten antagonistischen Aktivität am serotonergen 5HT2A-Rezeptor. Paliperidon besitzt ausserdem antagonistische Wirkungen auf α1- und α2-adrenerge Rezeptoren sowie auf H1-histaminerge Rezeptoren. Die Substanz besitzt keine Affinität zu cholinergen Muskarin- oder β1- und β2-adrenergen Rezeptoren. Die pharmakologische Aktivität der (+)- und (–)-Enantiomere von Paliperidon ist qualitativ und quantitativ vergleichbar.
Der Wirkmechanismus von Paliperidon ist wie auch bei anderen in der Schizophreniebehandlung wirksamen Arzneimitteln unbekannt. Es wurde jedoch postuliert, dass die therapeutische Wirkung des Arzneimittels bei Schizophrenie über eine Kombination des Dopamin-Typ-2-(D2-) und Serotonin-Typ-2-(5HT2A-)Rezeptor-Antagonismus vermittelt sein könnte. Für manche der sonstigen Wirkungen von Paliperidon könnten antagonistische Effekte auf andere Rezeptoren als D2 und 5HT2A verantwortlich sein.
Klinische Wirksamkeit
Die Wirksamkeit von Xeplion bei der akuten Behandlung von Schizophrenie wurde in vier kurzzeitigen (eine über 9 Wochen und drei über 13 Wochen) doppelblinden, randomisierten, placebokontrollierten Studien mit fixer Dosierung bei stationär behandelten erwachsenen Patienten mit akutem Rezidiv nachgewiesen, welche die DSM-IV-Kriterien für Schizophrenie erfüllten. Die in diesen Studien angewendete fixe Dosierung von Xeplion wurde in der 9-wöchigen Studie am Tag 1, 8 und 36 und zusätzlich in den 13-wöchigen Studien am Tag 64 verabreicht, d.h. die ersten beiden Dosen im Abstand von einer Woche und anschliessend alle 4 Wochen zur Erhaltung.
Die Abschätzung der Wirksamkeit erfolgte mithilfe der PANS-Skala (Positive and Negative Syndrome Scale), einem validierten Multi-Item-Inventar, das aus fünf Faktoren zusammengesetzt ist und zur Abschätzung positiver Symptome, negativer Symptome, desorganisierter Gedanken, unkontrollierter Feindseligkeit/Erregung und von Angststörungen/Depression herangezogen wird. Die Funktionsfähigkeit wurde auf der PSP-Skala (Personal and Social Performance-Skala) untersucht. Bei der PSP handelt es sich um eine validierte Skala zur Bewertung der persönlichen und sozialen Funktionsfähigkeit in den Bereichen sozial nützlicher Aktivitäten durch den Arzt. In einer 13-wöchigen Studie (R092670-PSY-3007) (n= 636), in der drei fixe Dosierungen von Xeplion (Injektion der Anfangsdosis von 150 mg in den Deltamuskel, gefolgt von 3 Dosen zu 25 mg/4 Wochen, 100 mg/4 Wochen oder 150 mg/4 Wochen in den Delta- oder Glutealmuskel) mit einem Placebo verglichen wurden, waren alle drei Dosierungen von Xeplion hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen. In dieser Studie zeigten die Behandlungsgruppen, die 100 mg/4 Wochen und 150 mg/4 Wochen erhielten, aber nicht die Gruppe, die 25 mg/4 Wochen erhielt, hinsichtlich des PSP-Wertes statistische Überlegenheit gegenüber dem Placebo.
In einer anderen 13-wöchigen Studie (R092670-PSY-3003) (n= 349), in der drei fixe Dosierungen von Xeplion (50 mg/4 Wochen, 100 mg/4 Wochen und 150 mg/4 Wochen) mit einem Placebo verglichen wurden, war nur die Dosis zu 100 mg Xeplion alle 4 Wochen hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen. In dieser Studie waren die Behandlungsgruppen, die 50 mg/4 Wochen und 100 mg/4 Wochen erhielten, wären hinsichtlich der Verbesserung des PSP-Wertes gegenüber dem Placebo überlegen. In dieser Studie gab es zwar auch eine Gruppe, die eine Dosis zu 150 mg erhielt, aber die Anzahl der Patienten unter dieser Dosierung war zu klein, um definitive Schlussfolgerungen zur Wirksamkeit dieser Dosis ziehen zu können.
In einer dritten 13-wöchigen Studie (R092670-PSY-3004) (n= 513), in der drei fixe Dosierungen von Xeplion (25 mg/4 Wochen, 50 mg/4 Wochen und 100 mg/4 Wochen) mit einem Placebo verglichen wurden, waren alle drei Dosen von Xeplion hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen. In dieser Studie erzielte keine der Paliperidon-Dosisgruppen hinsichtlich der Verbesserung des PSP-Wertes im Placebovergleich statistische Signifikanz.
In der 9-wöchigen Studie (R092670-PSY-201) (n= 197), in der zwei fixe Dosierungen von Xeplion (50 mg/4 Wochen und 100 mg/4 Wochen) mit einem Placebo verglichen wurden, waren beide Dosen von Xeplion hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen.
Die Wirksamkeit von Xeplion hinsichtlich der Erhaltung der Kontrolle der Schizophreniesymptome und Verzögerung des Auftretens schizophrener Rezidive wurde in einer länger laufenden doppelblinden placebokontrollierten Studie mit flexibler Dosierung mit 849 Probanden im jungen und mittleren Erwachsenenalter, welche die DSM-IV-Kriterien für Schizophrenie erfüllten, nachgewiesen. Diese Studie (R092670-PSY-3001) bestand aus einer offenen Akutbehandlungs- (9 Wochen) und Stabilisierungsphase (24 Wochen) und aus einer randomisierten placebokontrollierten Phase zur Beobachtung auf Rezidive sowie einer 52-wöchigen offenen Anschlussbeobachtungsphase. In dieser Studie wurden monatlich Xeplion-Dosen von 25, 50, 75 und 100 mg verabreicht, wobei die Dosis von 75 mg nur während der 52-wöchigen offenen Erweiterung zugelassen war. Die Probanden erhielten anfangs während einer 9-wöchigen Übergangsphase flexible Dosen (25 bis 100 mg) Xeplion, gefolgt von einem 24-wöchigen Erhaltungszeitraum, wobei die Probanden einen PANSS-Wert ≤75 aufweisen mussten, um in diesen eintreten zu können. Eine Anpassung der Dosis war nur in den ersten zwölf Wochen des Erhaltungszeitraums zulässig. Im Verlauf der unterschiedlich langen Doppelblindphase wurden die Patienten randomisiert und erhielten entweder die gleiche Dosis Xeplion (mittlere Dauer: 171 Tage [1 Tag–407 Tage]), die sie auch während der Stabilisierungsphase alle 4 Wochen erhalten hatten, oder ein Placebo (mittlere Dauer: 105 Tage [8 Tage–441 Tage]). Insgesamt wurden 410 stabilisierte Patienten nach Randomisierung in den Xeplion-Gruppen oder in der Placebogruppe behandelt, bis bei ihnen ein Rezidiv der Schizophreniesymptome eintrat. Ein Rezidiv war definiert als Zeitraum bis zum ersten Auftreten mindestens eines der folgenden Symptome bzw. Ereignisse: stationäre Aufnahme in die Psychiatrie, Anstieg um ≥25% (bei einem Ausgangswert >40) bzw. um 10 Punkte (bei einem Ausgangswert ≤40) des PANSS-Gesamtwertes bei zwei aufeinanderfolgenden Bewertungen, absichtliche Selbstverletzung, gewalttätiges Verhalten, Selbsttötungs-/Tötungsabsicht oder ein Wert von ≥5 (bei einem maximalen Ausgangswert von ≤3) oder ≥6 (bei einem maximalen Ausgangswert von 4) bei zwei aufeinanderfolgenden Bewertungen der PANSS-Einzelitems P1 (Wahnvorstellungen), P2 (verwirrtes Denken), P3 (halluzinatorisches Verhalten), P6 (Misstrauen/Verfolgungswahn), P7 (Feindseligkeit) oder G8 (Unkooperativität). Die primäre Wirksamkeitsvariable war der Zeitraum bis zum Rezidiv. Einer im Voraus geplanten Zwischenanalyse (nach Auftreten von 68 Rezidivereignissen) zufolge, war der Zeitraum bis zum Auftreten eines Rezidivs bei mit Xeplion behandelten Patienten signifikant länger als bei den Patienten in der Placebogruppe (siehe Abbildung 1), und die Studie wurde vorzeitig beendet, weil die Beibehaltung der Wirksamkeit nachgewiesen worden war.
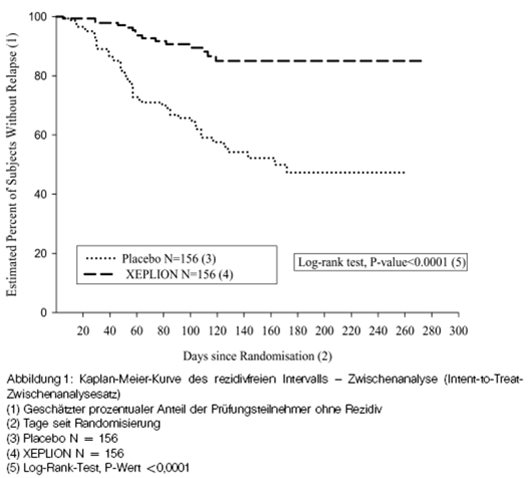
Das Analysenresultat basierend auf den finalen Daten, einschliesslich aller Daten bis zum Studienabschluss, war im Einklang mit dem der primären Wirksamkeitsanalyse basierend auf den Interimdaten.
Eine Untersuchung von Patientensubgruppen ergab keine klinisch signifikanten Unterschiede hinsichtlich des Ansprechens aufgrund von Geschlecht, Alter oder ethnischer Zugehörigkeit.
PharmakokinetikAbsorption
Aufgrund seiner extrem schwachen Wasserlöslichkeit löst sich Paliperidonpalmitat nach intramuskulärer Injektion langsam auf, bevor es zu Paliperidon hydrolysiert und in den Blutkreislauf absorbiert wird. Nach Applikation einer intramuskulären Einzeldosis steigt die Plasmakonzentration von Paliperidon stetig an, bis nach einer mittleren tmax von 13 Tagen eine maximale Plasmakonzentration erreicht ist. Die Freisetzung des Wirkstoffs beginnt bereits am Tag 1 und dauert bis zu 126 Tage.
Nach intramuskulärer Injektion von Einzeldosen (25–150 mg) in den Deltamuskel war die Cmax im Durchschnitt 28% höher als nach Injektion in den Glutealmuskel. Die beiden Anfangsinjektionen von 150 mg am Tag 1 und von 100 mg am Tag 8 in den Deltamuskel tragen dazu bei, rasch eine therapeutische Konzentration zu erreichen. Das Freisetzungsprofil und der Dosierungsplan von Xeplion bewirken anhaltende therapeutische Konzentrationen. Die Gesamtexposition gegenüber Paliperidon nach der Verabreichung von Xeplion war im Dosisbereich von 25–150 mg dosisproportional und bei Dosen über 50 mg hinsichtlich der Cmax weniger als dosisproportional. Das mittlere Spitzen:Tal-Verhältnis im Steady-State bei einer Xeplion-Dosis von 100 mg betrug 1,8 nach Applikation in den Glutealmuskel und 2,2 nach Applikation in den Deltamuskel. Die mittlere Halbwertszeit von Paliperidon nach Applikation von Xeplion im Dosisbereich von 25–150 mg lag bei 25 bis 49 Tagen.
Nach Anwendung von Paliperidonpalmitat kommt es zu einer Interkonversion der (+)- und (–)-Enantiomere von Paliperidon, wobei im Steady-State ein AUC(+)/(–)-Verhältnis von ungefähr 1,6 bis 1,8 erreicht wird.
Distribution
Einer Populationsanalyse zufolge beträgt das scheinbare Verteilungsvolumen von Paliperidon 391 l. Razemisches Paliperidon ist zu 74% an Plasmaproteine gebunden. Der Wirkstoff bindet vorwiegend an α1-saures Glykoprotein und Albumin.
Metabolismus
Eine Woche nach Verabreichung einer oralen Einzeldosis von 1 mg 14C-markiertem Paliperidon mit sofortiger Freisetzung wurden 59% der Dosis unverändert über den Urin ausgeschieden. Dies deutet darauf hin, dass Paliperidon in der Leber nicht extensiv metabolisiert wird. Ungefähr 80% der verabreichten Radioaktivität wurden im Urin wiedergefunden, 11% in den Fäzes. In vivo wurden vier Stoffwechselwege identifiziert, von denen keiner für mehr als 6,5% der Dosis verantwortlich war: Dealkylierung, Hydroxylierung, Dehydrogenierung und Benzisoxazol-Spaltung. Obwohl In-vitro-Versuche für eine Beteiligung von CYP2D6 und CYP3A4 an der Metabolisierung von Paliperidon sprechen, deutet in vivo nichts darauf hin, dass diese Isoenzyme bei der Verstoffwechslung von Paliperidon eine bedeutende Rolle spielen. Obwohl hinsichtlich der Fähigkeit zur Metabolisierung von CYP2D6-Substraten in der Allgemeinbevölkerung starke Unterschiede bestehen, haben Analysen der Populationspharmakokinetik mit Blick auf die scheinbare Clearance von Paliperidon nach Anwendung von oralem Paliperidon keine deutlichen Unterschiede zwischen schnellen Metabolisierern (extensive metabolisers) und langsamen Metabolisierern (poor metabolisers) von CYP2D6-Substraten ergeben. In vitro-Studien an menschlichen Lebermikrosomen zeigten, dass Paliperidon den Metabolismus von Wirkstoffen, die von Cytochrom-P-450-Isoenzymen umgesetzt werden, einschliesslich CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 und CYP3A5, nicht wesentlich hemmt.
In-vitro-Studien haben gezeigt, dass Paliperidon ein Substrat von P-GP und in hoher Konzentration ein schwacher Inhibitor von P-GP ist. Es liegen keine In vivo-Daten vor, und die klinische Relevanz ist unbekannt.
Injektion von lang wirkendem Paliperidonpalmitat im Vergleich zu oralem Paliperidon mit retardierter Freisetzung
Xeplion ist so formuliert, dass Paliperidon über einen Zeitraum von einem Monat hinweg abgegeben wird, während orales Paliperidon mit retardierter Freisetzung täglich appliziert wird. Der Therapieeinleitungsplan für Xeplion (150 mg/100 mg in den Deltamuskel am Tag 1/Tag 8) zielt darauf ab, rasch Steady-State-Paliperidonkonzentrationen zu erreichen, wenn die Therapie ohne Anwendung oraler Supplementierung eingeleitet wird.
Der Gesamtplasmaspiegel war nach Einleitung der Therapie mit Xeplion im Allgemeinen im gleichen Konzentrationsbereich, wie er auch mit 6–12 mg oralem Paliperidon mit retardierter Freisetzung beobachtet wird. Durch die Anwendung des Therapieeinleitungsplans für Xeplion blieben die Patienten selbst an Tagen mit Talkonzentrationen vor der Dosisgabe (Tag 8 und Tag 36) in diesem Expositionsfenster von 6–12 mg oralem Paliperidon mit retardierter Freisetzung. Die Variabilität der Pharmakokinetik von Paliperidon nach Freisetzung aus Xeplion zwischen den Patienten war niedriger als die Variabilität bei Anwendung von oralen Paliperidontabletten mit retardierter Freisetzung. Aufgrund des Unterschieds der mittleren pharmakokinetischen Profile zwischen den beiden Präparaten ist beim direkten Vergleich ihrer pharmakokinetischen Eigenschaften Vorsicht angezeigt.
Elimination
Eine Woche nach Verabreichung einer oralen Einzeldosis von 1 mg 14C-markiertem Paliperidon mit sofortiger Freisetzung wurden 59% der Dosis unverändert über den Urin ausgeschieden, siehe «Metabolismus».
Kinetik spezieller Patientengruppen
Ethnische Zugehörigkeit
In der populationspharmakokinetischen Analyse von Daten aus Studien mit oralem Paliperidon ergaben sich aufgrund der Ethnie keine Anzeichen für Unterschiede in der Pharmakokinetik von Paliperidon nach Anwendung von Xeplion.
Geschlecht
Obwohl Frauen in den populationspharmakokinetischen Analysen eine langsamere Absorption zeigten als Männer, wurden keine klinisch signifikanten Unterschiede zwischen Männern und Frauen festgestellt.
Raucherstatus
Aus In-vitro-Studien mit Enzymen der menschlichen Leber geht hervor, dass Paliperidon kein Substrat von CYP1A2 ist; Rauchen sollte daher keinen Einfluss auf die Pharmakokinetik von Paliperidon haben.
Eine populationspharmakokinetische Auswertung zeigte eine leicht niedrigere Exposition mit Paliperidon bei Rauchern im Vergleich zu Nichtrauchern. Der Unterschied ist jedoch vermutlich nicht von klinischer Relevanz.
Leberfunktionsstörungen
Xeplion wurde bei Patienten mit Leberfunktionsstörung nicht untersucht. Basierend auf einer Studie mit oralem Paliperidon bei Patienten mit mässiger Leberfunktionsstörung (Child-Pugh Klasse B) ist bei Patienten mit leicht bis mässig eingeschränkter Leberfunktion keine Dosisanpassung erforderlich. Bei Prüfungsteilnehmern mit mittelschwerer Einschränkung der Leberfunktion (Child-Pugh-Klasse B) waren die Plasmakonzentrationen von freiem Paliperidon ähnlich denen gesunder Prüfungsteilnehmer. Zu Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh-Klasse C) liegen keine Erkenntnisse vor.
Nierenfunktionsstörungen
Xeplion wurde bei Patienten mit Nierenfunktionsstörung nicht systemisch untersucht. Bei Patienten mit leichter Nierenfunktionsstörung sollte die Dosis von Xeplion reduziert werden. Xeplion wird nicht für die Anwendung bei Patienten mit mässig bis stark eingeschränkter Nierenfunktion empfohlen (siehe «Dosierung/Anwendung»). In Studien mit oralem Paliperidon erhielten Patienten mit unterschiedlich stark eingeschränkter Nierenfunktion eine Einzeltablette mit 3 mg Paliperidon mit retardierter Freisetzung. Die Elimination von Paliperidon nahm mit abnehmender Nierenfunktion ab. Die Gesamt-Clearance von Paliperidon war bei Prüfungsteilnehmern mit eingeschränkter Nierenfunktion um 32% bei leichter Einschränkung der Nierenfunktion (CrCl = 50 bis <80 ml/min), um 64% bei mässiger (CrCl = 30 bis <50 ml/min) und um 71% bei schwerer Einschränkung der Nierenfunktion (CrCl = 10 bis <30 ml/min) verringert, was einem durchschnittlichen Anstieg der Exposition (AUCinf) um das 1,5-, 2,6- bzw. 4,8-fache gegenüber gesunden Personen entspricht. Die mittlere terminale Eliminationshalbwertzeit von Paliperidon betrug bei Prüfungsteilnehmern mit leichter, mässiger und schwerer Einschränkung der Nierenfunktion jeweils 24, 40 bzw. 51 Stunden, im Vergleich zu 23 Stunden bei Prüfungsteilnehmern mit normaler Nierenfunktion (CrCl ≥80 ml/min).
Ausgehend von einer begrenzten Anzahl von Beobachtungen mit Xeplion bei Patienten mit leichter Nierenfunktionsstörung und von pharmakokinetischen Simulationen sollte die Therapie mit Xeplion bei Patienten mit leicht eingeschränkter Nierenfunktion mit einer Dosis von 100 mg am Behandlungstag 1 und 75 mg nach einer Woche eingeleitet werden (beide Applikationen in den Deltoidmuskel). Anschliessend sollten monatliche (alle 4 Wochen) Injektionen von 50 mg in den deltoiden oder glutealen Muskel erfolgen, angepasst innerhalb des Bereiches 25–100 mg je nach individueller Verträglichkeit und/oder Wirksamkeit (siehe «Dosierung/Anwendung»).
Ältere Patienten (65 und älter)
Eine Dosisanpassung allein auf Grundlage des Alters wird nicht empfohlen. Es könnte jedoch eine Dosisanpassung aufgrund des altersbedingten Rückgangs der Kreatinin-Clearance erforderlich sein (siehe «Nierenfunktionsstörungen»und «Dosierung/Anwendung»).
Präklinische DatenToxizität bei wiederholter Gabe
Studien zur Toxizität bei wiederholter Gabe haben gezeigt, dass intramuskulär injiziertes Paliperidonpalmitat (≥20 mg/kg/Monat bei Ratten und ≥5 mg/kg/Monat bei Hunden) und oral dosiertes Paliperidon (≥0,63 mg/kg/Tag bei Ratten), wie auch andere Dopamin-D2-Rezeptor-Antagonisten, Prolaktin-vermittelte Wirkungen, z.B. auf die Brustdrüse und Genitalien, hervorrufen. Aufgrund von fehlenden no-observed-effect levels konnte bei Ratten keine Sicherheitsspanne ermittelt werden. Bei Hunden, die intramuskulär mit Paliperidonpalmitat behandelt wurden, betrug die Expositions-basierte Sicherheitsspanne ca. das 1,6fache.
Genotoxizität
Im Ames-Rückmutationstest und im Mauslymphoma-Assay in vitro sowie im Mikrokerntest in der Ratte in vivo ergaben sich keine Hinweise auf ein genotoxisches Potential von Paliperidon oder Paliperidonpalmitat.
Kanzerogenität
Das kanzerogene Potential von intramuskulär injiziertem Paliperidonpalmitat wurde in einer Studie zur Kanzerogenität mit einer Laufzeit von 24-Monaten an Ratten untersucht. Bei weiblichen Ratten wurde bei Dosen von 10, 30 und 60 mg/kg/Monat ein statistisch signifikanter Anstieg von Brustdrüsenadenokarzinomen festgestellt. Männliche Ratten zeigten bei 30 und 60 mg/kg/Monat einen statistisch signifikanten Anstieg der Brustdrüsenadenome und -karzinome. Aufgrund des fehlenden no-observed-effect levels konnte keine Expositions-basierte Sicherheitsspanne bestimmt werden.
Die Bewertung des kanzerogenen Potentials von Paliperidon, dem aktiven Metaboliten von Risperidon, erfolgte ausserdem auf Grundlage von Studien mit Risperidon an Mäusen und Ratten. Mäuse wurden über einen Zeitraum von 18 Monaten, Ratten über einen Zeitraum von 25 Monaten mit Risperidon in Dosen von ca. 0,63, 2,5 und 10 mg/kg/Tag behandelt. Es wurde eine statistisch signifikante Zunahme von Hypophysenadenomen, Adenomen des endokrinen Pankreas sowie Adenokarzinomen der Brustdrüse beobachtet. Eine erhöhte Inzidenz von Tumoren der Brustdrüse, Hypophyse und des endokrinen Pankreas nach chronischer Applikation von Antipsychotika bei Nagern ist in der wissenschaftlichen Literatur gut dokumentiert. Es wird davon ausgegangen, dass dieser Anstieg auf einen dauerhaften Dopamin-D2-Antagonismus zurückzuführen ist. Die Relevanz dieser Tumorbefunde bei Nagern für das Risiko beim Menschen ist unbekannt.
Reproduktionstoxizität
Studien zur embryo-/fötalen Entwicklung zeigten nach oraler Verabreichung von bis zu 10 mg/kg/Tag Paliperidon bei Ratten und von bis zu 5 mg/kg/Tag bei Kaninchen keine teratogene Wirkung. Die Zahl überlebender Kaninchen-Feten war bei einer Dosis von 5 mg/kg/Tag reduziert, welche auch Maternaltoxizität aufwies. Nach wiederholter intramuskulärer Verabreichung von Paliperidonpalmitat bei trächtigen Ratten wurde bis zur höchsten Dosis (160 mg/kg/Tag), welche dem 4,1fachen des Expositionsniveaus beim Menschen bei der empfohlenen Maximaldosis von 150 mg entspricht, keine Embryotoxizität oder Teratogenität beobachtet.
Fertilität
Wenngleich eine Behandlung mit oralem Paliperidon zu Prolaktin- und ZNS-vermittelten Effekten führte, waren keine Auswirkungen auf die Fertilität männlicher und weiblicher Ratten zu beobachten. Unter maternal toxischen Dosierungen von 2,5 mg/kg/Tag war die Anzahl lebender Embryonen vermindert. Bei Hunden wurde für orales Risperidon nach Gabe von Dosen, die äquivalent zur empfohlenen Maximaldosis von Risperidon beim Menschen waren, eine verminderte Motilität der Spermien und des Testosteron-Plasmaspiegels beschrieben. Bei weiblichen (aber nicht bei männlichen) Ratten kam es unter Risperidon zu einer Beeinträchtigung des Paarungsverhaltens, während Wirkungen auf die Fertilität nicht festgestellt wurden.
Sonstige HinweiseInkompatibilitäten
Xeplion darf nicht mit anderen Produkten oder Verdünnungsmitteln gemischt werden und ist für die intramuskuläre Anwendung direkt aus der Spritze, in welcher es verpackt ist, bestimmt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Der Injektionssatz enthält eine Fertigspritze und 2 Sicherheitskanülen (eine Kanüle der Grösse 22 G und der Länge 3,8 cm und eine Kanüle der Grösse 23 G und der Länge 2,5 cm) für die intramuskuläre Injektion.
A-22G×3,8 cm grauer Ansatz;
B-23G×2,5 cm blauer Ansatz;
C-Fertigspritze;
D-Ansatz;
E-Spitzenkappe.
Xeplion ist nur für den Einmalgebrauch bestimmt.
1.Die Spritze mindestens 10 Sekunden lang kräftig schütteln, damit eine homogene Suspension entsteht.
2. Die geeignete Kanüle auswählen.
Für die Injektion in den DELTAMUSKEL die 23-G-Kanüle mit einer Länge von 2,5 cm verwenden (Kanüle mit blauem Ansatz), wenn der Patient <90 kg wiegt; wiegt der Patient ≥90 kg, die 22-G-Kanüle mit einer Länge von 3,8 cm (Kanüle mit grauem Ansatz) verwenden.
Für die Injektion in den GLUTEALMUSKEL die 22-G-Kanüle mit einer Länge von 3,8 cm verwenden (Kanüle mit grauem Ansatz).
3. Die Spritze mit der Spitzenkappe nach oben halten, die Gummikappe mit einer behutsamen Drehbewegung abnehmen.
4. Den Beutel mit der Sicherheitskanüle zur Hälfte aufreissen. Die Kanülenschutzhülse mit dem Aufreissbeutel aus Kunststoff anfassen. Die Spritze mit der Spitze nach oben halten. Die Sicherheitskanüle mit einer behutsamen Drehbewegung an der Spritze befestigen, um Risse oder Beschädigungen des Nadelansatzes zu vermeiden. Vor der Verabreichung stets auf Anzeichen von Beschädigungen oder austretender Flüssigkeit prüfen.
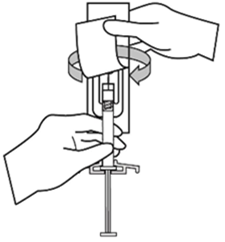
5. Die Schutzhülse der Kanüle gerade von der Kanüle wegziehen. Die Hülse nicht drehen, da sich sonst die Kanüle wieder von der Spritze löst.
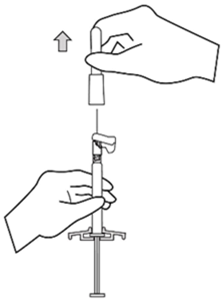
6. Die Spritze mit der daran befestigten Nadel senkrecht halten, um Luftbläschen zu entfernen. Dazu den Kolben vorsichtig nach vorne bewegen.
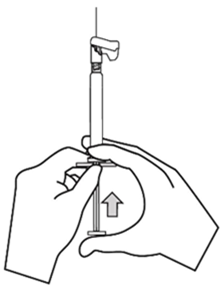
7. Den gesamten Inhalt der Spritze langsam, tief intramuskulär in den ausgewählten Delta- oder Glutealmuskel des Patienten injizieren. Nicht intravasal oder subkutan verabreichen.
8. Nach Abschluss der Injektion mit dem Daumen oder Finger der Hand, die die Spritze hält oder auf einer flachen Oberfläche das Kanülenschutzsystem aktivieren. Das Nadelschutzsystem ist vollständig aktiviert, wenn ein Klicken zu hören ist. Die Spritze mit der Kanüle sachgemäss entsorgen.
8a
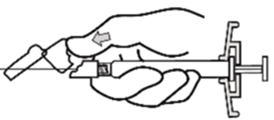
8b
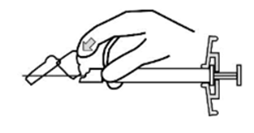
8c
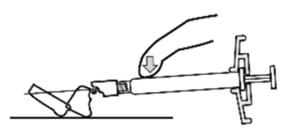
Zulassungsnummer60466 (Swissmedic).
PackungenXeplion, Depot-Injektionssuspension in einer Fertigspritze zu 25 mg, 50 mg, 75 mg, 100 mg, 150 mg: 1 Fertigspritze und zwei Injektionsnadeln (22 G, 23 G) [B]
ZulassungsinhaberinJanssen-Cilag AG, Zug, ZG
Stand der InformationMärz 2023
|










