Eigenschaften/WirkungenATC-Code
N05AX13
Xeplion enthält eine razemische Mischung aus (+)- und (–)-Paliperidon.
Wirkungsmechanismus / Pharmakodynamik
Paliperidone, der Wirkstoff in Xeplion, ist ein psychotroper Wirkstoff, der zur chemischen Klasse der Benzisoxazolderivate gehört (atypisches Antipsychotikum).
Paliperidonpalmitat wird zu Paliperidon hydrolysiert (siehe «Präklinische Daten»). Bei Paliperidon handelt es sich um einen zentral wirkenden Dopamin-D2-Antagonisten mit einer ausgeprägten antagonistischen Aktivität am serotonergen 5HT2A-Rezeptor. Paliperidon besitzt ausserdem antagonistische Wirkungen auf α1- und α2-adrenerge Rezeptoren sowie auf H1-histaminerge Rezeptoren. Die Substanz besitzt keine Affinität zu cholinergen Muskarin- oder β1- und β2-adrenergen Rezeptoren. Die pharmakologische Aktivität der (+)- und (–)-Enantiomere von Paliperidon ist qualitativ und quantitativ vergleichbar.
Der Wirkmechanismus von Paliperidon ist wie auch bei anderen in der Schizophreniebehandlung wirksamen Arzneimitteln unbekannt. Es wurde jedoch postuliert, dass die therapeutische Wirkung des Arzneimittels bei Schizophrenie über eine Kombination des Dopamin-Typ-2-(D2-) und Serotonin-Typ-2-(5HT2A-)Rezeptor-Antagonismus vermittelt sein könnte. Für manche der sonstigen Wirkungen von Paliperidon könnten antagonistische Effekte auf andere Rezeptoren als D2 und 5HT2A verantwortlich sein.
Klinische Wirksamkeit
Die Wirksamkeit von Xeplion bei der akuten Behandlung von Schizophrenie wurde in vier kurzzeitigen (eine über 9 Wochen und drei über 13 Wochen) doppelblinden, randomisierten, placebokontrollierten Studien mit fixer Dosierung bei stationär behandelten erwachsenen Patienten mit akutem Rezidiv nachgewiesen, welche die DSM-IV-Kriterien für Schizophrenie erfüllten. Die in diesen Studien angewendete fixe Dosierung von Xeplion wurde in der 9-wöchigen Studie am Tag 1, 8 und 36 und zusätzlich in den 13-wöchigen Studien am Tag 64 verabreicht, d.h. die ersten beiden Dosen im Abstand von einer Woche und anschliessend alle 4 Wochen zur Erhaltung.
Die Abschätzung der Wirksamkeit erfolgte mithilfe der PANS-Skala (Positive and Negative Syndrome Scale), einem validierten Multi-Item-Inventar, das aus fünf Faktoren zusammengesetzt ist und zur Abschätzung positiver Symptome, negativer Symptome, desorganisierter Gedanken, unkontrollierter Feindseligkeit/Erregung und von Angststörungen/Depression herangezogen wird. Die Funktionsfähigkeit wurde auf der PSP-Skala (Personal and Social Performance-Skala) untersucht. Bei der PSP handelt es sich um eine validierte Skala zur Bewertung der persönlichen und sozialen Funktionsfähigkeit in den Bereichen sozial nützlicher Aktivitäten durch den Arzt. In einer 13-wöchigen Studie (R092670-PSY-3007) (n= 636), in der drei fixe Dosierungen von Xeplion (Injektion der Anfangsdosis von 150 mg in den Deltamuskel, gefolgt von 3 Dosen zu 25 mg/4 Wochen, 100 mg/4 Wochen oder 150 mg/4 Wochen in den Delta- oder Glutealmuskel) mit einem Placebo verglichen wurden, waren alle drei Dosierungen von Xeplion hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen. In dieser Studie zeigten die Behandlungsgruppen, die 100 mg/4 Wochen und 150 mg/4 Wochen erhielten, aber nicht die Gruppe, die 25 mg/4 Wochen erhielt, hinsichtlich des PSP-Wertes statistische Überlegenheit gegenüber dem Placebo.
In einer anderen 13-wöchigen Studie (R092670-PSY-3003) (n= 349), in der drei fixe Dosierungen von Xeplion (50 mg/4 Wochen, 100 mg/4 Wochen und 150 mg/4 Wochen) mit einem Placebo verglichen wurden, war nur die Dosis zu 100 mg Xeplion alle 4 Wochen hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen. In dieser Studie waren die Behandlungsgruppen, die 50 mg/4 Wochen und 100 mg/4 Wochen erhielten, wären hinsichtlich der Verbesserung des PSP-Wertes gegenüber dem Placebo überlegen. In dieser Studie gab es zwar auch eine Gruppe, die eine Dosis zu 150 mg erhielt, aber die Anzahl der Patienten unter dieser Dosierung war zu klein, um definitive Schlussfolgerungen zur Wirksamkeit dieser Dosis ziehen zu können.
In einer dritten 13-wöchigen Studie (R092670-PSY-3004) (n= 513), in der drei fixe Dosierungen von Xeplion (25 mg/4 Wochen, 50 mg/4 Wochen und 100 mg/4 Wochen) mit einem Placebo verglichen wurden, waren alle drei Dosen von Xeplion hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen. In dieser Studie erzielte keine der Paliperidon-Dosisgruppen hinsichtlich der Verbesserung des PSP-Wertes im Placebovergleich statistische Signifikanz.
In der 9-wöchigen Studie (R092670-PSY-201) (n= 197), in der zwei fixe Dosierungen von Xeplion (50 mg/4 Wochen und 100 mg/4 Wochen) mit einem Placebo verglichen wurden, waren beide Dosen von Xeplion hinsichtlich der Verbesserung des PANSS-Gesamtwertes gegenüber dem Placebo überlegen.
Die Wirksamkeit von Xeplion hinsichtlich der Erhaltung der Kontrolle der Schizophreniesymptome und Verzögerung des Auftretens schizophrener Rezidive wurde in einer länger laufenden doppelblinden placebokontrollierten Studie mit flexibler Dosierung mit 849 Probanden im jungen und mittleren Erwachsenenalter, welche die DSM-IV-Kriterien für Schizophrenie erfüllten, nachgewiesen. Diese Studie (R092670-PSY-3001) bestand aus einer offenen Akutbehandlungs- (9 Wochen) und Stabilisierungsphase (24 Wochen) und aus einer randomisierten placebokontrollierten Phase zur Beobachtung auf Rezidive sowie einer 52-wöchigen offenen Anschlussbeobachtungsphase. In dieser Studie wurden monatlich Xeplion-Dosen von 25, 50, 75 und 100 mg verabreicht, wobei die Dosis von 75 mg nur während der 52-wöchigen offenen Erweiterung zugelassen war. Die Probanden erhielten anfangs während einer 9-wöchigen Übergangsphase flexible Dosen (25 bis 100 mg) Xeplion, gefolgt von einem 24-wöchigen Erhaltungszeitraum, wobei die Probanden einen PANSS-Wert ≤75 aufweisen mussten, um in diesen eintreten zu können. Eine Anpassung der Dosis war nur in den ersten zwölf Wochen des Erhaltungszeitraums zulässig. Im Verlauf der unterschiedlich langen Doppelblindphase wurden die Patienten randomisiert und erhielten entweder die gleiche Dosis Xeplion (mittlere Dauer: 171 Tage [1 Tag–407 Tage]), die sie auch während der Stabilisierungsphase alle 4 Wochen erhalten hatten, oder ein Placebo (mittlere Dauer: 105 Tage [8 Tage–441 Tage]). Insgesamt wurden 410 stabilisierte Patienten nach Randomisierung in den Xeplion-Gruppen oder in der Placebogruppe behandelt, bis bei ihnen ein Rezidiv der Schizophreniesymptome eintrat. Ein Rezidiv war definiert als Zeitraum bis zum ersten Auftreten mindestens eines der folgenden Symptome bzw. Ereignisse: stationäre Aufnahme in die Psychiatrie, Anstieg um ≥25% (bei einem Ausgangswert >40) bzw. um 10 Punkte (bei einem Ausgangswert ≤40) des PANSS-Gesamtwertes bei zwei aufeinanderfolgenden Bewertungen, absichtliche Selbstverletzung, gewalttätiges Verhalten, Selbsttötungs-/Tötungsabsicht oder ein Wert von ≥5 (bei einem maximalen Ausgangswert von ≤3) oder ≥6 (bei einem maximalen Ausgangswert von 4) bei zwei aufeinanderfolgenden Bewertungen der PANSS-Einzelitems P1 (Wahnvorstellungen), P2 (verwirrtes Denken), P3 (halluzinatorisches Verhalten), P6 (Misstrauen/Verfolgungswahn), P7 (Feindseligkeit) oder G8 (Unkooperativität). Die primäre Wirksamkeitsvariable war der Zeitraum bis zum Rezidiv. Einer im Voraus geplanten Zwischenanalyse (nach Auftreten von 68 Rezidivereignissen) zufolge, war der Zeitraum bis zum Auftreten eines Rezidivs bei mit Xeplion behandelten Patienten signifikant länger als bei den Patienten in der Placebogruppe (siehe Abbildung 1), und die Studie wurde vorzeitig beendet, weil die Beibehaltung der Wirksamkeit nachgewiesen worden war.
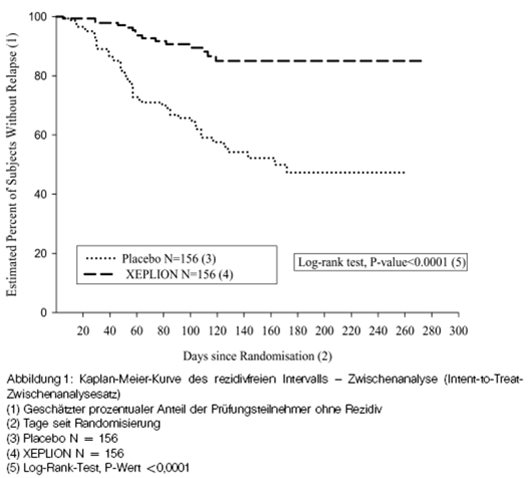
Das Analysenresultat basierend auf den finalen Daten, einschliesslich aller Daten bis zum Studienabschluss, war im Einklang mit dem der primären Wirksamkeitsanalyse basierend auf den Interimdaten.
Eine Untersuchung von Patientensubgruppen ergab keine klinisch signifikanten Unterschiede hinsichtlich des Ansprechens aufgrund von Geschlecht, Alter oder ethnischer Zugehörigkeit.
|

