ZusammensetzungWirkstoffe
Tobramycinum.
Hilfsstoffe
1,2-distearoyl-sn-glycero-3-phosphatidylcholinum, calcii chloridum dihydricum, acidum sulfuricum (E513).
Indikationen/AnwendungsmöglichkeitenTobi Podhaler ist für die Behandlung pulmonaler Infektionen mit Pseudomonas aeruginosa bei Patienten mit zystischer Fibrose (CF) ab dem Alter von 6 Jahren indiziert.
Dosierung/AnwendungAllgemeine Zielpopulation: Erwachsene und Kinder ab 6 Jahren mit zystischer Fibrose (CF) und pulmonaler Infektion mit Pseudomonas aeruginosa
Die Dosis von TOBI Podhaler ist dieselbe für alle Patienten unabhängig vom Alter oder Körpergewicht. Die empfohlene Dosierung beträgt vier Kapseln (4 x 28 mg = 112 mg Tobramycin) zweimal täglich während 28 Tagen. Jede Dosis zu vier Kapseln soll im Abstand von möglichst genau 12 Stunden und nicht weniger als sechs Stunden inhaliert werden.
TOBI Podhaler wird in abwechselnden Zyklen genommen, 28 Tage mit dem Medikament, gefolgt von 28 Tagen ohne das Medikament.
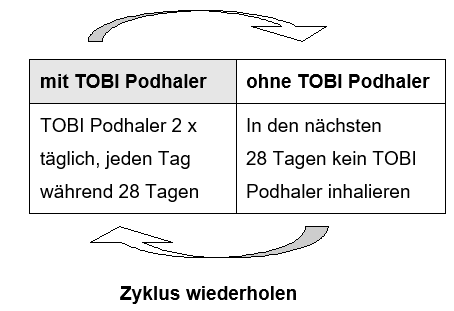
Wurde eine Dosis ausgelassen und beträgt das Intervall vor der nächsten Dosis noch mindestens 6 Stunden, so soll der Patient die Dosis so bald wie möglich inhalieren. Andernfalls soll der Patient bis zur nächsten Dosis warten, aber nicht als Ausgleich für die ausgelassene Dosis mehr Kapseln inhalieren.
Bei Patienten unter 6 Jahren, Patienten mit einem FEV1 (forciertes exspiratorisches Volumen in 1 Sekunde) <25% oder >80% des vorausgesagten Werts sowie bei Patienten mit Besiedelung durch Burkholderia cepacia sind die Sicherheit und Wirksamkeit nicht nachgewiesen.
Anwendung bei besonderen Patientenpopulationen
Patienten mit Leberfunktionsstörungen
Es wurden keine Studien mit leberinsuffizienten Patienten durchgeführt. Da Tobramycin kaum metabolisiert wird, ist keine Auswirkung einer hepatischen Insuffizienz auf die Tobramycin-Exposition zu erwarten.
Patienten mit Nierenfunktionsstörungen
Tobramycin wird primär unverändert im Urin ausgeschieden und eine Beeinflussung der Tobramycin-Exposition durch die Nierenfunktion ist zu erwarten. Patienten mit einem Serumkreatinin ≥2 mg/dl und Harnstoffstickstoff im Blut (BUN) ≥40mg/dl wurden nicht in klinische Studien aufgenommen und es gibt für sie keine Daten, um eine Empfehlung für oder gegen eine Dosisanpassung von TOBI Podhaler auszusprechen (siehe auch «Warnhinweise und Vorsichtsmassnahmen», Nephrotoxizität).
Ältere Patienten (≥65 Jahre)
Für diese Population liegen nicht genügend Daten vor, um eine Empfehlung für oder gegen eine Dosisanpassung abzugeben. Bei der Anwendung von TOBI Podhaler durch ältere Patienten ist die Nierenfunktion zu berücksichtigen (s. «Warnhinweise und Vorsichtsmassnahmen», Nephrotoxizität).
Kinder unter 6 Jahren
TOBI Podhaler ist für die Anwendung in dieser Altersgruppe nicht indiziert. An klinischen Studien mit TOBI Podhaler nahmen Kinder ab 6 Jahren teil; an jüngeren Kindern ist TOBI Podhaler nicht untersucht worden.
Patienten nach Organtransplantation
Es liegen keine ausreichenden Daten zur Anwendung von TOBI Podhaler bei Patienten nach Organtransplantation vor.
Art der Anwendung
TOBI Podhaler wird ausschliesslich mittels Inhalation durch den Mund und nur mit dem T-326 Inhalator angewendet. Das Medikament darf nicht auf einem anderen Applikationsweg und nicht mit einem anderen Inhalator verwendet werden (s. «Sonstige Hinweise», «Handhabung»). TOBI Podhaler-Kapseln nicht schlucken!
Falls der Patient mehrere Medikamente inhaliert und eine Thorax-Physiotherapie erhält, wird empfohlen, TOBI Podhaler zuletzt zu inhalieren.
KontraindikationenTOBI Podhaler ist bei Patienten mit bekannter Überempfindlichkeit gegen Aminoglykoside oder einen anderen Inhaltsstoff kontraindiziert.
Warnhinweise und VorsichtsmassnahmenVerträglichkeit
Während klinischer Studien wurde zur Verträglichkeit von TOBI Podhaler im Vergleich zu TOBI eine höhere Anzahl von unerwünschten Wirkungen wie Husten oder oropharyngeale Schmerzen berichtet.
Eine Bewertung der Verträglichkeit von TOBI Podhaler durch den Patienten sollte regelmässig quartalsweise vorgenommen werden. Im Falle einer kontinuierlichen therapiebezogenen Unverträglichkeit sollte die Behandlung alternativ mit TOBI Lösung zur Inhalation fortgesetzt werden.
Mikrobiologische Resistenz
In klinischen Studien mit TOBI Podhaler zeigten manche Patienten eine Erhöhung der MHK bei getesteten P. aeruginosa-Isolaten. Diese erhöhten MHK waren grösstenteils reversibel während behandlungsfreier Perioden.
Es besteht trotz allem ein theoretisches Risiko, dass Patienten, unter TOBI Podhaler gegenüber der TOBI-Inhalation über Vernebler vermehrt P. aeruginosa-Stämme entwickeln könnten, die sich möglicherweise gegenüber intravenös verabreichtem Tobramycin als resistent erweisen. Dies sollte regelmässig mindestens quartalsweise überwacht werden. Bei signifikantem Anstieg der MHK (über die beim Patienten beobachteten Schwankungen hinaus), sollte, bei Lichte, der bisher mit TOBI Podhaler beim Patienten erzielten klinischen Wirkung, die Behandlung mit einem alternativen inhalierbaren Antibiotikum erwogen werden.
TOBI Podhaler sollte bei Patienten mit bekannter oder vermuteter renaler, auditorischer, vestibulärer oder neuromuskulärer Dysfunktion oder mit schwerer aktiver Hämoptyse mit Vorsicht eingesetzt werden.
Ototoxizität
Für parenterale Aminoglykoside liegen Berichte über Ototoxizität vor, als Schädigung sowohl des Hörvermögens als auch der vestibulären Funktion. Die vestibuläre Toxizität kann sich als Schwindel, Ataxie oder Taumeligkeit äussern. Tinnitus kann ein Leitsymptom der Ototoxizität sein, daher ist beim Auftreten dieses Symptoms Vorsicht geboten.
In den klinischen Studien mit TOBI Podhaler wurde von Patienten eine Verminderung des Hörvermögens und Tinnitus berichtet (s. «Unerwünschte Wirkungen»). Bei der Verschreibung von TOBI Podhaler an Patienten mit bekannter oder vermuteter Störung der Hör- oder Gleichgewichtsfunktion ist Vorsicht geboten.
Bei Patienten mit Hinweisen auf eine Beeinträchtigung des Hörvermögens oder mit einem prädisponierenden Risikofaktor sollte vor Einleitung der Therapie mit TOBI Podhaler eine audiologische Untersuchung erwogen werden.
Risiko der Ototoxizität aufgrund mitochondrialer DNA-Varianten
Fälle von Ototoxizität mit Aminoglykosiden wurden bei Patienten mit bestimmten Varianten im mitochondrial kodierten 12S rRNA-Gen (MT-RNR1), insbesondere der Variante m.1555A>G, beobachtet. Bei einigen Patienten trat Ototoxizität auf, selbst wenn die Aminoglykosid-Serumspiegel innerhalb des empfohlenen Bereichs lagen. Mitochondriale DNA-Varianten variiert je nach Bevölkerung, wird aber auf etwa 1-2% geschätzt und der Anteil der Varianten-Träger, die Ototoxizität entwickeln können, sowie der Schweregrad der Ototoxizität sind unbekannt. Bei bekannter Ototoxizität durch Aminoglykoside in der Vorgeschichte der Mutter oder einer bekannten mitochondrialen DNA-Variante beim Patienten sollten andere Behandlungen als Aminoglykoside in Betracht gezogen werden, es sei denn, das erhöhte Risiko eines dauerhaften Hörverlusts wird durch die Schwere der Infektion und den Mangel an sicheren und wirksamen Alternativtherapien aufgewogen.
Wenn ein Patient während der Behandlung mit TOBI Podhaler über Tinnitus oder vermindertes Hörvermögen klagt, sollte der Arzt eine audiologische Abklärung veranlassen.
Zur Überwachung der Tobramycin-Serumspiegel (s. unten, «Laboruntersuchungen»).
Nephrotoxizität
Nephrotoxizität wurde für parenteral applizierte Aminoglykoside berichtet. Während der klinischen Studien mit TOBI Podhaler beobachtete man keine Nephrotoxizität. Bei der Verschreibung von TOBI Podhaler an Patienten mit bekannter oder vermuteter Nierenfunktionsstörung ist Vorsicht geboten (s. unten, Laboruntersuchungen).
Vor Beginn der Behandlung mit TOBI Podhaler ist die Nierenfunktion zu beurteilen. Nach jeweils 6 kompletten Behandlungszyklen mit TOBI Podhaler/TOBI Lösung zur Inhalation ist eine erneute Bestimmung des Harnstoff- und Kreatininspiegels angezeigt.
Laboruntersuchungen – Serumspiegel
Bei Patienten mit bekannter oder vermuteter Störung des Hörvermögens oder der Nierenfunktion soll der Tobramycin-Serumspiegel überwacht werden. Tritt unter Behandlung mit TOBI Podhaler eine Oto- oder Nephrotoxizität auf, so ist die Therapie mit Tobramycin zu unterbrechen, bis der Serumspiegel unter 2 µg/ml liegt.
1 Stunde nach Applikation von TOBI Podhaler beträgt der Tobramycin-Serumspiegel ungefähr 1-2 µg/ml. Ein Serumspiegel über 12 µg/ml geht mit Tobramycin-Toxizität einher und oberhalb dieser Konzentration ist die Behandlung abzubrechen.
Das Blut für die Messung des Tobramycin-Serumspiegels ist mittels Venenpunktion und nicht durch Punktion der Fingerkuppe zu entnehmen. Eine Kontamination der Fingerhaut mit Tobramycin kann zu einem falsch erhöhten Wert des Serumspiegels dieses Medikaments führen. Auch mittels Waschen der Hände vor der Blutentnahme lässt sich diese Kontamination nicht völlig vermeiden.
Bronchospasmus
Bronchospasmen können bei der Inhalation von Arzneimitteln auftreten und sind mit TOBI Podhaler während klinischer Studien berichtet worden. Ein Bronchospasmus ist medizinisch adäquat zu behandeln.
Die erste Dosis von TOBI Podhaler soll unter Aufsicht gegeben werden. Vor und nach der ersten Inhalation von TOBI Podhaler ist das FEV1 zu messen.
Liegen Hinweise für einen Therapie-induzierten Bronchospasmus vor, so muss der Arzt sorgfältig abwägen, ob der Nutzen einer weiteren Anwendung von TOBI Podhaler das Risiko für den Patienten überwiegt. Bei vermuteter allergischer Reaktion ist TOBI Podhaler abzusetzen.
Husten
Inhalierte Arzneimittel können Husten auslösen, was auch für TOBI Podhaler in klinischen Studien berichtet wurde. Der Husten hatte keinen Zusammenhang mit Bronchospasmus. Kinder unter 13 Jahren husten möglicherweise eher bei Behandlung mit TOBI Podhaler.
Bestehen Hinweise auf einen fortbestehenden Therapie-induzierten Husten mit TOBI Podhaler, sollte der Arzt bzw. die Ärztin therapeutische Alternativen in Betracht ziehen.
Antibiotische Begleitmedikation
Bei Patienten, die gleichzeitig ein parenterales Aminoglykosid (oder andere Arzneimittel mit möglichem Einfluss auf die Nierenausscheidung) erhalten, ist der Tobramycin-Serumspiegel zu überwachen. Solche Patienten sind unter Berücksichtigung des Risikos einer kumulativen Toxizität klinisch adäquat zu überwachen (s. oben, «Laboruntersuchungen»).
Neuromuskuläre Störungen
Bei der Verschreibung von TOBI Podhaler an Patienten mit bekannter oder vermuteter neuromuskulärer Erkrankung wie Myasthenia gravis oder Morbus Parkinson ist Vorsicht geboten. Aminoglykoside können wegen eines potenziellen Kurare-artigen Effekts auf die neuromuskuläre Funktion die Muskelschwäche verschlimmern.
Hämoptyse
Patienten mit klinisch relevanter Hämoptyse wurden von den klinischen Studien ausgeschlossen, weshalb keine Daten zur Anwendung von TOBI Podhaler bei solchen Patienten verfügbar sind. Derartige Patienten sollen TOBI Podhaler nur erhalten, wenn nach Einschätzung des Arztes der Nutzen der Behandlung gegenüber dem Risiko der Auslösung weiterer Blutungen überwiegt.
Abnahme des Ansprechens auf Tobramycin
In klinischen Studien zeigte sich bei manchen mit TOBI Podhaler behandelten Patienten ein Anstieg der minimalen Hemmkonzentration von Aminoglykosiden für die isolierten Stämme von P. aeruginosa.
Es besteht ein theoretisches Risiko, dass bei Patienten unter Behandlung mit TOBI Podhaler Tobramycin-resistente Stämme von P. aeruginosa entstehen.
Die für eine parenterale Tobramycin-Therapie verwendeten In-vitro-Testmethoden der antimikrobiellen Empfindlichkeit eignen sich auch für die Überwachung der Sensitivität von P. aeruginosa-Isolaten von Patienten mit zystischer Fibrose (siehe auch «Eigenschaften/Wirkungen»).
InteraktionenEs wurden keine klinischen Interaktionsstudien mit TOBI Podhaler durchgeführt. Einige Diuretika können durch veränderte Antibiotika-Konzentration in Serum und Gewebe die Toxizität der Aminoglycoside steigern. TOBI Podhaler soll nicht gleichzeitig mit Ethacrynsäure, Furosemid, Harnstoff oder intravenösem Mannitol verabreicht werden.
Aufgrund des Wechselwirkungsprofils von Tobramycin nach intravenöser und Aerosol-Applikation soll die gleichzeitige und/oder aufeinanderfolgende Gabe von TOBI Podhaler und anderen Medikamenten mit neurotoxischem, nephrotoxischem oder ototoxischem Potenzial vermieden werden.
Zu den weiteren Medikamenten, für die eine Erhöhung der potenziellen Toxizität parenteral verabreichter Aminoglycoside berichtet wurde, gehören:
·Amphotericin B, Cefalotin, Ciclosporin, Tacrolimus, Polymyxine (Risiko der erhöhten Nephrotoxizität);
·Platinverbindungen (Gefahr der erhöhten Nephro- und Ototoxizität);
·Anticholinesterasen, Botulinum-Toxin (neuromuskuläre Wirkungen).
Während der Behandlungsphase der EAGER-Studie erhielt ein ähnlicher Anteil Patienten in der TOBI Podhaler- und der TOBI-Gruppe weiterhin Dornase alfa, Bronchodilatatoren, inhalierte Kortikosteroide und Makrolide.
Schwangerschaft, StillzeitSchwangerschaft
Zur Anwendung von Tobramycin mittels Inhalation bei Schwangeren liegen keine adäquaten Daten vor.
Aminoglykoside können eine fetale Schädigung (z.B. angeborene Taubheit) hervorrufen, wenn bei einer schwangeren Frau hohe systemische Konzentrationen erreicht werden.
TOBI Podhaler darf während der Schwangerschaft nicht angewendet werden, es sei denn, es ist eindeutig erforderlich.
Patientinnen, die TOBI Podhaler während der Schwangerschaft anwenden oder während der Anwendung von TOBI Podhaler schwanger werden, sind über die mögliche Gefahr für den Fetus zu informieren.
Stillzeit
Es ist nicht bekannt, wieviel Tobramycin nach der Inhalation in die Muttermilch übertritt. Wegen des Potenzials für Oto- und Nephrotoxizität bei Säuglingen darf TOBI Podhaler während der Stillzeit nicht angewendet werden, es sei denn, es ist eindeutig erforderlich.
Fertilität
Daten aus Tierversuchen mit subkutaner Gabe von Tobramycin ergaben kein Problem oder kein potenzielles Problem bezüglich der Fertilität männlicher oder weiblicher Tiere (s. «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenAuf Basis der berichteten unerwünschten Arzneimittelwirkungen wird angenommen, dass TOBI Podhaler wahrscheinlich keine Wirkung auf die Fahrtüchtigkeit und das Bedienen von Maschinen ausübt.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Sicherheit von TOBI Podhaler wurde bei 395 Patienten mit zystischer Fibrose beurteilt, die mindestens 1 Dosis von TOBI Podhaler erhalten hatten, davon 273 Patienten mit Behandlung während drei Zyklen (6 Monate). Jeder Zyklus umfasste 28 Tage mit Behandlung (112 mg zweimal täglich) und 28 Tage ohne Behandlung.
Die primäre Population der Arzneimittelsicherheit wurde im geplanten Verhältnis 3:2 randomisiert und bestand aus 308 Patienten unter Behandlung mit TOBI Podhaler und 209 Patienten mit TOBI (300 mg/5 ml Tobramycin-Verneblerlösung) in der EAGER-Studie, einer offenen Studie zum Vergleich von TOBI Podhaler mit TOBI während 3 Behandlungszyklen. Sowohl in der TOBI Podhaler- als auch der TOBI-Gruppe betrug die mittlere Dauer der Arzneimittel-Exposition in jedem Zyklus 28-29 Tage. Die supportive Sicherheitspopulation umfasste weitere 87 Patienten unter Behandlung mit TOBI Podhaler und 49 unter Placebo in der EVOLVE-Studie [5,20]; diese war im ersten Behandlungszyklus doppelblind, gefolgt von der Behandlung aller Patienten mit TOBI Podhaler in 2 weiteren Zyklen.
In der EAGER-Studie beobachtete man die häufigsten unerwünschten Arzneimittelreaktionen in der System-Organ-Klasse «Atemwege, Thorax und Mediastinum». Die häufigsten unerwünschten Arzneimittelreaktionen (nach bevorzugter Bezeichnung) waren sowohl in der TOBI Podhaler- als auch der TOBI-Behandlungsgruppe Husten und pulmonale Störungen.
Während des Placebo-kontrollierten Zyklus der EVOLVE-Studie war die Inzidenz unerwünschter Arzneimittelreaktionen in der TOBI Podhaler-Behandlungsgruppe insgesamt niedriger als in der Placebo-Gruppe, mit Ausnahme von pharyngo-laryngealem Schmerz, Dysphonie und Dysgeusie.
In der EVOLVE-Studie berichteten keine Patienten von Nebenwirkungen im Zusammenhang mit Hörbeschwerden. Bei zwei Patienten wurde bei geplanten Hörtests eine signifikant verminderte Hörfähigkeit festgestellt (definiert als 10–15 dB bei mindestens zwei aufeinander folgenden Frequenzen oder 20 dB oder mehr bei einer einzelnen Frequenz).
In der EAGER-Studie wurden Hörstörungen wie Tinnitus von ungefähr 2% der Patienten berichtet. In einer Untergruppe von Patienten in der EAGER-Studie mit einer Serie audiometrischer Tests zeigte sich an mindestens 1 Studientermin bei 25,6% der Patienten unter TOBI Podhaler und 15,6% derjenigen unter TOBI eine Abnahme gegenüber dem Ausgangswert (80% der Untergruppe hatten bei der Untersuchung des Hörvermögens einen normalen Ausgangswert). Die Mehrzahl derartiger Veränderungen war jedoch vorübergehend und hatte sich bis zum Ende der Studie normalisiert. Bei vier Patienten in der TOBI Podhaler-Behandlungsgruppe kam es zu einer relevanten Abnahme des Hörvermögens, die bei drei Patienten vorübergehend war und in einem Fall persistierte. Eine signifikante Minderung des Hörvermögens trat bei weniger als 3% der Patienten in jeder der beiden Behandlungsgruppen auf. Anhand des Kriteriums einer einseitigen Hörminderung um 10 dB bei 3 aufeinanderfolgenden Frequenzen oder 15 dB bei 2 aufeinanderfolgenden Frequenzen oder 20 dB bei einer beliebigen Frequenz fand sich eine Ototoxizität bei 3 TOBI Podhaler- und 2 TOBI-Patienten, was dem Randomisierungsverhältnis entspricht.
Husten ist ein häufiges Symptom bei zystischer Fibrose und wurde von 42% der Patienten zu Beginn (Basislinie) der EAGER-Studie berichtet. In beiden klinischen Studien war Husten das am häufigsten berichtete unerwünschte Ereignis. Bemerkenswerterweise war die Häufigkeit von Bronchospasmus in den TOBI Podhaler-, TOBI- und Placebo-Behandlungsgruppen ähnlich. In der EVOLVE-Studie trat Husten bei den Placebo-behandelten Patienten häufiger auf (26,5%) als mit TOBI Podhaler (13%), während in der EAGER-Studie ein grösserer Prozentsatz (48%) der Patienten mit TOBI Podhaler-Behandlung als derjenigen mit TOBI (31%) Husten berichtete. [5] 12 Patienten (4%) unter Behandlung mit TOBI Podhaler haben wegen Husten-Episoden die EAGER-Studie unterbrochen; bei fünf dieser Patienten war der Husten ein isoliertes unerwünschtes Ereignis, im Vergleich zu zwei Patienten (1%) in der TOBI-Behandlungsgruppe. Husten unter TOBI Podhaler war in jedem der drei Behandlungszyklen während der Behandlungsphase häufiger.
Tabellarische Zusammenfassung der unerwünschten Arzneimittelwirkungen in klinischen Studien
Die unerwünschten Arzneimittelwirkungen in den EAGER-Studien, siehe Tabelle 1, sind nach der MedDRA System-Organ-Klasse aufgeführt. Die Nennung der unerwünschten Arzneimittelwirkungen in jeder System-Organ-Klasse erfolgt in der Reihenfolge ihrer Häufigkeit mit den häufigsten unerwünschten Wirkungen zuerst, und nach der Datenbank. Innerhalb jeder Häufigkeitsgruppierung wird die Reihenfolge der unerwünschten Wirkungen von der absteigenden Häufigkeit bestimmt. Zusätzlich wird für jede unerwünschte Wirkung auch die Häufigkeitskategorie gemäss folgender Konvention (CIOMS III) angegeben: «sehr häufig» (≥1/10); «häufig» (≥1/100, <1/10); «gelegentlich» (≥1/1000, <1/100); «selten» (≥1/10'000, <1/1000); «sehr selten» (<1/10'000) einschliesslich Einzelmeldungen.
Tabelle 1: Unerwünschte Arzneimittelwirkungen bei ≥2% der TOBI Podhaler-Patienten in der EAGER-Studie (TOBI Podhaler im Vergleich zu TOBI, offene Studie), Sicherheitspopulation aller randomisierten Patienten)
|
System-Organ-Klasse / bevorzugte Bezeichnung nach MedDRA
|
TOBI Podhaler
(n = 308)
% Patienten
|
TOBI
(n = 209)
% Patienten
|
Häufigkeits-kategorie
| |
Infektionen und parasitäre Erkrankungen
| |
Infektion der oberen Atemwege
|
6,8
|
8,6
|
Häufig
| |
Erkrankungen des Nervensystems
| |
Kopfschmerzen
|
11,4
|
12,0
|
Sehr häufig
| |
Erkrankungen des Ohrs und des Labyrinths
| |
Tinnitus
|
1,9
|
2,4
|
Häufig
| |
Taubheit einschliesslich einseitiger Ertaubung (berichtet als leichte bis mässige Hörminderung oder Verschlimmerung einer bestehenden Hörminderung)
|
1,0
|
0,5
|
Häufig
| |
Gefässerkrankungen
| |
Epistaxis
|
2,6
|
1,9
|
Häufig
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
| |
Husten
|
48,4
|
31,1
|
Sehr häufig
| |
Pulmonale Störungen
|
33,8
|
30,1
|
Sehr häufig
| |
Produktiver Husten
|
18,2
|
19,6
|
Sehr häufig
| |
Dyspnoe
|
15,6
|
12,4
|
Sehr häufig
| |
Oropharyngealer Schmerz
|
14,0
|
10,5
|
Sehr häufig
| |
Dysphonie
|
13,6
|
3,8
|
Sehr häufig
| |
Hämoptyse
|
13,0
|
12,4
|
Sehr häufig
| |
Verstopfte Nase
|
8,1
|
7,2
|
Häufig
| |
Rasselgeräusche
|
7,1
|
6,2
|
Häufig
| |
Keuchen
|
6,8
|
6,2
|
Häufig
| |
Unbehagen im Thorax
|
6,5
|
2,9
|
Häufig
| |
Reizung des Rachens
|
4,5
|
1,9
|
Häufig
| |
Bronchospasmus
|
1,6
|
0,5
|
Häufig
| |
Aphonie
|
1,0
|
0
|
Häufig
| |
Erkrankungen des Gastrointestinaltrakts
| |
Übelkeit
|
7,5
|
9,6
|
Häufig
| |
Erbrechen
|
6,2
|
5,7
|
Häufig
| |
Diarrhoe
|
4,2
|
1,9
|
Häufig
| |
Dysgeusie
|
3,9
|
0,5
|
Häufig
| |
Erkrankungen der Haut und des Unterhautgewebes
| |
Hautausschlag
|
2,3
|
2,4
|
Häufig
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
| |
Muskuloskelettaler Thoraxschmerz
|
4,5
|
4,8
|
Häufig
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
| |
Fieber
|
15,6
|
12,4
|
Sehr häufig
| |
Untersuchungen
| |
Verschlechterung des Lungenfunktionstestes
|
6,8
|
8,1
|
Häufig
| |
Vermindertes forciertes exspiratorisches Volumen
|
3,9
|
1,0
|
Häufig
| |
Erhöhter Blutzucker
|
2,9
|
0,5
|
Häufig
|
Ereignisse in allen Behandlungszyklen mit und ohne Therapie.
Zu den unerwünschten Arzneimittelwirkungen im Placebo-kontrollierten Zyklus 1 der EVOLVE-Studie mit 46 TOBI Podhaler- und 49 Placebo-behandelten Patienten gehörten: pharyngo-laryngealer Schmerz (10,9% TOBI Podhaler und 0% Placebo, sehr häufig) und Dysphonie (4,3% TOBI Podhaler und 0% Placebo, häufig) in der System-Organ-Klasse (SOC) Erkrankungen der Atemwege, des Brustraums und Mediastinums und Dysgeusie (6,5% TOBI Podhaler und 2,0% Placebo, häufig) in der SOC Erkrankungen des Gastrointestinaltrakts.
Unerwünschte Arzneimittelnebenwirkungen aus Spontanberichten und Fällen aus der Literatur (Häufigkeit nicht bekannt)
Die folgenden unerwünschten Arzneimittelnebenwirkungen wurden Erfahrungen mit dem TOBI Podhaler nach Markteinführung mittels spontaner Fallberichte und Fällen aus der Literatur entnommen. Da diese Wirkungen aus einer Population von unbekannter Grösse berichtet wurden, ist es nicht möglich, ihre Häufigkeit zuverlässig zu schätzen. Diese wird daher als nicht bekannt klassifiziert.
Malaise (Unwohlsein), verfärbtes Sputum.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie maximal tolerierte Tagesdosis von TOBI Podhaler ist nicht bekannt. Die Bestimmung des Tobramycin-Serumspiegels kann für die Überwachung bei Überdosierung nützlich sein.
Die akute Toxizität erfordert das sofortige Absetzen von TOBI Podhaler und Tests der Nierenfunktion zum Ausgangszeitpunkt (Baseline).
Im Falle der versehentlichen Einnahme von TOBI Podhaler-Kapseln sind toxische Erscheinungen wenig wahrscheinlich, da Tobramycin von einem intakten Verdauungstrakt kaum resorbiert wird.
Hämodialyse kann für die Elimination von Tobramycin aus dem Körper hilfreich sein.
Eigenschaften/WirkungenATC-Code
J01GB01
Wirkungsmechanismus
Tobramycin ist ein von Streptomyces tenebrarius produziertes Aminoglykosid-Antibiotikum. Es wirkt primär durch Unterbrechen der Proteinsynthese, was zu veränderter Permeabilität der Zellmembran, fortschreitender Zerstörung der Zellhülle und schliesslich zum Zelltod führt. Es ist bei Konzentrationen bakterizid, die der hemmenden Konzentration entsprechen oder wenig darüber liegen.
Pharmakodynamik
Pharmakodynamische Eigenschaften – Mikrobiologie
In der EAGER-Studie charakterisierte man die Verteilung der minimalen Hemmkonzentration (MHK) von Tobramycin für Isolate von P. aeruginosa nach folgenden Biotypen: mucoid, trocken, Varianten mit kleinen Kolonien und insgesamt. Die Beurteilung des Sputums in dieser Studie zeigte, dass beim Ausgangswert 91% der TOBI Podhaler-Patienten P. aeruginosa-Isolate mit einer MHK hatten, die mindestens 20mal geringer war als die innerhalb von 30 Minuten nach der Inhalation beobachtete mittlere Sputumkonzentration. Am Ende des dritten 28-tägigen Behandlungszyklus war die MHK der P. aeruginosa–Isolate bei 86% der TOBI Podhaler-Patienten mindestens 30mal geringer und bei 89% der TOBI Podhaler-Patienten mindestens 15mal geringer als die innerhalb von 30 Minuten nach der Applikation beobachtete mittlere Konzentration im Sputum.
In zwei klinischen Studien hatte die Behandlung mit TOBI Podhaler während 25 Wochen keinen Einfluss auf die Empfindlichkeit der Mehrzahl der untersuchten Isolate von P. aeruginosa. Für die meisten Proben lag die MHK für Tobramycin zwischen 0,5 µg/ml und 8 µg/ml. In der EAGER-Studie zeigte sich unter Behandlung mit TOBI Podhaler keine relevante Verschiebung der Verteilung der MHK für die Summe aller Biotypen von P. aeruginosa. Die Verteilung der MHK blieb für die mucoiden Isolate nahezu identisch beim Ausgangswert, und nach 25 Wochen Behandlung sowie für die trockenen Biotypen gab es eine geringe Verschiebung, die unter dem üblichen Resistenz-Schwellenwert von 8 µg/ml bei systemischer Exposition blieb. Die maximale MHK aller Biotypen sowohl in den TOBI Podhaler- als auch in den TOBI-Behandlungsgruppen blieb für jeden Biotyp während der Dauer der Studie relativ konstant.
Die klinische Bedeutung von Änderungen der MHK für P. aeruginosa bei der Behandlung von Patienten mit zystischer Fibrose ist noch unklar. Klinischen Studien zufolge schliesst eine mikrobiologisch ermittelte In-vitro-Resistenz gegen das Antibiotikum einen klinischen Nutzen für den Patienten nicht unbedingt aus. In der EAGER-Studie zeigte die Untergruppe der Patienten mit einem MHK-Ausgangswert >8 µg/ml nach 3 Behandlungszyklen mit TOBI Podhaler eine Verbesserung der Messwerte der vorausgesagten FEV1 in %.
Empfindlichkeitstests
Die für eine parenterale Therapie mit Tobramycin verwendeten In-vitro-Testmethoden der antimikrobiellen Empfindlichkeit können zur Überwachung der aus Patienten mit zystischer Fibrose isolierten Stämme von P. aeruginosa herangezogen werden. Die für die parenterale Applikation von Tobramycin ermittelten Empfindlichkeitsschwellen gelten nicht für inhaliertes Tobramycin (s. «Eigenschaften/Wirkungen», Klinische Studien).
Klinische Wirksamkeit
Klinische Studien
Das klinische Entwicklungsprogramm der Phase III umfasste zwei Studien mit 612 randomisierten, mit der Studienmedikation behandelten Patienten mit einer klinischen CF-Diagnose, die wie folgt bestätigt wurde: quantitativer iontophoretischer Schweisschlorid-Test mit Pilocarpin oder gut charakterisierte Krankheit mit Mutationen in jedem CFTR-Gen oder anomale nasale transepitheliale Potenzialdifferenz, wie sie für CF charakteristisch ist.
Alle Patienten waren ≥6 Jahre alt und hatten beim Screening einen FEV1 von ≥25% und ≤80% des vorausgesagten Normalwerts in Abhängigkeit von Alter, Geschlecht und Grösse nach den Knudson-Kriterien. Zusätzlich waren alle Patienten mit P. aeruginosa infiziert, was man mit einer positiven Sputum- oder Rachenabstrich-Kultur (oder aus bronchoalveolärer Lavage) innerhalb von 6 Monaten vor dem Screening und mit einer Sputumkultur am Screening-Termin nachwies. Unter den 395 mit TOBI Podhaler behandelten Patienten waren beide Geschlechter beinahe gleich vertreten, ebenso Patienten unter und solche über 20 Jahren. Die Patienten hatten als Ausgangswert ein mittleres FEV1 von 54% des vorausgesagten Normalwerts.
Die folgenden gesundheitlichen Auswirkungen wurden nachgewiesen:
In einer randomisierten doppelblinden placebokontrollierten multizentrischen Studie (EVOLVE) wurden 112 mg TOBI Podhaler zweimal täglich (jeden Morgen und Abend zur gleichen Zeit) appliziert, dies während drei Zyklen mit 28 Tagen Behandlung und 28 Tagen ohne Behandlung (gesamte Behandlungsdauer 24 Wochen). Alle Patienten waren unter 22 Jahre alt (Durchschnittsalter 13,3 Jahre) und hatten in den 4 Monaten vor dem Screening keine inhalierten Anti-Pseudomonas-Antibiotika erhalten; 55,8% waren weiblich und 84,2% kaukasisch. Patienten, die randomisiert der Behandlung mit Placebo zugeteilt wurden, erhielten dieses im ersten Behandlungszyklus und TOBI Podhaler in den nachfolgenden zwei Zyklen.
TOBI Podhaler verbesserte im Vergleich zu Placebo die Lungenfunktion signifikant, was sich als relative Zunahme der Prozent des vorausgesagten FEV1 nach 28 Behandlungstagen zeigte (s. Abbildung 1). Die im ersten Behandlungszyklus erzielte Verbesserung der Lungenfunktion blieb in den nachfolgenden Behandlungszyklen mit TOBI Podhaler erhalten. Als die Patienten in der Placebogruppe zu Beginn des zweiten Behandlungszyklus auf TOBI Podhaler umgestellt wurden, war die relative Änderung in Prozent des vorausgesagten FEV1 gegenüber dem Ausgangswert gleich gross wie im ersten Behandlungszyklus in der TOBI Podhaler-Behandlungsgruppe und die Besserung blieb auch im zeitlichen Verlauf während des dritten Behandlungszyklus erhalten.
Figur 1: EVOLVE-Studie: Relative Änderung in Prozent des vorausgesagten FEV1 in den Zyklen 1-3 gegenüber Ausgangswert (mit und ohne Behandlung), aufgeschlüsselt nach Behandlungsgruppe (gesamte ITT-Population).

Vertikale Balken bezeichnen das 95%-Vertrauensintervall.
Phasen ohne Behandlung: Woche 5 bis 9, Woche 13 bis 17 und Woche 21 bis 25
Die x-Achse ist zwischen den Wochen 1 und 5 nicht linear.
In einer zweiten offenen multizentrischen Studie (EAGER) erhielten die Patienten entweder TOBI Podhaler 112 mg oder TOBI 300 mg zweimal täglich (jeden Morgen und Abend zur gleichen Zeit) während drei Zyklen zu 28 Tagen mit Behandlung und 28 Tagen ohne Behandlung (gesamte Behandlungsdauer 24 Wochen). Die Patienten waren vorwiegend im Alter ≥20 Jahre (einschliesslich vier über 60-jährige Patienten) und hatten in den 28 Tagen vor der Studienmedikation kein Anti-Pseudomonas-Antibiotikum inhaliert; 90% waren kaukasisch und 55% männlich.
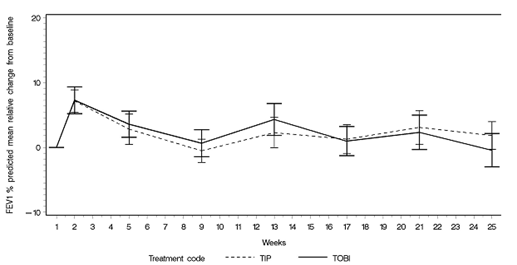
Sowohl die Behandlung mit TOBI Podhaler als auch mit TOBI bewirkte eine relative Zunahme in Prozent des vorausgesagten FEV1 gegenüber dem Ausgangswert bis zum Tag 28 des dritten Behandlungszyklus, und zwar um 5,8% bzw. 4,7% (s. Abbildung 2). Die Verbesserung in Prozent des vorausgesagten FEV1 war in der TOBI Podhaler-Behandlungsgruppe zahlenmässig grösser und statistisch gegenüber TOBI nicht unterlegen. Die Verbesserung der Lungenfunktion war zwar in dieser Studie geringer, doch lässt sich dies mit der früheren Behandlung dieser Patientenpopulation mit inhaliertem Tobramycin erklären.
Figur 2: EAGER-Studie: Relative Änderung in Prozent des vorausgesagten FEV1 gegenüber Ausgangswert in den Zyklen 1-3 (ITT-Population)
Hinsichtlich Unterdrückung der Infektion mit Pseudomonas aeruginosa (P. aeruginosa) zeigte sich in beiden Studien eine verminderte Dichte von P. aeruginosa im Sputum unter TOBI Podhaler (siehe folgende zwei Abbildungen). Die Behandlung mit TOBI Podhaler während 28 Tagen führte zu einer statistisch signifikanten Reduktion der Dichte von P. aeruginosa im Sputum (log10 CFUs) im Vergleich zu Placebo (mittlere Differenz nach der Methode der kleinsten Quadrate = 2,70, 95% CI: -3,60, -1,79, p <0,001), wobei man die grösste Differenz am Tag 28 der Behandlung beobachtete. Nach der Umstellung der Patienten von Placebo auf TOBI Podhaler waren die Ergebnisse für beide Behandlungsgruppen im Allgemeinen ähnlich, mit einem Trend zum Wiederanstieg der Dichte von P. aeruginosa nach 28 Tagen ohne Behandlung, und einer Trendumkehr nach weiteren 28 Tagen mit Behandlung.
Figur 3: Vergleich der Behandlungsgruppen: Änderung der Dichte von P. aeruginosa im Sputum (log10 CFUs) gegenüber Ausgangswert – EVOLVE-Studie (ITT-Population)

Die vertikalen Balken repräsentieren das 95%-Vertrauensintervall. Verwendet wird die Dichte insgesamt, definiert als Summe der Biotypen (mucoid, trocken und Variante mit kleinen Kolonien).
In der EAGER-Studie gab es eine stärkere Abnahme der mittleren Änderung gegenüber dem Ausgangswert der log10 CFUs in der Behandlungsgruppe mit TOBI Podhaler im Vergleich zu TOBI, insbesondere im dritten Behandlungszyklus (mittlere Änderung -1,61 log10 CFUs in der TOBI Podhaler-Behandlungsgruppe im Vergleich zu -0,77 log10 CFUs in der TOBI-Gruppe) (s. Abbildung 4). Wie in der vorhergehenden Studie kam es zum teilweisen Wiederanstieg der Dichte von P. aeruginosa am Ende der 28-tägigen Phase ohne Behandlung in beiden Behandlungsgruppen, doch folgte eine Trendumkehr während der Behandlungsphase eines jeden Zyklus.
Figur 4: Vergleich der Behandlungen: Änderung der Sputumdichte (log10 CFUs) von P aeruginosa – EAGER-Studie (ITT-Population)

In beiden klinischen Studien beobachtete man bis zum Ende der Behandlungsperiode negative Änderungen gegenüber dem Ausgangswert der maximalen MHK von Tobramycin für jeden Biotyp von P. aeruginosa. Im Allgemeinen zeigte ein höherer Prozentsatz von TOBI Podhaler-behandelten Patienten eine Zunahme der MHK von Tobramycin als eine Abnahme. Trotzdem gab es im Vergleich zu Placebo eine ≥2-fache Abnahme der MHK von Tobramycin nach 25 Wochen bei anteilsmässig ungefähr halb so viel TOBI Podhaler-behandelten Patienten (40,5% der Patienten unter Placebo und 20,0% unter TOBI Podhaler-Behandlung).
Der Prozentsatz Patienten mit Anti-Pseudomonas-Antibiotika im Zyklus 1 war in der Placebo-Behandlungsgruppe grösser (20,4%) als in der TOBI Podhaler-Behandlungsgruppe (13,0%), zudem wurden diese Antibiotika in der Placebo-Gruppe länger angewendet (18,2 Tage) als in der TOBI Podhaler-Gruppe (13,3 Tage). Im Zyklus 1 wurde kein Patient in der TOBI Podhaler-Behandlungsgruppe, aber 6 Patienten (12,2%) in der Placebo-Gruppe wegen Atemwegserkrankung hospitalisiert, mit einer durchschnittlichen Hospitalisierungsdauer von 12,3 Tagen. In der EAGER-Studie benötigte mehr als die Hälfte der Patienten sowohl in der TOBI Podhaler- als auch in der TOBI-Behandlungsgruppe (64,9% bzw. 54,5%) neue anti-Pseudomonas-Antibiotika im Verlauf der drei Behandlungszyklen und die Anwendungsdauer (30,9 bzw. 33,4 Tage) war in beiden Behandlungsgruppen ähnlich. Ein ähnlicher Anteil Patienten in der TOBI Podhaler- und TOBI-Behandlungsgruppe wurde wegen respiratorischer Symptome hospitalisiert (24,4% bzw. 22,0%) und die Dauer der Hospitalisierungen (15,6 bzw. 15,3 Tage) war ebenfalls ähnlich.
Begleitmedikation
In beiden klinischen Studien erhielten über 90% der Patienten eine Begleittherapie für Indikationen im Zusammenhang mit CF. Wie anhand der Krankheitsmerkmale bei Aufnahme in die Studie zu erwarten und im Einklang mit der rekrutierten CF-Patientenpopulation in dieser Studie gehörten zu den meistverwendeten Begleitmedikationen Enzympräparate, Mukolytika – insbesondere Dornase alfa - und selektive β2-adrenerge Agonisten. Zusätzlich hatten die meisten Patienten in der Vergangenheit anti-pseudomonale Antibiotika und Makrolide erhalten. Die meist verwendeten Wirkstoffe (alle Anwendungsarten) waren Tobramycin (nur EAGER-Studie), Azithromycin, Ciprofloxacin und Ceftazidim.
PharmakokinetikAbsorption
Es ist anzunehmen, dass die systemische Tobramycin-Exposition nach der Inhalation von TOBI Podhaler aus der pulmonalen Resorption des in die Lunge gelangten Dosis-Anteils resultiert, weil Tobramycin nach oraler Aufnahme nicht nennenswert resorbiert wird.
Serumspiegel: Die systemische Exposition mit Tobramycin wurde bei TOBI Podhaler nach Inhalation einer Einzeldosis von 112 mg (4 x 28 mg Kapseln) und bei TOBI nach Inhalation einer Einzeldosis von 300 mg in einer Phase I Studie untersucht. Der Vergleich zeigte ähnliche Resultate. Die mittlere Dauer bis zum Erreichen des maximalen Serumspiegels (Tmax) betrug bei TOBI Podhaler wie auch bei TOBI 1 Stunde. Bei Patienten, welche eine TOBI Podhaler-Einzeldosis zu 112 mg erhielten, betrug die Cmax 1,02 ± 0,53 μg/ml (Mittelwert ± Standardabweichung), bei denjenigen die 300 mg TOBI erhielten betrug sie 1,04 ± 0,58 µg/ml [3,28]. Das Ausmass der systemischen Exposition (AUC0,∞) war für die TOBI Podhaler-Dosis zu 112 mg und die TOBI-Dosis zu 300 mg ebenfalls ähnlich (5,3 ± 2,6 vs 5,1 ± 2 µg h/ml).
In einer anderen Studie wurden Patienten über 3 Behandlungszyklen mit dem empfohlenen Dosierungsschema behandelt. Am Ende des ersten 4-wöchigen Behandlungszyklus betrug der Tobramycin-Serumspiegel 0-2 Stunden nach der Inhalation mit TOBI Podhaler (112 mg zweimal täglich) 1,39 ± 0,8 µg/ml (Durchschnittswert ± Standardabweichung) und unter TOBI (300 mg 2x täglich) 1,18 ± 0,72 µg/ml; der minimale Tobramycin-Serumspiegel vor der nächsten Inhalation mit TOBI Podhaler betrug am Ende des Zyklus 0,47 ± 0,73 µg/ml und unter TOBI 0,21 ± 0,15 µg/ml.
Konzentration im Sputum: In der bereits erwähnten Studie von Geller wurde auch die Konzentration im Sputum gemessen (Geller et al., 2007). Nach Inhalation einer TOBI Podhaler-Einzeldosis zu 112 mg (4 x 28 mg Kapseln) war Cmax von Tobramycin im Sputum 1048 ± 1080 µg/g (Mittelwert ± Standardabweichung). Dem gegenüber betrug Cmax im Sputum nach Inhalation einer 300-mg-Einzeldosis von TOBI (aktive Kontrolle) 737,3 ± 1028,4 µg/g [3,28]. Die Variabilität der pharmakokinetischen Parameter war im Sputum grösser als im Serum.
Distribution
Eine populationspharmakokinetische Analyse für TOBI Podhaler bei Patienten mit zystischer Fibrose schätzte das apparente Verteilungsvolumen von Tobramycin im zentralen Kompartiment auf 84,1 l für einen typischen CF-Patienten. Es wurde zwar eine Änderung des Volumens in Abhängigkeit von BMI (body mass index) und Lungenfunktion (als vorausgesagte FEV1 in %) nachgewiesen, doch zeigten Simulationen auf der Basis eines Modells, dass Änderungen des BMI oder der Lungenfunktion keinen ausgeprägten Einfluss auf die maximalen (Cmax) und minimalen (Ctrough) Konzentrationen hatten.
Die Bindung von Tobramycin an Serumproteine ist zu vernachlässigen.
Metabolismus
Tobramycin wird kaum metabolisiert und vorwiegend unverändert im Urin ausgeschieden.
Elimination
Die Elimination von Tobramycin aus der systemischen Zirkulation erfolgt primär durch glomeruläre Filtration des unveränderten Moleküls.
Die apparente terminale Halbwertszeit von Tobramycin im Serum nach der Inhalation einer TOBI Podhaler-Einzeldosis zu 112 mg betrug bei Patienten mit zystischer Fibrose ungefähr 3 Stunden und stimmte mit der Halbwertszeit von Tobramycin nach der Inhalation von TOBI überein.
Eine populationspharmakokinetische Analyse für TOBI Podhaler bei CF-Patienten im Alter von 6 bis 66 Jahren ergab eine geschätzte apparente Tobramycin-Serumclearance von 14 l/h. Diese Analyse zeigte keine geschlechts- oder altersbedingten Unterschiede der Pharmakokinetik.
Präklinische DatenGemäss präklinischen Daten aus Untersuchungen zur Sicherheitspharmakologie, Toxizität nach wiederholter Anwendung, Genotoxizität und reproduktiven Toxizität besteht die Hauptgefahr für den Menschen in Nieren- und Ototoxizität. Im Allgemeinen beobachtet man eine Toxizität bei höheren systemischen Tobramycin-Spiegeln als sie bei der Inhalation mit der klinisch empfohlenen Dosis erreichbar ist.
Präklinische Untersuchungen mit inhaliertem Tobramycin zum karzinogenen Potential ergaben keine eindeutigen Hinweise auf besondere Risiken für den Menschen.
Es wurden keine Studien zur reproduktiven Toxizität mit inhalativ verabreichtem Tobramycin durchgeführt. Die subkutane Applikation von Tobramycin in einer Dosierung bis zu 100 mg/kg/Tag bei der Ratte oder 20 mg/kg/Tag beim Kaninchen während der Organogenese war jedoch nicht teratogen. Eine Tobramycin-Dosis ≥40 mg/kg/Tag war beim Kaninchen-Muttertier hochtoxisch (Nephrotoxizität mit spontanen Aborten und Tod) und verunmöglichte die Beurteilung der Teratogenität. Aufgrund der verfügbaren Daten aus Tierversuchen kann ein Toxizitätsrisiko (z.B. Ototoxizität) bei pränatalen Expositionskonzentrationen nicht ausgeschlossen werden.
Die subkutane Verabreichung von bis zu 100 mg/kg Tobramycin hatte keinen Einfluss auf das Paarungsverhalten und beeinträchtigte die Fertilität männlicher oder weiblicher Ratten nicht.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalpackung nicht über 30 °C und vor Feuchtigkeit geschützt lagern. Wenn der Inhalator nicht verwendet wird, ist er in seinem dicht verschlossenen Behälter zu lagern.
TOBI Podhaler ausser Reichweite von Kindern aufbewahren, ausser zur therapeutischen Anwendung unter adäquater Beaufsichtigung durch eine erwachsene Person.
Hinweise für die Handhabung
Nur der T-326 Inhalator darf mit TOBI Podhaler-Kapseln verwendet werden; er eignet sich für kein anderes Medikament als TOBI Podhaler.
Jede Wochenpackung enthält sieben Kapsel-Karten (entsprechend den sieben Wochentagen) und jede Kapsel-Karte enthält acht Kapseln (entsprechend einer Tagesdosis, nämlich 4 Kapseln morgens und 4 Kapseln abends).
Die TOBI Podhaler-Kapseln sind immer in der Kapsel-Karte aufzubewahren und erst unmittelbar vor der Anwendung zu entnehmen. Jeder T-326 Inhalator und sein Behälter werden sieben Tage lang verwendet und dann entsorgt und ersetzt.
Die grundlegende Gebrauchsanweisung finden Sie nachfolgend:
1.Hände waschen und gut trocknen.
2.Nehmen Sie unmittelbar vor der Anwendung den T-326 Inhalator aus seinem Behälter, indem sie den Boden des Behälters festhalten und den Deckel gegen den Uhrzeigersinn abdrehen. Legen Sie den Deckel des Behälters beiseite und inspizieren Sie kurz den Inhalator auf Beschädigung oder Schmutz. Stellen Sie dann den Inhalator in der Basis des Behälters auf.
3.Halten Sie den Inhalatorkörper fest, schrauben Sie das Mundstück ab und legen Sie es auf einer sauberen trockenen Fläche ab.
4.Trennen Sie die beiden Hälften der Kapsel-Karte mit den Kapseln für den Morgen und für den Abend. Ziehen Sie die Folie so weit von der Kapsel-Karte ab, bis eine TOBI Podhaler-Kapsel zu sehen ist. Entnehmen Sie die Kapsel aus der Karte.
5.Führen Sie die Kapsel sofort in die Inhalatorkammer ein. Setzen Sie das Mundstück wieder auf und schrauben Sie es bis zum Anschlag fest. Zu starkes Anschrauben ist zu vermeiden.
6.Zum Anstechen der Kapsel halten Sie den Inhalator mit dem Mundstück nach unten, drücken den Knopf mit dem Daumen bis zum Anschlag und lassen dann den Knopf los. Nun ist das Arzneimittel zur Inhalation bereit.
7.Atmen Sie vom Inhalator abgewendet vollständig aus.
8.Halten Sie den Inhalator mit dem Mundstück auf sich zugerichtet. Umschliessen Sie das Mundstück dicht mit dem Mund. Atmen Sie das Pulver mit einer einzigen ununterbrochenen Inhalation tief ein.
9.Nehmen Sie den Inhalator vom Mund weg und halten Sie etwa fünf Sekunden lang den Atem an. Atmen Sie dann vom Inhalator abgewendet normal aus.
10.Nach einigen normalen Atemzügen inhalieren Sie ein zweites Mal aus derselben Kapsel, wozu Sie die obigen Schritte 7, 8 und 9 wiederholen.
11.Schrauben Sie das Mundstück ab und nehmen Sie die Kapsel aus der Kammer.
12.Inspizieren Sie die gebrauchte Kapsel. Sie sollte angestochen und leer erscheinen.• Wenn die Kapsel zwar angestochen ist, aber noch etwas Pulver enthält, legen Sie die Kapsel mit der angestochenen Seite voraus in die Kammer zurück, setzen das Mundstück wieder auf und inhalieren noch zweimal aus der Kapsel (Wiederholung der Schritte 5, dann Schritte 7 bis 11). Inspizieren Sie die Kapsel nochmals.• Wenn die Kapsel nicht angestochen erscheint, legen Sie sie in die Kammer zurück, setzen das Mundstück wieder auf, drücken bis zum Anschlag auf den Knopf und inhalieren noch zweimal aus der Kapsel (Wiederholung der Schritte 5 bis 11). Wenn danach die Kapsel immer noch voll ist und nicht angestochen erscheint, ersetzen Sie den Inhalator durch den Reserve-Inhalator und versuchen es nochmals (Schritte 2, 3 und 5 bis 11 wiederholen).
13.Die leere Kapsel entsorgen.
14.Wiederholen Sie den Vorgang ab Schritt 4 mit den drei übrigen Kapseln der Dosis.
15.Setzen Sie das Mundstück wieder auf und schrauben Sie es bis zum Anschlag fest. Nach dem Inhalieren der vollen Dosis (4 Kapseln) wischen Sie das Mundstück mit einem trockenen sauberen Tuch ab.
16.Legen Sie den Inhalator in den Aufbewahrungsbehälter zurück und schliessen Sie diesen dicht ab. Den Inhalator nie mit Wasser abwaschen.
Siehe auch «Dosierung/Anwendung».
Pflegepersonen sollten Kindern, die eine Behandlung mit dem TOBI Podhaler beginnen, Hilfe leisten, insbesondere Kindern im Alter bis zu 10 Jahren, und sie überwachen, bis sie in der Lage sind, den Podhaler-Inhalator ordnungsgemäss und ohne Hilfe zu benutzen.
Zulassungsnummer60565 (Swissmedic).
PackungenDer TOBI Podhaler-Inhalator und sein Aufbewahrungsbehälter sind aus Kunststoff hergestellt.
TOBI Podhaler wird in Monatspackungen geliefert, die 4 Wochenkartons und einen Reserve-Inhalator in dessen Aufbewahrungsbehälter, enthalten. Jeder Wochenkarton enthält 56 x 28 mg Kapseln (7 Blisterstreifen mit 8 Kapseln pro Streifen), und einen TOBI Podhaler-Inhalator in seinem Aufbewahrungsbehälter.
Packungsgrössen
Packungen zu 224 (4 x 56) Kapseln und 5 Inhalatoren (Monatsmultipackung). [A]
ZulassungsinhaberinViatris Pharma GmbH, 6312 Steinhausen.
Stand der InformationJuli 2023.
Version 103 D
|





