ZusammensetzungWirkstoffe
Insulinum Aspartum 100 E/ml; gentechnologisch hergestelltes kurzwirksames Humaninsulin-Analog (B28 Asp) aus Saccharomyces cerevisiae.
Hilfsstoffe
Glycerolum, Zinci chloridum, Natrii chloridum, Dinatrii phosphas dihydricus, Phenolum, Metacresolum, Acidum hydrochloridum (zur pH Einstellung), Natrii hydroxidum (zur pH Einstellung), Aqua ad iniectabilia pro 1 mL.
Die Injektionslösung enthält 3.216 mg/mL Natrium.
Indikationen/AnwendungsmöglichkeitenDiabetes mellitus, sofern eine Insulinbehandlung notwendig ist.
Dosierung/AnwendungNovoRapid ist ein schnell wirkendes Insulinanalogon.
Dosierung
Die Dosierung von NovoRapid ist individuell und wird vom Arzt bzw. von der Ärztin gemäss dem Bedarf des Patienten bestimmt. NovoRapid sollte normalerweise mit einem intermediär wirkenden oder lang wirkenden Insulin, das mindestens einmal täglich verabreicht wird, kombiniert werden.
NovoRapid kann auch zur kontinuierlichen subkutanen Insulininfusion (CSII) in Pumpensystemen angewendet werden.
Eine Überwachung des Blutzuckerspiegels und eine Anpassung der Insulindosierung werden empfohlen, um eine optimale Einstellung des Blutzuckers zu erreichen.
Der individuelle Insulinbedarf bei Erwachsenen und Kindern ab 2 Jahren liegt in der Regel zwischen 0,5 und 1,0 E/kg/Tag. Bei einem Basis-Bolus-Behandlungsschema können 50-70% des Insulinbedarfs durch, NovoRapid, der Rest von einem intermediär wirkenden oder lang wirkenden Insulin gedeckt werden.
Wenn NovoRapid zur Pumpentherapie eingesetzt wird, deckt es den Bolus- und den Basis-Insulin-Bedarf ab.
Bei erhöhter körperlicher Aktivität, einer Änderung der Ernährungsgewohnheiten oder Begleiterkrankungen kann eine Anpassung der Dosierung notwendig sein.
Umstellung von anderen Insulinprodukten auf NovoRapid
NovoRapid hat im Vergleich zu kurzwirksamem Humaninsulin einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer.
Bei subkutaner Injektion in die Bauchdecke tritt die Wirkung innerhalb von 10-20 Minuten nach der Injektion ein. Das Wirkungsmaximum ist 1 bis 3 Stunden nach der Injektion erreicht. Die Wirkungsdauer beträgt 3-5 Stunden.
Aufgrund des schnelleren Wirkungseintritts sollte NovoRapid im Allgemeinen unmittelbar vor einer Mahlzeit verabreicht werden. Falls notwendig, kann NovoRapid aber auch kurz nach der Mahlzeit injiziert werden. Unabhängig von der Injektionsstelle ist der Wirkungseintritt schneller als nach Injektion von löslichem Humaninsulin.
Wenn von einem anderen Insulinprodukt umgestellt wird, kann eine Anpassung der NovoRapid Dosis und der Dosis des Basalinsulins notwendig sein.
Anwendungshinweise
NovoRapid wird subkutan in die Bauchdecke, den Oberschenkel, den Oberarm oder in die Gesässregion injiziert. Die Einstichstelle sollte bei jeder Injektion innerhalb derselben Körperregion gewechselt werden, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren.
Wie bei anderen Insulinen variiert auch bei NovoRapid die Wirkungsdauer abhängig von Dosis, Injektionsstelle, Blutfluss, Temperatur und dem Ausmass der körperlichen Betätigung. Wie bei allen Insulinen führt die subkutane Injektion in das Unterhaut-Fettgewebe des Bauches im Vergleich zu anderen Injektionsstellen zu einer schnelleren Resorption.
Intravenöse Verabreichung
Falls notwendig, kann NovoRapid auch intravenös appliziert werden (siehe Rubrik «Hinweise für die Handhabung»). Die intravenöse Applikation darf allerdings nur durch eine medizinische Fachperson erfolgen. Die medizinische Betreuung muss dabei gewährleistet sein und zur Vermeidung einer Hypoglykämie resp. Hypokaliämie müssen die Blutwerte (Glucose- und Kaliumspiegel) eng überwacht werden.
Spezielle Dosierungsanweisungen
Nieren- oder Leberinsuffizienz kann den Insulinbedarf des Patienten reduzieren. Bei älteren Patienten und bei Patienten mit Nieren- oder Leberfunktionsstörungen soll, wie bei allen Insulinen, die Kontrolle des Blutzuckers intensiviert und die Dosierung von NovoRapid individuell angepasst werden.
Anwendung bei Kindern und Jugendlichen
Es wurden keine Studien bei Kindern unterhalb 2 Jahren durchgeführt. NovoRapid sollte in dieser Altersgruppe nur unter sorgfältiger ärztlicher Überwachung angewendet werden.
Bei Kindern kann NovoRapid dann löslichem Humaninsulin vorgezogen werden, wenn ein schneller Wirkeintritt von Vorteil sein könnte, beispielsweise bei der zeitlichen Abstimmung von Injektion und Mahlzeit.
Verwendung von Insulin-Pumpensystemen
NovoRapid kann zur kontinuierlichen subkutanen Insulininfusion (CSII) in Insulin-Pumpensystemen, die für die Insulininfusion geeignet sind, verwendet werden.
NovoRapid PumpCart ist nur für die Verwendung mit einem Insulininfusions-Pumpensystem, das für die Verwendung mit dieser Patrone geeignet ist, wie Accu-Chek Insight und YpsoPump Insulinpumpe, vorgesehen.
NovoRapid PumpCart enthält eine Packungsbeilage mit detaillierten Anwendungshinweisen, die befolgt werden müssen.
Die CSII soll in die Bauchdecke verabreicht werden. Die Infusionsstelle sollte bei jeder Anwendung gewechselt werden. Wird NovoRapid durch eine Insulininfusionspumpe verabreicht, darf es mit keinem anderen Insulin gemischt werden.
Patienten, die NovoRapid mit Hilfe von CSII verabreichen, müssen für den Fall eines Versagens des Pumpensystems ein alternatives Insulin bei sich haben.
Patienten, die CSII verwenden, müssen umfassend über den Gebrauch des Pumpensystems instruiert werden und das richtige Reservoir sowie den richtigen Schlauch für die Pumpe benutzen. Das Infusionsset (Schlauch und Nadel) muss gemäss den Anweisungen in der Bedienungsanleitung des Infusionssets gewechselt werden.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenBeim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Dies gilt besonders zu Beginn der Behandlung, bei Präparatewechsel, unregelmässigen Injektionen oder unregelmässiger Nahrungsaufnahme sowie allgemein bei nicht optimaler Stoffwechseleinstellung, wo es zu starken Blutzuckerschwankungen u.a. Hypoglykämien kommen kann. Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen. Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o.ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis bei sich haben.
Das Auslassen einer Mahlzeit oder eine nicht geplante, körperliche Anstrengung können eine Hypoglykämie verursachen.
Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist (siehe unter «Unerwünschte Wirkungen»).
Wechseln Patienten zwischen verschiedenen Insulinarten, können sich die Frühwarnsymptome einer Hypoglykämie verändern oder weniger ausgeprägt sein als dies bei ihrem vorherigen Insulin der Fall war.
Eine Folge der pharmakodynamischen Eigenschaften schnell wirksamer Insulin-Analoga besteht darin, dass nach der Injektion im Vergleich zu Humaninsulin eine Hypoglykämie rascher auftreten kann.
Bei Patienten mit deutlich gebesserter Stoffwechsellage (z.B. aufgrund einer intensiven Insulintherapie) können unter Umständen einige oder sämtliche Warnsymptome entfallen, mit denen sich eine Hypoglykämie ankündigt. Diese Patienten sind entsprechend vorzuwarnen. Bei Patienten mit schon lange bestehendem Diabetes verschwinden möglicherweise die üblichen Warnsymptome.
Alle Insulinpräparate, auch NovoRapid, verursachen eine Verschiebung von Kalium vom extrazellulären in den intrazellulären Raum, was möglicherweise zu einer Hypokaliämie führen kann. Dies kann, falls unbehandelt, zu Atemparalyse, ventrikuläre Arrhythmie und Tod führen. Somit ist bei Patienten mit einem möglichen Hypokaliämie Risiko Vorsicht geboten (z.B. Patienten, die Insulin intravenös erhalten, Patienten mit schlechter Blutzuckereinstellung und Patienten, die Medikamente erhalten, die kaliumsenkend wirken oder sensitiv auf Kaliumkonzentration im Serum sind).
NovoRapid sollte in unmittelbarer Verbindung mit einer Mahlzeit verabreicht werden. Bei Patienten, die an Begleiterkrankungen leiden oder Arzneimittel einnehmen, die möglicherweise die Absorption von Nahrung verzögern, ist der rasche Wirkungseintritt zu beachten.
β-Blocker können die üblichen Hypoglykämie-Warnsymptome abschwächen, bzw. maskieren.
Alkoholkonsum kann die Hypoglykämie-Gefahr erhöhen (Hemmung der hepatischen Glukoneogenese).
Eine nicht ausreichende Dosierung oder Unterbrechung der Behandlung kann, insbesondere bei Typ 1 Diabetes, zu Hyperglykämie führen. Die ersten Symptome einer Hyperglykämie äussern sich normalerweise allmählich über Stunden und Tage. Sie beinhalten Übelkeit, Erbrechen, Schläfrigkeit, rötliche trockene Haut, trockenen Mund, erhöhten Harndrang, Durst, Appetitlosigkeit sowie Konfusion und Koma. Ein nach Aceton riechender Atem weist auf eine diabetische Ketoazidose hin, was vor allem beim Typ-1-Diabetiker, aber auch beim Typ-2-Diabetiker vorkommen kann. Ein unbehandeltes hyperglykämisches Koma, mit oder ohne Ketoazidose, führt zum Tod.
Erkrankung der Haut und des Unterhautgewebes
Patienten müssen angewiesen werden, die Injektionsstelle regelmässig zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren. Es besteht das potenzielle Risiko einer verzögerten Insulinresorption und einer schlechteren Blutzuckerkontrolle nach Insulininjektionen an Stellen mit diesen Reaktionen. Bei einem plötzlichen Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich wurde darüber berichtet, dass dies zu Hypoglykämie führte. Nach einem Wechsel des Injektionsbereichs wird eine Überwachung des Blutzuckers empfohlen und eine Dosisanpassung der Antidiabetika kann in Erwägung gezogen werden.
Unsachgemässer Gebrauch von NovoRapid PumpCart
NovoRapid PumpCart ist nur für die Verwendung mit einem Insulininfusions-Pumpensystem, das für die Verwendung mit dieser Patrone geeignet ist, wie Accu-Chek Insight und YpsoPump Insulinpumpen, vorgesehen. Es darf nicht mit anderen Insulininjektionssystemen, die nicht für die NovoRapid PumpCart entwickelt wurden, verwendet werden (z.B. andere Insulinpumpen oder Peninjektionssysteme), da dies zu einer falschen Insulindosierung mit der Folge einer Hyper- oder Hypoglykämie führen kann.
Die Umstellung auf ein anderes Insulinpräparat soll nur unter sorgfältiger ärztlicher Kontrolle und Instruktion erfolgen. Veränderungen der Stärke, Insulinmarke, Insulinart, Insulinspezies (tierisch, human, humanes Insulinanalog) und/oder Herstellungsverfahren können eine Veränderung der Dosierung bewirken.
Es kann sein, dass Patienten, die NovoRapid anwenden, eine erhöhte Zahl täglicher Injektionen oder eine gegenüber ihrem üblichen Insulin veränderte Dosierung benötigen. Wenn eine Anpassung notwendig ist, kann diese bei der ersten Dosis oder innerhalb der ersten Wochen oder Monate erforderlich sein.
Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken (andere illegale Substanzen wurden nicht getestet; andere Interaktionen s. Rubrik «Interaktionen»).
Begleiterkrankungen, insbesondere Infektionen und fiebrige Zustände, erhöhen in der Regel den Insulinbedarf des Patienten.
Eine Nieren- oder Leberfunktionsstörung kann den Insulinbedarf des Patienten verringern.
Es liegen keine Studien mit Kindern unter 2 Jahren vor.
Bei Kindern sollte NovoRapid nur dann löslichem Humaninsulin vorgezogen werden, wenn ein schneller Wirkeintritt von Vorteil sein könnte, beispielsweise bei der zeitlichen Abstimmung von Injektion und Mahlzeit.
Wie bei jeder Insulintherapie können Reaktionen an der Injektionsstelle auftreten, wie z.B. Schmerzen, Rötungen, Juckreiz, Urtikaria, Schwellungen und Entzündungen. Das kontinuierliche Wechseln der Injektionsstelle innerhalb eines bestimmten Bereiches kann dabei helfen, diese Reaktionen zu reduzieren oder zu vermeiden. Die Reaktionen klingen gewöhnlich innerhalb weniger Tage oder Wochen wieder ab. In seltenen Fällen können Reaktionen an der Injektionsstelle das Absetzen von NovoRapid erfordern.
Kombination von NovoRapid mit Pioglitazon
Es gibt Spontanmeldungen von Herzinsuffizienz, wenn Pioglitazon in Kombination mit Insulin insbesondere Patienten mit Risikofaktoren für die Entwicklung von Herzinsuffizienz verabreicht wurde. Dies sollte beachtet werden, falls eine Behandlung mit der Kombination von Pioglitazon und NovoRapid erwogen wird. Falls die Kombination angewendet wird, sollten die Patienten hinsichtlich der Anzeichen und Symptomen von Herzinsuffizienz, Gewichtszunahme und Ödemen beobachtet werden. Pioglitazon muss beim Auftreten jeder Verschlechterung kardialer Symptome abgesetzt werden.
Als Folge einer erhöhten Insulinsensitivität kann bei der Kombination mit Pioglitazone das Hypoglykämierisiko zunehmen und eine Reduktion der Insulindosis erfordern.
Vermeidung von versehentlichen Verwechslungen/Medikationsfehlern
Die Patienten müssen angewiesen werden, vor jeder Injektion immer das Insulin-Etikett zu überprüfen, um versehentliche Verwechslungen zwischen NovoRapid und anderen Insulinprodukten zu vermeiden.
Antikörper
Die Anwendung von Insulin kann die Bildung von Insulin-Antikörpern verursachen. In seltenen Fällen kann das Vorhandensein solcher Insulin-Antikörper eine Anpassung der Insulindosis zur Korrektur der Entwicklung von Hyper- oder Hypoglykämien erforderlich machen.
NovoRapid enthält Metacresol, das in seltenen Fällen allergische Reaktionen hervorrufen kann.
Bevor der Patient in andere Zeitzonen reist, muss er sich mit seinem Arzt beraten, da dies bedeuten kann, dass er das Insulin und die Mahlzeiten zu anderen Uhrzeiten anwenden bzw. einnehmen muss.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
InteraktionenDer Glukosestoffwechsel wird von einigen Arzneimitteln beeinflusst.
1. Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitität erhöhen), die Insulinsekretion steigern, die hepatische Gluconeogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme von:
oralen Antidiabetika; Alkohol; ACE-Hemmern (z.B. Captopril und Enalapril); antiarrhytmischen Substanzen wie Disopyramid; β-Blockern und Clonidin; SSRI (insbesondere Fenfluramine); MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie, gelegentlich mit nachfolgender Hyperglykämie); Antimalariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z.B. Cotrimoxazol); Cimetidin und Ranitidin.
2. Der Insulinbedarf kann erhöht sein bei gleichzeitiger Einnahme/Anwendung der folgenden Substanzen bzw. Substanzgruppen:
Orale Kontrazeptiva und andere Oestrogen- oder Progestagen-Präparate; Korticosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive Sympathikomimetika, sowie nicht selektive wie Epinephrin); Diazoxid; Nikotinsäure und –Derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); anti-retrovirale Substanzen; immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus), atypische Antipsychotika.
3. Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw. abgeschwächt werden:
Octreotid-, Lanreotid-, Salicylsäure-Derivate, Lithium-Salze (selten).
β-Blocker können zu einer Verstärkung der Insulinresistenz aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Schwangerschaft, StillzeitSchwangerschaft
NovoRapid (Insulin Aspart) kann während der Schwangerschaft angewendet werden. Daten aus zwei randomisierten kontrollierten klinischen Studien (322 bzw. 27 exponierte Schwangerschaften, 157 bzw. 14 davon erhielten NovoRapid) lassen nicht auf Nebenwirkungen von Insulin Aspart auf die Schwangerschaft oder auf die Gesundheit des Fetus/Neugeborenen im Vergleich mit Humaninsulin schliessen (siehe unter «Eigenschaften/Wirkungen»).
Schwangeren Frauen mit Diabetes (Typ 1 Diabetes, Typ 2 Diabetes oder Gestationsdiabetes) und Frauen mit Diabetes, die eine Schwangerschaft planen, wird während der gesamten Schwangerschaft eine intensivierte Blutzuckereinstellung und eine engmaschige Blutzuckerkontrolle empfohlen.
Sowohl Hypoglykämie als auch Hyperglykämie, die bei einer nicht ausreichend kontrollierten Diabetestherapie auftreten können, erhöhen das Risiko von Missbildungen und Fruchttod in utero. Daher sollten Frauen, die an Diabetes erkrankt sind und eine Schwangerschaft planen bzw. bereits schwanger sind, intensiver überwacht werden.
Im ersten Trimenon fällt gewöhnlich der Insulinbedarf, dieser steigt aber anschliessend im Verlauf des zweiten und dritten Trimenon wieder an.
Nach der Geburt fällt der Insulinbedarf innerhalb kurzer Zeit auf die Werte zurück, wie sie vor der Schwangerschaft bestanden haben.
Stillzeit
Die Insulinbehandlung der stillenden Mutter stellt kein Risiko für das Neugeborene dar. Es kann jedoch erforderlich werden, die Dosierung von NovoRapid, die Ernährungsgewohnheiten oder beides anzupassen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen.
Dem Patienten sollte geraten werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämieepisoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Kraftfahrzeuges ratsam ist.
Unerwünschte WirkungenDie beobachteten Nebenwirkungen bei Patienten, die NovoRapid verwenden, sind hauptsächlich dosisabhängig und werden durch die pharmakologische Wirkung des Insulins verursacht. Wie bei allen Insulinen ist auch bei NovoRapid die Hypoglykämie generell die häufigste unerwünschte Wirkung. Eine solche kann auftreten, wenn die Insulindosis zu hoch im Vergleich zum Insulinbedarf ist. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder zu Krämpfen mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion oder sogar zum Tod führen.
Die Häufigkeit (häufig bis sehr häufig) variiert in den klinischen Studien und gemäss den Erfahrungen nach Markteinführung je nach Patientenpopulation und Dosierungsschema.
Die Gesamtrate an Hypoglykämien in den klinischen Studien unterschied sich zwischen den mit NovoRapid und mit Humaninsulin behandelten Patienten nicht.
Die Häufigkeit der unerwünschten Wirkungen ist wie folgt definiert: sehr häufig ( ≥1/10), häufig (<1/10, ≥1/100, ), gelegentlich (<1/100, ≥1/1'000, ), selten (<1/1'000, ≥1/10'000, ) und sehr selten(<1/10'000).
Erkrankungen des Immunsystems
Urtikaria, Exanthem und Hautausschlag – gelegentlich.
Anaphylaktische Reaktionen – sehr selten.
Symptome einer generalisierten Überempfindlichkeitsreaktion sind generalisierter Hautausschlag, Jucken, Schwitzen, gastrointestinale Beschwerden, angioneurotische Ödeme, Atembeschwerden, Palpitationen und Blutdrucksenkung. Generalisierte Überempfindlichkeitsreaktionen sind potentiell lebensgefährlich.
Stoffwechsel- und Ernährungsstörungen
Veränderung des Blutzuckers: Hypoglykämie/Hyperglykämie - sehr häufig.
Die Symptome einer Hypoglykämie sind:
Neurovegetative Zeichen: Schwitzen, Hungergefühle, Zittern (neurovegetative Warnsymptome), Blässe, Herzklopfen, Kopfschmerzen.
Neuroglykopenische Zeichen: Konzentrationsstörungen, Verhaltensauffälligkeiten (Unruhe, Reizbarkeit, Aggressivität, Verwirrtheit, u.a.), Bewusstseinsstörungen, Koordinations-, Seh- und Sprachstörungen. Diese können über Benommenheit und Somnolenz bis zum Koma fortschreiten. Die Hypoglykämie kann auch zu epileptischen Anfällen führen oder als zerebraler Insult, z.B. mit Hemiparese, Aphasie, positivem Babinskizeichen, imponieren.
Abgeschwächte/veränderte Warnsymptome
Besonders bei Einstellung auf tiefe Blutzuckerwerte aber auch bei lang bestehendem Diabetes (u.U. mit Neuropathie), bei Präparatewechsel u.a. können die Warnsymptome der Hypoglykämie verändert und die neurovegetativen Symptome abgeschwächt sein oder erst spät auftreten. Der insulinbehandelte Diabetiker und seine Umgebung sind deshalb zu instruieren, dass sich eine Hypoglykämie auch überraschend und primär durch neuroglykopenische Zeichen wie Konzentrationsstörungen, Unruhe, Verhaltensauffälligkeiten und Bewusstseinsstörungen anzeigen kann, so dass er eventuell nicht früh genug mit Einnahme von Zucker reagiert.
Als Ursachen einer Hypoglykämie kommen in Frage: Auslassen einer Mahlzeit, Erbrechen, Durchfall, aussergewöhnliche körperliche Anstrengung, Insulinüberdosierung, endokrine Krankheiten wie Nebennierenrindeninsuffizienz, Hypothyreose u.a.
Alkoholgenuss kann eine Hypoglykämie verstärken (siehe unter «Interaktionen» und «Warnhinweise und Vorsichtsmassnahmen»).
Therapie der Hypoglykämie siehe unter «Überdosierung».
Nach jeder schweren Hypoglykämie ist die Diabeteseinstellung zu überprüfen, der Patient ist anzuweisen, den Arzt über jede durchgemachte schwere Hypoglykämie zu orientieren.
Dem Patienten ist zu empfehlen, seine nähere Umgebung (Freunde, Arbeitskollegen) über seine Zuckerkrankheit zu informieren sowie über die entsprechenden Verhaltensregeln; unter anderem auch, wie man Glukagon subkutan injiziert.
Erkrankungen des Nervensystems
Periphere Neuropathie – selten.
Eine rasche Besserung der Blutzuckereinstellung kann mit einer «akuten, schmerzhaften Neuropathie» assoziiert werden, die aber in der Regel vorübergehend ist.
Augenerkrankungen
Refraktionsanomalien - gelegentlich.
Zu Beginn einer Insulintherapie können Refraktionsanomalien auftreten, die aber in der Regel von vorübergehender Natur sind.
Diabetische Retinopathie - gelegentlich.
Langfristige verbesserte Blutzuckereinstellung vermindert das Risiko der Progression einer diabetischen Retinopathie. Jedoch kann eine Intensivierung der Insulintherapie mit einer abrupten Verbesserung der Blutzuckereinstellung zu einer vorübergehenden Verschlechterung einer diabetischen Retinopathie führen.
Erkrankungen der Haut- und des Unterhautgewebes
Lipodystrophie - gelegentlich.
Kutane Amyloidose - nicht bekannt.
Lipodystrophie (einschliesslich Lipohypertrophie, Lipoatrophie) und kutane Amyloidose können an der Injektionsstelle auftreten und die lokale Insulinresorption verzögern. Durch einen regelmässigen Wechsel der Injektionsstelle innerhalb des jeweiligen Injektionsbereichs können diese Reaktionen reduziert oder verhindert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Ödeme – gelegentlich.
Zu Beginn einer Insulintherapie können Ödeme auftreten, die aber in der Regel von vorübergehender Natur sind.
Lokale Überempfindlichkeitsreaktionen - gelegentlich.
Bei einer Insulinbehandlung können lokale Überempfindlichkeitsreaktionen (Schmerzen, Rötung, Schwellung und Juckreiz an der Injektionsstelle) auftreten. Diese Reaktionen sind jedoch in der Regel vorübergehend und verschwinden im Laufe einer kontinuierlichen Behandlung.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungFür Insulin kann keine spezifische Überdosierung definiert werden.
Eine Hypoglykämie kann sich jedoch stufenweise entwickeln, wenn zu hohe Insulindosen im Vergleich zum Insulinbedarf verabreicht werden.
·Milde hypoglykämische Vorfälle können durch orale Verabreichung von Glukose oder anderen zuckerhaltigen Lebensmitteln behandelt werden. Es wird empfohlen, dass der Diabetiker immer einige Würfelzucker oder andere zuckerhaltige Lebensmittel (z.B. einige Biskuits) bei sich hat.
·Bei schweren hypoglykämischen Vorfällen, bei welchen der Patient bewusstlos ist, kann 0.5 bis 1.0 mg Glucagon intramuskulär oder subkutan durch eine geübte Person oder Glukose intravenös durch einen Arzt verabreicht werden. Falls der Patient nach 10 bis 15 Minuten auf eine Glucagon-Verabreichung nicht reagiert, muss ebenfalls Glukose intravenös appliziert werden.
Sobald der Patient wieder bei Bewusstsein ist, empfiehlt sich die Verabreichung von Kohlenhydraten, um einen Rückfall zu vermeiden.
Eigenschaften/WirkungenATC-Code
A10AB05
Wirkungsmechanismus
Die Blutzucker senkende Wirkung von Insulin beruht auf der Fähigkeit des Moleküls, die Aufnahme von Glucose durch Bindung an Insulinrezeptoren von Muskel- und Fettzellen zu erhöhen. Gleichzeitig wird die Ausschüttung von Glucose aus der Leber inhibiert.
NovoRapid enthält das aus Hefezellen gentechnologisch hergestellte Humaninsulin-Analog Insulin Aspart.
Pharmakodynamik
Verglichen mit löslichem Humaninsulin weist NovoRapid einen rascheren Wirkungseintritt auf und der Blutzuckerspiegel ist innerhalb 4 Stunden nach einer Mahlzeit niedriger. NovoRapid hat eine mit löslichem Humaninsulin verglichene kürzere Wirkdauer nach s.c. Injektion.
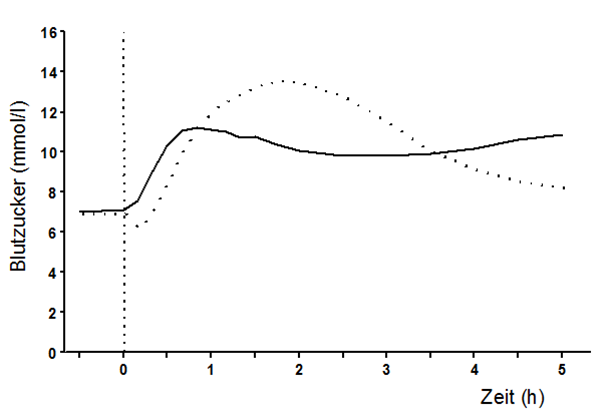
Abb. I. Blutzuckerspiegelverlauf bei Patienten mit Typ 1 Diabetes nach einer Einmalgabe vor einer Mahlzeit a) von NovoRapid unmittelbar vor der Mahlzeit (durchgezogene Linie) und b) von löslichem Humaninsulin 30 Minuten vor einer Mahlzeit (gestrichelte Linie).
Wird NovoRapid subkutan verabreicht, tritt die Wirkung innerhalb von 10–20 Minuten nach der Injektion ein. Das Wirkmaximum ist 1 bis 3 Stunden nach der Injektion erreicht. Die Wirkdauer beträgt 3 bis 5 Stunden.
Insulin Aspart ist auf molarer Basis äquipotent zu löslichem Humaninsulin.
Klinische Wirksamkeit
Erwachsene: Die Ergebnisse klinischer Studien bei Typ 1 Diabetikern belegen, dass mit NovoRapid im Vergleich zu löslichem Humaninsulin erniedrigte postprandiale Blutzuckerwerte erreicht werden (Abb. I). Zwei offene Langzeitstudien mit NovoRapid bei 1070 bzw. 884 Typ 1 Diabetikern zeigten reduzierte Werte für glykosyliertes Hämoglobin um 0,12 [95% C.I. 0,03; 0,22] Prozentpunkte bzw. 0,15 [95% C.I. 0,05; 0,26] Prozentpunkte im Vergleich zu Humaninsulin. Ob dieser Unterschied klinische Bedeutung hat, ist nicht gewiss.
Ältere Patienten: Eine randomisierte, doppelblinde Cross-Over-Studie zur Pharmakokinetik und Pharmakodynamik, in der Insulin Aspart mit löslichem Humaninsulin verglichen wurde, wurde bei älteren Patienten (19 Patienten im Alter von 65 bis 83 Jahren, Durchschnittsalter 70 Jahre) mit Typ 2 Diabetes durchgeführt. Der relative Unterschied in den pharmako-dynamischen Eigenschaften (maximale Glukose-Infusionsrate (GIRmax), AUCGIR, 0-120min) zwischen Insulin Aspart und Humaninsulin bei älteren Patienten war dem bei Gesunden und bei jüngeren Patienten mit Diabetes ähnlich.
Kinder und Jugendliche: Diabetes bei Kindern ist eine ähnliche Krankheit wie bei Erwachsenen und die Resultate von kleineren Studien mit Kindern bestätigen die allgemeinen Resultate der grösseren Studien mit Erwachsenen. Die prandiale Verabreichung von NovoRapid und die präprandiale Verabreichung von löslichem Humaninsulin wurde bei Kleinkindern (2 bis 6-jährig, n=30) verglichen und stellte sich als gleich wirksam in Bezug auf die Blutzuckerkontrolle, gemessen anhand des HbA1c, heraus.
Eine 12-wöchige klinische Studie mit Kleinkindern (20 Patienten zwischen 2 und 6 Jahren, 4 davon waren jünger als 4 Jahre alt) verglich die präprandiale Verabreichung von löslichem Humaninsulin mit der postprandialen Verabreichung von NovoRapid und eine Pharmakokinetik/Pharmakodynamik Studie mit einer Einfachdosis wurde mit Kindern (6-12 Jahren) und Jugendlichen (13-17 Jahren) durchgeführt. Das pharmakodynamische Profil von Insulin Aspart war bei Kindern ähnlich dem bei Erwachsenen.
Schwangerschaft: Eine klinische Studie, die die Sicherheit und Wirksamkeit von Insulin Aspart mit der von Humaninsulin bei der Behandllung von schwangeren Frauen mit Typ 1 Diabetes (322 exponierte Schwangerschaften; Insulin Aspart: 157; Humaninsulin 165) verglich, liess nicht auf Nebenwirkungen von Insulin Aspart auf die Schwangerschaft oder die Gesundheit des Fetus/Neugeborenen schliessen.
Zusätzlich zeigten die Daten einer klinischen Studie mit 27 Frauen mit Schwangerschaftdiabetes, die zu einer Behandlung mit Insulin Aspart bzw. zu einer Behandlung mit Humaninsulin (Insulin Aspart: 14; Humaninsulin: 13) randomisiert wurden, ähnliche Sicherheitsprofile beider Behandlungen.
Gemäss Ergebnissen klinischer Studien bei Typ 1 Diabetikern ist das relative Risiko nächtlicher (zwischen 24:00 und 06:00 Uhr) Hypoglykämien verglichen mit löslichem Humaninsulin bei Insulin Aspart vermindert. Das Risiko von Hypoglykämien während des Tages war nicht signifikant erhöht.
Bei den mit Insulin Aspart behandelten Patienten wurde eine Erhöhung der kreuzreagierenden Antikörper beobachtet, die sowohl mit löslichem Humaninsulin als auch mit Insulin Aspart reagierten. Dieser Anstieg war bei den mit Insulin Aspart behandelten bei mehr Patienten zu beobachten als bei den mit löslichem Humaninsulin behandelten. Die Daten einer
12-monatigen, kontrollierten Studie mit Typ 1 Diabetikern weisen darauf hin, dass der Anstieg dieser Antikörper vorübergehend ist. Der beobachtete Unterschied des Antikörperlevels nach 3 und 6 Monaten war bei den mit löslichem Humaninsulin und Insulin Aspart behandelten nach 12 Monaten nicht mehr evident.
Kinder und Jugendliche: In einer retrospektiven Analyse wurde die mögliche Immunogenizität von NovoRapid (n = 42) im Vergleich zu löslichem Humaninsulin (n = 30) bei Kindern im Alter von 2-16 Jahren über einen Zeitraum von 18-30 Monate untersucht. Obwohl kreuzreagierende Antikörper vor allem während den ersten 6 bis 9 Monaten deutlich ansteigen, konnte eine stabile Blutzuckerkontrolle aufrechterhalten werden. Es ergab sich keine Korrelation zwischen Antikörpern und HbA1c bzw. zwischen Antikörpern und relativer Insulindosis, aber eine positive Assoziierung zwischen Humaninsulin-Antikörper (einschliesslich kreuzreagierenden) und der Insulingesamtdosis.
PharmakokinetikBei NovoRapid wurde an der Position B28 die Aminosäure Prolin gegen Asparaginsäure ausgetauscht, wodurch die Neigung zur Bildung von Hexameren, wie sie bei löslichem Humaninsulin beobachtet wird, herabgesetzt ist. NovoRapid wird daher schneller als lösliches Humaninsulin aus der Subkutanschicht resorbiert.
Absorption
Die Wirkung tritt nach subkutaner Injektion innerhalb von 10-20 Minuten ein. Das Wirkungsmaximum ist 1 bis 3 Stunden nach der Injektion erreicht. Die Wirkdauer beträgt 3 bis 5 Stunden.
Die maximale Wirkstoffkonzentration wird durchschnittlich doppelt so schnell erreicht wie bei löslichem Humaninsulin. Sie wird mit Insulin Aspart in verschiedenen Studien nach einer Zeit von 40 bis 50 Minuten (tmax), mit Humaninsulin nach 80 bis 120 Minuten erreicht. Bei NovoRapid waren die Zeitschwankungen bis zum Erreichen der maximalen Wirkstoffkonzentration innerhalb der Probandengruppe signifikant weniger ausgeprägt als bei löslichem Humaninsulin.
Distribution
Die maximale Wirkstoffkonzentration (Cmax) ist bei NovoRapid durchschnittlich doppelt so hoch wie bei löslichem Humaninsulin. In einer Studie mit Typ 1 Diabetikern, bei der Dosen von 0.15 E/kg Körpergewicht verabreicht wurden, wurde eine mittlere maximale Plasmakonzentration von 492 pmol/l ± 256 pmol/l nach 40 (Interquatilenabstand: 30-40) Minuten mit NovoRapid erreicht. Die Insulinkonzentration ging etwa 4 bis 6 Stunden nach der Gabe auf den Ausgangswert zurück.
Die Resorptionsrate war bei Patienten mit Typ 2 Diabetes etwas langsamer, was zu einer niedrigeren Cmax (352 ± 240 pmol/l) und einer späteren tmax (60 (Interquatilenabstand: 50-90) Minuten) führte.
Die intraindividuellen Schwankungen der Zeit bis zur maximalen Konzentration sind bei NovoRapid signifikant geringer als bei löslichem Humaninsulin, wohingegen die intraindividuellen Schwankungen von Cmax bei NovoRapid grösser sind.
Metabolismus
Keine Daten vorhanden.
Elimination
Keine Daten vorhanden.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Eine Einzeldosis-Studie zur Pharmakokinetik mit Insulin Aspart wurde bei 24 Patienten mit einer normalen bis stark eingeschränkten Leberfunktion durchgeführt. Bei Patienten mit eingeschränkter Leberfunktion war die Resorptionsrate verringert und variierte stärker, was in einem späteren tmax resultierte (ca. 50 Minuten bei Patienten mit normaler Leberfunktion gegenüber ca. 85 Minuten bei Patienten mit stark eingeschränkter Leberfunktion). AUC, Cmax und CL/F bei Patienten mit eingeschränkter Leberfunktion waren den Werten bei Patienten mit normaler Leberfunktion ähnlich.
Nierenfunktionsstörungen
Eine Einzeldosis-Studie zur Pharmakokinetik von Insulin Aspart wurde bei 18 Patienten mit einer normalen bis stark eingeschränkten Nierenfunktion durchgeführt. Es wurde kein offensichtlicher Effekt der Kreatinin-Clearance-Rate auf AUC, Cmax, CL/F und tmax von Insulin Aspart festgestellt. Es lagen nur limitierte Daten für Patienten mit mittlerer oder stark eingeschränkter Nierenfunktion vor. Dialysepatienten wurden nicht untersucht.
Ältere Patienten
Der relative Unterschied in den pharmakokinetischen Eigenschaften zwischen Insulin Aspart und Humaninsulin bei älteren Patienten (65–83 Jahre, Durchschnittsalter 70 Jahre) mit Typ 2 Diabetes war dem bei Gesunden und bei jüngeren Patienten mit Diabetes ähnlich.
Bei älteren Patienten wurde eine verringerte Resorptionsrate beobachtet, was eine spätere tmax (82 Minuten, Interquartilenbereich 60-120 Minuten) zur Folge hatte. Die entsprechende Cmax war ähnlich der bei jüngeren Patienten mit Typ 2 Diabetes, aber leicht erniedrigt im Vergleich mit der Cmax von Typ 1 Diabetikern.
Kinder und Jugendliche
Die pharmakokinetischen und pharmakodynamischen Eigenschaften von NovoRapid wurden bei Kindern (6-12 Jahre) und Jugendlichen (13-17 Jahre) mit Typ 1 Diabetes untersucht. NovoRapid wurde in beiden Altersgruppen rasch resorbiert mit ähnlichem tmax wie bei Erwachsenen. Cmax unterschied sich jedoch zwischen den Altersgruppen, was die Wichtigkeit einer individuellen Titration von NovoRapid unterstreicht.
Präklinische DatenIn-vitro-Studien zur Rezeptorbindungskinetik an Insulin- und IGF-1-Rezeptoren und zu Auswirkungen auf das Zellwachstum zeigten, dass Insulin Aspart diesbezüglich keine relevanten Unterschiede zu nativem Humaninsulin aufweist. Die Dissoziation von Insulin Aspart vom Insulinrezeptor war entsprechend der von Humaninsulin.
Präklinische Daten, die auf konventionellen Studien zur Sicherheitspharmakologie, chronischen Toxizität, Genotoxizität, zum karzinogenen Potential und zur Reproduktionstoxizität basieren, lassen keine besonderen Gefahren für den Menschen erkennen.
Fortpflanzungsstudien beim Tier zeigten keine Unterschiede zwischen NovoRapid und Humaninsulin hinsichtlich Embryotoxizität und Teratogenität.
Sonstige HinweiseInkompatibilitäten
Wenn Insulin zusammen mit anderen Arzneimitteln verabreicht wird, kann dies zur Degradierung von Insulin Aspart führen.
NovoRapid PumpCart darf wie in Abschnitt «Dosierung/Anwendung» beschrieben niemals mit einem anderen Insulin gemischt werden.
Haltbarkeit
Vor dem ersten Öffnen: 30 Monate. Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Vor dem ersten Öffnen
Im Kühlschrank (2-8° C) lagern. Vom Kühlelement fernhalten. Nicht einfrieren. Die Patrone im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
NovoRapid Durchstechflaschen, Penfill Patronen und FlexPen/FlexTouch Fertigpens:
Nach dem ersten Öffnen und bei Verwendung als Ersatz: Nicht im Kühlschrank aufbewahren. Unter 30 °C aufbewahren und innerhalb von 4 Wochen verbrauchen.
NovoRapid PumpCart
Bei Verwendung als Ersatz: Kann bis zu 2 Wochen unter 30 °C gelagert werden. Nicht im Kühlschrank lagern oder einfrieren. Während des Gebrauchs in der Pumpe: Unter 37 °C lagern und innerhalb von 7 Tagen verbrauchen.
Hinweise für die Handhabung
Intravenöse Anwendung:
Infusionslösungen mit 0.9% Natriumchlorid, 5% Dextrose oder 10% Dextrose und 40 mmol/l Kaliumchlorid Lösung in Polypropylen Infusionsbehälter zur intravenösen Applikation von NovoRapid 100 E/ml in Konzentrationen von 0.05 E/ml bis 1.0 E/ml bleiben bei Raumtemperatur 24 Stunden stabil.
Obwohl stabil, wird anfänglich ein gewisser Anteil des Insulins vom Material des Infusionsbehälters absorbiert. Während einer Insulininfusion muss der Blutzucker gemessen werden.
NovoRapid darf nur verwendet werden, wenn es klar und farblos aussieht.
NovoRapid Penfill, NovoRapid FlexPen und NovoRapid FlexTouch dürfen jeweils nur von einer einzigen Person benutzt werden. Der Behälter darf nicht wieder aufgefüllt werden.
Verwendung von Durchstechflaschen
NovoRapid Durchstechflaschen sind für den Gebrauch mit Insulinspritzen mit der entsprechenden Dosierskala vorgesehen.
Verwendung von Penfill (Patronen)
NovoRapid Penfill wurden für die Verwendung zusammen mit den Injektionsgeräten von Novo Nordisk und NovoFine Nadeln entwickelt. NovoRapid Penfill darf nur in Kombination mit Produkten verwendet werden, die damit kompatibel sind und ein einwandfreies und sicheres Funktionieren der Penfill garantieren.
Verwendung von FlexPen und FlexTouch (Fertigpen)
Bei Benützung von FlexPen und FlexTouch ist die jeweilige Gebrauchsanweisung genau zu befolgen. NovoFine und NovoTwist Nadeln sind zum Gebrauch mit NovoRapid FlexPen und NovoRapid FlexTouch vorgesehen.
Als Lichtschutz zwischen dem Gebrauch, die Verschlusskappe von NovoRapid FlexPen bzw. NovoRapid FlexTouch aufgesetzt lassen.
Verwendung in Insulinpumpen
NovoRapid kann, wie unter «Dosierung/Anwendung» beschrieben, in einem Infusionspumpensystem (CSII) verwendet werden. Schläuche, bei denen die inneren Oberflächen aus Polyethylen oder Polyolefin bestehen, erwiesen sich im Rahmen der Evaluierung als kompatibel.
Nadeln, Infusionsset und NovoRapid PumpCart dürfen nicht mit anderen geteilt werden.
NovoRapid PumpCart ist eine vorgefüllte Patrone, die für den direkten Gebrauch in der Pumpe vorgesehen ist. NovoRapid PumpCart darf nur wie in Abschnitt «Dosierung/Anwendung» beschrieben mit einem Insulininfusions-Pumpensystem, das für die Verwendung mit dieser Patrone vorgesehen ist, wie Accu-Chek Insight und YpsoPump Insulinpumpe, verwendet werden.
Die Patrone darf nicht wieder aufgefüllt werden. Bitte lesen Sie die Packungsbeilage, die detaillierte Anwendungshinweise enthält.
Um eine korrekte Dosierung sicherzustellen, darf NovoRapid PumpCart nicht mit einem Insulinpen verwendet werden.
In einem Notfall bei einem NovoRapid Anwender (Einlieferung ins Spital oder mangelnde Funktion des Insulinpumpe) kann NovoRapid mit einer E100 Insulinspritze aus NovoRapid PumpCart aufgezogen werden.
Zulassungsnummer55045, 55046, 55712, 62260, 65630 (Swissmedic)
PackungenNovoRapid
Einzelpackungen mit Durchstechflaschen zu 10 ml (100 E/ml): 1 [B]
NovoRapid Penfill
Patronen zu 3 ml (100 E/ml; 300 E pro Penfill) zur Anwendung in Novo Nordisk Injektionsgeräten: 5 (B)
NovoRapid FlexPen
Fertigpen zu 3 ml (100 E/ml; 300 E pro FlexPen): 5 [B]
NovoRapid FlexTouch
Fertigpen zu 3 ml (100 E/ml; 300 E pro FlexTouch): 5 [B]
NovoRapid PumpCart
Patronen zu 1.6 ml (100 E/ml; 160 E pro PumpCart): 5 [B]
ZulassungsinhaberinNovo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der InformationMai 2021.
|

