Eigenschaften/WirkungenATC-Code
A10AE56
Wirkungsmechanismus
Xultophy ist ein Kombinationspräparat bestehend aus Insulin Degludec und Liraglutide, mit einem sich ergänzenden Wirkmechanismus zur Verbesserung des Blutzuckerspiegels.
Insulin Degludec ist ein Basalinsulin, das nach subkutaner Injektion lösliche Multihexamere bildet, die ein Depot bilden, aus dem kontinuierlich und langsam Insulin Degludec in den Blutkreislauf abgegeben wird. Dies führt zu einer flachen und stabilen blutzuckersenkenden Wirkung von Insulin Degludec mit einer niedrigen Tag-zu-Tag Variabilität der Insulinwirkung.
Insulin Degludec bindet spezifisch an den Humaninsulin-Rezeptor und hat die gleiche pharmakologische Wirkung wie Humaninsulin.
Die blutzuckersenkende Wirkung von Insulin Degludec beruht auf der verbesserten Aufnahme von Glukose nach der Bindung des Insulins an die Insulin-Rezeptoren auf Muskel- und Fettzellen und der gleichzeitigen Hemmung der Freisetzung von Glukose aus der Leber.
Liraglutide ist ein Glucagon-ähnliches Peptid 1 (GLP-1) mit einer Sequenzhomologie von 97% zu humanem GLP-1, das an den GLP-1-Rezeptor (GLP-1R) bindet und diesen aktiviert. Das verzögerte Wirkprofil nach subkutaner Applikation basiert auf drei Mechanismen: Selbstassoziation, was zu einer langsameren Resorption führt, Bindung an Albumin sowie höhere enzymatische Stabilität gegenüber den Enzymen Dipeptidylpeptidase 4 (DPP-4) und neutralen Endopeptidase (NEP), was zu einer langen Plasmahalbwertszeit führt.
Die Wirkung von Liraglutide wird durch eine spezifische Interaktion mit GLP-1-Rezeptoren vermittelt, die zu einem Anstieg der cAMP-Konzentration führt. Liraglutide stimuliert die Insulinsekretion glucoseabhängig. Gleichzeitig dämpft Liraglutide ebenfalls glucoseabhängig eine überhöhte Glucagonsekretion. Bei hohem Blutzuckerspiegel wird demnach die Insulinsekretion stimuliert und die Glucagonsekretion vermindert. Umgekehrt reduziert Liraglutide bei Hypoglykämie die Insulinsekretion und lässt die Glucagonsekretion unbeeinträchtigt. Der Mechanismus der Blutzuckersenkung beinhaltet ausserdem eine geringe Verzögerung der Magenentleerung. Liraglutide führt über Mechanismen, die eine Verminderung des Hungergefühls und der Energieaufnahme umfassen, zu einer Abnahme des Körpergewichts und der Körperfettmasse.
GLP-1 ist ein physiologischer Regulator von Appetit und Nahrungsaufnahme. GLP-1-Rezeptoren (GLP-1R) kommen in verschiedenen Hirnregionen vor, die an der Appetitregulation beteiligt sind. Tierexperimentelle Studien zeigten, dass Liraglutide nach peripherer Verabreichung in Hirnregionen aufgenommen wird, die an der Regulation des Appetits beteiligt sind, wie z.B. den Hypothalamus. Die Aktivierung von GLP-1-Rezeptoren in diesen Hirnarealen verstärkte die Sättigung, verringerte Hungersignale und induzierte letztlich eine Abnahme des Körpergewichts.
GLP-1-Rezeptoren kommen ebenfalls an spezifischen Orten des Herzens, des Gefässsystems, des Immunsystems und der Nieren vor. Human- und Tierstudien haben aufgezeigt, dass die Aktivierung dieser Rezeptoren mit Liraglutide kardiovaskuläre und mikrovaskuläre Wirkungen, einschliesslich verminderter Entzündung, vermitteln kann. In Tierstudien führte Liraglutide zur Hemmung der Entwicklung von Atherosklerose.
Weiterhin zeigten tierexperimentelle Studien, dass Liraglutide eine deutliche Reduktion der Aorten Plaque-Läsionen induzierte. Jedoch zeigte Liraglutide keine Hemmung auf die Weiterbildung von Aorten Plaque bzw. eine Wirkung auf vorhandene Plaques. Zusätzlich induzierte Liraglutide eine Abnahme der Entzündung in umliegenden Geweben und hatte eine positive Wirkung auf die Plasmalipide.
Pharmakodynamik
Die Wirkdauer von Insulin Degludec und Liraglutide erlaubt die einmal tägliche Verabreichung von Xultophy zeitlich unabhängig von Mahlzeiten.
Xultophy verbessert die Blutzuckerkontrolle durch die anhaltende Senkung des Nüchtern- und postprandialen Blutzuckerspiegels nach allen Mahlzeiten. Diese Effekte bewirken eine ganztägige Abdeckung des Blutzuckerspiegels, einschliesslich der postprandialen Blutzuckerspitzen.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Xultophy wurde in sechs randomisierten, kontrollierten, Parallelgruppenstudien der Phase 3 bei Erwachsenen mit Diabetes mellitus Typ 2 und verschiedener antihyperglykämischer Vorbehandlung untersucht. Vergleichstherapien waren Basalinsulin, Therapie mit GLP-1-Rezeptor-Agonisten, Placebo und eine Basal-Bolus-Therapie. Die Studiendauer betrug ≥26 Wochen, mit 199 bis 833 Patienten im Xultophy Arm. Xultophy wurde in allen Studien zweimal wöchentlich titriert (siehe Tabelle 2). Der gleiche Titrationsalgorithmus wurde im Basalinsulin-Vergleichsarm angewendet.
Tabelle 2: Titration von Xultophy
|
Plasmaglucose vor dem Frühstück*
|
Dosisanpassung
(zweimal wöchentlich)
| |
mmol/l
|
mg/dl
|
Xultophy (Dosisschritte)
| |
<4,0
|
<72
|
-2
| |
4,0–5,0
|
72–90
|
0
| |
>5,0
|
>90
|
+2
|
* Selbstgemessene Plasmaglukose
Anwendung von Xultophy zusätzlich zu Metformin
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu Insulin Degludec und Liraglutide, alle einmal täglich verabreicht, wurden in einer 26-wöchigen randomisierten, kontrollierten, offenen, Treat-to-Target-Studie bei Patienten mit Typ 2 Diabetes, mit einer Verlängerung um 26 Wochen, untersucht. Die Anfangsdosis von Xultophy und Insulin Degludec betrug 10 Dosisschritte bzw. 10 Einheiten, wobei die Dosis zweimal wöchentlich gemäss obenstehender Tabelle 2 titriert wurde.
Patienten unter Liraglutide befolgten eine fixe Dosissteigerung mit einer Anfangsdosis von 0.6 mg und eine wöchentliche Dosissteigerung um 0.6 mg bis die Erhaltungsdosis von 1.8 mg erreicht war. Die Maximaldosis von Xultophy betrug 50 Dosisschritte, während für Insulin Degludec keine Maximaldosis festgelegt wurde. Ein Teil (140/833) der Patienten erhielt zusätzlich zu Xultophy und Metformin noch Pioglitazon.
Die wichtigsten Resultate der Studie sind aufgelistet in Tabelle 3 und Abbildung 1.
Tabelle 3: Resultate einer 26-wöchigen Studie mit Xultophy bei Patienten mit unzureichender Blutzuckerkontrolle unter Metformin alleine oder in Kombination mit Pioglitazon
|
|
Vorgängige Behandlung mit Met ± Pioglitazon
| |
Xultophy
|
Insulin Degludec
|
Liraglutide
| |
N
|
833
|
413
|
414
| |
HbA1c (%)
|
|
|
| |
Ausgangswert → Studienende
|
8.3 → 6.4
|
8.3 → 6.9
|
8.3 → 7.0
| |
Durchschnittliche Veränderung
|
-1.91
|
-1.44
|
-1.28
| |
Geschätzte Differenz
|
|
-0.47AB
[-0.58; -0.36]
|
-0.64AB
[-0.75; -0.53]
| |
Anzahl bestätigter Hypoglykämien* pro Patientenjahr unter Exposition (prozentualer Anteil Patienten)
|
1.80 (31.9%)
|
2.57 (38.6%)
|
0.22 (6.8%)
| |
Geschätzte Anzahl
|
|
0.68AC
[0.53; 0.87]
|
7.61B
[5.17; 11.21]
| |
Körpergewicht (kg)
|
|
|
| |
Ausgangswert → Studienende
|
87.2 → 86.7
|
87.4 → 89.0
|
87.4 → 84.4
| |
Durchschnittliche Veränderung
|
-0.5
|
1.6
|
-3,0
| |
Geschätzte Differenz
|
|
-2.22AB
[-2.64; -1.80]
|
2.44B
[2.02; 2.86]
| |
Postprandiale Glukoseerhöhung (mmol/L) Mahlzeitentest (Durchschnitt über 4 Stunden)
|
|
|
| |
Ausgangswert → Studienende
|
4.11 → 3.22
|
4.12 → 3.95
|
4.12 → 3.36
| |
Durchschnittliche Veränderung
|
-0.87
|
-0.17
|
-0.78
| |
Geschätzte Differenz
|
|
-0.71AC
[-1.17; -0.26]
|
-0.09
[-0.56; 0.37]
| |
Dosis am Studienende
|
|
|
| |
Insulin Degludec (Einheiten)
|
38
|
53
|
-
| |
Liraglutide (mg)
|
1.4
|
-
|
1.8
| |
Geschätzte Differenz, Insulin Degludec Dosis
|
|
-14.90AB
[-17.14; -12.66]
|
|
Ausgangswert, Studienende und durchschnittliche Veränderung wurden als «Last observation carried forward» (LOCF) beobachtet. Der 95% confidence interval ist angegeben in «[]».
* Bestätigte Hypoglykämie definiert als schwere Hypoglykämie (Episode, welche die Hilfe einer anderen Person erforderlich macht) und/oder schwache Hypoglykämien (Plasmaglukose <3,1 mmol/L, unabhängig von Symptomen).
** Mahlzeit-Test wurde in einer Teilstudie mit 260 Patienten durchgeführt, die unzureichend mit Metformin ± Pioglitazon kontrolliert wurden (131 Patienten wurden mit Xultophy, 64 mit Insulin Degludec und 65 mit Liraglutide behandelt).
A Endpunkte mit bestätigter Überlegenheit von Xultophy vs. Komparator
B p <0.0001
C p <0.05
Der Anteil bestätigter Hypoglykämien war unabhängig von der Blutzuckerkontrolle niedriger mit Xultophy als mit Insulin Degludec, siehe Abbildung 1.
Abb. 1a
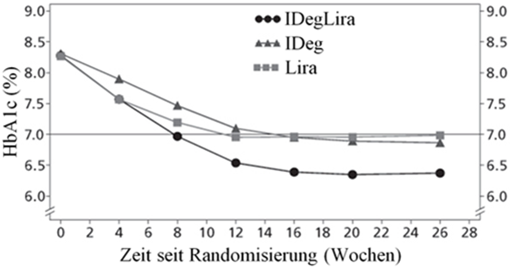
Abb. 1b
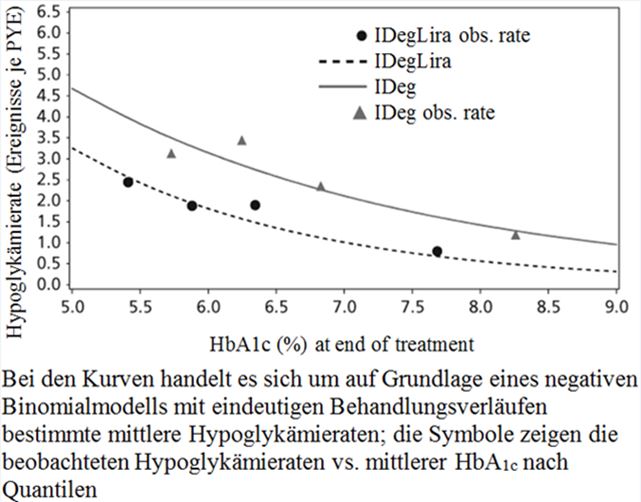
Abb. 1c
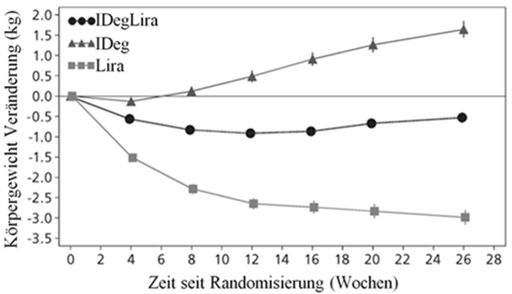
Abb. 1d
IDegLira = Xultophy, IDeg = Insulin Degludec, Lira = Liraglutide, obs. rate = beobachtete Rate, PYE = Patientenjahr Exposition.
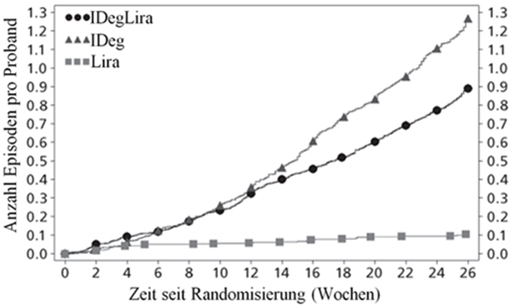
Abbildung 1 - Durchschnittliches HbA1c (%) nach Behandlungswochen (Abb. 1a), Anzahl bestätigte Hypoglykämien pro Patientenjahr Exposition gegenüber dem durchschnittlichen HbA1c (%) (Abb. 1b), durchschnittliche Veränderung des Körpergewichts nach Behandlungswochen (Abb. 1c) und die mittlere kumulative Anzahl an Hypoglykämie-Ereignissen nach Behandlungswochen (Abb. 1d).
Die Rate pro Patientenjahr unter Exposition (Prozent der Patienten) von schweren Hypoglykämien, definiert als Episode in welcher fremde Hilfe benötigt wurde, war 0.01 (2 Patienten von 825) für Xultophy, 0.01 (2 Patienten von 412) für Insulin Degludec und 0.00 (0 Patienten von 412) für Liraglutide. Die Rate der nächtlichen Hypoglykämien war ähnlich bei einer Behandlung mit Xultophy und Insulin Degludec trotz des niedrigeren HbA1c für Xultophy im Vergleich zu Insulin Degludec.
Patienten, die mit Xultophy behandelt wurden, hatten insgesamt weniger gastrointestinale Nebenwirkungen als Patienten unter einer Liraglutide-Behandlung, aber mehr als unter Insulin Degludec. Dies könnte durch eine langsamere Dosiserhöhung der Liraglutide Komponente während des Behandlungsbeginns mit Xultophy bedingt sein im Vergleich zu einer Therapie mit Liraglutide alleine.
Langzeit-Daten (52 Wochen)
Die Wirksamkeit und Sicherheit von Xultophy blieb bei einer Behandlung bis zu 52 Wochen aufrecht. Die Reduktion des HbA1c vom Ausgangswert bis nach 52 Wochen betrug mit Xultophy 1.84% mit einer geschätzten Behandlungsdifferenz von -0.65% [-0.76; -0.53]95%CI im Vergleich zu Liraglutide und -0.46% [-0.57; -0.34]95%CI im Vergleich zu Insulin Degludec. Das Körpergewicht wurde um 0.4 kg reduziert mit einem geschätzten Behandlungsunterschied zwischen Xultophy und Insulin Degludec von -2.80 kg. Die Rate der bestätigten Hypoglykämien betrug 1.8 Ereignissen pro Patientenjahr für Xultophy und 2.8 Ereignisse für Insulin Degludec mit einer geschätzten Behandlungsdifferenz von 0.63 [0.50; 0.79]95%CI.
Anwendung von Xultophy zusätzlich zu Sulfonylharnstoff alleine oder in Kombination mit Metformin
Die Wirksamkeit und Sicherheit von Xultophy bei Hinzugabe zu Sulfonylharnstoff alleine oder in Kombination mit Metformin wurden in einer 26-wöchigen randomisierten, Placebo-kontrollierten, doppelblinden, Treat-to-Target-Studie mit 435 Patienten untersucht, von denen 289 mit Xultophy behandelt wurden. 259/289 erhielten Xultophy plus Metformin plus Sulfonylharnstoffe, 30/289 Xultophy plus Sulfonylharnstoffe, ohne Metformin. Die Anfangsdosis von Xultophy betrug 10 Dosisschritte, und die Dosis wurde zweimal wöchentlich gemäss obenstehender Tabelle 2 mit einem Titrationsziel von 4-6 mmol/l titriert.
Die Reduktion des HbA1c-Ausgangswerts betrug -1.45% von 7.9% auf 6.4% mit Xultophy vs. einer Reduktion des HbA1c-Ausgangswerts um -0.46% von 7.9% auf 7.4% mit Placebo, mit einer geschätzten Behandlungsdifferenz von -1.02 [-1.18; -0.87] 95% CI (siehe Abbildung 2).
Abb. 2a
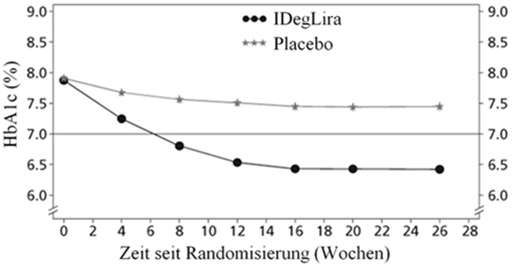
Abb. 2b
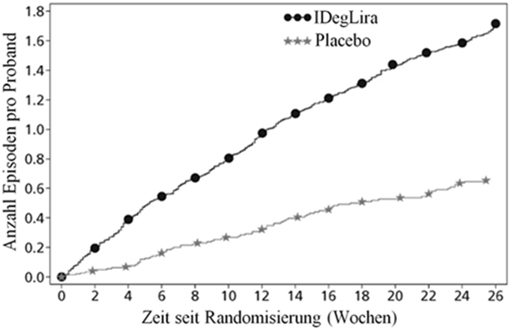
Abb. 2c
IDegLira = Xultophy
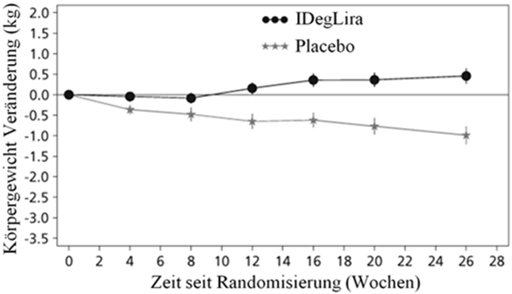
Abbildung 2 - Durchschnittliches HbA1c (%) nach Behandlungswochen (Abb. 2a), die mittlere kumulative Anzahl an Hypoglykämie-Ereignissen (Abb. 2b) und durchschnittliche Veränderung des Körpergewichts nach Behandlungswochen (Abb. 2c) bei Patienten mit unzureichender Blutzuckerkontrolle unter SU±Met.
41.7% der Patienten unter Xultophy und 17.1% der Patienten unter Placebo hatten mindestens einmal während der Studie eine bestätigte Hypoglykämie. Dies entspricht einer hochgerechneten Hypoglykämierate von 3.52 pro Patientenjahr unter Xultophy vs. 1.35 unter Placebo. Patienten, die mit Xultophy behandelt wurden, hatten eine mittlere Zunahme des Körpergewichts von 0.5 kg, während die Patienten der Placebogruppe einen mittleren Gewichtsverlust von 1.0 kg (geschätzter Behandlungsunterschied: 1.48; [0.90; 2.06]95%CI) hatten.
Die mittlere Dosis von Xultophy war am Ende der Studie bei 28 Dosisschritten entsprechend 28 Einheiten Insulin Degludec und 1.0 mg Liraglutide.
Zusatz zu SGLT2i allein oder in Kombination mit Metformin: Xultophy im Vergleich zu Insulin Glargin U100
In einer offenen Studie, in der die Wirksamkeit und die Sicherheit von Xultophy und Insulin Glargin U100 jeweils als Zusatz zu SGLT2i ± OAD verglichen wurden, war Xultophy Insulin Glargin überlegen hinsichtlich der Verminderung des durchschnittlichen HbA1c nach 26 Wochen. Unter Xultophy wurde eine Verminderung von 1.9% (von 8.2% auf 6.3%) und unter Insulin Glargin von 1.7% (von 8.4% auf 6.7%) erreicht, was einer geschätzten Behandlungsdifferenz von -0.36% [-0.50; -0.21] entspricht.
Unter Xultophy veränderte sich das durchschnittliche Körpergewicht im Vergleich zum Ausgangswert nicht, während es bei Patienten, die mit Insulin Glargin behandelt wurden, zu einer durchschnittlichen Gewichtszunahme von 2,0 kg kam (geschätzte Behandlungsdifferenz von -1.92 kg [95% KI: -2.64; -1.19]). In der Xultophy-Gruppe lag der Anteil der Patienten, bei denen es zu einer schweren oder mittels Blutzuckermessung bestätigten symptomatischen Hypoglykämie kam, bei 12.9% und in der Insulin Glargin-Gruppe bei 19.5% (geschätzte Behandlungsratio von 0.42 [95% KI: 0.23; 0.75]). Die durchschnittliche tägliche Insulindosis lag am Ende der Studie bei Patienten, die mit Xultophy behandelt wurden, bei 36 Einheiten und bei Patienten, die mit Insulin Glargin behandelt wurden, bei 54 Einheiten.
Umstellung von GLP-1-Rezeptoragonisten-Therapie auf Xultophy
Die Wirksamkeit und Sicherheit von Xultophy (einmal täglich) im Vergleich zu einer unveränderten GLP-1-Rezeptoragonisten-Therapie (Dosierung gemäss Label), wurden in einer 26-wöchigen randomisierten, open-label, Treat-to-Target-Studie bei Patienten mit Typ 2 Diabetes mellitus untersucht, die unter einem GLP-1-Rezeptoragonisten und Metformin (Met) allein (74.2%) oder in Kombination mit Pioglitazon (2.5%), Sulfonylharnstoffen (21.2%) oder beiden eine unzureichende Blutzuckerkontrolle hatten.
Die Anfangsdosis von Xultophy und Insulin Degludec betrug 16 Dosisschritte (16 Einheiten Insulin Degludec und 0.6 mg Liraglutide) und die Dosis wurde zweimal wöchentlich gemäss Tabelle 2 titriert. Patienten im GLP-1-Rezeptoragonisten Arm führten ihre GLP-1-Rezeptoragonisten Behandlung analog fort wie vor der Studie.
Die Resultate der Studie sind, in Tabelle 4 und Abbildung 3 aufgeführt.
Tabelle 4: Resultate einer 26-wöchigen Studie mit Xultophy bei Patienten mit Typ 2 Diabetes mellitus mit unzureichender Blutzuckerkontrolle unter GLP-1-Rezeptoragonisten
|
|
Vorgängige Behandlung mit GLP-1-Rezeptoragonist
| |
Xultophy
|
GLP-1-Rezeptoragonist
| |
N
|
292
|
146
| |
HbA1c (%)
|
|
| |
Ausgangswert → Studienende
|
7.8→6.4
|
7.7→7.4
| |
Durchschnittliche Veränderung
|
-1.3
|
-0.3
| |
Geschätzte Differenz
|
|
-0.94AB
[-1.11; -0.78]
| |
Patienten (%) mit erreichtem HbA1c <7%
|
|
| |
Alle Patienten
|
75.3
|
35.6
| |
Geschätzte Odds-Ratio
|
|
6.84B
[4.28; 10.94]
| |
Patienten (%) mit erreichtem HbA1c <6.5%
|
|
| |
Alle Patienten
|
63.0
|
22.6
| |
Geschätzte Odds-Ratio
|
|
7.53B
[4.58; 12.38]
| |
Anzahl bestätigter Hypoglykämien* pro Patientenjahr unter Exposition (prozentualer Anteil Patienten)
|
2.82 (32.0%)
|
0.12 (2.8%)
| |
Geschätzte Anzahl
|
|
25.36B
[10.63; 60.51]
| |
Körpergewicht (kg)
|
|
| |
Ausgangswert → Studienende
|
95.6 → 97.5
|
95.5 → 94.7
| |
Durchschnittliche Veränderung
|
2.0
|
-0.8
| |
Geschätzte Differenz
|
|
-2.89B
[2.17; 3.62]
| |
FPG (mmol/l)
|
|
| |
Ausgangswert → Studienende
|
9.0 → 6.0
|
9.4 → 8.8
| |
Durchschnittliche Veränderung
|
-2.98
|
-0.60
| |
Geschätzte Differenz
|
|
-2.64B
[-3.03; -2.25]
| |
Dosis am Studienende
|
|
| |
Insulin Degludec (Einheiten)
|
43
|
Die Dosis des GLP-1-Rezeptoragonisten wurde unverändert vom Anfangswert weitergeführt
| |
Liraglutide (mg)
|
1.6
| |
Geschätzte Differenz, Insulin Degludec Dosis
|
|
Ausgangswert, Studienende und durchschnittliche Veränderung wurden als «Last observation carried forward» (LOCF) beobachtet. Der 95% confidence interval ist angegeben in «[]».
* Bestätigte Hypoglykämie definiert als schwere Hypoglykämie (Episode, welche die Hilfe einer anderen Person erforderlich macht) und/oder schwache Hypoglykämien (Plasmaglukose <3,1 mmol/l, unabhängig von Symptomen).
A Endpunkte mit bestätigter Überlegenheit von Xultophy vs. Komparator
B p <0.001
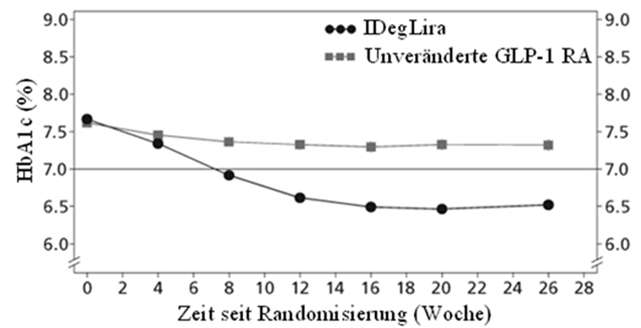
IDegLira = Xultophy, GLP-1-RA = GLP-1-Rezeptoragonist
Abbildung 3 - Durchschnittliches HbA1c (%) nach Behandlungswochen bei Patienten mit Diabetes mellitus Typ 2 mit unzureichender Blutzuckerkontrolle unter GLP-1-Rezeptoragonisten.
Die Anzahl bestätigter schweren Hypoglykämien pro Patientenjahr unter Exposition (prozentualer Anteil Patienten) war 0.01 (1 Patient aus 291) für Xultophy und 0.00 (0 Patienten aus 199) für GLP-1-Rezeptoragonisten.
Intensivierung einer Basalinsulintherapie mittels Umstellung auf Xultophy
Vergleich mit Basal-Bolus-Therapie
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu einem Basal-/Bolusinsulin-Schemata bestehend aus Insulin Glargin U100 in Kombination mit mahlzeitenbezogenem Insulin Aspart zu Hauptmahlzeiten wurden im Rahmen einer 26-wöchigen randomisierten, offenen Treat-to-Target-Studie bei Patienten mit Diabetes mellitus Typ 2, deren Blutzuckereinstellung mit Insulin Glargin U100 (20 bis 50 Einheiten) und Metformin unzureichend war, untersucht. Die Anfangsdosis von Xultophy betrug 16 Dosisschritte. Im Basal-/Bolus-Studienarm entsprach die Anfangsdosis von Insulin Glargin U100 der Tagesdosis vor der Studie und die Anfangsdosis von mahlzeitenbezogenem Insulin Aspart betrug 4 Einheiten vor Hauptmahlzeiten. Die Dosen für Xultophy und Insulin Glargin U100 wurden zweimal in der Woche gemäss Tabelle 2 titriert, wogegen mahlzeitenbezogenes Insulin Aspart zweimal wöchentlich auf Basis der Selbstmessungen der Plasmaglukose (SMPG) in den drei vorangegangenen Tagen titriert wurde. Die maximale Tagesdosis für Xultophy betrug 50 Dosisschritte. Für Insulin Glargin U100 und Insulin Aspart bestand dagegen keine Maximaldosis.
Abbildung 4 und Tabelle 5 führen die wesentlichen Ergebnisse der Studie auf.
Im Xultophy- bzw. Basal-/Bolus-Arm erreichten nach 26-wöchiger Behandlung 57.6% bzw. 33.5% einen HbA1c-Zielwert <7% ohne schwere oder durch Blutzuckerwerte bestätigte, symptomatische, hypoglykämische Episoden (p<0.0001).
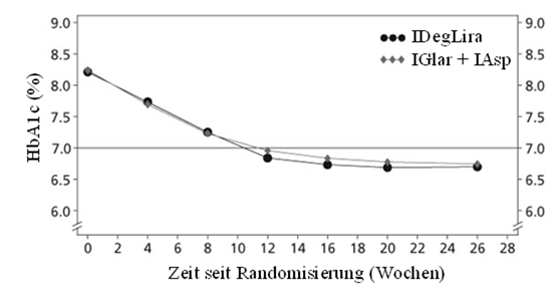
IDegLira = Xultophy, IGlar + IAsp = Insulin Glargin U100 + Insulin Aspart
Abbildung 4. Mittlerer HbA1c-Wert (%) nach Behandlungswoche bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin U100
Die Rate schwerer Hypoglykämien pro Patientenjahr der Exposition lag bei 0.02 (3 Patienten von 252) für Xultophy und bei 0.08 (4 Patienten von 253) für das Basal-/Bolusschemata.
Die Rate der nächtlichen schweren oder durch Blutzuckerwerte bestätigten, symptomatischen, hypoglykämischen Episoden war mit Xultophy statistisch signifikant niedriger als beim Basal-/Bolusschemata (geschätztes Behandlungsverhältnis 0.08, p <0.0001).
Tabelle 5. Ergebnisse einer 26-wöchigen Studie mit Xultophy bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin U100
|
|
Xultophy
|
Basal-bolus (Insulin glargine + insulin aspart)
| |
n
|
252
|
254
| |
HbA1c (%)
|
|
| |
Ausgangswert → Studienende
|
8.2→6.7
|
8.2→6.7
| |
Änderung im Mittel
|
-1.49
|
-1.48
| |
Geschätzte Differenz
|
|
-0.02A [-0.16; -0.12]
| |
Patienten (%), die HbA1c <7% erreichen
|
|
| |
Alle Patienten
|
66.0
|
67.0
| |
Geschätztes Odds-Verhältnis
|
|
0.91 [0.62; 1.33]
| |
Patienten (%), die HbA1c <6,5% erreichen
|
|
| |
Alle Patienten
|
49.6
|
44.6
| |
Geschätztes Odds-Verhältnis
|
|
1.26 [0.88; 1.82]
| |
Rate der Hypoglykämien* pro Patientenjahr der Exposition (Prozentsatz der Patienten)
|
|
| |
Geschätztes Verhältnis
|
1.07 (19.8%)
|
8.17 (52.6%) 0.11B [0.08; 0.17]
| |
Körpergewicht (kg)
|
|
| |
Ausgangswert → Studienende
|
87.2→85.8
|
88.2→90.7
| |
Änderung im Mittel
|
-0.9
|
2.6
| |
Geschätzte Differenz
|
|
-3.57B [-4.19; -2.95]
| |
Nüchternplasmaglucose (mmol/l)
|
|
| |
Ausgangswert → Studienende
|
8.5→6.1
|
8.3→6.4
| |
Änderung im Mittel
|
-2.35
|
-1.88
| |
Geschätzte Differenz
|
|
-0.31 [-0.67; 0.05]
| |
Dosis am Studienende
|
|
| |
Insulin degludec (Einheiten)
|
40
|
| |
Liraglutid (mg)
|
1.4
|
| |
Insulin glargin (Einheiten)
|
|
52
| |
Insulin aspart (Einheiten)
|
|
32
| |
Geschätzte Differenz, Gesamtinsulindosis
|
|
-44.5 [-48.3; -40.7]
| |
Geschätzte Differenz, Basalinsulindosis
|
|
-12.6 [-14.9; -10.3]
|
Keine Anrechnung fehlender Daten. In eckigen Klammern „[]“: Angabe des 95%-Konfidenzintervalls
*Schwere oder durch Blutzuckerwerte bestätigte, symptomatische Hypoglykämie ist definiert als Episode, die die Hilfestellung einer anderen Person erfordert, die aktiv Kohlenhydrate oder Glucagon verabreicht oder andere korrektive Handlungen durchführt, oder als eine Episode, die durch einen Blutzuckerwert im Plasma von <3.1 mmol/l (56 mg/dl) bestätigt wird und mit für Hypoglykämie typischen Symptomen einhergeht.
A Nichtunterlegenheit von Xultophy gegenüber dem Vergleichspräparat bestätigender Endpunkt (Bereich 0.3%). p <0.0001
B Überlegenheit von Xultophy gegenüber dem Vergleichspräparat bestätigender Endpunkt. p <0.0001.
Vergleich mit optimierter Basalinsulintherapie
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu Insulin Glargin, beide einmal täglich gegeben, wurden in einer 26-wöchigen, randomisierten, offenen Treat-to-Target-Studie bei Patienten mit Diabetes mellitus Typ 2, deren Blutzucker mit Insulin Glargin (20 – 50 Einheiten) und Metformin unzureichend eingestellt war, untersucht. Die Anfangsdosis von Xultophy betrug 16 Dosisschritte, und die Anfangsdosis von Insulin Glargin entsprach der täglichen Dosis vor der Studie. Die Dosen wurden in beiden Studienarmen zweimal wöchentlich entsprechend Tabelle 2 titriert. Die maximal erlaubte Dosis war 50 Dosisschritte für Xultophy, während es für Insulin Glargin keine Maximaldosis gab.
Tabelle 5 und Abbildung 5 führen die wesentlichen Ergebnisse der Studie auf.
54.3% der Patienten, die mit Xultophy behandelt wurden, erreichten einen HbA1c-Zielwert von <7% ohne bestätigte hypoglykämische Episoden gegenüber 29.4% der Patienten, die mit Insulin Glargin behandelt wurden (Odds-Verhältnis 3.24; p <0.001).
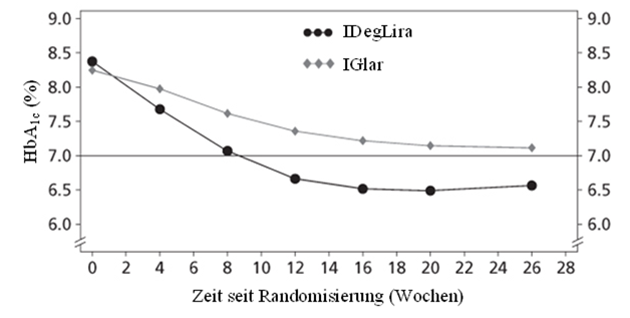
IDegLira = Xultophy, IGlar = Insulin Glargin
Abbildung 5. - Mittlerer HbA1c (%) nach Behandlungswoche bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin
Die Rate schwerer Hypoglykämien pro Patientenjahr der Exposition (Anteil der Patienten) betrug 0.00 (0 Patienten von 278) für Xultophy und 0.01 (1 Patient von 279) für Insulin Glargin. Die Rate der nächtlichen Hypoglykämien war mit Xultophy signifikant niedriger gegenüber Insulin Glargin (geschätztes Behandlungsverhältnis 0,17; p <0,001).
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu Insulin Degludec, beide einmal täglich verabreicht, wurden in einer 26-wöchigen randomisierten, doppelblinden, Treat-to-Target-Studie bei Patienten mit Typ 2 Diabetes mellitus untersucht, die unter Basalinsulin (20–40 Einheiten) und Metformin (Met) allein oder in Kombination mit Sulfonylharnstoffen/Gliniden eine unzureichende Blutzuckerkontrolle hatten. Basalinsulin und Sulfonylharnstoffe/Glinide wurden bei der Randomisierung abgesetzt.
Die Anfangsdosis von Xultophy und Insulin Degludec betrug 16 Dosisschritte respektive 16 Einheiten, und die Dosis wurde zweimal wöchentlich gemäss Tabelle 2 titriert. Die zugelassene Maximaldosis betrug 50 Dosisschritte für Xultophy und 50 Einheiten für Insulin Degludec.
Die Resultate im Primärendpunkt der Studie sind, nebst Insulindosis und Hypoglykämieinzidenz in Tabelle 5 und Abbildung 6 zusammengefasst.
48.7% der Patienten erreichten einen HbA1c-Zielwert <7% ohne bestätigte hypoglykämische Episoden; dieser Anteil war signifikant höher als der bei den mit Insulin degludec behandelten Patienten (15.6%, Odds-Verhältnis 5.57; p <0.0001).
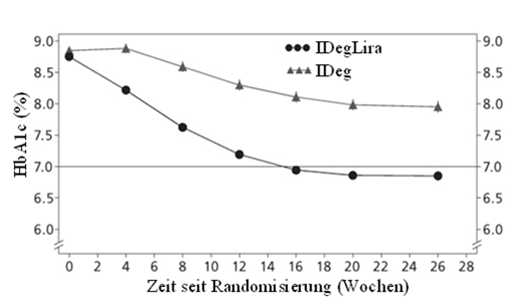
Abbildung 6 - Durchschnittliches HbA1c (%) nach Behandlungswochen bei Patienten mit unzureichender Blutzuckerkontrolle unter Basalinsulin.
Tabelle 6. - Ergebnisse von zwei 26-wöchigen Studien mit Xultophy bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin (links) oder Basalinsulin (rechts)
|
|
Vorherige Behandlung mit Insulin Glargin
|
Vorherige Behandlung mit Basalinsulin (NPH, Insulin Detemir, Insulin Glargin)
| |
|
Xultophy
|
Insulin Glargin, keine Dosisbeschränkung
|
Xultophy
|
Insulin Degludec, maximal 50 Einheiten erlaubt
| |
N
|
278
|
279
|
199
|
199
| |
HbA1c (%)
|
|
|
|
| |
Ausgangswert→Studienende
|
8.4→6,6
|
8.2→7.1
|
8.7→6.9
|
8.8→8.0
| |
Änderung im Mittel
|
-1.81
|
-1.13
|
-1.90
|
-0.89
| |
Geschätzte Differenz
|
|
-0.59AB
[-0.74; -0.45]
|
|
-1.05AB
[-1.25; -0.84]
| |
Patienten (%), die einen HbA1c-Wert <7% erreichen
|
|
|
|
| |
Alle Patienten
|
71.6
|
47.0
|
|
| |
Geschätztes Odds-Verhältnis
|
|
3.45B
[2.36; 5.05]
|
|
| |
Rate bestätigter Hypoglykämien* pro Patientenjahr der Exposition (Prozentsatz der Patienten)
|
2.23 (28.4%)
|
5.05 (49.1%)
|
1.53 (24.1%)
|
2.63 (24.6%)
| |
Geschätztes Verhältnis
|
|
0.43AB
[0.30;0.61]
|
|
0.66
[0.39; 1.13]
| |
Körpergewicht (kg)
|
|
|
|
| |
Ausgangswert→Studienende
|
88.3→86.9
|
87.3→89.1
|
|
| |
Änderung im Mittel
|
-1.4
|
1.8
|
|
| |
Geschätzte Differenz
|
|
-3.20AB
[-3.77; -2.64]
|
|
| |
Nüchternplasmaglucose (mmol/l)
|
|
|
|
| |
Ausgangswert→Studienende
|
8.9→6.1
|
8.9→6.1
|
|
| |
Änderung im Mittel
|
-2.83
|
-2.77
|
|
| |
Geschätzte Differenz
|
|
-0.01
[-0.35;0.33]
|
|
| |
Dosis am Studienende
|
|
|
|
| |
Insulin (Einheiten)
|
41
|
66D
|
45
|
45
| |
Liraglutide (mg)
|
1.5
|
-
|
1.7
|
-
| |
Geschätzte Differenz, Basalinsulin Dosis
|
|
-25.47B
[-28.90; -22.05]
|
|
-0.02
[-1.88; 1.84]
|
Ausgangswert, Studienende und Veränderungswerte: LOCF-Werte (Last Observation Carried Forward). In eckigen Klammern «[]»: Angabe des 95%-Konfidenzintervalls
A Endpunkt mit bestätigter Überlegenheit von Xultophy gegenüber dem Vergleichspräparat
B p <0.0001
C p <0.05
D die durchschnittliche Dosis von Insulin Glargin vor der Studie war 32 Einheiten
Kardiovaskuläre Sicherheit
Es wurden keine kardiovaskulären (CV) Endpunktstudien eigens für das Kombinationspräparat Xultophy durchgeführt. Die kardiovaskuläre Sicherheit seiner beiden Komponenten wurde in den zugehörigen CV Endpunktstudien, LEADER und DEVOTE, demonstriert. Zusätzliche post-hoc Analysen untersuchten den Effekt in den Patienten dieser beiden Studien, welche gleichzeitig mit Liraglutide und einem langwirksamen Insulin (inklusive Insulin Degludec) behandelt wurden. Die Ergebnisse dieser post-hoc Analysen unterstützen die Übertragbarkeit der positiven Befunde von LEADER und DEVOTE auf Xultophy (kardiovaskuläre Sicherheit und kardiovaskulärer Nutzen).
Liraglutide (Victoza)
LEADER - Primäranalyse
Die LEADER Studie (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results) untersuchte die Häufigkeit schwerer kardiovaskulärer Ereignisse (MACE: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall) in 9'340 Patienten mit Diabetes mellitus Typ 2 Diabetes und einem erhöhten kardiovaskulären Risiko. Randomisiert (1:1) wurden die Patienten zusätzlich zur Standardtherapie entweder mit bis zu 1.8 mg Liraglutide täglich (4'668) oder Placebo (4'672) behandelt (mediane Behandlungsdauer zirka 3.5 Jahre). Primärer Endpunkt war die Zeit bis zum ersten Auftreten eines MACE. Die geschätzte Hazard Ratio für die Zeit bis zur ersten MACE wurde durch Liraglutide in der untersuchten Dosierung signifikant reduziert (Hazard Ratio [95% KI]: 0.87 [0.78; 0.97]).
Eine Senkung des HbA1c-Wertes von Baseline zu Monat 36 wurde mit Liraglutid im Vergleich zu Placebo zusätzlich zur Standardtherapie beobachtet (-1.16% vs. -0.77%; geschätzte Behandlungsdifferenz [ETD] -0.40% [-0.45; -0.34]).
LEADER – Post-hoc-Analyse
Die LEADER-Primäranalyse wurde für 2'118 Patienten, die bei Baseline ein langwirksames Insulin erhielten, wiederholt, um die Anwendbarkeit des Ergebnisses der Primäranalyse für die Kombination aus Liraglutide und langwirksamem Insulin zu bestimmen. Die Baseline-Charakteristika dieser Subgruppe waren vergleichbar mit der der Gesamtpopulation. Die Ergebnisse der post-hoc-Analyse für die Zeit bis zum ersten MACE waren konsistent mit der LEADER-Primäranalyse (geschätzte HR [95% KI] in der Subgruppe: 0.82 [0.66; 1.03]).
Insulin Degludec (Tresiba)
DEVOTE – Primäranalyse
Bei der DEVOTE Studie (Trial Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events) handelte es sich um eine randomisierte, doppelblinde klinische Studie, bei der die kardiovaskuläre Sicherheit von Insulin Degludec mit derjenigen von Insulin Glargin (100 Einheiten/ml) bei 7'637 Patienten mit Typ 2 Diabetes mellitus und einem hohen Risiko für kardiovaskuläre Ereignisse verglichen wurde. Die Dauer der Studie war «ereignisgesteuert», d.h. sie dauerte bis ≥633 Ereignisse erreicht waren. Die Behandlungsdauer betrug im Median 1.83 Jahre, die Beobachtungszeit im Median 1.99 Jahre.
Gegenstand der Primäranalyse war die Zeit von der Randomisierung bis zum ersten Auftreten eines schweren kardiovaskulären Ereignisses (MACE: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall). Die Primäranalyse ergab eine geschätzte HR [95% KI] für Insulin Degludec im Vergleich zu Insulin Glargin von 0.91 [0.78; 1.06].
Der Ausgangswert von HbA1c betrug in beiden Behandlungsgruppen 8.4% und nach 2 Jahren lag der HbA1c bei 7.5% sowohl für Insulin Degludec als auch für Insulin Glargin.
DEVOTE – Post-hoc-Analyse
Um die Übertragbarkeit des Ergebnisses der Primäranalyse auf die Kombination eines langwirksamen Insulins (inklusive Insulin Degludec) mit Liraglutide zu ermitteln, wurde eine Post-hoc-Analysis für die Untergruppe von Patienten durchgeführt, welche bei Baseline bereits zusätzlich mit Liraglutide behandelt wurden.
Die Baseline-Charakteristika der 436 Patienten, die bei Baseline mit Liraglutide behandelt wurden, waren vergleichbar mit jenen der 7'201 Patienten, die bei Baseline nicht Liraglutide behandelt wurden. Die Post-hoc-Analyse der Zeit bis zum ersten MACE ergab eine geschätzte HR [95% KI] von 0.65 [0.45; 0.96] für die Liraglutide-behandelte Patienten im Vergleich zu Patienten, die nicht mit Liraglutide behandelt wurden.
Mikrovaskuläre Beurteilung
In der LEADER Studie umfassten mikrovaskuläre Ereignisse die Nephropathie und Retinopathie. Die Analyse der Zeit bis zum ersten mikrovaskulären Ereignis unter Liraglutide im Vergleich zum Placebo wies eine HR von 0.84 [0.73; 0.97] auf. Die HR für Liraglutide vs. Placebo betrug 0.78 [0.67; 0.92] hinsichtlich der Zeit bis zum ersten Auftreten der Nephropathie und 1.15 [0.87; 1.52] bis zum ersten Auftreten der Retinopathie.
|











