Eigenschaften/WirkungenATC-Code
L01EX09
Wirkungsmechanismus
Nintedanib ist ein Tyrosinkinaseinhibitor vom Typ der kleinen Moleküle. Zu den inhibierten Tyrosinkinasen gehören die Rezeptoren Platelet-Derived Growth Factor-Receptor (PDGFR) α und β, Fibroblastenwachstumsfaktorrezeptor (FGFR) 1-3 und Vaskulärer Endothelialer Wachstumsfaktorrezeptor (VEGFR) 1-3. Nintedanib bindet kompetitiv an die ATP-Bindungstasche dieser Rezeptoren und blockiert die intrazelluläre Signalgebung, die für die Proliferation, Migration und Transformation von Fibroblasten – die essentielle Pathomechanismen der IPF sind – entscheidend ist. Darüber hinaus hemmt Nintedanib die Kinasen Flt-3, Lck, Lyn und Src.
Pharmakodynamik
Die Aktivierung der FGFR- und PDGFR-Signalkaskaden ist ein entscheidender Faktor für die Proliferation und Migration von Lungenfibroblasten/Myofibroblasten, den kennzeichnenden Zellen der Pathologie der idiopathischen Lungenfibrose. Die potenzielle Bedeutung der Hemmung von VEGFR für die Pathologie der IPF wurde noch nicht vollständig aufgeklärt. Es wird angenommen, dass Nintedanib auf molekularer Ebene die FGFR- und PDGFR-Signalkaskaden hemmt, die die Proliferation und Migration von Lungenfibroblasten vermitteln, indem es an die Adenosintriphosphat-(ATP)Bindungstasche der intrazellulären Rezeptorkinasedomäne bindet und auf diese Weise die Kreuzaktivierung (über Autophosphorylierung der Rezeptor-Homodimere) beeinträchtigt.
In vitro hemmt Nintedanib seine Zielrezeptoren in Konzentrationen im niedrigen nanomolaren Bereich. An Lungenfibroblasten von Patienten mit IPF hemmte Nintedanib die durch PDGF, FGF und VEGF stimulierte Proliferation mit EC50-Werten von 11 nmol/l, 5,5 nmol/l bzw. unter 1 nmol/l. In Konzentrationen zwischen 100 und 1'000 nmol/l hemmte Nintedanib darüber hinaus die durch PDGF, FGF und VEGF stimulierte Fibroblastenmigration und die TGF-β2-induzierte Transformation von Fibroblasten in Myofibroblasten. Darüber hinaus wird angenommen, dass die antiinflammatorische Aktivität von Nintedanib die fibrotische Stimulation begrenzt, indem sie profibrotische Mediatoren wie IL-1β und IL-6 reduziert. Es wurde noch nicht geklärt, welchen Anteil die antiangiogene Aktivität von Nintedanib am Wirkmechanismus des Arzneimittels bei fibrotischen Lungenerkrankungen hat. In In-vivo-Studien hatte Nintedanib eine starke antifibrotische und antiinflammatorische Aktivität.
Klinische Wirksamkeit
Idiopathische Lungenfibrose (IPF)
Die klinische Wirksamkeit von Nintedanib wurde in einer Phase-II-Studie (TOMORROW) und zwei Phase-III-Studien (INPULSIS-1 und INPULSIS-2) bei 1231 Patienten mit IPF untersucht. Bei den genannten Studien handelte es sich um randomisierte, doppelblinde, placebokontrollierte Studien, in denen eine 52-wöchige Behandlung mit Ofev 150 mg zweimal täglich mit Placebo verglichen wurde.
Die Studien INPULSIS-1 und INPULSIS-2 hatten ein identisches Studiendesign und das Design der TOMORROW-Studie war sehr ähnlich. Die Patienten wurden in einem Verhältnis von 3:2 (in der TOMORROW-Studie 1:1) randomisiert einer 52-wöchigen Behandlung mit Ofev 150 mg oder Placebo, jeweils zweimal täglich, zugeteilt. Die TOMORROW-Studie besass darüber hinaus weitere Behandlungsarme (50 mg pro Tag, 50 mg zweimal täglich und 100 mg zweimal täglich), die hier nicht weiter besprochen werden.
Primärer Endpunkt war die jährliche Abnahme der forcierten Vitalkapazität (FVC). Die Änderung des Gesamtscores im Saint George's Respiratory Questionnaire (SGRQ) zwischen Studienbeginn und Woche 52 und die Zeit bis zur ersten akuten IPF-Exazerbation waren wichtige sekundäre Endpunkte der INPULSIS-Studien und sekundäre Endpunkte der TOMORROW-Studie.
Jährliche Abnahme der FVC
Die jährliche Abnahme der FVC (in ml) war bei mit Nintedanib behandelten Patienten signifikant geringer ausgeprägt als bei mit Placebo behandelten Patienten. Die Wirkung der Behandlung war in allen 3 Studien einheitlich. Tabelle 1 enthält die Ergebnisse der Einzelstudien und der gepoolten INPULSIS-Analyse.
Tabelle 1: Jährliche Abnahme der FVC (ml) in den Studien TOMORROW, INPULSIS-1 und INPULSIS-2 sowie der gepoolten INPULSIS-Analyse – behandelte Population2
|
|
TOMORROW
|
INPULSIS-1
|
INPULSIS-2
|
INPULSIS-1 und INPULSIS-2
gepoolt
| |
|
Placebo
|
Ofev 150 mg zweimal täglich
|
Placebo
|
Ofev 150 mg zweimal täglich
|
Placebo
|
Ofev 150 mg zweimal täglich
|
Placebo
|
Ofev 150 mg zweimal täglich
| |
Anzahl der ausgewerteten Patienten
|
83
|
84
|
204
|
309
|
219
|
329
|
423
|
638
| |
Rate 1,2 (SE) der Abnahme über 52 Wochen
|
-190 (36)
|
-60 (39)
|
−239,9 (18,71)
|
−114,7 (15,33)
|
−207,3 (19,31)
|
−113,6 (15,73)
|
−223,5 (13,45)
|
−113,6(10,98)
| |
Vergleich vs. Placebo
| |
Differenz1
|
|
131
|
|
125,3
|
|
93,7
|
|
109,9
| |
95%-KI
|
|
(27; 235)
|
|
(77,7; 172,8)
|
|
(44,8; 142,7)
|
|
(75,9; 144,0)
| |
p-Wert
|
|
0,01363
|
|
<0,0001
|
|
0,0002
|
|
<0,0001
| |
1
Berechnung auf Grundlage eines Regressionsmodells mit Zufallskoeffizienten.
2 Randomisierte Population in der TOMORROW-Studie; behandelte Population in INPULSIS-1, INPULSIS-2 und den gepoolten INPULSIS-Daten
3 Nominaler p-Wert.
|
Alle präspezifizierten Sensitivitätsanalysen bestätigten die Robustheit der Wirkung von Nintedanib im Sinne einer Reduktion der jährlichen Abnahme der FVC. Darüber hinaus wurden vergleichbare Auswirkungen auf andere Endpunkte der Lungenfunktion wie beispielsweise die Änderung der FVC in Woche 52 gegenüber dem Ausgangwert und die FVC-Responder-Analyse beobachtet, was die Wirkungen von Nintedanib im Sinne einer Verlangsamung des Fortschreitens der Erkrankung untermauert. Abbildung 1 zeigt den Verlauf der Änderung gegenüber dem Ausgangswert über die Zeit in beiden Behandlungsgruppen (auf Grundlage der gepoolten Analyse der Studien INPULSIS-1 und INPULSIS-2).
Abbildung 1: Mittlere (SEM) beobachtete Änderung der FVC gegenüber dem Ausgangswert (ml) über die Zeit, Studien INPULSIS-1 und INPULSIS-2 (gepoolte Daten)
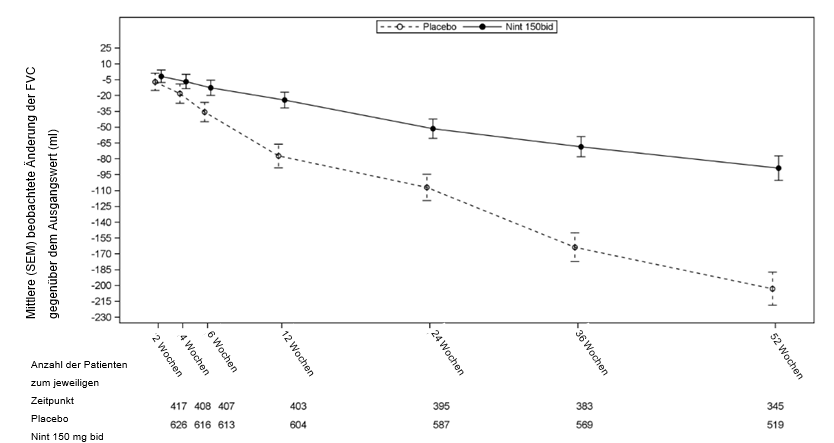
bid = zweimal täglich, SEM = Standardfehler des Mittelwerts
Änderung im SGRQ-Gesamtscore in Woche 52 gegenüber dem Ausgangswert
Der Gesamtscore im St. George's Respiratory Questionnaire (SGRQ) ist ein Mass für die gesundheitsbezogene Lebensqualität (HRQoL) und wurde in Woche 52 ausgewertet. In der TOMORROW-Studie betrug die geschätzte mittlere Änderung im SGRQ-Gesamtscore zwischen Studienbeginn (Baseline) und Woche 52 unter Placebo 5,46, was auf eine Verschlechterung der gesundheitsbezogenen Lebensqualität hinweist, und unter Nintedanib -0,66, was eine stabile gesundheitsbezogene Lebensqualität anzeigt. Die geschätzte mittlere Differenz zwischen Nintedanib und Placebo betrug -6,12 (95%-KI: -10,57; -1,67; p = 0,0071).
In der Studie INPULSIS-2 wiesen die mit Placebo behandelten Patienten einen ausgeprägteren Anstieg des SGRQ-Gesamtscores gegenüber dem Ausgangswert auf als die mit Nintedanib 150 mg zweimal täglich behandelten Patienten. Die Verschlechterung der HRQoL war in der Nintedanib-Gruppe geringer ausgeprägt. Die Differenz zwischen den Behandlungsgruppen war statistisch signifikant (-2,69; 95%-KI: -4,95; -0,43; p = 0,0197).
In der Studie INPULSIS-1 fiel der Anstieg des SGRQ-Gesamtscores in Woche 52 gegenüber dem Ausgangswert in der Nintedanib- und Placebogruppe vergleichbar aus (Differenz zwischen den Behandlungsgruppen: -0,05; 95%-KI: -2,50; 2,40; p = 0,9657). In der gepoolten Analyse der INPULSIS-Studien war die geschätzte mittlere Änderung im SGRQ-Gesamtscore zwischen Ausgangswert und Woche 52 in der Nintedanib-Gruppe (3,53) geringer als in der Placebogruppe (4,96). Die Differenz zwischen den Behandlungen betrug -1,43 (95%-KI: -3,09; 0,23; p = 0,0923). Insgesamt ist der über den SGRQ-Gesamtscore beurteilte Einfluss von Nintedanib auf die gesundheitsbezogene Lebensqualität moderat und weist auf eine geringer ausgeprägte Verschlechterung hin als unter Placebo.
Zeit bis zur ersten akuten IPF-Exazerbation
In den Studien TOMORROW und INPULSIS-2 war das Risiko für eine erste akute IPF-Exazerbation über den Zeitraum von 52 Wochen bei mit Nintedanib behandelten Patienten signifikant geringer als bei mit Placebo behandelten Patienten (Hazard Ratio [HR]: 0,16; 95%-KI: 0,04; 0,71; p = 0,0054) bzw. (HR: 0,38; 95%-KI: 0,19; 0,77; p = 0,005). In der Studie INPULSIS-1 gab es keine Differenz zwischen den Behandlungsgruppen (HR: 1,15; 95%-KI: 0,54; 2,42; p = 0,6728).
Überlebensanalyse
In der präspezifizierten gepoolten Analyse der Überlebensdaten der INPULSIS-Studien fiel die Gesamtmortalität über 52 Wochen in der Nintedanib-Gruppe (5,5 %) numerisch niedriger aus als in der Placebogruppe (7,8 %). Die Analyse der Zeit bis zum Tod ergab eine HR von 0,70 (95%-KI: 0,43; 1,12; p = 0,1399). Die Ergebnisse für alle Überlebensendpunkte (wie Mortalität während der Behandlung und respiratorische Mortalität) zeigten einheitlich numerische Differenzen zugunsten von Nintedanib, die jedoch keine statistische Signifikanz erreichten.
Langzeitbehandlung mit Ofev bei Patienten mit IPF (INPULSIS-ON)
In eine unverblindete Verlängerungsstudie zu Ofev wurden 734 Patienten mit IPF aufgenommen. Einige Patienten wurden für mehr als 5 Jahre mit Ofev behandelt. Patienten, welche die 52-wöchige Behandlungsphase in einer INPULSIS-Studie abgeschlossen haben, erhielten im Rahmen der Verlängerungsstudie INPULSIS-ON eine unverblindete Behandlung mit Ofev. Die mediane Expositionsdauer für Patienten, die sowohl in einer INPULSIS-Studie als auch in der INPULSIS-ON-Studie mit Ofev behandelt wurden, betrug 44,7 Monate (Bereich 11,9–68,3). Die adjustierte jährliche Rate der FVC-Abnahme über 192 Wochen lag bei −135,1 (5,8) ml/Jahr bei allen behandelten Patienten und deckte sich mit der jährlichen Rate der FVC-Abnahme bei Patienten, die in den INPULSIS-Studien der Phase III mit Ofev behandelt wurden (−113,6 ml pro Jahr). Das Profil unerwünschter Ereignisse von Ofev in der INPULSIS-ON-Studie war dem in den INPULSIS-Studien der Phase III ähnlich.
IPF-Patienten mit fortgeschrittener Beeinträchtigung der Lungenfunktion (INSTAGE)
Eine doppelblinde, randomisierte Parallelgruppenstudie zur Beurteilung der Wirksamkeit und Sicherheit von Ofev in Kombination mit oralem Sildenafil im Vergleich zur Behandlung mit Ofev allein bei 273 Patienten mit IPF und fortgeschrittener Beeinträchtigung der Lungenfunktion (DLCO < 35 % vorhergesagt) über 24 Wochen.
Die FVC-Abnahme bei Patienten, die mit Ofev allein behandelt wurden, stimmte mit der FVC-Abnahme bei Patienten mit weniger fortgeschrittenen Erkrankungen überein, die in den INPULSIS-Studien der Phase III mit Ofev behandelt wurden. Die Zugabe von Sildenafil zu Ofev brachte keinen signifikanten Nutzen in Bezug auf die Lebensqualität im Vergleich zu Ofev allein. Das Sicherheits- und Verträglichkeitsprofil von Ofev bei IPF-Patienten mit fortgeschrittener Beeinträchtigung der Lungenfunktion deckte sich mit den Profilen, die in den INPULSIS-Studien beobachtet wurden. Das Profil unerwünschter Ereignisse der Kombination aus Ofev und Sildenafil stimmte mit dem bekannten Sicherheitsprofil der einzelnen Komponenten überein, ohne einen Anstieg von schwerwiegenden oder tödlichen unerwünschten Ereignissen im Vergleich zu Ofev allein.
Weitere Daten aus der Phase-IV-Studie INJOURNEY mit zweimal täglicher Gabe von 150 mg Ofev und zusätzlich Pirfenidon:
In einer exploratorischen, unverblindeten, randomisierten Studie wurde die gemeinsame Gabe von 150 mg Nintedanib zweimal täglich plus Pirfenidon (Titration auf 801 mg dreimal täglich) im Vergleich zur alleinigen Gabe von 150 mg Nintedanib zweimal täglich bei 105 Patienten über 12 Wochen untersucht. Primärer Endpunkt war der Prozentsatz an Patienten mit unerwünschten gastrointestinalen Ereignissen von Studienbeginn bis Woche 12. Gastrointestinale unerwünschte Ereignisse traten häufig auf, was mit dem belegten Sicherheitsprofil für jede der beiden Substanzen übereinstimmt. Diarrhoe, Übelkeit und Erbrechen waren die häufigsten unerwünschten Ereignisse, die bei 20 (37,7%) gegenüber 16 (31,4%), 22 (41,5%) gegenüber 6 (11,8%) bzw. 15 (28,3%) gegenüber 6 (11,8%) der Patienten nach Behandlung mit Pirfenidon zusätzlich zu Nintedanib gegenüber Nintedanib allein gemeldet wurden.
Die mittleren (SE) absoluten Änderungen der FVC gegenüber den Ausgangswerte nach 12 Wochen waren −13,3 (17,4) mL in Patienten, welche mit Pirfenidon zusätzlich zu Nintedanib behandelt wurden (n=48) gegenüber −40,9 (31,4) mL in Patienten, welche mit Nintedanib allein behandelt wurden (n=44).
Chronisch fibrosierende Interstitielle Lungenerkrankungen (ILD) mit einem progressiven Phänotyp
Die klinische Wirksamkeit von OFEV bei Patienten mit chronisch fibrosierender ILD mit einem progressiven Phänotyp wurde in einer randomisierten, doppelblinden, Placebo-kontrollierten Phase 3 Studie (INBUILD) untersucht.
Insgesamt wurden n=663 Patienten 1:1 randomisiert. Sie erhielten entweder OFEV 2x150mg pro Tag oder Placebo für mindestens 52 Wochen.
Die Randomisierung wurde stratifiziert gemäss Fibrosemuster in der hochauflösenden Computertomographie (HRCT). N=412 Patienten mit einem UIP (usual interstitial pneumonia)-artigen Fibrosemuster und n=251 Patienten mit anderen Fibrosemustern wurden randomisiert. Für die Studienauswertung wurden 2 co-primäre Populationen definiert: die Gesamtpopulation und die Population mit UIP-artigem Fibrosemuster gemäss HRCT.
Der primäre Studienendpunkt war die jährliche Abnahme der FVC (ml) über 52 Wochen. Weitere Studienendpunkte waren beispielsweise die Zeit bis zur ersten akuten ILD Exazerbation oder zum Tod oder die Zeit bis zum Tod.
Patienten mit der Diagnose einer chronisch fibrosierenden ILD wurden für die Studie berücksichtigt, wenn sie im HRCT eine relevante Fibrosierung aufwiesen (>10% Fibrosierung) und klinische Merkmale einer Krankheitsprogression (definiert als Abnahme der FVC ≥10%, Abnahme der FVC zwischen 5 und 10% mit Verschlechterung in Krankheitssymptomen ODER Bildgebung oder Verschlechterung in Krankheitssymptomen UND Bildgebung) über die vorausgehenden 24 Monate trotz adäquater Behandlung aufwiesen. Die FVC musste ≥45% predicted und die DLCO zwischen 30% und 80% predicted betragen.
Von einer Teilnahme an der Studie ausgeschlossen waren Patienten mit
·IPF, relevanter Bronchokonstriktion (z.B. FEV1/FVC <0,7 vor Bronchodilatation) oder signifikanter pulmonaler Hypertonie
·Erhöhungen der Transaminasen oder des Bilirubins >1,5 ULN
·bekanntem Blutungsrisiko, voller Antikoagulation, kürzlichem Myokardinfarkt oder Schlaganfall
·vorausgegangener Behandlung mit Nintedanib, Pirfenidon, Azathioprin, Cyclosporin, Mycophenolat, Tacrolimus, oralen Kortikoiden >20mg/Tag oder oralen Kortikoiden+Azathioprin+N-Acetylcystein innert 4 Wochen vor Randomisierung*
·vorausgegangener Behandlung mit Cyclophosphamid innert 8 Wochen vor Randomisierung*
·vorausgegangener Behandlung mit Rituximab innert 6 Monaten vor Randomisierung*
* der Einsatz der genannten Medikamente war ab 6 Monaten nach Studienbeginn wieder gestattet, soweit klinisch indiziert
Die Studienteilnehmer waren im Wesentlichen Kaukasier (74%) und Asiaten (25%). 54% der Patienten waren männlich, 49% hatten niemals geraucht, das mittlere Alter betrug 66 Jahre und die FVC betrug im Mittel 69% predicted. Die zugrundeliegenden ILDs waren Hypersensitivitätspneumonien (26%), autoimmun-assoziierte ILDs (26%), idiopathische nicht-spezifische interstitielle Pneumonie (19%), unklassifizierbare idiopathische interstitielle Pneumonie (17%) und andere ILDs (12%).
Jährliche Abnahme der FVC (ml)
Über 52 Wochen wurde eine statistisch signifikante Reduktion in der Abnahme der FVC unter der Behandlung mit OFEV versus Placebo beobachtet. Der Unterschied von OFEV zu Placebo betrug 107ml (Tabelle 2).
Tabelle 2: Jährliche Abnahme der FVC (ml, primärer Studienendpunkt INBUILD Studie)
|
|
Gesamtpopulation
|
Subpopulation
UIP-artig
|
Subpopulation
Andere Fibrosemuster in der HRCT
| |
|
OFEV
|
Placebo
|
OFEV
|
Placebo
|
OFEV
|
Placebo
| |
Anzahl der ausgewerteten Patienten
|
332
|
331
|
206
|
206
|
126
|
125
| |
Ratea (SE) der Abnahme über 52 Wochen
|
-80,8
|
-187,8
|
-82,9
|
-211,1
|
-79,0
|
-154,2
| |
Vergleich vs Placebo
Differenza
|
107,0
|
128,2
|
75,2*
| |
95%-KI
|
(65,4; 148.5)
|
(70,8; 185,6)
|
(15,5; 135,0)*
| |
p-Wert
|
< 0,0001
|
< 0,0001
|
| |
* Ein auf der Subpopulation mit anderen Fibrosemustern in der HRCT beruhender Vergleich wurde nicht in die multiple Testprozedur aufgenommen. Die hier gezeigten Werte dienen beschreibenden Zwecken.
a Basierend auf einem Regressionsmodell mit zufälligen Koeffizienten und den festen kategorialen Effekten von Behandlung, HRCT-Muster, den festen kontinuierlichen Effekten von Zeit, FVC-Ausgangswert (ml) und einschliesslich der Interaktion zwischen Therapie und Zeit und der Interaktion zwischen Ausgangswert und Zeit.
|
Abbildung 2 zeigt die zeitliche Entwicklung der FVC-Veränderung gegenüber Studienbeginn in den Behandlungsgruppen.
Abbildung 2. Mittlere (SEM) beobachtete Veränderung der FVC (ml) gegenüber Studienbeginn über 52 Wochen
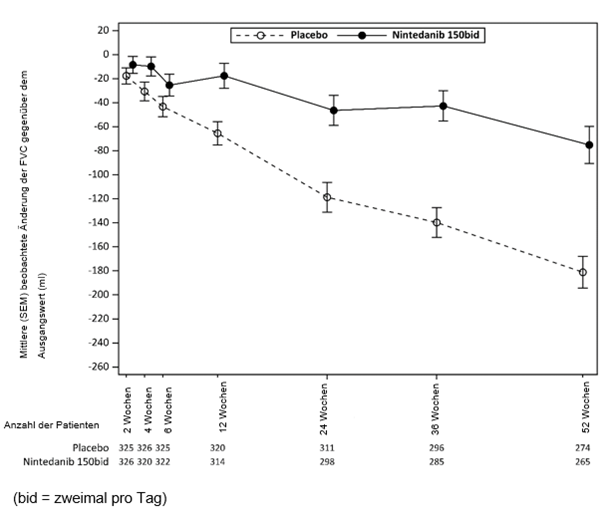
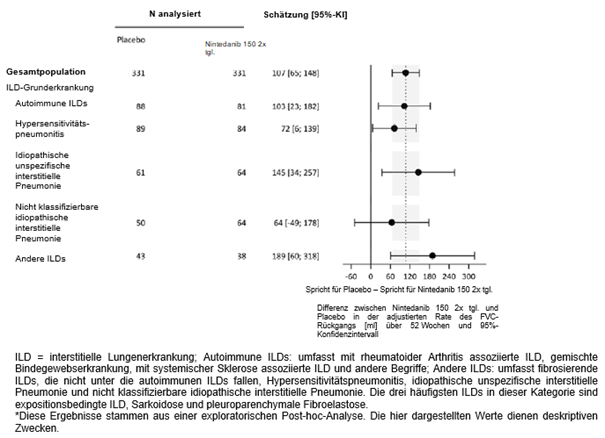
Eine post-hoc durchgeführte exploratorische Analyse nach ILD-Diagnose wurde durchgeführt (Abbildung 3). Insgesamt wurde ein konsistenter Behandlungseffekt in den unterschiedlichen ILD-Diagnosen gezeigt.
Abbildung 3: Jährliche Rate des FVC-Rückgangs (ml) über 52 Wochen basierend auf ILD-Grunddiagnose in Studie 5*
Prozentuale Abnahme der FVC
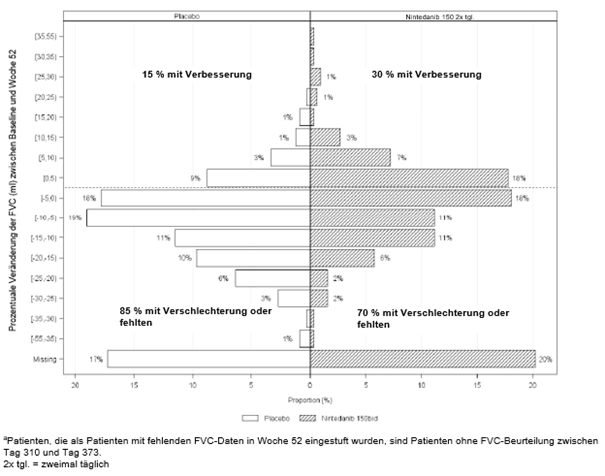
Abbildung 4 zeigt die prozentuale Veränderung der FVC (ml) von Baseline bis Woche 52. Für die Mehrzahl der Patienten fiel die Abnahme der Lungenfunktion unter OFEV geringer aus als unter Placebo.
Abbildung 4: Histogramm der prozentualen Veränderung der FVC (ml) von Baseline bis Woche 52 nach Behandlung mit prozentualen Inkrementen oder Dekrementen in 5er-Schritten (Studie 5)a
Zeit bis zur ersten akuten ILD-Exazerbation oder zum Tod
Das Risiko einer ersten akuten ILD-Exazerbation oder des Todes verminderte sich in der Ofev-Gruppe gegenüber der Placebogruppe über 52 Wochen (HR Ofev versus Placebo: 0,80; 95%-KI: 0,48; 1,34) oder über die gesamte Studiendauer (HR Ofev versus Placebo: 0,67; 95%-KI: 0,46; 0,98), was einer Reduktion des Risikos für eine erste akute ILD-Exazerbation oder den Tod um 33 % bei Patienten unter Ofev im Vergleich zu Placebo entspricht.
Überlebensanalyse
In der INBUILD-Studie wurden die Überlebensdaten unter Ofev im Vergleich zu Placebo ausgewertet, um den primären Endpunkt (FVC) zu untermauern. Die Mortalität jeglicher Ursache wurde über die gesamte Studiendauer und den verfügbaren Nachbeobachtungszeitraum beurteilt, unabhängig von der Todesursache und davon, ob die Behandlung weitergeführt wurde oder nicht. Die Analyse ergab keinen statistisch signifikanten Unterschied über 52 Wochen (HR OFEV versus Placebo 0,94: 95%-KI 0,47; 1,86) bzw. über die gesamte Studiendauer (HR OFEV versus Placebo 0,78; 95%-KI 0,5; 1,21).
Mit systemischer Sklerose assoziierte interstitielle Lungenerkrankung (SSc-ILD)
Die klinische Wirksamkeit von Nintedanib wurde in einer randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie (SENSCIS) bei Patienten mit SSc-ILD untersucht.
Insgesamt wurden 580 Patienten in einem Verhältnis von 1:1 randomisiert um mindestens 52Wochen entweder Ofev 150 mg zweimal täglich oder Placebo zu erhalten. Die Randomisierung wurde nach Anti-Topoisomerase-Antikörper-(ATA)-Status stratifiziert. Einzelne Patienten setzten die verblindete Studienbehandlung bis zu 100 Wochen lang fort.
Die Diagnose der Patienten mit SSc-ILD beruhte auf den Klassifikationskriterien für SSc des American College of Rheumatology / der European League Against Rheumatism, wenn das Auftreten der Erkrankung (erstes Nicht-Raynaud-Symptom) weniger als 7 Jahre zurücklag und eine mindestens 10 %ige Lungenfibrose vorlag, ermittelt anhand eines in den vorausgegangenen 12 Monaten durchgeführten hochauflösenden Computertomografie (HRCT)-Scans.
Die FVC musste bei den Patienten mindestens 40 % des geschätzten Wertes betragen, während die DLCO 30-89 % des geschätzten Wertes betragen musste. Patienten mit relevanten Atemwegsobstruktionen (d.h. FEV1/FVC vor Bronchodilatation unter 0,7) oder einer vorherigen oder anstehenden hämatopoetischen Stammzelltransplantation durften nicht an der Studie teilnehmen. Weitere Ausschlusskriterien waren erhöhte ALT-, AST- oder Bilirubin-Werte (>1,5xOGN), ein erhöhtes Risiko für Blutungen (einschliesslich therapeutische Antikoagulation), kürzlich erfolgter Myokardinfarkt oder Schlaganfall, eine signifikante pulmonale Hypertonie, Geschwüre an mindestens drei Fingerkuppen, eine schwere Fingernekrose mit erforderlicher Hospitalisierung in der Anamnese sowie eine sklerodermale renale Krise in der Anamnese. Patienten wurden ebenfalls ausgeschlossen, wenn sie andere Prüfmedikamente erhielten, bereits mit Nintedanib oder Pirfenidon behandelt worden waren und 8 Wochen vor Randomisierung Azathioprin oder 6 Monate vor Randomisierung Cyclophosphamid oder Cyclosporin A erhalten hatten. Eine stabile Therapie mit Mycophenolat oder Methotrexat sowie Prednison ≤10 mg/Tag oder Äquivalent war zulässig.
Primärer Endpunkt war die jährliche Abnahme der forcierten Vitalkapazität (FVC) über 52 Wochen.
Wichtige sekundäre Endpunkte waren die absolute Veränderung des modifizierten Rodnan Skin Score (mRSS) in Woche 52 gegenüber dem Ausgangswert, die absolute Veränderung des Gesamtscores im Saint George's Respiratory Questionnaire (SGRQ) in Woche 52 gegenüber dem Ausgangswert sowie die Mortalität während der gesamten Studie.
75,2 % der Patienten waren weiblich. Die Patienten waren überwiegend Kaukasier (67 %), Asiaten (25 %) oder hatten eine schwarze Hautfarbe (6 %). Das mittlere (Standardabweichung [SD], Min.-Max.) Alter betrug 54,0 (12,2, 20–79) Jahre. Insgesamt litten 51,9 % der Patienten an einer diffusen kutanen systemischen Sklerose (SSc) und 48,1 % an einer limitierten kutanen SSc. Die mittlere (SD) Zeit seit dem ersten Auftreten eines Nicht-Raynaud-Symptoms betrug 3,49 (1,7) Jahre. 49,0 % der Patienten erhielten zu Studienbeginn eine stabile Therapie mit Mycophenolat (46.5% Mycophenolat-Mofetil, 1.9% Mycophenolat-Natrium, 0.5% Mycophenolsäure) und das bei Patienten mit bzw. ohne Mycophenolat beobachtete Sicherheitsprofil war vergleichbar.
Jährliche Abnahme der FVC
Die jährliche Abnahme der FVC (in ml) über 52 Wochen wurde bei mit Ofev behandelten Patienten um 41,0 ml im Vergleich zu Placebo signifikant reduziert (siehe Tabelle 3), was einem relativen Behandlungseffekt von 43,8% entspricht.
Tabelle 3: Jährliche Abnahme der FVC (ml) über 52 Wochen
|
|
Placebo
|
Ofev
150 mg zweimal täglich
| |
Anzahl der ausgewerteten Patienten
|
288
|
287
| |
Rate1 (SE) der Abnahme über 52 Wochen
|
-93,3 (13,5)
|
-52,4 (13,8)
| |
Vergleich vs. Placebo
| |
Differenz1
|
|
41,0
| |
95%-KI
|
|
(2,9, 79,0)
| |
p-Wert
|
|
<0,05
| |
1
Basierend auf einer Regression mit zufälligen Koeffizienten, adjustiert für Behandlung, Geschlecht, Grösse, Alter, ATA status, FVC-Ausgangswert, FVC*Zeit und Behandlung*Zeit
|
Eine explorative Analyse der Daten bis zu 100 Wochen (maximale Behandlungsdauer in der SENSCIS-Studie) wies darauf hin, dass die Wirkung unter einer Behandlung mit Ofev auf die Verlangsamung der Progression der SSc-ILD über 52 Wochen hinaus anhielt.
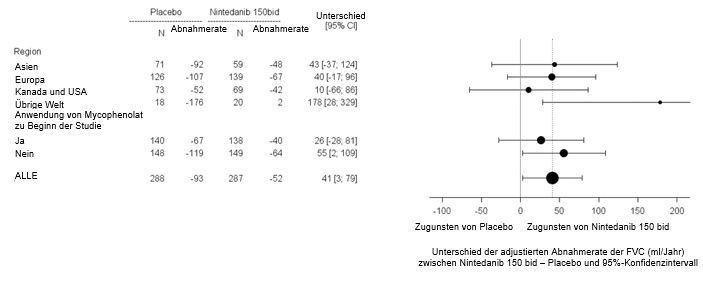
In zwei vorgegebenen Subgruppen-Wirksamkeitsanalysen wurde der mittlere Behandlungsunterschied in Bezug auf die Abnahme der FVC in Woche 52 bei den Patienten nach Region und Anwendung von Mycophenolat untersucht (siehe Abbildung 5).
Abbildung 5: Subgruppenanalyse des mittleren Behandlungsunterschiedes in Bezug auf die Abnahme der FVC (ml) in Woche 52 nach Region und Anwendung von Mycophenolat (SENSCIS)
Prozentuale Änderung der forcierten Vitalkapazität ab Studienbeginn
In Abbildung 6 wird für die SENSCIS Studie die prozentuale Änderung der FVC in ml in Woche 52 gegenüber dem Ausgangswert gezeigt. Die Verschlechterung der Lungenfunktion war bei der Mehrheit der Patienten unter Ofev geringer ausgeprägt als unter Placebo.
Abbildung 6: Histogramm der prozentualen Änderung der FVC (ml) in Woche 52 gegenüber dem Ausgangswert je nach Behandlung und prozentualer Zunahme oder Abnahme um 5 (SENSCIS)a
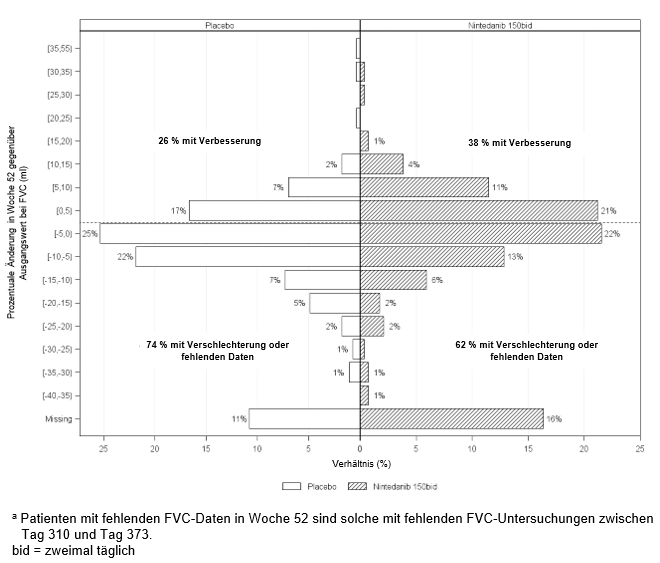
Abbildung 7: Mittlere (SEM) beobachtete Änderung der FVC gegenüber dem Ausgangswert (ml) über 52 Wochen
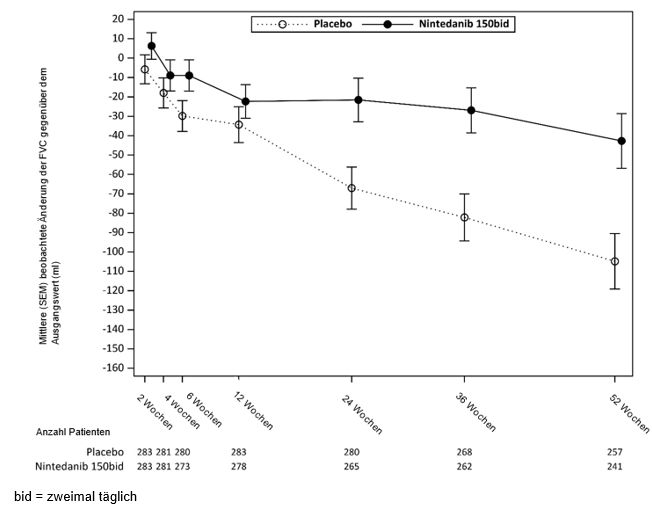
Tabelle 4: Jährliche Abnahme der FVC (% des Sollwerts) über 52 Wochen
|
|
Placebo
|
Ofev
150 mg zweimal täglich
| |
Anzahl der ausgewerteten Patienten
|
288
|
287
| |
Rate1 (SE) der Abnahme über 52 Wochen
|
-2,6 (0,4)
|
-1,4 (0,4)
| |
Vergleich vs. Placebo
| |
Differenz1
|
|
1,15
| |
95%-KI
|
|
(0,09, 2,21)
| |
p-Wert
|
|
<0,05
| |
1
Basierend auf einer Regression mit zufälligen Koeffizienten und den festen kategorialen Effekten von Behandlung, ATA-Status, den festen kontinuierlichen Effekten von Zeit, FVC-Ausgangswert [% des Sollwerts] und einschliesslich der Interaktion zwischen Therapie und Zeit und der Interaktion zwischen Ausgangswert und Zeit. Als zufälliger Effekt wurden patientenspezifisch Intercept und Zeit angegeben. Die Messfehler-Varianz (within-patient error) innerhalb eines Patienten wurde durch eine unstrukturierte Varianz-Kovarianz-Matrix modelliert. Die interindividuelle Variabilität wurde durch eine Varianz-Kovarianz-Matrix der Varianzkomponenten modelliert.
|
Änderung des modifizierten Rodnan Skin Scores (mRSS) in Woche 52 gegenüber dem Ausgangswert
Die adjustierte mittlere absolute Veränderung des mRSS in Woche 52 gegenüber dem Ausgangswert war zwischen der Ofev-Gruppe (-2,17 (95%-KI -2,69, -1,65)) und der Placebogruppe (-1,96 (95%-KI -2,48, -1,45)) vergleichbar. Die adjustierte mittlere Differenz zwischen den Behandlungsgruppen betrug -0,21 (95%-KI -0,94, 0,53; p = 0,5785).
Änderung des Gesamtscores im St. George's Respiratory Questionnaire (SGRQ) in Woche 52 gegenüber dem Ausgangswert
Die adjustierte mittlere absolute Veränderung des SGRQ-Gesamtscores in Woche 52 gegenüber dem Ausgangswert war zwischen der Ofev-Gruppe (0,81 (95%-KI -0,92, 2,55)) und der Placebogruppe (-0,88 (95%-KI -2,58, 0,82)) vergleichbar. Die adjustierte mittlere Differenz zwischen den Behandlungsgruppen betrug 1,69 (95%-KI -0,73, 4,12; p = 0,1711).
Überlebensanalyse
Über die gesamte Studie war die Mortalität zwischen der Ofev-Gruppe (N = 10; 3,5 %) und der Placebogruppe (N = 9; 3,1 %) vergleichbar. Über die gesamte Studie ergab die Analyse der Zeit bis zum Tod eine HR von 1,16 (95%-KI 0,47, 2,84; p = 0,7535).
Wirkung auf das QT-Intervall
In einer speziellen Studie zu Patienten mit Nierenzellkarzinom zeigten QT/QTc-Messungen, dass eine orale Nintedanib Einzeldosis zu 200 mg und mehrmalige orale Nintedanib-Dosen zu 200 mg zweimal täglich für 15 Tage keine Verlängerung des QTcF-Intervalls zur Folge hatten. Eine vollständige Thorough-QT-Study wurde mit Nintedanib nicht durchgeführt.
Studien mit Kindern und Jugendlichen
Nintedanib sollte bei Kindern und Jugendlichen Patienten mit chronisch fibrosierenden interstitiellen Lungenerkrankungen (ILDs) nicht angewendet werden.
|







