ZusammensetzungWirkstoffe
Fulvestrantum.
Hilfsstoffe
Ethanolum 96% 100 mg, alcohol benzylicus 100 mg, benzylis benzoas 150 mg, ricini oleum virginale q.s. ad solutionem pro 1 ml corresp. Ethanolum 12,7 % V/V.
Indikationen/AnwendungsmöglichkeitenMonotherapie
Behandlung des lokal fortgeschrittenen oder metastasierenden, Östrogenrezeptor-positiven Mammakarzinoms bei Frauen mit natürlicher oder induzierter Menopause, deren Erkrankung nach einer Hormontherapie fortgeschritten ist.
Behandlung des lokal fortgeschrittenen oder metastasierenden, Östrogenrezeptor-positiven, humaner epidermaler Wachstumsfaktor-Rezeptor 2 (HER2)-negativen Mammakarzinoms bei postmenopausalen Frauen ohne endokrine Vortherapie.
Kombinationstherapie mit Palbociclib
Fulvestrant Sandoz ist angezeigt zur Behandlung von postmenopausalen Frauen mit Hormonrezeptor (HR)-positivem, humanen epidermalen Wachstumsfaktor-Rezeptor-2 (HER2)-negativem lokal fortgeschrittenem oder metastasiertem Mammakarzinom in Kombination mit Palbociclib bei Frauen, die zuvor eine endokrine Therapie erhielten.
Bei prä- oder perimenopausalen Frauen soll die endokrine Therapie mit einem LHRH-Agonisten (LHRH = Luteinizing Hormone-Releasing Hormone) kombiniert werden.
Dosierung/AnwendungMonotherapie
Fulvestrant Sandoz wird am Tag 1, 15 und 29 sowie danach monatlich in einer Dosierung von 500 mg i.m. appliziert, das heisst je eine Fertigspritze in jede Gesässhälfte (Glutealbereich). Die Injektion soll langsam über 1–2 Minuten erfolgen.
Bei der Injektion von Fulvestrant Sandoz im dorsoglutealen Bereich ist Vorsicht geboten auf Grund der Nähe des darunterliegenden Ischiasnervs.
Kombinationstherapie mit Palbociclib
Bei der kombinierten Behandlung von Fulvestrant mit Palbociclib ist die empfohlene Dosis von Palbociclib 125 mg einmal täglich während 21 Tagen, gefolgt von einer siebentägigen Pause (Schema 3/1), was einen vollständigen Zyklus von 28 Tagen ergibt. Bitte beachten Sie die Fachinformation zu Palbociclib. Fulvestrant wird in der Kombinationstherapie mit Palbociclib analog zur Monotherapie dosiert.
Vor Beginn und im Verlauf der Kombinationsbehandlung mit Palbociclib und Fulvestrant sollten prä- und perimenopausale Frauen mit LHRH Agonisten entsprechend der lokalen klinischen Praxis behandelt werden.
Spezielle Dosierungsanweisungen
Patientinnen mit Leberfunktionsstörungen
Fulvestrant wird hauptsächlich in der Leber metabolisiert. Bei Patientinnen mit einer Leberinsuffizienz Child-Pugh A und B wird keine Dosisanpassung empfohlen (siehe «Pharmakokinetik»). Fulvestrant Sandoz sollte bei diesen Patientinnen nur mit Vorsicht angewendet werden. Die Anwendung von Fulvestrant wurde bei Patientinnen mit einer Leberinsuffizienz Child-Pugh C nicht untersucht und ist kontraindiziert (siehe «Kontraindikationen» und «Pharmakokinetik»).
Bei Patientinnen mit Lebermetastasen und Erhöhung der Transaminasen und/oder des Bilirubins wird keine Dosisanpassung empfohlen.
Patientinnen mit Nierenfunktionsstörungen
Bei Patientinnen mit einer Kreatinin-Clearance grösser als 30 ml/min wird keine Dosisanpassung empfohlen. Die Sicherheit und Wirksamkeit ist bei Patientinnen mit einer Kreatinin-Clearance von weniger als 30 ml/min nicht untersucht worden. Bei diesen Patientinnen sollte Fulvestrant Sandoz nur mit besonderer Vorsicht angewendet werden.
Ältere Patientinnen
Bei älteren Patientinnen ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Fulvestrant Sandoz ist nicht indiziert bei Kindern und Jugendlichen.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Leberinsuffizienz Child-Pugh C.
Schwangerschaft, Stillzeit.
Bitte beachten Sie für die Kombinationstherapie mit Palbociclib die entsprechenden Kontraindikationen in der Fachinformation von Palbociclib (siehe «Kontraindikationen»).
Warnhinweise und VorsichtsmassnahmenMonotherapie
In klinischen Studien bei Patientinnen mit fortgeschrittenem Mammakarzinom wurde Fulvestrant einigen Patientinnen mit erhöhten Transaminasen verabreicht (ALT höher als der obere Grenzwert des normalen Referenzbereichs, aber niedriger als das Doppelte des oberen Grenzwertes). Es bestand kein eindeutiger Zusammenhang zwischen der Fulvestrant-Clearance und der Transaminasenerhöhung. Das Sicherheitsprofil bei Patientinnen mit erhöhten Transaminasen war mit jenem bei Patientinnen mit normalen Leberwerten vergleichbar.
Wie bei allen i.m.-Verabreichungen sollte die Behandlung mit Fulvestrant Sandoz bei Blutungsneigung, Thrombozytopenie oder Behandlung mit Antikoagulantien mit Vorsicht erfolgen.
Thromboembolische Ereignisse wurden in den klinischen Studien beobachtet und sind bei postmenopausalen Frauen mit Brustkrebs ein häufiges Ereignis. Bei der Behandlung mit Fulvestrant Sandoz sollten entsprechende Risikofaktoren abgeklärt werden.
Langzeiteffekte von Fulvestrant auf den Knochen sind nicht untersucht. Aufgrund des Wirkungsmechanismus besteht ein potentielles Risiko einer Osteoporose.
Folgende Ereignisse in Bezug auf die Injektionsstelle wurden bei der Anwendung der Fulvestrant Injektion berichtet: Ischiasbeschwerden, Neuralgien, neuropathische Schmerzen und periphere Neuropathie. Bei der Anwendung von Fulvestrant Sandoz an der dorsoglutealen Injektionsstelle ist Vorsicht geboten auf Grund der Nähe des darunterliegenden Ischiasnervs (Siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).
Kombinationstherapie mit Palbociclib
Hämatologische Störungen
In klinischen Studien mit Palbociclib wurden verminderte Werte für neutrophile Granulozyten beobachtet (siehe «Unerwünschte Wirkungen»). Bei Patientinnen, die Palbociclib in Kombination mit Fulvestrant (Studie 1023) erhielten, wurde verringerte Neutrophilenzahl vom Grad 3 in 55% bzw. Grad 4 in 11% der Fälle berichtet.
Die mediane Zeit bis zum ersten Auftreten einer Neutropenie eines beliebigen Schweregrades betrug 15 Tage (min. 13 Tage bis max. 317 Tage). Die mediane Dauer der Neutropenien vom Grad ≥3 betrug 7 Tage.
Das grosse Blutbild sollte vor Beginn der Behandlung mit Palbociclib und zu Beginn jedes Zyklus sowie jeweils an Tag 15 der ersten beiden Zyklen und bei klinischer Indikation kontrolliert werden.
Bei Auftreten einer Neutropenie beachten Sie bitte die Massnahmen in der Fachinformation von Palbociclib.
Infektionen
Aufgrund seiner myelosuppressiven Eigenschaften kann Palbociclib für Infektionen prädisponieren.
Infektionen, unabhängig vom Schweregrad, wurden bei Patientinnen, die mit Palbociclib plus Fulvestrant behandelt wurden, häufiger (47%) gemeldet als bei Patientinnen in der jeweiligen Kontrollgruppe (31%). Infektionen vom Grad 3 und 4 traten bei 3% bzw. 1% der mit Palbociclib in Kombinationen mit Fulvestrant behandelten Patientinnen auf, verglichen mit 3% bzw. 0% in der entsprechenden Kontrollgruppe.
Die Patientinnen sind hinsichtlich Anzeichen und Symptomen einer Infektion zu überwachen und medizinisch angemessen zu behandeln. Die Patientinnen sind aufzufordern, sich bei Fieber umgehend beim Arzt zu melden.
Bitte beachten Sie die Warnhinweise und Vorsichtsmassnahmen zu Palbociclib in der Fachinformation von Palbociclib (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Ethanol
Dieses Arzneimittel enthält 12 Vol.-% Ethanol (Alkohol), d.h. bis zu 1000 mg pro Dosis, entsprechend 20 ml Bier, 8 ml Wein pro Fertigspritze.
Gesundheitliches Risiko für Patienten, die unter Alkoholismus leiden.
Ist bei Kindern und Patienten mit erhöhtem Risiko auf Grund einer Lebererkrankung oder Epilepsie zu berücksichtigen.
Dieses Arzneimittel enthält 1500 mg Benzylbenzoat pro Dosis.
Dieses Arzneimittel enthält 100 mg Benzylalkohol pro Fertigspritze.
Benzylalkohol kann allergische Reaktionen hervorrufen. Die intravenöse Anwendung von Benzylalkohol war mit schwerwiegenden Nebenwirkungen und Todesfällen bei Neugeborenen («Gasping- Syndrom») verbunden. Die minimale Menge Benzylalkohol, bei der Toxizität auftritt, ist nicht bekannt. Bei Kleinkindern besteht aufgrund von Akkumulation ein erhöhtes Risiko. Grosse Mengen sollten wegen des Risikos der Akkumulation und Toxizität («metabolische Azidose») nur mit Vorsicht und wenn absolut nötig angewendet werden, insbesondere bei Personen mit eingeschränkter Leber- oder Nierenfunktion.
InteraktionenKeines der relevanteren Cytochrom P450 (CYP) Isoenzyme wird in vitro durch Fulvestrant signifikant gehemmt. Die Ergebnisse aus einer klinischen Studie zur Pharmakokinetik, in der Fulvestrant zusammen mit Midazolam verabreicht wurde, deuten ebenfalls darauf hin, dass therapeutische Dosierungen von Fulvestrant keine hemmende Wirkung auf CYP 3A4 haben. Eine klinische Studie mit Rifampicin hat keine Veränderung der Fulvestrant-Clearance infolge der Induktion von CYP 3A4 gezeigt. Resultate einer klinischen Studie mit Ketoconazol, einem potenten CYP 3A4-Inhibitor, zeigte ebenfalls keine klinisch relevante Veränderung der Fulvestrant-Clearance.
Aufgrund der strukturellen Ähnlichkeiten von Fulvestrant und Östradiol, kann Fulvestrant mit den in den in Immunoassays verwendeten Antikörpern kreuzreagieren und zu falsch erhöhten Östradiol-Messwerten führen.
Wirkungen von Fulvestrant auf Palbociclib
Daten aus einer klinischen Studie bei Patientinnen mit Mammakarzinom zeigten, dass bei gleichzeitiger Gabe von Fulvestrant und Palbociclib keine klinisch relevanten Interaktionen zwischen diesen beiden Arzneimitteln auftraten.
Schwangerschaft, StillzeitSchwangerschaft
Wie bei einem wirksamen Antiöstrogen zu erwarten, haben Tierstudien eine Reproduktionstoxizität gezeigt. In Dosierungen, vergleichbar mit der klinischen Dosierung, beeinflusste Fulvestrant in Tierstudien entsprechend seiner antiöstrogenen Wirkung die Fortpflanzung und embryonale/fetale Entwicklung (siehe «Präklinische Daten»). Das mögliche Risiko für den Menschen ist unbekannt. Fulvestrant Sandoz sollte daher bei schwangeren Frauen nicht angewendet werden. Patientinnen im gebärfähigen Alter sollten während der Behandlung mit Fulvestrant Sandoz und während 2 Jahren nach der letzten Dosis eine wirksame Empfängnisverhütung anwenden.
Stillzeit
In der Milch der Ratte wird Fulvestrant in erheblich höheren Konzentrationen als im Rattenplasma gefunden. Es ist nicht bekannt, ob Fulvestrant in der menschlichen Muttermilch ausgeschieden wird. Das mögliche Risiko für den Menschen ist unbekannt. Patientinnen, die Fulvestrant Sandoz erhalten, sollten nicht stillen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenWährend der Behandlung mit Fulvestrant wurde über Asthenie berichtet. Daher sollten Patientinnen, bei denen dieses Symptom auftritt, beim Führen von Fahrzeugen und beim Bedienen von Maschinen besonders vorsichtig sein.
Unerwünschte WirkungenMonotherapie
Bei ungefähr 47% der Patientinnen traten unerwünschte Wirkungen auf; es brachen jedoch lediglich 0,9% der Patientinnen die Therapie aufgrund einer unerwünschten Wirkung während der klinischen Studien ab. Die am häufigsten angegebenen unerwünschten Wirkungen sind Hitzewallungen, Übelkeit und Reaktionen an der Injektionsstelle, die normalerweise leichter Art sind.
Die nachfolgenden Angaben basieren auf den Sicherheitsdaten von insgesamt 889 Patientinnen, welche in sechs Phase II/III-Studien gegenüber einer Fulvestrant-Dosis von 500 mg exponiert waren (siehe auch «Eigenschaften/Wirkungen»).
Die Häufigkeit der unerwünschten Wirkungen sind wie folgt definiert: «sehr häufig» (≥1/10); «häufig» (≥1/100, <1/10); «gelegentlich» (≥1/1000, <1/100); «selten» (≥1/10'000, <1/1000); «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Häufig: urogenitale Infektionen (gewöhnlich leicht).
Erkrankungen des Blutes und des Lymphsystems
Häufig: reduzierte Thrombozytenzahl.
Erkrankungen des Immunsystems
Sehr häufig: Hypersensitivitätsreaktionen (14%).
Häufig: Urtikaria, Angioödem.
Stoffwechsel- und Ernährungsstörungen
Häufig: Anorexie (normalerweise leicht).
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen (meist leicht), Schwindel.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (13%).
Häufig: tiefe Venenthrombosen.
Gelegentlich: Lungenembolie, zerebrovaskulärer Insult.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Nausea (10%).
Häufig: Erbrechen, Diarrhoe.
Leber- und Gallenerkrankungen
Sehr häufig: Erhöhung der Leberenzyme (mehrheitlich <2x obere Grenze des Normbereiches): AST 19%, ALP 18%, ALT 17%.
Häufig: Bilirubinerhöhung.
Gelegentlich: Erhöhung der Gamma-GT, Hepatitis, Leberversagen.
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Rash (gewöhnlich leicht) (11%).
Häufig: Pruritus.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Schmerzen des Muskel-Skelett-Systems (32%; insbesondere Arthralgien).
Häufig: Arthritis.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: vaginale Blutungen.
Gelegentlich: vaginale Candidose, Leukorrhö.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle (18%; wie vorübergehende leichte Schmerzen, Entzündung, Neuralgien sowie neuropathische oder ischiadiforme Schmerzen), Asthenie (14%).
Häufig: Müdigkeit, Fieber, Schmerzen, periphere Neuropathie, Ischialgie.
Gelegentlich: Blutungen an der Injektionsstelle, Hämatome an der Injektionsstelle, Neuralgie.
Kombinationstherapie mit Palbociclib
Die hier wiedergegebenen Daten beziehen sich auf die Palbociclib-Exposition von insgesamt 345 Patientinnen mit HR-positivem, HER2-negativem fortgeschrittenem Mammakarzinom in einer randomisierten Studie in Kombination mit Fulvestrant.
Bei 42% der Patientinnen wurden Dosisreduktionen aufgrund von unerwünschten Wirkungen vorgenommen.
Bei 8% der Patientinnen kam es zu einem dauerhaften Abbruch der Behandlung aufgrund von unerwünschten Wirkungen.
Die am häufigsten (≥20%) berichteten unerwünschten Wirkungen aller Grade waren Neutropenie (84%), Leukopenie (60%), Infektionen (55%), Fatigue (44%), Nausea (36%), Anämie (32%), Stomatitis (30%), Kopfschmerzen (29%), Diarrhoe (27%), Thrombozytopenie (26%), Husten (22%), Konstipation (22%), Erbrechen (22%) und Arthralgie (20%).
Die am häufigsten (≥1%) berichteten schwerwiegenden unerwünschten Wirkungen bei Patientinnen, die Palbociclib plus Fulvestrant erhielten (Studie 1023), waren Infektionen (4,9%), Pyrexie (1,4%) und Neutropenie (1,2%).
Die Häufigkeit der unerwünschten Wirkungen sind wie folgt definiert: «sehr häufig» (≥1/10); «häufig» (≥1/100, <1/10); «gelegentlich» (≥1/1000, <1/100); «selten» (≥1/10'000, <1/1000); «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektionen (54,5%).
Erkrankungen des Blutes und des Lymphsystems
Sehr häufig: Neutropenie (84,1%), Leukopenie (60,0%), Anämie (31,6%), Thrombozytopenie (25,5%).
Gelegentlich: Febrile Neutropenie.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Verminderter Appetit (17,4%).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (28,7%).
Häufig: Dysgeusie.
Augenerkrankungen
Häufig: Vermehrter Tränenfluss, verschwommenes Sehen, trockene Augen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Epistaxis.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Nausea (35,9%), Stomatitis (30,1%), Diarrhoe (27,2%), Erbrechen (21,7%).
Häufig: Mundtrockenheit.
Leber- und Gallenerkrankungen
Sehr häufig: Aspartat-Aminotransferase (AST) erhöht (11,6%).
Häufig: Alanin-Aminotransferase (ALT) erhöht.
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Alopezie (19,4%), Ausschlag (18,3%).
Häufig: Hauttrockenheit.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Arthralgie (20,0%).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Fatigue (44,1%), Pyrexie (13,6%).
Häufig: Asthenie.
Bitte beachten Sie die unerwünschten Wirkungen zu Palbociclib in der Fachinformation von Palbociclib (siehe «Unerwünschte Wirkungen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs gibt vereinzelte Berichte von Überdosierung von Fulvestrant im Menschen. Falls eine Überdosierung eintritt, soll die Behandlung symptomatisch erfolgen. Tierstudien deuten darauf hin, dass sich unter höheren Fulvestrantdosen keine anderen Wirkungen zeigen als solche, die direkt oder indirekt in Zusammenhang mit der antiöstrogenen Wirkung stehen.
Bitte beachten Sie die Fachinformation von Palbociclib für Informationen zur Überdosierung unter Palbociclib.
Eigenschaften/WirkungenATC-Code
L02BA03
Wirkungsmechanismus
Fulvestrant, ein synthetisches Steroid, ist ein Östrogenrezeptor-Antagonist ohne partiell agonistische (östrogenartige) Wirkung. Es bindet kompetitiv und mit einer hohen, dem Östradiol vergleichbaren Affinität an Östrogenrezeptoren. Fulvestrant führt ferner dosisabhängig zu einer Downregulierung des Östrogen- und Progesteronrezeptors.
Fulvestrant hemmt in vitro reversibel das Wachstum von östrogenempfindlichen humanen Mammakarzinomzellen und in vivo die Entwicklung von Tumoren aus Xenotransplantaten bei Nacktmäusen. Fulvestrant hemmt in vitro das Wachstum von Tamoxifen-resistenten Mammakarzinomzellen und in vivo das Wachstum von Tamoxifen-resistenten Mammakarzinomen.
Wirkungen auf das in vivo Gewebe des Mammakarzinoms
Klinische Studien an postmenopausalen Frauen mit primärem Mammakarzinom haben gezeigt, dass Fulvestrant das ER-Protein in ER-positiven Tumoren dosierungsabhängig signifikant reduziert. Es wurde auch eine signifikante Reduktion der Progesteron-Rezeptoren (PR) (Marker für die Östrogen-Aktivität) beobachtet. Diese Resultate sind mit den präklinischen konsistent, die zeigen, dass Fulvestrant keine intrinsische östrogene Aktivität besitzt.
Pharmakodynamik
Siehe oben.
Klinische Wirksamkeit
Wirkungen auf das fortgeschrittene Mammakarzinom
In der Studie CONFIRM wurden 736 postmenopausale Frauen mit fortgeschrittenem Mammakarzinom behandelt, die ein Rezidiv der Erkrankung während oder nach einer adjuvanten Hormontherapie oder eine Progression in der Folge einer Hormontherapie der fortgeschrittenen Erkrankung zeigten. Die Studie umfasste 423 Patientinnen, deren Erkrankung während einer Antiöstrogentherapie wieder aufgetreten oder fortgeschritten war (AE-Untergruppe), und 313 Patientinnen, deren Erkrankung während einer Aromatasehemmer-Therapie wieder aufgetreten oder fortgeschritten war (AI-Untergruppe). In dieser Studie wurden Wirksamkeit und Sicherheit von Fulvestrant 500 mg versus Fulvestrant 250 mg verglichen.
Primärer Endpunkt war die Zeit bis zur Progression (TTP). Die TTP für Fulvestrant 500 mg war signifikant länger als diejenige für Fulvestrant 250 mg, 6,5 vs. 5,5 Monate (HR=0,80; 95% CI 0,68–0,94; p=0,006). Zu den entscheidenden sekundären Endpunkten hinsichtlich der Wirksamkeit zählten die objektive Ansprechrate (ORR), die klinische Benefitrate (CBR) und das Gesamtüberleben (OS). Die finale Überlebensanalyse bei einer Datenreife von 75% ergab, dass das mediane Gesamtüberleben unter Fulvestrant 500 mg 26,4 versus 22,3 Monate unter Fulvestrant 250 mg betrug und mit einem 19%-igen Rückgang des Sterberisikos von Fulvestrant 500 mg im Vergleich zu Fulvestrant 250 mg verbunden war [HR=0,81; 95% CI 0,69–0,96; p=0,016 (nominaler p-Wert ohne Multiplizitätsbereinigung)]. Die objektive Ansprechrate war ähnlich für Fulvestrant 500 mg und 250 mg (13,8% vs. 14,6%; Odds ratio 0,94 [95% CI 0,57–1,55]; p=0,795).
FALCON (Studie D699BC00001) war eine randomisierte, doppelblinde, double-dummy, multizentrische Phase III Studie, welche die Wirksamkeit und Sicherheit von Fulvestrant 500 mg mit Anastrozol 1 mg bei postmenopausalen Frauen mit ER-positivem und/ oder PgR-positivem, HER2-negativem, lokal fortgeschrittenem oder metastasiertem Brustkrebs ohne vorgängige endokrine Therapie verglich. Insgesamt wurden 462 Patientinnen 1:1 randomisiert, entweder in den Fulvestrant 500 mg Arm oder in den Anastrozol 1 mg Arm.
Die Randomisierung wurde stratifiziert nach Tumorstadium (lokal fortgeschritten oder metastasierend), nach vorgängiger Chemotherapie für die fortgeschrittene Erkrankung und nach Messbarkeit der Krankheit.
Der primäre Wirksamkeitsendpunkt der Studie war das vom Prüfarzt nach RECIST 1.1 (Response Evaluation Criteria in Solid Tumors) evaluierte PFS. Die wichtigsten sekundären Endpunkte zur Wirksamkeit beinhalteten das OS und die ORR.
Die in die Studie eingeschlossenen Patientinnen hatten ein medianes Alter von 63 (36–90) Jahren. Die Mehrheit der Patientinnen (87,0%) wies zu Studienbeginn eine Metastasierung auf. 55,0% der Patientinnen hatten viszerale Metastasen. Insgesamt erhielten 17,1% der Patientinnen zuvor ein Chemotherapie Regimen für ihre fortgeschrittene Erkrankung; 84,2% der Patientinnen hatte messbare Metastasen. Es wurden circa 40% der Patientinnen in Russland und in der Ukraine eingeschlossen. Patientinnen, welche im osteuropäischen Raum eingeschlossen wurden, erhielten häufiger eine vorgängige neoadjuvante und/oder adjuvante Chemotherapie im Vergleich zur restlichen Studienpopulation (27,1% vs. 9,8%).
Im Fulvestrant Arm wurde eine statistisch signifikante Verbesserung des PFS beobachtet verglichen mit dem Anastrozol Arm [HR=0,797 (95% CI 0,637–0,999; 2-seitiges p=0,0486)]. Zum Zeitpunkt der Auswertung waren in der Fulvestrant Gruppe 143 (62,2%) Patientinnen ohne Progression, verglichen mit 166 (71,6%) in der Anastrozol Gruppe. Das mediane PFS lag bei 16,6 Monaten (95% CI 13,83–20,99) im Fulvestrant Arm und bei 13,8 Monaten (95% CI 11,99–16,59) im Anastrozol Arm. Zum Zeitpunkt der Analyse waren die Daten zum Gesamtüberleben (OS) noch nicht reif (31%). Es gab zu diesem Zeitpunkt keinen statistisch signifikanten Unterschied bzgl. des OS in den beiden Behandlungsarmen (HR 0,875; 95% CI 0,629–1,217; 2-seitiger p=0,4277).
In der Subgruppe der Patientinnen ohne viszerale Metastasen (n=208), lag das HR bei 0,592 (95% CI 0,419–0,837) zwischen Fulvestrant und Anastrozol, mit einem medianen PFS von 22,3 Monaten (95% CI 16,62–32,79) im Fulvestrant Arm gegenüber 13,8 Monate (11,04–16,59) im Anastrozol Arm. In der Subgruppe der Patientinnen mit viszeralen Metastasen (n=254), lag das HR bei 0,993 (95% CI 0,740–1,331) zwischen Fulvestrant und Anastrozol, mit einem medianen PFS von 13,8 Monaten (11,04–16,53) im Fulvestrant Arm gegenüber 15,9 Monate (11,27–16,89) im Anastrozol Arm.
Zwei klinische Phase III Studien wurden an insgesamt 851 postmenopausalen Frauen mit fortgeschrittenem Mammakarzinom und Rezidiv während oder nach adjuvanter Hormontherapie oder einer Progression unter einer Hormontherapie durchgeführt.
Verglichen wurde Fulvestrant 250 mg 1x monatlich versus Anastrozol 1 mg. In beiden Studien war Fulvestrant 250 mg in Bezug auf das objektive Ansprechen, den klinischen Benefit (CR, PR und SD), die Zeit bis zur Progression, die Zeit bis zum Versagen der Therapie und die Lebensqualität mindestens gleich wirksam wie Anastrozol.
Kombinationstherapie mit Palbociclib
Die Anwendung von Palbociclib plus Fulvestrant im Vergleich zu Placebo plus Fulvestrant bei Frauen mit HR-positivem, HER2-negativem fortgeschrittenem Mammakarzinom, deren Erkrankung nach vorausgegangener endokriner Therapie fortgeschritten war, wurde in einer internationalen, randomisierten, doppelblinden, multizentrischen Parallelgruppen-Studie (Studie 1023, n=521) untersucht.
Die Patientinnen wurden hinsichtlich dokumentierter Sensitivität gegenüber einer vorausgegangenen hormonellen Therapie, Menopausenstatus bei Studieneintritt (prä-/peri- vs. postmenopausal) und Vorliegen viszeraler Metastasen stratifiziert. Die beiden Arme waren bezüglich demographischer Daten und prognostischer Charakteristika gut ausgewogen. In beiden Behandlungsarmen hatten die meisten Patientinnen ein vorausgegangenes Chemotherapie-Regime erhalten. 61,8% wiesen einen ECOG (Eastern Cooperative Oncology Group) PS (Performance Status) von 0 auf, 59,7% hatten viszerale Metastasen und 59,7% erhielten mehr als ein vorausgegangenes hormonelles Regime zur Behandlung ihrer primären Diagnose. Das mediane Alter betrug 57 Jahre (29–88).
Primärer Wirksamkeitsendpunkt war das durch den Prüfer beurteilte PFS gemäss RECIST. Sekundäre Endpunkte waren u.a. OS und ORR.
Im primären Endpunkt PFS zeigte sich für Palbociclib plus Fulvestrant (n=347) ein signifikanter Vorteil gegenüber dem Vergleichsarm (n=174) mit medianem PFS von 11,2 Monaten (95% CI 9,5–12,9) vs. 4,6 Monaten (95% CI 3,5–5,6) (HR 0,497; 95% CI 0,398–0,620; 1-sided p<0,0001).
Die ORR betrug 21,0% für Palbociclib plus Fulvestrant vs. 8,6% im Vergleichsarm (1-sided p=0,0001).
Insgesamt gab es 112 Todesfälle, 71 (20,5%) in der Palbociclib plus Fulvestrant Gruppe vs. 41 (23,6%) im Vergleichsarm.
Nach einer Verlaufsbeobachtung über median 45 Monate wurde die abschliessende Analyse des OS basierend auf 310 Ereignissen (59,5% der randomisierten Patientinnen) durchgeführt. Es wurde für das mediane OS eine Differenz von 6,9 Monaten für Palbociclib plus Fulvestrant (34,9 Monate [95% CI 28,8–40,0]) verglichen mit dem Vergleichsarm (28,0 Monate [95% CI 23,6–34,6]) festgestellt (HR 0,814; 95% CI 0,644–1,029; 1-sided p=0,0429); dieses Resultat ist bei vorbestimmtem Signifikanzlevel von 0,0235 (1-sided) nicht statistisch signifikant.
Wirkungen auf das postmenopausale Endometrium
Die präklinischen Daten lassen vermuten, dass Fulvestrant keine stimulierende Wirkung auf das postmenopausale Endometrium hat. In einer Studie an postmenopausalen gesunden Freiwilligen, welche täglich 20 μg Ethinylestradiol erhielten, führte eine Vorbehandlung mit 250 mg Fulvestrant im Vergleich zu Placebo zu einer signifikant verminderten Stimulierung des Endometriums. Dies zeigt, dass Fulvestrant eine starke antiöstrogene Wirkung auf das postmenopausale Endometrium ausübt.
PharmakokinetikAbsorption
Bei intramuskulärer Injektion von Fulvestrant beträgt die Bioverfügbarkeit 90%. Maximale Plasmaspiegel werden nach einer einmaligen Injektion nach ca. 7 Tagen erreicht. Aufgrund der langsamen Absorption vom Injektionsort bewegen sich die Plasmakonzentrationen von Fulvestrant während eines Zeitraums von mindestens 28 Tagen nach der Injektion in einem engen Bereich (Konzentrationsschwankungen bis zu einem Faktor 3). Bei der Verabreichung von Fulvestrant 500 mg werden innerhalb des ersten Monats der Verabreichung Konzentrationen in der Grössenordnung des Steady State erreicht.
Distribution
Fulvestrant unterliegt einer extensiven und schnellen Verteilung. Das ersichtliche Verteilungsvolumen im Steady State ist gross (ungefähr 3 bis 5 l/kg). Fulvestrant wird in hohem Masse (99%) an Plasmaproteine gebunden. VLDL, LDL und HDL Lipoproteinfraktionen scheinen die hauptsächlichen Bindungspartner zu sein. Die Rolle des SHBG (sex hormone-binding globulin) konnte nicht bestimmt werden.
Metabolismus
Fulvestrant wird in der Leber extensiv metabolisiert. Der Metabolismus beinhaltet unter anderem Oxidation, aromatische Hydroxylierung, Konjugation mit Glukuronsäure und/oder Sulfat an den Hydroxygruppen der Positionen 2, 3 und 17 des Steroidgerüstes sowie Oxidation des Seitenkettensulfoxids. In Antiöstrogenmodellen sind die identifizierten Metaboliten entweder weniger aktiv oder zeigen eine ähnliche pharmakologische Aktivität wie Fulvestrant. Studien an menschlichen Leberpräparaten und rekombinanten menschlichen Enzymen zeigen, dass CYP 3A4 das einzige P450 Isoenzym ist, das an der Oxidation von Fulvestrant beteiligt ist, jedoch scheinen in vivo nicht-P450 abhängige Biotransformationswege zu überwiegen.
Elimination
Die Halbwertszeit beträgt 40–50 Tage und wird durch die langsame Absorption determiniert. Die Ausscheidung erfolgt in Form von Metaboliten über die Fäzes. Die renale Ausscheidung ist unbedeutend (weniger als 1%).
Kinetik spezieller Patientinnengruppen
Leberfunktionsstörungen
Bei Probanden mit einer Leberinsuffizienz Child-Pugh A bzw. B war die mittlere Clearance um 30% respektive um 50% reduziert. Patientinnen mit einer Leberinsuffizienz Child-Pugh C wurden nicht untersucht.
Bei Patientinnen mit einer Erhöhung der Transaminasen ist die Clearance von Fulvestrant unverändert.
Nierenfunktionsstörungen
Bei Patientinnen mit einer Kreatinin–Clearance >30 ml/min ist die Clearance von Fulvestrant unverändert. Bei Patientinnen mit einer Kreatinin–Clearance <30 ml/min liegen keine Daten zur Pharmakokinetik vor.
Ältere Patientinnen
Es wurde kein altersbedingter Unterschied im pharmakokinetischen Profil von Fulvestrant festgestellt (Altersbereich 33 bis 89 Jahre).
Ethnizität
Das Pharmakokinetik-Profil von Fulvestrant ist unabhängig von ethnischen Gruppen.
Präklinische DatenAkute und chronische Toxizität
Fulvestrant wurde von allen Tierarten, bei denen es geprüft wurde, gut vertragen. In Toxizitätsstudien mit intramuskulärer Mehrfachdosierung bei Ratten und Hunden waren die meisten der beobachteten Effekte auf die antiöstrogene Wirkung von Fulvestrant zurückzuführen, insbesondere soweit sie das weibliche Reproduktionssystem, aber auch die anderen hormonempfindlichen Organe bei beiden Geschlechtern betrafen. In Studien an Hunden wurden nach oraler und intravenöser Verabreichung hoher Dosen (Cmax >15-fach) Auswirkungen auf das Herz-Kreislauf-System beobachtet (leichte Erhöhung des S-T-Segments im EKG [oral] und Sinusstillstand bei einem Hund [intravenös]).
Untersuchungen zur lokalen Toleranz an Kaninchen zeigten leichte, reversible Muskelnekrosen und Myositis an der Injektionsstelle.
Mutagenität
Fulvestrant zeigte kein genotoxisches Potential.
Karzinogenität
Eine Karzinogenitätsstudie über 2 Jahre (intramuskuläre Verabreichung) zeigte bei weiblichen Ratten bei sehr hohen Dosen von 10 mg/Ratte/15 Tage eine erhöhte Inzidenz gutartiger Granulosazelltumoren der Ovarien. In einer zweijährigen Onkogenitätsstudie an Mäusen war die orale Verabreichung bei Dosen von 150 und 500 mg/kg/Tag mit einem erhöhten Auftreten benigner und maligner Keimstrang-Stromatumoren des Ovars assoziiert. Der No Observed Effect Level (NOEL) für diese Befunde lag bei 10 mg/Ratte/30 Tage bei der Ratte bzw. bei 20 mg/kg/Tag bei der Maus. Die Induktion solcher Tumore entspricht den pharmakologisch ausgelösten, durch endokrine Feedbackmechanismen bedingten Veränderungen der Gonadotropinkonzentrationen durch das Antiöstrogen bei Tieren mit Zyklus. Daher werden diese Befunde nicht als relevant angesehen für die Anwendung von Fulvestrant bei postmenopausalen Frauen und bei prä-/perimenopausalen Frauen bei gleichzeitiger Behandlung mit LHRH Analoga.
Reproduktionstoxizität
Bei Ratten führte Fulvestrant bei einer Dosierung von 0,01 mg/kg/Tag zu einer reversiblen Verminderung der weiblichen Fertilität und der Überlebensrate der Embryonen, bei höheren Dosierungen zu Dystokie und zu vermehrtem Auftreten fetaler Missbildungen, einschliesslich Tarsalflexuren. Bei Kaninchen, die Fulvestrant in Dosierungen ≥1 mg/kg/Tag erhielten, konnte die Trächtigkeit nicht aufrecht erhalten werden und in Dosierungen von bis zu 0,25 mg/kg/Tag wurden eine Zunahme des Plazentagewichts und Verluste nach der Implantation beobachtet, aber keine Auswirkungen auf die Entwicklung der Feten.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, nicht über 30°C und ausser Reichweite von Kindern lagern.
Hinweise für die Handhabung
Die Originalverpackung enthält zwei 5 ml Fertigspritzen aus Glas mit einem Stempel aus Polystyrol in einer Schale zusammen mit je einer Nadel mit Sicherheitssystem (SafetyGlide™).
Die Fertigspritze enthält eine klare, farblose bis gelbe, visköse Lösung.
Die Fertigspritze ist nur zum einmaligen Gebrauch bestimmt.
Die Injektion soll entsprechend den lokalen Weisungen betreffend der Durchführung einer Intramuskulär-Injektion mit grossem Volumen angewendet werden.
Hinweis: Bei der Injektion von Fulvestrant Sandoz im dorsoglutealen Bereich ist Vorsicht geboten auf Grund der Nähe des darunterliegenden Ischiasnervs (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die SafetyGlide™ Nadel darf vor Gebrauch nicht autoklaviert werden.
Handhabung für die SafetyGlide™ Spritze:
Nehmen Sie die Fertigspritze aus der Schale und prüfen Sie, ob sie nicht beschädigt ist.
Öffnen Sie die äussere Verpackung der Sicherheitsnadel (SafetyGlideTM).
Parenterale Lösungen müssen vor der Verabreichung visuell auf Partikel und Farbveränderungen geprüft werden.
Abbildung 1
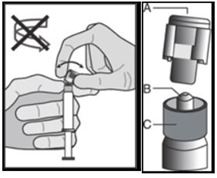
Halten Sie die Spritze aufrecht am strukturierten Teil (C) mit der einen Hand. Mit der anderen Hand fassen Sie die Verschlusskappe (A) und bewegen diese vor und zurück, bis die Verschlusskappe sich löst und abgezogen werden kann. Nicht drehen (siehe Abbildung 1).
Abbildung 2
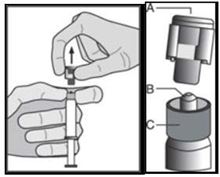
Entfernen Sie die Verschlusskappe (A) mit einem leichten Zug nach oben. Zur Erhaltung der Sterilität berühren Sie nicht den Nadelanschluss (B) (siehe Abbildung 2).
Abbildung 3
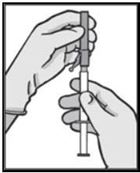
Verbinden Sie die Injektionsnadel mit dem Nadelanschluss (Luer-Lock) und drehen Sie solange, bis beide Teile fest miteinander verbunden sind.
Prüfen Sie, ob die Nadel fest mit dem Luer-Anschluss verbunden ist, bevor Sie die Schutzabdeckung gerade von der Spritze abziehen, ohne die Nadelspitze zu beschädigen.
Führen Sie die gefüllte Spritze zur Applikationsstelle.
Entfernen Sie die überschüssige Luft aus der Spritze.
Abbildung 4
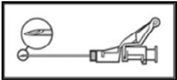
Verabreichen Sie die Lösung langsam (1–2 Min/Injektion) intramuskulär ins Gesäss (Glutealbereich).
Als Hilfe für den Anwender ist die Abschrägung der Nadelöffnung dem Hebelarm zugewandt, wie in Abbildung 4 gezeigt.
Abbildung 5
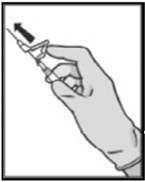
Aktivieren Sie sofort nach dem Herausziehen der Nadel das Sicherheitssystem mit einem Fingerdruck nach vorne (siehe Abb. 5).
Hinweis: Aktivieren Sie das Sicherheitssystem immer mit der Nadelspitze von sich und anderen wegweisend. Sie hören ein Klicken. Überzeugen Sie sich, dass die Nadelspitze ganz abgedeckt ist.
Entsorgen Sie die Spritze nach der einmaligen Anwendung in einen dafür vorgesehenen Behälter.
SafetyGlide™ ist ein für Becton Dickinson and Company registriertes Warenzeichen.
Autorisierte Vertretung: Becton Dickinson, Laagstraat 57, B-9140 Temse.
Zulassungsnummer65651 (Swissmedic)
Packungen2 Fertigspritzen zu je 250 mg/5 ml. [B]
ZulassungsinhaberinSandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz
Stand der InformationFebruar 2024
|





