ZusammensetzungWirkstoffe
Paliperidonum (ut Paliperidoni palmitas).
Hilfsstoffe
Polysorbatum 20, Macrogolum 4000, Acidum citricum monohydricum, Natrii dihydrogenophosphas monohydricus, Natrii hydroxidum, Aqua ad iniectabile.
1 Fertigspritze à 175 mg enthält 3.59 mg Natrium.
1 Fertigspritze à 263 mg enthält 5.40 mg Natrium.
1 Fertigspritze à 350 mg enthält 7.18 mg Natrium.
1 Fertigspritze à 525 mg enthält 10.78 mg Natrium.
Indikationen/AnwendungsmöglichkeitenTrevicta, eine injizierbare 3-Monatsformulierung von Paliperidonpalmitat, ist zur Behandlung von Schizophrenie bei erwachsenen Patienten indiziert, die mindestens vier Monate lang adäquat auf die injizierbare 1-Monatsformulierung von Paliperidonpalmitat eingestellt sind.
Dosierung/AnwendungTrevicta darf erst angewendet werden, nachdem der betreffende Patient mindestens vier Monate lang adäquat auf Paliperidonpalmitat als Depotinjektion für 1 Monat eingestellt wurde. Zur Festlegung einer einheitlichen Erhaltungsdosis wird empfohlen, die letzten beiden Dosen der Depotinjektion für 1 Monat vor Beginn der Anwendung von Trevicta in derselben Dosierungsstärke zu verabreichen.
Übliche Dosierung
Mit der Anwendung von Trevicta ist zum Zeitpunkt der nächsten geplanten Dosis der Paliperidonpalmitat-Depotinjektion für 1 Monat zu beginnen. Die Trevicta-Dosis richtet sich dabei nach der Dosis der vorherigen Depotinjektion für 1 Monat (siehe Tabelle 1). Trevicta kann bis zu 7 Tage vor oder nach dem monatlichen Zeitpunkt der nächsten geplanten Dosis der Paliperidonpalmitat-Depotinjektion für 1 Monat verabreicht werden.
Tabelle 1: Umrechnung der letzten Dosis von Paliperidonpalmitat als Depotinjektion für 1 Monat auf die Dosis von Paliperidonpalmitat als Depotinjektion für 3 Monate (Trevicta) mithilfe des Multiplikationsfaktor 3.5
|
Betrug die Dosis der Paliperidonpalmitat Depotinjektion für 1 Monat zuletzt:
|
Ist die Anwendung von Trevicta in folgender Dosis zu beginnen:
| |
50 mg
|
175 mg
| |
75 mg
|
263 mg
| |
100 mg
|
350 mg
| |
150 mg
|
525 mg
|
Zur Umrechnung der 25 mg Dosis der Paliperidonpalmitat-Depotinjektion für 1 Monat wurden keine Untersuchungen durchgeführt.
Nach der Anfangsdosis sollte Trevicta im Abstand von 3 Monaten verabreicht werden. Bei Bedarf kann alle 3 Monate je nach Verträglichkeit und/oder Wirksamkeit bei dem jeweiligen Patienten eine Dosierungsanpassung in Stufen von 175 mg bis 525 mg durchgeführt werden. Aufgrund der langen Wirksamkeit von Trevicta ist das Ansprechen des Patienten auf eine veränderte Dosierung möglicherweise erst nach mehreren Monaten erkennbar (siehe «Pharmakokinetik»).
Auslassen einer Dosis bzw. mehrerer Dosen
Dosierungsfenster: Es sollten nach Möglichkeit keine Trevicta-Dosen ausgelassen werden. In Ausnahmefällen kann den Patienten die Injektion bis zu 2 Wochen vor oder nach dem 3-Monats-Zeitpunkt verabreicht werden.
Ausgelassene Dosis über einen Zeitraum von mehr als 3,5 bzw. bis zu 4 Monaten: Wenn seit der letzten Trevicta-Injektion mehr als 3,5 Monate (bis zu 4 Monate) vergangen sind, sollte Trevicta sobald wie möglich in der zuletzt angewendeten Dosis verabreicht werden. Die Folgeinjektionen sind dann wieder im Abstand von 3 Monaten zu geben.
Ausgelassene Dosis über einen Zeitraum von mehr als 4 bzw. bis zu 9 Monaten: Wenn seit der letzten Trevicta-Injektion mehr als 4 Monate (bis zu 9 Monate) vergangen sind, die nächste Trevicta-Dosis NICHT verabreichen. Stattdessen muss die Therapie nach dem in Tabelle 2 gezeigten Plan erneut eingeleitet werden.
Tabelle 2: Erneute Einleitung der Therapie nach Auslassen von Trevicta über einen Zeitraum von mehr als 4 bzw. bis zu 9 Monaten
|
Letzte Dosis der Trevicta Depotinjektion für 3 Monate
|
Zwei Dosen der Paliperidonpalmitat Depotinjektion für 1 Monat im Abstand von einer Woche verabreichen (in den M. deltoideus)
|
Dann die Dosis der Trevicta Depotinjektion für 3 Monate verabreichen (in den M. deltoideusa oder in den M. gluteus)
| |
|
Tag 1
|
Tag 8
|
1 Monat nach Tag 8
| |
175 mg
|
50 mg
|
50 mg
|
175 mg
| |
263 mg
|
75 mg
|
75 mg
|
263 mg
| |
350 mg
|
100 mg
|
100 mg
|
350 mg
| |
525 mg
|
100 mg
|
100 mg
|
525 mg
|
a Siehe die Rubrik: «Hinweise zur Anwendung» zur Auswahl der Injektionsnadel für den M. deltoideus nach Körpergewicht.
Ausgelassene Dosis über einen Zeitraum von mehr als 9 Monaten: Wenn seit der letzten Trevicta-Injektion mehr als 9 Monate vergangen sind, ist die Therapie mit Paliperidonpalmitat als Depotinjektion für 1 Monat nach den Angaben in der Fachinformation für dieses Präparat noch einmal von vorne zu beginnen. Die Anwendung von Trevicta kann dann fortgesetzt werden, nachdem der betreffende Patient mindestens vier Monate lang adäquat mit der Paliperidonpalmitat-Depotinjektion für 1 Monat eingestellt wurde.
Umstellung von einem anderen Antipsychotikum auf Trevicta
Trevicta ist erst dann anzuwenden, nachdem der betreffende Patient mindestens vier Monate lang adäquat mit dem Paliperidonpalmitat-Präparat als Depotinjektion für 1 Monat eingestellt wurde (siehe «Indikationen/Anwendungsmöglichkeiten» und «Dosierung/Anwendung»).
Wenn Trevicta abgesetzt wird, ist die verlängerte Freisetzung des Wirkstoffes zu berücksichtigen. Wie es auch bei anderen Antipsychotika empfohlen wird, sollte der fortgesetzte Bedarf einer Medikation gegen vorhandene extrapyramidale Symptome (EPS) regelmässig neu beurteilt werden.
Umstellung von Trevicta auf Paliperidonpalmitat als Depotinjektion für 1 Monat
Zur Umstellung von Trevicta auf Paliperidonpalmitat als Depotinjektion für 1 Monat sollte zum nächsten geplanten Zeitpunkt anstelle der Trevicta-Dosis eine Paliperidonpalmitat-Depotinjektion für 1 Monat in der entsprechenden, 3,5 Mal niedrigeren Dosis verabreicht werden (siehe Tabelle 3). Danach sollte die Verabreichung der Paliperidonpalmitat-Depotinjektion für 1 Monat in monatlichen Abständen fortgesetzt werden.
Tabelle 3: Umrechnung der letzten Dosis von Paliperidonpalmitat als Depotinjektion für 3 Monate (Trevicta) auf die Dosis von Paliperidonpalmitat als Depotinjektion für 1 Monat mithilfe des Multiplikationsfaktor 3,5
|
Betrug die letzte Trevicta Dosis:
|
Ist Paliperidonpalmitat als Depotinjektion für 1 Monat in folgender Dosis zu verabreichen:
| |
175 mg
|
50 mg
| |
263 mg
|
75 mg
| |
350 mg
|
100 mg
| |
525 mg
|
150 mg
|
Auf die Einleitungsdosierung, wie sie in der Fachinformation für Paliperidonpalmitat als Depotinjektion für 1 Monat beschrieben ist, kann verzichtet werden.
Umstellung von Trevicta auf orale Paliperidon-Retardtabletten
Zur Umstellung von Trevicta auf orale Paliperidon-Retardtabletten sollte 3 Monate nach der letzten Trevicta-Dosis mit der täglichen Dosierung der Paliperidon-Retardtabletten begonnen und die Umstellung im Lauf der nächsten Monate durchgeführt werden (siehe Tabelle 4). Tabelle 4 enthält einen Plan zur Umrechnung der Dosierung, um bei Patienten mit zuvor stabiler Dosierung von Trevicta bei Anwendung von Paliperidon-Retardtabletten einmal täglich eine vergleichbare Paliperidon-Exposition zu erreichen.
Tabelle 4: Erforderliches Schema zur Umstellung von Trevicta auf Paliperidon-Retardtabletten einmal täglich, um eine verlgeichbare Paliperidon-Exposition zu erreichen*
|
|
Wochen seit der letzten Trevicta-Dosis
| |
≥3 Monate bis ≤18 Wochen
|
>18 Wochen bis ≤24 Wochen
|
>24 Wochen
| |
Letzte Trevicta-Dosis
|
Tägliche Dosis der oralen Paliperidon-Retardtabletten
| |
175 mg
|
3 mg
|
3 mg
|
3 mg
| |
263 mg
|
3 mg
|
3 mg
|
6 mg
| |
350 mg
|
3 mg
|
6 mg
|
9 mg
| |
525 mg
|
6 mg
|
9 mg
|
12 mg
|
* Dosen der oralen Paliperidon-Retardtabletten sollten unter Berücksichtigung des Umstellungsgrundes, des Ansprechens auf die vorhergehende Behandlung mit Paliperidon, der Schwere der psychotischen Symptome und/oder der Verträglichkeit individuell abgestimmt werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Trevicta wurde bei Patienten mit eingeschränkter Leberfunktion nicht untersucht. Ausgehend von einer Studie mit oralem Paliperidon sind bei Patienten mit leichter oder mittelschwerer Einschränkung der Leberfunktion keine Dosierungsanpassungen erforderlich. Bei Patienten mit schwerer Einschränkung der Leberfunktion wurde Paliperidon nicht untersucht (siehe «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Trevicta wurde bei Patienten mit eingeschränkter Nierenfunktion nicht systematisch untersucht (siehe «Pharmakokinetik»). Bei Patienten mit leichter Einschränkung der Nierenfunktion (Creatininclearance ≥50 bis <80 ml/min) wird bei der Einleitung der Behandlung mit Paliperidonpalmitat als Depotinjektion für 1 Monat eine Dosierungsanpassung vorgenommen; eine Dosierungsanpassung von Trevicta ist nicht erforderlich. Wie unter «Übliche Dosierung» vorstehend beschrieben, erfolgt die Umstellung auf Trevicta mit einer Dosis im Verhältnis von 3,5 zu 1 gegenüber der letzten stabilisierten Paliperidonpalmitat-Depotinjektion für 1 Monat. Die empfohlene Höchstdosis von Trevicta bei Patienten mit leichter Einschränkung der Nierenfunktion beträgt 350 mg.
Bei Patienten mit mittelschwerer oder schwerer Einschränkung der Nierenfunktion (Creatininclearance <50 ml/min) wird Trevicta nicht empfohlen.
Ältere Patienten
Für ältere Patienten mit normaler Nierenfunktion wird im Allgemeinen dieselbe Dosierung von Trevicta empfohlen wie für jüngere erwachsene Patienten mit normaler Nierenfunktion. Da bei älteren Patienten die Nierenfunktion beeinträchtigt sein kann, ist hinsichtlich der Dosierungsempfehlungen bei solchen Patienten die Rubrik «Patienten mit Nierenfunktionsstörungen» oben zu beachten.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Trevicta bei Patienten <18 Jahren sind nicht untersucht.
Andere Patientengruppen
Für Trevicta werden keine Dosierungsanpassungen auf der Grundlage von Geschlecht, Ethnizität oder Raucherstatus empfohlen. (Hinsichtlich schwangerer und stillender Frauen siehe «Schwangerschaft/Stillzeit».)
Art der Anwendung
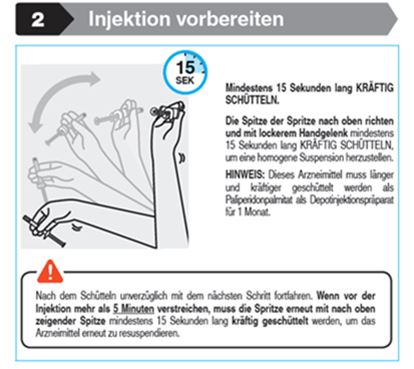
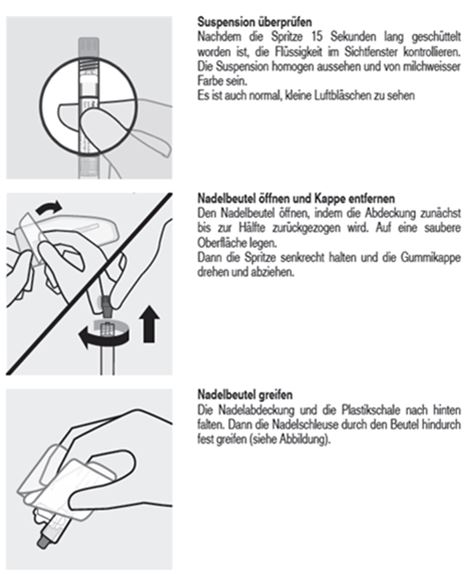
Parenterale Arzneimittel sollten vor der Verabreichung einer Sichtprüfung auf Fremdkörper und Verfärbung unterzogen werden. Es ist wichtig, die Spritze innerhalb von 5 Minuten vor der Verabreichung von Trevicta an den Patienten mindestens 15 Sekunden lang kräftig zu schütteln, um eine homogene Suspension herzustellen (siehe Rubrik «Sonstige Hinweise»).
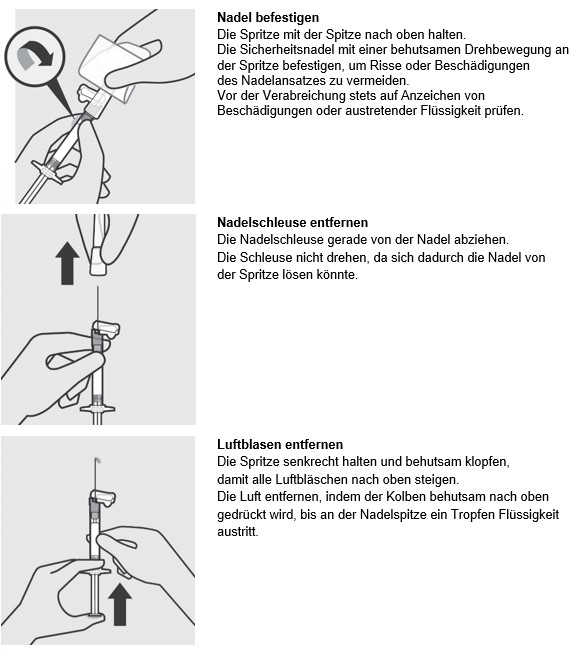
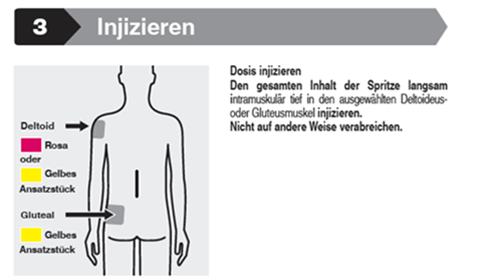
Trevicta ist nur für die intramuskuläre Anwendung bestimmt. Nicht intravasal oder subkutan verabreichen. Die versehentliche Injektion in ein Blutgefäss ist zu vermeiden. Jede Injektion darf nur von einer medizinischen Fachperson verabreicht werden. Die Dosis ist als Einzelinjektion zu verabreichen; die Dosis darf nicht auf mehrere Injektionen aufgeteilt verabreicht werden. Die Injektion ist langsam und tief in den M. deltoideus oder M. gluteus zu verabreichen.
Trevicta darf nur mit den weitlumigen Nadeln verabreicht werden, die der Trevicta-Packung beiliegen. Die Nadeln aus der Packung mit dem Paliperidonpalmitat-Depotinjektionspräparat für 1 Monat oder andere handelsübliche Nadeln dürfen nicht zur Verabreichung von Trevicta verwendet werden.
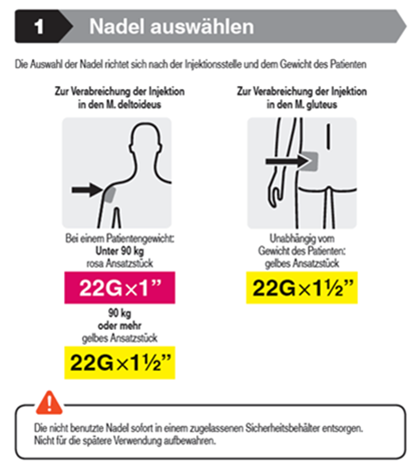
Die empfohlene Nadelgrösse zur Verabreichung von Trevicta in den M. deltoideus richtet sich nach dem Gewicht des Patienten. Für Patienten ≥90 kg (≥200 lbs) wird die weitlumige Nadel mit der Länge 1,5 Zoll (3,81 cm) und einem Aussendurchmesser von 22 Gauge empfohlen. Für Patienten <90 kg (<200 lbs) wird die weitlumige Nadel mit der Länge 1 Zoll (2,54 cm) und einem Aussendurchmesser von 22 Gauge empfohlen. Die Injektion in die Mitte des M. deltoideus verabreichen. Die Injektionen abwechselnd in einen der beiden Deltamuskeln verabreichen.
Für die Verabreichung von Trevicta in den M. gluteus wird, unabhängig vom Körpergewicht, die weitlumige Nadel mit der Länge 1½ Zoll (3,81 cm) und einem Aussendurchmesser von 22 Gauge empfohlen. Die Injektion in den oberen äusseren Quadranten des M. gluteus verabreichen. Die Injektionen abwechselnd in einen der beiden Gluteusmuskeln verabreichen.
Da es sich bei Paliperidon um den aktiven Metaboliten von Risperidon handelt, ist bei der Verabreichung von Trevicta zusammen mit Risperidon oder mit oralem Paliperidon über einen längeren Zeitraum hinweg Vorsicht geboten. Die Datenlage zur Sicherheit der gleichzeitigen Anwendung von Trevicta und anderen Antipsychotika ist begrenzt.
Unvollständige Verabreichung: Zur Vermeidung einer unvollständigen Verabreichung von Trevicta ist darauf zu achten, die Fertigspritze vor der Verabreichung mindestens 15 Sekunden lang kräftig zu schütteln, um eine homogene Suspension zu erzeugen [siehe Rubrik «Sonstige Hinweise»]. Sollte es dennoch dazu kommen, dass eine Dosis nicht vollständig verabreicht wird, die in der Spritze verbliebene Restdosis nicht erneut injizieren und keine weitere Dosis verabreichen. Stattdessen den Patienten bis zur nächsten geplanten 3-Monats-Injektion von Trevicta engmaschig überwachen und entsprechend behandeln.
KontraindikationenTrevicta ist bei Patienten mit bekannter Überempfindlichkeit gegenüber Paliperidon oder einem der der Hilfsstoffe gemäss Zusammensetzung kontraindiziert. Da es sich bei Paliperidon um einen aktiven Metaboliten von Risperidon handelt, ist Trevicta bei Patienten mit bekannter Überempfindlichkeit auf Risperidon kontraindiziert.
Warnhinweise und VorsichtsmassnahmenPaliperidon war in klinischen Studien nach Gabe einer Einzeldosis Trevicta bis zu 18 Monate im Plasma nachweisbar. Die langandauernde Freisetzung von Paliperidon bei Anwendung von Trevicta sollte in die therapeutischen Überlegungen miteinbezogen werden, insbesondere hinsichtlich unerwünschter Wirkungen, pharmakokinetischer und pharmakodynamischer Wechselwirkungen sowie bezüglich Schwangerschaft und Stillzeit.
Malignes Neuroleptika-Syndrom
In Verbindung mit Antipsychotika, einschliesslich Paliperidon, wurde über ein malignes Neuroleptika-Syndrom (MNS) berichtet, das durch Hyperthermie, Muskelsteifigkeit, autonome Instabilität, Bewusstseinsstörungen und erhöhte Serum-Creatinphosphokinase-Werte gekennzeichnet ist. Weitere klinische Anzeichen können Myoglobinurie (Rhabdomyolyse) und akute Niereninsuffizienz sein. Wenn ein Patient Anzeichen oder Symptome entwickelt, die auf ein MNS hindeuten, sollten alle Antipsychotika, einschliesslich Trevicta, abgesetzt werden. Dabei ist die lange Wirksamkeit von Trevicta zu berücksichtigen.
Spätdyskinesie/extrapyramidale Symptome
Arzneimittel mit Dopaminrezeptor-antagonistischen Eigenschaften wurden mit der Induktion einer Spätdyskinesie in Zusammenhang gebracht, die durch unwillkürliche, rhythmische Bewegungen vor allem der Zunge und/oder des Gesichts charakterisiert ist. Bei Auftreten von Anzeichen und Symptomen einer Spätdyskinesie sollte in Erwägung gezogen werden, sämtliche Antipsychotika, einschliesslich Trevicta, abzusetzen. Dabei ist die lange Wirksamkeit von Trevicta zu berücksichtigen.
Extrapyramidale Symptome und Psychostimulanzien
Bei Patienten, die gleichzeitig sowohl Psychostimulanzien (z.B. Methylphenidat) als auch Paliperidon erhalten, ist Vorsicht geboten, da bei der Anpassung eines Arzneimittels oder beider Arzneimittel extrapyramidale Symptome auftreten könnten. Es sollte ein Ausschleichen einer der Behandlungen oder beider Behandlungen erwogen werden (siehe «Interaktionen»).
QT-Intervall
Wie bei anderen Antipsychotika ist Vorsicht geboten, wenn Trevicta Patienten mit Herzrhythmusstörungen in der Vorgeschichte oder Patienten mit angeborenem Long-QT-Syndrom verordnet wird, sowie bei Anwendung zusammen mit Arzneimitteln mit bekannter QT-verlängernder Wirkung.
Überempfindlichkeitsreaktionen
Im Rahmen der Anwendungsbeobachtung nach der Markteinführung wurden bei Patienten, welche orales Risperidon oder orales Paliperidon zuvor vertragen hatten, sehr selten Fälle anaphylaktischer Reaktionen nach der Verabreichung von Paliperidonpalmitat als Depotinjektion für 1 Monat beschrieben (siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).
Beim Auftreten von Überempfindlichkeitsreaktionen ist die Anwendung von Trevicta zu beenden; allgemeine unterstützende Massnahmen je nach klinischer Indikation sind einzuleiten und der Patient ist zu überwachen, bis die Anzeichen und Symptome abgeklungen sind (siehe «Kontraindikationen» und «Unerwünschte Wirkungen»).
Hyperglykämie und Diabetes mellitus
Es liegen Berichte über das Auftreten von Hyperglykämie, eines Diabetes mellitus und eine Verschlechterung einer bereits vorhandenen Diabeteserkrankung während der Behandlung mit Antipsychotika vor. Die Beurteilung des Zusammenhangs zwischen der Anwendung von Atypika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Basisrisikos des Auftretens eines Diabetes mellitus bei Patienten mit Schizophrenie und die erhöhte Inzidenz von Diabetes mellitus in der Allgemeinbevölkerung erschwert. In Anbetracht dieser Einflussfaktoren kann der Zusammenhang zwischen der Anwendung von Atypika und Hyperglykämie-bedingten unerwünschten Ereignissen nicht als geklärt betrachtet werden. Alle Patienten unter Behandlung mit Atypika, einschliesslich Trevicta, sollten auf Symptome einer Hyperglykämie und eines Diabetes mellitus überwacht werden (siehe auch «Unerwünschte Wirkungen»).
Gewichtszunahme
Bei der Anwendung von Atypika wurde eine Gewichtszunahme beobachtet. Es wird empfohlen, das Gewicht der Patienten klinisch zu überwachen.
Orthostatische Hypotonie
Bei manchen Patienten kann Paliperidon aufgrund seiner alpha-adrenerg blockierenden Wirkung eine orthostatische Hypotonie induzieren. Trevicta sollte bei Patienten mit bekannter kardiovaskulärer Krankheit (z.B. Herzinsuffizienz, Myokardinfarkt oder Ischämie, Erregungsleitungsstörungen), zerebrovaskulärer Krankheit oder Störungen, welche den Patienten gegenüber einer Hypotonie anfällig machen (z.B. Dehydrierung, Hypovolämie und Behandlung mit Antihypertensiva), mit Vorsicht angewendet werden.
Krampfanfälle
Wie andere Antipsychotika sollte Trevicta bei Patienten mit Krampfanfällen in der Vorgeschichte oder anderen Zuständen, welche die Anfallsschwelle senken könnten, bedachtsam angewendet werden.
Ältere Patienten mit Demenz
Trevicta ist bei älteren Patienten mit Demenz nicht untersucht worden.
Gesamtmortalität
In einer Metaanalyse von 17 kontrollierten klinischen Prüfungen war das Sterberisiko bei älteren Patienten mit Demenz unter Behandlung mit anderen Atypika wie Risperidon, Aripiprazol, Olanzapin und Quetiapin im Placebovergleich erhöht. Unter Behandlung mit Risperidon betrug die Mortalität 4% gegenüber 3,1% bei Gabe eines Placebos.
Zerebrovaskuläre Nebenwirkungen
In placebokontrollierten Prüfungen bei älteren Patienten mit Demenz unter Behandlung mit bestimmten Atypika wie Risperidon, Aripiprazol und Olanzapin war die Inzidenz zerebrovaskulärer unerwünschter Ereignisse (Schlaganfälle und transitorische ischämische Attacken), von denen einige zum Tode führten, im Placebovergleich erhöht.
Leukopenie, Neutropenie und Agranulozytose
Es liegen Berichte über das Auftreten von Leukopenie, Neutropenie und Agranulozytose in Zusammenhang mit der Anwendung von Antipsychotika, einschliesslich Paliperidon, vor. Im Rahmen der Überwachung nach der Markteinführung trat Agranulozytose sehr selten auf (bei weniger als 1 von 10000 Patienten).
Patienten mit klinisch bedeutsamer niedriger Leukozytenzahl (LEU) oder medikamenteninduzierter Leukopenie/Neutropenie in der Vorgeschichte sollten in den ersten Therapiemonaten überwacht werden. Beim ersten Anzeichen eines klinisch signifikanten Abfalls des LEU-Werts, und wenn keine anderen ursächlichen Faktoren vorliegen, sollte eine Beendigung der Therapie mit Trevicta in Betracht gezogen werden.
Patienten mit klinisch signifikanter Neutropenie sollten aufmerksam im Hinblick auf Fieber oder andere Symptome oder Anzeichen einer Infektion überwacht und unverzüglich behandelt werden, wenn solche Symptome bzw. Anzeichen auftreten. Bei Patienten mit schwerer Neutropenie (absolute Neutrophilenzahl <1× 109/l) sollte die Gabe von Trevicta beendet und der LEU-Wert kontrolliert werden, bis er sich wieder normalisiert hat.
Dabei ist die lange Wirksamkeit von Trevicta zu berücksichtigen.
Venöse Thromboembolie
Es sind Fälle einer venösen Thromboembolie (VTE) bei Anwendung von Antipsychotika beschrieben worden. Da bei Patienten unter Behandlung mit Antipsychotika häufig erworbene VTE-Risikofaktoren vorliegen, sollten vor und während der Therapie mit Trevicta alle möglichen VTE-Risikofaktoren abgeklärt und entsprechende Präventionsmassnahmen durchgeführt werden.
Parkinson-Krankheit und Lewy-Körper-Demenz
Bei der Verordnung von Antipsychotika wie Trevicta an Patienten mit der Parkinson-Krankheit oder Lewy-Körper-Demenz (engl. Dementia with Lewy Bodies, DLB) sind von Ärzteseite die Risiken gegenüber dem Nutzen einer solchen Behandlung abzuwägen, da bei beiden Patientengruppen unter Umständen das Risiko eines malignen Neuroleptika-Syndroms erhöht ist und eine verstärkte Empfindlichkeit gegenüber Antipsychotika vorliegt. Letztere kann sich beispielsweise als Verwirrtheit, Sopor, Gleichgewichtsstörungen mit häufigen Stürzen sowie in Form von extrapyramidalen Symptomen äussern.
Priapismus
Es wurde berichtet, dass Arzneimittel mit alpha-adrenerg blockierender Wirkung Priapismus verursachen. Bei Paliperidon wurde im Rahmen der Überwachung nach der Markteinführung über Priapismus berichtet (siehe «Unerwünschte Wirkungen»).
Regulierung der Körpertemperatur
Mit Antipsychotika wurden Störungen der Fähigkeit des Körpers, seine Kerntemperatur zu senken, in Verbindung gebracht. Es wird zu entsprechender Umsicht geraten, wenn Patienten Trevicta verordnet wird, bei denen es umständehalber zu einer Erhöhung der Körperkerntemperatur kommen kann, z.B. aufgrund intensiver körperlicher Belastung, extreme Hitzeeinwirkung, bei Anwendung von Begleitmedikamenten mit anticholinerger Wirkung oder durch Dehydrierung.
Antiemetische Wirkung
In präklinischen Studien mit Paliperidon wurde eine antiemetische Wirkung beobachtet. Diese Wirkung kann, falls sie beim Menschen auftritt, die Anzeichen und Symptome einer Überdosierung bestimmter Arzneimittel oder bestimmter Erkrankungen wie gastrointestinale Obstruktion, Reye-Syndrom und eines Hirntumors verschleiern.
Verabreichung
Es ist darauf zu achten, Trevicta nicht versehentlich in ein Blutgefäss zu injizieren.
Intraoperatives Floppy Iris Syndrom
Bei Patienten unter Behandlung mit Medikamenten mit alpha1a-adrenerg antagonistischer Wirkung, wie beispielsweise Trevicta, wurde bei Kataraktoperationen ein intraoperatives Floppy Iris Syndrom (IFIS) beobachtet (siehe «Unerwünschte Wirkungen»).
IFIS kann das Risiko für Augenkomplikationen während und nach der Operation erhöhen. Der Augenchirurg ist vor dem Eingriff auf die aktuelle oder frühere Anwendung von Medikamenten mit alpha1a-adrenerg antagonistischer Wirkung aufmerksam zu machen. Der mögliche Nutzen der Beendigung der Alphablocker-Therapie vor der Kataraktoperation wurde nicht untersucht und ist gegenüber dem Risiko in Verbindung mit der Beendigung der Antipsychotika-Therapie abzuwägen.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Fertigspritze, d.h. es ist nahezu «natriumfrei».
InteraktionenWenn Trevicta zusammen mit Arzneimitteln mit bekannter QT-verlängernder Wirkung verordnet ist, wird zur Vorsicht geraten.
Da Paliperidonpalmitat zu Paliperidon hydrolysiert wird (siehe «Pharmakokinetik»), sollten zur Beurteilung möglicher Arzneimittelinteraktionen die Ergebnisse aus Studien mit oralem Paliperidon berücksichtigt werden.
Wirkung von Trevicta auf andere Arzneimittel
Es ist nicht davon auszugehen, dass Paliperidon klinisch bedeutsame pharmakokinetische Interaktionen mit Substanzen verursacht, die von Cytochrom-P-450-Isozymen umgesetzt werden. In-vitro-Studien mit humanen Lebermikrosomen zeigen, dass Paliperidon die Verstoffwechselung von Substanzen, die von Cytochrom-P-450-Isozymen wie CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 und CYP3A5 umgesetzt werden, nicht in wesentlichem Umfang hemmt. Die Clearance von Substanzen, die auf klinisch massgebliche Weise über diese Stoffwechselwege abgebaut werden, wird daher von Paliperidon voraussichtlich nicht gehemmt. Paliperidon hat vermutlich auch keine enzyminduzierenden Eigenschaften.
In hohen Konzentrationen geht von Paliperidon eine schwache Hemmwirkung auf das P-Glykoprotein (P-gp) aus. Es liegen keine In vivo-Daten vor, und die klinische Relevanz ist nicht bekannt.
In Anbetracht dessen, dass Paliperidon hauptsächlich im ZNS wirkt (siehe «Unerwünschte Wirkungen»), sollte Trevicta in Kombination mit anderen zentral wirkenden Substanzen und Alkohol mit Vorsicht angewendet werden. Paliperidon kann als Antagonist von Levodopa und anderen Dopaminagonisten wirken.
Aufgrund der Möglichkeit der Induktion einer orthostatischen Hypotonie (siehe «Warnhinweise und Vorsichtsmassnahmen»: Orthostatische Hypotonie) ist unter Umständen ein additiver Effekt zu beobachten, wenn Trevicta zusammen mit anderen Therapeutika angewendet wird, die ebenfalls diese Wirkung haben.
Die Verabreichung von oralen Paliperidon-Retardtabletten im Fliessgleichgewicht, bzw. Steady-State (einmal täglich 12 mg) zusammen mit Divalproex Natrium-Retardtabletten (einmal täglich 500 mg bis 2000 mg) hatte keine Auswirkungen auf die Pharmakokinetik von Valproat im Steady-State.
Eine pharmakokinetische Interaktion zwischen Trevicta und Lithium ist unwahrscheinlich.
Wirkung anderer Arzneimittel auf Trevicta
Paliperidon ist kein Substrat von CYP1A2, CYP2A6, CYP2C9, CYP2C19 und CYP3A5. Eine Interaktion zwischen Inhibitoren oder Induktoren dieser Isozyme dürfte daher unwahrscheinlich sein. Während aus In vitro-Studien zwar hervorgeht, dass CYP2D6 und CYP3A4 möglicherweise minimal in die Verstoffwechselung von Paliperidon involviert sind, gibt es weder in vitro noch in vivo Hinweise darauf, dass dieser Einfluss signifikant ist. In vitro-Studien zeigen, dass Paliperidon ein P-gp-Substrat ist.
Paliperidon wird in begrenztem Umfang von CYP2D6 umgesetzt (siehe «Pharmakokinetik»: Metabolismus und Elimination). In einer Interaktionsstudie bei gesunden Freiwilligen, denen orales Paliperidon zusammen mit Paroxetin, einem starken CYP2D6-Inhibitor, verabreicht worden war, waren keine klinisch relevanten Einflüsse auf die Pharmakokinetik von Paliperidon zu beobachten.
Orales Paliperidon-Retard einmal täglich zusammen mit 200 mg Carbamazepin zweimal täglich bewirkte eine Verringerung der mittleren Cmax und des AUC-Werts im Steady-State von Paliperidon um ungefähr 37%. Dieser Rückgang ist in wesentlichem Umfang auf einen Anstieg der renalen Clearance von Paliperidon um 35% zurückzuführen, vermutlich als Ergebnis einer Induktion von renalem P-gp durch Carbamazepin. Eine geringfügige Reduzierung der unverändert im Urin ausgeschiedenen Wirkstoffmenge lässt den Schluss zu, dass der CYP-Metabolismus oder die Bioverfügbarkeit von Paliperidon während der Anwendung zusammen mit Carbamazepin kaum beeinflusst wurden. Bei Einleitung einer Behandlung mit Carbamazepin sollte die Trevicta-Dosis neu überprüft und bei Bedarf erhöht werden. Umgekehrt sollte bei Beendigung einer Behandlung mit Carbamazepin die Trevicta-Dosis gleichfalls überprüft und bei Bedarf reduziert werden. Dabei ist die lange Wirksamkeit von Trevicta zu berücksichtigen.
Paliperidon liegt bei physiologischen pH-Werten als Kation vor und wird vorwiegend unverändert über die Nieren ausgeschieden, ungefähr je zur Hälfte durch Filtration und durch aktive Ausscheidung. Bei Anwendung zusammen mit Trimethoprim, einem Arzneimittel mit bekannter Hemmwirkung auf den aktiven Arzneistoffkationentransport in der Niere, wurde kein Einfluss auf die Pharmakokinetik von Paliperidon festgestellt.
Die gleichzeitige Verabreichung von oralen Paliperidon-Retardtabletten als Einzeldosis von 12 mg mit Divalproex Natrium-Retardtabletten (einmal täglich zwei 500-mg-Tabletten) führte zu einer Erhöhung der Cmax und des AUC-Werts von Paliperidon um cirka 50%, vermutlich als Ergebnis einer verstärkten Absorption über die Mundschleimhaut. Da kein signifikanter Einfluss auf die systemische Clearance festgestellt wurde, wäre auch zwischen Divalproex Natrium-Retardtabletten und Trevicta als intramuskuläre Injektion keine klinisch bedeutsame Interaktion zu erwarten. Es wurden jedoch keine Untersuchungen zu dieser Interaktion mit Trevicta durchgeführt.
Eine pharmakokinetische Interaktion zwischen Lithium und Trevicta ist unwahrscheinlich.
Anwendung von Trevicta zusammen mit Risperidon oder oralem Paliperidon
Da es sich bei Paliperidon um den aktiven Metaboliten von Risperidon handelt, ist bei der Verabreichung von Trevicta zusammen mit Risperidon oder mit oralem Paliperidon über längere Zeiträume hinweg Vorsicht geboten. Die Datenlage zur Sicherheit der gleichzeitigen Anwendung von Trevicta und anderen Antipsychotika ist begrenzt.
Gleichzeitige Anwendung von Trevicta mit Psychostimulanzien
Die Anwendung von Psychostimulanzien (z.B. Methylphenidat) in Kombination mit Paliperidon kann bei Veränderung einer Behandlung oder beider Behandlungen zum Auftreten extrapyramidaler Symptome führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft, StillzeitSchwangerschaft
Die Sicherheit von intramuskulär injiziertem Paliperidonpalmitat oder oral dosiertem Paliperidon bei Anwendung während einer Schwangerschaft wurde nicht untersucht.
Eine retrospektive observative Kohortenstudie auf der Grundlage einer US-Datenbank mit abgerechneten Gesundheitsversorgungsleistungen verglich das Risiko angeborener Fehlbildungen bei Lebendgeburten zwischen Frauen mit und solchen ohne Anwendung von Antipsychotika im ersten Schwangerschaftstrimenon. In dieser Studie wurde keine konkrete Beurteilung von Paliperidon, dem aktiven Metaboliten von Risperidon, durchgeführt. Das Risiko angeborener Fehlbildungen bei Anwendung von Risperidon war nach Anpassung im Hinblick auf Störvariablen in der Datenbank gegenüber der Nichtanwendung von Antipsychotika erhöht (relatives Risiko = 1,26, 95%-KI: 1,02-1,56). Es wurde kein biologischer Mechanismus identifiziert, der diese Feststellung erklären konnte, und in präklinischen Studien wurden keine teratogenen Wirkungen beobachtet. Auf der Grundlage der Ergebnisse dieser observativen Einzelstudie wurde kein Kausalzusammenhang zwischen der Risperidonexposition in utero und den angeborenen Fehlbildungen erkannt.
Bei Neugeborenen, deren Mütter im dritten Trimenon der Schwangerschaft Antipsychotika (einschliesslich Paliperidon) angewendet haben, besteht nach der Geburt ein Risiko des Auftretens von extrapyramidalen Symptomen und/oder von Entzugssymptomen, deren Intensität unter Umständen variieren kann, wie beispielsweise Unruhe, Hypertonie, Hypotonie, Tremor, Somnolenz, Atemnot oder Fütterstörungen. Diese Komplikationen können einen unterschiedlichen Schweregrad aufweisen. Bei einigen Fällen waren sie selbst limitierend, in anderen Fällen benötigten die Neugeborenen eine Überwachung auf der Intensivstation oder eine längere Hospitalisation.
Da Paliperidon nach Gabe einer Einzeldosis Trevicta bis zu 18 Monate lang im Plasma nachweisbar war, sollte die lange Wirksamkeit von Trevicta in die Überlegungen einbezogen werden. Eine maternale Exposition gegenüber Trevicta vor und während der Schwangerschaft kann unerwünschte Wirkungen beim Neugeborenen hervorrufen.
Teratogene Wirkungen wurden in tierexperimentellen Studien nicht festgestellt, es wurden jedoch andere Arten reproduktionstoxischer Effekte beobachtet. Bei Labortieren, denen eine hohe Paliperidon-Dosis oral verabreicht wurde, zeigte sich eine leichte Zunahme abgestorbener Feten (s. «Präklinische Daten»).
Trevicta darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist absolut notwendig. Der Einfluss von Trevicta auf die Wehentätigkeit und den Geburtsvorgang beim Menschen ist nicht bekannt.
Stillzeit
In tierexperimentellen Studien mit Paliperidon und in Probandenstudien mit Risperidon ging Paliperidon in die Muttermilch über. Trevicta soll während der Stillzeit nicht angewendet werden.
Da Paliperidon nach Gabe einer Einzeldosis Trevicta bis zu 18 Monate lang im Plasma nachweisbar war, sollte die lange Wirksamkeit von Trevicta in die Überlegungen einbezogen werden, da auch bei Anwendung von Trevicta lange vor dem Stillen ein Risiko für den Säugling bestehen kann.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDurch die Anwendung von Trevicta können sich Auswirkungen auf Tätigkeiten einstellen, die geistige Aufmerksamkeit erfordern, und Sehstörungen auftreten (siehe «Unerwünschte Wirkungen»). Den Patienten sollte daher angeraten werden, sich nicht ans Steuer eines Fahrzeugs zu setzen und keine Maschinen zu bedienen, bis der Grad ihres individuellen Beeinflussungspotenzials bekannt ist.
Unerwünschte WirkungenIm folgenden Abschnitt werden die unerwünschten Wirkungen dargestellt. Unerwünschte Wirkungen sind unerwünschte Ereignisse, bei denen auf Basis einer gründlichen Bewertung der vorliegenden Informationen über das unerwünschte Ereignis ein plausibler Zusammenhang mit der Anwendung von Paliperidonpalmitat angenommen wird. In einzelnen Fällen kann ein ursächlicher Zusammenhang mit Paliperidonpalmitat nicht zuverlässig festgestellt werden. Da zudem klinische Studien unter verschiedenartigen Bedingungen durchgeführt werden, kann die Häufigkeit unerwünschter Wirkungen, die in klinischen Studien mit einem Arzneimittel beobachtet wurden, nicht direkt mit der in klinischen Studien mit einem anderen Arzneimittel beobachteten Häufigkeit verglichen werden und entspricht nicht unbedingt der in der klinischen Praxis beobachteten Auftretenshäufigkeit.
Paliperidonpalmitat wird zu Paliperidon hydrolysiert. Paliperidon ist der aktive Metabolit von Risperidon. Daher sind die Nebenwirkungsprofile beider Substanzen (ihre oralen und injizierbaren Formulierungen einschliessend) von gegenseitiger Relevanz.
Zusammenfassung des Sicherheitsprofiles
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen) wurde bei 7'565 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht.
Die Sicherheit von Paliperidon Retardtabletten wurde bei 2'159 Patienten mit Schizophrenie, schizoaffektiver Störung und Bipolar-I-Störung in klinischen Studien untersucht.
Die Sicherheit von Risperidon (alle Formulierungen) wurde in klinischen Studien bei 12'195 Patienten mit Schizophrenie, schizoaffektiver Störung, bipolarer Störung, autistischer Störung, Verhaltensstörungen bei Patienten mit leichter bis mittelschwerer geistiger Behinderung, Demenz, Störungen des Sozialverhaltens, Alzheimer-Demenz, Alzheimer-Krankheit mit Psychose oder chronischen Psychosen untersucht.
Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%), die im Rahmen von klinischen Studien in Paliperdionpalmitat Depot-Injektionssuspension-behandelten Patienten beobachtet wurden waren: Schlaflosigkeit (12.0%), Reaktion an der Injektionsstelle (9.6%), Gewichtszunahme (9.6%), Infektionen der oberen Atemwege (9.4%), Kopfschmerzen (8.8%), Angst (7.4%), Akathisie (6.7%) und Parkinsonismus (6.1%).
Im Folgenden werden sämtliche unerwünschten Wirkungen aufgeführt, die mit Paliperidon und/oder Risperidon aufgetreten sind. Sie sind nach Häufigkeitsgruppen geordnet, wobei sich die Angaben zur Häufigkeiten ausschliesslich auf klinische Studien mit Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen) beziehen. Nebenwirkungen, die nicht in klinischen Studien, sondern nach der Marktzulassung für Paliperidonpalmitat berichtet wurden, sind unter der Häufigkeitskategorie nicht bekannt aufgeführt. Dasselbe gilt für alle unerwünschten Wirkungen, die in klinischen Studien oder nach der Marktzulassung für Risperidon (alle Darreichungsformen) oder oralem Paliperidon beobachtet wurden.
Es werden die folgenden Häufigkeitskategorien verwendet: «Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000) und «nicht bekannt» (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen
Häufig: Infektionen der oberen Atemwege, Harnwegsinfektion, Influenza.
Gelegentlich: Pneumonie, Bronchitis, Infektion der Atemwege, Sinusitis, Zystitis, Infektion des Ohres, Augeninfektion, Tonsillitis, Onychomykose, Cellulitis, Akrodermatitis, subkutaner Abszess.
Erkrankungen des Blut- und Lymphsystems
Gelegentlich: Abnahme der Anzahl weisser Blutkörperchen, Anämie, Neutropenie, Thrombozytopenie, Zunahme der Anzahl eosinophiler Granulozyten.
Nicht bekannta: Agranulozytose, Abnahme des Hämatokrits.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen.
Nicht bekannta: Anaphylaktische Reaktion.
Endokrine Erkrankungen
Häufig: Hyperprolaktinämieb.
Selten: inadäquate Sekretion des antidiuretischen Hormons, Glukose im Urin.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperglykämie, Gewichtszunahme, Gewichtsabnahme, verminderter Appetit, Anstieg der Triglyzeride.
Gelegentlich: Diabetes mellitusd, Hyperinsulinämie, gesteigerter Appetit, Anorexie, Anstieg des Blutcholesterinspiegels, Polydipsie.
Selten: diabetische Ketoazidose, Hypoglykämie.
Nicht bekannta: Wasser-Intoxikation
Psychiatrische Erkrankungen
Sehr häufig: Schlaflosigkeite.
Häufig: Agitation, Depression, Angst.
Gelegentlich: Schlafstörung, Manie, verminderte Libido, Verwirrtheit, Nervosität, Albträume, Anorgasmie
Selten: Katatonie, Somnambulismus, abgestumpfter Affekt
Nicht bekannta: Schlafbezogene Essstörung (unkontrollierte Essenseinnahme beim Schlafwandeln).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen
Häufig: Parkinsonismusc, Akathisiec, Somnolenz, Dystoniec, Schwindel, Dyskinesiec, Tremor.
Gelegentlich: Tardive Dyskinesie, Konvulsionene, Synkope, psychomotorische Hyperaktivität, posturaler Schwindel, Störung der Aufmerksamkeit, Dysarthrie, Dysgeusie, Hypästhesie, Parästhesie, zerebrovaskuläre Ischämie.
Selten: Malignes neuroleptisches Syndrom, fehlende Stimulusresponse, Bewusstseinsverlust, Verminderung des Bewusstseinsgrades, Gleichgewichtsstörung, Koordinationsstörung, Kopfzittern.
Nicht bekannta: Diabetisches Koma.
Augenerkrankungen
Gelegentlich: verschwommenes Sehen, Konjunktivitis, trockenes Auge.
Selten: Glaukom, Störung der Augenbewegung, Augenrollen, Photophobie, verstärkte Tränensekretion, okuläre Hyperämie.
Nicht bekannta: Floppy-Iris Syndrom (intraoperativ).
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Vertigo, Tinnitus, Ohrenschmerz.
Herzerkrankungen
Häufig: Bradykardie, Tachykardie.
Gelegentlich: Atrioventrikulärer Block, Erregungsleitungsstörung, Vorhofflimmern, verlängertes QT-Intervall im Elektrokardiogramm, posturales tachykardes Syndrom, abnormes Elektrokardiogramm, Palpitationen.
Selten: Sinusarrhythmien.
Gefässerkrankungen
Häufig: Hypertension.
Gelegentlich: Hypotonie, orthostatische Hypotonie, tiefe Venenthrombose
Selten: Lungenembolie, Flush.
Nicht bekannta: Ischämie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten, verstopfte Nase.
Gelegentlich: Dyspnoe, Lungenstauung, Keuchen, pharyngolaryngealer Schmerz, Epistaxis, Stauung der Atemwege,
Selten: Schlaf-Apnoe-Syndrom, Lungenrasseln.
Nicht bekannta: Hyperventilation, Aspirationspneumonie, Dysphonie.
Erkrankungen des Gastrointestinaltrakts
Häufig: abdominelle Schmerzen, Erbrechen, Übelkeit, Obstipation, Diarrhö, Dyspepsie, Zahnschmerzen.
Gelegentlich: abdominelle Beschwerden, Gastroenteritis, Dysphagie, Mundtrockenheit, Flatulenz, geschwollene Zunge
Selten: Pankreatitis, intestinale Obstruktion, Stuhlinkontinenz, Fäkulom, Cheilitis.
Nicht bekannta: Ileus.
Leber- und Gallenerkrankungen
Häufig: erhöhte Transaminasen.
Gelegentlich: erhöhte Gamma-Glutamyl-Transferase-Werte, Leberenzymwerte erhöht.
Nicht bekannta: Ikterus.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Gelegentlich: Urtikaria, Pruritus, Alopezie, Ekzem, trockene Haut, Erythem, Akne.
Selten: Arzneimittelexanthem, Hyperkeratose, seborrhoische Dermatitis, Schuppen.
Nicht bekannta: Stevens-Johnson-Syndrom/Toxische epidermale Nekrolyse, Angioödem, Hautverfärbung.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: muskuloskelettale Schmerzen, Rückenschmerzen, Arthralgie.
Gelegentlich: erhöhter Kreatinphosphokinase-Wert, Muskelkrämpfe, Steifheit der Gelenke, Muskelschwäche, Anschwellen der Gelenke.
Selten: Rhabdomyolyse.
Nicht bekannta: Anomale Haltung, Nackenschmerzen.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Harninkontinenz, Pollakisurie, Dysurie.
Selten: Harnretention.
Schwangerschafts-, Wochenbett- und perinatale Erkrankungen
Sehr selten: Extrapyramidalmotorische Symptome und/oder Entzugserscheinungen beim Neugeborenen (s. «Schwangerschaft, Stillzeit»).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Amenorrhö, Galaktorrhoe, Menstruationsstörunge
Gelegentlich: erektile Dysfunktion, Ejakulationsstörung, Gynäkomastie, sexuelle Dysfunktion, Brustbeschwerden, Brustschmerzen, vaginaler Ausfluss, Brustvergrösserung.
Selten: Priapismus, Brustdrüsenschwellung, Stauungserscheinungen der Brust.
Nicht bekannta: Verspätete Menstruation.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Pyrexie, Asthenie, Fatigue, Reaktionen an der Injektionsstelle.
Gelegentlich: Gesichtsödem, Ödeme, anormaler Gang, erhöhte Körpertemperatur, Schmerzen im Brustkorb, Beschwerden im Brustkorb, Unwohlsein, Induration, Schüttelfrost.
Selten: Hypothermie, Durst, Arzneimittelentzugssyndrom, Abszess an der Injektionsstelle, Cellulitis an der Injektionsstelle, Zyste an der Injektionsstelle, Hämatom an der Injektionsstelle.
Nicht bekannta: Verminderte Körpertemperatur, Nekrose an der Injektionsstelle, Ulkus an der Injektionsstelle.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: Sturz.
a Die Häufigkeit der Nebenwirkungen ist als «nicht bekannt» eingestuft, da sie nicht in klinischen Studien mit Paliperidonpalmitat beobachtet wurden. Sie stammen aus spontanen Berichten nach Markteinführung und die Häufigkeit kann nicht ermittelt werden oder aus klinischen Studien und/oder Berichten nach Markteinführung mit Risperidon (alle Darreichungsformen) oder mit oralem Paliperidon.
b Eine Hyperprolaktinämie kann in einigen Fällen zu Gynäkomastie, Menstruationsstörungen, Amenrorrhoe und Galaktorrhoe führen. Siehe «Hyperprolaktinämie» unten.
c Siehe «Extrapyramidale Symptome» unten.
d In Placebo-kontrollierten Studien wurde Diabetes mellitus bei 0,32% der mit Xeplion behandelten Patienten berichtet, im Vergleich lag die Rate in der Placebo-Gruppe bei 0,39%. Die Gesamtinzidenz aus allen klinischen Studien betrug 0,65% bei allen mit Xeplion behandelten Patienten.
e Schlaflosigkeit beinhaltet: initiale Schlafstörung, Durchschlafstörungen; Konvulsionen beinhaltet: Grand-mal-Anfälle; Ödeme beinhaltet: generalisierte Ödeme, periphere Ödeme, Ödeme mit eindrückbaren Dellen («pitting edema»); Menstruationsstörungen beinhaltet: unregelmässige Menstruation, Oligomenorrhoe.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Paliperidonpalmitat Depot-Injektionssuspension 1-Monatsspritze
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze) wurde bei 4'484 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht. Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%) waren: Schlaflosigkeit (14.4%), Kopfschmerzen (9.9%), Infektion der oberen Atemwege (7.3%), Angstzustände (7.0%), Reaktionen an der Injektionsstelle (7.0%), Gewichtszunahme (6.4%), Parkinsonismus (6.2%) und Akathisie (6.5%).
Die folgenden unerwünschten Wirkungen wurden für Paliperidonpalmitat Depot-Injektionssuspension (1-Monatsspritze) häufiger gemeldet als in den gepoolten Sicherheitsdaten für die 1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen), wie sie in der obigen Liste der unerwünschten Wirkungen beschrieben werden:
Häufig: Mundtrockenheit, Pruritus
Gelegentlich: Gleichgewichtsstörung, okuläre Hyperämie, Sinusarrhythmien, Stuhlinkontinenz,
Paliperidonpalmitat Depot-Injektionssuspension 3-Monatsspritze
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (3-Monatsspritze) wurde bei 1'191 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht. Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%) waren: Gewichtszunahme(13.5%), Infektion der oberen Atemwege (10.7%), Angstzustände (7.6%), Kopfschmerzen (6.7%), Schlaflosigkeit (6.0%) und Reaktionen an der Injektionsstelle (5.3%).
Die folgenden unerwünschten Wirkungen wurden für Paliperidonpalmitat Depot-Injektionssuspension (3-Monatsspritze) häufiger gemeldet als in den gepoolten Sicherheitsdaten für die 1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze (letztere in der Schweiz nicht zugelassen), wie sie in der obigen Liste der unerwünschten Wirkungen beschrieben werden:
Sehr häufig: Infektionen der oberen Atemwege, Gewichtszunahme
Häufig: pharyngolaryngealer Schmerz
Gelegentlich: Glukose im Urin, diabetische Ketoazidose, verstärkte Tränensekretion, Cheilitis
Paliperidonpalmitat Depot-Injektionssuspension 6-Monatsspritze (in der Schweiz nicht zugelassen)
Die Sicherheit von Paliperidonpalmitat Depot-Injektionssuspension (6-Monatsspritze, in der Schweiz nicht zugelassen) wurde bei 478 Patienten mit Schizophrenie und schizoaffektiver Störung in klinischen Studien untersucht. Die häufigsten unerwünschten Arzneimittelwirkungen (≥5%) waren: Infektionen der oberen Atemwege (11.5%), Reaktionen an der Injektionsstelle (10.7%), Gewichtszunahme (9.0%), Kopfschmerzen (6.7%) und Parkinsonismus (5.0%).
Die folgenden unerwünschten Wirkungen wurden für Paliperidonpalmitat Depot-Injektionssuspension (6-Monatsspritze, in der Schweiz nicht zugelassen) häufiger gemeldet als in den gepoolten Sicherheitsdaten für die 1-Monatsspritze, 3-Monatsspritze und 6-Monatsspritze, wie sie in der obigen Liste der unerwünschten Wirkungen beschrieben werden:
Sehr häufig: URTI, Reaktionen an der Injektionsstelle
Häufig: Anämie, Diabetes mellitus, Gastroenteritis, erhöhter Kreatinphosphokinase-Wert
Gelegentlich: Kopfzittern, intestinale Obstruktion, seborrhoische Dermatitis, Priapismus
Klasseneffekte
QT-Verlängerungen, ventrikuläre Arrhythmien (ventrikuläres Flimmern, ventrikuläre Tachykardien), plötzliche und unerwartete Todesfälle, Herzstillstand und Torsades de pointes können unter der Behandlung mit Antipsychotika auftreten. Es wurden Fälle von venöser Thromboembolie, einschliesslich Fälle von Lungenembolie und tiefer Beinvenenthrombose unter der Behandlung mit Antipsychotika berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Extrapyramidalmotorische Symptome (EPS)
Daten aus der doppelblinden placebokontrollierten Phase der Langzeitstudie zur Rezidivprävention (siehe «Eigenschaften/Wirkungen»: Klinische Wirksamkeit) zeigten, dass die Inzidenz EPS-bedingter UE in der Trevicta-Gruppe höher war (13 Patienten [8,1%]) als in der Placebogruppe (5 Patienten [3,4%]).
Extrapyramidale Symptome (EPS) schliesst eine gepoolte Analyse der folgenden Begriffe ein:
Parkinsonismus (einschliesslich extrapyramidale Beschwerden, extrapyramidale Symptome, On-Off-Phänomen, Morbus Parkinson, Parkinson-Krise, verstärkte Speichelsekretion, muskuloskelettale Steifheit, Parkinsonismus, vermehrter Speichelfluss, Zahnradphänomen, Bradykinesie, Hypokinesie, Maskengesicht, Muskelanspannung, Akinesie, Steifheit der Nackenmuskulatur, Muskelsteifheit, parkinsonähnlicher Gang, anomaler Glabellareflex und parkinsonähnlicher Ruhetremor), Akathisie (einschliesslich Akathisie, Ruhelosigkeit, Hyperkinesie und Restless-Legs-Syndrom), Dyskinesie (Dyskinesie, Chorea, Bewegungsstörungen, Muskelzuckungen, Choreoathetose, Athetose und Myoklonie), Dystonie (einschliesslich Dystonie, zervikale Spasmen, Emprosthotonus, okulogyrische Krise, oromandibuläre Dystonie, Risus sardonicus, Tetanie, Hypertonie, Torticollis, unwillkürliche Muskelkontraktionen, Muskelkontraktur, Blepharospasmus, Okulogyration, Zungenparalyse, Gesichtsspasmus, Laryngospasmus, Myotonie, Opisthotonus, oropharyngealer Spasmus, Pleurothotonus, Zungenspasmus und Trismus) und Tremor.
Dystonie
Klasseneffekt: Symptome einer Dystonie, verlängerte abnorme Kontraktion von Muskelgruppen, können bei hierfür empfänglichen Patienten während der ersten Behandlungstage und bei höheren Dosierungen antipsychotischer Arzneimittel auftreten. Insbesondere bei Männern und jüngeren Patienten wird ein erhöhtes Risiko für akute Dystonie beobachtet.
Gewichtszunahme
In der randomisierten Langzeit-Studie nach Absetzen wurden anomale Erhöhungen des Körpergewichts um ≥7 % vom doppelblinden Ausgangswert zum doppelblinden Endpunkt bei 10 % der Studienteilnehmer in der Trevicta-Gruppe und 1 % der Studienteilnehmer in der Placebogruppe berichtet. Umgekehrt wurden anomale Verringerungen des Körpergewichts (≥7 %) vom doppelblinden Ausgangswert zum doppelblinden Endpunkt bei 1 % der Studienteilnehmer in der Trevicta-Gruppe und 8 % der Studienteilnehmer in der Placebogruppe berichtet. Die mittleren Veränderungen des Körpergewichts vom doppelblinden Ausgangswert zum doppelblinden Endpunkt betrugen + 0,94 kg bzw. – 1,28 kg in der Trevicta- bzw. Placebogruppe.
Hyperprolaktinämie
Eine Hyperprolaktinämie kann in einigen Fällen zu Gynäkomastie, Menstruationsstörungen, Amenrorrhoe und Galaktorrhoe führen.
In der doppelblinden placebokontrollierten Phase der Langzeitstudie zur Rezidivprävention (siehe «Eigenschaften/Wirkungen, klinische Wirksamkeit») wurden Erhöhungen der Prolaktinspiegel über den Referenzbereich (>13,13 ng/ml bei Männern und >26,72 ng/ml bei Frauen) hinaus in der Trevicta-Gruppe bei einem höheren Anteil beobachtet als in der Placebogruppe (9% vs. 3% bzw. 5% vs. 1%). In der Trevicta-Gruppe betrug die mittlere Veränderung zwischen Beginn und Endpunkt der doppelblinden Phase bei Männern +2,90 ng/ml (vs. -10,26 ng/ml in der Placebogruppe) und bei Frauen +7,48 ng/ml (vs. -32,93 ng/ml in der Placebogruppe). Eine Frau (2,4%) in der Trevicta-Gruppe entwickelte eine unerwünschte Wirkung in Form einer Amenorrhö, während bei den Frauen in der Placebogruppe keine potenziell prolaktinbedingten unerwünschten Wirkungen festgestellt wurden. Bei den Männern beider Gruppen gab es keine potenziell prolaktinbedingten unerwünschten Wirkungen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Bei den zu erwartenden Anzeichen und Symptomen handelt es sich im Allgemeinen um solche, die in Folge einer übermässigen Steigerung der bekannten pharmakologischen Wirkungen von Paliperidon auftreten, d.h. Benommenheit und Sedierung, Tachykardie und Hypotonie, QT-Verlängerung und extrapyramidale Symptome. Bei Überdosierungen von oralem Paliperidon wurde über Torsade-de-Pointes-Tachykardien und Ventrikelflimmern berichtet. Im Fall einer akuten Überdosierung sollte die Möglichkeit der Beteiligung mehrerer Substanzen in Betracht gezogen werden.
Behandlung
Bei der Beurteilung des Behandlungsbedarfs und der Wiederherstellung sollten die verlängerte Freisetzung [Depotwirkung] von Trevicta und die lange scheinbare Halbwertszeit von Paliperidon in die Erwägungen einbezogen werden. Es gibt kein spezielles Gegenmittel gegen Paliperidon. Es sind allgemeine unterstützende Massnahmen zu ergreifen. Es ist dafür zu sorgen, dass die Atemwege frei sind und frei bleiben und dass eine ausreichende Sauerstoffversorgung und Beatmung gewährleistet sind. Es ist unverzüglich mit dem kardiovaskulären Monitoring zu beginnen, das ausserdem eine Dauerüberwachung per Elektrokardiogramm auf mögliche Arrhythmien einschliessen sollte. Hypotonie und Kreislaufversagen sollten mit geeigneten Massnahmen, zum Beispiel mit der intravenösen Einleitung von Flüssigkeit und/oder der Gabe von Sympathomimetika, behandelt werden. Bei starken extrapyramidalen Symptomen sollten Anticholinergika verabreicht werden. Der Patient sollte bis zur Wiederherstellung engmaschig betreut und überwacht werden.
Eigenschaften/WirkungenATC-Code
N05AX13
Trevicta enthält ein razemisches Gemisch aus (+)- und (-)-Paliperidon.
Wirkungsmechanismus / Pharmakodynamik
Paliperidonpalmitat, der Wirkstoff in Trevicta, ist eine psychotrope Substanz, die der chemischen Klasse der Benzisoxazolderivative zugeordnet wird (atypisches neuroleptisches Antipsychotikum). Trevicta enthält ein racemisches Gemisch von (+)- und (-)-Paliperidon.
Paliperidonpalmitat wird zu Paliperidon hydrolysiert (siehe «Präklinische Daten»). Paliperidon ist ein zentral wirkender aktiver Dopamin-D2-Antagonist mit überwiegend serotonerger 5-HT2A-antagonistischer Aktivität. Darüber hinaus wirkt Paliperidon auch als Antagonist an α1- und α2-adrenergen Rezeptoren und an H1-histaminergen Rezeptoren. Es hat keine Affinität für cholinerge muskarinische oder β1- und β2-adrenerge Rezeptoren. Die pharmakologische Wirkung der (+)– und (-)-Enantiomere von Paliperidon ist qualitativ und quantitativ ähnlich.
Wie bei anderen Substanzen mit Wirksamkeit bei Schizophrenie ist auch der Wirkmechanismus von Paliperidon nicht bekannt. Es wurden die Vermutung geäussert, dass die therapeutische Aktivität von Paliperidon bei Schizophrenie auf einem Dopamin-Typ-2(D2)- und einem Serotonin-Typ-2(5HT2A)-Rezeptorantagonismus beruht. Einige der sonstigen Wirkungen von Paliperidon lassen sich möglicherweise durch einen Antagonismus an anderen Rezeptoren als D2 und 5HT2A erklären.
Klinische Wirksamkeit
Die Wirksamkeit von Trevicta in der Behandlung von Schizophrenie wurde in einer doppelblinden, placebokontrollierten Langzeitstudie zur Rezidivprävention bzw. mit randomisiertem Entzug und in einer doppelblinden Langzeitstudie der Nichtunterlegenheit mit aktiver Kontrolle bei Patienten untersucht, die mindestens 4 Monate lang adäquat mit Paliperidonpalmitat als Depotinjektion für 1 Monat eingestellt worden waren.
Studie zur Rezidivprävention bzw. mit randomisiertem Entzug
In der randomisierten Langzeit-Entzugsstudie wurden 506 erwachsene Patienten, welche die DSM IV-Kriterien für Schizophrenie erfüllten, in die offene Übergangsphase aufgenommen und 17 Wochen lang mit flexiblen Dosen von Paliperidonpalmitat als Depotinjektion für 1 Monat in den Delta- oder Gluteusmuskel (50–150 mg) behandelt (in Woche 5 und 9 wurden Dosisanpassungen durchgeführt). Insgesamt 379 Patienten erhielten dann in der offenen Stabilisierungsphase eine Einzeldosis von Trevicta entweder in den Delta- oder in den Gluteusmuskel (die Dosis entsprach dem 3,5-Fachen der letzten Dosis von Paliperidonpalmitat als Depotinjektion für 1 Monat). Patienten, die am Ende der 12-wöchigen Stabilisierungsphase als klinisch stabil erachtet wurden, wurden dann im Verhältnis 1:1 randomisiert, um in einer doppelblinden Phase unterschiedlicher Dauer Trevicta oder Placebo zu erhalten (die Trevicta-Dosis entsprach der letzten, in der Stabilisierungsphase verabreichten Dosis; diese Dosis wurde während der gesamten doppelblinden Phase beibehalten). In dieser Phase wurden 305 Patienten mit stabiler Symptomatik randomisiert, um die Behandlung mit Trevicta (n = 160) oder Placebo (n = 145) bis zum Eintreten eines Rezidivs, dem vorzeitigen Ausscheiden aus der Studie oder bis zum Studienende fortzusetzen. Die primäre Wirksamkeitsvariable war die Dauer des Zeitraums bis zum ersten Rezidiv. Eine planmässige Zwischenanalyse, die durchgeführt wurde, nachdem 283 Patienten randomisiert und 42 Rezidivereignisse verzeichnet worden waren, zeigte einen statistisch signifikant längeren Zeitraum (p <0,001) bis zum Eintreten eines Rezidivs bei Patienten unter Behandlung mit Trevicta im Vergleich zum Placebo. Bei 23% der Patienten in der Placebogruppe und bei 7,4% der Patienten in der Trevicta-Gruppe trat ein Rezidivereignis ein. Die Studie wurde auf der Grundlage dieser Wirksamkeitsergebnisse abgebrochen. Das Hazard-Ratio betrug 3,45 (95%-KI: 1,73; 6,88), d.h. es wurde eine Senkung des Rezidivrisikos mit Trevicta um 71% im Vergleich zu Placebo erzielt. In Abbildung 1 ist ein Kaplan-Meier-Plot des Zeitraums bis zum Eintreten eines Rezidivs nach Behandlungsgruppe dargestellt. Ausserdem ist der Zeitraum bis zum Eintreten eines Rezidivs in der Placebogruppe dargestellt (Median 274 Tage), der signifikant kürzer war als in der Trevicta-Gruppe (aufgrund des geringen prozentualen Anteils der Patienten mit Rezidiv [7,4%] war hier keine Schätzung des Medians möglich).
Abbildung 1: Kaplan-Meier-Plot des Zeitraums bis zum Eintreten eines Rezidivs – Zwischenanalyse

Nichtunterlegenheitsstudie
In der Nichtunterlegenheitsstudie wurden 1429 Patienten mit akuter Krankheit (mittlerer PANSS-Gesamtscore zum Baseline-Zeitpunkt: 85,7) in die offene Phase aufgenommen und 17 Wochen lang mit Paliperidonpalmitat als Depotinjektion für 1 Monat behandelt. Die Dosis konnte bei den Injektionen in Woche 5 und 9 angepasst werden (d.h. 50 mg, 75 mg, 100 mg oder 150 mg) und als Injektionsstelle kam der Delta- oder Gluteusmuskel in Frage. Von den Patienten, welche in Woche 14 und 17 die Randomisierungskriterien erfüllten, wurden 1016 im Verhältnis 1:1 randomisiert, um entweder weiter monatliche Injektionen von Paliperidonpalmitat als Depotinjektion für 1 Monat zu erhalten oder auf Trevicta umgestellt zu werden, wobei in diesem Fall das 3,5-Fache der Dosis von Paliperidonpalmitat als Depotinjektion für 1 Monat aus Woche 9 und 13 angewendet wurde. Die Behandlungsdauer betrug jeweils 48 Wochen. Die Patienten erhielten Trevicta einmal alle 3 Monate und in den anderen Monaten Placeboinjektionen, um die Verblindung aufrechtzuerhalten.
Der primäre Endpunkt der Studie war der prozentuale Anteil der Patienten ohne Rezidiv am Ende der 48-wöchigen doppelblinden Phase ausgehend von dem Kaplan-Meier-Schätzwert nach 48 Wochen (Trevicta: 91,2%, Paliperidonpalmitat-Depotinjektion für 1 Monat: 90,0%). Die mittlere (SD) Expositionsdauer während der doppelblinden Phase betrug in der mit Trevicta behandelten Gruppe 295 (88) Tage und in der mit Paliperidonpalmitat als Depotinjektion für 1 Monat behandelten Gruppe 287 (96) Tage. Aufgrund des geringen Anteils der Patienten mit Rezidiv war bei keiner der beiden Gruppen eine Einschätzung der medianen Dauer bis zum Eintreten eines Rezidivs möglich. Der Unterschied (95%-KI) zwischen den Behandlungsgruppen betrug 1,2% (-2,7%, 5,1%), sodass das festgelegte Nichtunterlegenheitskriterium basierend auf einem Grenzwert von -15% erfüllt war. Die Trevicta-Behandlung war daher gegenüber der Behandlung mit Paliperidonpalmitat als Depotinjektion für 1 Monat nicht unterlegen. Die funktionsbezogenen Verbesserungen bei Messung auf der PSP-Skala (Skala zur Beurteilung der persönlichen und sozialen Funktion), die während der offenen Stabilisierungsphase festzustellen waren, blieben bei beiden Gruppen in der doppelblinden Phase erhalten.
Abbildung 2: Kaplan-Meier-Plot der Dauer bis zum Eintreten eines Rezidivs im Vergleich zwischen Trevicta und Paliperidonpalmitat als Depotinjektion für 1 Monat

Die Wirksamkeitsergebnisse waren bei allen Teilgruppen des Kollektivs (Geschlecht, Alter und ethnische Zugehörigkeit) in beiden Studien einheitlich.
PharmakokinetikAbsorption
Aufgrund ihrer äusserst geringen Wasserlöslichkeit löst sich die Paliperidonpalmitat-Rezeptur als Depotinjektion für 3 Monate nach der intramuskulären Injektion langsam, bevor sie zu Paliperidon hydrolysiert und im Körperkreislauf resorbiert wird. Die Freisetzung des Arzneimittels beginnt bereits an Tag 1 und hält bis zu 18 Monate an.
Die in diesem Abschnitt beschriebenen Daten beruhen auf einer populationspharmakokinetischen Analyse. Nach einer intramuskulären Einzeldosis von Trevicta steigen die Plasmaspiegel von Paliperidon mit einer medianen Tmax von 30-33 Tagen allmählich auf die maximale Konzentration an. Nach intramuskulärer Injektion von Trevicta-Dosen von 175 bis 525 mg in den M. deltoideus wurde im Durchschnitt eine 11 bis 12% höhere Cmax als bei Injektion in den M. gluteus beobachtet. Das Freisetzungsprofil und Dosierungsschema von Trevicta führt zur Aufrechterhaltung der therapeutischen Konzentrationen. Die Gesamtexposition gegenüber Paliperidon nach der Verabreichung von Trevicta war über einen Dosisbereich von 175 bis 525 mg proportional zur Dosis und ungefähr proportional zur Dosis für Cmax. Das mittlere Verhältnis der maximalen und minimalen Steady-State-Werte bei einer Trevicta-Dosis lag nach glutealer Verabreichung bei 1,6 und nach deltoidaler Verabreichung bei 1,7.
Distribution
Das scheinbare Distributionsvolumen von Paliperidon nach Verabreichung von Trevicta beträgt 1960 Liter.
Die Plasmaproteinbindung von racemischen Paliperidon beträgt 74%.
Nach der Verabreichung von Trevicta kommt es zu einer Interkonversion der (+)- und (-)- Enantiomere von Paliperidon, wobei ein AUC(+)/(-)-Verhältnis von ca. 1,7 bis 1,8 erreicht wird.
Metabolismus
In einer Studie mit 14C-Paliperidon mit unverzüglicher Freisetzung wurden eine Woche nach der Verabreichung einer oralen Einzeldosis von 1 mg 14C-Paliperidon mit unverzüglicher Freisetzung 59% der Dosis unverändert über den Urin ausgeschieden, was bedeutet, dass Paliperidon in der Leber nicht extensiv metabolisiert zu werden scheint. Ungefähr 80% der verabreichten Radioaktivität wurden im Urin und 11% in den Fäzes wiedergefunden. In vivo wurden vier Stoffwechselwege identifiziert, wobei auf keinen mehr als 10% der Dosis entfallen: Dealkylierung, Hydroxylierung, Dehydrogenierung und Benzisoxazol-Abspaltung. Obwohl In vitro-Studien auf eine mögliche Beteiligung von CYP2D6 und CYP3A4 an der Umsetzung von Paliperidon hindeuten, gibt es in vivo keine Hinweise auf eine signifikante Rolle dieser Isoenzyme bei der Metabolisierung von Paliperidon. Populationspharmakokinetische Analysen zeigten keinen erkennbaren Unterschied zwischen extensiven Metabolisierern und langsamen Metabolisierern von CYP2D6-Substraten in Bezug auf die apparente Clearance von Paliperidon nach Anwendung von oralem Paliperidon. In-vitro-Studien mit humanen Lebermikrosomen zeigen, dass Paliperidon die Verstoffwechselung von Arzneimitteln, die von Cytochrom-P-450-Isozymen wie CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 und CYP3A5 umgesetzt werden, nicht in wesentlichem Umfang hemmt.
In vitro-Studien haben gezeigt, dass Paliperidon ein P-gp-Substrat und ein schwacher P-gp-Inhibitor bei hohen Konzentrationen ist. Es liegen keine In vivo-Daten vor, und die klinische Relevanz ist nicht bekannt.
Ausgehend von der populationspharmakokinetischen Analyse lag die mediane apparente Halbwertszeit von Paliperidon nach Verabreichung von Trevicta über den Dosisbereich von 175 bis 525 mg nach Injektion in den Deltoideus zwischen 84 und 95 Tagen und nach Injektion in den Gluteus zwischen 118 und 139 Tagen.
Paliperidonpalmitat-Depotinjektion für 3 Monate im Vergleich zu anderen Paliperidon-Rezepturen
Trevicta ist zur Gabe von Paliperidon alle 3 Monate bestimmt, während Paliperidonpalmitat als Depotinjektion für 1 Monat jeden Monat verabreicht wird. Wenn Trevicta in Dosen verabreicht wird, die 3,5 Mal höher sind als die entsprechende Dosis von Paliperidonpalmitat als Depotinjektion für 1 Monat, führt dies zu einer ähnlichen Paliperidonexposition wie nach Gabe entsprechender monatlicher Dosen der Paliperidonpalmitat-Depotinjektion für 1 Monat und wie nach Einnahme entsprechender Dosen von Paliperidon-Retardtabletten einmal täglich. Der Expositionsbereich bei Anwendung von Trevicta liegt innerhalb des Expositionsbereichs bei Anwendung der zugelassenen Dosisstärken der Paliperidon-Retardtabletten.
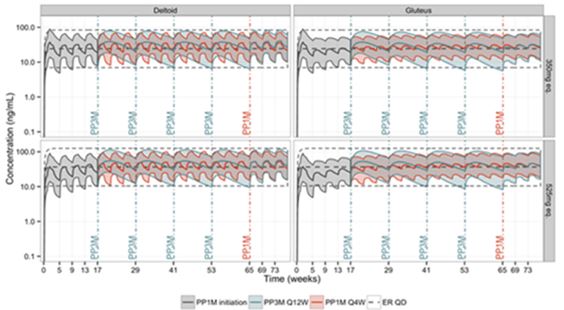
Abbildung 3 zeigt die populationsbezogen prognostizierten medianen pharmakokinetischen Profile von Paliperidon nach Verabreichung von Trevicta in der Dosis 350 mg und 525 mg im Vergleich zur Verabreichung monatlicher Injektionen von 100 mg und 150 mg Paliperidonpalmitat für 1 Monat und zur Einnahme oraler Retardtabletten (8 mg oder 12 mg). Eine mindestens 4-monatige Behandlung mit Paliperidonpalmitat als Depotinjektion für 1 Monat vor Beginn der Verabreichung von Trevicta führte zur Aufrechterhaltung der Paliperidon-Plasmaexposition im Steady-State.
Abbildung 3: Prognostizierte Paliperidonplasmakonzentrationen im Zeitverlauf bei Anwendung von Trevicta (PP3M) in den Dosisgruppen 350 mg und 525 mg im Vergleich zur monatlichen Gabe von Paliperidonpalmitat als Depotinjektion für 1 Monat (PP1M) in der Dosis 100 mg oder 150 mg. Die gestrichelten Linien zeigen die prognostizierten Paliperidonkonzentrationen nach Einnahme von oralen Paliperidon-Retardtabletten mit 8 mg und 12 mg
Elimination
Siehe Metabolismus.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Paliperidon wird nicht extensiv in der Leber metabolisiert. Zwar wurde Trevicta nicht bei Patienten mit eingeschränkter Leberfunktion untersucht, bei Patienten mit leichter oder mittelschwerer Einschränkung der Leberfunktion ist jedoch keine Anpassung der Dosis erforderlich. In einer Studie mit oralem Paliperidon bei Probanden mit mittelschwerer Einschränkung der Leberfunktion (Child- Pugh-Klasse B) waren die Plasmakonzentrationen von freiem Paliperidon ähnlich wie bei gesunden Probanden. Bei Patienten mit schwerer Einschränkung der Leberfunktion wurde Paliperidon nicht untersucht.
Nierenfunktionsstörungen
Trevicta wurde bei Patienten mit eingeschränkter Leberfunktion nicht systematisch untersucht. Die Disposition einer oralen Einzeldosis von 3 mg Paliperidon als Retard-Tablette wurde an Probanden mit unterschiedlich stark eingeschränkter Nierenfunktion untersucht. Die Elimination von Paliperidon nahm mit reduzierter geschätzter Creatininclearance ab. Die Gesamt-Clearance von Paliperidon war bei Probanden mit leichter Einschränkung der Nierenfunktion (CrCl = 50 bis <80 ml/min) um 32%, solchen mit mässiger Einschränkung (CrCl = 30 bis <50 ml/min) um 64% und solchen mit schwerer Einschränkung (CrCl = 10 bis <30 ml/min) um 71% verringert. Dies entspricht einer durchschnittlichen 1,5-, 2,6- bzw. 4,8-fachen Erhöhung der Exposition (AUCinf) im Vergleich zu gesunden Probanden. Auf Grundlage von wenigen Beobachtungen von Trevicta bei Probanden mit leichter Einschränkung der Nierenfunktion und pharmakokinetischen Simulationen wird bei Patienten mit leichter Einschränkung der Nierenfunktion eine reduzierte Einleitungs- und Erhaltungsdosis der Paliperidonpalmitat-Depotinjektion für 1 Monat empfohlen. Solche Patienten können auf Trevicta in der entsprechenden, mit dem Multiplikationsfaktor 3,5 berechneten Dosis umgestellt werden. Nach Beginn der Anwendung von Trevicta ist keine weitere Dosisreduzierung erforderlich (siehe «Dosierung/Anwendung»).
Ältere Patienten
Eine Dosisanpassung allein auf Grundlage des Alters wird nicht empfohlen. Es kann jedoch eine Dosisanpassung auf Grundlage einer altersbedingten Verminderung der Creatininclearance erforderlich sein (siehe «Nierenfunktionsstörungen» und «Dosierung/Anwendung»).
Ethnizität
In der populationspharmakokinetischen Analyse von Daten aus Studien mit oralem Paliperidon ergaben sich keine Anzeichen für ethnische Unterschiede in der Pharmakokinetik von Paliperidon nach Verabreichung von Trevicta.
Geschlecht
Es wurden keine klinisch signifikanten Unterschiede zwischen Männern und Frauen beobachtet.
Rauchen
Aus In vitro-Studien mit Enzymen der menschlichen Leber geht hervor, dass Paliperidon kein Substrat von CYP1A2 ist; Rauchen sollte daher keinen Einfluss auf die Pharmakokinetik von Paliperidon haben. In Korrelation mit diesen In vitro-Ergebnissen zeigte eine populationspharmakokinetische Auswertung keine Unterschiede zwischen Rauchern und Nichtrauchern.
Body Mass Index (BMI)/Körpergewicht
Es ist keine Anpassung der Dosis nach BMI erforderlich. Bei übergewichtigen und adipösen Patienten wurde eine niedrigere Cmax festgestellt. Im apparenten Steady-State bei Anwendung von Trevicta waren die Talspiegel bei normalgewichtigen, übergewichtigen und adipösen Patienten ähnlich.
Präklinische DatenLangzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Wie bei anderen Arzneimitteln mit antagonistischer Wirkung auf Dopamin-D2-Rezeptoren wurden in Studien zur Toxizität bei wiederholter Gabe von intramuskulär injiziertem Paliperidonpalmitat und oral verabreichten Paliperidon erhöhte Prolaktinspiegel im Serum festgestellt.
In einer 7-wöchigen Studie zur Toxizität bei jungen Ratten mit oralen Paliperidondosen von 0,16, 0,63 und 2,5 mg/kg/Tag, wurden keine Auswirkungen auf das Wachstum, die Geschlechtsreife und die Reproduktionsleistung beobachtet. Orale Dosen bis zu 2,5 mg/kg/Tag hatten keine Beeinträchtigung der neurologischen Verhaltensentwicklung bei männlichen und weiblichen Tieren zur Folge, bei weiblichen Ratten, denen 2,5 mg/kg/Tag verabreicht worden war, wurde jedoch ein Effekt auf Lernen und Gedächtnis festgestellt. Nach Absetzen der Behandlung war dieser Effekt nicht mehr vorhanden. Die Cmax- und AUC-basierte Sicherheitsspanne betrug bei männlichen Ratten unter 2,5 mg/kg/Tag das 9- bzw. 2-Fache und bei weiblichen Ratten unter 0,63 mg/kg/Tag das 2- bzw. 0,6-Fache im Vergleich zur empfohlenen Tageshöchstdosis von 12 mg beim Menschen.
In einer 40-wöchigen Studie bei Junghunden, denen orales Risperidon (das weitgehend zu Paliperidon abgebaut wird) in Dosen von 0,31, 1,25 und 5 mg/kg/Tag verabreicht wurde, ergab sich bei 0,31 und 1,25 mg/kg/Tag kein unerwünschter Einfluss auf die Geschlechtsreife. Bei Anwendung der Dosen 1,25 und 5 mg/kg/Tag wurden Einflüsse auf das Wachstum der Röhrenknochen festgestellt, die bei Anwendung der Dosis von 0,31 mg/kg/Tag nicht vorhanden waren.
Mutagenität
Im Rückmutationstest (Ames Test), im Mauslymphomtest oder im Rattenmikrokerntest ergaben sich keine Hinweise auf ein mutagenes Potential. Paliperidonpalmitat wies im Rückmutations- bzw. Ames Test oder im Mauslymphomtest keine genotoxischen Eigenschaften auf.
Kanzerogenität
Das kanzerogene Potential von intramuskulär injiziertem Paliperidonpalmitat wurde an Ratten untersucht. Es wurde eine statistisch signifikante Erhöhung der Inzidenz von Brustdrüsenadenokarzinomen bei weiblichen Ratten bei 10, 30 und 60 mg/kg/Monat beobachtet. Männliche Ratten zeigten eine statistisch signifikante Erhöhung der Inzidenz von Brustdrüsenadenomen und -karzinomen bei 30 und 60 mg/kg/Monat. Dies entspricht Expositionen in Höhe des 0,6- bzw. 1,2-Fachen der AUC beim Menschen unter der empfohlenen Tageshöchstdosis von 525 mg.
Das karzinogene Potential von oralem Paliperidon, einem aktiven Metaboliten von Risperidon, wurde ausgehend von Studien mit Risperidon bei Mäusen und Ratten bewertet. Risperidon wurde in Dosen bis zu 10 mg/kg/Tag 18 Monate lang an Mäuse und 25 Monate lang an Ratten verabreicht. Es wurden statistisch signifikante Erhöhungen der Häufigkeit von Hypophysenadenomen, endokrinen Pankreasadenomen und Brustdrüsenadenokarzinomen beobachtet. Ein Anstieg der Häufigkeit von Tumoren in der Brustdrüse, der Hypophyse und im endokrinen Pankreas wurde bei Nagern auch nach chronischer Gabe anderer Antipsychotika festgestellt und ist vermutlich auf den verlängerten Dopamin-D2-Antagonismus zurückzuführen. Die Relevanz dieser Tumornachweise bei Nagern für das Risiko beim Menschen ist nicht bekannt.
Reproduktionstoxizität
Embryo-fetale Entwicklung
Studien zur embryo-fetalen Entwicklung zeigten nach oraler Verabreichung von bis zu 10 mg/kg/Tag Paliperidon bei Ratten und von bis zu 5 mg/kg/Tag bei Kaninchen keine teratogene Wirkung. Die Zahl überlebender Kaninchen-Feten war bei einer Dosis von 5 mg/kg/Tag reduziert, welche auch Maternaltoxizität aufwies. Nach intramuskulärer Verabreichung von Paliperidonpalmitat bei trächtigen Ratten wurde bis zur höchsten Dosis (160 mg/kg), welche dem 2,2-fachen des Expositionsniveaus beim Menschen bei der empfohlenen Maximaldosis von 525 mg entspricht, keine Embryotoxizität oder Teratogenität beobachtet.
Fertilität
Wenngleich die Gabe von oralem Paliperidon zu Prolaktin- und ZNS-vermittelten Einflüssen führte, waren keine Auswirkungen auf die Fertilität männlicher und weiblicher Ratten zu beobachten. Unter maternal toxischen Dosierungen von 2,5 mg/kg/Tag war die Anzahl lebender Embryonen vermindert. Bei Hunden wurde für orales Risperidon nach Gabe von Dosen, die äquivalent zur empfohlenen Maximaldosis von Risperidon beim Menschen waren, eine verminderte Motilität der Spermien und des Testosteron-Plasmaspiegels beschrieben. Bei weiblichen (aber nicht bei männlichen) Ratten kam es unter Risperidon zu einer Beeinträchtigung des Paarungsverhaltens, während Wirkungen auf die Fertilität nicht festgestellt wurden.
Sonstige HinweiseInkompatibilitäten
Trevicta sollte nicht mit einem anderen Arzneimittel oder Verdünnungsmittel gemischt werden und ist für die intramuskuläre Verabreichung direkt aus der Fertigspritze, in dem es sich bei Lieferung befindet, bestimmt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30 °C lagern.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer66054 (Swissmedic).
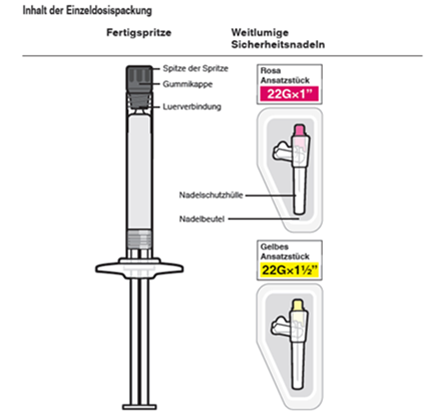
PackungenKit mit Depot-Injektionssuspension in einer Fertigspritze zu 175 mg/0,875 ml, 263 mg/1,315 ml, 350 mg/ 1,75 ml, 525 mg/2,625 ml, einem Kolbenstopfen und einer Spitzenkappe (Brombutylkautschuk), einem Backstop und einer weitlumigen 22G-Sicherheitsnadel mit einer Länge von 1,5 Zoll (3,81 cm) und einer weitlumigen 22G-Sicherheitsnadel mit der Länge von 1 Zoll (2,54 cm). [B]
ZulassungsinhaberinJanssen-Cilag AG, Zug, ZG.
Stand der InformationMärz 2023
Hinweise zur Anwendung, Handhabung und Entsorgung
Trevicta
Depot-Injektionssuspension zur intramuskulären Injektion

Nur für die intramuskuläre Injektion. Nicht auf andere Weise verabreichen.
Wichtig
Trevicta sollte von einer medizinischen Fachperson als Einzelinjektion verabreicht werden. Die Dosis nicht in mehrere Injektionen aufteilen.
Trevicta ist nur für die intramuskuläre Anwendung bestimmt. Langsam und tief in den Muskeln spritzen und darauf achten, die Injektion in ein Blutgefäss zu vermeiden.
Vor der Anwendung die ganze Anleitung durchlesen.
Dosierung
Dieses Arzneimittel sollte einmal alle 3 Monate verabreicht werden.
Vorbereitung
Die Etikettlasche von der Spritze abziehen und in die Krankenakte des Patienten legen.
Trevicta muss länger und kräftiger geschüttelt werden als Paliperidonpalmitat als Depotinjektion für 1 Monat. Die Spritze innerhalb von 5 Minuten vor der Verabreichung mindestens 15 Sekunden lang kräftig schütteln und die Spitze der Spritze dabei nach oben halten (siehe Schritt 2).
Auswahl der weitlumigen Sicherheitsnadel
Trevicta wird mit speziellen weitlumigen Sicherheitsnadeln verabreicht. Es dürfen daher nur die dem Trevicta-Kit beiliegenden Nadeln verwendet werden.

|











