ZusammensetzungWirkstoffe
Tropicamidum, Phenylephrini hydrochloridum und Lidocaini hydrochloridum monohydricum.
Hilfsstoffe
Natrii chloridum, Dinatrii phosphas dodecahydricus, Dinatrii phosphas dihydricus, Dinatrii edetas, Aqua ad iniectabile.
Gesamtmenge an Natrium: 2.96 mg Natrium pro ml, entsprechend 0.59 mg pro Dosis.
Indikationen/AnwendungsmöglichkeitenMydrane wird angewendet im Rahmen einer Kataraktoperation zur Erzielung einer Mydriasis und intraokularen Anästhesie während des chirurgischen Eingriffs.
Mydrane ist nur für die Behandlung bei Erwachsenen indiziert.
Dosierung/AnwendungIntrakamerale Anwendung. Eine Ampulle zur einmaligen Anwendung am Auge.
Dosierung
Mydrane darf nur bei Patienten angewendet werden, die bereits im Rahmen einer präoperativen Untersuchung nach Applikation eines topischen Mydriatikums eine zufriedenstellende Pupillenerweiterung gezeigt haben.
Erwachsene:
Zu Beginn des chirurgischen Eingriffs sind 0,2 ml Mydrane intrakameral als langsame Injektion zu applizieren. Es soll nur eine Injektion gegeben werden.
Spezielle Dosierungsanweisungen:
Patienten mit Leberfunktionsstörungen
Eine Dosisanpassung ist in Anbetracht der niedrigen Dosis und der sehr niedrigen systemischen Exposition (siehe «Pharmakokinetik») nicht erforderlich.
Patienten mit Nierenfunktionsstörungen
Eine Dosisanpassung ist in Anbetracht der niedrigen Dosis und der sehr niedrigen systemischen Exposition (siehe «Pharmakokinetik» und «Warnhinweise und Vorsichtsmassnahmen») nicht erforderlich.
Ältere Patienten
Es ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Mydrane bei Kindern und Jugendlichen im Alter von 0 bis 18 Jahren ist nicht erwiesen.
Art der Anwendung
Intrakamerale Anwendung.
Folgende Vorgehensweise ist zu beachten:
1.Fünf Minuten vor der Durchführung der präoperativen antiseptischen Vorbereitung und dem ersten Schnitt werden ein bis zwei Tropfen einer anästhesierenden Augentropfenlösung in das Auge geträufelt.
2.Zu Beginn der Operation werden 0,2 ml Mydrane langsam mit einer einzigen Injektion von einem Augenchirurgen intrakameral über den Seitenanschluss oder den Hauptanschluss injiziert.
Kontraindikationen·Überempfindlichkeit gegenüber einem der Wirkstoffe (Tropicamid, Phenylephrinhydrochlorid und Lidocainhydrochlorid) oder einem der Hilfsstoffe.
·Bekannte Überempfindlichkeit gegen Anästhetika vom Amid-Typ (z.B. Articain, Bupivacain, Mepivacain, Prilocain, Ropivacain).
·Bekannte Überempfindlichkeit gegen Atropin-Derivate.
·Patienten mit flacher Augenvorderkammer mit Risiko eines Verschlusses des Iridokornealwinkels.
Warnhinweise und VorsichtsmassnahmenDie empfohlene Dosis beträgt 0,2 ml Mydrane; es sollte keine weitere Dosis injiziert werden, da keine bedeutsame Zusatzwirkung nachgewiesen werden konnte und ein erhöhter Verlust von Endothelzellen beobachtet wurde (siehe auch «Überdosierung»).
Nach Applikation der empfohlenen Dosis Mydrane wurde über keine toxischen Wirkungen auf das Kornea-Endothel berichtet. Dennoch kann dieses Risiko nicht gänzlich ausgeschlossen werden, da bisher nur begrenzte Daten dazu vorliegen.
Es liegen keine klinischen Erfahrungen mit der Anwendung von Mydrane vor bei:
·Patienten mit insulinpflichtigem oder nicht eingestelltem Diabetes mellitus,
·Patienten mit einer Erkrankung der Kornea, insbesondere einer gleichzeitig bestehenden Schädigung der Endothelzellen,
·Patienten mit anamnestisch bekannter Uveitis,
·Patienten mit Pupillenanomalien oder Augentrauma,
·Patienten mit sehr dunklen Iriden,
·Kataraktoperation in Verbindung mit einer Korneatransplantation.
Es liegen keine Erfahrungen mit Mydrane bei Patienten mit einem Risiko für das Floppy-Iris-Syndrom vor. Bei diesen Patienten sollte eine schrittweise herbeigeführte Pupillendilatation, beginnend mit der Applikation von Augentropfen zur Erzielung einer Mydriasis, von Nutzen sein.
Es gibt keine klinischen Erfahrungen während einer Kataraktchirurgie mit Mydrane bei Patienten, welche mit einem topischen Mydriatikum behandelt wurden, und bei denen eine Pupillenverengung (oder sogar Miosis) während der Operation aufgetreten ist.
Die Anwendung von Mydrane bei Kataraktoperationen in Kombination mit einer Vitrektomie wird auf Grund der gefässverengenden Wirkungen von Phenylephrin nicht empfohlen.
Die Anwendung von Mydrane bei Patienten mit flacher Augenvorderkammer oder anamnestisch bekanntem akuten Engwinkelglaukom wird nicht empfohlen.
Eine Anwendung von Mydrane bei Patienten mit flacher Augenvorderkammer, anamnestisch bekanntem akuten Engwinkelglaukom und/oder ungenügender Pupillendilatation kann das Risiko von Iridozele und «Floppy-Iris-Syndrom» erhöhen.
Besondere Vorsichtsmassnahmen für die Anwendung
Es wurde gezeigt, dass Mydrane zu nicht nachweisbaren bzw. sehr niedrigen systemischen Wirkstoffkonzentrationen führt (siehe «Pharmakokinetik»). Da die systemischen Wirkungen von Phenylephrin und Lidocain dosisabhängig sind, ist es unwahrscheinlich, dass solche Wirkungen bei Mydrane auftreten. Ein Risiko kann jedoch nicht gänzlich ausgeschlossen werden und deshalb wird an dieser Stelle auf Folgendes hingewiesen:
·Phenylephrin besitzt eine sympathomimetische Aktivität, die sich bei Hypertonie, Herzerkrankungen, Hyperthyreose, Atherosklerose oder Prostataerkrankungen auswirken und alle Patienten betreffen kann, bei denen eine Kontraindikation gegen die systemische Anwendung von pressorischen Aminen (z.B. Epinephrin, Norepinephrin, Dopamin, Dobutamin) besteht.
·Lidocain sollte bei Patienten mit Epilepsie, Myasthenia gravis, Erregungsleitungsstörungen des Herzens, dekompensierter Herzinsuffizienz, Bradykardie, schwerem Schock, eingeschränkter Atemfunktion oder Nierenfunktionsstörungen mit einer Kreatinin-Clearance von weniger als 10 ml/Minute mit Vorsicht angewendet werden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro 0,2 ml, d.h. es ist nahezu «natriumfrei».
InteraktionenEs wurden keine Studien zur Erfassung von Wechselwirkungen mit Mydrane durchgeführt.
Da mit einer sehr geringen systemischen Exposition gerechnet wird (siehe «Pharmakokinetik»), sind systemische Wechselwirkungen unwahrscheinlich.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen keine ausreichenden Erfahrungen mit der Anwendung von Phenylephrin und Tropicamid bei Schwangeren vor. Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf die Wirkungen auf die Schwangerschaft, embryonale/fetale Entwicklung, Geburt und die postnatale Entwicklung vor.
Obwohl tierexperimentelle Studien keine Hinweise auf eine schädigende Wirkung für den Fetus ergeben haben, soll Lidocain während der Schwangerschaft nicht angewendet werden, da es plazentagängig ist.
Auch wenn zu erwarten ist, dass die systemische Aufnahme vernachlässigbar gering ist, kann eine niedrige systemische Exposition nicht ausgeschlossen werden.
Daher soll Mydrane während der Schwangerschaft nicht angewendet werden.
Stillzeit
Es gibt keine Informationen darüber, ob Phenylephrin oder Tropicamid in die Muttermilch übergehen. Phenylephrin wird oral nur schlecht resorbiert, was darauf schliessen lässt, dass die Aufnahme durch das Kind vernachlässigbar wäre. Andererseits können Säuglinge sehr empfindlich auf Anticholinergika reagieren und die Anwendung von Tropicamid während der Stillzeit wird daher trotz der erwarteten vernachlässigbaren systemischen Exposition nicht empfohlen.
Geringe Mengen Lidocain werden in die Muttermilch ausgeschieden und es besteht die Möglichkeit des Auftretens einer allergischen Reaktion beim Säugling.
Daher soll Mydrane während der Stillzeit nicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenMydrane hat auf Grund seiner pupillenerweiternden Wirkung einen mässigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Daher sollte der Patient nach der Kataraktoperation mit einer Mydrane-Injektion darauf hingewiesen werden, kein Fahrzeug zu führen und/oder keine Maschinen zu bedienen, solange die Sehstörungen anhalten.
Unerwünschte WirkungenAus klinischen Prüfungen mit Mydrane wurden Nebenwirkungen berichtet. Die meisten betrafen die Augen und waren in ihrer Intensität leicht bis mittelschwer.
Zusammenfassung des Nebenwirkungsprofils:
Posteriore Kapselruptur und zystoides Makulaödem sind bekannte Komplikationen, die während oder nach der Katarakt-Operation auftreten.
Tabelle der Nebenwirkungen:
Die Nebenwirkungen werden entsprechend ihrer Häufigkeit wie folgt kategorisiert: Sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10000, <1/1000); sehr selten (<1/10000).
In der nachfolgenden Tabelle sind die Nebenwirkungen, welche während klinischer Studien gemeldet wurden, nach Systemorganklassen und nach abnehmendem Schweregrad innerhalb jeder Häufigkeitsgruppe aufgeführt:
|
Systemorganklasse
|
Häufigkeit
|
Nebenwirkung
| |
Erkrankungen des Nervensystems
|
Gelegentlich
|
Kopfschmerzen
| |
Augenerkrankungen
|
Gelegentlich
|
Keratitis, zystoides Makulaödem, erhöhter Augeninnendruck, posteriore Kapselruptur, okulare Hyperämie
| |
Nicht bekannt
|
Floppy-Iris-Syndrome, Irisprolaps
| |
Gefässerkrankungen
|
Gelegentlich
|
Hypertonie
|
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungSystemische Wirkungen
Auf Grund der einmaligen Anwendung und der erwarteten geringen systemischen Passage von Mydrane ist das Risiko systemischer Wirkungen durch Überdosierung als minimal anzusehen.
Bei einer ophthalmologischen Überdosierung von Phenylephrin ist wahrscheinlich mit Wirkungen zu rechnen, die auf eine systemische Resorption zurückzuführen sind, wie z.B. extreme Müdigkeit, Schweissausbrüche, Schwindel, Bradykardie und Koma.
Da schwere toxische Reaktionen nach Phenylephrin rasch auftreten und nur von kurzer Dauer sind, besteht die Behandlung in erster Linie in unterstützenden Massnahmen. Die sofortige Injektion eines schnell wirksamen Alpha-Blockers wie Phentolamin (2 bis 5 mg bei intravenöser Anwendung) wurde empfohlen.
Zu den Symptomen einer ophthalmologischen Tropicamid-Überdosierung zählen Kopfschmerzen, Tachykardie, Mundtrockenheit, Hauttrockenheit, untypische Benommenheit und Hitzewallungen.
Systemische Wirkungen durch Tropicamid sind nicht zu erwarten. Falls es zu einer Überdosierung mit lokalen Auswirkungen kommt, wie z.B. einer anhaltenden Mydriasis, sollte Pilocarpin oder Physostigmin (als 0,25%ige Lösung) angewendet werden.
Bei exzessiver Resorption von Lidocain in die Blutbahn können u.a. zentralnervöse Symptome (wie Krampfanfälle, Bewusstlosigkeit und möglicherweise Atemstillstand) und kardiovaskuläre Reaktionen (wie Hypotonie, Myokarddepression, Bradykardie und möglicherweise Herzstillstand) auftreten.
Die Behandlung eines Patienten, bei dem die Anzeichen einer systemischen Toxizität von Lidocain auftreten, besteht in der Beseitigung der Krampfanfälle und der Gewährleistung einer ausreichenden Sauerstoffversorgung, ggf. durch eine assistierte oder kontrollierte Beatmung (Respiration).
Lokale Wirkungen
Eine Überdosierung kann zum Verlust von Endothelzellen führen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Eigenschaften/WirkungenATC-Code
S01FA56
Mydrane ist eine Lösung zur Injektion in die Vorderkammer, in der zwei synthetische Wirkstoffe zur Pupillenerweiterung (Tropicamid- ein Anticholinergikum- und Phenylephrin- ein Alpha-Sympathomimetikum) sowie ein Lokalanästhetikum (Lidocainhydrochlorid) enthalten sind.
Wirkungsmechanismus
Phenylephrin ist ein direkt wirkendes Sympathomimetikum. Es bewirkt über Stimulation der alpha-adrenergen Rezeptoren des Musculus dilatator pupillae eine Kontraktion des M.dilatator pupillae und dadurch eine Mydriase. Die zykloplegische Wirkung ist schwach.
Tropicamid ist ein Parasympatholytikum. Seine anticholinerge Wirkung führt, nach Bindung an die M4- Muskarinrezeptoren der Augenmuskeln, zu einer Lähmung des M.sphincter pupillae und des M.ciliaris und dadurch zu einer Mydriase und zu einer Zykloplegie.
Lidocain ist ein Lokalanästhetikum vom Amid-Typ. Es entfaltet seine Wirkung durch Hemmung des für die Initiierung und Weiterleitung von Impulsen erforderlichen Ionenrückflusses und stabilisiert dadurch die neuronale Membran.
Obgleich Tropicamid als Monotherapie sowohl eine Mydriasis als auch eine Zykloplegie bewirkt, tritt durch die gleichzeitige Anwendung von Sympathomimetika wie Phenylephrin eine zusätzliche Mydriasis auf. Solche synergistischen Kombinationen werden verordnet, um eine maximale Dilatation der Pupille zur Kataraktextraktion zu erzielen.
In der klinischen Studie der Phase II wurden im Durchschnitt 95% der vor der Injektion des Viskoelastikums gemessenen Dilatation innerhalb von 30 Sekunden nach einer einmaligen intrakameralen Injektion von 200 µl Mydrane erreicht. Die in den klinischen Studien der Phase II und Phase III beobachteten Pupillengrössen (von Patienten mit einer einmaligen intrakameralen Injektion von 200 µl Mydrane) sind in der nachstehenden Tabelle dargestellt:
|
|
Phase-II-Studie, n=24
|
Phase-III-Studie, n=181
| |
Innerhalb von 30 Sekunden nach der Mydrane-Injektion
|
Nach Injektion von Mydrane und anschliessender Injektion des Viskoelastikums
|
Nach Injektion von Mydrane und anschliessender Injektion des Viskoelastikums
|
Unmittelbar vor der IOL-Injektion
| |
Pupillengrösse (mm)
| |
Mittelwert (SD)
|
6,7 (0,7)
|
7,7 (0,7)
|
7,8 (0,8)
|
7,9 (0,9)
| |
Median
|
6,7
|
7,7
|
7,8
|
7,9
|
In der Phase-III-Studie betrug die Pupillengrösse nach einmaliger Injektion von 200 µl Mydrane und nach der Injektion des Viskoelastikums (unmittelbar vor der Kapsulorhexis) bei 86,7% der Patienten mindestens 7 mm. In diesen klinischen Studien der Phase II und III wurde unter Mydrane eine bis zum Ende der Operation stabile Mydriasis nachgewiesen.
Die Rückkehr zur normalen Pupillengrösse ist nach 5-7 Stunden erreicht.
Pharmakodynamik
Siehe Kapitel «Wirkungsmechanismus»
Klinische Wirksamkeit und Sicherheit
Die pupillenerweiternden und anästhesierenden Wirkungen von Mydrane wurden in einer multizentrischen, offenen, randomisierten klinischen Studie der Phase III im Vergleich mit einer topischen Standardbehandlung (Phenylephrin und Tropicamid) bei 555 Patienten, die sich einer Kataraktoperation unterzogen und nach der topischen Applikation des Mydriatikums einen Pupillendurchmesser von ≥7 mm zeigten, bewertet. Bei beiden Patientengruppen wurden Tetracain 1%-Augentropfen 5 Minuten und 1 Minute vor dem chirurgischen Eingriff in das Auge geträufelt.
Mydriasis:
Im mITT-Kollektiv wurde die Nichtunterlegenheit von Mydrane versus Vergleichsbehandlung (Applikation von Tropicamid 0,5% Augentropfen und Phenylephrin 10% Augentropfen mit jeweils einem Tropfen jedes Arzneimittels und 3-maliger Wiederholung der Applikation vor dem chirurgischen Eingriff) für den primären und coprimären Wirksamkeitsendpunkt nachgewiesen (siehe nachstehende Tabelle):
|
mITT Population
|
Mydrane
|
Vergleichsbehandlung
|
Unterschied (%) zwischen den Gruppen
(Mydrane - Reference)
[95% KI]
| |
Primärer Wirksamkeitsendpunkt
|
N=268
|
N=281
|
| |
Anzahl (%) Responder*
95% KI
|
265 (98,9)
[96,8; 99,8]
|
266 (94,7)
[91,3; 97,0]
|
4,2
[-4,2; 12,6]
| |
Coprimärer Wirksamkeitsendpunkt
|
N=250
|
N=261
|
| |
Anzahl (%) Responder**
95% KI
|
246 (98,4)
[96,0; 99,6]
|
246 (94,3)
[90,7; 96,7]
|
4,1
[-4,5; 12,8]
| |
* Ein Responder war definiert als ein Patient, bei dem die Kapsulorhexis ohne die Anwendung einer zusätzlichen pupillenerweiternden Behandlung durchgeführt wurde.
** Ein Responder war definiert als ein Patient, bei dem die Kapsulorhexis ohne die Anwendung eines zusätzlichen Mydriatikums durchgeführt wurde und dessen Pupillengrösse unmittelbar vor der Linsenkapseleröffnung ≥5,5 mm betrug.
mITT = Alle randomisierten Patienten, die nachweislicherweise die Studienmedikation verwendeten und die die Nicht-Aufnahmekriterien hinsichtlich nicht genehmigter früherer und gleichzeitiger Medikamente erfüllten.
|
In der Phase-III-Studie erhielten 197 Patienten in der Mydrane-Gruppe (N=268) eine einmalige intrakamerale Injektion von 200 µl und 71 erhielten eine zusätzliche intrakamerale Injektion von 100 µl, für die kein signifikanter Zusatzeffekt nachgewiesen werden konnte und bei denen ein erhöhter Endothelzellverlust beobachtet wurde (siehe auch «Überdosierung»).
Die ausgewerteten Daten von Patienten mit einer einmaligen intrakameralen Injektion von 200 µl, bei denen die Kapsulorhexis ohne zusätzliche mydriatische Behandlung durchgeführt wurde und bei denen die Pupillengrösse unmittelbar vor der Linsenkapseleröffnung >6 mm betrug, sind in der Tabelle unten dargestellt.
|
|
Mydrane
200 µl
|
Vergleichs-behandlung
|
Unterschied (%) zwischen den Gruppen
(Mydrane 200 µl – Vergleichspräparat)
[95% KI]
| |
N
|
N=181
|
N=261
|
| |
Anzahl (%) Patienten ohne zusätzliche mydriatische Behandlung und mit einer Pupillengrösse unmittelbar vor der Kapsulorhexis von >6 mm
|
180 (99,4)
|
246 (94,3)
|
5,2
| |
95% KI
|
[97,0; 100,0]
|
[90,7; 96,7]
|
[-4,3; 14,6]
|
Anästhesie:
Vor der Injektion der Intraokularlinse war der Komfort von Patienten mit Mydrane statistisch signifikant besser (p=0,034) und zu den anderen Zeitpunkten der Operation (vor Injektion des Viskoelastikums, Kapsulorhexis und Cefuroxim-Injektion) wurde kein statistisch signifikanter Unterschied zwischen den Gruppen beobachtet.
PharmakokinetikFür Mydrane liegen keine okulären pharmakokinetischen Daten vor.
Bei 15 Patienten, die sich einer Kataraktoperation unterzogen, wurden nach intrakameraler Injektion von Mydrane die Wirkstoffkonzentrationen im Plasma 2, 12 und 30 Minuten nach der Injektion gemessen und mit denen einer topischen Standardbehandlung (Phenylephrin 10% Augentropfen und Tropicamid 0,5% Augentropfen) verglichen. Bei Tropicamid lagen die Plasmakonzentrationen von allen Patienten in der Mydrane-Gruppe unterhalb der Nachweisgrenze (<0,1 ng/ml), während die Plasmakonzentrationen von allen Patienten in der Vergleichsgruppe über diesem Grenzwert lagen. Die Phenylephrin-Konzentration (Quantifizierungsgrenze <0,1 ng/ml) war ausser in 2 Fällen (maximal 0,59 ng/ml) bei keinem der Patienten in der Mydrane-Gruppe nachweisbar, während bei allen Patienten in der Vergleichsgruppe Konzentrationen oberhalb der Quantifizierungsgrenze gemessen wurden (maximal 1,42 ng/ml).
Die Lidocain-Plasmakonzentration wurde bei allen mit Mydrane behandelten Patienten gemessen; die höchste Konzentration betrug 1,45 ng/ml (und lag damit deutlich unter den Werten von 1500 bis 5000 µg/ml, die bestimmte systemische Wirkungen hervorrufen).
Absorption
Nicht anwendbar.
Distribution
Nicht anwendbar.
Metabolismus
Nicht anwendbar.
Elimination
Nicht anwendbar.
Präklinische DatenBei Kaninchen war die Verträglichkeit von Mydrane am Auge nach einer einmaligen intrakameralen Anwendung von 200 µl Mydrane mit oder ohne Spülen (Spaltlampe, wässriges Flare-Phänomen, Korneadicke und zelluläre Dichte des Endothels, Elektroretinographie und Histologie) in den sieben Tagen nach der Behandlung sehr gut.
Anzeichen einer okulären Unverträglichkeit wurden nur bei Formulierungen mit höheren Konzentrationen der drei Wirkstoffe (bei oder über dem 5-Fachen der Konzentrationen in Mydrane) beobachtet. Unter der höchsten getesteten Konzentration (das 10-Fache) zeigten sich Verdickung der Kornea und schwere Augenveränderungen, die bei einem Tier am 3.Tag zur Euthanasie führten.
Die systemische Toxizität der Fixkombination aus Phenylephrin, Tropicamid und Lidocain wurde nicht untersucht.
Da die ophthalmologische Sicherheit der drei Einzelwirkstoffe als gesichert gilt und Mydrane nur als einmalige intrakamerale Injektion gegeben wird, ist bei der Kombination jedoch kein besonderes Risiko zu erwarten.
Die Sicherheitspharmakologie, Genotoxizität und Reproduktionstoxizität der Einzelsubstanzen der Fixkombination wurden ebenfalls nicht bewertet. Bei Ratten führte die Anwendung von Phenylephrin (12,5 mg/kg, s.c.) zu einer verringerten Uterusdurchblutung (Abnahme um 86,8% in ca. 15 Minuten), was ein Hinweis auf fetotoxische und co-teratogene Eigenschaften ist. Bei Lidocain wurden in Studien zur embryonalen/fetalen Entwicklung an Ratten und Kaninchen keine teratogenen Wirkungen beobachtet. Eine Embryotoxizität und eine Abnahme der Überlebensrate nach der Geburt wurden nur nach Dosen beobachtet, die für die Muttertiere toxisch waren. Lidocain war auch nicht genotoxisch.
Sonstige HinweiseInkompatibilitäten
In der Fachliteratur und während klinischer Studien wurden keine Inkompatibilitäten der Wirkstoffe mit den meisten gängigen Arzneimitteln, die in der Kataraktchirurgie eingesetzt werden, beschrieben. Bei gebräuchlichen Viskoelastika wurde dies ausserdem durch einen pharmazeutischen Interaktionstest bestätigt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nur zur einmaligen Anwendung am Auge. Nach dem Anbrechen der Ampulle sofort verwenden.
Angabe ausschliesslich für das Kit-System (d.h. eine Blisterpackung enthält eine Ampulle, sowie eine Nadel): Kleben Sie das Abziehetikett, das auf der Blisterpackung aufgebracht ist, auf die Patientenakte.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Warnhinweis: Nicht verwenden, wenn die Blisterpackung oder die abziehbare Schutzfolie beschädigt oder eingerissen ist. Nur unter aseptischen Bedingungen öffnen. Der Blisterinhalt ist garantiert steril.
|
Bitte beachten Sie bei der Vorbereitung des Arzneimittels zur intrakameralen Injektion die folgenden Anweisungen:
| |
|
|
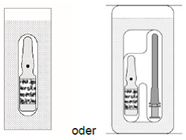
1. Die ungeöffnete Blisterpackung muss visuell auf Unversehrtheit geprüft werden. Um die Sterilität des Inhalts zu gewährleisten, Blisterpackung unter aseptischen Bedingungen durch Abziehen der Schutzfolie öffnen.
| |
|

|
2. Sterile Brechampulle mit dem Arzneimittel öffnen. Die Brechampulle (One-Point-Cut-Ampulle, OPC-Ampulle) ist wie folgt zu öffnen: Den unteren Teil der Ampulle so halten, dass der Daumen zu dem farbigen Punkt weist. Die Ampullenspitze mit der anderen Hand oben anfassen, den Daumen auf dem farbigen Punkt platzieren und mit dem Daumen gegen den farbigen Punkt drücken, sodass die Ampullenspitze am Ritz unter diesem Punkt bricht.
| |
|
|
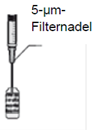
3. Die (mitgelieferte) sterile 5 µm-Filternadel auf eine sterile Spritze aufstecken. Die Schutzhülse von der sterilen 5 µm-Filternadel abziehen und mindestens 0,2 ml Injektionslösung aus der Ampulle in die Spritze aufziehen.
| |
|
|
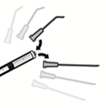
4. Nadel von der Spritze abziehen und eine geeignete Vorderkammerkanüle auf die Spritze aufsetzen.
| |
|
|
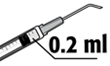
5. Luft vorsichtig aus der Spritze herausdrücken und das Volumen auf 0,2 ml einstellen. Die Spritze ist jetzt für die Injektion bereit.
6. Das 0,2 ml-Volumen in der Spritze langsam über den Seitenzugang oder den Hauptzugang mit einer einzigen Injektion in die Augenvorderkammer injizieren.
| |
Nach der Applikation verbleibende Reste der Injektionslösung müssen ordnungsgemäss entsorgt werden. Es dürfen keine Lösungsreste für weitere Anwendungen aufbewahrt werden.
|
Nur für die Präsentation als Kit (d.h. Blister mit einer Ampulle und einer Nadel): kleben Sie das Flag-Label des Blisters auf die Patientenakte.
Die Lösung muss visuell geprüft werden und darf nur verwendet werden, wenn sie klar, leicht bräunlich-gelb und praktisch frei von sichtbaren Partikeln ist.
Mydrane wird von einem Augenchirurgen unter den für die Kataraktoperation empfohlenen aseptischen Bedingungen intrakameral injiziert.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. Entsorgen Sie benutzte Nadeln in einem speziellen Abwurfbehälter.
Zulassungsnummer66151 (Swissmedic).
PackungenEine Papier/PVC-Blisterpackung mit einer sterilen 1 ml-Braunglasampulle, gefüllt mit 0,6 ml Injektionslösung. Separat werden sterile 5 µm-Filternadel(n), die in einzelnen Blistern verpackt sind, mitgeliefert.
Schachtel zu 1, 20 und 100 sterilen Ampullen mit 1, 20 bzw. 100 sterilen 5 µm-Filternadel(n). (A).
Kit aus einer Papier/PVC-Blisterpackung mit einer sterilen 1 ml-Braunglasampulle, gefüllt mit 0,6 ml Injektionslösung und einer sterilen 5 µm-Filternadel.
Schachtel mit 1, 20 und 100 Kits (d.h. Blister, die eine sterile Ampulle und eine sterile Filternadel enthalten).
ZulassungsinhaberinTHEA Pharma S.A., 8200 Schaffhausen.
Stand der InformationJuni 2022.
|





