ZusammensetzungWirkstoffe
Methoxyfluran.
Hilfsstoffe
Butylhydroxytoluol (E321) 0.01% m/m.
Indikationen/AnwendungsmöglichkeitenNotfallbehandlung mittelstarker bis starker traumabedingter Schmerzen bei erwachsenen Patienten, die bei Bewusstsein sind.
Dosierung/AnwendungPenthrox wird zur Inhalation mit dem Penthrox-Inhalator verabreicht.
Eine für die Verabreichung geschulte medizinische Fachperson sollte den Penthrox-Inhalator vorbereiten, den Patienten über die korrekte Eigenanwendung anweisen und die Anwendung überwachen.
Erwachsene
Übliche Dosierung
Es wird eine 3-ml-Flasche als Einzeldosis mit dem Penthrox-Inhalator verabreicht. Eine zweite 3-ml-Flasche kann verabreicht werden, um die Dauer der Schmerzlinderung zu verlängern, sollte jedoch nur im Bedarfsfall verwendet werden.
Es sollte die niedrigste analgetisch wirksame Dosierung von Penthrox verwendet werden, vor allem für ältere Menschen (siehe «Spezielle Dosierungsanweisungen»). Bis zu 6 ml können pro Tag verabreicht werden. Die wöchentliche Gesamtdosis sollte 15 ml nicht überschreiten. Die Verabreichung an aufeinander folgenden Tagen wird nicht empfohlen.
Die Schmerzlinderung setzt bereits nach 1 bis 10 Inhalationszügen ein. Zur Erreichung einer angemessenen Schmerzlinderung sollten die Patienten angehalten werden, mit Unterbrechungen zu inhalieren. Patienten können ihr Schmerzniveau selbst beurteilen und die Menge an inhaliertem Penthrox, die sie für eine adäquate Schmerzkontrolle benötigen, selbst anpassen. Durch kontinuierliches Inhalieren einer 3-ml-Flasche kann für einen Zeitraum von bis zu 25 bis 30 Minuten Schmerzlinderung erreicht werden.
Art der Anwendung
Anweisungen zur Vorbereitung des Penthrox-Inhalators und zur korrekten Anwendung finden Sie in «Sonstige Hinweise».
Spezielle Dosierungsanweisungen
Ältere Patienten
Bei älteren Patienten ist aufgrund einer möglichen Blutdrucksenkung oder Risikofaktoren für eine Nieren- oder Lebererkrankung Vorsicht geboten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Kinder und Jugendliche
Die Anwendung und Sicherheit bei Kindern und Jugendlichen ist bisher nicht genügend geprüft worden. Penthrox soll daher bei dieser Altersgruppe nicht angewendet werden.
Kontraindikationen·Überempfindlichkeit gegenüber dem Wirkstoff Methoxyfluran, anderen halogenierten Inhalationsanästhetika oder dem Hilfsstoff Butylhydroxytoluol,
·Verwendung als Anästhetikum,
·maligne Hyperthermie oder bekannte genetische Prädisposition für maligne Hyperthermie,
·bekannte familiäre Prädisposition für schwerwiegende unerwünschte Wirkungen nach Inhalation von halogenierten Anästhetika,
·schwere Leberinsuffizienz und Zeichen einer Leberschädigung anschliessend einer früheren Anwendung von Methoxyfluran oder halogenierten Anästhetika,
·klinisch signifikante Niereninsuffizienz,
·verändertes Bewusstsein unabhängig von der Ursache, einschliesslich Kopfverletzungen, Drogen oder Alkohol,
·klinisch relevante Kreislaufinstabilität,
·klinisch relevante Atemdepression.
Warnhinweise und VorsichtsmassnahmenNierenerkrankungen
Methoxyfluran verursacht bei hohen Dosen eine signifikante Nephrotoxizität. Es wird angenommen, dass die Nephrotoxizität mit der Wirkung von metabolisch freigesetzten anorganischen Fluoridionen auf die distalen Tubuli in Verbindung steht. Bei anweisungsgemässer Anwendung zur Analgesie führt eine Einzeldosis von 3 ml Methoxyfluran zu Fluoridionen-Serumspiegeln unter 10 µmol/l. Bei Anwendung in höheren Dosen (40–60 ml) zur Anästhesie kann es ab einem Fluoridionen-Serumspiegel von 40 µmol/l zu einer signifikanten Nephrotoxizität kommen. Die Nephrotoxizität ist ausserdem abhängig von der Rate des Metabolismus. Daher können Faktoren, die den Metabolismus beschleunigen, z. B. gleichzeitige Anwendung von Arzneimitteln, die Leberenzyme induzieren, das Risiko einer mit Methoxyfluran verbundenen Toxizität erhöhen. Ein erhöhtes Risiko besteht zudem bei Subgruppen von Patienten mit durch genetische Abweichungen bedingtem schnellerem Metabolismus (siehe «Interaktionen»).
Um eine sichere Anwendung von Penthrox zur Schmerzbehandlung zu gewährleisten, müssen folgende Vorsichtsmassnahmen beachtet werden:
·Anwendung der kleinsten wirksamen Dosis zum Erreichen der Schmerzkontrolle.
·Besondere Vorsicht bei älteren Patienten oder Patienten mit bekannten Risikofaktoren für eine Nierenerkrankung.
·Besondere Vorsicht bei Patienten mit diagnostizierten klinischen Erkrankungen, die zu einer Prädisposition für ein Nierenversagen führen können.
Lebererkrankungen
Methoxyfluran wird in der Leber metabolisiert. Eine erhöhte Exposition bei Patienten mit beeinträchtigter Leberfunktion kann daher zu Toxizität führen. Penthrox darf bei Patienten mit Hinweisen auf eine Leberschädigung nach Anwendung von Methoxyfluran oder Inhalation von halogenierten Anästhetika in der Vorgeschichte, nicht angewendet werden (siehe «Kontraindikationen»). Bei Patienten mit zugrundeliegender Lebererkrankung oder mit Risiken für eine Leberfunktionsstörung (z. B. Enzyminduktoren, siehe auch «Interaktionen») sollte Penthrox mit Vorsicht angewendet werden.
Bei vorheriger Exposition gegenüber halogenierten Anästhetika (einschliesslich Methoxyfluran) wurde von einem erhöhten Risiko einer Leberschädigung berichtet, insbesondere dann, wenn die Exposition weniger als 3 Monate zurücklag. Falls Penthrox mehr als einmal alle 3 Monate verwendet werden soll, sollte eine besonders sorgfältige klinische Beurteilung erfolgen.
Unterdrückung der Herz-Kreislauf-Funktion / Anwendung bei älteren Patienten
Mögliche Effekte auf Blutdruck und Herzfrequenz sind bekannte Klasseneffekte halogenierter Anästhetika (einschliesslich hochdosiertem, anästhetisch wirksamem Methoxyfluran). Bei den analgetischen Dosen von Methoxyfluran scheinen diese Klasseneffekte nicht relevant zu sein. Nach Anwendung von Methoxyfluran als Analgetikum sind bei keiner Altersgruppe Veränderungen des systolischen Blutdrucks in eine einheitliche Richtung bekannt geworden. Da das Risiko bei älteren Patienten mit Hypotonie und Bradykardie möglicherweise jedoch erhöht sein kann, ist bei älteren Patienten wegen eines möglichen Blutdruckabfalls Vorsicht geboten.
Wirkungen auf das zentrale Nervensystem (ZNS)
Penthrox soll nicht gleichzeitig mit sedierenden oder atemdepressiv wirkenden Arzneimitteln verabreicht werden (siehe «Interaktionen»). Potenzielle sekundäre pharmakodynamische Wirkungen auf das ZNS wie Sedierung, Euphorie, Amnesie, eingeschränkte Konzentrationsfähigkeit, veränderte sensomotorische Koordination und Stimmungsschwankungen sind bekannte Klasseneffekte von halogenierten Anästhetika. Die Selbstverabreichung von Methoxyfluran in analgetischen Dosen wird durch Wirkungen auf das ZNS wie Sedierung limitiert.
Zusätzlich können die Effekte auf das ZNS ein Risikofaktor für möglichen Missbrauch sein.
Atemdepression
Eine Atemdepression wurde auch unter analgetischen Dosierungen berichtet (siehe «Unerwünschte Wirkungen»). Die Atmung sollte wegen des Risikos einer Atemdepression und einer Hypoxie überwacht werden.
Häufige wiederholte Anwendung
Aufgrund von Einschränkungen bei der Dosierung von Penthrox (siehe «Dosierung/Anwendung») und der Dauer der Schmerzlinderung ist Penthrox nicht geeignet für die Behandlung von Durchbruchschmerzen oder Exazerbationen von chronischen Schmerzen bzw. von eng aufeinander folgenden Episoden traumabedingter Schmerzen bei demselben Patienten.
Berufsbedingte Exposition
Medizinisches Fachpersonal, das regelmässig Kontakt zu Patienten hat, die Penthrox-Inhalatoren verwenden, sollte die relevanten Arbeitsschutz- und Sicherheitsrichtlinien für den Umgang mit inhalierten Wirkstoffen kennen. Um die berufsbedingte Exposition gegenüber Methoxyfluran zu verringern, sollte der Penthrox-Inhalator nur in gut belüfteten Räumen und immer mit der Aktivkohlekammer verwendet werden, von der ausgeatmetes Methoxyfluran adsorbiert wird. Durch den wiederholten Gebrauch des Penthrox-Inhalators ohne Aktivkohlekammer-Kammer entstehen zusätzliche Risiken.
Bei exponiertem Personal in Entbindungsstationen wurde über einen Anstieg der Leberenzymwerte, Harnsäurewerte und Harnstoffwerte im Serum berichtet, als Methoxyfluran ohne Aktivkohlekammer bei gynäkologischen Patientinnen während der Wehen und der Entbindung angewendet wurde.
Es gibt Berichte von medizinischem Personal, bei welchem nach Exposition gegenüber Penthrox nicht schwerwiegende, vorübergehende unerwünschte Wirkungen wie Schwindel, Kopfschmerzen, Übelkeit oder Unbehagen sowie Überempfindlichkeitsreaktionen auf Methoxyfluran oder des im Produkt enthaltenen Hilfsstoffs aufgetreten sind. In Spitalpersonal gemessene Methoxyfluranspiegel waren signifikant niedriger als solche, die mit Nephrotoxizität in Verbindung stehen.
Pädiatrische Neurotoxizität
Präklinische Studien (inklusive an fetalen Rhesusaffen) zeigen, dass die Anwendung von Anästhetika oder Sedativa, welche wie Flurane NMDA-Rezeptoren blockieren oder die GABA-erge Übertragung potenzieren, während der Zeit des schnellen Hirnwachstums oder der Synaptogenese zu einem Zellverlust im sich entwickelnden Gehirn führt, was mit anhaltenden kognitiven Defiziten verbunden sein kann. Die klinische Bedeutung dieser Befunde ist nicht bekannt (siehe unter «Schwangerschaft/Stillzeit» und «Präklinische Daten»).
Butylhydroxytoluol
Penthrox enthält den Hilfsstoff Butylhydroxytoluol (E321), ein Antioxidans. Butylhydroxytoluol kann örtlich begrenzt Hautreizungen (z. B. Kontaktdermatitis),Reizungen der Augen und der Schleimhäute verursachen.
InteraktionenPharmakokinetische Interaktionen
Über Arzneimittelinteraktionen mit Induktoren der Leberenzyme (z. B. Barbituraten), welche die Metabolisierung von Methoxyfluran beschleunigen und in einigen wenigen Fällen zu Nephrotoxizität geführt haben, wurde bei der Anwendung von Methoxyfluran in höheren narkotischen Dosen (40-60 ml) berichtet. Aufgrund der unzureichenden Datenlage konnte nicht ermittelt werden, ob die Anwendung einer analgetischen Dosis von Methoxyfluran nach Enzyminduktion zu Leberschäden führt.
Die Metabolisierung von Methoxyfluran wird durch CYP450-Enzyme vermittelt, insbesondere durch CYP2E1, CYP2B6 und bis zu einem gewissen Grad durch CYP2A6. Enzyminduktoren (z.B. Alkohol oder Isoniazid für CYP2E1, Phenobarbital oder Rifampicin für CYP2A6 und Carbamazepin, Efavirenz, Rifampicin oder Nevirapin für CYP2B6), welche die Metabolisierungsrate von Methoxyfluran steigern, können das Risiko einer Toxizität erhöhen, weshalb die gleichzeitige Anwendung mit Methoxyfluran zu vermeiden ist.
Die gleichzeitige Anwendung von Methoxyfluran mit Medikamenten, die für ihre nephrotoxische Wirkung bekannt sind (z. B. Kontrastmittel und einige Antibiotika), sollte vermieden werden, da es zu einer additiven nephrotoxischen Wirkung kommen könnte. Zu den Antibiotika mit bekanntem nephrotoxischem Potenzial gehören Tetracyclin, Gentamicin, Colistin, Polymyxin B und Amphotericin B. Nach der Schmerzbehandlung mit Methoxyfluran sollte die Verwendung von Sevofluran als Narkosemittel vermieden werden, da Sevofluran den Fluoridserumspiegel steigert und die Nephrotoxizität von Methoxyfluran mit einem erhöhten Fluoridserumspiegel verbunden ist.
Pharmakodynamische Interaktionen
Die gleichzeitige Anwendung mit Substanzen, welche dämpfend auf das zentrale Nervensystem wirken, wie Opioide, Sedativa oder Hypnotika, Allgemeinanästhetika, Phenothiazine, Beruhigungsmittel, Muskelrelaxantien, sedierende Antihistaminika und Alkohol, kann zu einer zusätzlichen sedierenden Wirkung führen. Werden Opioide in Verbindung mit Penthrox verabreicht, muss der Patient engmaschig überwacht werden.
Bei gleichzeitiger Anwendung von Methoxyfluran in höheren narkotischen Dosen (40–60 ml) mit Arzneimitteln wie Barbituraten, die eine Abnahme des Herzzeitvolumens bewirken, wurde über eingeschränkte Nierendurchblutung und eine dadurch zu erwartende verstärkte Wirkung auf die Nieren berichtet.
Bei der Anwendung von Methoxyfluran in höheren narkotischen Dosen (40–60 ml) wurde über eine Kardiodepression berichtet, welche durch andere kardiodepressive Wirkstoffe wie β-Blocker gesteigert werden kann.
Vorsicht ist geboten bei der gleichzeitigen Anwendung von Penthrox mit Calciumantagonisten wegen des möglichen Risikos einer additiven blutdrucksenkenden Wirkung, die bei anderen inhalativen Arzneimitteln ähnlichen chemischen Typs beobachtet wurde, die bei höheren anästhetischen Dosen verwendet werden.
Schwangerschaft, StillzeitSchwangerschaft
Die aus Tierversuchen mit Methoxyfluran verfügbaren Daten sind im Hinblick auf die Reproduktionstoxizität unzureichend. Publizierte tierexperimentelle Studien mit Anästhetika/sedierenden Medikamenten berichteten von unerwünschten Wirkungen auf die Gehirnentwicklung im frühen Stadium (siehe «Präklinische Daten»).
Bei Gabe von Methoxyfluran zur Schmerzlinderung in der Geburtshilfe wurde in einem Fall von einer neonatalen Atemdepression berichtet, die mit dem hohen Methoxyfluranspiegel des Neugeborenen in Zusammenhang gebracht wurde. Bei Dosierung gemäss Dosierungsempfehlung zeigte Methoxyfluran einen geringen Effekt auf den Fötus.
Penthrox sollte nicht während der Schwangerschaft angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Es liegen keine ausreichenden Informationen zum Übergang von Methoxyfluran in die Muttermilch vor. Soll einer stillenden Mutter Methoxyfluran verabreicht werden, ist daher besondere Vorsicht geboten.
Fertilität
Es liegen keine klinischen Daten zur Wirkung von Methoxyfluran auf die Fertilität vor. Begrenzte Daten aus Tierstudien liefern keine Hinweise auf Wirkungen auf die Morphologie der Spermien (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenPenthrox hat einen ausgeprägten Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Nach Gabe von Methoxyfluran können Schwindel, Schläfrigkeit und Benommenheit auftreten (siehe «Unerwünschte Wirkungen»). Patienten sollten darauf hingewiesen werden, dass sie bei Schwindel oder Benommenheit weder ein Fahrzeug lenken noch Maschinen bedienen dürfen.
Eine 15-minütige Inhalation von Methoxyfluran führt zu einer akuten, aber kurze Zeit andauernden Beeinträchtigung der psychomotorischen und kognitiven Fähigkeiten, die innerhalb von 30 Minuten nach Beendigung der Inhalation reversibel ist.
Unerwünschte WirkungenEine ernsthafte dosisbedingte Nephrotoxizität wurde mit Methoxyfluran assoziiert, wenn Methoxyfluran in hohen Dosen über längere Zeiträume zur Anästhesie verwendet wurde. Methoxyfluran wird daher nicht mehr für die Anästhesie verwendet (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die empfohlene Höchstdosis für Penthrox soll daher nicht überschritten werden.
Die Häufigkeiten werden wie folgt definiert: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), und «gelegentlich» (≥1/1000, <1/100).
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: gesteigerter Appetit.
Psychiatrische Erkrankungen
Häufig: Euphorische Stimmung.
Gelegentlich: Angst, Depression, Aufmerksamkeitsstörung, unangemessener Affekt, Verbigeration.
Erkrankungen des Nervensystems
Sehr häufig: Schwindel.
Häufig: Kopfschmerzen, Somnolenz, Geschmacksstörungen.
Gelegentlich: Amnesie, Dysarthrie, Parästhesie, periphere sensorische Neuropathie.
Augenerkrankungen
Gelegentlich: Sehbeeinträchtigung.
Gefässerkrankungen
Gelegentlich: Hitzegefühl, Hypotonie, Hypertonie.
Erkrankungen der Atemwege, des Brustraums und des Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit.
Gelegentlich: Mundtrockenheit, orale Beschwerden, oraler Pruritus, Hypersalivation, Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Hyperhidrose.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Trunkenheitsgefühl
Gelegentlich: Müdigkeit, Krankheitsgefühl, Schüttelfrost, Gefühl der Entspannung.
Weitere einzelne Vorfälle im Zusammenhang mit der Anwendung von Methoxyfluran für die Analgesie (zusätzlich zu den oben aufgelisteten unerwünschten Wirkungen aus klinischen Studien) sowie Berichte aus der Literatur:
Psychiatrische Erkrankungen
Stimmungslabilität, Agitation, Verwirrtheitszustand, Dissoziation, Unruhe.
Erkrankungen des Nervensystems
Veränderter Bewusstseinszustand, Nystagmus.
Erkrankungen der Atemwege, des Brustraums und des Mediastinums
Erstickungsanfall, Hypoxie, Atemdepression.
Erkrankungen des Immunsystems
Hypersensibilität
Leber- und Gallenerkrankungen
Erhöhte Leberenzymwerte, Hepatitis, Ikterus, Leberschädigung, Leberversagen.
Erkrankungen der Nieren und Harnwege
Erhöhte Harnsäurewerte, Harnstoffwerte und Kreatininwerte im Serum, Nierenversagen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Bei hoher Dosierung ist Methoxyfluran ein Anästhetikum, bei analgetischer(niedriger) Dosierung sollten jedoch keine Anästhesieeffekte auftreten. Patienten sollten nach Gabe von Methoxyfluran auf Anzeichen wie extremer Müdigkeit, einschliesslich Bewusstlosigkeit, Schwindel, Blässe und Muskelrelaxation beobachtet werden. Nach Abbruch der Penthrox Gabe gehen solche Überdosis-effekte normalerweise schnell vorbei, wobei meist keine weitere Intervention notwendig ist.
Die kardio- und atemdepressiven Wirkungen sind bekannte Klasseneffekte von zur Anästhesie verwendetem hochdosiertem Methoxyfluran und anderer Anästhetika. Bei analgetischen Dosen scheinen diese Klasseneffekte nicht relevant zu sein (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Hohe Methoxyfluran-Dosierungen verursachen eine dosisabhängige Nephrotoxizität. Mehrere Stunden oder Tage nach wiederholter Verabreichung hoher analgetischer oder anästhetischer Dosen von Methoxyfluran kam es zu polyurischem oder oligurischem Nierenversagen
Behandlung
Patienten sollten ihr Analgesie-Niveau kontrollieren und das Einatmen durch den Penthrox-Inhalator unterbrechen, wenn sie sich schläfrig fühlen. Im Falle eines übermässigen Urinausstosses nach Überdosierung sollten Flüssigkeits- und Elektrolytverluste überwacht und umgehend ersetzt werden.
Eigenschaften/WirkungenATC-Code
N02BG09
Wirkungsmechanismus
Der Mechanismus, über den Methoxyfluran seine analgetische Wirkung entfaltet, ist nicht vollständig aufgeklärt. Zu den potenziellen Faktoren, die zur schmerzstillenden Wirkung von Methoxyfluran beitragen, gehören die Effekte auf Substanz P und β-Endorphin im Gehirn.
Pharmakodynamik
Methoxyfluran gehört zur Gruppe der fluorierten Kohlenwasserstoffe (Flurane). Methoxyfluran-Dampf sorgt für Schmerzlinderung, wenn er in niedrigen Dosierungen von Patienten, die bei Bewusstsein sind, inhaliert wird.
Bei Verabreichung in analgetischen Dosen zur Schmerzlinderung kann Schwindel und Benommenheit auftreten und der Blutdruck kann geringfügig sinken, was von Bradykardie begleitet sein kann. Der Herzrhythmus ist meist regelmässig, der Herzmuskel wird durch Methoxyfluran nur minimal für Adrenalin sensibilisiert.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Penthrox wurden in einer randomisierten, doppelblinden, multizentrischen, Placebo-kontrollierten Studie zur Behandlung von akuten Schmerzen bei Patienten über 12 Jahren mit leichten Traumata (physische Wunden oder Verletzungen wie Knochenbrüche, Schnittwunden, Verbrennungen, Verrenkungen, Quetschungen oder Verletzungen durch Fremdkörper) nachgewiesen, die sich in der Notaufnahme vorstellten. Primärer Endpunkt war die Schmerzreduktion auf einer 100 mm Visual Analog Scale (VAS) zwischen 5 und 20 Minuten im Vergleich mit Placebo. Die basalen Schmerzwerte betrugen im Mittel 64,8 mm, bzw. 64,0 mm.
Die Verabreichung von Methoxyfluran (n = 149) mit dem Penthrox-Inhalator führte zu einer höheren Reduktion der Schmerzintensitätswerte im Vergleich zur Placebo-Gruppe (n = 149) (geschätzter Behandlungseffekt –15,1 mm; P <0,0001). Zwei Patienten (1,3%) in der Methoxyfluran-Gruppe im Vergleich zu 25 Patienten (16,8%) in der Placebo-Gruppe (P = 0,0002) verlangten die Anwendung von Notfallmedikation innerhalb von 20 Minuten nach dem Beginn der Behandlung. Insgesamt 126 Patienten (84,6%) in der Methoxyfluran-Gruppe im Vergleich zu 76 Patienten (51%) in der Placebo-Gruppe berichteten nach 1 bis 10 Inhalationszügen über eine Schmerzlinderung. Veränderungen der Vitalfunktionen (Herzfrequenz, Puls, Atemfrequenz, Blutdruck, Bewusstseinsgrad und Temperatur) waren in beiden Gruppen vergleichbar. Unerwünschte Ereignisse in Bezug auf die Laborwerte der Biochemie und Hämatologie, die während der Behandlung in der Methoxyfluran-Gruppe auftraten, standen nicht in einem kausalen Zusammenhang mit der Studienmedikation.
In einer weiteren randomisierten, doppelblinden, Placebo-kontrollierten Studie wurden Erwachsenen, die eine Analgesie aufgrund einer geplanten Knochenmarkbiopsie unter Lokalanästhesie benötigten, Methoxyfluran mit dem Penthrox-Inhalator bzw. Placebo (maximale Dosis je 3 ml) gegeben. Die Schmerzintensität wurde mit Hilfe einer 11-Punkte-Skala basierend auf der Bewertung durch die Patienten während der Inhalation, während der Durchführung der Biopsie und am Ende der Biopsie bestimmt. Die Patienten in der Methoxyfluran-Gruppe (n = 49) hatten im Mittel (SD) mit 4,9±2,1 Punkte eine niedrigere maximale Schmerzintensität im Vergleich zur Placebo-Gruppe (n = 48) mit 6,0±2,2 Punkte (p=0,011). Die Gesamtmenge an Fluorid (anorganisches und organisches Fluorid) war signifikant höher in der Methoxyfluran-Gruppe im Vergleich zur Placebo-Gruppe (P < 0,001), wobei die Fluorid-Höchstwerte nicht über 10 μmol/l lagen. Für alle anderen Vitalfunktionen (Herzfrequenz, Atemfrequenz, Blutdruck und Temperatur) sowie für die Laborwerte der Biochemie und Hämatologie ergaben sich keine statistisch signifikanten Unterschiede.
PharmakokinetikAbsorption
Bei Gebrauch des Penthrox-Inhalators ist die inhalierte Konzentration von Methoxyfluran ungefähr 0,1-0,2% bei offener Verdünnungsöffnung und 0,2-0,4% bei geschlossener Verdünnungsöffnung.
Methoxyfluran dringt als Dampf in die Lungen ein und wird von dort aus schnell ins Blut transportiert, was ein schnelles Einsetzen der schmerzstillenden Wirkung ermöglicht. In einer pharmakokinetischen (PK) Studie mit gesunden Probanden zeigte die mittlere Plasmakonzentration-Zeitkurve einen extrem schnellen Anstieg der Plasmakonzentration von Methoxyfluran. Nach einer Einzeldosis von 3 ml Methoxyfluran, intermittierend über den Zeitraum einer Stunde inhaliert wurde, zeigte sich ein arterielles Profil mit einem medianen tmax bei 0,25 Stunden (Bereich 0,08 – 0,75 Stunden), einem Mittelwert des Cmax von 32,39 ug/mL (SD 13,546 ug/mL, CV 41,8%) und einem Mittelwert der AUC von 30,54 h.ug/mL (SD 12,76 ug/mL, CV 41,8%). Das venöse Profil umfasste einen medianen tmax von 0,21 Stunden (Bereich 0,08 - 0,75 Stunden), einen Mittelwert des Cmax von 21,86 ug/mL (SD 8,62 ug/mL, CV 39,4%) und einem Mittelwert der AUC von 29,30 h.ug/mL (SD 13,39 ug/mL, CV 45,7%).
Distribution
Methoxyfluran besitzt einen hohen Öl-Gas-Koeffizienten, d. h. Methoxyfluran ist äusserst lipophil. Methoxyfluran hat eine starke Neigung, sich im Fettgewebe anzureichern, und wird aus diesem Reservoir über Tage langsam abgegeben.
Metabolismus
Methoxyfluran wird in der Leber über das Cytochrom-P450-Enzymsystem, vor allem über CYP2E1, CYP2B6 und CYP2A6, durch Abspaltung von Chlor oder O-Demethylierung zu freiem Fluorid, Oxalsäure, Difluormethoxyessigsäure und Dichloressigsäure metabolisiert. In Konzentrationen, die höher sind als die, welche nach Inhalation von analgetischen Einzeldosen von Methoxyfluran erreicht werden, können sowohl freies Fluorid als auch Oxalsäure Nierenschäden verursachen. Methoxyfluran weist im Vergleich zu anderen halogenierten Methylethylethern einen höheren Metabolisierungsgrad auf und neigt stärker dazu, sich im Fettgewebe anzureichern. Methoxyfluran wird daher langsam aus dem im Fettgewebe gebildeten Reservoir freigesetzt und steht über mehrere Tage zur Biotransformation zur Verfügung.
Elimination
In der PK-Studie an gesunden Probanden, die 3 ml Methoxyfluoran über eine Stunde inhalierten, kam es zu einem frühen Peak in den Mittelwerten der arteriellen und venösen Plasmakonzentrations-Zeit-Kurven von Methoxyflouran, gefolgt von einer schnellen Eliminierung aus dem Plasma, wobei die venösen Methoxyfluran-Konzentrationen 24 Stunden nach der Verabreichung wieder den Ausgangswert erreichten. Die arteriellen und venösen Konzentrationen des Metaboliten, des anorganischen Fluorids, stiegen weniger schnell an als Methoxyfluran (Median des tmax bei 1,5 Stunden) und wurden allmählich aus dem Plasma eliminiert, wobei 48 Stunden nach Methoxyfluran-Verabreichung signifikante Konzentrationen im venösen Plasma gemessen wurden. Nach einer Einzeldosis von 3 ml Methoxyfluran, die intermittierend über eine Stunde inhaliert wurde, betrug die arteriellen und venösen mediane Halbwertszeit für Methoxyfluran 4,71 Stunden (Bereich von 2,68-8,90 Stunden) bzw. 3,16 Stunden (Bereich von 1,06-7,89 Stunden). Die arteriellen und venösen Halbwertszeit für anorganisches Fluorid betrug 13,39 Stunden (Bereich von 13,39-13,39 Stunden) bzw. 33,30 Stunden (Bereich von 23,50-51,20 Stunden). Die PK-Profile für Methoxyfluran und anorganisches Fluorid wiesen eine hohe Variabilität zwischen den Probanden auf.
Ungefähr 60% des aufgenommenen Methoxyflurans wird in Form von organischem Fluor, Fluorid und Oxalsäure über den Urin ausgeschieden. Der Rest wird unverändert (19-35%) oder als Kohlenstoffdioxid ausgeatmet.
Die Aktivkohlekammer kann die Konzentration von ausgeatmetem Methoxyfluran nach Anwendung von 1-2 Flaschen Penthrox auf nahezu Null reduzieren, was die passive Exposition gegenüber dem Arzneimittel reduziert.
Kinetik spezieller Patientengruppen
Im Vergleich zu nicht-adipösen Patienten werden bei adipösen Patienten ebenso wie bei älteren Patienten höhere Fluoridspiegel im Blut zu einem früheren Zeitpunkt erreicht.
Präklinische DatenToxizität bei Einzelgabe und wiederholter Verabreichung
Die Verabreichung von hochdosiertem, anästhetisch wirksamem Methoxyfluran an Ratten war mit renalen tubulären Nekrosen und mitochondrialen Schwellungen assoziiert. Wiederholte intermittierende oder kontinuierliche Gabe von subanästhetischen Methoxyfluran-Dosen (365 mg/kg bei Ratten, 310 mg/kg bei Meerschweinchen und 237 mg/kg bei Kaninchen) während 7 h/Tag, 5 Tage/Woche und eine Gesamtdauer von 7 Wochen führten bei Ratten, Meerschweinchen oder Kaninchen nicht zu renalen Effekten. Begrenzte und meist reversible hepatische Veränderungen wurden bei mehreren Spezies auch bei tieferen Dosen beobachtet (Fettmetamorphose, erhöhte ALAT-/ASAT-Werte).
In einer 14-Tage-Studie in Ratten mit 6-stündiger kontinuierlicher Inhalation von Methoxyfluran bis zu 792 mg/kg/Tag wurden in der Niere minimale Vakuolisierung der kortikalen Tubuli und in der Leber eine minimale/leichte zentrilobuläre Vakuolisierung beobachtet.
In einer 14-Tage-Studien in Hunden mit 90-minütiger kontinuierlicher Inhalation von Methoxyfluran bis zu 407 mg/kg wurden keine auffälligen Nierenbefunde festgestellt; in der Leber fand sich eine minimale/leichte zentrilobuläre Glykogenakkumulation. In der Hochdosisgruppe gab es ausserdem mikroskopische Veränderungen in Thymus (Atrophie) und Knochenmark (reduzierte Hämatopoese).
In den oben genannten Ratten- und Hundestudien wurden NOAEL-Werte (höchste Dosis, bei der keine toxischen Befunde beobachtet werden) von 396 mg/kg und 153 mg/kg berichtet. Die NOAELs bei Ratten und Hunden entsprechen einen 0.3-fachen Sicherheitsabstand basierend auf AUC-Daten im Vergleich zur vorgeschlagenen maximalen klinischen Dosis von 6 ml/Tag. Diese Auswirkungen auf die Nieren und die Leber wurden jedoch bei wiederholter Verabreichung über 14 Tage beobachtet, so dass die Gesamtexposition die bei normaler klinischer Anwendung des Produkts zu erwartenden Werte übersteigt.
Mutagenität
Im Ames-Test und im in vivo Mikrokern-Test ergaben sich für Methoxyfluran keine Hinweise auf Genotoxizität.
Karzinogenität
Es wurden keine Langzeituntersuchungen zur kanzerogenen Wirkung von Methoxyfluran in Mäusen und/oder Ratten durchgeführt. Zwei Kurzzeitstudien an Mäusen zeigten keine kanzerogenen Eigenschaften von Methoxyfluran.
Reproduktions- und Entwicklungstoxizität
Methoxyfluran hat bei Mäusen keinen Einfluss auf die Spermienzellen. In Studien an Mäusen und Ratten passierte Methoxyfluran die Plazentaschranke, es wurden aber keine Anzeichen für embryotoxische oder teratogene Eigenschaften gefunden. Nach wiederholter Gabe über 9 Tage wurde jedoch eine verzögerte Fötalentwicklung beobachtet (verringertes Körpergewicht des Fötus und verringerte Ossifikation). Der NOAEL (höchste Dosis, bei der keine toxischen Befunde beobachtet werden) für die embryo-fötale Entwicklung liegt bei 0,006% (104 mg/kg, 4 Stunden/Tag) bei Mäusen und nahe 0.01% (245 mg/kg, 8 Stunden/Tag) bei Ratten.
Da Penthrox nicht zur täglichen Anwendung bestimmt ist, wird das Risiko einer verzögerten Fötalentwicklung als gering angesehen.
Veröffentlichte Studien bei Tieren (einschliesslich Primaten) in Dosen, die eine leichte bis mässige Betäubung bewirkten, zeigten, dass die Anwendung von Narkosemitteln während der Zeit des schnellen Hirnwachstums oder der Synaptogenese zu einem Zellverlust im sich entwickelnden Gehirn führt, was mit anhaltenden kognitiven Defiziten verbunden sein kann. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Nach Vorbereitung des Penthrox-Inhalators unverzüglich anwenden. Zum einmaligen Gebrauch für einen einzelnen Patienten.
Hinweise für die Handhabung
1.Es ist sicherzustellen, dass die Aktivkohlekammer in die Verdünnungsöffnung oben am Penthrox-Inhalator eingesetzt ist.

2.Die Verschlusskappe der Flasche von Hand entfernen.
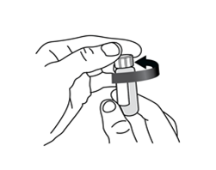
Alternativ kann die Verschlusskappe mit dem Unterteil des Penthrox-Inhalators durch eine halbe Umdrehung gelöst werden. Den Inhalator von der Flasche trennen und den Verschluss der Flasche von Hand entfernen.
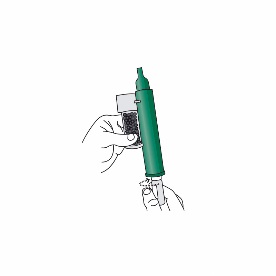
3.Den Penthrox-Inhalator mit dem Mundstück nach unten im 45°-Winkel halten und den gesamten Inhalt einer Penthrox-Flasche in das Unterteil des Inhalators giessen, während dieser gedreht wird.

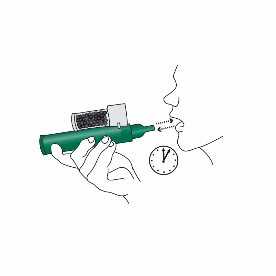
4.Die Handgelenkschlaufe um das Handgelenk des Patienten legen. Der Patient inhaliert über das Mundstück des Penthrox-Inhalators, bis die Schmerzlinderung eintritt. Die ersten Atemzüge erfolgen langsam, danach ist normal durch den Inhalator zu atmen.
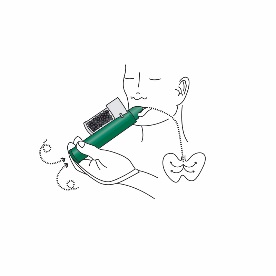
5.Der Patient muss durch den Penthrox-Inhalator ausatmen. Der ausgeatmete Dampf wird durch die Aktivkohlekammer geleitet, wo das ausgeatmete Methoxyfluran adsorbiert wird, damit die umgebenden Personen Methoxyfluran nicht ausgesetzt werden.
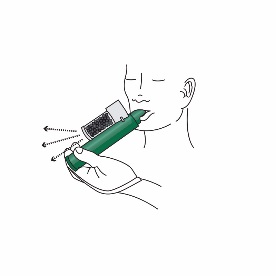
6.Für eine stärkere Schmerzlinderung kann der Patient beim Inhalieren mit dem Finger die Verdünnungsöffnung an der Aktivkohlekammer verschliessen.
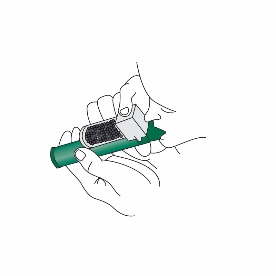
7.Zur Erreichung einer angemessenen Schmerzlinderung sollte der Patient angehalten werden, mit Unterbrechungen zu inhalieren. Bei kontinuierlicher Inhalation reduziert sich die Anwendungsdauer. Die niedrigste Dosis, die zur Schmerzlinderung benötigt wird, soll verabreicht werden.
Ist nach dem Aufbrauchen des Methoxyflurans der ersten Flasche weitere Schmerzlinderung erforderlich, kann eine zweite 3-ml-Flasche mit demselben Inhalator beim Wiederholen des obigen Vorgehens ab Schritt 2 verwendet werden. Es besteht keine Notwendigkeit, die Aktivkohle-Kammer zu ersetzen. Alternativ kann ein zweiter vorbereiteter Inhalator von einer neuen Kombinationspackung genommen werden, in dem das obigen Vorgehen ab Schritt 1 durchgeführt wird.
8.Die Penthrox-Flasche nach dem Laden des Penthrox-Inhalators wieder mit der Verschlusskappe verschliessen.
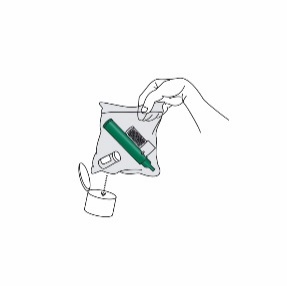
Den benutzten Penthrox-Inhalator und die verwendete Flasche in den beigefügten Plastikbeutel geben, diesen verschliessen und sachgerecht entsorgen.
Zulassungsnummer66533 (Swissmedic)
PackungenKombinationspackung mit einer 3-ml-Flasche, einem Penthrox-Inhalator und einer Aktivkohlekammer (1er- oder 10er-Packungen) [B]
3-ml-Flasche (10er-Packung) [B]
ZulassungsinhaberinFuture Health Pharma GmbH, 8620 Wetzikon
Stand der InformationOktober 2023
|









