Eigenschaften/WirkungenATC-Code
V10XX04
Physikalische Eigenschaften
Lutathera/Lutathera CA mit Lutetium (177Lu) zerfällt mit einer Halbwertszeit von 6.647 Tagen zu stabilem Hafnium (177Hf) und emittiert hauptsächlich β—Strahlung —mit einer maximalen Energie von 0.498 MeV. Die durchschnittliche β-Energie beträgt 0.13 MeV. Es wird auch Photonen-Strahlung (γ) von 0.113 MeV (6.2 %) und 0.208 MeV (11 %) emittiert.
Lutathera CA wird unter Verwendung von 176Lu hergestellt, das eine kleine Menge des metastabilen Lutetium-Kernisomers (177mLu) enthält. Das Isomer 177mLu hat eine Halbwertszeit von 160.44 Tagen. Das Isomer 177mLu zerfällt teilweise (22.8 %) durch isomeren Übergang unter Emission von Gammastrahlung und Konversionselektronen zum Grundzustand von Lu-177, und teilweise (77.2 %) durch Abgabe von Betastrahlung (40.8 keV) zu metastabilem Hafnium-177 (177mHf), das durch mehrfache Gammaemission und Konversionselektronen sofort zu stabilem 177Hf zerfällt. Bezüglich allen aus der Verwendung von Lutetium (177Lu)-Oxodotreotid entstehenden radioaktiven Abfällen muss für eine sachgerechte Entsorgung das Vorhandensein und die Menge dieses speziellen Isomers beachtet werden.
Wirkungsmechanismus
Lutetium (177Lu)-Oxodotreotid hat eine hohe Affinität zu Somatostatin-Subtyp-2-Rezeptoren (sst2). Es bindet spezifisch an maligne Zellen, die sst2-Rezeptoren überexprimieren.
Lutetium-177 ist ein β-minus emittierendes Radionuklid mit einem maximalen Penetrationsbereich im Gewebe von etwa 2.2 mm (mittlerer Penetrationsbereich von 0.67 mm), das den Tod der anvisierten Tumorzellen herbeiführt bei gleichzeitig begrenzter Wirkung auf benachbarte normale Zellen.
Pharmakodynamik
Bei der verwendeten Konzentration (insgesamt ca. 10 µg/ml, sowohl für die freie als auch die radiomarkierte Form), übt das Peptid Oxodotreotid keine klinisch relevante pharmakodynamische Wirkung aus.
Klinische Wirksamkeit
NETTER-1-Studie
Die NETTER-1-Studie der Phase III war eine randomisierte, multizentrische, offene aktiv-kontrollierte Vergleichsstudie, in der die Behandlung mit Lutathera CA (4 Dosen mit jeweils 7'400 MBq, eine Dosis alle 8 Wochen [±1 Woche]) bei gleichzeitiger Verabreichung einer Aminosäurenlösung und bestmöglicher unterstützender Behandlung (Octreotid mit verlängerter Wirkstoffabgabe [LAR] 30 mg nach jeder Lutathera CA-Dosis und alle 4 Wochen nach Abschluss der Behandlung mit Lutathera CA zur Symptomkontrolle, ersetzt durch Octreotid mit verkürzter Wirkstoffabgabe in den 4 bis 6 Wochen vor der Verabreichung von Lutathera CA) mit hochdosiertem Octreotid mit LAR (60 mg alle 4 Wochen) bei Patienten mit inoperablen, progressiven, Somatostatinrezeptor-positiven karzinoiden Tumoren des Mitteldarms verglichen wurde. Der primäre Endpunkt der Studie war das progressionsfreie Überleben (PFS), beurteilt anhand der RECIST-Kriterien (RECIST V.1.1) und basierend auf einer verblindeten unabhängigen radiologischen Beurteilung. Sekundäre Wirksamkeitsendpunkte schlossen die objektive Ansprechrate (ORR), das Gesamtüberleben (OS), die Zeit bis zur Tumorprogression (TTP), die Sicherheit und Verträglichkeit des Arzneimittels sowie die gesundheitsbezogene Lebensqualität (HRQoL) mit ein.
Zum Zeitpunkt der Primäranalyse waren 229 Patienten randomisiert und erhielten entweder Lutathera CA (n = 116) oder eine hohe Dosis von 60 mg Octreotid LAR (n = 113). Die Randomisierung erfolgte stratifiziert nach dem Score der Octreoscan®-Szintigraphie (Grad 2, 3 und 4) und der längsten Dauer der vom Patienten zuletzt vor der Randomisierung erhaltenen konstanten Octreotid-Dosis (d.h. ≤6 oder > 6 Monate). Demografische Kriterien sowie Patienten- und Krankheitscharakteristika waren zwischen den beiden Studienarmen ausgeglichen, mit einem medianen Alter von 64 Jahren und einem Anteil von 82.1 % Patienten weisser Hautfarbe in der allgemeinen Population.
Die Ergebnisse der endgültigen Per-Protokoll-Analyse (Stichtag 24. Juli 2015) sind in Tabelle 7 dargestellt.
Tabelle 7 Beobachtetes PFS in der Phase-III-Studie NETTER 1 bei Patienten mit progressiven karzinoiden Mitteldarmtumoren – (volles Analyseset [FAS], n = 229)
|
|
Behandlung
| |
|
Lutathera CA und Octreotid LAR
|
Hochdosiertes Octreotid LAR
| |
N
|
116
|
113
| |
Patienten mit Ereignissen
|
21
|
70
| |
Ausgeschlossene Patienten
|
95
|
43
| |
Median Monate (95 %-CI)
|
Nicht erreicht
|
8.5 (5.8; 9.1)
| |
p-Wert des Log-Rank-Tests
|
< 0.0001
| |
Hazard ratio (95 %-CI)
|
0.177 (0.108; 0.289)
|
N: Anzahl Patienten, CI: Konfidenzintervall LAR = verlängerte Wirkstoffabgabe.
Die Kaplan-Meier-Grafik des PFS für das volle Analyseset (FAS) ist in Abbildung 3 dargestellt.
Abbildung 3 Kaplan-Meier-Kurven des PFS für Patienten mit progressiven karzinoiden Mitteldarmtumoren – (NETTER-1- Studie der Phase III; FAS, n = 229)
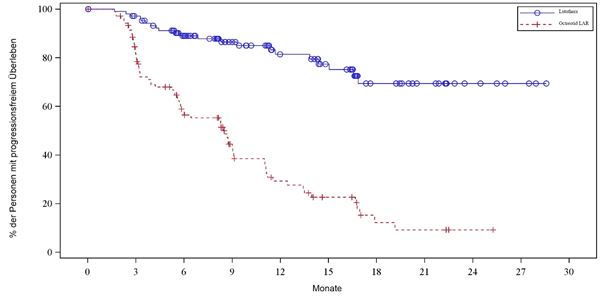
Die OS Ergebnisse der Zwischenanalyse (Stichtag 24. Juli 2015) und der endgültigen Analyse (Stichtag 18. Januar 2021) sind in Tabelle 8 dargestellt.
Zum Zeitpunkt der endgültigen OS-Analyse, die 5 Jahre nach der Randomisierung des letzten Patienten stattfand (N=231, Stichtag 24. Juli 2015) betrug die mediane Nachbeobachtungszeit in jedem Studienarm 76 Monate. Die endgültigen OS-Ergebnisse erreichten keine statistische Signifikanz.
Im hochdosierten Octreotid-LAR-Arm erhielten 22.8 % der Patienten innerhalb von 24 Monaten nach der Randomisierung eine anschliessende Radioliganden-Therapie (einschliesslich Lutetium (177Lu)-Oxodotreotid) und 36 % der Patienten bis zum endgültigen OS-Stichtag, was zusammen mit anderen Faktoren das OS in dieser Untergruppe von Patienten beeinflusst haben könnte.
Tabelle 8 Ergebnisse der NETTER-1-Phase-III-Studie zum Gesamtüberleben von Patienten mit progressiven karzinoiden Mitteldarmtumoren (FAS)
|
|
LUTATHERA CA und Octreotid LAR
|
Hochdosiertes Octreotid LAR
| |
Zwischenanalyse des Gesamtüberlebens (24. Juli 2015) - N=229*
| |
Todesfälle (%)
|
17 (14.7 %)
|
31 (27.4 %)
| |
Median in Monaten (95 % CI)
|
NR (NE, NE)
|
27.4 (20.1, NE)
| |
Hazard Ratioa,b (99,9915 % CI)
|
0.46 (0.14, 1.51)
| |
Endgültige Analyse des Gesamtüberlebens (18. Januar 2021) - N=231**
| |
Todesfälle (%)
|
73 (62.4 %)
|
69 (60.5 %)
| |
Median in Monaten (95 % CI)
|
48.0 (37.4, 55.2)
|
36.3 (25.9, 51.7)
| |
Hazard Ratioa,b,c (95 % CI)
|
0.84 (0.60, 1.17)
| |
Endgültige Analyse des Gesamtüberlebens nach eingeschränkter mittlerer Überlebenszeit (RMST = Restricted Mean Survival Time) nach 60 Monaten (18. Januar 2021) – N=231**)
| |
Todesfälle (%)
|
65 (55.6)
|
63 (55.3)
| |
RMST (95% CI)
|
41.2 (37.6, 44.9)
|
36.1 (31.9, 40.4)
| |
Differenz (95% CI)
|
5.1 (-0.5, 10.7)
| |
a: Hazard Ratio basierend auf einem nicht-stratifizierten Cox-Modell
b: Nach den vorgegebenen Signifikanzkriterien statistisch nicht signifikant
c: HR auf der Grundlage nichtproportionaler Hazards
*: Die Analyse wurde bei 116 Patienten in der Lutathera CA-Gruppe und 113 Patienten in der Gruppe mit hochdosiertem Octreotid LAR durchgeführt (N=229).
**: Die Analyse wurde bei 117 Patienten in der Lutathera CA-Gruppe und 114 Patienten in der Gruppe mit hochdosiertem Octreotid LAR durchgeführt (N=231).
NR=Nicht erreicht
NE=Nicht schätzbar
|
Das OS-Kaplan-Meier-Diagramm für den vollständigen Analysesatz (FAS) zum Stichtag 18. Januar 2021 ist in Abbildung 4 dargestellt.
Abbildung 4 OS-Kaplan-Meier-Kurven für Patienten mit progressiven karzinoiden Mitteldarmtumoren - Stichtag 18. Januar 2021 (NETTER-1-Studie der Phase III; FAS, N=231)
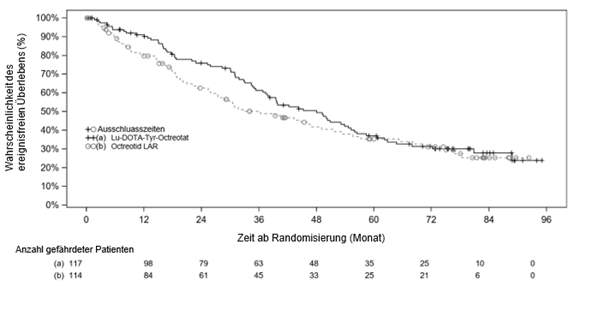
Bei Vorliegen nichtproportionaler Hazards wurde zum Zeitpunkt der endgültigen OS-Analyse eine zusätzliche Sensitivitätsanalyse (Restricted Mean Survival Time) durchgeführt, um den Behandlungseffekt weiter abzuschätzen (siehe Tabelle 8).
Die gesundheitsbezogene Lebensqualität (Health Related Quality of Life, HRQoL) wurde unter Verwendung des Fragebogens zur Lebensqualität der Europäische Organisation zur Erforschung und Behandlung von Krebs (EORTC QLQ-C30) (allgemeines Instrument) und seinem Modul für neuroendokrine Tumoren (EORTC QLQ-GI.NET-21) beurteilt.
Die Ergebnisse weisen für Patienten im Lutathera CA-Behandlungsarm im Vergleich zum Behandlungsarm mit hochdosiertem Octreotid LAR auf eine Verbesserung der allgemeinen gesundheitsbezogenen Lebensqualität bis Woche 84 hin.
Somatostatinrezeptor-exprimierende gastroenteropankreatische neuroendokrine Tumoren (GEP-NET)
Die Wirksamkeit von Lutathera CA bei Patienten mit Somatostatinrezeptor-exprimierenden gastroenteropankreatischen (GEP) und bronchialen neuroendokrinen Tumoren (NETs), wurde in der klinischen, monozentrischen, nicht vergleichenden, offenen Erasmus-Studie untersucht. Das Behandlungsprotokoll für Lutathera CA bestand hier aus vier intravenösen Verabreichungen von jeweils 7'400 MBq zusammen mit einer Aminosäurenlösung bestand. Lutathera CA wurde zunächst im Rahmen eines in einem einzigen Zentrum in den Niederlanden durchgeführten Härtefallprogramms («Compassionate Use Program») gemäss einem allgemeinen Peptidrezeptor-Radionuklidtherapie-Protokoll verabreicht. Acht Jahre nach dem Beginn dieses Programms wurde dann ein konkret auf Lutathera CA bezogenes Protokoll erstellt, das eine retrospektive Datenerfassung ermöglichte, auch wenn die Gesamtzahl der Patienten und die geprüfte Hypothese nicht genau beschrieben sind. Insgesamt wurden 360 Patienten langfristig nachbeobachtet, die zu Beginn der Behandlung einen gastroenteropankreatischen und bronchialen neuroendokrinen Tumor aufwiesen (ein Tumor des Mitteldarms 183, Pankreas 133, Bronchien 19, Hinterdarm 13, Vorderdarm ohne Bronchien und Pankreas 12). Das mittlere Alter betrug 60 Jahre, 51 % waren Männer, 99.4 % wiesen beim Octreoscan einen Anreicherungsscore von ≥2 (5.6 % (2)/62.8 % (3)/31.1 % (4)) auf, 71.4 % hatten einen Karnofsky-Index ≥90 und 52 % eine Begleitmedikation mit Somatostatin-Analoga. Die durch den Prüfarzt bestimmte objektive Ansprechrate als Hauptkriterium der Wirksamkeit betrug 45 % (95 % CI: 40, 50). Der Median der Ansprechdauer lag bei 16.3 Monaten (95 % CI: 12.2, 17.8). Die höchste objektive Ansprechrate wurde bei Patienten mit neuroendokrinen Pankreastumoren festgestellt (61 %, 95 % CI: 52, 69), die geringste Ansprechrate bei neuroendokrinen Tumoren des Mitteldarms (33 %, 95 % CI: 27, 41).
|


