Dosierung/AnwendungDas Arzneimittel ist ausschliesslich zur Verwendung im in Krankenhäusern bestimmt und darf nur von fachärztlichen Personen mit eidgenössischem Weiterbildungstitel in Nuklearmedizin verabreicht werden.
Aufgrund der verabreichten Menge an Radioaktivität muss sich der Patient nach der Behandlung in einem Isolierzimmer aufhalten. Die Vorsichtsmassnahmen zum Strahlenschutz müssen eingehalten werden. Siehe die Rubriken «Warnhinweise und Vorsichtsmassnahmen» sowie «Sonstige Hinweise: Hinweise für die Handhabung/Strahlenschutz».
Bevor eine Behandlung mit Lutathera/Lutathera CA begonnen wird, muss mit Somatostatinrezeptor-Bildgebung (Szintigraphie oder Positronen-Emissions-Tomographie [PET]) die Überexpression dieser Rezeptoren im Tumorgewebe bestätigt werden, wobei die Aufnahme durch Tumorherde mindestens so hoch wie die normale Aufnahme durch die Leber sein muss.
Übliche Dosierung
Erwachsene
In der Regel besteht das empfohlene Behandlungsprotokoll beim Erwachsenen aus 4 Infusionen zu jeweils 7'400 MBq. Zwischen jeder Infusion muss eine Pause von 8 Wochen (± 1 Woche) eingehalten werden (siehe auch «Dosisanpassung»).
Aminosäurenlösung
Zum Schutz der Nierenfunktion muss für 4 Stunden (siehe Tabelle 1 und Tabelle 2) eine Aminosäurenlösung mit L-Lysin und L-Arginin intravenös verabreicht werden. Die Infusion der Aminosäurenlösung sollte 30 Minuten vor Beginn der Verabreichung von Lutathera/Lutathera CA eingeleitet werden.
Die Infusion der Aminosäurenlösung und von Lutathera/Lutathera CA über einen separaten venösen Zugang in je einem Arm des Patienten ist die bevorzugte Methode. Wenn jedoch zwei intravenöse Zugänge aufgrund eines schlechten Venenzugangs oder aufgrund von Präferenzen in der Einrichtung/im Spital nicht möglich sind, kann die Infusion der Aminosäurenlösung und von Lutathera/Lutathera CA über denselben Zugang über einen Dreiwegehahn erfolgen, wobei die Flussrate und die Offenhaltung des Venenzugangs zu überwachen ist. Die Dosis der Aminosäurenlösung sollte nicht verringert werden, auch wenn eine reduzierte Dosis Lutathera/Lutathera CA verabreicht wird.
Angesichts der grossen Menge der Aminosäurelösung und den beträchtlichen Volumina, die handelsübliche Lösungen benötigen, um die oben genannten Spezifikationen zu erfüllen, wird die als Rezepturarzneimittel hergestellte Lösung aufgrund ihres geringeren Infusionsvolumens und der geringeren Osmolalität als Produkt der Wahl angesehen. Die Aminosäurenlösung kann, unter Berücksichtigung der guten Praxis zur Herstellung von sterilen Arzneimitteln des Spitals und gemäss der in Tabelle 1 spezifizierten Zusammensetzung, auf Anfrage hergestellt werden.
Tabelle 1 Zusammensetzung der als Rezepturarzneimittel hergestellten Aminosäurenlösung
|
Zusammensetzung
|
Menge
| |
L-Lysin-HCl
|
25 g (entspricht 20 g Lysin)
| |
L-Arginin-HCl
|
25 g (entspricht 20.7 g Arginin)
| |
Natriumchloridlösung 9 mg/ml (0.9 %) für Injektionszwecke oder Wasser für Injektionszwecke
|
1 l
|
Der pH der als Rezepturarzneimittel hergestellten Aminosäurenlösung gemäss der in Tabelle 1 beschriebenen Zusammensetzung muss mit Natriumhydroxid (NaOH) auf einen Wert von 7.4 ± 0.2 angepasst werden.
Alternativ können einige kommerziell verfügbare Aminosäurenlösungen verwendet werden, wenn diese mit der in Tabelle 2 beschriebenen Spezifikationen übereinstimmen.
Tabelle 2 Spezifikation von kommerziell verfügbaren Aminosäurenlösungen
|
Charakteristika
|
Spezifikation
| |
L-Lysin-HCl
|
Zwischen 18 und 25 g (entspricht 14.4 bis 20 g L-Lysin)
| |
L-Arginin-HCl
|
Zwischen 18 und 25 g (entspricht 14.9 bis 20.7 g L-Arginin)
| |
Volumen
|
1 l bis 2 l
| |
Osmolalität
|
<1'200 mOsmol/kg
|
Überwachung der Behandlung
Vor jeder Anwendung und während der Behandlung müssen Laboruntersuchungen durchgeführt werden, um den Zustand des Patienten neu zu beurteilen und um das Therapieprotokoll, falls nötig, anzupassen (Dosis, Infusionsintervall, Anzahl der Infusionen).
Vor jeder Infusion sind mindestens folgende Laboruntersuchungen erforderlich:
·Hämatologie (Hämoglobin [Hb], weisses Blutbild mit Differenzialblutbild, Thrombozytenzahl)
·Nierenfunktion (Serumkreatinin und Kreatinin-Clearance nach der Cockcroft-Gault-Formel)
·Leberfunktion (Alanin-Aminotransferase [ALT], Aspartat-Aminotransferase [AST], Serumalbumin, internationaler normalisierter Quotient (INR) und Bilirubin).
Diese Untersuchungen müssen mindestens einmal innerhalb von 2 bis 4 Wochen vor der Anwendung sowie unmittelbar vor der Anwendung durchgeführt werden. Es wird auch empfohlen, diese Untersuchungen für mindestens 3 Monate nach der letzten Infusion von Lutathera/Lutathera CA alle 4 Wochen sowie anschliessend alle 6 Monate durchzuführen, um mögliche verzögert auftretende unerwünschte Wirkungen zu erkennen (siehe Rubrik «Unerwünschte Wirkungen»). Die Dosierung muss möglicherweise entsprechend den Laborergebnissen angepasst werden.
Dosisanpassung
Bei schweren oder unerträglichen unerwünschten Wirkungen kann es erforderlich sein, die Dosisgaben vorübergehend auszusetzen (das Dosisintervall von 8 Wochen auf bis zu 16 Wochen zu verlängern), die Dosis zu reduzieren oder die Behandlung mit Lutathera/Lutathera CA ganz abzubrechen (siehe Tabelle 3 und Abbildung 1).
Tabelle 3 Empfohlene Dosisanpassungen bei unerwünschten Wirkungen (UW)
|
UW
|
Schweregrad der UW
|
Dosisanpassung
| |
Thrombozytopenie
|
Erstes Auftreten von:
Grad 2 (Thrombozytenzahl < 75 bis 50 x 109/l)
Grad 3 (Thrombozytenzahl < 50 bis 25 x 109/l)
Grad 4 (Thrombozytenzahl < 25 x 109/l)
|
Nächste Dosis erst nach vollständiger oder teilweiser Besserung (Grad 0 bis 1) verabreichen.
Nach vollständiger oder partieller Besserung Lutathera/Lutathera CA-Gaben mit einer Dosis von 3'700 MBq (100 mCi) wieder aufnehmen. Wenn unter reduzierter Dosis keine Thrombozytopenie Grad 2, 3 oder 4 auftritt, kann Lutathera/Lutathera CA bei der nächsten Gabe mit 7'400 MBq (200 mCi) dosiert werden.
Wenn aufgrund einer Thrombozytopenie Grad ≥2 ein Dosierungsintervall von über 16 Wochen erforderlich wird, ist Lutathera/Lutathera CA dauerhaft abzusetzen.
| |
|
Grad 2, 3 oder 4 mehrfach auftretend
|
Dauerhaftes Absetzen der Lutathera/Lutathera CA-Behandlung.
| |
Anämie und Neutropenie
|
Erstes Auftreten von Anämie:
Grad 3 (Hb < 8.0 g/dl); Transfusion indiziert
Grad 4 (lebensbedrohliche Folgen)
Erstes Auftreten von Neutropenie:
Grad 3 (absolute Neutrophilenzahl (ANC) < 1.0 bis 0.5 x 109/l)
Grad 4 (ANC < 0.5 x 109/l)
|
Nächste Dosis erst nach vollständiger oder teilweiser Besserung (Grad 0, 1 oder 2) verabreichen.
Nach vollständiger oder partieller Besserung Lutathera/Lutathera CA-Gaben mit einer Dosis von 3'700 MBq (100 mCi) wieder aufnehmen. Wenn unter reduzierter Dosis keine Anämie oder Neutropenie Grad 3 oder 4 auftritt, kann Lutathera/Lutathera CA bei der nächsten Gabe mit 7'400 MBq (200 mCi) dosiert werden.
Wenn aufgrund einer Anämie oder Neutropenie Grad ≥3 ein Dosierungsintervall von über 16 Wochen erforderlich wird, ist Lutathera/Lutathera CA dauerhaft abzusetzen.
| |
|
Grad 3 oder 4 mehrfach auftretend
|
Dauerhaftes Absetzen der Lutathera/Lutathera CA-Behandlung.
| |
Nierentoxizität
|
Erstes Auftreten von:
·Kreatinin-Clearance < 40 ml/min, berechnet nach Cockcroft/Gault mit dem aktuellen Körpergewicht, oder
·40 % Anstieg des Serumkreatinin-Ausgangswertes oder
·40 % Abnahme der Kreatinin-Clearance gegenüber dem Ausgangswert, berechnet nach Cockcroft/Gault mit dem aktuellen Körpergewicht.
|
Dosisgaben bis zur
Besserung oder Rückkehr zum Ausgangswert aussetzen.
Nach Besserung oder Rückkehr zum Ausgangswert Lutathera/Lutathera CA-Gaben mit einer Dosis von 3'700 MBq (100 mCi) wieder aufnehmen. Wenn unter reduzierter Dosis keine Nierentoxizität auftritt, kann Lutathera/Lutathera CA bei der nächsten Gabe mit 7'400 MBq (200 mCi) dosiert werden.
Wenn aufgrund von Nierentoxizität ein Dosierungsintervall von über 16 Wochen erforderlich wird, ist Lutathera/Lutathera CA dauerhaft abzusetzen.
| |
|
Wiederholte Nierentoxizität
|
Dauerhaftes Absetzen von Lutathera/Lutathera CA.
| |
Hepatotoxizität
|
Definiert als:
·Bilirubinämie > dem dreifachen oberen Normgrenzwert (Grad 3 oder 4) oder
·Albuminämie < 30 g/l mit INR > 1.5
|
Dosisgaben bis zur Besserung oder Rückkehr zum Ausgangswert aussetzen.
Nach vollständiger Besserung oder Rückkehr zum Ausgangswert Lutathera/Lutathera CA-Gaben mit einer Dosis von 3'700 MBq (100 mCi) wieder aufnehmen. Wenn unter reduzierter Dosis keine Hepatotoxizität auftritt, kann Lutathera/Lutathera CA bei der nächsten Gabe mit 7'400 MBq (200 mCi) dosiert werden.
Wenn aufgrund von Hepatotoxizität ein Dosierungsintervall von über 16 Wochen erforderlich wird, ist Lutathera/Lutathera CA dauerhaft abzusetzen.
| |
|
Wiederholte Hepatotoxizität
|
Dauerhaftes Absetzen von Lutathera/Lutathera CA
| |
Jede andere UAW vom Grad 3 oder Grad 4 gemäss CTCAE*
|
Erstes Auftreten von Grad 3 oder 4
|
Dosisgaben bis zur vollständigen oder partiellen Rückbildung (auf Grad 0 bis 2) aussetzen.
Nach vollständiger oder partieller Besserung Lutathera/Lutathera CA-Gaben mit einer Dosis von 3'700 MBq (100 mCi) wieder aufnehmen. Wenn unter reduzierter Dosis keine Toxizität Grad 3 oder 4 auftritt, kann Lutathera/Lutathera CA bei der nächsten Gabe mit 7'400 MBq (200 mCi) dosiert werden.
Wenn aufgrund einer UAW vom Grad ≥3 ein Dosierungsintervall von über 16 Wochen erforderlich wird, ist Lutathera/Lutathera CA dauerhaft abzusetzen.
| |
|
Wiederkehrende Toxizität Grad 3 oder 4
|
Dauerhaftes Absetzen von Lutathera/Lutathera CA.
| |
Keine Dosisanpassung erforderlich bei hämatologischen Toxizitäten des Grades 3 oder 4, die ausschliesslich auf eine Lymphopenie zurückzuführen sind
*CTCAE: Common Terminology Criteria for Adverse Events (Gemeinsame Terminologiekriterien für unerwünschte Ereignisse), National Cancer Institute
|
Abbildung 1 Anweisungsschemata für Dosisanpassungen
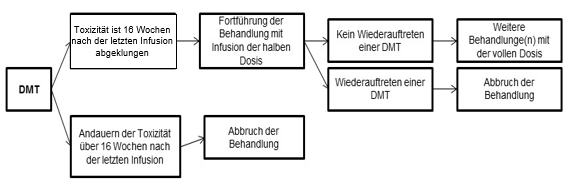
DMT: Dosis-modifizierende Toxizität
Weitere Gründe, eine vorübergehende Unterbrechung der Lutathera/Lutathera CA-Behandlung zu erwägen, sind interkurrente Erkrankungen (z.B. eine Harnwegsinfektion), die nach Einschätzung des Arztes die mit der Verabreichung von Lutathera/Lutathera CA verbundenen Risiken verstärken könnten und die daher vor einer Wiederaufnahme der Behandlung abgeklungen oder stabil sein müssen, sowie grössere Operationen, in diesem Fall sollte die Behandlung mit Lutathera/Lutathera CA für 12 Wochen nach dem Eingriff ausgesetzt werden.
Spezielle Populationen
Ältere Patienten
In den Ergebnissen klinischer Studien konnten keine Unterschiede bezüglich des Ansprechens zwischen älteren und jüngeren Patienten beobachtet werden. Weil aber bei älteren Patienten (≥70 Jahre alt) ein erhöhtes Risiko für das Auftreten einer Hämatotoxizität beschrieben wurde, ist in dieser Population eine engmaschige Beobachtung mit der Möglichkeit einer raschen Dosisanpassung empfohlen.
Patienten mit Nierenfunktionsstörungen
Die zu verabreichende Aktivität muss bei Patienten mit Nierenfunktionsstörung sorgfältig erwogen werden, weil eine erhöhte Strahlenbelastung auftreten kann. Das pharmakokinetische Profil und die Sicherheit von Lutetium (177Lu)-Oxodotreotid bei Patienten mit einer vorbestehenden schweren oder terminalen Niereninsuffizienz wurden nicht untersucht. Die Behandlung mit Lutathera/Lutathera CA ist bei Patienten mit schwerer Niereninsuffizienz und einer Kreatinin-Clearance unter 30 ml/min kontraindiziert (siehe Rubrik «Kontraindikationen»). Wenn der Ausgangswert der Kreatinin-Clearance (nach Cockcroft/Gault) unter 40 ml/min liegt, wird die Behandlung mit Lutathera/Lutathera CA nicht empfohlen. Für Patienten mit eingeschränkter Nierenfunktion und einer vorbestehenden Kreatinin-Clearance ≥40 ml/min wird keine Dosisanpassung empfohlen. Weil dieses Arzneimittel hauptsächlich über die Nieren ausgeschieden wird, sollte die Nierenfunktion jedoch während der Behandlung häufiger überwacht werden, denn es besteht bei diesen Patienten ein erhöhtes Toxizitätsrisiko.
Für weitere Informationen zur Behandlung von Patienten mit Nierentoxizität, siehe die Rubriken «Dosierung/Anwendung» (Tabelle 3) und «Warnhinweise und Vorsichtsmassnahmen».
Patienten mit Leberfunktionsstörungen
Die zu verabreichende Aktivität muss bei Patienten mit einer Leberinsuffizienz sorgfältig erwogen werden, weil eine erhöhte Strahlenbelastung auftreten kann. Das pharmakokinetische Profil und die Sicherheit von Lutetium (177Lu)-Oxodotreotid bei Patienten mit vorbestehender schwerer Leberinsuffizienz (Gesamtbilirubin oberhalb des dreifachen oberen Normgrenzwerts, unabhängig vom AST-Wert) wurden nicht untersucht. Infolgedessen wird die Behandlung dieser Patienten mit Lutathera/Lutathera CA nicht empfohlen. Patienten mit einer vorbestehenden Leberfunktionsstörung, bei denen entweder das Gesamtbilirubin mehr als das 3-Fache der oberen Grenze des Normalwerts oder die Albuminämie < 30 g/l und die INR > 1,5 beträgt, sollten nur nach einer sorgfältigen Nutzen-Risiko-Abwägung mit Lutathera/Lutathera CA behandelt werden.
Für das bei Patienten mit Hepatotoxizität anzuwendende Verfahren, siehe Tabelle 3 in der Rubrik «Dosierung/Anwendung» und der Rubrik «Warnhinweise und Vorsichtsmassnahmen».
Pädiatrische Population
Es gibt im Anwendungsgebiet der GEP-NET (mit Ausnahme von Neuroblastom, Neuroganglioblastom und Phäochromozytom) keinen relevanten Nutzen von Lutathera/Lutathera CA bei Kindern und Jugendlichen. Lutathera/Lutathera CA ist für die Anwendung in der pädiatrischen Population nicht zugelassen.
Prämedikation
Antiemetika
Eine Prämedikation mit Antiemetika muss mit ausreichender Vorlaufzeit vor Beginn der Infusion der Aminosäurenlösung verabreicht werden. Hinweise zur Verabreichung entnehmen Sie bitte der ausführlichen Fachinformation der Antiemetika.
Tritt während der Infusion der Aminosäurenlösung trotz der vorherigen Verabreichung eines Antiemetikums starke Übelkeit oder Erbrechen auf, kann ein Antiemetikum einer anderen pharmakologischen Klasse verabreicht werden.
Gleichzeitige Anwendung von Somatostatinanaloga
Vor Beginn der Behandlung mit Lutathera/Lutathera CA: Die Verabreichung von Somatostatinanaloga mit verzögerter Freisetzung (wie z.B. Octreotid mit verlängerter Wirkstoffabgabe [LAR]) ist mindestens 4 bis 6 Wochen vor Beginn der Behandlung mit Lutathera/Lutathera CA zu unterbrechen. Gegebenenfalls kann Octreotid mit kurzer Wirkungsdauer bis 24 Stunden vor der Anwendung von Lutathera/Lutathera CA verabreicht werden (siehe Rubrik «Interaktionen»).
Während der Behandlung mit Lutathera/Lutathera CA: In den 4 bis 6 Wochen vor jeder Infusion von Lutathera/Lutathera CA darf Octreotid LAR nicht verabreicht werden. Zum Management der Krankheitssymptome während der Behandlung mit Lutathera/Lutathera CA kann dem Patienten Octreotid mit kurzer Wirkungsdauer verabreicht werden; diese Verabreichung muss spätestens 24 Stunden vor jeder Infusion von Lutathera/Lutathera CA unterbrochen werden.
Nach der Behandlung mit Lutathera/Lutathera CA: Fortführen der Verabreichung von 30 mg Octreotid LAR intramuskulär alle 4 Wochen nach Ende der Behandlung mit Lutathera/Lutathera CA, falls klinisch angezeigt.
Art der Anwendung
Lutathera/Lutathera CA ist zur intravenösen Anwendung vorgesehen. Es handelt sich um ein gebrauchsfertiges Radiopharmazeutikum zum Einmalgebrauch.
Anweisungen für die Verabreichung
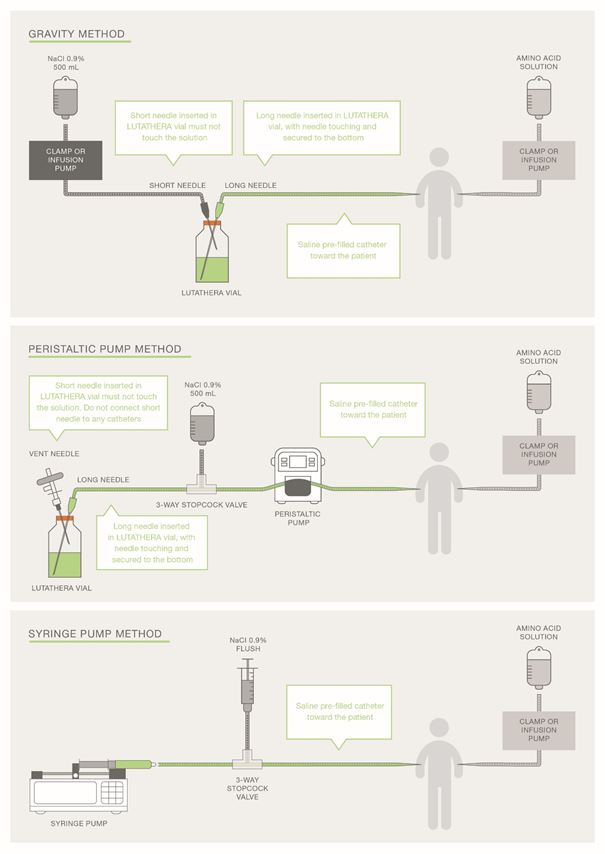
Für die Verabreichung der empfohlenen Dosis kann die Infusionsmethode mittels Schwerkraft, die Schlauchpumpenmethode (Peristaltikpumpe) oder die Spritzenpumpenmethode verwendet werden. Das behandelnde medizinische Fachpersonal kann andere als geeignet und sicher geltende Methoden anwenden, besonders dann, wenn eine Dosisreduktion erforderlich ist.
Bei Anwendung der Schwerkraftmethode oder der Schlauchpumpenmethode sollte Lutathera/Lutathera CA direkt aus dem Originalbehältnis infundiert werden. Die Schlauchpumpenmethode oder die Spritzenpumpenmethode sollte verwendet werden, wenn eine reduzierte Dosis von Lutathera/Lutathera CA nach einer Dosisänderung aufgrund einer unerwünschten Reaktion verabreicht wird (siehe Tabelle 3). Die Verwendung der Schwerkraftmethode zur Verabreichung einer reduzierten Dosis von Lutathera/Lutathera CA kann zur Abgabe einer falschen Menge Lutathera/Lutathera CA führen, wenn die Dosis vor der Verabreichung nicht angepasst wird. Während der Verabreichung sollten die üblichen Vorsichtsmassnahmen zum Strahlenschutz unabhängig von der Infusionsmethode getroffen werden (s. Rubrik «Hinweise für die Handhabung/den Strahlenschutz»).
Lutathera/Lutathera CA darf nicht als Bolus infundiert werden.
Kurz nach Beginn der Infusion sollte die vom Patienten abgegebene Radioaktivität mit einem kalibrierten System zur Messung der Radioaktivität überwacht werden, um sicherzustellen, dass die Dosis abgegeben wird. Während der Infusion sollte die vom Patienten abgegebene Radioaktivität stetig ansteigen, während die von der Lutathera/Lutathera CA-Durchstechflasche abgegebene Radioaktivität abnehmen sollte.
Es wird empfohlen, die Vitalzeichen des Patienten während der Infusion sorgfältig zu überwachen.
Tabelle 4 fasst die im Verlauf einer Behandlung mit Lutathera/Lutathera CA notwendigen Verfahren zusammen.
Tabelle 4 Verfahren zur Verabreichung der Antiemetika, der Aminosäurenlösung und von Lutathera/Lutathera CA
|
Verabreichte Mittel
|
Startzeit
(min)
|
Infusionsrate
(ml/h)
|
Dauer
| |
Antiemetika
|
mit ausreichender Vorlaufzeit vor der Aminosäurenlösung
|
nach Angaben in der Fachinformation
|
nach Angaben in der Fachinformation
| |
Aminosäurenlösung: Auf Anfrage zubereitete Lösung (1 l) oder kommerzielle Lösung (1 bis 2 l).
|
0
|
250–500
je nach Volumen
|
4 Stunden
| |
Lutathera/Lutathera CA mit Natriumchloridlösung 9 mg/ml (0.9 %) für Injektionszwecke
|
30
|
bis 400
|
30 ± 10 Minuten
|
Hinweise zur Handhabung des Arzneimittels vor der Anwendung, siehe Rubrik «Sonstige Hinweise».
Hinweise zur Vorbereitung des Patienten, siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen».
Hinweise zu Empfehlungen im Falle einer Paravasation, siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen».
Intravenöse Verabreichungsverfahren
Anweisungen für die Schwerkraftinfusion (mit einer Schlauchklemme oder einer Infusionspumpe)
1.Eine 2,5 cm lange 20-Gauge-Nadel (Kurznadel) in die Lutathera/Lutathera CA-Durchstechflasche einführen und über einen Katheter mit 500 ml steriler 0,9%iger Natriumchloridlösung verbinden (die zum Transport der Lutathera/Lutathera CA-Lösung während der Infusion verwendet wird). Darauf achten, dass die kurze Nadel die Lutathera/Lutathera CA-Lösung in der Durchstechflasche nicht berührt. Die Kurznadel darf nicht direkt an den Patienten angeschlossen werden. Die Natriumchloridlösung darf nicht in die Lutathera/Lutathera CA-Durchstechflasche fliessen, bevor die Lutathera/Lutathera CA-Infusion eingeleitet wird. Die Lutathera/Lutathera CA-Lösung darf nicht direkt in die Natriumchloridlösung injiziert werden.
2.Eine 9 cm lange 18-Gauge-Nadel (Langnadel) in die Lutathera/Lutathera CA-Durchstechflasche einführen und darauf achten, dass diese lange Nadel während der gesamten Infusion den Boden der Lutathera/Lutathera CA-Durchstechflasche berührt und dort fixiert ist. Die Langnadel über einen intravenösen Katheter, der mit 0,9%iger steriler Natriumchloridlösung verbunden ist und für die Lutathera/Lutathera CA-Infusion in den Patienten verwendet wird, mit dem Patienten verbinden.
3.Eine Rollenklemme oder eine Infusionspumpe verwenden, um den Fluss der Natriumchloridlösung über die Kurznadel in die Lutathera/Lutathera CA-Durchstechflasche zu regulieren. Die Natriumchloridlösung, die über die Kurznadel in die Durchstechflasche gelangt, transportiert die Lutathera/Lutathera CA-Lösung aus der Durchstechflasche über den an die Langnadel angeschlossenen intravenösen Katheter über eine Gesamtdauer von 30±10 Minuten mit einer Infusionsgeschwindigkeit von bis zu 400 ml/h zum Patienten. Die Infusion sollte in den ersten 5 bis 10 Minuten mit einer niedrigeren Infusionsgeschwindigkeit von <100 ml/h beginnen und dann in Abhängigkeit vom Venenstatus des Patienten erhöht werden. Der Druck in der Durchstechflasche sollte während der gesamten Infusion konstant gehalten werden.
4.Während der Infusion sicherstellen, dass das Niveau der Lösung in der Lutathera/Lutathera CA-Flasche konstant bleibt. Dafür wiederholt eine direkte Sichtkontrolle durchführen, wenn ein transparenter, abgeschirmter Behälter verwendet wird, oder die Durchstechflache mit einer Zange handhaben, wenn ein Bleiversandbehälter verwendet wird.
5.Der Fluss von Lutathera/Lutathera CA von der Durchstechflasche zum Patienten muss während der gesamten Infusion überwacht werden.
6.Die Infusion muss abgebrochen werden (die Durchstechflasche von der Schlauchleitung mit der Langnadel und die Kochsalzlösungsleitung abklemmen), sobald der Radioaktivitätswert während mindestens fünf Minuten stabil bleibt.
7.Im Anschluss an die Infusion werden dem Patienten 25 ml sterile 0,9%ige Natriumchloridlösung über den Venenkatheter intravenös zugeführt.
Anleitung für die apparategestützte Infusion mit Peristaltikpumpe (Schlauchpumpe)
1.Eine gefilterte 2,5 cm lange 20-Gauge-Nadel (kurze Entlüftungsnadel) in die Lutathera/Lutathera CA-Durchstechflasche einführen. Darauf achten, dass die Kurznadel die Lutathera/Lutathera CA-Lösung in der Durchstechflasche nicht berührt. Die Kurznadel darf nicht direkt an den Patienten oder an die Peristaltikpumpe angeschlossen werden.
2.Eine 9 cm lange 18-Gauge-Nadel (Langnadel) in die Lutathera/Lutathera CA-Durchstechflasche einführen und darauf achten, dass diese Langnadel während der gesamten Infusion den Boden der Lutathera/Lutathera CA-Durchstechflasche berührt und dort fixiert ist. Die Langnadel über einen geeigneten Schlauch an einen Dreiwegehahn und eine 0,9%ige sterile Natriumchloridlösung anschliessen.
3.Den Ausgang des Dreiwegehahns mit den Schläuchen verbinden, die an der Eingangsseite der Peristaltikpumpe angebracht sind. Dabei die Anweisungen des Pumpenherstellers beachten.
4.Den Schlauch vorbefüllen, indem der Dreiwegehahn geöffnet und die Lutathera/Lutathera CA-Lösung durch den Schlauch gepumpt wird, bis sie den Ausgang des Ventils erreicht.
5.Den intravenösen Katheter vorbefüllen, der an den Patienten angeschlossen wird, indem der Dreiwegehahn geöffnet wird, damit die 0,9%ige sterile Natriumchloridlösung fliessen kann. Die 0,9%ige sterile Natriumchloridlösung wird gepumpt, bis sie am Ende des Katheterschlauchs austritt.
6.Den vorbefüllten intravenösen Katheter an den Patienten anschliessen und den Dreiwegehahn so einstellen, dass die Lutathera/Lutathera CA-Lösung in einer Linie mit der Peristaltikpumpe steht.
7.Ein angemessenes Volumen der Lutathera/Lutathera CA-Lösung über einen Zeitraum von 30±10 Minuten als Infusion verabreichen, um die gewünschte Radioaktivität zu liefern.
8.Sobald die gewünschte Lutathera/Lutathera CA-Radioaktivität abgegeben wurde, die Peristaltikpumpe stoppen und dann die Position des Dreiwegehahns ändern, sodass die Peristaltikpumpe mit der 0,9%igen sterilen Natriumchloridlösung in Verbindung steht. Die Peristaltikpumpe wieder starten und dem Patienten eine intravenöse Spülung mit 25 ml 0,9%iger steriler Natriumchloridlösung über den Venenkatheter zuführen.
Anleitung für die apparategestützte Infusion mit Spritzenpumpe
1.Ein angemessenes Volumen der Lutathera/Lutathera CA-Lösung aufziehen, um die gewünschte Radioaktivität zu verabreichen, dafür eine Einwegspritze mit einem Spritzenschutz und einer sterilen 9 cm langen 18-Gauge-Einwegnadel (Langnadel) verwenden. Zur Erleichterung der Entnahme der Lösung kann eine gefilterte 2,5 cm lange 20-Gauge-Nadel (kurze Entlüftungsnadel) verwendet werden, um den Widerstand der unter Druck stehenden Durchstechflasche zu verringern. Darauf achten, dass die kurze Nadel die Lutathera/Lutathera CA-Lösung in der Durchstechflasche nicht berührt.
2.Die Spritze in die abgeschirmte Pumpe einsetzen und einen Dreiwegehahn zwischen der Spritze und einem intravenösen Katheter einsetzen, der mit 0,9%iger steriler Natriumchloridlösung gefüllt ist und für die Verabreichung von Lutathera/Lutathera CA an den Patienten verwendet wird.
3.Ein angemessenes Volumen der Lutathera/Lutathera CA-Lösung über einen Zeitraum von 30±10 Minuten als Infusion verabreichen, um die gewünschte Radioaktivität zu liefern.
4.Sobald die gewünschte Lutathera/Lutathera CA-Radioaktivität abgegeben wurde, die Spritzenpumpe stoppen und dann die Position des Dreiwegehahns ändern, um die Spritze mit 25 ml steriler 0,9%iger Natriumchloridlösung zu spülen. Die Spritzenpumpe erneut starten.
5.Nachdem die Spülung der Spritze abgeschlossen ist, eine intravenöse Spülung mit 25 ml steriler 0,9%iger Natriumchloridlösung durch den intravenösen Katheter zum Patienten durchführen.
Abbildung 2 Überblick über die Verabreichungsmethoden
STRAHLENEXPOSITION
Die während den klinischen Studien zu Lutathera/Lutathera CA durchgeführten dosimetrischen Analysen haben zu folgenden Schlussfolgerungen geführt:
·Das kritische Organ ist das Knochenmark. Allerdings wurden mit der empfohlenen kumulativen Dosis von 29'600 MBq (4 Gaben von je 7'400 MBq) weder in der Erasmus-Studie der Phase I/II noch in der NETTER-1-Studie der Phase III eine Korrelation zwischen der Hämatotoxizität und der insgesamt verabreichten Radioaktivität oder vom Knochenmark absorbierten Dosis beobachtet.
·Die Niere ist kein kritisches Organ, wenn eine begleitende Infusion einer adäquaten Aminosäurenlösung durchgeführt wird.
Insgesamt stimmen die Ergebnisse der in der NETTER-1- Studie der Phase III und der Erasmus-Studie der Phase I/II durchgeführten dosimetrischen Analysen überein und weisen darauf hin, dass das Dosisregime von Lutathera/Lutathera CA (4 Gaben von 7'400 MBq) sicher ist.
Tabelle 5 Absorbierte Dosisschätzungen für Lutetium (177Lu)-Oxodotreotid aus der NETTER-1- Studie der Phase III (Olinda-Output)
|
Organ
|
Vom Organ absorbierte Dosis (mGy/MBq)
(n = 20)
| |
|
Mittelwert
|
SD
| |
Nebennieren
|
0.037
|
0.016
| |
Gehirn
|
0.027
|
0.016
| |
Brust**
|
0.027
|
0.015
| |
Gallenblasenwand
|
0.042
|
0.019
| |
Wand des unteren Dickdarms
|
0.029
|
0.016
| |
Dünndarm
|
0.031
|
0.015
| |
Magenwand
|
0.031
|
0.015
| |
Wand des oberen Dickdarms
|
0.032
|
0.015
| |
Herzwand
|
0.032
|
0.015
| |
Nieren
|
0.654
|
0.295
| |
Leber*
|
0.199
|
0.226
| |
Lunge
|
0.031
|
0.015
| |
Muskel
|
0.029
|
0.015
| |
Ovarien***
|
0.031
|
0.013
| |
Pankreas
|
0.038
|
0.016
| |
Rotes Knochenmark
|
0.035
|
0.029
| |
Osteogene Zellen
|
0.151
|
0.268
| |
Haut
|
0.027
|
0.015
| |
Milz
|
0.846
|
0.804
| |
Testikel**
|
0.026
|
0.018
| |
Thymus
|
0.028
|
0.015
| |
Schilddrüse
|
0.027
|
0.016
| |
Blasenwand
|
0.437
|
0.176
| |
Gebärmutter***
|
0.032
|
0.013
| |
Gesamter Organismus
|
0.052
|
0.027
|
* n=18 (zwei Patienten wurden ausgeschlossen, weil die von der Leber absorbierte Dosis durch die Aufnahme durch Lebermetastasen verzerrt war)
**n=11 (nur männliche Patienten)
***n=9 (nur weibliche Patienten)
Die Strahlendosis für bestimmte Organe, die nicht notwendigerweise Zielorgane der Therapie sind, kann durch pathophysiologische Veränderungen infolge des Krankheitsprozesses stark beeinflusst werden. Dies muss bei Verwendung dieser Informationen berücksichtigt werden.
|


